組合包在製備用於改善和治療人類小胖威利綜合症的食品、藥品、保健品、營養品中的應用的製作方法
2023-05-17 20:53:47 3
本發明涉及組合包的應用。更具體地,本發明涉及包括苦瓜粉的組合包在製備用於改善和治療人類小胖威利綜合症(Prader-Willi syndrome,PWS)的食品、藥品、保健品、營養品的應用。
背景技術:
不良飲食習慣及遺傳傾向性是肥胖及相關代謝疾病在全球不斷增長的兩大主要誘因(1-3)。小胖威利綜合症(Prader-Willi syndrome,簡稱「PWS」)是父源15號染色體(15q11.2-q13)的缺陷導致的,是最為常見的一種人類遺傳因素導致的肥胖(4,5)。PWS患兒能夠在生命早期成為病理性肥胖並發展為危機生命的2型糖尿病及心血管疾病(6)。PWS患兒的體重控制被證實異常困難,這是因為PWS患兒的肌肉張力較差,這會容易導致較少的體育鍛鍊、難以消除和不可控的飢餓感以及飽腹感不足,從而導致PWS患兒不斷渴望食物的表現。然而,使上述誘因發展為PWS患兒肥胖的大部分分子連結仍不為人所知(6)。幹預哪些病理性因素從而可以有效防止PWS中的肥胖和/或減緩其發展仍然是亟待解決的問題。
越來越多的證據表明,腸道菌群是膳食誘導的肥胖的發生原因之一(7,8)。無菌小鼠能夠抵抗高糖、高脂的「西式膳食」誘導的肥胖(9)。將肥胖患者或者小鼠的腸道菌群移植到無菌小鼠體內,能夠引起受體小鼠脂肪的過度積累(10,11)。用廣譜抗生素將小鼠腸道菌群清除後,高脂飲食誘發的肥胖將不會發生。將健康人得腸道菌群移植給肥胖患者,在移植後的6周內改善了受體的胰島素抵抗(12)。我們以由全穀物、中國傳統藥食同源食材和益生元組成的膳食(WTP)對成年單純性肥胖患者進行幹預,受試者腸道中內毒素產生菌下降而有益的雙歧桿菌增加,從而減少了內毒素入血並顯著改善了慢性炎症、脂代謝和胰島素抵抗(14,15)。以上證據充分說明了腸道菌群在人和小鼠膳食誘導的肥胖中的重要作用。
在一些遺傳缺陷的小鼠模型中發現,腸道菌群與遺傳因素造成的肥胖的也有關係。用廣譜抗生素清除腸道菌群,能夠阻止瘦素缺失的ob/ob小鼠和Toll樣受體5 敲除小鼠由於遺傳缺陷導致的肥胖和胰島素抵抗的發生(12,16)。將這兩種遺傳性肥胖模型小鼠的腸道菌群移植給野生型無菌小鼠,能夠在受體小鼠中複製出部分肥胖表型(16,17)。但是腸道菌群在人類遺傳因素導致的肥胖中得作用還不清楚。
然而,人類的遺傳性肥胖的腸道菌群的影響目前從未被表徵。也沒有任何現有技術顯示如何改善人類的遺傳性肥胖。
技術實現要素:
本發明至少在某種程度上基於意想不到的發現,即人類小胖威利綜合症(PWS)患者通過服用一種組合包可以用來扶持腸道有益菌,抑制條件致病菌,進而改善或者治療人類小胖威利綜合症。
因此,本發明提供一種組合包在製備用於改善和治療人類小胖威利綜合症的食品、藥品、保健品、營養品中的應用。
所述組合包包括以下組合物,每種組合物為便於劑量給予和均勻性的劑量單位形式,所述劑量單位形式是單一劑量的物理分散單位:
第一組合物包括:薏仁、燕麥、蕎麥、白扁豆、黃玉米、赤小豆、黃豆、山藥、大棗、花生、蓮子和枸杞;第一組合物也可以包括黑麥(rye)、小麥(wheat)、黎麥(quinoa)、或青稞(Hulless barley)。
第二組合物包括:苦瓜、可溶性膳食纖維和低聚糖;
第三組合物包括:可溶性膳食纖維和低聚糖。
在一些實施方案中,所述組合包用於男性人類小胖威利綜合症患者。
在一些實施方案中,所述第一組合物作為主食服用,其形式選自米、面、粥或飯。用所述第一組合物製備米、面、粥或飯前,先將第一組合物的種子、果實或其他植株部位粉碎成顆粒,其中1-70%、15-70%、25-70%、30-70%、50-70%的顆粒直徑為0.65mm或以上。
在一些實施方案中,所述薏仁的重量佔所述第一組合物重量的10-30%,燕麥的重量佔所述第一組合物重量的5-30%,所述蕎麥的重量佔所述第一組合物重量的5-50%,所述白扁豆的重量佔所述第一組合物重量的5-20%,所述山藥的重量佔所述第一組合物重量的5-30%。
在一些實施方案中,蛋白質的重量佔所述第一組合物重量的5-40%或10-20%,碳水化合物的重量佔所述第一組合物重量的30-80%或50-70%,脂肪的重量佔所述第一組合物重量的0.5-30%或2-15%,膳食纖維的重量佔所述第一組合物重量的0.5-30%或2-15%,維生素的重量佔所述第一組合物重量的0.1-5%或0.5-1%,礦物質的重量佔所述第一組合物重量的0.1-2%或0.8-1.2%。
在一些實施方案中,每100克的所述第一組合物提供320-400千卡總熱量。
在一些實施方案中,每100克的所述第一組合物含有:VA 3-857ugRE,VD0.01-5ugRE,VE 2-79.09mg,VB10.01-1.89mg,VB20.01-1.4mg,VB60.01-1.2mg,VB120.1-2.4mg,VC 1-1170mg,煙酸0.5-28.4mg,Ca 60-2458mg,P 200-1893mg,K 350-1796mg,Na 8-2200mg,Mg 100-350mg,Fe 2-20mg。
在一些實施方案中,所述第一組合物中的所述蕎麥包括:普通蕎麥或苦蕎麥。
在一些實施方案中,所述第一組合物中的所述蕎麥包括:蕎麥屬種子。
在一些實施方案中,所述第一組合物中的所述燕麥包括:燕麥屬植物種子。
在一些實施方案中,所述第一組合物中的所述山藥包括:山藥幹。
在一些實施方案中,所述第二組合物被製成衝調粉劑,在餐前0.25到1小時服用。
在一些實施方案中,所述第二組合物的日劑量為5-100克、40-60克、或30-80克,以水衝調。
在一些實施方案中,所述第二組合物中的所述苦瓜包括:苦瓜屬的植物果實全粉。
在一些實施方案中,所述植物果實全粉是通過冷凍乾燥或噴霧乾燥生產。
在一些實施方案中,所述第二組合物中的所述苦瓜包括:苦瓜提取物。
在一些實施方案中,所述第二組合物中的所述可溶性膳食纖維包括:
Fibersol-2、抗性澱粉、聚葡萄糖、纖維素、半纖維素、果膠或樹膠。
在一些實施方案中,所述第二組合物中的所述低聚糖包括:低聚果糖、低聚半乳糖、低聚木糖、低聚異麥芽糖、大豆低聚糖、低聚葡萄糖、水蘇糖或低聚乳果糖。
在一些實施方案中,所述苦瓜與所述膳食纖維和所述低聚糖的重量比為 10:1-1:1。
在一些實施方案中,所述苦瓜粉的重量佔所述第二組合物重量的15-99.8%,所述可溶性膳食纖維的重量佔所述第二組合物重量的0.1-51%,所述低聚糖的重量佔所述第二組合物重量的0.1-34%。
在一些實施方案中,所述第三組合物被製成衝調粉劑,餐前2-5小時服用,或與早餐同時服用。
在一些實施方案中,所述第三組合物的日劑量為5-200克、30-100克或50-150克,以300-1500毫升水衝調。
在一些實施方案中,所述第三組合物中的所述可溶性膳食纖維包括:
Fibersol-2,抗性澱粉,聚葡萄糖、纖維素,半纖維素,果膠或樹膠。
在一些實施方案中,所述第三組合物中的所述低聚糖包括:低聚果糖、低聚半乳糖、低聚木糖、低聚異麥芽糖、大豆低聚糖、低聚葡萄糖、水蘇糖、或低聚乳果糖。
現有技術相比,本發明具有如下的有益效果:本發明的組合物可用於平衡人類小胖威利綜合症患者中腸道菌群結構,改善代謝綜合症,施用於受試者時,能夠增加短鏈脂肪酸產生菌的數量,減少內毒素產生菌的數量;可以多個途徑給予需要其的人類小胖威利綜合症患者,通過對人類小胖威利綜合症患者飲食營養的合理調整,達到減輕、解除、補救、預防或改善代謝綜合症症狀,恢復健康的目的。
附圖說明
圖1顯示了PWS患者遺傳分子檢測。其中,第1-4列:亞硫酸鹽處理樣品;第5-9列未處理樣品;第1和5列:父親;第2和5列:母親;第3和7列:淵源者;第4和8列:對照;第9列:空白,M,100bp DNA marker。
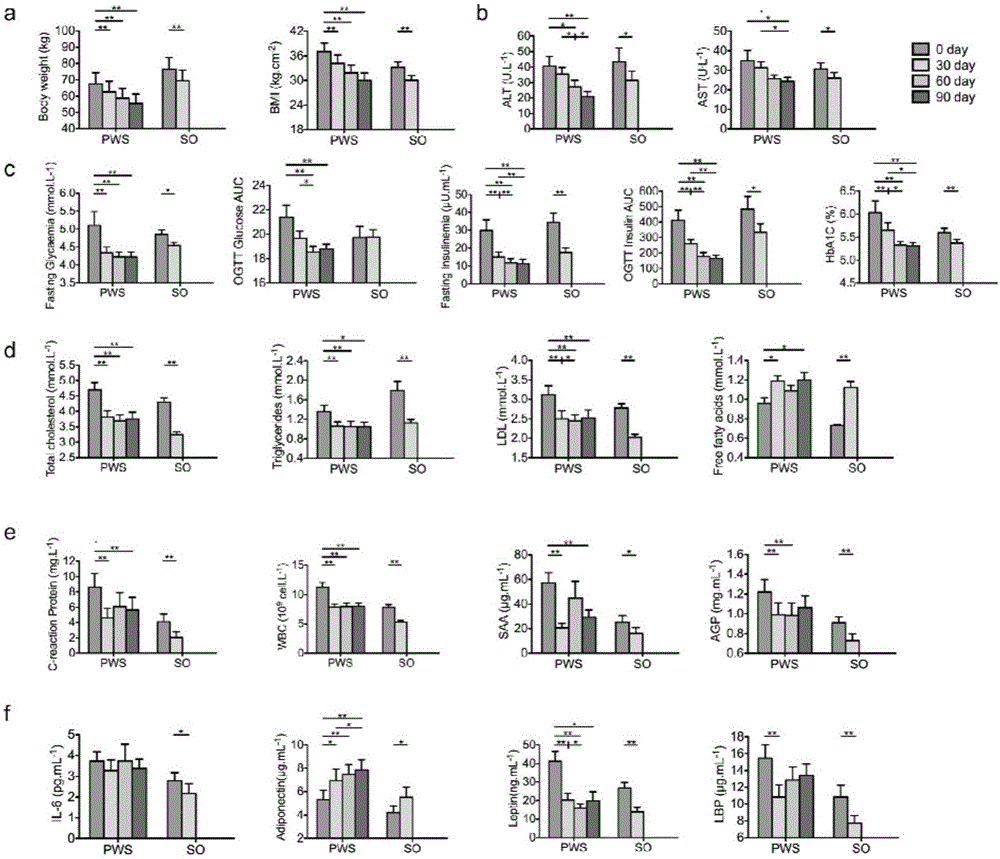
圖2顯示了(a)人體測量指標;(b)肝功能指標;(c)血糖平衡;(d)血脂代謝;(e)炎症相關指標。(f)IL-6、脂聯素(Adiponectin)、瘦素(Leptin)、LBP的測量。所示的數據為mean±s.e.m.。Wilcoxon配對符號秩次檢驗(雙邊檢驗)是用來分析PWS或SO患兒各時間點之間的差異。*P<0.05,P<0.01。對於大多數 的生化變量,PWS:n=17SO:n=21;對於OGTT血糖AUC,OGTT胰島素AUC,PWS:n=16,SO:n=20;對於CRP,w.b.c.,SAA,AGP,脂聯素,IL-6,PWS:n=16,SO:n=19。
圖3顯示了PWS患者幹預前的腸道菌群引起悉生小鼠代謝損傷。
圖4顯示了腸道菌群結構變化與宿主健康改善相關。
圖5顯示了膳食幹預過程中腸道菌群Beta多樣性分析。
圖6顯示了膳食幹預後基因多樣性顯著下降。
圖7顯示了膳食幹預顯著改善生理狀況。
圖8顯示了腸道菌群改變與生理指標變化的相關性。
圖9顯示了腸道菌群基因組水平的互作群的劃分。
圖10顯示了一個種裡處於同一個GIG的菌株基因組的相似性高於屬於不同GIG的同種的其他菌株。
圖11顯示了膳食幹預前後沒有發生顯著變化的GIG。
圖12顯示了CAG00184組裝基因組與參考基因組比較。
圖13顯示了CAG00184基因組中碳水化合物利用相關的基因。
圖14顯示了膳食幹預中腸道菌群功能變化。
圖15顯示了膳食幹預中糞便中代謝物的變化。
圖16顯示了不同分組的OPLS-DA模型。
圖17顯示了OPLS-DA係數圖表明幹預前後糞便樣品中顯著變化的代謝物。
圖18顯示了幹預30天SO患者糞便中顯著變化的代謝物。
圖19顯示了幹預60天PWS患者糞便中顯著變化的代謝物。
圖20顯示了幹預後糞便總菌量減少。
圖21顯示了短鏈脂肪酸相對含量的變化。
圖22顯示了幹預後糞便提取液對Caco-2細胞的毒性減少。
圖23顯示了PCA分析則顯示299CAZy家族幹預前後發生顯著變化。
圖24顯示了降解六種不同底物的CAZy基因家族豐度變化。
圖25顯示了乙酸、丙酸和丁酸產生相關基因的變化。
圖26顯示了膳食幹預中尿液代謝譜的變化。
圖27顯示了不同分組的OPLS-DA模型。
圖28顯示了OPLS-DA係數圖表明幹預前後糞便樣品中顯著變化的代謝物。
圖29顯示了膳食幹預中顯著變化的尿液代謝物。
圖30顯示了尿液代謝物與腸道菌群共變化分析。
圖31顯示了腸道菌群和宿主共代謝的變化。
具體實施方式
下面對本發明的實施例作詳細說明:本實施例在以本發明技術方案為前提下進行實施,給出了詳細的實施方式和具體的操作過程,但本發明的保護範圍不限於下述的實施例。
為了解決上述問題,本發明的目的是將一種組合包應用於製備改善和治療人類遺傳性肥胖/PWS的食品、藥品、保健品、營養品中。
例如,作為營養品,可以是飲食補充劑的形式。作為藥品,可以與藥學可接受載體混合以形成藥物組合物。「藥學可接受載體」包括溶劑、分散劑、包衣、抗菌和抗真菌劑以及等滲和吸收延遲劑等等,適合於藥物給藥。
所述組合包可以配製成與其計劃的給予途徑相適應的劑型。參見例如美國專利No.6,756,196。給予途徑的實例包括口服。所述組合包可以是用於口服的片劑、膠囊、米、粥或飯形式,為便於劑量給予和均勻性的劑量單位形式,配製口服組合物將是有利的。術語「劑量單位形式」指適合作為用於治療主體的單一劑量的物理分散單位,每一單位包含與所需的藥學載體結合、計劃產生所需治療效果的預定量的活性成分。
為了研究腸道菌群失調在人類遺傳性肥胖及相關代謝失調中的貢獻,我們招募了一批重度肥胖的PWS患兒和膳食因素導致肥胖的兒童,在醫院的對其進行WTP膳食幹預(14)。通過運用系統生物學策略,合併分析腸道元基因組特徵、宿主和腸道菌群共代謝譜特徵及將患者腸道菌群移植給無菌小鼠,我們發現,與膳食誘導的單純性肥胖(simple obesity,簡稱「SO」)類似,腸道菌群失調在遺傳因素造成的肥胖中也有重要貢獻。這些結果說明腸道菌群失調無論在遺傳因素造成的肥胖還是單純性肥胖中,都扮演著「分子哨卡」的作用。
實施例一:遺傳性肥胖及單純性肥胖的膳食幹預
(1)膳食幹預能夠緩解遺傳性肥胖及單純性肥胖並改善患者的生化指標
營養幹預在廣東省廣州市婦女兒童醫療中心進行。除了超重、持續超過3天給予抗生素或參與減肥項目外,參與營養幹預的主體在先前的3個月均未患有胃腸道疾病、未進行胃腸道手術或未患有慢性疾病。所述營養幹預的主體可以由主體或健康護理專業人員的判斷而確定,並且可以是主觀的(例如看法)或客觀的(例如可通過檢驗或診斷方法測量的)。例如,所述幹預的主體可以是具有低水平腸道有益菌和高水平條件致病菌的主體,或診斷有代謝綜合症的主體。
「營養幹預」定義為通過對主體飲食營養的合理調整,達到減輕、解除、補救、預防或改善代謝綜合症症狀,恢復健康的目的。
經上海交通大學生命與生物科技學院道德委員會批准,我們進行了開放標記研究及自控研究。臨床試驗在中國臨床試驗註冊中心的註冊編號為ChiCTR-ONC-12002646,並獲得了患兒監護人的書面同意。我們還進行了問卷調查,從而收集了人口統計特徵、健康狀態、疾病歷史、胃腸道狀況、飲食習慣及體育活動等信息。基於《中國食物成分表(2002版)》,隨餐頻率的問卷調查及24小時的飲食記錄被用於計算基本營養攝入。對患兒家長進行為小胖威利綜合症設計的攝食過量問卷調查,從而評估幹預前後的攝食過量(2)。
我們招募了PWS患兒17名(平均年齡9.26歲,範圍5-16歲)和單純性肥胖(SO)患兒21名(平均年齡10.52歲,範圍2-16歲)兩個人群年齡沒有顯著差異,患者信息見表1。PWS患者均經過遺傳分子檢測確診(圖1)。受試者在廣東省婦幼保健院進行30天膳食幹預。根據PWS患兒家長的要求,所有的PWS患兒又繼續進行了60天住院幹預。其中一名PWS患兒(GD02)在醫院進行了285天幹預。
表1:入組的PWS和SO患兒基本信息
所示的年齡數據為mean±s.d.,在學生T-檢驗(雙邊檢驗)中PWS和SO沒有顯著差別。
所述WTP飲食是指對患兒給予全穀物、中國傳統藥膳以及益生元。具體而言,在本實施例中,所述WTP飲食是指提供一種組合包,包括第一組合物、第二組合物及第三組合物。每種組合物為便於劑量給予和均勻性的劑量單位形式,所述劑量單位形式是單一劑量的物理分散單位。所述第一組合物、所述第二組合物及所述第三組合物由食品製造商:完美(中國)有限公司製備。
所述第一組合物為事先烹調好的12種選自富含膳食纖維的全穀物及傳統中醫植物的食材的混合物,包括:薏仁(薏苡)、燕麥、蕎麥、白扁豆、黃玉米、赤小豆、黃豆、山藥、大棗、花生、蓮子和枸杞,以罐頭粥的形式由食品製造商製備(每罐淨重為370g)。每罐第一組合物含有100g的成分(包括59g碳水化合物、15g蛋白質、5g脂肪、6g纖維)以及336kcal的熱量(包括70%碳水化合物、17%蛋白質、13%脂肪)。其中,總熱量可以通過氧彈測定能力修正法測定,蛋白質的含量可以通過凱氏微量法測定,碳水化合物的含量可以通過高壓液相色譜測定,脂肪的含量可以通過索氏抽提法測定,膳食纖維的含量可以通過中性洗滌劑法測 定,維生素的含量可以通過高壓液相色譜測定,礦物質的含量可以通過分光光度法測定。
所述第一組合物作為主食,可以製成米、面、粥或飯給予。在經過蒸、煮等烹調方式後,其中的澱粉不易糊化,不易升高血糖。患兒可被給予足夠的第一組合物以滿足飢餓感,並滿足其年齡段的標準營養要求,該標準營養要求規定於中國營養學會(CNS,2012)建議的《中國居民膳食營養素參考攝入量》(DRI)中。每名患者的飲食記錄被用於基於《中國食物成分表》(2002年)計算營養攝入。
所述第二組合物以衝調粉劑的形式製備(每袋20g),包括:苦瓜和低聚糖。其中,低聚糖為2個或2個以上(一般指2-10個)單糖單位以糖苷鍵相連形成的糖分子,例如低聚果糖或低聚異麥芽糖。第二組合物製成衝調粉劑後用溫水衝調食用,每天衝服5-100克第二組合物。
第三組合物包括:可溶性膳食纖維和低聚糖,其中可溶性膳食纖維包括:瓜爾膠、果膠、魔芋粉及其他可發酵膳食纖維(Fibersol-2、抗性澱粉、半纖維素)等益生元,第三組合物以衝調粉劑的形式給予。用300-1500毫升的水調勻衝服5-200克第三組合物,早晨空腹飲用。
本發明組合包的代表性給藥周期為一周至幾個月,例如一周、兩周、一個月、兩個月、四個月和八個月。在主體中腸道有益菌水平開始上升、條件致病菌水平開始下降後,組合物的劑量可以逐步降低。當腸道菌群結構恢復正常時可以結束給藥。
膳食幹預期間,兩類兒童總熱量攝入相比幹預前均下降了30%。攝入蛋白質的供能比變化不大,仍佔總熱量的13-%14%。攝入碳水化合物的供能比在PWS患兒中從52%增加到62%,在SO患兒中從57%增加到62%。碳水化合物的種類則從幹預前以精細加工的米麵為主變為以全穀物為主。攝入脂類的供能比在PWS患兒中從34%減少到20%,在SO患兒中從30%減少到20%。最本質的改變是膳食纖維攝入量的變化,在PWS患兒中從每天6g增加到49g,在SO患兒中從每天9g增加到51g(表2和表3)。
表2:PWS患兒幹預前後主要營養素攝入情況
所示的數據為中位數(最大-最小)或者mean±s.e.m.,在學生T-檢驗(雙邊檢驗)中PWS和SO沒有顯著差別。*P<0.05,**P<0.01,***P<0.001相對於基準線。對於幹預前,n=12;天數為30,60,90,n=17。
表3:PWS患兒幹預前後主要營養素攝入情況
所示的數據為中位數(最大-最小)或者mean±s.e.m.,在學生T-檢驗(雙邊檢驗)中PWS和SO沒有顯著差別。*P<0.05,**P<0.01and***P<0.001相對於基準線。對於幹預前,n=5;天數為30,60,90,n=21。
我們用幹預期間受試者的人體測量指標和血液代謝物來跟蹤身體狀況的變化。幹預30天後,所有相關的臨床指標在遺傳因素導致的肥胖和單純性肥胖患者中都顯著改善(圖2)。經過30天的幹預,SO患兒的體重減少了9.5±0.4%(mean±s.e.m.),而PWS減少了7.6±0.6%(圖2a)。血液中谷丙轉氨酶(AST)和穀草轉氨酶(ALT)降低表徵肝功能的改善(圖2b)。血糖穩態顯著改善,表徵胰島素敏感性增加(圖2c)。血液中總膽固醇、甘油三酯和低密度脂蛋白(LDL)減少(圖2d)。PWS患兒在繼續幹預60天後,體重最終減少了18.3±1.0%,其他代謝健康指標也進一步改善。不僅如此,PWS患兒暴食症行為得到整體改善(表4)。GD02在285天住院幹預中,從140.1kg減少到83.6kg,他出院後繼續在家幹預,在總共幹預430天後減低到73kg。他所有的生理指標均恢復到正常水平。這種膳食幹預能夠顯著改善人類遺傳因素造成的肥胖相關的代謝失調,膳食導致的減重程度可與接受胃腸繞道手術的效果媲美(18)。30天幹預後,多種與協同炎症相關的指標在PWS和SO中都發生顯著下降,包括C反應蛋白(CRP)、血清澱粉樣蛋白(SAA),alpha酸性糖蛋白和白細胞(圖2e)。脂聯素作為一種抗炎因子,幹預後水平增加,瘦素水平減少,說明代謝性疾病的風險因素下降。脂多糖結合蛋白(LBP)是細菌產生的內毒素進入血液的量的分子標識物,幹預後下降。這說明兩類人幹預後腸道菌群都變得健康,產生的能夠引起慢性炎症的抗原減少。
表4:PWS患兒幹預前後食慾問卷分析
所示的數據為mean±s.e.m.,n=11,兩個時間點間的變化的Wilcoxon配對符號秩次檢驗(雙邊檢驗)*P<0.05。
表5:PWS患兒膳食幹預前後生化指標
所示的數據為mean±s.e.m.,兩個時間點間的變化的威氏配對符號秩次檢驗(雙邊檢驗)*P<0.05,**P<0.01,***P<0.001相對於基準線;$P<0.05,$$P<0.01and$$$P<0.001v.s.30天;+P<0.05,++P<0.01,+++P<0.001v.s.60天。
BMI:身體質量指數;DBP:舒張壓;SBP:收縮壓;HOMA-IR:穩態模型評估的胰島素抵抗;OGTT:口服葡萄糖耐量試驗;HDL:高密度脂蛋白;LDL:低密度脂蛋白;CRP:C反應蛋白;W.B.C.:白細胞計數;ALT:丙氨酸氨基轉移酶;AST:穀草轉氨酶;SAA:血清澱粉樣蛋白A;AGP:α-酸性糖蛋白;LBP:脂多糖結合蛋白。
對於大多數生化變量,n=17;對於OGTT血糖AUC,OGTT胰島素AUC,CRP,W.B.C.,SAA,AGP,脂聯素及IL-6:n=16。
(2)幹預後腸道菌群在小鼠中產生很少炎症及脂肪堆積
為了比較幹預前後腸道菌群引起代謝紊亂能力的差異,我們把同一名PWS志願者(GD58)幹預前後的腸道菌群分別移植給無菌野生型C57BL/6J小鼠。接受了幹預前腸道菌群的小鼠在移植後前兩周體重出現顯著下降,說明移植物有一定的毒害作用,在接下來的兩周中這些小鼠體重迅速增加。接受了幹預後腸道菌群的小鼠沒有出現體重下降,在移植後的四周中其體重像正常小鼠一樣有所增加(圖3a)。在實驗結束時,儘管移植了幹預前腸道菌群的小鼠體重仍然低於移植幹預後菌群的小鼠,但是其脂肪比例顯著高於後者(圖3b)。附睪脂肪組織切片的脂肪細胞染色反映出,由於移植了毒性較大的菌群,菌群移植兩周後移植了幹預前 腸道菌群的小鼠脂肪細胞顯著小於移植幹預後菌群的小鼠,移植四周後前者脂肪細胞則顯著大於後者,但是移植移植幹預後菌群的小鼠的脂肪細胞大小沒有顯著變化(圖3c)。反轉錄定量PCR表明,移植了幹預前腸道菌群的小鼠肝臟、迴腸和結腸中TNFα、IL6和TLR4基因表達增加,說明最初一段時間的體重下降與其較高炎症水平相關(圖3d-f)。以上結果表明,PWS患兒幹預前的腸道菌群比幹預後的菌群有更強的引起炎症和脂肪積累的能力。
(3)膳食幹預改變腸道菌群結構
為了研究膳食幹預過程中腸道菌群整體結構的變化,我們用Illumina Hiseq2000平臺對PWS(0天、30天、60天和90天)和SO(0天和30天)糞便樣品進行了元基因組測序,平均每個樣本得到76.0±18.0million(mean±s.d.)高質量reads。我們對這些高質量序列進行de novo的組裝和基因預測,共得到2,077,766個非冗餘基因。基於Canopy算法,這兩百多萬個基因根據其豐度共變化相關性大於0.9的原則,歸併為28,072個的基因群(co-abundance gene groups,CAGs),屬於同一個CAG的基因很有可能是來自同一個基因組(26)。其中有376個CAGs包含的基因數大於700,可以被認為是可能是細菌基因組,這些CAGs共包含識別出的基因的36.4%(775,515)。這376個CAG中,有161個在不少於20%的樣本中被檢測到。我們對這161個CAG基因組進行組裝,得到118個組裝基因組符合人類元基因組計劃六條高質量組裝基因組標準中的至少5條。有50個組裝基因組與現有參考基因組的相似性大於95%且佔有率大於80%。有10個種的細菌得到了多於1個組裝基因組,比如Faecalibacterium prausnitzii有9個組裝基因組,而Eubacterium eligens有5個,說明這些細菌在菌株水平的多樣性。
基於376細菌CAG的Bray-Curtis距離做PCoA,反映出腸道菌群結構和組成在膳食幹預30天後就發生了顯著變化(MANOVA檢驗,P=2.17e-6,圖4a和b)。無論幹預前後,PWS和SO的腸道菌群均沒有顯著差異(P=0.99,P=0.8),說明PWS和SO幹預前的腸道菌群有著類似的失調結構,而膳食幹預對兩者腸道菌群的影響類似(圖4b)。基於其他距離的β-多樣性分析及腸道菌群16S rRNA基因V1-V3區焦磷酸測序的結果反映了同樣的結果(圖5)。幹預後兩類人群腸道菌群的多樣性均顯著下降(圖6)。更為重要的是,將基於376個CAG的PCoA結果(圖3a)和臨床指標的PCA結果(圖7)進行普氏分析(procrustes analysis),腸道菌群結構的改變與PWS和SO人群臨床指標的變化顯著相關,說明在細菌基因組水平的結構變化與宿 主健康狀況的改善有密切關係(M2=0.891,P<0.0001,999次Monte-Carlo模擬,圖8)。
(4)基因組水平的共變化分析
在腸道生態系統中,細菌基因組是組成不同的功能群對於膳食幹預進行反應的(27-29),為了建立研究這種反應(30),我們基於161個高共有率的細菌CAG在所有時間點和所用個體中分布,建立豐度共變化網絡關係。基於bootstrapped Spearman相關係數的Ward聚類算法和置換MANOVA檢驗(9999次置換,P<0.001)將細菌CAG分為18個基因組水平的互作群(GIG,圖3c和圖9)。值得注意的是,同一個種的不同CAG,比如屬於Faecalibacterium prausnitzii的9個CAG,屬於不同的GIG,說明同一個種下的不同菌株在腸道生態中可能處於不同的代謝生態位。一個種裡處於同一個GIG的菌株基因組的相似性高於屬於不同GIG的同種的其他菌株,說明屬於不同GIG的同種菌株可能具有功能上的差異(圖10)。將基於18個GIG和臨床指標的數據進行普氏分析,表明GIG水平的菌群變化和宿主臨床指標的變化均是沿著第一個坐標軸,說明GIG豐度變化與宿主健康狀況變化顯著相關(M2=0.898,P0.45,FDR<0.01,圖3c)。GIG3是膳食幹預後增加最為顯著的組群。值得注意的是,GIG3主要由屬於Bifidobacterium的基因組組成。CAG00184是幹預後增加最顯著組裝基因組,與參考基因組Bifidobacterium pseudocatenulatum DSM 20438的相似度為98.6%且佔有率為81.2%(圖12)。CAG00184的組裝基因組中包含有編碼發酵單糖、二糖、低聚糖和多聚糖產生乙酸和乳酸的代謝通路的基因(圖13)(28,31-33)。
(5)膳食幹預改變腸道菌群功能
為了研究腸道菌群群落結構的改變如何影響其代謝潛能,我們用HUMAnM對元基因組數據進行分析,將基因與其所在的生化反應途徑相關聯。總共有5,234個KEGG同源群(KO)被識別並定量。對所用KO做主成分分析發現幹預前後KO發 生了顯著變化(MANOVA檢驗,P=2.00e-7,圖14a和b),表明膳食幹預造成的菌群結構的改變也影響了其代謝潛能。無論幹預前後,PWS和SO在KO水平都沒有顯著差異(MANOVA檢驗,P=0.712且P=0.291,圖14b)。因此,幹預前後,PWS和SO患兒的腸道菌群結構與功能均相似。
用線性判別分析(LDA)相應水平(LEfSe)方法,KEGG資料庫共鑑定出67個生化反應通路在幹預前後有顯著差異(P<0.05,圖14c)。41個反應通路在幹預後顯著降低,而26個通路顯著增加。值得注意的是,在顯著增加的通路中有碳水化合物分解代謝相關的通路,包括澱粉和蔗糖代謝(ko00500)和基糖和核苷酸糖代謝(ko00520)。在顯著減少的途徑中則包含脂類和蛋白質代謝通路,如脂肪酸合成(ko00061)、苯丙氨酸代謝(ko00360)和色氨酸代謝(ko00380)。另外,脂多糖生物合成(ko00540)、肽聚糖生物合成(ko00550)和鞭毛組裝(ko02040)顯著減少,說明細菌來源的抗原合成在幹預後顯著減少。外源性化學物質生物降解(ko00627、ko00633和ko00930)和DNA損傷修復相關通路(ko03410、ko03430和ko03440)也顯著減少,或許反映了幹預後腸道環境中外源有毒物質及突變壓力減少。
(6)碳水化合物導致的腸道中代謝變化
幹預所使用的膳食富含大量人自身不能消化的碳水化合物,到達大腸後很可能會影響腸道菌群的代謝(表2和3)。用NMR對幹預前後PWS和SO患兒的糞便提取液進行代謝物進行檢測,對數據進行主成分分析(PCA)和隱變量正交投影判別分析(OPLS-DA)表明,幹預後代謝譜發生了顯著變化(圖15和16)。OPLS-DA係數圖表明糞便中不能消化的碳水化合物顯著增加(圖17)在PWS患兒中19種代謝物顯著減少,而SO患兒中18種代謝物減少(圖18和19)。這些減少的代謝物很多是細菌的代謝產物,這與定量PCR發現幹預後腸道中細菌總量減少的結果一致(圖20)。儘管細菌代謝產物減少,乙酸在短鏈脂肪酸中得相對比例增加,而異丁酸和異戊酸比例減少,表明腸道菌群從發酵蛋白質轉變為發酵碳水化合物(圖21)。三甲基胺是細菌發酵食物中脂類來源的膽鹼所產生的有毒代謝物,幹預後在糞便提取液中顯著減少(圖18和19)。體外實驗表明,幹預後PWS和SO患兒的糞便提取液對人源Caco-2細胞的細胞毒性顯著下降說明幹預後腸道菌群產生的有毒代謝物減少(圖22)。
為了進一步考察膳食幹預對腸道菌群碳水化合物代謝的改變,我們將所有 2,077,766非冗餘基因與dbCAN資料庫進行比對,鑑定出碳水化合物活性酶(carbohydrate-active enzymes,CAZy)。共有84,549個基因屬於299個CAZy家族,這些基因在幹預前後發生顯著變化,說明腸道菌群碳水化合物代謝相關的基因發生變化(圖23)。與降解澱粉(GH13、97和31)、菊粉(GH32和91)及纖維素(GH1,3,5,8,9,44and 48)相關的CAZys在幹預後顯著增加,而與降解黏膜多糖相關的CAZys則顯著減少(圖24)。Formate-tetrahydrofolate ligase是乙酸產生途經中的關鍵酶,我們發現編碼這個酶的基因在幹預後顯著增加,這解釋了幹預後乙酸相對比例的增加(圖25)。這些都反映了結腸中可利用的植物來源的碳水化合物增加,雙歧桿菌這樣的攜帶大量碳水化合物發酵相關基因的細菌就會大量增加,並且產生有益的代謝產物比如乙酸。
(7)腸道菌群和宿主代謝互作
在本研究中,我們用NMR這種無主觀偏好的技術獲得膳食幹預前後尿液代謝譜,從而找出幹預顯著影響的代謝物。用NMR對幹預前後PWS和SO患兒的尿液進行代謝物進行檢測,對數據進行主成分分析(PCA)和隱變量正交投影判別分析(OPLS-DA)表明,幹預後代謝譜發生了顯著變化(圖26a)。在所有NMR檢測到的代謝物中,利用OPLS-DA模型只找到13種代謝物在PWS或SO患兒幹預前後有顯著變化(圖26b-d和圖27-29)。13種代謝物中有4種是腸道菌群和宿主的共代謝產物,這些代謝物幹預後都顯著降低。它們是氧化三甲基胺(TMAO)、吲哚硫酸鹽(indoxyl sulfate)、苯乙醯穀氨醯胺(PAG)和馬尿酸(hippurate)。細菌產生的TMA進入宿主循環系統,宿主肝臟產生TMAO。其他三種代謝物的前體則是細菌在腸道中發酵胺基酸的產物,比如吲哚硫酸鹽的前體吲哚是細菌發酵色氨酸的產物。TMAO在臨床上能夠作為預測心血管事件的獨立分子標識物,而且在人和小鼠中都被證實參與動脈粥樣硬化發生的機制。類似的,吲哚硫酸鹽被認為與慢性腎炎病人發生高血壓和心血管疾病有關。另一方面,菌群代謝膽鹼產生TMAO減少,與人自身代謝膽鹼產生的二甲基甘氨酸(DMG)在尿液中增加相互印證(圖26c和d)。這說明幹預膳食中脂類來源的膽鹼主要被人吸收代謝,而不是被腸道中的細菌發酵產生TMA。
對376個細菌CAG和尿液代謝物進行協慣量分析(Co-inertia analysis),表明兩者之間有顯著的共變化關係(R=0.52,P0.4and FDR<0.01,圖31b)。在所有與潛在有毒代謝物吲哚硫酸鹽正相關的細菌CAG中,9個屬於GIG7和18(大部分是Bacteroides spp.和Alistipes spp.)的CAG的基因組中有編碼將色氨酸轉化為吲哚的色氨酸酶的基因(圖31c)。在所有與有毒代謝物TMAO正相關的細菌CAG中,13個屬於GIG7、8、14、15、16和18(大部分是Ruminococcus spp.、Parabacteroides spp.和Bacteroides spp.)的CAG的基因組中有編碼膽鹼厭氧降解相關膽鹼TMA裂解酶和膽鹼TMA裂解酶激酶基因簇(圖31d)。這些CAG所代表的菌株很可能是腸道中產生吲哚和TMA的細菌,他們所屬的GIG都是幹預後減少的。他們豐度的下降對於遺傳因素導致的肥胖和單純性肥胖患者代謝失調的改善都有貢獻。
PWS相關的肥胖似乎是遺傳因素決定的,但是其推動因素與單純性肥胖相似,仍然是過度飲食和低能量消耗。我們的研究表明,遺傳因素造成的肥胖和單純性肥胖患者的腸道菌群有著相似的結構和功能失調,比如1)產生的能夠引起代謝損傷的有毒物質如吲哚硫酸鹽和TMAO較多;2)編碼產生有毒共代謝物相關酶的基因豐度較高;3)產生細菌來源的抗原如內毒素的生物合成通路較多。將PWS患兒幹預前的腸道菌群移植給無菌小鼠,能夠引起後者腸道炎症和脂肪積累。WTP膳食幹預改變腸道菌群的代謝,使其從發酵蛋白質和脂類變為發酵碳水化合物,這種改變與遺傳因素造成的肥胖和單純性肥胖代謝失調的改善相關。
腸道菌群的一些結構特徵被認為是於肥胖相關,比如厚壁菌門與擬桿菌門的比例升高或者低基因豐度。但是腸道菌群中參與肥胖和代謝失調發生發展的特定的成員及其功能互作關係,還有待進一步研究。越來越多的證據表明,腸道菌群的重要功能可能是種甚至菌株特異性的,而許多元基因組相關的研究由於技術條件所限無法將獨立的基因組組裝出來,只能在屬甚至更高的水平上進行分析。來源於同一個基因組DNA分子上的兩個基因的豐度在整個複雜的元基因組數據中相關性應該是極高的,基於上述原理,最近提出的canopy算法將豐度共變化高度相關的基因歸併為一個群。如果測序深度足夠,屬於一個CAG的序列讀段能夠組裝為一個高質量的基因組,因此我們可以在基因組水平分析膳食幹預引起的腸道菌群變化。比如,我們發現膳食幹預顯著富集了具有豐富碳水化合物利用能力的B.pseudocatenulatum。這個種很可能是通過增加乙酸和其他物質的產生來抑制有害菌,從而形成健康的腸道生態環境的「關鍵物種」。
腸道菌群產生有毒的代謝物比如TMA和吲哚進入宿主循環系統,很可能是影 響宿主健康的方式之一。但是對於腸道菌群--特別是人腸道--中能夠產生這些特定化合物的成員,我們還知之甚少。在前期以健康人群為對象做得方法研究中,我們指出可以將腸道微生物群落中特定成員與特定尿液代謝物的變化關聯起來,從而揭示「群落中哪種細菌做了什麼」。在這個研究中,我們將腸道中獨立的細菌基因組與特定的尿液代謝物的變化關聯起來,揭示了「群落中哪個細菌的基因組執行了哪種功能」。一些細菌的基因組與尿液中TMAO或者吲哚硫酸鹽的水平顯著相關,在這些基因組中確實有編碼由膽鹼或色氨酸產生這兩種物質前體的酶的基因。在以後可以將這些關鍵細菌分離出來,進一步做深入的機制研究。
綜上所述,我們證明了無論是遺傳因素引起的還是膳食誘導的重度肥胖兒童,腸道菌群有著相似失調。富含不能被人體消化的複雜碳水化合物的膳食能夠改善腸道菌群的失調,使得利用蛋白質或脂類產生有毒物質的細菌豐度下降,而發酵碳水化合物產生有益物質的細菌增加。這種膳食對腸道菌群的改變顯著改善了PWS和SO患兒代謝失調,說明失調的腸道菌群在無論是遺傳因素還是不當膳食導致的肥胖發生過程中的普遍病理作用。因此,膳食改善腸道菌群可以成為管理代謝性疾病的有價值和前途的手段。
實施例2
對一位體重175千克的志願者進行營養幹預,並對幹預過程中身體各項生理生化指標和腸道菌群的變化進行系統的分子監測,進一步描述本發明。
(1)志願者幹預前的身體狀況
該志願者為26歲男性。身高172.5釐米,體重174.9千克,BMI(Body Mass Index)58.78,腰圍156.1釐米,根據亞洲成年人肥胖評價標準判斷,為重度肥胖患者。經系統體檢,發現其患有嚴重的代謝綜合症,其各項生理生化指標如下表6所示。
(2)幹預過程中身體的生理生化指標變化與幹預效果的分子評價。
相比較於該志願者幹預前0天的各項生理生化指標,營養幹預9周、23周後,體重和BMI顯著下降;空腹血糖、空腹胰島素、糖化血紅蛋白和胰島素抵抗指數的降低,直接反映糖穩態情況及其在幹預下的好轉;甘油三酯和總膽固醇的下降表明機體脂代謝的改善;穀草轉氨酶、丙氨酸氨基轉移酶和γ穀氨醯轉移酶的明顯
表6:實施例1志願者營養幹預前及幹預後9周、23周生理生化指標
降低,逐漸恢復到正常範圍內,說明肝臟細胞的損傷的減輕;同時脂肪肝與血壓均有所改善;炎性標記物中的C反應蛋白、炎性因子白介素6,提示腸道菌群引發的破壞身體的炎性反應的水平在幹預下降低;抗炎因子脂聯素的升高表明機體消除炎性反應的機能在幹預後恢復;內毒素結合蛋白的減少提示進入血液的細菌產生的內毒素的水平在幹預下降低。綜合上述各項指標,該志願者經過幹預之後,代謝綜合症各項表徵均明顯改善。
幹預過程中腸道菌群結構變化情況如下:16S rRNA基因V3-DGGE指紋圖譜 及注釋見說明書附圖。0d:為幹預前時間點,4w、9w、13w、18w、23w:分別為幹預後各時間點4周、9周、13周、18周和23周。紅色箭頭(23W泳道旁的2處箭頭)所示為營養幹預後增加的條帶(2條條帶),藍色箭頭(M泳道旁的5處箭頭)所示為營養幹預後逐漸減弱的條帶(5條條帶)。從DGGE圖譜可以看到營養幹預對該個體腸道菌群結構有較大影響,營養幹預後幾個時間點志願者腸道菌群結構是比較相似,這說明營養幹預顯著地改變了腸道菌群結構。
454焦磷酸測序結果顯示該志願者的變形菌門發生明顯下降,其中以腸桿菌科變化最明顯,由-30d的17.90%降為9w的0.10%和23w降為0.10%,表現在屬的水平上即為機會性病原菌腸桿菌的明顯下降。另外,屬水平在營養幹預後呈上趨勢的有Faecalibacterium,該屬菌種具有抗炎和產生丁酸鹽的作用,對宿主的能量代謝,保護腸黏膜完整性起著重要作用。
由此可見,營養幹預後,該志願者機會性病原菌數量發生明顯下降,進入宿主循環系統的腸道內內毒素減少,從而降低了宿主炎性反應水平,有效地緩解了該志願者代謝綜合症的症狀。
實施例3
對89位中心型Ⅱ度肥胖症志願者進行營養幹預,並對幹預過程中身體各項生理指標和腸道菌群的變化進行系統的分子監測,進一步描述本發明。
(1)幹預全過程中身體的生理變化與幹預效果的分子評價
相比較於志願者幹預前30天的各項生理生化指標,幹預9周、23周後,體重和BMI持續顯著下降;空腹血糖、空腹胰島素和胰島素抵抗指數的降低,直接反映糖穩態情況的好轉;甘油三酯和總膽固醇的下降表明機體脂代謝的改善;丙氨酸氨基轉移酶和γ穀氨醯轉移酶的明顯降低,說明肝臟細胞的損傷減輕;同時脂肪肝(志願者有68.5%幹預後狀況好轉,其中18.0%幹預後轉為正常)與血壓均有所改善;炎性標記物中的C反應蛋白、炎性因子白介素6和腫瘤壞死因子α的減少,反映腸道菌群引發的炎性反應的水平在幹預下降低;抗炎因子脂聯素的升高表明機體消除炎性反應的機能在幹預後的恢復;內毒素結合蛋白的減少提示進入血液的細菌產生的內毒素的水平在幹預下降低。
表7:實施例2志願者營養幹預全過程生理生化指標
數據表示為均值±標準偏差,或中位數(四分位數間距)。顯著性檢驗採用SPSS 17.0統計軟體的配對t檢驗(正態分布數據)或非參數分布Wilcoxon檢驗(非正態分布數據)。
腸道通透性測試,幹預前30天和幹預後9周收集得到的樣品數為89,幹預後23周的收集樣品數為76。
幹預後9周、23周與幹預前30天比較,*P<0.05,**P<0.01;幹預後23周與幹預後9周比較,§P<0.05,§§P<0.01。
幹預過程中腸道菌群結構變化情況如下:
454焦磷酸測序結果顯示營養幹預後志願者變形菌門數量顯著下降,放線菌門數量顯著上升。主要有三個科在營養幹預後發生顯著變化,腸桿菌科和脫硫弧菌科數量發生顯著下降,而雙歧桿菌科數量顯著上升。
營養幹預後,志願者腸桿菌科和脫硫弧菌科兩個常見的致病菌類型數量發生顯著下降,而保護腸屏障的雙歧桿菌科數量顯著上升,腸壁通透性下降,進入宿主循環系統的腸道的內毒素量減少,從而降低了宿主炎性反應水平,緩解了代謝綜合症的症狀。
本說明書引用的所有出版物通過引用整體引入。
引用文獻
1.Y.C.Wang,K.McPherson,T.Marsh,S.L.Gortmaker,M.Brown,Health and economic burden of the projected obesity trends in the USA and the UK.Lancet 378,815(Aug 27,2011).
2.G.S.Hotamisligil,Inflammation and metabolic disorders.Nature 444,860(Dec 14,2006).
3.J.P.Despres,I.Lemieux,Abdominal obesity and metabolic syndrome.Nature 444,881(Dec 14,2006).
4.Q.Xia,S.F.Grant,The genetics of human obesity.Ann N Y Acad Sci 1281,178(Apr,2013).
5.M.G.Butler,Prader‐Willi Syndrome:Obesity due to Genomic Imprinting.Curr Genomics 12,204(May,2011).
6.D.Lacroix et al.,Metabolic and adipose‐tissue signatures in adults with Prader‐Willi syndrome,a model of extreme adiposity.J Clin Endocrinol Metab,jc20143127(Dec 5,2014).
7.F.Backhed et al.,The gut microbiota as an environmental factor that regulates fat storage.Proc Natl Acad Sci U S A 101,15718(Nov 2,2004).
8.L.Zhao,The gut microbiota and obesity:from correlation to causality.Nature reviews.Microbiology 11,639(Sep,2013).
9.F.Backhed,J.K.Manchester,C.F.Semenkovich,J.I.Gordon,Mechanisms underlying the resistance to diet‐induced obesity in germ‐free mice.Proc Natl Acad Sci U S A 104,979(Jan 16,2007).
10.P.J.Turnbaugh,F.Backhed,L.Fulton,J.I.Gordon,Diet‐induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome.Cell Host Microbe 3,213(Apr 17,2008).
11.V.K.Ridaura et al.,Gut microbiota from twins discordant for obesity modulate metabolism in mice.Science 341,1241214(Sep 6,2013).
12.P.D.Cani et al.,Changes in Gut Microbiota Control Metabolic Endotoxemia‐Induced Inflammation in High‐Fat Diet–Induced Obesity and Diabetes in Mice.Diabetes 57,1470(June 2008,2008).
13.A.Vrieze et al.,Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome.Gastroenterology143,913(Oct,2012).
14.S.Xiao et al.,A gut microbiota‐targeted dietary intervention for amelioration of chronic inflammation underlying metabolic syndrome.FEMS Microbiol Ecol 87,357(Feb,2014).
15.N.Fei,L.Zhao,An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice.ISME J 7,880(Apr,2013).
16.M.Vijay‐Kumar et al.,Metabolic syndrome and altered gut microbiota in mice lacking Toll‐like receptor 5.Science 328,228(Apr 9,2010).
17.P.J.Turnbaugh et al.,An obesity‐associated gut microbiome with increased capacity for energy harvest.Nature 444,1027(Dec 21,2006).
18.S.T.Papavramidis,E.V.Kotidis,O.Gamvros,Prader‐Willi syndrome‐associated obesity treated by biliopancreatic diversion with duodenal switch.Case report and literature review.J Pediatr Surg 41,1153(Jun,2006).
19.G.Labruna et al.,High leptin/adiponectin ratio and serum triglycerides are associated with an"at‐risk"phenotype in young severely obese patients.Obesity 19,1492(Jul,2011).
20.J.Zweigner,R.R.Schumann,J.R.Weber,The role of lipopolysaccharide‐binding protein in modulating the innate immune response.Microbes Infect 8,946(Mar,2006).
21.P.D.Cani et al.,Metabolic endotoxemia initiates obesity and insulin resistance.Diabetes 56,1761(Jul,2007).
22.R.E.Ley et al.,Obesity alters gut microbial ecology.Proc Natl Acad Sci USA 102,11070(Aug 2,2005).
23.P.J.Turnbaugh et al.,A core gut microbiome in obese and lean twins.Nature457,480(Jan 22,2009).
24.A.Cotillard et al.,Dietary intervention impact on gut microbial gene richness.Nature 500,585(Aug 29,2013).
25.E.Le Chatelier et al.,Richness of human gut microbiome correlates with metabolic markers.Nature 500,541(Aug 29,2013).
26.H.B.Nielsen et al.,Identification and assembly of genomes and genetic elements in complex metagenomic samples without using reference genomes.Nature biotechnology 32,822(Aug,2014).
27.Y.Zhou et al.,Biogeography of the ecosystems of the healthy human body.Genome Biol 14,R1(Jan 14,2013).
28.A.M.Ellison et al.,Loss of foundation species:consequences for the structure and dynamics of forested ecosystems.Frontiers in Ecology and the Environment 3,479(Nov,2005).
29.M.J.Claesson et al.,Gut microbiota composition correlates with diet and health in the elderly.Nature 488,178(Aug 9,2012).
30.L.A.David et al.,Diet rapidly and reproducibly alters the human gut microbiome.Nature 505,559(Jan 23,2014).
31.K.P.Scott,S.W.Gratz,P.O.Sheridan,H.J.Flint,S.H.Duncan,The influence of diet on the gut microbiota.Pharmacol Res 69,52(Mar,2013).
32.S.Fukuda et al.,Bifidobacteria can protect from enteropathogenic infection through production of acetate.Nature 469,543(Jan 27,2011).
33.G.R.Gibson,X.Wang,Regulatory effects of bifidobacteria on the growth of other colonic bacteria.J Appl Bacteriol 77,412(Oct,1994).
34.S.Abubucker et al.,Metabolic reconstruction for metagenomic data and its application to the human microbiome.PLoS Comput Biol 8,e1002358(2012).
35.N.Segata et al.,Metagenomic biomarker discovery and explanation.Genome Biol 12,R60(2011).
36.K.M.Maslowski et al.,Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43.Nature 461,1282(Oct 29,2009).
37.V.Tremaroli,F.Backhed,Functional interactions between the gut microbiota and host metabolism.Nature 489,242(Sep 13,2012).
38.W.R.Russell et al.,High‐protein,reduced‐carbohydrate weight‐loss diets promote metabolite profiles likely to be detrimental to colonic health.American Journal of Clinical Nutrition 93,1062(May,2011).
39.H.J.Flint,K.P.Scott,S.H.Duncan,P.Louis,E.Forano,Microbial degradation of complex carbohydrates in the gut.Gut Microbes 3,289(Jul‐Aug,2012).
40.Z.Wang et al.,Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease.Nature 472,57(Apr 7,2011).
41.B.L.Cantarel,V.Lombard,B.Henrissat,Complex carbohydrate utilization by the healthy human microbiome.PLoS One 7,e28742(2012).
42.G.Zeller et al.,Potential of fecal microbiota for early‐stage detection of colorectal cancer.Mol Syst Biol 10,766(2014).
43.W.R.Wikoff et al.,Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites.Proc Natl Acad Sci U S A 106,3698(Mar 10,2009).
44.L.Hood,Tackling the microbiome.Science 336,1209(Jun 8,2012).
45.M.Li et al.,Symbiotic gut microbes modulate human metabolic phenotypes.Proceedings of the National Academy of Sciences of the United States of America 105,2117(Feb 12,2008).
46.Z.Wang et al.,Prognostic value of choline and betaine depends on intestinal microbiota‐generated metabolite trimethylamine‐N‐oxide.Eur Heart J 35,904(Apr,2014).
47.F.C.Barreto et al.,Serum indoxyl sulfate is associated with vascular disease and mortality in chronic kidney disease patients.Clin J Am Soc Nephrol 4,1551(Oct,2009).
48.M.E.Dumas et al.,Metabolic profiling reveals a contribution of gut microbiota to fatty liver phenotype in insulin‐resistant mice.Proc Natl Acad Sci U S A 103,12511(Aug 15,2006).
49.M.C.Deeley,C.Yanofsky,Transcription initiation at the tryptophanase promoter of Escherichia coli K‐12.J Bacteriol 151,942(Aug,1982).
50.S.Craciun,E.P.Balskus,Microbial conversion of choline to trimethylamine requires a glycyl radical enzyme.Proc Natl Acad Sci U S A 109,21307(Dec26,2012).。
