一種RNA成像的雙光子螢光探針及其在活細胞中的應用的製作方法
2023-05-23 17:33:32 2
本發明涉及一種螢光探針,特別涉及一種用於活細胞中RNA成像的雙光子螢光探針。
背景技術:
目前的螢光成像技術,尤其是雙光子螢光顯微成像技術,在實時監測活細胞中生物分子的形態、多寡等方面得到了廣泛應用。與雷射掃描共聚焦顯微鏡相比,雙光子螢光顯微鏡具有高檢測靈敏度、大的穿透深度、圖像高保真、低的光毒性和光漂白性等優勢,是生物活體組織成像的一個重要工具,獲得了生物、生命、醫學等學科研究者們的青睞。目前,商業化的螢光探針大多為針對雷射掃描共聚焦顯微鏡開發的單光子螢光探針,其雙光子吸收截面較小,所需激發光的光強偏大,易造成生物樣品熱損傷。單光子螢光探針的不匹配及雙光子螢光探針的缺乏大大限制了雙光子螢光顯微鏡的應用推廣。為適應當前形勢,開發有效的適用於雙光子螢光顯微鏡的新型螢光探針十分重要,各種能夠成像活細胞內不同靶標的雙光子螢光探針已成為研究熱點。
在細胞內的各種生命物質中,核糖核酸(RNA)是重要的生物大分子,其在催化生物反應、基因表達調控等生物學過程中扮演著極其重要的角色。RNA主要存在於細胞核的核仁區和細胞質中,其定位、活動、多寡、形態等包含著重要的生命科學信息,這些信息與醫學診斷和治療息息相關。因此,核仁和細胞質中的RNA成像對生物化學、生物醫藥、生命科學等具有十分重要的意義。與眾多的商業化探針(如DNA探針)相比,RNA探針非常少。目前只有分子探針公司(Molecular Probes Co.)提供一個可用RNA成像的探針「SYTO RNA-Select」,但該探針的化學結構式仍未對外公布。專利CN103265947A、CN103275699A分別提供了一種用於活細胞成像的RNA螢光探針,但該探針未能實現雙光子螢光成像。因此,在活細胞RNA螢光成像檢測方面,依然缺乏優良的雙光子螢光探針,這一現狀亟待解決。
技術實現要素:
本發明的目的是針對上述不足,而提供一種RNA成像的雙光子螢光探針,該探針具有膜通透性好、顯色強、光穩定性好的特點。
本發明的另一目的是提供該雙光子螢光探針在標記或顯示RNA在活細胞中分布的應用。
本發明採取的技術方案為:
一種RNA成像的雙光子螢光探針,結構通式如(I)所示:
其中:R為氫、烷基、羥烷基或醚基;X為溴或碘。
上述RNA成像的雙光子螢光探針中:所述R優選氫、C1-12的烷基、C1-12的羥烷基或乙醚基;進一步優選甲基、乙基、丁基、十二烷基或乙醚基。
所述的RNA成像的雙光子螢光探針最優選2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(簡稱為DI)。
上述RNA成像的雙光子螢光探針的製備方法:
先滷代反應在2-甲基苯並咪唑氮上引入R基,並獲得苯並咪唑鹽,然後利用苯並咪唑鹽與對二甲氨基苯甲醛knoevenagel反應得到最終產物。
所述的2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)的製備反應式如圖1所示。
上述RNA成像的雙光子螢光探針在標記或顯示RNA在活細胞中分布的應用。
所述的細胞為HeLa細胞。
將本發明雙光子螢光探針應用在HeLa細胞的染色,標記後的雙光子螢光圖像顯示,在細胞的細胞質和核仁區有明顯的螢光分布,明確提示所述探針能夠在活細胞中專一性成像細胞質和核仁中的RNA,並在經核糖核酸酶(RNase)消化實驗後的細胞進行對比實驗後得到進一步證實。SYTOX(R)藍色核酸染料(S-11348)是一種商業化成像壞死細胞核的發藍光的螢光染料,在利用本發明雙光子螢光探針與S-11348進行對比試驗後,在沒有S-11348標記的藍色螢光的活細胞中,本發明雙光子螢光探針發出了與S-11348螢光有明顯區別的螢光,這表明本發明所述雙光子螢光探針能成像活細胞中細胞質和核仁區的RNA。
用本發明雙光子螢光探針與S-11348進行對比試驗後,發現本發明雙光子螢光探針在活細胞細胞質和核仁區域具有清晰的螢光成像,這表明本發明雙光子螢光探針具有好的膜通透性,能進入活細胞並成像細胞質和核仁的RNA。
本發明雙光子螢光探針染色HeLa細胞,在800納米雷射持續輻照600秒後,仍能得到清晰的雙光子螢光成像照片,這表明其具有良好的雙光子光穩定性。
本發明雙光子螢光探針是一類新型的RNA選擇性識別的雙光子螢光探針,該探針具有膜通透性好、顯色強、光穩定性好的特點,可開發為RNA相關的生理、病理學研究用生物檢測試劑。
附圖說明
圖1為2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽的製備反應式;
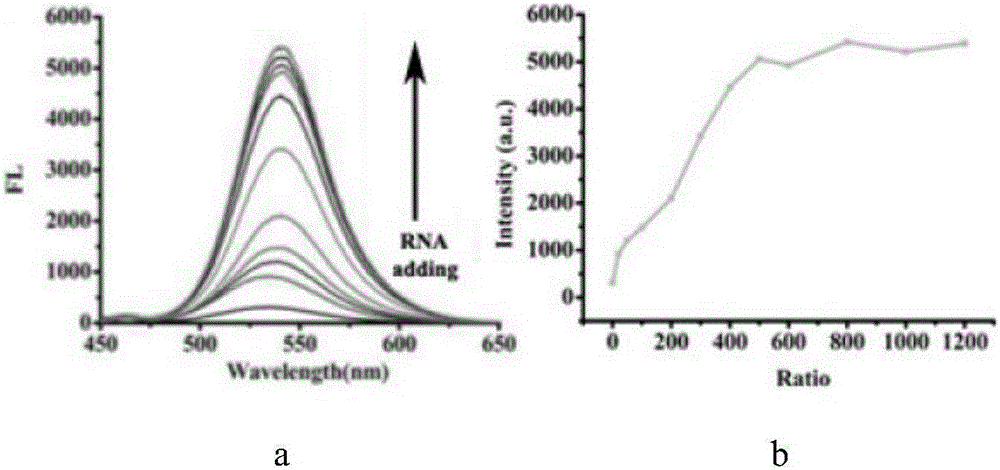
圖2為2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)的RNA雙光子螢光滴定圖;a為雙光子螢光光譜;b為最大螢光強度隨RNA與探針濃度比的變化圖;
圖3為2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)對活性Hela細胞進行染色在800納米雷射輻照下得到的雙光子螢光照片;a為雙光子螢光照片,收集螢光波長小於720納米;b為明場雷射掃描的微分幹涉顯微照片;c為a、b兩圖的合併圖(共定位圖);
圖4為HeLa細胞經核糖核酸酶(RNase)處理前後,用2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)細胞染色照片;a)為核糖核酸酶(RNase)處理前,用2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)染色HeLa細胞照片;b)為核糖核酸酶(RNase)處理前,明場雷射掃描的微分幹涉顯微照片;c)為核糖核酸酶(RNase)處理後,用2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)染色HeLa細胞照片;d)為核糖核酸酶(RNase)處理後,明場雷射掃描的微分幹涉顯微照片;
圖5為2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)與SYTOX(R)藍色核酸染料(S-11348)染色HeLa細胞的寬場螢光成像,藍光來自S-11348;a)為激發波長為510-550納米,收集的螢光波長大於 570nm得到的照片;b)為激發波長為426-450納米,收集的螢光波長為467-499納米得到的照片;c)為明場雷射掃描的微分幹涉顯微照片;d)為a,b和c圖的合併圖;
圖6為2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)染色HeLa細胞後,800納米雷射持續輻照不同時間得到的雙光子螢光成像照片。
具體實施方式
下面結合具體實施例進一步說明。
實施例1:2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)的合成
將1.32g(10mmol)2-甲基苯並咪唑與2.83g(20mmol)碘甲烷溶解在50ml甲苯中,攪拌6小時,隨後回流反應30分鐘,冷卻至室溫,過濾,乙醚洗滌,得到N-甲基-2-甲基苯並咪唑碘鹽。將0.288g(1mmol)N-甲基-2-甲基苯並咪唑碘鹽與0.149g(1mmol)對二甲氨基苯甲醛溶於20ml甲醇中,滴加3滴哌啶,回流反應6h,無水乙醇洗滌,得到褐色粉末,產率77%。
1H NMR(400MHz,DMSO-d6),δ(ppm):7.987(d,J=3.16Hz,2H),7.796(t,J=6.6Hz,2H),7.721(s,1H),7.650(dd,J1=J2=3.08Hz,2H),7.213(d,J=16.48,1H),6.822(d,J=8.84,2H),4.107(s,6H),3.044(s,6H).13C NMR(400MHz,DMSO-d6),δ(ppm):152.79,149.60,147.58,132.46,131.06,126.40,122.19,112.99,112.15,101.18,33.29.HRMS(m/z):[M-I]+.Calcd for C19H22IN3,292.3027;found,292.1806。
實施例2:2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二丁基-3H-苯並咪唑碘鹽的合成
將1.32g(10mmol)2-甲基苯並咪唑與3.68g(20mmol)碘丁烷溶解在50ml甲苯中,攪拌6小時,隨後回流反應30分鐘,冷卻至室溫,過濾,乙醚洗滌,得到N-丁基-2-甲基苯並咪唑碘鹽。將0.372g(1mmol)N-丁基-2-甲基苯並咪唑碘鹽與0.149g(1mmol)對二甲氨基苯甲醛溶於20ml甲醇中,滴加3滴哌啶,回流反應6h,無水乙醇洗滌,得到褐色粉末,產率70%。
實施例3:2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二乙基乙基醚-3H-苯並咪唑溴鹽的合成
將1.32g(10mmol)2-甲基苯並咪唑與3.06g(20mmol)2-溴乙基乙基醚溶解在50ml甲苯中,攪拌6小時,隨後回流反應30分鐘,冷卻至室溫,過濾,乙醚洗滌,得到N-乙基乙基醚-2-甲基苯並咪唑溴鹽。將0.404g(1mmol)N-乙基乙基醚-2-甲基苯並咪唑溴鹽與0.149g(1mmol)對二甲氨基苯甲醛溶於20ml甲醇中,並滴加3滴哌啶,回流反應7h,無水乙醇洗滌,得到褐色粉末,產率65%。
效果測試
(一)2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)的RNA雙光子螢光滴定:
固定2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)在Tris-HCl緩衝溶液(pH=7.2,Tris和KCl 100mmol/L)中的濃度,逐漸加入RNA,在800納米雷射輻照光下得到2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)的雙光子螢光滴定譜圖,如圖2所示。結果表明,隨著RNA的不斷加入,本發明所述探針的雙光子螢光強度先是急劇增大,而後增大幅度放緩。這表明本發明的探針對RNA具有明顯的螢光響應。
(二)HeLa細胞培養
HeLa細胞株貼壁培養於內含10%(v/v)胎牛血清和少量青黴素/鏈黴素的培養液中,在37℃、5%CO2(v/v)的飽和溼度孵箱中培養。待細胞生長到對數期,接片培養:將蓋玻片於鉻酸洗液中浸泡30分鐘,清水、超純水洗淨,烘乾,滅菌後放入一次性35mm無菌培養皿中;將100mL培養瓶中的培養基小心地倒出,細胞用PBS(磷酸鹽緩衝液,pH=7.4)洗2遍,用l mL 0.25%(質量分數)胰蛋白酶液消化2~3分鐘,倒掉胰蛋白酶液,加入少量新鮮培養基吹打均勻成細胞懸浮液,細胞計數後,留下合適密度的細胞,將培養基加至所需體積吹打均勻,而後將細胞接種至內含蓋玻片的培養皿中,放入培養箱中培養,使細胞爬片生長。24~48h後,生長至細胞密度達50%~70%,待染色。
(三)2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)對HeLa細胞的染色觀察:
將2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)配成1mM DMSO母液,染色時用PBS(磷酸鹽緩衝液,pH=7.4)稀釋至5μM。將接種好的細胞在5μM的探針分子溶液中,37℃條件下孵育30min,用PBS洗去未結合的多餘染液,細胞生長面朝下蓋在載玻片上;然後把樣品置於載物臺上螢光成像。結果見圖3,雙光子螢光圖像顯示在細胞質和核仁區有明顯的螢光分布,表明本發明的探針能夠在活細胞中專一性的成像細胞質和核仁中的RNA。
(四)2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)探針對HeLa細胞、RNase消化處理後的HeLa細胞的染色觀察:
固定細胞製備:將培養的HeLa細胞浸泡於4%(質量分數)多聚甲醛溶液30分鐘,或者用-20℃甲醇固定15分鐘,而後用0.5%Triton X-100室溫通透2分鐘,得到待染色固定細胞。
取兩組上述固定細胞,用濃度為5μM的2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)探針溶液在CO2培養箱中孵化染色30分鐘。用PBS對兩組細胞衝洗2遍,向其中一組加入25mg/mL DNase-Free RNase(GE)(核糖核酸酶),然後兩組細胞在37℃、5%CO2條件下孵育2小時。隨後,用PBS衝洗2次,在寬場顯微鏡下觀察、記錄兩組細胞中螢光分布及亮度變化等。
結果見圖4,未經RNase消化處理的HeLa細胞的螢光主要集中在細胞質和核仁區域;而經RNase消化處理後的HeLa細胞的螢光集中到了細胞核區域,其細胞質和核仁區域基本沒有螢光。由於RNase僅能水解掉細胞中的RNA,因此,該實施例可以證實本發明的探針能夠選擇性成像細胞中的RNA。
(五)2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)與SYTOX(R)藍色核酸染料(S-11348)共染色HeLa細胞的觀察:
將培養的HeLa細胞用濃度為5μM的2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)螢光探針在37℃條件下染色30分鐘。然後用PBS衝洗2遍,再用濃度為5μM的S-11348在培養箱中對HeLa細胞染色30分鐘。最後將細胞取出,在寬場顯微鏡下觀察、記錄細胞中螢光分布及亮度變化等。
結果見圖5,S-11348是一商業化的成像壞死細胞核的發藍光的螢光染料,在利用本發明所述螢光探針與S-11348進行對比試驗後,發現本發明所述的螢光探針在活細胞細胞質和核仁區域具有清晰的螢光成像,這表明本發明所述的螢光探針具有好的膜通透性,能進入活細胞並成像細胞質和核仁的RNA。
(六)2-[2-(4-二甲基胺基-苯基)-乙烯基]-1,3-二甲基-3H-苯並咪唑碘鹽(DI)染色HeLa細胞雙光子光穩定性觀察:
按照(三)得到本發明所述探針染色HeLa細胞的雙光子螢光圖像,用800納米雷射持續輻照,在雙光子螢光顯微鏡下觀察、記錄細胞中螢光分布及亮度變化等。結果見圖6,本發明所述螢光探針染色HeLa細胞,在800納米雷射持續輻照600秒後,仍能得到清晰的雙光子螢光成像照片,這表明本發明所述螢光探針具有良好的雙光子光穩定性。
以上是結合具體實施例對本發明的詳細介紹,本發明的保護範圍不限於此。
