YAP1基因及抑制劑在增強膀胱癌幹細胞化療敏感性中的應用的製作方法
2023-04-26 01:35:41 1
本發明屬於生物化學領域,涉及膀胱癌幹細胞化療敏感性相關靶點的發現和靶點抑制劑的開發,具體涉及YAP1基因及抑制劑在增強膀胱癌幹細胞化療敏感性中的應用。
背景技術:
腫瘤幹細胞是指腫瘤中具有無限自我更新能力並能產生出異質性腫瘤細胞的細胞。研究發現,這類細胞與腫瘤的生長、轉移和復發具有密切聯繫。這類細胞的很多性質與幹細胞類似,因此將其稱為腫瘤幹細胞。腫瘤幹細胞理論認為,發生腫瘤的根源就是機體組織中形成了腫瘤幹細胞,腫瘤治療後的復發以及耐藥性也都與腫瘤幹細胞有關。腫瘤幹細胞與普通腫瘤細胞相比具有很高的體內成瘤能力,且不易被殺傷去除。
膀胱癌是我國泌尿系統最為常見的惡性腫瘤之一,近年來其發病率呈現不斷增高的趨勢。臨床上70%左右的膀胱癌患者確診時為非肌層浸潤性膀胱癌,其主要治療方法為經尿道膀胱腫瘤電切術,但術後復發率高是導致手術治療失敗的主要原因。目前預防非肌層浸潤性膀胱癌患者術後復發及進展的最有效辦法是在術後輔以膀胱灌注疫免抑制劑或化療藥物。儘管膀胱灌注在近期具有一定的療效,但目前常用的灌注藥物均存在不同程度的全身或局部毒副反應,包括骨髓抑制、過敏反應以及膀胱刺激徵等。此外,仍有20%左右的患者雖經膀胱灌注但腫瘤仍會復發。患者一旦進展為轉移性膀胱癌,治療主要釆用以順鉑為主的化療方案,儘管大多數膀胱癌患者對含順鉑的化療方案比較敏感,但是其療效卻並不能持久,容易出現耐藥性,從而化療敏感性降低。鑑於目前膀胱癌灌注藥物和化療藥物療效的不穩定性,尋找安全而有效的膀胱癌治療藥物已經成為腫瘤治療領域研究的熱點和難點。
Hippo通路在人體發育和腫瘤形成過程中發揮重要作用,其通過調節細胞增殖和凋亡之間的動態平衡,調控發育過程中組織器官的大小和重量。最新研究表明,Hippo通路在細胞自我更新、幹細胞擴增、組織特異性前體細胞再生和組織再生過程中亦起重要作用。Hippo通路由大量的上遊信號通路分子激活,導致YAP1等下遊轉錄因子磷酸化和功能抑制。YAP1即yes相關蛋白,是Hippo通路中重要的靶分子,以磷酸化的形式參與細胞內信號轉導和下遊靶分子的轉錄共激活。YAP1本身並不具有轉錄活性,其在腫瘤形成過程中的作用仍有爭議。大量研究表明,YAP1在腫瘤形成過程中的不同作用可能具有組織和細胞特異性。一方面,YAP1能夠聯合p73誘導細胞凋亡應對DNA損傷,具有抑癌作用;另一方面,YAP1在一些惡性腫瘤如肝細胞癌中高表達,提示其具有促癌作用。YAP1作為轉錄共激活因子之一,可與癌基因或抑癌基因轉錄因子特異性結合,發揮相應的功能,並且結合靶點具有組織特異性。
目前尚未見YAP1基因及抑制劑在增強膀胱癌幹細胞化療敏感性方面的報導。
技術實現要素:
本發明的目的在於提供YAP1基因及抑制劑在增強膀胱癌幹細胞化療敏感性中的應用,以提高化療藥物對膀胱癌的治療效果。
本發明上述目的是通過以下技術方案得以實現:
YAP1基因高表達作為靶點在製備增強膀胱癌幹細胞化療敏感性的藥物中的應用。
一種增強膀胱癌幹細胞化療敏感性的藥物,其有效成分為YAP1基因高表達的抑制劑。
優選地,所述抑制劑為siRNA、shRNA、dsRNA、miRNA、cDNA、小分子化合物、肽、抗體中的一種或多種。
優選地,小分子化合物為2-胺基苯並惡唑衍生物。
優選地,所述2-胺基苯並惡唑衍生物選自如下結構衍生物1-3中的一種:
衍生物1
衍生物2
衍生物3
一種增強膀胱癌幹細胞化療敏感性的複方藥物,其有效成分為上述抑制劑以及化療藥物。
優選地,化療藥物為鉑類藥物或絲裂黴素C。
優選地,所述鉑類藥物為順鉑。
本發明的有益效果:
本發明證明YAP1基因與膀胱癌幹細胞化療敏感性有關,YAP1基因高表達的抑制劑可以通過下調YAP1基因表達提高膀胱癌幹細胞對化療藥物絲裂黴素C和順鉑的化療敏感性,提高化療藥物絲裂黴素C和順鉑對膀胱癌幹細胞的抑制率。YAP1基因高表達的抑制劑可以為siRNA、shRNA、dsRNA、miRNA、cDNA、小分子化合物、肽、抗體中的任意一種或多種。
附圖說明
圖1為YAP1mRNA相對表達量;
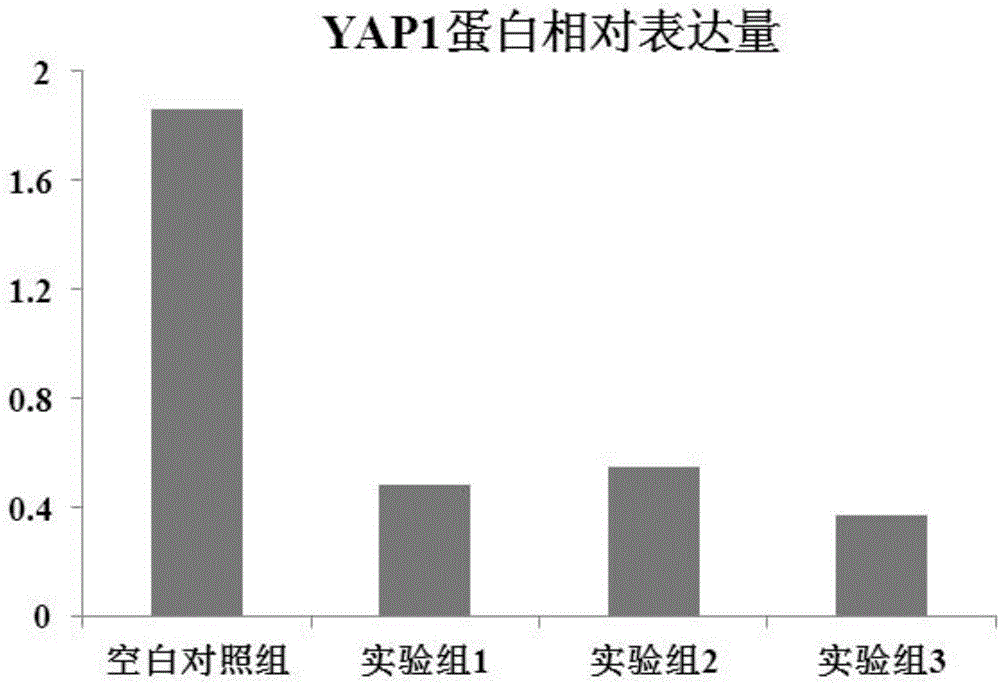
圖2為YAP1蛋白相對表達量;
圖3為絲裂黴素C對膀胱癌幹細胞的抑制率。
具體實施方式
下面結合實施例進一步說明本發明的實質性內容。
實施例1:膀胱癌幹細胞的分選
一、實驗材料
人膀胱癌T24細胞株,培養於含10%胎牛血清的RPMI-1640培養基中(含100U/mL青黴素和100μg/mL鏈黴素),培養箱溫度37℃,CO2濃度5%,每2天換液1次。
細胞抑制率實驗使用CCK-8細胞增殖及細胞毒性檢測試劑盒:根據說明書使用,細胞增殖越多越快,則顏色越深;細胞毒性越大,則顏色越淺,顏色的深淺和細胞數目呈線性關係。
細胞周期檢測使用細胞周期即時檢測試劑盒檢測,然後流式細胞儀分析。
二、實驗方法
1、化療藥物幹預培養分選耐藥膀胱癌細胞
在T75培養瓶中接種T24細胞5×106個,用含10%胎牛血清的RPMI-1640培養基培養24小時後,隨機分為對照組和分選組。分選組加入絲裂黴素C至終濃度為2mg/mL,對照組加入等體積的PBS。幹預24小時後測定細胞抑制率,收集耐藥細胞備用。
2、細胞周期分析
將上述分選收集的耐藥細胞用PBS重懸成1×106/mL的細胞懸液,離心去上清,用細胞周期即時檢測試劑盒檢測對照組和分選組細胞的細胞周期,操作方法見試劑盒說明書。最後使用流式細胞儀檢測,記錄激發波長488nm處紅色螢光。
3、RT-PCR測定幹細胞標誌物OCT-4和NANOG表達
採用Trizol試劑盒提取上述耐藥細胞的總RNA,紫外分光光度計測A260、A280值,計算RNA含量。採用特異性OCT-4逆轉錄引物(F:5』-TCAGCCAAACGACCATCTGC-3』;R:5』-TTCTCCAGGTTGCCTCTCAC-3』)、NANOG逆轉錄引物(F:5』-CAGCTGTGTGTACTCAAT GATAGATTT-3』;R:5』-ACACCATTGCTATTCTTCGGCCAGTTG-3』)及GAPDH內參逆轉錄引物(F:5』-TGCACCACCAACTGCTTAGC-3』;R:5』-GGCATGGACTGTGGTCATGAG-3』)進行逆轉錄,獲取產物再行瓊脂糖凝膠電泳,在燈下分析條帶,計算相對表達量。
按試劑盒說明書和常規RT-PCR操作。
4、Western Blot測定幹細胞標誌物OCT-4和NANOG表達
用蛋白質裂解液裂解上述耐藥細胞,勻漿後離心取上清,採用BCA試劑盒測蛋白含量。按50μg蛋白上樣行SDS-PAGE電泳。溼轉印法將蛋白質轉印至PVDF膜;50g/L脫脂奶粉溶液室溫封閉2h,加入OCT-4兔抗人單克隆抗體稀釋液、NANOG兔抗人多克隆抗體稀釋液及β-actin兔抗人多克隆抗體稀釋液,室溫搖床輕搖過夜;TBST洗膜,加入羊抗兔IgG的二抗,室溫搖床輕搖1.5h;TBST充分漂洗,加入ECL顯色液,自動凝膠分析儀照相,以相應蛋白條帶灰度值除以內參β-actin灰度值校正得到相應蛋白的相對表達量。
三、實驗結果
1、耐藥膀胱癌細胞分選結果
分選組絲裂黴素C作用24小時後,T24細胞株的抑制率達90%以上。細胞周期分析顯示,分選組有80%以上的細胞處於G0/G1期,S期佔15%以下;而對照組有60%以上的細胞處於S期,G0/G1期佔30%以下。結果說明,分選組獲得的耐藥細胞多數處於G0/G1期,符合幹細胞的細胞周期特徵。
2、幹細胞標誌物OCT-4和NANOG在耐藥細胞中的表達情況
RT-PCR法測定結果表明,與對照組相比,分選組幹細胞標誌物OCT-4的表達增強26倍,幹細胞標誌物NANOG的表達增強32倍;Western Blot法測定結果顯示同樣的趨勢,OCT-4和NANOG表達顯著增強,分選組與對照組差異顯著(P<0.01)。
申請人還測試了經其他濃度絲裂黴素C幹預獲得的耐藥細胞中幹細胞標誌物OCT-4和NANOG的表達,這兩種標誌物的表達均顯著增強,且呈劑量依賴性。
上述結果證明,經絲裂黴素C幹預後剩餘耐藥性細胞具有幹細胞潛能,膀胱癌的耐藥性可能與這些膀胱癌幹細胞的存在有關。
實施例2:YAP1基因在膀胱癌幹細胞中的表達及與化療敏感性的關係
一、實驗材料
人膀胱癌T24細胞株,培養於含10%胎牛血清的RPMI-1640培養基中(含100U/mL青黴素和100μg/mL鏈黴素),培養箱溫度37℃,CO2濃度5%,每2天換液1次。
膀胱癌幹細胞,採用實施例1方法分選得到耐藥細胞。
靶向幹擾YAP1的siRNA以及siRNA陰性對照由上海吉瑪提供。
二、實驗方法
1、細胞培養和轉染
收集耐藥細胞接種在培養板上,隨機分為空白對照組、siRNA幹擾組和siRNA陰性對照組。空白對照組不進行轉染處理;siRNA幹擾組轉染幹擾YAP1的siRNA;siRNA陰性對照組轉染siRNA陰性對照。轉染按照脂質體轉染試劑盒Lipofectamine 2000說明書操作。
2、RT-PCR測定膀胱癌幹細胞中YAP1表達
轉染處理後收集各組耐藥細胞,用PBS洗滌、離心棄上清,採用Trizol試劑盒提取上述耐藥細胞的總RNA,紫外分光光度計測A260、A280值,計算RNA含量。以總RNA 1μg的上樣量按照Taka逆轉錄試劑盒說明書進行逆轉錄,採用特異性YAP1逆轉錄引物(F:CAACTCCAACCAGCAGCAACA;R:GCAGCCTCTCCTTCTCCATCTG)及GAPDH內參逆轉錄引物進行逆轉錄,獲取產物再行瓊脂糖凝膠電泳,在燈下分析條帶,計算相對表達量。
3、Western Blot測定膀胱癌幹細胞中YAP1表達
轉染處理後收集各組耐藥細胞,PBS洗滌後用蛋白質裂解液裂解耐藥細胞,勻漿離心取上清,採用BCA試劑盒測蛋白含量。按50μg蛋白上樣行SDS-PAGE電泳。溼轉印法將蛋白質轉印至PVDF膜;50g/L脫脂奶粉溶液室溫封閉2h,加入YAP1和β-actin一抗稀釋液,室溫搖床輕搖過夜;TBST洗膜,加入二抗室溫搖床輕搖2h;TBST充分漂洗,加入ECL顯色液,自動凝膠分析儀照相,以相應蛋白條帶灰度值除以內參β-actin灰度值校正得到相應蛋白的相對表達量。
4、絲裂黴素C對轉染處理後的膀胱癌幹細胞的抑制率
轉染處理後,用不含胎牛血清的RPMI-1640培養基洗滌各組耐藥細胞,然後以含5%胎牛血清的RPMI-1640培養基培養4小時,加入絲裂黴素C至終濃度為2mg/mL,幹預8小時後測定細胞抑制率。
三、實驗結果
1、siRNA幹擾結果
RT-PCR法測定結果表明,與空白對照組相比,siRNA幹擾組YAP1的表達下調24倍,siRNA陰性對照組與空白對照組無顯著差異;Western Blot法測定結果顯示同樣的趨勢,siRNA幹擾組YAP1表達顯著下調,與空白對照組差異顯著(P<0.01),siRNA陰性對照組與空白對照組無顯著差異。siRNA對YAP1幹擾成功。
2、絲裂黴素C對轉染處理後的膀胱癌幹細胞的抑制率
幹預8小時後,絲裂黴素C對siRNA幹擾組中膀胱癌幹細胞的抑制率為90.5%,而對siRNA陰性對照組中膀胱癌幹細胞的抑制率僅為18.6%。
實施例3:小分子化合物對膀胱癌幹細胞化療敏感性的影響
一、實驗材料
相關實驗材料同實施例1和實施例2。
二、實驗方法
1、細胞培養和分組
收集耐藥細胞,用含5%胎牛血清的RPMI-1640培養基培養4小時後,隨機分為空白對照組、實驗組1-3,各組添加如表1所示結構和終濃度的增敏劑繼續幹預培養12小時。
表1各組增敏劑的化學結構和在培養基中的濃度
2、RT-PCR測定膀胱癌幹細胞中YAP1表達
幹預培養12小時後,收集空白對照組、實驗組1-3的耐藥細胞,PBS洗滌、離心棄上清,採用Trizol試劑盒提取上述耐藥細胞的總RNA,紫外分光光度計測A260、A280值,計算RNA含量。以總RNA 1μg按照Taka逆轉錄試劑盒說明書進行逆轉錄,採用特異性YAP1逆轉錄引物(序列同前)及GAPDH內參逆轉錄引物(序列同前)進行逆轉錄,獲取產物再行瓊脂糖凝膠電泳,在燈下分析條帶,計算相對表達量。
3、Western Blot測定膀胱癌幹細胞中YAP1表達
幹預培養12小時後,收集空白對照組、實驗組1-3的耐藥細胞,PBS洗滌,用蛋白質裂解液裂解,勻漿後離心取上清,採用BCA試劑盒測蛋白含量。按50μg蛋白上樣行SDS-PAGE電泳。溼轉印法將蛋白質轉印至PVDF膜;50g/L脫脂奶粉溶液室溫封閉2h,加入YAP1和β-actin一抗稀釋液,室溫搖床輕搖過夜;TBST洗膜,加入二抗室溫搖床輕搖2h;TBST充分漂洗,加入ECL顯色液,自動凝膠分析儀照相,以相應蛋白條帶灰度值除以內參β-actin灰度值校正得到相應蛋白的相對表達量。
4、絲裂黴素C對膀胱癌幹細胞的抑制率
幹預培養12小時後,用不含胎牛血清的RPMI-1640培養基洗滌各組耐藥細胞,然後以含5%胎牛血清的RPMI-1640培養基培養4小時,加入絲裂黴素C至終濃度為2mg/mL,幹預8小時後測定細胞抑制率。
三、實驗結果
1、增敏劑孵育對YAP1表達的影響
RT-PCR法測定結果表明,與空白對照組相比,實驗組1-3中YAP1mRNA的表達顯著下調(如圖1所示);Western Blot法測定結果顯示同樣的趨勢,實驗組1-3中YAP1蛋白的表達顯著下調(如圖2所示)。結果表明實驗組1-3中的增敏劑可以顯著下調YAP1基因表達。
2、絲裂黴素C對增敏劑處理後的膀胱癌幹細胞的抑制率
幹預8小時後,絲裂黴素C對各組膀胱癌幹細胞的抑制率如圖3所示。
結果表明,表1中2-胺基苯並惡唑衍生物通過下調膀胱癌幹細胞YAP1基因的表達增強膀胱癌幹細胞對化療藥物絲裂黴素C的敏感性,從而提高化療藥物對膀胱癌幹細胞的抑制率。發明人用順鉑替代絲裂黴素C,結果YAP1下調的膀胱癌幹細胞對順鉑的敏感性也顯著提高。
本發明證明YAP1基因與膀胱癌幹細胞化療敏感性有關,YAP1基因高表達的抑制劑可以通過下調YAP1基因表達提高膀胱癌幹細胞對化療藥物絲裂黴素C和順鉑的化療敏感性,提高化療藥物絲裂黴素C和順鉑對膀胱癌幹細胞的抑制率。YAP1基因高表達的抑制劑可以為siRNA、shRNA、dsRNA、miRNA、cDNA、小分子化合物、肽、抗體中的任意一種或多種。
