用於牲畜生產系統的疫苗的製作方法
2023-04-25 20:46:16 9
本發明涉及用於保護免於腸細菌感染的活疫苗。
發明背景
說明書中對任何現有技術的引用並非是承認或表明了本技術形成任何管轄區中公知常識的一部分或本技術可合理地預期被本領域的技術人員所理解、被認為是相關的,和/或與現有技術的其他部分進行組合。
非傷寒沙門氏菌(Nontyphoidal Salmonella)是美國最大的食源性疾病負擔,其導致最多的感染、住院和死亡,具有每年報告的103萬例疾病。與疾病相關的經濟負擔是驚人的,而僅醫療開銷就達到每年110億美元,且通過食品工業(召回、訴訟、降低消費者信心)和通過州、地方和聯邦公共衛生機構響應NTS爆發產生大量額外費用。在全球範圍,非傷寒沙門氏菌估計為9,380萬例且每年死亡15.5萬,並已經成為撒哈拉以南的非洲(sub-Saharan Africa)中菌血症的主要原因,其中其致死率達到多至25%。
隨著抗生素的長期施用已經導致在世界範圍內傳播的多藥抗性菌株的出現,與沙門氏菌相關的健康和經濟負擔可能會惡化;例如,鼠傷寒沙門氏菌DT104在過去二十年已引起了數起食源性疾病爆發,並且對獸藥中五種最常用的抗生素中的四種(四環素、β-內醯胺、氨基糖苷和磺醯胺)有抗性。這些多藥抗性菌株常常與更多的住院和菌血症相關,並且它們在自然中的維持可以通常在包括地下水的環境中發現的非常低的抗生素濃度發生。此外,在2009年從患者中分離出了一種新類型的碳青黴烯抗性腸桿菌科,其對於β-內醯胺、氟喹諾酮類和氨基糖苷類有抗性,並且這種抗性現在表現出在革蘭氏陰性病原體(包括沙門氏菌)中的廣泛分布。此外,最近(2012)從源自牲畜的天然微生物群體中已分離出「超毒力(hypervirulent)」沙門氏菌。這些超毒力菌株的毒力是大多數臨床分離株的100倍,更易殺死免疫接種的動物,且由於離體快速轉變為較低毒力狀態以致在標準實驗室測試條件下檢測不到。總之,這些發現支持這樣的觀點,即沙門氏菌疾病負擔隨著更具毒力的多藥抗性菌株的潛在出現而將惡化,所述菌株難以使用目前可獲得的抗生素加以控制。
腸沙門氏菌(Salmonella enterica)經由糞-口途徑獲得且包含6個亞種,其基於糖、脂多糖(LPS)和鞭毛組成細分為超過2500個血清型(血清學變體),其中腸亞種包含超過99%的人致病性分離株。腸沙門氏菌感染可導致任何下述四種不同的疾病症候群:小腸結腸炎/腹瀉、菌血症、腸(傷寒)發熱和慢性無症狀攜帶。多種血清型感染人和動物兩者,且疾病的嚴重性是血清型、菌株毒力和宿主易感性的函數。
對牲畜中的沙門氏菌屬控制的努力由於下述原因持續性存在問題:1)大多數牲畜感染是亞臨床的;2)疾病爆發是零星的且經常由特定血清型引起,儘管許多血清型是牲畜生產系統特有的;3)環境持續性為牲畜感染提供了持續性的儲存;4)最近出現了更具毒力和可以殺死接種動物的菌株變體;5)一些源自人沙門氏菌病患者的菌株與動物來源的那些不同;和6)管理和環境事件可增加病原體暴露和/或損害宿主免疫力。
接種代表任何食品安全計劃的可持續性方法,其在食品生產鏈的開始減少病原體暴露[1]。然而,由常規疫苗賦予的免疫力受限於狹窄範圍的密切相關菌株,並且農場上(on-farm)的控制需要開發引發針對多種病原性血清型的保護的疫苗[1]。最近的進展已經導致修飾的活沙門氏菌屬交叉保護疫苗的開發,其中許多包含有利於抗原生產的全球調節網絡中的突變;並且也適合於異源抗原的表達[2-6]。交叉保護疫苗效力的分子基礎尚未完全清楚。相關參數可包括:病原性血清型中共享的多個抗原的表達;減少的疫苗誘導的免疫抑制;靶向去除免疫顯性抗原以暴露交叉保護表位;重組抗原的III型分泌;和/或用於免疫響應的增強刺激的延遲疫苗減毒([1,3,7,8]中進行了綜述)。
在基因中攜帶功能缺失突變的修飾的活減毒腸沙門氏菌鼠傷寒血清型可用於提供針對沙門氏菌的多樣性的保護。可考慮用於提供可應用的功能缺失突變的基因座的數目是龐大的,如在每個基因座可應用的突變數目般。用於提供功能缺失的基因座的一些實例包括涉及細菌的粘附、侵入和細胞內和細胞外存活的基因座(包括編碼參與代謝過程的蛋白的多種基因)。編碼DNA腺嘌呤甲基化酶(dam)的基因的一些突變能夠引起針對沙門氏菌的多樣性的保護。當作為修飾的活疫苗在小鼠[2,9]、家禽[10,11]、綿羊[12]和小牛[13-15]中應用時,這些看起來被充分耐受。免疫力的誘導是快速的,且疫苗可以低成本和牲畜群體的低應激免疫以經由飲用水的遞送施用[12,16]。
任何疫苗的商業成功取決於治療指數、安全性/毒力的比率,且安全性對於具有回覆至升高毒力的潛力的修飾的活疫苗是特別關注的。一般而言,疫苗應滿足4個安全類別才能被考慮作為牲畜生產系統中商業用途的候選。相關的安全性表型如下:減少的i)疫苗脫落;ii)激發株脫落;iii)在全身組織(肝/脾)中的持續性;和iv)在環境中的持續性。
理解的是在提供包含功能缺失突變的減毒株中,重要的是由相關突變產生的改進的安全性概貌就其提供的保護而言不減少疫苗效力。最終,尋找的是其不減少免疫的個體中低水平感染的持續性且當病原體從免疫動物脫落並釋放到環境中時不增加免疫原在環境中的持續性的突變。
難以預測哪些功能缺失突變在減毒中比其他更有效,特別是考慮到與每個基因座和突變相關的效力和回復到病原性的數據產生自不同的實驗室系統。
另一複雜性是希望選擇多於一個基因座用於突變,使得在至少一種功能缺失突變丟失時防止回復到病原性表型。這樣的方法需要組合來自大量候選基因座的至少2個基因座,然而對於特定組合是否可能增加或減少回復的可能性或可能增加或降低所得的減毒疫苗的效力仍僅有有限指導。
對於用於保護針對沙門氏菌屬感染的減毒活疫苗存在需要。
對於具有改進的安全性表型的用於保護針對沙門氏菌屬感染的減毒活疫苗也存在需求。
對於具有有限的或沒有從動物脫落的傾向、當從動物脫落時在環境中具有最小持續性,且在動物中保持可接受水平的持續性以引起免疫力的減毒活疫苗存在需求。
發明概述
本發明尋求改善或解決上述一個或多個問題、限制或需要,且在一個實施方案中提供了腸細菌,其包含:
-編碼DNA腺嘌呤甲基化酶的基因(本文稱為dam)中的第一功能缺失突變和
-選自下組的基因中的第二功能缺失突變:sifA、spvB和mgtC。
在另一實施方案中提供了疫苗,其包含:
-如上文所述的腸細菌;和
-載劑、稀釋劑、賦形劑或佐劑。
在另一實施方案中提供了預防或治療細菌性腸疾病或病況的方法,其包括下述步驟:將如上文所述的疫苗提供給其待預防或治療細菌性腸疾病或病況的個體。
在另一實施方案中提供了用於產生適用於預防或治療細菌性腸疾病或病況的疫苗的免疫原集合的方法,其包括:
-提供具有dam中的功能缺失突變的腸細菌,
-將功能缺失突變引入選自下組的細菌基因:sifA、spvB和mgtC。
在另一實施方案中提供了用於產生適用於預防或治療細菌性腸疾病或病況的疫苗的免疫原集合的方法,其包括:
-提供具有選自下組的功能缺失突變的腸細菌:sifA、spvB和mgtC,
-將功能缺失突變引入所述細菌的dam基因。
附圖簡述
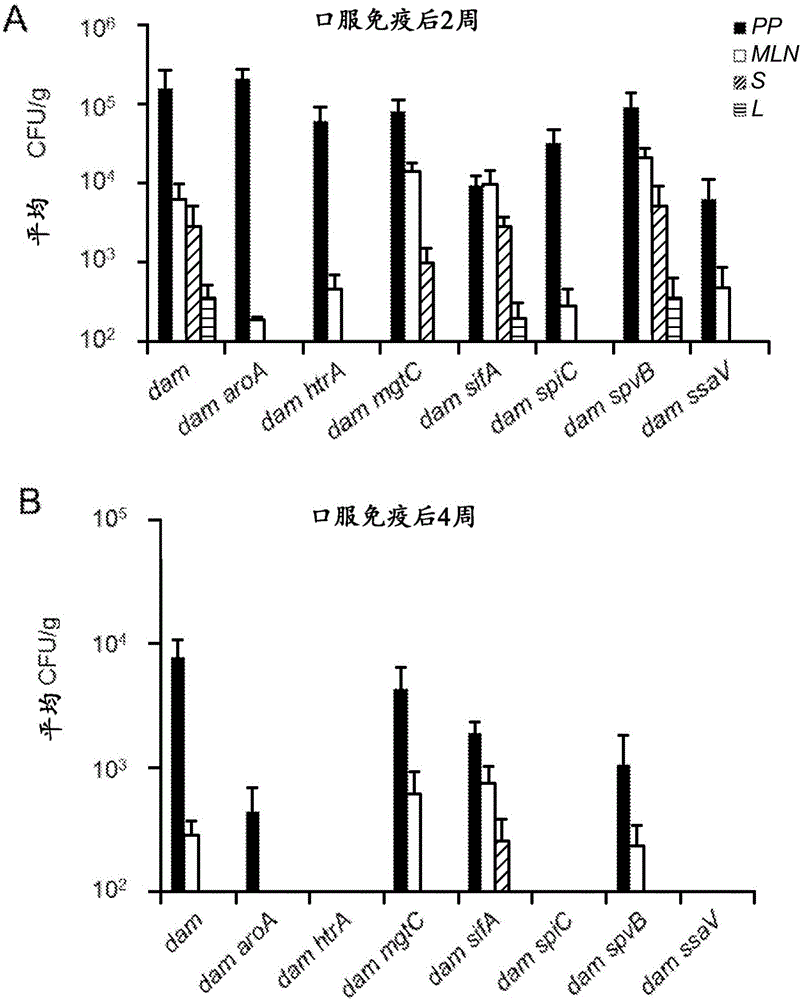
圖1.評估用於菌落化的沙門氏菌屬dam雙突變疫苗候選物和在黏膜和全身組織中的持續性。用鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物(dam aroA[MT3138],dam htrA[MT3142],dam mgtC[MT3146],dam sifA[MT3150],dam spiC[MT3154],dam spvB[MT3158],dam ssaV[MT3162])或親本UK-1damΔ232疫苗株(MT3134)(109CFU)口服免疫BALB/c小鼠。在口服免疫後第2周(A)和第4周(B),評估了從派爾集合淋巴結(Peyer’s patches,PP)、腸繫膜淋巴結(mesenteric lymph nodes,MLN)、肝(L)和脾(S)回收的細菌在LB培養基上的集落形成單位(CFU)。檢測限制:PP、MLN、脾<100CFU;肝<50CFU。
圖2.沙門氏菌屬dam雙突變疫苗候選物的同源菌株效力評估。用鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物(dam aroA[MT3138],dam htrA[MT3142],dam mgtC[MT3146],dam sifA[MT3150],dam spiC[MT3154],dam spvB[MT3158],dam ssaV[MT3162])或親本UK-1 damΔ232疫苗株(MT3134)(109CFU)口服免疫BALB/c小鼠。免疫後11周,用200LD50口服劑量的同源菌株、野生型鼠傷寒沙門氏菌UK-1(χ3761)激發接種的小鼠。未免疫的對照小鼠在感染後第21天全部死亡。毒力激發存活的小鼠比例的差異使用邏輯回歸分析(Genstat第15版[34])。接種提供顯著的保護(P<0.01)。相比親本dam疫苗,通過將併入次級缺失mgtC、sifA和spvB的dam疫苗提供了相似的保護。引入次級缺失aroA、htrA、spiC和ssaV後觀察到dam疫苗效力的顯著減少(**P<0.01;***P<0.001)。
圖3.沙門氏菌屬dam雙突變疫苗候選物的異源交叉保護效力評估。用鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物(dam mgtC[MT3146],dam sifA[MT3150],dam spvB[MT3158];109CFU)口服免疫BALB/c小鼠(16-25隻每窩)。免疫後11周,用100LD50口服劑量的與畜牧業臨床相關的異源沙門氏菌屬血清型(都柏林沙門氏菌8895[牛]、病牛沙門氏菌225[羊]、鼠傷寒沙門氏菌131[羊])激發接種的小鼠。未免疫的對照小鼠在感染後第21天全部死亡。毒力激發存活的小鼠比例的差異使用邏輯回歸分析(Genstat第15版[34])。用併入了次級缺失mgtC、sifA和spvB的每種dam疫苗的接種提供了針對所評估的同源和異源激發株的顯著保護(***P<0.001)。
圖4.沙門氏菌屬dam雙突變疫苗候選物中疫苗安全性評估(回復至2-AP抗性)。用105CFU的鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物(dam mgtC[MT3146],dam sifA[MT3150],dam spvB[MT3158])或dam UK-1親本疫苗株[MT3134]腹膜內感染BALB/c小鼠。在感染後第5天計數了脾(A)或肝(B)中2-AP敏感(開放框)或2-AP抗性(封閉框)沙門氏菌屬生物的數目。0CFU值表示其中脾和肝中的細菌載荷低於檢測限(<25CFU)的小鼠數目。鼠傷寒沙門氏菌UK-1 dam雙突變疫苗的持續性(2-APs)和回復至提高毒力(2-APr)相比親本沙門氏菌屬damΔ232疫苗株的統計學顯著性使用方差分析確定(*P<0.05)。
圖5.沙門氏菌屬dam雙突變疫苗候選物的疫苗糞便脫落評估。
將鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物dam mgtC(MT3183)、dam sifA(MT3184)、dam spvB(MT3186)和dam UK-1親本株(MT3180)的卡那黴素抗性衍生物用於通過口服途徑接種BALB/c小鼠(109CFU)。在免疫後第2、4、7、11、14和21天從個體小鼠收集糞便並鋪板用於在卡那黴素50μg/ml LB平板上的CFU/g。使用REML重複測量分析對沙門氏菌屬dam雙缺失疫苗候選物對親本沙門氏菌屬damΔ232疫苗株的糞便脫落進行了分析。免疫後疫苗和時間都是顯著的(*P<0.05)。不同雙缺失dam疫苗之間未觀察到糞便脫落的顯著差異。給出的值是接種後小鼠糞便中CFU/g的模型預測平均數。檢測的極限是60CFU。
圖6.使用沙門氏菌屬dam雙突變疫苗候選物免疫的小鼠中激發株的糞便脫落。將鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物dam mgtC(MT3183)、dam sifA(MT3184)、dam spvB(MT3186)和dam UK-1親本株(MT3180)的卡那黴素抗性衍生物用於通過口服途徑免疫BALB/c小鼠(109CFU)。免疫後四周實現疫苗菌株糞便清除。免疫後11周,使用100LD50劑量的野生型鼠傷寒沙門氏菌UK-1(MT2315;107CFU)的卡那黴素抗性衍生物激發接種的小鼠。在免疫後第2、4、7、11、14和21天從個體小鼠收集糞便並鋪板用於在卡那黴素50μg/ml LB平板上的CFU/g。使用REML重複測量分析對激發免疫小鼠後野生型激發株的糞便脫落進行了分析。免疫後疫苗和時間都是顯著的(*P<0.05)且存在時間和疫苗之間顯著相互作用的趨勢(P=0.075)。逐對比較揭示了毒力激發後在不同時間組間的顯著差異;a=雙缺失疫苗的脫落顯著小於親本dam疫苗的脫落;b=dam sifA和dam spvB疫苗的脫落小於親本dam疫苗的脫落且dam sifA脫落顯著少於dam mgtC和dam spvB疫苗的脫落;c=dam sifA和dam spvB疫苗的脫落顯著少於dam mgtC和dam spvB疫苗的脫落且dam spvB疫苗的脫落顯著少於dam mgtC疫苗的脫落;d=dam sifA、dam spvB和dam mgtC疫苗的脫落顯著少於dam spvB疫苗的脫落。給出的值是激發後糞便中野生型激發株的模型預測的平均CFU。檢測限是60CFU。
圖7.沙門氏菌屬dam雙突變疫苗候選物的環境疫苗持續性(去離子水)評估。
將鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物dam mgtC(MT3183)、dam sifA(MT3184)、dam spvB(MT3186)和dam UK-1親本株(MT3180)的卡那黴素抗性衍生物用於接種20ml的去離子水(104CFU/ml)。在具有松頂帽的50ml錐形管中在室溫實施一式三份測定。將樣品渦旋並在兩周期間在所示時間點鋪板用於CFU/ml。給出的值是具有誤差棒的平均CFU/ml,指示±平均值的標準誤(SEM)。使用REML重複測量分析對隨時間水中存在的CFU/ml數目進行了分析。觀察到疫苗組和時間之間顯著的相互作用(P<0.001)。逐對比較揭示了在不同時間組之間的顯著差異(P<0.05)。a=全部疫苗具有比親本UK-1野生型株低的CFU/ml;b=damΔ232株的CFU/ml顯著少於dam mgtC、dam sifA和dam spvB株的CFU/ml;c=damΔ232和dam spvB株的CFU/ml顯著少於dam sifA和dam mgtC株。
圖8.沙門氏菌屬dam雙突變疫苗候選物的環境疫苗持續性(綿羊糞便)評估。通過添加20ml的去離子水至5g幹綿羊糞便(來自Barbara Byrne,University of California,Davis的禮物;[32,33])生成20%的糞便乾物質。使用鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物dam mgtC(MT3183)、dam sifA(MT3184)、dam spvB(MT3186)或dam UK-1親本株(MT3180)的卡那黴素抗性衍生物接種20%糞便乾物質(104CFU/ml)。在具有松頂帽的50ml錐形管中在室溫實施一式三份測定。渦旋樣品並在兩周期間在所示時間點鋪板用於CFU/ml。給出的值是具有誤差棒的平均CFU/ml,表明±平均值的標準誤(SEM)。使用REML重複測量分析對隨時間糞便中存在的CFU/ml數目進行了分析。觀察到疫苗組和時間之間顯著的相互作用(P<0.001)。逐對比較揭示了在不同時間組之間的顯著差異(P<0.05)。除第1天和第6天在全部時間點全部疫苗株的CFU/ml小於親本UK-1野生型。a=dam sifA顯著少於dam、dam mgtC和dam spvB;b=dam sifA顯著少於dam和dam mgtC;c=dam sifA顯著少於dam mgtC;d=dam spvB顯著少於dam mgtC;e=dam spvB顯著少於dam;f=dam mgtC顯著少於dam。
實施方案的詳述
如上文所述,腸細菌疾病例如胃腸炎和以腹瀉、發熱和脫水為特徵的其它病況仍為畜牧生產中的主要問題。沙門氏菌屬感染和沙門氏菌病為核心問題。至今,牲畜動物中預防或治療這些病況的所有嘗試僅獲得了有限的成功,這是由於疫苗的所包含的/受損的或有限的效價或包含的/受損的安全性概貌。特別引起關注的是從動物脫落並保持在環境中的疫苗。
激發已提供足夠穩固的減毒細菌以便能夠在牲畜動物中保持,由此提供免疫性,並在糞便和更一般的環境(如飼養場或畜牧生產鏈的其他部分)中具有有限的脫落和持續的潛力。提供雙突變以預防回復至病原性表型的需要是額外的複雜性水平,特別是在已知非常大量的用於失活的候選基因的情況下。
本發明的發明人有興趣提供作為活免疫原有用的具有改進的安全性概貌或表型的腸細菌(例如在減毒活疫苗中),只要其具有更少回復至致病性表型的可能性、更少脫落的可能性和更少在環境中保持的可能性。從廣泛的潛在候選基因座列表中,本發明的發明人已鑑定了3個基因座,其可用於在dam失活菌株中引入功能缺失突變以提供具有合意的安全性概貌的減毒微生物,同時保持治療或保護免於寬範圍的腸細菌且特別是廣泛的沙門氏菌屬的效力。
A.定義
『功能缺失突變』一般指完全或部分失活基因在給定生物過程中的相關功能的基因突變。感興趣的具體功能缺失突變是中斷宿主中腸細菌生命周期,同時不中斷細菌的免疫原性概貌的那些。
『腸細菌』一般指腸或腸道的細菌。特別感興趣的是『腸桿菌科(Enterobacteriaceae)』,其為包括病原體如沙門氏菌屬(Salmonella)、大腸桿菌(Escherichia coli),鼠疫耶爾森氏菌(Yersinia pestis),克雷伯氏菌屬(Klebsiella)和志賀氏菌屬(Shigella)的革蘭氏陰性腸細菌的大家族。此家族中其他導致疾病的細菌包括變形菌屬(Proteus)、腸桿菌屬(Enterobacter)、沙雷氏菌屬(Serratia)和檸檬酸桿菌屬(Citrobacter)。
『沙門氏菌屬』是腸桿菌科的腸細菌。
『dam』指編碼DNA腺嘌呤甲基化酶的基因,也稱為脫氧腺苷甲基化酶,DNA腺嘌呤甲基轉移酶或脫氧腺苷甲基轉移酶。鼠傷寒沙門氏菌dam基因登錄號的實例為NCBI登錄號:1255007。該基因的基因座標籤是STM3484。
『sifA』指編碼分泌的效應蛋白SifA的基因。鼠傷寒沙門氏菌sifA基因的登錄號的實例為NCBI登錄號1252742。該基因的基因座標籤是STM 1224。
『spvB』指編碼沙門氏菌屬質粒毒力蛋白B(SpvB)的基因。鼠傷寒沙門氏菌spvB基因登錄號的實例為NCBI登錄號1256199。該基因的基因座標籤為PSLT039。
『mgtC』指編碼Mg(2+)轉運ATP酶蛋白C,MgtC的基因。鼠傷寒沙門氏菌mgtC基因登錄號的實例為NCBI登錄號1255288。該基因的基因座標籤為STM3764。
『減毒的』例如在『減毒細菌』中一般指減少細菌毒力但仍使其保持活力(或"活著")使得其能夠複製的細菌的修飾(儘管以較慢的速率或在不同的條件下)。減毒需要感染劑並將其改變使得其變為無害或較少毒力。通常,減毒基本上不減少相關細菌的免疫原性。
『疫苗』一般指包含免疫原(即能夠引起免疫響應的物質)的組合物。通常疫苗暴露至病原體時可用於免疫、預防或提供保護免於感染或表現相關症狀,特別是其中暴露為激發形式的情況中。疫苗可用於預防或治療病況。疫苗可用於最小化以病原體感染的可能性。
『細菌腸疾病或病況』一般指由以腸細菌感染個體產生的病況。這樣的病況可包括下述症狀:胃炎、脫水、腹瀉、發熱。沙門氏菌病是細菌腸疾病或病況的一個實例。
如本文使用的『免疫』一般指通過其受試者的免疫系統針對免疫原被強化的過程。本發明減毒的沙門氏菌屬微生物可用於免疫受試者抵抗沙門氏菌屬並由此預防其他以更具毒力的沙門氏菌屬血清型的感染。
如本文使用的『基因』指編碼序列和其調節序列如啟動子和終止信號。
『包含(comprise)』和該術語的變型如『包含(comprising)』、『包含(comprises)』和『包含(comprised)』並非意在排除其他添加劑、組分、整數或步驟。
本發明的發明人已發現沙門氏菌屬基因中功能缺失突變的特定組合在沙門氏菌屬的活的減毒株的產生中提供特別的優勢,其作為活疫苗可用於賦予對於以沙門氏菌屬的毒力或致病性血清型的感染的免疫力。
具體而言,本發明的發明人已發現在還具有dam基因中的功能缺失突變的沙門氏菌屬菌株中的sifA、spvB或mgtC基因中引入突變導致可安全施用至受試者的微生物的生成,其在環境中安全並維持賦予對沙門氏菌屬的異源致病性血清型的保護的能力。
本發明因此提供活的減毒沙門氏菌屬微生物,其中所述微生物在dam基因中包含功能缺失突變和在選自下組的基因中的至少一個其他功能缺失突變:sifA、spvB和mgtC。
在特別優選的實施方案中,根據本發明的微生物具有dam中的功能缺失突變和sifA中的另一功能缺失突變。在該實施方案中,微生物或腸細菌可不具有spvB或mgtC中的功能缺失突變。
本發明的減毒沙門氏菌屬微生物可通過已知技術製備,例如通過缺失誘變、插入失活或靶基因中一個或多個核苷酸的取代。本領域的技術人員會理解的是假如天然基因產物的表達以某些方式被破壞,則靶基因不必需是突變的。例如,突變可在靶基因上遊進行,例如在啟動子或調節區中。
在一個實施方案中,工程化入dam、sifA、mgtC和spvB基因中的功能缺失突變是框內缺失。使用框內缺失以維持下遊基因的轉錄。
其他合適的技術包括自殺載體的使用,其包含突變的基因和選擇性標記。將自殺載體通過偶聯引入攜帶野生型基因序列(儘管如本領域的技術人員所理解,在可選的基因座可包含一個或多個突變)的沙門氏菌屬微生物。用突變的基因經由同源重組替換野生型基因,並使用選擇性標記鑑定突變的微生物。其他合適的技術描述於例如WO 1996/17951中。
本領域的技術人員還會容易地確定引入的突變是否已導致功能缺失或基因功能是否受損。例如,mgtC基因對於具有低鎂濃度的環境中的沙門氏菌屬的存活是必須的。
引入dam基因和sifA、spvB或mgtC基因任一者中的功能缺失突變可有效產生微生物的減毒。
優選地,微生物是腸細菌,且特別是致病性腸細菌,如腸桿菌科的成員。
最優選地,微生物是沙門氏菌屬。本領域的技術人員會理解的是,通常為毒力或致病性的任何數目的沙門氏菌屬血清型可使用上述技術處理以生成活的減毒株。例如,沙門氏菌屬微生物可來自多種腸沙門氏菌腸亞種血清型,包括但不限於血清型鼠傷寒沙門氏菌(S.Typhimurium)、腸炎沙門氏菌(S.Enteritidis)、都柏林沙門氏菌(S.Dublin)、紐波特沙門氏菌(S.Newport)、豬霍亂沙門氏菌(S.Choleraesuis)或病牛沙門氏菌(S.Bovismorbificans)。在一個特別優選的實施方案中,將功能缺失突變引入鼠傷寒沙門氏菌微生物。
在另一優選的實施方案中,減毒的活微生物是在dam和sifA基因中都具有功能缺失突變的鼠傷寒沙門氏菌。
本發明的發明人已發現本發明的微生物特別適於用作用於免疫受試者抵抗沙門氏菌屬的毒力血清型並最小化以毒力血清型感染的可能性的疫苗。具體而言,本發明的發明人已發現相比在其他基因組合中具有功能缺失突變的沙門氏菌屬,在dam基因中以及在sifA、spvB或mgtC基因的任一者中具有突變的沙門氏菌屬在要免疫的受試者中和在環境中呈現改進的疫苗安全性。
因此,另一方面,本發明提供用於在受試者中誘導對腸細菌(優選致病性細菌如沙門氏菌屬)的免疫響應的疫苗組合物。疫苗組合物包含足以在受試者中引起免疫響應的量的活的減毒沙門氏菌屬微生物和適當的載劑或稀釋劑,其中所述活的減毒微生物包含在dam基因中的功能缺失突變和在選自下組的基因中的至少一個其他功能缺失突變:sifA、spvB和mgtC。
在一個特別優選的實施方案中,疫苗組合物包含一定量的活的減毒沙門氏菌屬,其在dam和sifA基因中都包含功能缺失突變。
為配製疫苗組合物,減毒的微生物可在組合物中與任何適當的賦形劑一起存在。例如,組合物可包含任何適當的佐劑。此外,組合物可適應多種施用方式。優選的施用途徑包括口服、黏膜(例如鼻)或全身途徑(例如胃腸外注射)且所述疫苗為活的減毒沙門氏菌屬微生物。在一個特定的實施方案中,可提供疫苗組合物用於包含在將被遞送於受試者的飲用水或食物或飼養場中。
存在於疫苗組合物中的減毒微生物的數目可取決於疫苗組合物的預期施用途徑和最終其將被遞送的受試者由本領域的技術人員容易地確定。
在疫苗組合物中採用的特別合適的載劑或稀釋劑對本發明並非是關鍵的且為本領域常規的那些。稀釋劑的實例包括:用於緩衝抵抗胃中的胃酸的緩衝液,如包含蔗糖的檸檬酸鹽緩衝液(pH 7.0)、僅有碳酸氫鹽的緩衝液(pH 7.0)或包含抗壞血酸、乳糖和任選的阿斯巴甜的碳酸氫鹽緩衝液(pH 7.0)。載劑的實例包括:蛋白,例如,如在脫脂乳中發現的;糖,例如蔗糖;或聚乙烯吡咯烷酮。
本發明的發明人已發現將本發明減毒微生物或包含該微生物的疫苗組合物施用至受試者賦予受試者對於以野生型或致病性血清型後續感染的抗性。
因此,另一方面,本發明提供預防以沙門氏菌屬的毒力株感染的方法,所述方法包括:
-向對其有需要的受試者施用:
-一定量的活的減毒沙門氏菌屬微生物,其中所述微生物包含dam基因中的功能缺失突變和選自下組的基因中的至少一個其他功能缺失突變:sifA、spvB和mgtC,或
-疫苗組合物,其包含活的減毒沙門氏菌屬微生物和合適的載劑或稀釋劑,其中所述活的減毒微生物包含dam基因中的功能缺失突變和選自下組的基因中的至少一個其他功能缺失突變:sifA、spvB和mgtC。
-其中施用的微生物或疫苗的量足以在受試者中引起免疫響應。
可以理解的是在以沙門氏菌屬的毒力株感染的預防中,本發明還提供免疫受試者抵抗沙門氏菌屬的毒力血清型的感染的方法。
本發明的減毒微生物和包含該微生物的疫苗組合物適於免疫受試者抵抗通常導致沙門氏菌病的沙門氏菌屬的毒力和致病性血清型的感染。本發明的減毒微生物和包含所述微生物的疫苗組合物特別適於免疫任何對沙門氏菌屬微生物感染易感的動物。例如,在一些實施方案中,可被免疫的受試者可為人。可替換地,待免疫的受試者可為獸醫種類和牲畜。依據本發明的待免疫的受試者的實例包括豬、綿羊、小牛、牛、鹿、山羊、駱駝、馬、雞、火雞、鴨、鵪鶉等。
減毒的沙門氏菌屬微生物或疫苗的量或數目可由本領域的技術人員容易地確定。一般而言,施用約102cfu至約1010cfu,優選約105至約1010cfu的微生物。免疫劑量根據施用途徑變化。本領域的技術人員將理解的是胃腸外施用的疫苗的有效劑量(例如通過靜脈內、腹膜內或皮下注射)可能小於口服施用(例如在飲用水中或在食物中)的相似疫苗。
如本文使用的『免疫的量』意為能夠在接受減毒微生物或包含所述微生物的疫苗的受試者中誘導保護性免疫響應的量。免疫響應可為體液的、黏膜的、局部的和/或細胞的免疫響應。此外,如本領域的技術人員會理解的,所需減毒微生物或疫苗的量還會取決於與待免疫的受試者相關的年齡、體重和其他因素。
本領域的技術人員會理解的是為產生足夠數目的本文所述的活減毒微生物,在適當的環境中培養所述微生物可為必需的。例如,取決於微生物的意欲施用途徑,在需氧或厭氧條件下培養所述微生物可為必需的。本領域的技術人員將容易地能夠確定相關的培養條件。此外,一旦培養物中已產生足夠數目的微生物(例如,一旦微生物已達到對數期生長),理想的是純化培養物以去除並非意欲包含於微生物下遊使用的生長培養基的任何元素。
因此,在一個實施方案中,本發明提供如上文所述的活的減毒沙門氏菌屬微生物的純化的培養物。
可純化包含活的減毒沙門氏菌屬微生物的培養物從而其可在下遊應用中使用,包括用作疫苗或用於製造疫苗組合物以在受試者中誘導對沙門氏菌屬微生物的免疫響應。
可以理解的是取決於培養物的意欲下遊應用,可冷凍乾燥、冷凍或重構純化的培養物。
之前段落中所述的本發明的另外的方面和所述方面的另外的實施方案將從通過實施例方式給出的下述說明並參照附圖而變得顯而易見。
可理解的是,在本說明書中公開和定義的本發明延伸到從文本或附圖提及或顯而易見的兩個或多個單獨特徵的所有可替換的組合。所有這些不同的組合構成本發明多種可替換的方面。此說明書中引用的全部的專利、專利申請和出版物通過提述以其整體併入本文,其程度如同具體而單獨地指示各獨立的專利申請或出版物以通過提述併入。
實施例
1.材料和方法
1.1.細菌菌株和生長條件
沙門氏菌屬動物分離株源自不同疫情、個體病例或至診斷實驗室的監督提交[31]。毒力鼠傷寒沙門氏菌UK-1在全部用於比較的研究中使用[17]。除非另外詳明,細菌源自含有Luria-Bertani(LB)培養基的37℃通氣的固定相(stationary phase)培養物[18]。以下述濃度使用抗生素:卡那黴素(Kn),50μg/ml,氨苄青黴素(Ap),50μg/ml。
1.2.包含額外減毒突變的鼠傷寒沙門氏菌dam疫苗候選物的構建
使用標準遺傳方案[20]通過引入定義的dam序列的框內300bp缺失(稱為damΔ232[19])構建了鼠傷寒沙門氏菌UK-1Δdam。獲得的鼠傷寒沙門氏菌UK-1 damΔ232株(MT3134)顯示對嘌呤類似物2-氨基嘌呤(2-AP)敏感,其對於缺少非功能性DNA腺嘌呤甲基化酶的菌株是毒性的[21,22],且對於全部研究將其用作親本沙門氏菌屬dam疫苗株。如所述[20]利用自殺載體pCVD442將次級毒力減毒缺失突變引入親本鼠傷寒沙門氏菌UK-1 damΔ232株,在下述靶向基因中獲得定義編碼序列的框內缺失的構建:dam aroA(MT3138;1056bp缺失);dam htrA(MT3142;1341bp缺失);dam mgtC(MT3146;606bp缺失);dam sifA(MT3150;807bp缺失);dam spiC(MT3154;306bp缺失);dam spvB(MT3158;1563bp缺失);和dam ssaV(MT3162;1959bp缺失)。所得的基因構建體使用缺失序列側翼的引物通過PCR確認。
1.3.毒力和保護測定
口服和腹膜內致死劑量50(LD50):殺死50%的感染動物所需的劑量經由口服(經由胃插管)和腹膜內(i.p.)途徑通過感染至少10隻小鼠確定[30,19]。沙門氏菌屬測試株和野生型鼠傷寒沙門氏菌參照株14028在LB培養基中生長過夜。將在0.2ml的0.2M Na2HPO4pH 8.1或0.1ml的0.15M NaCl(分別用於口服和腹膜內施用)中重懸的細菌細胞用於感染小鼠,每日檢查其發病率和死亡率直至感染後3周。鼠傷寒沙門氏菌UK-1的口服和腹膜內LD50分別為105和<10生物體[30]。將6-8周齡的BALB/c小鼠用於全部毒力研究。保護測定法.使用鼠傷寒沙門氏菌dam疫苗株以109CFU的劑量口服免疫小鼠[30,19]。為避免歸因於疫苗株在宿主組織中持續性的瞬時非特異性交叉保護免疫響應[23-25],直至疫苗株從免疫動物的黏膜(派爾集合淋巴結;腸繫膜淋巴結)和全身組織(肝;脾)清除後4-5周,不使用毒力沙門氏菌屬激發免疫小鼠。免疫後11周,用相當於100-至200-倍LD50的感染劑量的毒力腸沙門氏菌血清型口服激發小鼠。激發後每日檢查小鼠的發病率和死亡率直至激發後3周。
1.4.構建沙門氏菌屬疫苗候選物的抗生素抗性衍生物以評估疫苗和激發株糞便脫落,和在去離子水和綿羊糞便內的持續性
構建鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物的卡那黴素抗性(Knr)衍生物以評估疫苗糞便脫落。鼠傷寒沙門氏菌株MT2057是野生型參照株14028的Knr衍生物,其包含用於將其與其他作為固有地Lac-的沙門氏菌屬辨別的編碼Knr的Lac+MudJ轉錄融合[19,26]。將生長在供體株MT2057上的噬菌體P22用於將受體沙門氏菌屬dam疫苗候選物轉導為卡那黴素抗性[18],生成Knr鼠傷寒沙門氏菌UK-1 dam Δ232雙突變疫苗候選物dam mgtC(MT3183)、dam sifA(MT3184)、dam spvB(MT3186)和dam UK-1親本株(MT3180)。疫苗株脫落.用Knr鼠傷寒沙門氏菌UK-1 dam雙突變疫苗候選物通過口服途徑接種BALB/c小鼠(109CFU)。在免疫後第2、4、7、11、14和21天從個體小鼠收集糞便並鋪板用於在卡那黴素50μg/ml LB平板上的CFU/g。激發株脫落.用Knr鼠傷寒沙門氏菌UK-1 dam雙突變疫苗候選物通過口服途徑接種BALB/c小鼠(109CFU)。疫苗株糞便清除發生在免疫後4周。免疫後11周,用100LD50劑量的鼠傷寒沙門氏菌UK-1的Knr衍生物(MT2315;107CFU)激發接種的小鼠。在免疫後第2、4、7、11、14和21天從個體小鼠收集糞便並鋪板用於在卡那黴素50μg/ml LB平板上的CFU/g。去離子水和綿羊糞便內的持續性.通過將20ml的去離子水添加至5g乾燥的綿羊糞便(來自Barbara Byrne,University of California,Davis的禮物;[27,28])製備20%的糞便乾物質。使用鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物的Knr衍生物dam mgtC(MT3183)、dam sifA(MT3184)、dam spvB(MT3186)或dam UK-1親本株(MT3180)接種去離子水(20ml)和20%綿羊糞便(2x105CFU)。在具有松頂帽的50ml錐形管中在室溫實施一式三份測定。將樣品渦旋並在兩周期間鋪板用於CFU。
1.5統計學分析
使用殘留(或受限)的最大似然(REML)分析對連續重複的測量數據進行了分析(Genstat,第15th版,VSN International,UK,[34])。對於因素時間和用於可變的CFU的治療擬合單變量、重複測量模型。將Wald卡方檢驗用於確定顯著的個體效果和或因素之間顯著的相互作用。從模型中刪除任何非顯著項並重複分析。如下分析數據作為基於預測模型的平均值表示。預測的平均值是從擬合模型而非原始樣品平均值獲得的那些。這是重要的,因為預測的平均值代表調整至通用變量集合(a common set of variables)的平均值,因此可允許平均值間有效的比較。將小於0.05的P值認為是統計學上顯著的。使用方差分析(ANOVA,Genstat,第15版,VSN International,UK)對屍檢時組織中存在的CFU的數目進行了分析。使用REML和ANOVA計算的個體平均值間的差異通過計算近似最小顯著差異(LSD)確定。超過計算的LSD的平均值差異認為是顯著的。
使用邏輯回歸模型(Genstat,第15版,VSN International,UK,[34])分析了二項式數據(脫落[是/否]和結果[活/死])。將疫苗擬合至模型。使用Wald統計評估了整體顯著性(P<0.05)。根據相對於參照組的t參數估計評估了固定效果(疫苗)的顯著性。小於0.05的p值認為是統計學上顯著的。
1.6.倫理聲明
全部動物實驗依照國立健康研究院對於實驗室動物的飼養和護理指南實施,並在加州大學聖巴巴拉分校機構動物護理和使用委員會相關審查和批准後依照機構規章實施。
2.結果
2.1.包含次級毒力減毒突變的沙門氏菌屬dam疫苗候選物的構建
修飾的活疫苗的商業成功取決於治療指數、安全性/效力的比,且因此將次級毒力減毒突變引入腸沙門氏菌鼠傷寒血清型dam疫苗以改進疫苗安全性。構建了親本菌株UK-1的抗生素敏感的dam-缺失衍生物以消除抗生素抗性向其他微生物菌株的潛在傳播(材料和方法)。將所得的鼠傷寒沙門氏菌UK-1 damΔ232(MT3134)用作全部研究的親本疫苗背景。隨後將次級毒力減毒突變引入鼠傷寒沙門氏菌UK-1 damΔ232以改進疫苗安全性(材料和方法)。這些突變靶向參與細胞內和/或系統性存活的基因,包括aroA(胺基酸生物合成);htrA(應激響應);mgtC(鎂運輸);sifA、spiC、ssaV(沙門氏菌屬致病性島-2(SPI-2);和spvB(細胞毒素產生)。隨後評估了所得的沙門氏菌屬dam雙突變疫苗候選物dam aroA、dam htrA、dam mgtC、dam sifA、dam spiC、dam spvB、dam ssaV相比親本沙門氏菌屬dam疫苗株改進的安全性/效力。
2.2.沙門氏菌屬dam雙突變疫苗候選物用於菌落化和在黏膜和全身組織中持續性的評估
將次級毒力減毒突變引入修飾的活疫苗的主要問題是由於作為加速的疫苗清除的結果的減少的抗原暴露所致的可能的效力損失。因此,檢查了鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物dam aroA、dam htrA、dam mgtC、dam sifA、dam spiC、dam spvB、dam ssaV中維持與在親本鼠傷寒沙門氏菌UK-1 damΔ232疫苗株中發現的那些相似的菌落化和持續性的那些。使用沙門氏菌dam雙突變疫苗候選物口服感染BALB/c小鼠(109CFU),並在感染後第2和4周在黏膜(派爾集合淋巴結;腸繫膜淋巴結)和全身組織(肝和脾)中評估了疫苗株的菌落化/持續性(圖1)。將沙門氏菌屬dam雙突變候選物分為兩組,I類:相對親本鼠傷寒沙門氏菌UK-1 damΔ232單突變疫苗株顯示相似的菌落化/持續性的那些(dam mgtC;dam sifA;dam spvB);和II類:相對由親本沙門氏菌屬dam疫苗所呈現的,呈現菌落化/持續性的那些(dam aroA、dam htrA、dam spiC、dam ssaV)。這些數據指示I類疫苗候選物疫苗在宿主組織中維持低級別的持續性,而II類疫苗顯示了在接種動物中的快速清除。
2.3.沙門氏菌屬dam雙突變疫苗候選物的效力評估
檢查了沙門氏菌屬dam雙突變疫苗候選物(I類和II類)以辨別低級別的持續性是否對賦予與由親本沙門氏菌屬dam疫苗引起的情況相似的保護性免疫響應是必須的。使用7種沙門氏菌屬dam雙突變疫苗候選物的每一種口服免疫BALB/c小鼠(109CFU)。為避免歸因於疫苗株在宿主組織中持續性的瞬時非特異性交叉保護的免疫響應[23-25],直至疫苗株從免疫動物的黏膜(派爾集合淋巴結;腸繫膜淋巴結)和全身組織(肝;脾)清除後4-5周,不用毒力沙門氏菌屬激發免疫小鼠。免疫後11周,用200-倍LD50感染劑量以毒力親本株鼠傷寒沙門氏菌UK-1口服激發小鼠。用全部(3種中的3種)I類疫苗候選物(dam mgtC、dam sifA、dam spvB)免疫的小鼠呈現了抵抗毒力同源激發的穩固保護,與由親本鼠傷寒沙門氏菌UK-1 damΔ232株呈現的情況相似(圖2)。反過來,呈現加速清除的II類疫苗候選物(dam aroA、dam htrA、dam spiC、dam ssaV)中相比親本鼠傷寒沙門氏菌UK-1 dam 23株無一(4種中的0種)賦予對毒力同源激發的顯著保護(**P<0.01,***P<0.001)。
評估了I類疫苗候選物引起對異源株交叉保護的能力,如已在沙門氏菌病的鼠類[2,9]、鳥類[10,11]、羊[12]和牛[13-15]模型中的沙門氏菌屬dam疫苗株所顯示的。用I類疫苗候選物(dam mgtC、dam sifA或dam spvB;109CFU)口服免疫BALB/c小鼠。免疫後11周,用分別包含血清組C2-C3、B和D、源自綿羊(病牛沙門氏菌174,鼠傷寒沙門氏菌131)和牛(都柏林沙門氏菌8895)的畜牧業相關致病性沙門氏菌屬菌株激發小鼠。全部3種I類疫苗候選物賦予對測試的三種異源毒力株的穩固的交叉保護(圖3;***P<0.001),與先前用鼠傷寒沙門氏菌14028damΔ232疫苗株接種的小鼠中針對這3種異源激發株呈現的交叉保護水平相似[2]。這些數據與宿主組織中I類疫苗(dam mgtC、dam sifA和dam spvB)低級別的持續性可隨時間提供穩定的抗原來源(需要其以轉變為形成強適應性免疫響應)[2,9,19]的假設一致。
2.4.經由回復至2-AP抗性的評估的疫苗安全性評價
對於全部修飾的活疫苗,關注的是回復至提高的毒力。經由甲基定向錯配修復基因中突變的獲得,腹膜內(但非口服)感染後沙門氏菌屬dam突變疫苗具有經歷回復至更具毒力狀態的能力[29]。這種回復可使用嘌呤類似物2-氨基嘌呤(2-AP)評價,其對缺乏Dam功能的細菌是毒性的[21]。也就是說,可評估親本dam株(2-APS)在全身組織中至2-APr的回覆(作為提高的毒力的潛在指標)[29]。用沙門氏菌屬dam雙突變疫苗候選物dam mgtC、dam sifA、dam spvB或親本鼠傷寒沙門氏菌UK-1 damΔ232株(103CFU)腹膜內(i.p.)感染BALB/c小鼠。感染後5天,評估從肝和脾回收的細菌的2-APs(持續性)和至2-APr表型的回覆(圖4)。全部3種疫苗候選物(dam mgtC、dam sifA、dam spvB)顯示了相對親本鼠傷寒沙門氏菌UK-1 damΔ232株的情況相對在脾/肝中顯著減少的菌落化/持續性(2-APs)和減少的至2-AP抗性的回覆(*P<0.05)。
沙門氏菌屬dam雙突變疫苗候選物的2-Apr衍生物和從感染的小鼠的脾分離的親本dam UK-1疫苗經由口服和腹膜內致死劑量(LD50)毒力測定法進行了評價。野生型UK-1的口服和腹膜內LD50分別為105和<10CFU。源自全部沙門氏菌屬dam雙突變疫苗候選物的全部2-APr分離株(11種中的11種)或親本沙門氏菌屬dam疫苗(5種中的5種)的口服LD50通過口服施用為無毒的(表2)。相反,源自沙門氏菌屬dam雙突變疫苗候選物的全部2-APr分離株(11種中的11種)經由腹膜內感染高度減毒,而源自親本dam疫苗的那些(5種中的5種)與回復至更具毒力的狀態相關,如先前所證明的[29]。這些數據指示沙門氏菌屬dam mgtC、dam sifA和dam spvB疫苗株呈現了顯著改進的疫苗安全性,如通過在感染過程中不能產生毒力回復體所證實,與沙門氏菌屬dam疫苗相反。
2.5.沙門氏菌屬dam雙突變疫苗株的疫苗和激發株脫落評價
對於疫苗的安全性,在接種的動物中減少的疫苗和激發株脫落是合意的性狀。構建了鼠傷寒沙門氏菌UK-1 damΔ232雙突變疫苗候選物的卡那黴素抗性衍生物以評估在免疫動物的糞便中疫苗株和激發株脫落。用沙門氏菌屬dam雙突變疫苗候選物(dam mgtC[MT3183];dam sifA[MT3184];dam spvB[MT3186])或dam UK-1親本株(MT3180)通過口服途徑免疫BALB/c小鼠(109CFU)。疫苗株脫落.在感染後第2、4、7、11、14和21天獲得糞便顆粒並評估Knr細菌。全部的沙門氏菌屬dam雙缺失疫苗候選物相比親本鼠傷寒沙門氏菌UK-1 damΔ232株的情況呈現顯著減少的疫苗株糞便脫落(圖5;P<0.05)。激發株脫落.免疫後11周,用100LD50劑量的鼠傷寒沙門氏菌UK-1(MT2315;107CFU)的Knr衍生物激發接種的小鼠。在感染後第2、4、7、11、14和21天獲得糞便顆粒並評估Knr細菌。在3周期間,相對親本鼠傷寒沙門氏菌UK-1 damΔ232疫苗,沙門氏菌屬dam mgtC、dam sifA和dam spvB株呈現了激發株脫落中的顯著減少,其中dam sifA和dam spvB株從第4天至第21天顯示減少的脫落(圖6;P<0.05)。這些數據指示相對親本沙門氏菌屬dam疫苗,用沙門氏菌屬dam雙突變疫苗的接種導致較少的疫苗糞便脫落,且雙缺失接種在毒力激發後提供比dam親本疫苗更穩固的野生型沙門氏菌屬脫落的減毒/弱化。
2.6.沙門氏菌dam雙突變疫苗株的環境持續性(去離子水和綿羊糞便)評價
評價了沙門氏菌屬dam雙突變疫苗候選物在去離子水和在綿羊糞便中的環境持續性。去離子水.用沙門氏菌屬dam雙突變疫苗候選物(dam mgtC[MT3183];dam sifA[MT3184];dam spvB[MT3186])或dam UK-1親本株(MT3180)的Knr衍生物接種去離子水(104CFU/ml)(圖7)。在兩周期間將水樣品鋪板用於CFU/g。相比野生型UK-1株的情況,全部(3種中的3種)沙門氏菌屬dam雙突變疫苗候選物和親本dam株在去離子水中在兩周溫育期間顯示顯著減少的活力(圖7;P<0.05)。此外,水中低水平的疫苗持續性可與槽水疫苗施用兼容。綿羊糞便.用沙門氏菌屬dam雙突變疫苗候選物(dam mgtC[MT3183];dam sifA[MT3184];dam spvB[MT3186])或dam UK-1親本株(MT3180)的Knr衍生物接種20%乾物質綿羊糞便(104CFU/ml)。在兩周期間將糞便樣品鋪板用於CFU/g。相比野生型UK-1株的情況,全部(3種中的3種)沙門氏菌屬dam雙突變疫苗候選物在綿羊糞便中在兩周溫育期間顯示了顯著減少的活力(圖8;P<0.05)。此外,沙門氏菌屬dam sifA在綿羊糞便中顯示了相對其他3種疫苗株測試顯著更少的活力(P<0.05)。這些數據指示相比野生型UK-1株的情況,沙門氏菌屬疫苗候選物在去離子水和綿羊糞便中都顯示減少的環境持續性。
3.討論
雖然有良好的農業管理實踐,沙門氏菌病持續成為在集約化生產系統中利於糞-口傳播的重要問題。疾病主要由增加的病原暴露和疾病易感性導致。環境條件的波動導致環境病原體載荷的變化和隨後的宿主激發。與妊娠和分娩相關的生理變化增加對疾病的易感性,如新生兒的天然免疫狀態所表現。管理實踐還可對具有經歷農場庫存(運輸前的集群、堆場、食物和水剝奪)和運輸過程中(食物和水剝奪、環境應激)和在銷售場(共混、病原體暴露)的積累的應激因素的宿主免疫力產生負面影響。
針對沙門氏菌病的牲畜接種是預防疾病的可行方法,因為它在開始時防止食品和水供應的汙染,導致減少的病原體暴露、傳播、動物疾病和牲畜衍生食品的直接汙染和水果和蔬菜食品通過汙染的水的間接汙染。
理想情況下,應在原產地農場接種牲畜以在牲畜經歷與銷售、運輸和進入飼養場後的高風險期相關的應激因素和病原體暴露前引起免疫。因為疾病的成本不在原產地產生,挑戰是說服為飼養場提供庫存的生產者在銷售前接種動物,這導致在進入飼養場後緊接下來的高風險期進行牲畜免疫的目前實踐。
如果向商業部門提供可負擔和有效的產品,則疫苗可在整個動物生產工業廣泛應用,因為疫苗接種簡單,被生產者理解,並可能被採用,且因此可以在任何全面的食品安全計劃的成功中起關鍵作用。
作為解決這一問題的潛在手段,修飾的活沙門氏菌屬dam疫苗已顯示在免疫的儲備中是有效的和良好耐受的[10-15],並且可經由飲用水施用[12,16]。然而,活疫苗的主要問題是安全性、脫落和環境持續性。
本文中,將次級毒力減毒突變引入沙門氏菌屬dam株以篩選在動物和環境中安全的疫苗候選物,並保持賦予交叉保護效力的能力。鼠傷寒沙門氏菌dam sifA呈現了改進的疫苗安全性,減少的疫苗和激發株脫落、減少的環境持續性,並賦予了宿主組織中低級別的持續性,其足以賦予源自感染牲畜的異源致病性沙門氏菌屬血清型的交叉保護[31]。這些數據指示,沙門氏菌屬dam sifA對於商業應用呈現出有利的治療指數(安全性/效力),這支持了接種者和環境中改進的安全性,連同引起針對致病性血清型的交叉保護免疫的能力。
本文中,在接種的動物中和在模擬環境的條件中評價了疫苗的安全性。沙門氏菌屬dam mgtC、dam sifA和dam spvB疫苗株在宿主組織中維持低級別的持續性,其與針對源自感染牲畜的異源致病性血清型的交叉保護免疫力的維持相關。此外,沙門氏菌屬dam sifA疫苗呈現了改進的疫苗安全性(疫苗脫落;激發株脫落;在全身組織中的持續性;在環境中的持續性),同時維持了針對用同源和異源致病性血清型的毒力激發的穩固效力。因此,沙門氏菌屬dam sifA疫苗候選物呈現大大增加的安全性而無損交叉保護效力且可證明是牲畜口服給藥的安全、有效和低成本手段而無顯著的環境持續性。
表1.本研究中使用的細菌株
表2.體內選擇的dam雙突變沙門氏菌屬的2-APr衍生物經由腹膜內或口服感染途徑是無毒的
a獨立分離的、體內選擇的沙門氏菌屬dam突變疫苗株的2-氨基嘌呤抗性(2-APr)衍生物分離自感染的小鼠的脾,並評價了在未治療小鼠中口服和腹膜內(IP)的毒力[29]。這些菌株中的每一種的LD50測定與野生型(UK-1)的情況進行了比較。通過感染5隻小鼠每激發劑量確定了腹膜內LD50;通過感染10隻小鼠每激發劑量確定了經由胃插管的經口LD50。野生型UK-1的口服和腹膜內LD50分別為105和2周。
參考文獻
[1]Mahan MJ,Heithoff DM,House JK.Salmonella cross-protective vaccines:fast-forward to the next generation of food safety.Future Microbiol.2012;7:805-8.
[2]Heithoff DM,Enioutina EY,Bareyan D,Daynes RA,Mahan MJ.Conditions that diminish myeloid-derived suppressor cell activities stimulate cross-protective immunity.Infect Immun.2008;76:5191-9.
[3]Hegazy WAH,Hensel M.Salmonella enterica as a vaccine carrier.Future Microbiol.2012;7:111-27.
[4]Kong Q,Yang J,Liu Q,Alamuri P,Roland KL,Curtiss III R.Effect of deletion of genes involved in lipopolysaccharide core and O-antigen synthesis on virulence and immunogenicity of Salmonella enterica serovar Typhimurium.Infect Immun.2011;79:4227-39.
[5]Li Y,Wang S,Scarpellini G,Gunn B,Xin W,Wanda SY等Evaluation of new generation Salmonella enterica serovar Typhimurium vaccines with regulated delayed attenuation to induce immune responses against PspA.Proc Natl Acad Sci USA.2009;106:593-8.
[6]Nagy G,Palkovics T,Otto A,Kusch H,Kocsis B,Dobrindt U等"Gently rough":the vaccine potential of a Salmonella enterica regulatory lipopolysaccharide mutant.J Infect Dis.2008;198:1699-706.
[7]Curtiss R,Xin W,Yuhua L,Kong W,Wanda SY,Gunn B等New technologies in using recombinant attenuated Salmonella vaccine vectors.Crit Rev Immunol.2010;30:255-70.
[8]Singh B.Salmonella vaccines for animals and birds and their future perspective.Open Vaccine J.2009;2:100-12.
[9]Heithoff DM,Enioutina EY,Daynes RA,Sinsheimer RL,Low DA,Mahan MJ.Salmonella DNA adenine methylase mutants confer cross-protective immunity.Infect Immun.2001;69:6725-30.
[10]Dueger EL,House JK,Heithoff DM,Mahan MJ.Salmonella DNA adenine methylase mutants elicit protective immune responses to homologous and heterologous serovars in chickens.Infect Immun.2001;69:7950-4.
[11]Dueger EL,House JK,Heithoff DM,Mahan MJ.Salmonella DNA adenine methylase mutants prevent colonization of newly hatched chickens by homologous and heterologous serovars.Intl J Food Microbiol.2003a;80:153-9.
[12]Mohler VL,Heithoff DM,Mahan MJ,Walker KH,Hornitzky MA,Gabor L等Protective immunity conferred by a DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine when delivered in-water to sheep challenged with Salmonella enterica serovar Typhimurium.Vaccine.2011;29:3571-82.
[13]Dueger EL,House JK,Heithoff DM,Mahan MJ.Salmonella DNA adenine methylase mutants elicit early and late onset protective immune responses in calves.Vaccine.2003;21:3249-58.
[14]Mohler V,Heithoff D,Mahan M,Walker K,Hornitzky M,McConnell C等Cross-protective immunity in calves conferred by a DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine.Vaccine.2006;24:1339.
[15]Mohler V,Heithoff D,Mahan M,Walker K,Hornitzky M,Shum L等Cross-protective immunity conferred by a DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine in calves challenged with Salmonella serovar Newport.Vaccine.2008;26:1751-8.
[16]Mohler V,Heithoff D,Mahan M,Hornitzky M,Thomson P,House J.Development of a novel in-water vaccination protocol for DNA adenine methylase deficient Salmonella enterica serovar Typhimurium vaccine in adult sheep.Vaccine.2012;30:1481-91.
[17]Hassan JO,Curtiss R,3rd.Development and evaluation of an experimental vaccination program using a live avirulent Salmonella typhimurium strain to protect immunized chickens against challenge with homologous and heterologous Salmonella serotypes.Infect Immun.1994;62:5519-27.
[18]Davis RW,Botstein D,Roth JR.Advanced bacterial genetics.Plainview,N.Y.:Cold Spring Harbor Laboratory Press;1980.
[19]Heithoff DM,Sinsheimer RL,Low DA,Mahan MJ.An essential role for DNA adenine methylation in bacterial virulence[see comments].Science.1999;284:967-70.
[20]Donnenberg MS,Kaper JB.Construction of an eae deletion mutant of enteropathogenic Escherichia coli by using a positive-selection suicide vector.Infect Immun.1991;59:4310-7.
[21]Glickman B,van den Elsen P,Radman M.Induced mutagenesis in dam-mutants of Escherichia coli:a role for 6-methyladenine residues in mutation avoidance.Mol Gen Genet.1978;163:307-12.
[22]Julio S,Heithoff D,Provenzano D,Klose K,Sinsheimer R,Low D等DNA Adenine methylase is essential for viability and plays a role in the pathogenesis of Yersinia pseudotuberculosis and Vibrio cholerae.Infect Immun.2001;69:7610-5.
[23]Harrison JA,Villarreal-Ramos B,Mastroeni P,Demarco de Hormaeche R,Hormaeche CE.Correlates of protection induced by live Aro-Salmonella typhimurium vaccines in the murine typhoid model.Immunology.1997;90:618-25.
[24]Hormaeche CE,Joysey HS,Desilva L,Izhar M,Stocker BA.Immunity conferred by Aro-Salmonella live vaccines.Microb Pathog.1991;10:149-58.
[25]Hormaeche CE,Mastroeni P,Harrison JA,Demarco de Hormaeche R,Svenson S,Stocker BA.Protection against oral challenge three months after i.v.immunization of BALB/c mice with live Aro Salmonella typhimurium and Salmonella enteritidis vaccines is serotype(species)-dependent and only partially determined by the main LPS O antigen.Vaccine.1996;14:251-9.
[26]Conner CP,Heithoff DM,Julio SM,R.L.S,Mahan MJ.Differential patterns of acquired virulence genes distinguish Salmonella strains.Proc Natl Acad Sci U S A 1998.;95:4641-5.
[27]Griggs T.Determining forage dry matter concentration with a microwave oven AG/Forage&Pasture/2005-01.2005.
[28]Pitt R,Brusewitz G,Chase L,Collins M.Forage moisture determination.NRAES(59)(Cooperative Extension).1993.
[29]Heithoff D,Badie G,Julio S,Enioutina E,Daynes R,Sinsheimer R等In vivo-selected mutations in methyl-directed mismatch repair suppress the virulence attenuation of Salmonella dam mutant strains following intraperitoneal,but not oral,infection ofmice.J Bacteriol.2007;189:4708-17.
[30]Heithoff DM,Shimp WR,House JK,Xie Y,Weimer BC,Sinsheimer RL等Intraspecies variation in the emergence of hyperinfectious bacterial strains in nature.PLoS Pathogens.2012;8:e1002647.
[31]Heithoff DM,Shimp WR,Lau PW,Badie G,Enioutina EY,Daynes RA等Human Salmonella clinical isolates distinct from those of animal origin.Appl Environ Microbiol.2008;74:1757-66.
[32]Griggs T.Determining forage dry matter concentration with a microwave oven AG/Forage&Pasture/2005-01.2005.
[33]Pitt R,Brusewitz G,Chase L,Collins M.Forage moisture determination.NRAES(59)(Cooperative Extension).1993.
[34]International V.GenStat for Windows 15th Edition VSN International,Hemel Hempstead,UK.2012.
