苉衍生物、光電轉換材料及光電轉換元件的製作方法
2023-07-28 09:27:51 1
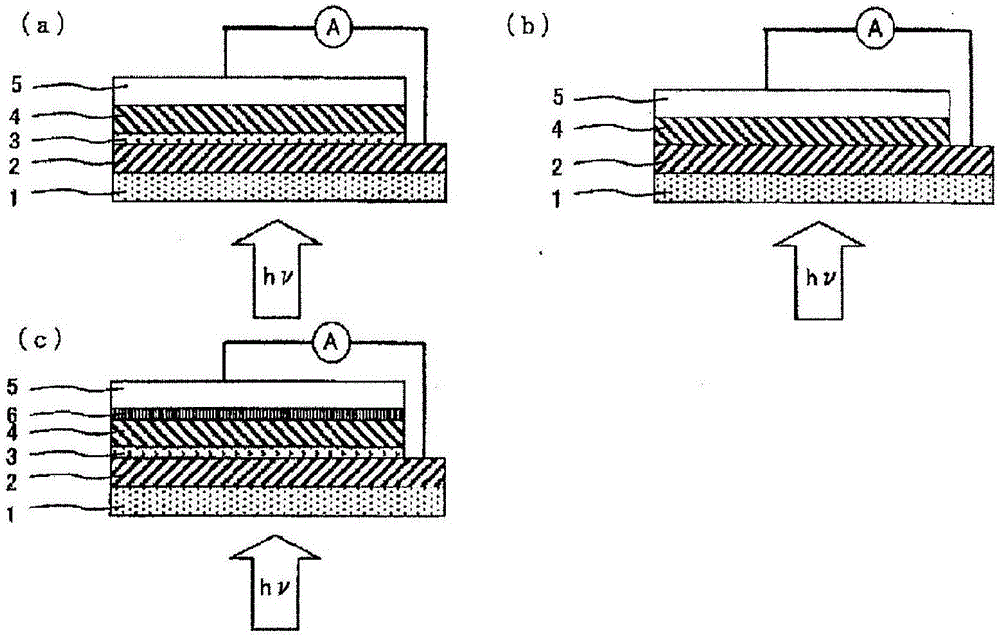
本發明涉及具有特定的結構的新型p型有機半導體材料、光電轉換材料及使用了該光電轉換材料的光電轉換元件。
背景技術:
:近年來,正在積極研究能夠持續利用、資源不會枯竭、環境汙染小的太陽能電池(太陽光發電)。太陽能電池大致分為Si系或非Si系的無機系太陽能電池和色素敏化型或有機薄膜型的有機系太陽能電池。無機系太陽能電池一般光電轉換效率高,但是由於需要高真空、或者需要高溫熱處理,因此具有製造成本變高這樣的缺點。另一方面,有機系太陽能電池由於能夠利用塗布法或印刷法等制膜,所以製造成本低,能夠以大面積制膜。此外,作為優點,還可列舉出與無機系太陽能電池相比能夠將元件變輕。特別是,有機薄膜型的太陽能電池由於印刷法優異,也容易在薄膜等上制膜,所以認為柔性太陽能電池也是容易的。但是,有機系太陽能電池的光電轉換效率大多較低,所以高光電轉換效率化成為課題。目前,作為可得到有機薄膜型的太陽能電池中的高光電轉換效率的材料,可列舉出由p型有機半導體材料的P3HT〔聚(3-己基噻吩)〕與n型有機半導體材料的PCBM〔[6,6]-苯基-C61-丁酸甲酯〕的混合材料構成的本體異質結(參照非專利文獻1等)。此外,作為p型有機半導體材料,有時也使用並五苯等低分子化合物,但是一般認為高分子型的材料適合於利用塗布來製造元件,低成本化和大畫面化容易。作為對p型有機半導體材料所要求的特徵,可列舉出在材料中具有平面性高的π共軛平面。這是因為能夠期待高π-π相互作用和高載流子輸送效率,所以結果是能夠提供高的光電動勢。專利文獻1~3中,公開了高分子型的p型有機半導體。現有技術文獻專利文獻專利文獻1:美國專利申請公開2008/0083455號公報專利文獻2:日本特開2009-158921號公報專利文獻3:日本特表2011-116962號公報非專利文獻非專利文獻1:F.Padinger,etal.,Adv.Funct.Mater.,13,85(2003)技術實現要素:發明所要解決的問題因此,本發明的目的在於提供容易製造、在高分子骨架內具有高平面性的p型有機半導體材料。此外,本發明的目的在於提供使用上述p型有機半導體材料而具有高的光電轉換效率的光電轉換層、光電轉換元件及有機薄膜太陽能電池。用於解決問題的方法本發明人們反覆進行了深入研究,結果發現:下述通式(1)所表示的苉衍生物若作為p型有機半導體材料使用,則能夠容易地製造光電轉換層。進一步進行了研究,結果發現:具有該光電轉換層的光電轉換元件顯示出高的載流子遷移率,能夠解決上述課題。本發明是基於上述見解而完成的,提供具有至少1個下述通式(1)所表示的結構單元的新型的苉衍生物(以下也稱為苉衍生物)。(式中,A1及A2分別獨立地表示單環,R1、R2、R3、R4、R5及R6分別獨立地表示氫原子、滷素原子、氰基、硝基、羥基、羧基、硫醇基、-SiR7R8R9、-NR10R11基、或者具有取代基的或未取代的烴基,R1、R2、R3、R4、R5及R6中的至少一個不為氫原子,R7、R8、R9、R10或R11分別獨立地表示氫原子或者具有取代基的或未取代的烴基。)此外,本發明提供一種光電轉換材料,其含有(A)作為p型有機半導體材料的上述的苉衍生物及(B)n型有機半導體材料。此外,本發明提供一種光電轉換材料,其含有(A)包含至少一種苉衍生物的p型有機半導體材料及(B)n型有機半導體材料。此外,本發明提供一種光電轉換層,其是將上述光電轉換材料制膜而得到的。此外,本發明提供一種光電轉換元件,其具有上述光電轉換層。此外,本發明提供一種有機薄膜太陽能電池,其具有上述光電轉換元件。發明效果根據本發明,能夠提供作為有機半導體材料有用的新型苉衍生物。若使用含有該化合物的本發明的光電轉換材料,則能夠通過高載流子遷移率來實現元件的高性能化。附圖說明圖1(a)是表示本發明的光電轉換元件的構成的一例的截面圖,圖1(b)是表示本發明的光電轉換元件的構成的另一例的截面圖,圖1(c)是表示本發明的光電轉換元件的構成的另一例的截面圖。具體實施方式以下,對本發明的苉衍生物、光電轉換材料、光電轉換層、光電轉換層及有機薄膜太陽能電池,基於優選的實施方式進行詳細說明。苉衍生物是具有至少1個上述通式(1)所表示的結構單元的化合物。另外,上述通式(1)中的*是指這些式子所表示的基團以*部分與鄰接的基團鍵合(以下同樣)。上述通式(1)中的A1及A2所表示的單環沒有特別限定,但優選為芳香族性的單環,作為具體的例子,可列舉出苯環、呋喃環、噻吩環、硒吩環、碲吩環、噻唑環、異噻唑環、噁唑環、異噁唑環、吡啶環、吡嗪環、嘧啶環、噠嗪環、吡咯環、咪唑環、吡唑環等。其中,包含硫原子、硒原子、碲原子的雜環由於使元件的特性提高,所以優選。上述通式(1)中的R1、R2、R3、R4、R5或R6分別獨立地表示氫原子、滷素原子、氰基、硝基、羥基、羧基、硫醇基、-SiR7R8R9、-NR10R11基、具有取代基的或未取代的烴基,R1、R2、R3、R4、R5及R6中的至少一個不為氫原子。R7、R8、R9、R10或R11分別獨立地表示氫原子或者具有取代基的或未取代的烴基。上述通式(1)中,作為滷素原子,可列舉出氟、氯、溴、碘等,作為上述烴基,可列舉出芳香族烴基、被脂肪族烴取代的芳香族烴基、脂肪族烴基,優選碳原子數為1~40、特別是為4~22的烴基。作為上述芳香族烴基,可列舉出例如苯基、萘基、環己基苯基、聯苯基、三聯苯、芴基、硫苯基苯基、呋喃基苯基、2』-苯基-丙基苯基、苄基、萘基甲基等,作為上述脂肪族烴基,例如可列舉出甲基、乙基、丙基、異丙基、丁基、仲丁基、叔丁基、異丁基、戊基、異戊基、叔戊基、己基、庚基、異庚基、叔庚基、正辛基、異辛基、叔辛基、壬基、環丙基、環丁基、環戊基、環己基、環庚基、環辛基、環壬基、環癸基等直鏈、支鏈及環狀的烷基,這些脂肪族烴基也可以被-O-、-COO-、-OCO-、-CO-、-S-、-SO-、-SO2-、-NR15-、-HC=CH-或-C≡C-中斷(另外,該中斷也可以將脂肪族烴基的鍵合的部分中斷),R15表示具有取代基的或未取代的烴基,作為具有取代基的或未取代的烴基,可列舉出與上述同樣的基團,其中優選全氟烷基。作為上述被脂肪族烴取代的芳香族烴基,可列舉出被上述脂肪族烴基取代的苯基、萘基、苄基等。作為也可以取代這些烴基的基團,可列舉出滷素原子、氰基、硝基、羥基、羧基、硫醇基、-NR』R」基等,R』及R」表示具有取代基的或未取代的烴基,作為具有取代基的或未取代的烴基,可列舉出與上述同樣的基團。苉衍生物中,具有2個以上且100個以下上述通式(1)所表示的結構單元的苉衍生物由於制膜性優異,所以優選。此外,苉衍生物也可以具有除上述通式(1)所表示的結構單元以外的結構單元(以下也稱為其他的結構單元)。苉衍生物包含其他的結構單元時,上述通式(1)的結構單元優選為5~100摩爾%,進一步優選為10~90摩爾%,特別優選為20~80摩爾%。上述通式(1)所表示的苉衍生物中,下述通式(1-1)或(1-2)所表示的衍生物由於製造容易,所以優選。(式中,A3及A4表示上述A1及A2中例示內的作為6元環的單環,A5及A6表示上述A1及A2中例示內的作為5元環的單環,R1、R2、R3、R4、R5或R6與上述通式(1)同樣,R1、R2、R3、R4、R5及R6中的至少一個不為氫原子。)具有上述通式(1-1)及(1-2)所表示的構成的苉衍生物中,上述通式(1-1)中的A3及A4為相同6元環的苉衍生物、或上述通式(1-2)中的A5及A6為相同5元環的苉衍生物由於製造更容易,所以優選。作為其他的結構單元,只要是π共軛的基團則沒有特別限定,但作為例子,可列舉出選自下述組Y或組Z中的結構單元,從材料的耐久性、耐光性的方面出發,優選(Y-2)、(Y-3)、(Y-4)或選自組Z中的結構單元。(式中,X1及X4表示S、O或NR12,k表示1~4的整數,R12表示被取代的或未取代的烴基,組Y所表示的結構單元中的氫原子也可以被滷素原子、氰基、硝基、羥基、羧基、硫醇基、-NR13R14基、被取代的或未取代的烴基或者被取代的或未取代的雜環基取代,R13及R14表示被取代的或未取代的烴基。)(式中,X2表示S或NR15,X3表示S、NR15、CR16R17或SiR16R17,X5表示S、O或NR15,R15、R16及R17表示被取代的或未取代的烴基,組Z所表示的結構單元中的氫原子也可以被滷素原子、氰基、硝基、羥基、羧基、硫醇基、-NR18R19基、被取代的或未取代的烴基或者被取代的或未取代的雜環基取代,R18及R19表示被取代的或未取代的烴基。)作為也可以取代組Y或組Z所表示的結構單元中的氫原子的烴基、以及表示組Y中的X1及X4的NR12、組Z中的R15、表示X2及X5的NR15、及表示X3的NR15、CR16R17、SiR16R17的R12、R15、R16及R17所表示的被取代的或未取代的烴基,可列舉出與上述通式(1)中的被取代的或未取代的烴基同樣的基團。當苉衍生物包含上述組Y或組Z的結構單元時,苉衍生物表示為下述通式(1』),該通式(1』)中的o、p或q個各結構單元的排列沒有特別限定地發揮本發明的效果。此外,作為各結構單元的優選的比率,當設式(1)的結構單元即o為1時,組Y或組Z的結構單元即p或q為1~10。從長波長區域的高的光吸收效率的方面出發,更優選的p的值為0~8,進一步優選為1~5。此外從長波長區域的高的光吸收效率的方面出發,更優選的q的值為0~2,進一步優選為1~2,特別優選為1。(式中的氫原子也可以與上述通式(1)同樣地被取代,Y表示選自上述組Y中的基團,Z表示選自上述組Z中的基團,o表示1以上且1000以下,p及q表示0以上且1000以下。)此外,作為苉衍生物的優選的例子,可列舉出下述通式(2)所表示的化合物,作為更優選的例子,可列舉出下述通式(2-1)或(2-2)所表示的化合物。(式中,A1、A2、R1、R2、R3、R4、R5及R6表示與上述式(1)同樣的基團,R1、R2、R3、R4、R5及R6中的至少一個不為氫原子,Y1及Y2為單鍵或將1~5個選自下述(Y-1)~(Y-8)中的基團組合連接而成的基團,Z1表示單鍵或選自下述(Z-1)~(Z-21)中的基團,n表示1以上且1000以下的整數。)(式中,X1及X4表示S、O或NR12,k表示1~4的整數,R12表示被取代的或未取代的烴基,(Y-1)~(Y-4)及(Y-6)~(Y-8)所表示的基團中的氫原子也可以被滷素原子、氰基、硝基、羥基、羧基、硫醇基、-NR13R14基、被取代的或未取代的烴基或者被取代的或未取代的雜環基取代,R13及R14表示被取代的或未取代的烴基。)(式中,X2表示S或NR15,X3表示S、NR15、CR16R17或SiR16R17,X5表示S、O或NR15,R15、R16及R17表示被取代的或未取代的烴基,(Z-1)~(Z-21)所表示的基團中的氫原子也可以被滷素原子、氰基、硝基、羥基、羧基、硫醇基、-NR18R19基、被取代的或未取代的烴基或者被取代的或未取代的雜環基取代,R18及R19表示被取代的或未取代的烴基。)(式中,A1、A2、R1、R2、R3、R4、R5及R6表示與上述式(1)同樣的基團,A3及A4與上述式(1-1)同樣,A5及A6與上述式(1-2)同樣,Y1、Y2、Z1及n與上述式(2)同樣,R1、R2、R3、R4、R5及R6中的至少一個不為氫原子。)上述通式(2)、(2-1)或(2-2)所表示的化合物中,Y1、Y2或Z1中的至少一個不為單鍵的化合物由於作為光電轉換元件的特性優異,所以優選。此外,通式(2)、(2-1)或(2-2)所表示的化合物中,R1、R2、R3、R4、R5及R6中的至少一個為除氫原子以外的取代基,儘管對R1、R2、R3、R4、R5及R6的取代基的種類沒有特別限定的情況下也可發揮本發明的效果,但優選R1、R2、R3、R4、R5及R6中的至少一個表示碳原子數為1~30的未取代烷基、或碳原子數為1~30的取代烷基,該未取代烷基及取代烷基中的亞甲基也可以表示-CH=CH-或-C≡C-,優選可取代該烷基的取代基為烷氧基、烷硫基、芳基、芳氧基、芳硫基、雜環基、醯基、醯氧基、氨基、磺醯基、羧基、氰基、磺基、羥基、巰基、醯亞胺基、滷素原子的化合物、更優選為碳原子數為1~30的未取代烷基、或碳原子數為1~30的取代烷基的化合物、特別是碳原子數為10~20的未取代烷基、或碳原子數為10~20的取代烷基的化合物。此外,在R1、R2、R3、R4、R5及R6中,關於除氫原子以外的取代基的位置,儘管對取代基的位置沒有特別限定的情況下也可發揮本發明的效果,但優選為R1、R3、R4及R6,更優選為R1及R6。作為苉衍生物的具體例子,可列舉出下述No.1~No.17,但並不特別地限制於這些。另外,下述式中的R1、R2、R3、R4、R5、R6為與上述通式(1)中的基團同樣的基團,n表示與上述通式(2)中的同樣的數,Hex表示己基,2-EH表示2-乙基己基,2-HD表示2-己基癸基,2-OD表示2-辛基十二烷基。本發明的苉衍生物均對其製造方法沒有限制,可以通過利用了眾所周知的一般的反應的方法來獲得。作為上述通式(2)所表示的苉衍生物的製造方法的一例,通過按照下述的反應式,使由苉衍生物(3)反應的雙(三甲基錫)體(4)與通過已知的合成法得到的滷代π共軛基(5)進行縮聚反應,可以獲得本發明的苉衍生物(2)。(式中,A1、A2、R1、R2、R3、R4、R5、R6、Y1、Y2、Z1、n表示與上述通式(2)中說明的基團同樣的基團。)本發明的苉衍生物除了適合作為有機半導體材料以外,還可以用於抗氧化劑等用途。本發明的光電轉換材料含有(A)含有至少一種苉衍生物的p型有機半導體材料及(B)n型有機半導體材料。作為(A)p型有機半導體材料,只要包含至少一種上述的本發明的苉衍生物即可,可以與其他的公知材料組合使用。關於本發明的苉衍生物,可以適當適用上述的內容。作為公知材料,可列舉出例如酞菁系顏料、靛藍或硫靛系顏料、喹吖啶酮系顏料、三芳基甲烷衍生物、三芳基胺衍生物、噁唑衍生物、腙衍生物、芪衍生物、吡唑啉衍生物、聚矽烷衍生物、聚苯乙炔及其衍生物(例如聚[2-甲氧基-5-(2-乙基己氧基)-1,4-苯乙炔]:MEH-PPV、聚[2-甲氧基-5-(3』,7』-二甲基辛氧基)-1,4-苯乙炔])、聚噻吩及其衍生物(例如聚(3-十二烷基噻吩)、聚(3-己基噻吩):P3HT、聚(3-辛基噻吩))、聚-N-乙烯基咔唑衍生物等。當使用其他的公知材料作為(A)p型有機半導體材料時,苉衍生物的含量在(A)p型有機半導體材料中優選為1~99質量%,更優選為1~80質量%。作為(B)n型有機半導體材料,可以使用苝系顏料、紫環酮系顏料、多環醌系顏料、偶氮系顏料、C60富勒烯或C70富勒烯及其衍生物等,此外,還可以使用有機金屬絡合物〔例如三(8-羥基喹啉)鋁、雙(10-苯並[h]羥基喹啉)鈹、5-羥基黃酮的鈹鹽、5-羥基黃酮的鋁鹽〕、噁二唑衍生物〔例如1,3-雙[5'-(對叔丁基苯基)-1,3,4-噁二唑-2'-基]苯〕、三唑衍生物〔例如3-(4'-叔丁基苯基)-4-苯基-5-(4」-聯苯基)-1,2,4-三唑〕、菲咯啉衍生物[例如2,9-二甲基-4,7-二苯基-1,10-菲咯啉(浴銅靈、BCP)]、三嗪衍生物、喹啉衍生物、喹喔啉衍生物、二苯醌衍生物、硝基取代芴酮衍生物、二氧噻喃衍生物等。在(B)n型有機半導體材料中,從作為n型材料具有高的載流子遷移率和/或電荷分離效率高的方面出發,優選C60富勒烯或C70富勒烯及其衍生物。另外,作為n型有機半導體材料所舉例的化合物可以單獨使用,或者也可以將多種並用。作為上述的C60富勒烯或C70富勒烯及其衍生物,可列舉出以下的C1~C6的化合物,其中,從電子能級的一致性優異、獲得容易的方面出發,優選使用C1的PCBM(苯基-C61-丁酸甲酯)。本發明的光電轉換材料中,(A)成分與(B)成分的重量比率(前者:後者)為10:90~90:10,優選為10:90~70:30,進一步優選為20:80~50:50。此外,本發明的光電轉換材料可以根據需要含有一種或兩種以上的溶劑。作為上述溶劑,只要是能夠溶解或分散(A)成分及(B)成分則沒有特別限制,例如可列舉出水、醇系溶劑、二醇系溶劑、酮系溶劑、酯系溶劑、醚系溶劑、脂肪族或脂環族烴系溶劑、芳香族烴系溶劑、具有氰基的烴溶劑、滷代烴系溶劑、其他的溶劑等。使用了溶劑的光電轉換材料可以作為塗布液使用。作為上述醇系溶劑,例如可列舉出甲醇、乙醇、丙醇、異丙醇、1-丁醇、異丁醇、2-丁醇、叔丁醇、戊醇、異戊醇、2-戊醇、新戊醇、叔戊醇、己醇、2-己醇、庚醇、2-庚醇、辛醇、2-乙基己醇、2-辛醇、環戊醇、環己醇、環庚醇、甲基環戊醇、甲基環己醇、甲基環庚醇、苄基醇、乙二醇單甲基醚、乙二醇單乙基醚、丙二醇單甲基醚、丙二醇單乙基醚、二乙二醇單甲基醚、二乙二醇單乙基醚、三乙二醇單甲基醚、三乙二醇單乙基醚、2-(N,N-二甲基氨基)乙醇、3(N,N-二甲基氨基)丙醇等。作為上述二醇系溶劑,例如可列舉出乙二醇、丙二醇、1,2-丁二醇、1,3-丁二醇、1,4-丁二醇、1,5-戊二醇、新戊二醇、異戊二醇(3-甲基-1,3-丁二醇)、1,2-己二醇、1,6-己二醇、3-甲基-1,5-戊二醇、1,2-辛二醇、辛二醇(2-乙基-1,3-己二醇)、2-丁基-2-乙基-1,3-丙二醇、2,5-二甲基-2,5-己二醇、1,2-環己二醇、1,4-環己二醇、1,4-環己烷二甲醇等。作為上述酮系溶劑,例如可列舉出丙酮、乙基甲基酮、甲基異丙酮、甲基丁酮、甲基異丁酮、甲基戊酮、甲基己酮、乙基丁酮、二乙酮、二丙酮、二異丁酮、甲基戊酮、環己酮、甲基環己酮等。作為上述酯系溶劑,例如可列舉出甲酸甲酯、甲酸乙酯、乙酸甲酯、乙酸乙酯、乙酸異丙酯、乙酸丁酯、乙酸異丁酯、乙酸仲丁酯、乙酸叔丁酯、乙酸戊酯、乙酸異戊酯、乙酸叔戊酯、乙酸苯酯、丙酸甲酯、丙酸乙酯、丙酸異丙酯、丙酸丁酯、丙酸異丁酯、丙酸仲丁酯、丙酸叔丁酯、丙酸戊酯、丙酸異戊酯、丙酸叔戊酯、丙酸苯酯、2-乙基己酸甲酯、2-乙基己酸乙酯、2-乙基己酸丙酯、2-乙基己酸異丙酯、2-乙基己酸丁酯、乳酸甲酯、乳酸乙酯、甲氧基丙酸甲酯、乙氧基丙酸甲酯、甲氧基丙酸乙酯、乙氧基丙酸乙酯、乙二醇單甲基醚乙酸酯、二乙二醇單甲基醚乙酸酯、乙二醇單乙基醚乙酸酯、乙二醇單丙基醚乙酸酯、乙二醇單異丙基醚乙酸酯、乙二醇單丁基醚乙酸酯、乙二醇單仲丁基醚乙酸酯、乙二醇單異丁基醚乙酸酯、乙二醇單叔丁基醚乙酸酯、丙二醇單甲基醚乙酸酯、丙二醇單乙基醚乙酸酯、丙二醇單丙基醚乙酸酯、丙二醇單異丙基醚乙酸酯、丙二醇單丁基醚乙酸酯、丙二醇單仲丁基醚乙酸酯、丙二醇單異丁基醚乙酸酯、丙二醇單叔丁基醚乙酸酯、丁二醇單甲基醚乙酸酯、丁二醇單乙基醚乙酸酯、丁二醇單丙基醚乙酸酯、丁二醇單異丙基醚乙酸酯、丁二醇單丁基醚乙酸酯、丁二醇單仲丁基醚乙酸酯、丁二醇單異丁基醚乙酸酯、丁二醇單叔丁基醚乙酸酯、乙醯乙酸甲酯、乙醯乙酸乙酯、氧代丁酸甲酯、氧代丁酸乙酯、γ-內酯、丙二酸二甲酯、琥珀酸二甲酯、丙二醇二乙酸酯、δ-內酯等。作為上述醚系溶劑,例如可列舉出四氫呋喃、四氫吡喃、嗎啉、乙二醇二甲基醚、二乙二醇二甲基醚、二丙二醇二甲基醚、三乙二醇二甲基醚、二丁基醚、二乙基醚、二噁烷等。作為上述脂肪族或脂環族烴系溶劑,例如可列舉出戊烷、己烷、環己烷、甲基環己烷、二甲基環己烷、乙基環己烷、庚烷、辛烷、十氫化萘、溶劑石腦油、松節油、D-檸檬烯、蒎烯、礦物油精、Swasol#310(CosmoOil株式會社、Solvesso#100(ExxonChemical株式會社)等。作為上述芳香族烴系溶劑,例如可列舉出苯、甲苯、乙苯、二甲苯、均三甲苯、二乙苯、異丙苯、異丁苯、傘花烴、四氫化萘等。作為上述具有氰基的烴溶劑,例如可列舉出乙腈、1-氰基丙烷、1-氰基丁烷、1-氰基己烷、氰基環己烷、氰基苯、1,3-二氰基丙烷、1,4-二氰基丁烷、1,6-二氰基己烷、1,4-二氰基環己烷、1,4-二氰基苯等。作為上述滷代烴系溶劑,例如可列舉出四氯化碳、氯仿、二氯甲烷、三氯乙烯、氯苯、二氯苯、三氯苯等。作為上述其他的有機溶劑,例如可列舉出N-甲基-2-吡咯烷酮、二甲基亞碸、二甲基甲醯胺、苯胺、三乙基胺、吡啶、二硫化碳等。它們中,作為優選的溶劑,可列舉出氯仿、二氯甲烷、甲苯、二甲苯、氯苯、二氯苯、三氯苯等。當本發明的光電轉換材料中含有上述溶劑時,其含量只要不對使用了該光電轉換材料的光電轉換層的形成產生障礙則沒有特別限制,例如,在將溶劑設為100重量份時,優選從(A)成分及(B)成分的總量成為0.1~20重量份的範圍適當選擇,希望從進一步優選為1~10重量份、特別優選從3~7重量份的範圍選擇。接著,對本發明的光電轉換層進行說明。本發明的光電轉換層是將本發明的光電轉換材料制膜而得到的。關於制膜方法沒有特別限定,例如可列舉出利用蒸鍍法、物理氣相沉積法(PVD)、化學氣相沉積法(CVD)、原子層沉積法(ALD)、原子層外延法(ALE)、分子束外延法(MBE)、氣相外延法(VPE)、濺射法、等離子體聚合法等乾式工藝;浸塗法、流延法、氣刀塗布法、幕式淋塗法、輥塗法、繞線棒塗布法、凹版塗布法、旋塗法、LB法、膠版印刷法、絲網印刷法、柔性印刷法、分配印刷法、噴墨法、擠壓塗布法等溼式工藝在支撐體上形成塗膜的方法。上述光電轉換層的膜厚沒有特別限定,一般優選設定為5nm~5μm左右,也可以進行退火等加熱處理。上述光電轉換層被用於混雜了p型和n型的有機半導體材料的元件,除了作為優選的實施方式的有機本體異質結元件以外,還被用於超分級納米結構結元件、混合型異質結型、p-i-n結型元件中的i層等。本發明的光電轉換元件除了具有至少一個本發明的光電轉換層以外,與以往公知的光電轉換元件同樣地構成。例如,若以圖1(a)為例示出,則具有支撐體1、電極2、電荷移動層3、光電轉換層4及電極5依次層疊而成的結構。此外,可以是如圖1(b)中所示的那樣除去了電荷移動層3的結構,也可以是如圖1(c)中所示的那樣進一步具有電荷移動層6的結構。在本發明的光電轉換元件中,需要光從支撐體1到達至光電轉換層4。為了使照射光從支撐體1、電極2及電荷移動層3到達至光電轉換層4,優選由透光性的材料形成支撐體1、電極2及電荷移動層3,並以透光率達到70%以上的方式設定。支撐體1隻要能夠將電極2穩定地保持在表面,就對材質和厚度沒有限制,但是需要具有透明性。因此,支撐體的形狀可以是板狀,也可以是薄膜狀。透明性是指以高百分率透過光電轉換元件中使用的規定波長區域、例如可見光區域的光的性質。支撐體1例如可以使用玻璃、透明聚合物薄膜(聚對苯二甲酸乙二醇酯(PET)、四乙醯纖維素(TAC)、聚碳酸酯、聚萘二甲酸乙二醇酯、聚苯硫醚、聚酯碸、間規聚苯乙烯)等。另外,本發明的光電轉換元件優選形成於支撐體1的表面上,但當電極2本身具有一定程度的硬度、具有自立性時,也可以為電極2兼作支撐體1的結構,在該情況下,支撐體1也可以省略。本發明中,相對配置的一對電極(電極2及電極5)的功函數隻要是相互相對具有大小關係(即功函數彼此不同)即可。因此,只要電極2的功函數比電極5相對大即可。這種情況下,兩電極間的功函數之差優選為0.5V以上。另外,在各電極與半導體層之間設置緩衝層,當電極上的緩衝層的化合物與電極化學鍵合時,這些制約有時會被緩和。作為電極2及電極5,例如可以適當使用金、鉑、銀等貴金屬類、氧化鋅、氧化銦、氧化錫(NESA)、摻雜錫的氧化銦(ITO)、摻雜氟的氧化錫(FTO)等金屬氧化物、鋰、鋰-銦合金、鈉、鈉-鉀合金、鈣、鎂、鎂-銀合金、鎂-銦合金、銦、釕、鈦、錳、釔、鋁、鋁-鋰合金、鋁-鈣合金、鋁-鎂合金、鉻、石墨薄膜以及PEDOT-PSS等有機導電性化合物等。這些電極物質可以單獨使用,或者也可以將多種並用。電極2需要具有透明性,所以使用氧化鋅、NESA、ITO、FTO及PEDOT-PSS等具有透明性的材料。電極2及電極5能夠使用這些電極物質而與上述光電轉換層4同樣地通過乾式工藝或溼式工藝的方法而形成。此外,也可以利用溶膠凝膠法等進行燒成而形成。此外,電極的厚度也因所使用的電極物質的材料而異,電極2及電極5一般均設定為5~1000nm左右,進一步優選為10~500nm左右。電荷移動層3及6具有以下等作用:防止電極材料侵入光電轉換層並反應,或者防止被光電轉換層分離出來的電荷的再鍵合,從而有效地使電荷向電極2及5移動。作為材料,可列舉出PEDOT:PSS、PEO、V2O5、氧化鋅、氟化鋰、TiOx、萘四羧酸酐等電荷移動物質。電荷移動層3需要具有透明性。光電轉換層4為P3HT:PCBM的本體異質型時,電荷移動層3常使用PEDOT:PSS,電荷移動層6常使用LiF。電荷移動層3及6能夠使用這些電荷移動物質而與上述光電轉換層4同樣地通過乾式工藝或溼式工藝的方法而形成。此外,電荷移動層3及6的厚度通常設定為0.01~100nm,進一步優選為0.1~50nm左右。本發明的光電轉換元件除了能夠用於本發明的有機薄膜太陽能電池以外,還能夠用於光電二極體、光檢測器等。實施例以下,利用實施例及比較例對本發明更詳細地進行說明。然而,本發明不受以下的實施例等的任何限制。[實施例1]化合物No.11(R1及R6=C12H25、R2、R3、R4及R5=H)的合成(步驟1)2,9-雙(三異丙基甲矽烷基)菲並[1,2-b:8,7-b']二噻吩(7a)的合成在氬氣氣氛下,在50mL舒侖克管中加入菲並[1,2-b:8,7-b']二噻吩(PDT)(6a)(809mg,2.8mmol,1equiv)、脫水THF(50mL),冷卻至-78℃。之後,滴加n-BuLi(1.6M在己烷中)(3.85mL,6.2mmol,2.2equiv)後,放冷至室溫,攪拌1小時。攪拌後,冷卻至-78℃,滴加TIPSCl(三異丙基甲矽烷基氯,1.44mL,6.7mmol,2.4equiv)後,回流24小時。通過加入水及1N鹽酸而使反應停止,用氯仿萃取。用飽和氯化鈉水溶液將有機層洗滌後,用無水硫酸鎂進行乾燥,將該混合溶液過濾後,使用旋轉蒸發儀將溶劑蒸餾除去。之後,利用矽膠柱色譜法進行精製,以69%(1.17g,1.9mmol)的收率得到白色固體的目標化合物即7a。以下,示出矽膠柱色譜法的條件及化合物7a的分析結果。矽膠柱色譜法(Rf=0.38,己烷)。m.p.:98-100℃FT-IR(KBr,cm-1):2941(w),2989(m),2864(w),1564(s),1460(m),1284(m),1072(m),949(w),883(m),842(m),686(m),592(m).1HNMR(600MHz,CDCl3,rt):1.20(d,J=7.2Hz,36H),1.55(sept,J=7.2Hz,6H)7.68(s,2H),8.04(d,J=8.4Hz,2H),8.26(s,2H),8.65(d,J=9Hz,2H).13C[1H]NMR(150MHz,CDCl3,rt):11.9,18.7,120.2,122.2,123.8,126.8,127.4,133.5,135.8,138.9,142.9.29Si[1H]NMR(119MHz,CDCl3,rt):2.16.對於C36H50S2Si2的分析計算值:C,71.70;H,8.36%.實驗值:C,71.72;H,8.36%.(步驟2)4,7-雙(4,4,5,5-四甲基-1,3,2-二氧雜環戊硼烷-2-基)-2,9-雙(三異丙基甲矽烷基)菲並[1,2-b:8,7-b]二噻吩(8a)的合成在氬氣氣氛下,在50mL舒侖克管中加入[Ir(OMe)(cod)]2((1,5-環辛二烯)(甲氧基)銥(I)二聚體,50mg,0.075mmol,5mol%)、dtbpy(4,4-二叔丁基二吡啶,40mg,0.15mmol,10mol%)、B2pin2(聯硼酸頻那醇酯,762mg,3mmol,2equiv)、脫水環己烷(30mL),在室溫下攪拌10分鐘。之後,加入7a(905mg,1.5mmol,1equiv),在遮光下80℃下攪拌10小時。通過加入水而使反應停止,使用氯仿進行萃取。利用飽和氯化鈉水溶液將有機層洗滌後,利用無水硫酸鎂進行乾燥,將該混合溶液過濾後,使用旋轉蒸發儀將溶劑蒸餾除去。之後,利用矽膠柱色譜法進行精製,以84%(1.07g,1.26mmol)的收率得到目標化合物即8a白色固體。以下,示出矽膠柱色譜法的條件及化合物8a的分析結果。矽膠柱色譜法(Rf=0.54,己烷/乙酸乙酯=5/1)。m.p.:174-175℃FT-IR(KBr,cm-1):2943(w),2891(m),2866(w),1587(m),1463(m),1317(w),1303(w),1143(w),1099(m),974(w),846(m),680(m),605(s).1HNMR(600MHz,CDCl3,rt):1.25(d,J=7.8Hz,36H),1.48-1.53(m,30H),8.33(s,2H),8.48(s,2H),9.32(s,2H).13C[1H]NMR(150MHz,CDCl3,rt):12.0,18.7,25.1,83.9,125.1,126.9,128.6,129.2,135.1,136.1,142.5,142.7.ThecarbonsignaladjacenttoBwasnotobservedduetolowintensity.11B[1H]NMR(192MHz,CDCl3,rt):31.6.29Si[1H]NMR(119MHz,CDCl3,rt):1.96.對於C48H72B2O4S2Si2的分析計算值:C,67.43;H,8.49%.實驗值:C,67.14;H,8.52%.(步驟3)4,7-二溴-2,9-雙(三異丙基甲矽烷基)菲並[1,2-b:8,7-b']二噻吩(9a)的合成在50mL舒侖克管中加入8a(1.07g,1.25mmol,1equiv)、CuBr2(1.68g,7.5mmol,6equiv)、NMP/MeOH/H2O(15mL/6mL/3mL),回流15小時。通過加入1N鹽酸而使反應停止,將沉澱物過濾後,利用己烷進行洗滌、乾燥,以88%(833mg,1.1mmol)的收率得到白色固體的目標化合物即9a。以下,示出化合物9a的分析結果。m.p.:184-185℃FT-IR(KBr,cm-1):2943(w),2889(m),2864(w),1548(s),1460(m),1087(m),954(w),881(m),648(m),599(m).1HNMR(600MHz,CDCl3,rt):1.22(d,J=7.2Hz,36H),1.51(sept,J=7.2Hz,6H)7.79(s,2H),8.09(s,2H),8.66(s,2H).13C[1H]NMR(150MHz,CDCl3,rt):11.9,18.6,116.8,123.0,123.6,125.9,127.3,133.6,137.3,138.7,143.3.29Si[1H]NMR(119MHz,CDCl3,rt):2.55.對於C36H48Br2S2Si2的分析計算值:C,56.83;H,6.36%.實驗值:C,56.83;H,6.30%.(步驟4)4,7-雙十二烷基-2,9-雙(三異丙基甲矽烷基)菲並[1,2-b:8,7-b']二噻吩(10a)的合成在氬氣氣氛下,在50mL舒侖克管中加入1-十二碳烯(412μL,1.86mmol,3equiv)、9-BBN二聚體(232mg,0.95mmol,1.53equiv)、脫水THF(12mL),在60℃下攪拌1小時。放冷至室溫後,加入9a(472mg,0.62mmol,1equiv)、Pd(dba)2(36mg,0.03mmol,10mol%)、[HPtBu3]BF4(36mg,0.06mmol,20mol%)、氫氧化鉀(209mg,3.72mmol,6equiv),回流7小時。通過加入水而使反應停止,利用氯仿進行萃取。利用飽和氯化鈉水溶液將有機層洗滌後,利用無水硫酸鎂進行乾燥,將該混合溶液過濾後,使用旋轉蒸發儀將溶劑蒸餾除去。之後,利用矽膠柱色譜法進行精製,以87%(506mg,0.54mmol)的收率得到無色液體的目標化合物即10a。以下,示出矽膠柱色譜法的條件及化合物10a的分析結果。矽膠柱色譜法(Rf=0.69,己烷)。FT-IR(KBr,cm-1):2924(w),2854(w),1573(s),1454(w),1382(s),999(m),883(m),650(m),500(s).1HNMR(600MHz,CDCl3,rt):0.92(t,J=7.2Hz,6H),1.26(d,J=7.8Hz,36H),1.30-1.37(m,28H),1.45(quin,J=7.8Hz,4H),1.51-1.57(m,10H),1.93(quin,J=7.8Hz,4H),3.22(t,J=7.8Hz,4H),7.77(s,2H),8.17(s,2H),8.42(s,2H).13C[1H]NMR(150MHz,CDCl3,rt):11.9,14.1,18.7,22.7,29.4,29.6,29.66,29.69,29.73,29.75,29.8,31.1,31.9,35.0,119.1,122.8,125.5,127.5,131.5,134.8,136.2,138.6,143.2.29Si[1H]NMR(119MHz,CDCl3,rt):2.16.對於C60H98S2Si2的分析計算值:C,76.69;H,10.51%.實驗值:C,76.72;H,10.69%.(步驟5)4,7-雙十二烷基菲並[1,2-b:8,7-b']二噻吩(3a)的合成在氬氣氣氛下,在50mL舒侖克管中加入10a(613mg,0.65mmol,1equiv)、TBAF(1MinTHF)(6.5mL,6.5mmol,10equiv)、脫水THF(26mL),在室溫下攪拌15小時。通過加入水而使反應停止,利用氯仿進行萃取。利用飽和氯化鈉水溶液將有機層洗滌後,利用無水硫酸鎂進行乾燥,將該混合溶液過濾後,使用旋轉蒸發儀將溶劑蒸餾除去。之後,利用矽膠柱色譜法進行精製,以89%(363mg,0.58mmol)的收率得到白色固體的目標化合物即3a。以下,示出矽膠柱色譜法的條件及化合物3a的分析結果。矽膠柱色譜法(Rf=0.52,己烷)m.p.:84-86℃FT-IR(KBr,cm-1):3039(m),3072(s),3043(s),2954(w),2914(w),2848(w),1577(s),1469(w),1344(s),1153(m),854(w),802(w),694(w).1HNMR(600MHz,CDCl3,rt):0.89(t,J=7.8Hz,6H),1.22-1.35(m,28H),1.41(quin,J=7.8Hz,4H),1.51(quin,J=7.8Hz,4H),1.87(quin,J=7.8Hz,4H),3.17(t,J=7.8Hz,4H),7.56(d,J=5.4Hz,2H),7.60(d,J=5.4Hz,2H),8.11(s,2H),8.43(s,2H).13C[1H]NMR(150MHz,CDCl3,rt):14.1,22.7,29.4,29.6,29.65,29.69,29.71,29.8,31.1,31.9,35.0,119.2,122.6,123.0,125.1,125.7,127.7,136.6,137.3,139.0.對於C42H58S2的分析計算值:C,80.45;H,9.32%.實驗值:C,80.51;H,9.17%.(步驟6)4,7-雙十二烷基-2,9-雙(三甲基錫烷基)菲並[1,2-b:8,7-b']二噻吩(4a)的合成在氬氣氣氛下,在20ml舒侖克管中加入3a(188mg,0.3mmol,1equiv)、脫水THF(12mL),冷卻至0℃。之後,滴加n-BuLi(1.6M在己烷中)(0.56mL,0.9mmol,3equiv)後,回流2小時。攪拌後,冷卻至0℃,滴加Me3SnCl(239mg,1.2mmol,4equiv)後,在室溫下攪拌12小時。通過加入水而使反應停止,利用二氯甲烷進行萃取。利用飽和氯化鈉水溶液將有機層洗滌後,利用無水硫酸鎂進行乾燥,將該混合溶液過濾後,使用旋轉蒸發儀將溶劑蒸餾除去。之後,利用2次高效液相色譜法進行精製,以56%(159mg,0.17mmol)的收率得到淡黃色液體的目標化合物即4a。以下,示出化合物4a的分析結果。FT-IR(KBr,cm-1):2924(w),2852(w),1571(s),1465(s),1377(s),950(s),771(m),532(m).1HNMR(600MHz,CDCl3,rt):0.46(t,J=28.8Hz,18H),0.88(t,J=7.2Hz,6H),1.22-1.36(m,28H),1.43(quin,J=7.8Hz,4H),1.53(quin,J=7.8Hz,4H),1.90(quin,J=7.8Hz,4H),3.20(t,J=7.8Hz,4H),7.65(s,2H),8.15(s,2H),8.40(s,2H).13C[1H]NMR(150MHz,CDCl3,rt):8.16(t,JC-Sn=177Hz),14.1,22.7,29.4,29.6,29.67,29.69,29.72,29.8,31.0,31.9,35.0,119.1,122.8,125.4,127.2,130.8,136.0,138.6,138.8,143.9.對於C48H74S2Sn2的分析計算值:C,60.52;H,7.83%.實驗值:C,60.74;H,7.96%.(步驟7)化合物No.11(R1及R6=C12H25、R2、R3、R4及R5=H)的合成在5mL的管形瓶中,加入4a(62.7mg,0.066mmol,1equiv)、BTz-2T-HD(5a、59.7mg,0.066mmol,1equiv)、Pd(PPh3)4(1.5mg,1.32μmol,2mol%)後,封入氬氣,塞住而密閉。之後,加入脫水甲苯(3.3mL),使用微波照射裝置,在微波照射下,180℃下攪拌40分鐘。之後,加入甲醇/鹽酸(100mL/5mL),在室溫下攪拌3小時。在過濾器中濾取沉澱物,使用索氏萃取器,以甲醇、己烷、氯仿分別萃取3小時。對氯仿成分使用旋轉蒸發儀將溶劑蒸餾除去,進行減壓乾燥,以77%(69.7mg,0.051mmol)的收率得到黑紫色固體的目標化合物即化合物No.11。以下,示出化合物No.11的分析結果。對於C88H128N2S5的分析計算值:C,76.91;H,9.39;N,2.04%.實驗值:C,76.54;H,9.26;N,1.99%.Mw/Mn=31443/21602(測定條件:140℃、o-DCB)[實施例2]化合物No.16(R1及R6=C12H25、R2、R3、R4及R5=H)的合成首先,通過與實施例1的步驟1~步驟6同樣的方法,合成化合物4b。在5ml的反應容器中加入4b(56.1mg,0.059mmol),5b(55.5mg,0.059mmol)及Pd(PPh3)41.4mg,1.2μmol)後,加入氬氣,將反應容器密閉。之後,將甲苯(2.5mL)加入反應容器中,利用微波反應裝置在180℃下攪拌40分鐘。將反應混合物冷卻至室溫後,加入到甲醇(100mL)與濃鹽酸(5mL)的混合溶液中,在室溫下攪拌3小時。將沉澱物過濾後,依次利用甲醇、己烷、氯仿、氯苯進行索氏萃取。將利用氯仿及氯苯萃取的溶液分別濃縮,使用甲醇再沉澱後,進行過濾及在減壓下乾燥,得到37.9mg(46%)具有金屬光澤的紫色固體的可溶於氯仿的目標化合物即化合物No.16。以下,示出化合物No.16的分析結果。GPC(o-DCB,140℃):Mn=30.6kDa,PDI=2.05(CHCl3),Mn=42.3kDa,PDI=1.82(PhCl).[實施例3]化合物No.17(R1及R6=C12H25、R2、R3、R4及R5=H)的合成首先,通過與實施例1的步驟1~步驟6同樣的方法,合成了化合物4b。在5mL的反應容器中加入4b(60.0mg、0.063mmol)、5c(72.1mg、0.063mmol)及Pd(PPh3)4(1.5mg、1.2μmol)後,加入氬氣,將反應容器密閉。之後,將甲苯(2.9mL)加入反應容器中,利用微波反應裝置在180℃下攪拌40分鐘。將反應混合物冷卻至室溫後,注入到甲醇(100mL)與濃鹽酸(5mL)的混合溶液中,在室溫下攪拌3小時。將沉澱物過濾後,依次利用甲醇、己烷、氯仿進行索氏萃取。將利用氯仿萃取的溶液分別濃縮,使用甲醇再沉澱後,進行過濾及在減壓下乾燥,得到90.7mg(89%)具有金屬光澤的紫色固體的可溶於氯仿的目標化合物即化合物No.17。以下,示出化合物No.17的分析結果。GPC(o-DCB,140℃):Mn=22.8kDa,PDI=1.39.[實施例4及5以及比較例1]有機薄膜太陽能電池元件的製作及評價將ITO基板(Geomatec社、膜厚:150nm、電阻率:<12Ω/□、透射率:(λ=550nm)≥85%)使用中性洗劑、離子交換水、丙酮及異丙醇分別進行10分鐘超聲波洗滌。之後,將放有基板的異丙醇煮沸10分鐘,乾燥後,進行20分鐘UV-臭氧洗滌。在洗滌後的基板上,作為陽極緩衝層經過0.45μm的PVDF制注射式過濾器後滴加聚(3,4-乙撐-二氧噻吩):聚(苯乙烯磺酸鹽)(PEDOT:PSS、CleviousPVPAI4083)的水溶液,以5000rpm進行30秒鐘旋塗。在120℃下在熱板上乾燥10分鐘後,立即搬入手套箱內。在濃度為10g/L的化合物No.16(實施例2中合成)的無水氯苯溶液中,按照重量比((A)/(B))=1:1~1:2的方式加入可溶性富勒烯衍生物(PC61BM),在保持於100℃的狀態下,以400rpm旋塗30秒,接著以1000rpm旋塗5秒鐘,從而在塗敷了(PEDOT:PSS)的基板上製作了活性層。在室溫下乾燥後,轉移至真空蒸鍍裝置中,在3×10?5Pa左右的減壓下,作為陰極緩衝層真空蒸鍍10nm的鈣,接著通過蔭罩真空蒸鍍80nm的鋁作為陰極,從而製作活性區域為0.16cm?2的本體異質結型太陽能電池元件,測定光電轉換效率。光電轉換效率通過對所得到的本體異質結型太陽能電池元件從ITO電極側照射氣團1.5G、100mW/cm2的模擬太陽光而進行測定。此外,作為比較例,使用化合物A來代替化合物No.16,除此以外,通過與實施例4及5同樣的方法製作太陽能電池元件,測定光電轉換效率。將它們的結果示於表1中。表1成分(A)成分(B)轉換效率(%)(A)/(B)實施例4No.16PCBM5.071/1實施例5No.16PCBM4.231/2比較例1化合物APCBM2.011/1化合物A確認了當使用通過上述實施例得到的本發明的苉衍生物作為p型有機半導體時,顯示高的光電轉換效率。符號說明1支撐體2電極3電荷移動層4光電轉換層5電極6電荷移動層當前第1頁1 2 3 
