一種異花授粉植物愈傷組織高頻再生系的獲得方法及其在遺傳轉化中的應用與流程
2024-03-27 19:55:05
本發明涉及生物技術領域,具體涉及一種異花授粉植物愈傷組織高頻再生系的獲得方法及其在遺傳轉化中的應用。
背景技術:
野大麥(Hordeum brevisubulatum(Trin.)Link)是禾本科大麥屬一種多年生兼性鹽生優良牧草,又叫短芒大麥草,是一種典型的異花授粉植物。主要分布在西西伯利亞、蒙古和我國東北、華北、新疆、西藏和內蒙等省區,是鹽化和鹼化草甸草原的建群種,可在含鹽量0.6~1.0%(質量百分比)的土地上良好生長,它的耐鹽性可與小花鹼茅等媲美,具有重要的應用和科學研究價值。目前,野大麥耐鹽分子機理和耐鹽基因功能解析方面研究較少。野大麥的離體再生鮮有報導,偶有報導開展了遺傳轉化的研究,但轉化效率較低。截止目前,仍未建立穩定的野大麥遺傳轉化體系,極大的限制了野大麥以離體再生為基礎的轉基因育種和基因功能分析的深入開展。
技術實現要素:
本發明所要解決的技術問題是提供獲得同一基因型的異花授粉植物愈傷組織高頻再生系。
為解決上述技術問題,本發明首先提供了一種異花授粉植物離體再生的方法。
本發明所提供的異花授粉植物離體再生的方法,是以所述異花授粉植物單株的幼穗或用所述幼穗截成的節段為外植體,完成離體再生。
所述異花授粉植物的幼穗為發育至1.5~2.5cm(如1.5cm、2cm或2.5cm)的幼穗。
所述節段的長度為0.2~0.4cm(如0.2cm、0.3cm或0.4cm)。
按照上述方法進行離體再生獲得的再生苗的基因型為同一基因型。而異花授粉植物,一般獲得的資源材料或品種均為混合基因型。
所述異花授粉植物離體再生的方法可包括如下步驟:
(1)將所述外植體接種於誘導培養基進行培養,獲得愈傷組織;所述誘導培養基中含有2~4mg/L 2,4-D、30~40g/L蔗糖和0.4~0.6g/L水解酪蛋白;
(2)將步驟(1)獲得的愈傷組織置於繼代培養基進行培養,獲得胚性愈傷組織;所述繼代培養基中含有0.8~1.2mg/L 2,4-D、30~40g/L蔗糖和0.4~0.6mg/L 6-BA;
(3)將步驟(2)獲得的胚性愈傷組織置於分化培養基甲進行培養,獲得分化苗;分化培養基甲中含有0.8~1.2mg/L 6-BA、0.15~0.25mg/L玉米素和30~40g/L蔗糖;
(4)將步驟(3)獲得的分化苗置於生根培養基甲進行培養,獲得再生苗;所述生根培養基甲中含有20~30g/L蔗糖。
所述誘導培養基具體可為含有3mg/L的2,4-D、35g/L的蔗糖和0.5g/L的水解酪蛋白的MS固體培養基。
所述繼代培養基具體可為含有1.0mg/L的2,4-D、35g/L的蔗糖和0.5mg/L的6-苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)的MS固體培養基。
所述分化培養基甲具體可為含有1.0mg/L的6-BA、0.2mg/L的玉米素(Zeatin,ZT)和35g/L的蔗糖的MS固體培養基。
所述生根培養基甲具體可為含有25g/L的蔗糖的1/2MS固體培養基。
所述步驟(1)中,所述培養的條件可為:25℃~28℃(如25℃、26℃、27℃或28℃),暗培養4~5周(如4周或5周)。
所述步驟(2)中,所述培養的條件可為:25℃~28℃(如25℃、26℃、27℃或28℃),暗培養9~12周(如9周、10周、11周或12周)。「將步驟(1)獲得的愈傷組織」可為愈傷誘導率高於75%以上的單株的愈傷組織。
所述步驟(3)中,所述培養的條件可為:25℃~28℃(如25℃、26℃、27℃或28℃),光暗交替培養5~8周(如5周、6周、7周或8周)。「將步驟(2)獲得的胚性愈傷組織」可為胚性愈傷率高於70%以上的單株的胚性愈傷組織。
所述步驟(4)中,所述培養的條件可為:25℃~28℃(如25℃、26℃、27℃或28℃),光暗交替培養4~7周(如4周、5周、6周或7周)。「將步驟(3)獲得的分化苗」可為分化率高於80%以上的單株的分化苗。
上述任一所述異花授粉植物離體再生的方法在異花授粉植物遺傳轉化中的應用也屬於本發明的保護範圍。
為解決上述技術問題,本發明還提供了異花授粉植物愈傷組織高頻再生系的獲得方法。
本發明所提供的異花授粉植物愈傷組織高頻再生系的獲得方法,可包括如下步驟:
(1)以異花授粉植物單株的幼穗或用所述幼穗截成的節段為外植體,將所述外植體接種於所述誘導培養基進行培養,獲得愈傷組織;
(2)完成步驟(1)後,取愈傷誘導率高於75%以上的單株的愈傷組織,置於所述繼代培養基進行培養,獲得胚性愈傷組織;
(3)完成步驟(2)後,取胚性愈傷率高於70%以上的單株的胚性愈傷組織,置於所述分化培養基甲進行培養,獲得分化苗;
(4)完成步驟(3)後,取分化率高於80%以上的單株的分化苗,置於所述生根培養基甲進行培養,獲得再生苗。
上述異花授粉植物愈傷組織高頻再生系的獲得方法中,所述異花授粉植物的幼穗為發育至1.5~2.5cm(如1.5cm、2cm或2.5cm)的幼穗。所述節段的長度為0.2~0.4cm(如0.2cm、0.3cm或0.4cm)。所述高頻再生系可為愈傷誘導率高於75%以上、胚性愈傷率高於70%以上和分化率高於80%以上的異花授粉植物單株的幼穗所誘導出的愈傷組織總稱。
按照上述異花授粉植物愈傷組織高頻再生系的獲得方法,獲得的異花授粉植物愈傷組織高頻再生係為同一基因型。
上文中,所述愈傷誘導率的計算公式為:愈傷誘導率=產生愈傷組織的外植體數/接種的外植體總數×100%。
上文中,所述胚性愈傷率的計算公式為:胚性愈傷率=產生胚性愈傷組織數/接種的外植體總數×100%。
上文中,所述分化率的計算公式為:分化率=分化出苗的愈傷組織數/接種於分化培養基上的愈傷組織數×100%。
為解決上述技術問題,本發明還提供了異花授粉植物的遺傳轉化方法。
本發明所提供的異花授粉植物的遺傳轉化方法,包括如下步驟:
(1)以異花授粉植物單株的幼穗或用所述幼穗截成的節段為外植體,將所述外植體接種於誘導培養基進行培養,獲得愈傷組織;所述誘導培養基中含有2~4mg/L 2,4-D、30~40g/L蔗糖和0.4~0.6g/L水解酪蛋白;
(2)完成步驟(1)後,將所述愈傷組織置於繼代培養基進行培養,獲得胚性愈傷組織;所述繼代培養基中含有0.8~1.2mg/L 2,4-D、30~40g/L蔗糖和0.4~0.6mg/L6-BA;
(3)完成步驟(2)後,對所述胚性愈傷組織進行遺傳轉化。
上述遺傳轉化方法,所述步驟(3)中,所述「對所述胚性愈傷組織進行遺傳轉化」依次可包括如下步驟:
(A)取重組農桿菌,對所述胚性愈傷組織進行侵染;所述重組農桿菌是將含有目的基因的重組表達載體導入出發農桿菌得到的;
(4)完成步驟(A)後,取所述胚性愈傷組織,進行幹化處理;
(5)完成步驟(4)後,取所述胚性愈傷組織,置於共培養基,共培養;所述共培養基中含有0.8~1.2mg/L 2,4-D、0.4~0.6mg 6-BA、30~40g/L蔗糖和40~60mg/L乙醯丁香酮;
(6)完成步驟(5)後,取所述胚性愈傷組織,依次置於一次篩選培養基、二次篩選培養基和三次篩選培養基上進行培養,獲得抗性愈傷組織;所述一次篩選培養基中含有2,4-D 0.8~1.2mg/L、蔗糖30~40g/L、特美汀120~180mg/L和潮黴素15~25mg/L;所述二次篩選培養基中含有2,4-D 0.8~1.2mg/L、蔗糖30~40g/L、特美汀120~180mg/L和潮黴素20~30mg/L;所述三次篩選培養基中含有2,4-D 0.8~1.2mg/L、蔗糖30~40g/L、特美汀120~180mg/L和潮黴素25~35mg/L;
(7)完成步驟(6)後,取所述抗性愈傷組織,置於分化培養基乙進行培養,獲得分化苗;所述分化培養基乙中含有6-BA 0.8~1.2mg/L、玉米素0.15~0.25mg/L和蔗糖30~40g、特美汀120~180mg/L和潮黴素15~25mg/L;
(8)完成步驟(7)後,取所述分化苗,依次置於生根培養基乙和生根培養基丙培養,獲得轉基因苗;所述生根培養基乙中含有蔗糖20~30g/L、特美汀120~180mg/L和潮黴素25~35mg/L;所述生根培養基丙中含有蔗糖20~30g/L、特美汀120~180mg/L和潮黴素45~55mg/L。
所述誘導培養基具體可為含有3mg/L的2,4-D、35g/L的蔗糖和0.5g/L的水解酪蛋白的MS固體培養基。
所述繼代培養基具體可為含有1.0mg/L的2,4-D、35g/L的蔗糖和0.5mg/L的6-苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)的MS固體培養基。
所述共培養基可為向侵染培養基中加入瓊脂,至其濃度為6~8g/L,得到的培養基。
所述共培養基可為向侵染培養基中加入瓊脂,至其濃度為7g/L,得到的培養基。
每1L所述侵染培養基的溶質具體可為:NH4NO3 1650mg、KNO3 1900mg、KH2PO4170mg、MgSO4·7H2O 370mg、CaCl2·2H2O 440mg、FeSO4·7H2O 27.80mg、Na2EDTA 37.30mg、MnSO4·4H2O 22.30mg、ZnSO4·7H2O 8.60mg、H3BO3 6.20mg、KI 0.83mg、Na2MOO4·2H2O0.25mg、CuSO4·5H2O 0.025mg、COCl2·6H2O 0.025mg、肌醇100.00mg、VB10.1mg、VB60.5mg、煙酸0.5mg、甘氨酸2.0mg、2,4-D 1.0mg、6-BA 0.5mg、蔗糖35g和乙醯丁香酮50mg,所述侵染培養基的溶劑為水,所述侵染培養基的pH值為5.1~5.3(如5.1、5.2或5.3)。
所述一次篩選培養基具體可為含有1.0mg/L的2,4-D、35g/L的蔗糖、150mg/L的特美汀和20mg/L的潮黴素的MS固體培養基。
所述二次篩選培養基具體可為含有1.0mg/L的2,4-D、35g/L的蔗糖、150mg/L的特美汀和25mg/L的潮黴素的MS固體培養基。
所述三次篩選培養基具體可為含有1.0mg/L的2,4-D、35g/L的蔗糖、150mg/L的特美汀和30mg/L的潮黴素的MS固體培養基。
所述分化培養基乙具體可為含有1.0mg/L的6-BA、0.2mg/L的ZT和35g/L的蔗糖、150mg/L的特美汀和20mg/L的潮黴素的MS固體培養基。
所述生根培養基乙具體可為含有25g/L的蔗糖、150mg/L的特美汀和30mg/L的潮黴素的1/2MS固體培養基。
所述生根培養基丙具體可為含有25g/L的蔗糖和50mg/L的潮黴素的1/2MS固體培養基。
所述步驟(1)中,所述培養的條件為:25℃~28℃(如25℃、26℃、27℃或28℃),暗培養4~5周(如4周或5周)。所述異花授粉植物的幼穗為發育至1.5~2.5cm(如1.5cm、2cm或2.5cm)的幼穗。所述節段的長度為0.2~0.4cm(如0.2cm、0.3cm或0.4cm)。
所述步驟(2)中,所述培養的條件為:25℃~28℃(如25℃、26℃、27℃或28℃),暗培養9~12周(如9周、10周、11周或12周)。
所述步驟(A)中,所述「侵染」的方法可如下:將侵染菌液滴在所述胚性愈傷組織的表面,然後真空處理5~15min(如5min、10min或15min);所述侵染菌液為重組農桿菌菌懸液。所述真空可為0.4~0.6個大氣壓。所述侵染菌液的製備方法為:將所述重組農桿菌懸浮於所述侵染培養基。所述侵染菌液的OD600nm值為0.4~0.6。
所述步驟(4)中,所述「幹化處理」的方法可如下:將所述胚性愈傷組織置於無菌條件下乾燥培養。所述「幹化處理」的方法具體可為將所述胚性愈傷組織移至鋪有無菌濾紙的無菌培養皿中,在超淨工作檯處理一天。
所述步驟(5)中,所述培養的條件為:25℃~27℃(如25℃、26℃或27℃),暗培養3~4天(如3天或4天)。
所述步驟(6)中,所述培養的條件為:25℃~28℃(如25℃、26℃、27℃或28℃),光暗交替培養8~10周(如8周、9周或10周)。
所述步驟(7)中,所述培養的條件為:25℃~28℃(如25℃、26℃、27℃或28℃),光暗交替培養6~8周(如6周、7周或8周)。
所述步驟(8)中,所述培養的條件為:25℃~28℃(如25℃、26℃、27℃或28℃),光暗交替培養4~7周(如4周、5周、6周或7周)。通過上述遺傳轉化方法獲得的轉基因苗,均以同一基因型材料進行的遺傳轉化。
為解決上述技術問題,本發明還提供了用於異花授粉植物離體再生的試劑盒甲或用於異花授粉植物遺傳轉化的試劑盒乙。
所述試劑盒甲含有所述誘導培養基和/或所述繼代培養基和/或所述分化培養基甲和/或所述生根培養基甲。
所述試劑盒乙含有所述誘導培養基和/或所述繼代培養基和/或所述共培養基和/或所述一次篩選培養基和/或所述二次篩選培養基和/或所述三次篩選培養基和/或所述分化培養基乙和/或所述生根培養基乙和/或所述生根培養基丙。
上述任一所述異花授粉植物可為單子葉異花授粉植物。所述單子葉異花授粉植物具體可為野大麥。
為解決上述技術問題,本發明還提供了一種植物的遺傳轉化方法。
本發明所提供的植物的遺傳轉化方法,包括步驟(a1)或(a2):
(a1)將侵染菌液滴在植物愈傷組織表面;
(a2)將所述侵染菌液滴在植物愈傷組織表面,幹化處理。
所述侵染菌液為重組農桿菌菌懸液;所述重組農桿菌通過將含有目的基因的重組表達載體導入出發農桿菌得到。
上述植物的遺傳轉化方法中,所述愈傷組織可為胚性愈傷組織。
所述步驟(a1)中,所述「將侵染菌液滴在植物愈傷組織表面」還包括真空處理5~15min的步驟(如5min、10min或15min)。所述真空可為0.4~0.6個大氣壓。
所述步驟(a2)中,所述「幹化處理」的方法可如下:將所述植物愈傷組織置於無菌條件下乾燥培養。所述「幹化處理」的方法具體可為將所述植物愈傷組織移至鋪有無菌濾紙的無菌培養皿中,在超淨工作檯處理一天。
上述植物的遺傳轉化方法中,所述植物可為異花授粉植物。所述異花授粉植物可為單子葉異花授粉植物。所述單子葉異花授粉植物具體可為野大麥。
上文中,所述異花授粉植物幼穗的獲得方法為:將異花授粉植物種子播種於營養土培養,然後移栽大田,第二年從葉鞘中取幼穗。
上文中,所述光暗交替培養即光照培養和暗培養交替。光照培養時的光照強度為2000Lx。光暗交替培養的周期具體為:16小時光照培養/8小時黑暗培養。
上文中,所述MS固體培養基的製備方法可為:將NH4NO3 1650mg、KNO3 1900mg、KH2PO4 170mg、MgSO4·7H2O 370mg、CaCl2·2H2O 440mg、FeSO4·7H2O 27.80mg、Na2EDTA37.30mg、MnSO4·4H2O 22.30mg、ZnSO4·7H2O 8.60mg、H3BO3 6.20mg、KI 0.83mg、Na2MOO4·2H2O 0.25mg、CuSO4·5H2O 0.025mg、COCl2·6H2O 0.025mg、肌醇100.00mg、VB10.1mg、VB60.5mg、煙酸0.5mg、甘氨酸2.0mg和瓊脂7g溶於1L蒸餾水,調節pH至5.8。
上文中,所述1/2MS固體培養基的製備方法可為:將NH4NO3 825mg、KNO3 950mg、KH2PO4 85mg、MgSO4·7H2O 185mg、CaCl2·2H2O 220mg、FeSO4·7H2O 13.90mg、Na2EDTA18.65mg、MnSO4·4H2O 11.15mg、ZnSO4·7H2O 4.30mg、H3BO3 3.10mg、KI 0.415mg、Na2MOO4·2H2O 0.125mg、CuSO4·5H2O 0.0125mg、COCl2·6H2O 0.0125mg、肌醇50.00mg、VB10.05mg、VB60.25mg、煙酸0.25mg、甘氨酸1.0mg和瓊脂7g溶於1L蒸餾水,調節pH至5.8。
異花授粉植物,一般獲得的資源材料或品種均為混合基因型。而實驗證明,本發明所提供的異花授粉植物離體再生方法獲得的再生苗的基因型為同一基因型,利用該方法可篩選獲得同一基因型的異花授粉植物愈傷組織高頻再生系;通過該高頻再生系遺傳轉化異花授粉植物,具有以下兩方面的優點:一為每個獨立的轉化體屬於相同基因型,既有利於外源基因在轉基因株系中的表達分析,又有利於轉基因株系和親本對照株系間進行表型等方面的比較分析,對異花授粉植物來說十分必要;二為獲得轉基因株系的效率較高,該高頻再生系不僅是高轉化率的保障,而且能夠保存,以後可直接利用,省去篩選基因型的繁瑣程序,節省人力和物力。因此,本發明所提供的方法具有重要的應用價值。
附圖說明
圖1為離體再生的過程。
圖2為分子檢測結果。
圖3為GUS染色分析結果。
具體實施方式
下面結合具體實施方式對本發明進行進一步的詳細描述,給出的實施例僅為了闡明本發明,而不是為了限制本發明的範圍。
下述實施例中的實驗方法,如無特殊說明,均為常規方法。
下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑得到。
下述實施例中所用的培養基如下:
MS固體培養基:將NH4NO3 1650mg、KNO3 1900mg、KH2PO4 170mg、MgSO4·7H2O 370mg、CaCl2·2H2O 440mg、FeSO4·7H2O 27.80mg、Na2EDTA 37.30mg、MnSO4·4H2O 22.30mg、ZnSO4·7H2O 8.60mg、H3BO3 6.20mg、KI 0.83mg、Na2MOO4·2H2O 0.25mg、CuSO4·5H2O0.025mg、COCl2·6H2O 0.025mg、肌醇100.00mg、VB10.1mg、VB60.5mg、煙酸0.5mg、甘氨酸2.0mg和瓊脂7g溶於1L蒸餾水,調節pH至5.8。
1/2MS固體培養基:將NH4NO3 825mg、KNO3 950mg、KH2PO4 85mg、MgSO4·7H2O 185mg、CaCl2·2H2O 220mg、FeSO4·7H2O 13.90mg、Na2EDTA 18.65mg、MnSO4·4H2O 11.15mg、ZnSO4·7H2O 4.30mg、H3BO3 3.10mg、KI 0.415mg、Na2MOO4·2H2O 0.125mg、CuSO4·5H2O 0.0125mg、COCl2·6H2O 0.0125mg、肌醇50.00mg、VB10.05mg、VB60.25mg、煙酸0.25mg、甘氨酸1.0mg和瓊脂7g溶於1L蒸餾水,調節pH至5.8。
誘導培養基:含有3mg/L的2,4-D、35g/L的蔗糖和0.5g/L的水解酪蛋白的MS固體培養基。
繼代培養基:含有1.0mg/L的2,4-D、35g/L的蔗糖和0.5mg/L的6-苄氨基腺嘌呤(6-Benzylaminopurine,6-BA)的MS固體培養基。
分化培養基甲:含有1.0mg/L的6-BA、0.2mg/L的玉米素(Zeatin,ZT)和35g/L的蔗糖的MS固體培養基。
生根培養基甲:含有25g/L的蔗糖的1/2MS固體培養基。
LB抗性培養基:將10g胰蛋白腖、5g酵母膏、5g NaCl、1g D-葡萄糖、30mg利福平和100mg卡那黴素溶於1L蒸餾水,調節pH值至7.0。
侵染培養基:將NH4NO3 1650mg、KNO3 1900mg、KH2PO4 170mg、MgSO4·7H2O 370mg、CaCl2·2H2O 440mg、FeSO4·7H2O 27.80mg、Na2EDTA 37.30mg、MnSO4·4H2O 22.30mg、ZnSO4·7H2O 8.60mg、H3BO3 6.20mg、KI 0.83mg、Na2MOO4·2H2O 0.25mg、CuSO4·5H2O0.025mg、COCl2·6H2O 0.025mg、肌醇100.00mg、VB10.1mg、VB60.5mg、煙酸0.5mg、甘氨酸2.0mg、2,4-D 1.0mg、6-BA 0.5mg、蔗糖35g和乙醯丁香酮(Acetosyringone,As)50mg溶於1L蒸餾水,調節pH至5.2。
共培養基:向侵染培養基中加入瓊脂,至其濃度為7g/L,得到的培養基。
一次篩選培養基:含有1.0mg/L的2,4-D、35g/L的蔗糖、150mg/L的特美汀和20mg/L的潮黴素的MS固體培養基。
二次篩選培養基:含有1.0mg/L的2,4-D、35g/L的蔗糖、150mg/L的特美汀和25mg/L的潮黴素的MS固體培養基。
三次篩選培養基:含有1.0mg/L的2,4-D、35g/L的蔗糖、150mg/L的特美汀和30mg/L的潮黴素的MS固體培養基。
分化培養基乙:含有1.0mg/L的6-BA、0.2mg/L的ZT和35g/L的蔗糖、150mg/L的特美汀和20mg/L的潮黴素的MS固體培養基。
生根培養基乙:含有25g/L的蔗糖、150mg/L的特美汀和30mg/L的潮黴素的1/2MS固體培養基。
生根培養基丙:含有25g/L的蔗糖和50mg/L的潮黴素的1/2MS固體培養基。
質粒pTCK303記載於如下文獻中:Wang Z.,Chen C.B.,Xy Y.Y.,Jiang R.X.,Han Y.,Xu Z.H.,Chong K.A Practical Vector for Efficient Knockdown of Gene Expression in Rice(Oryza sativa L.).2004.Plant Molecular Biology Reporter22(4):409–417.
GUS反應混和液:溶質及其濃度為10mmol/L EDTA-Na2、0.5mmol/L K3Fe(CN)6、0.5mmol/L K4Fe(CN)6·3H2O、1mg/mL X-gluc和0.1%(體積百分比)TritonX-100,溶劑為蒸餾水;pH值為7.0。
實施例1、同一基因型的野大麥愈傷組織高頻再生系的獲得方法
野大麥為異花授粉植物,一般獲得的資源材料或品種均為混合基因型。由於不同基因型的組織培養再生能力和遺傳轉化效率均不同,因此提供同一基因型的野大麥愈傷組織高頻再生系對野大麥的組織培養或/和基因研究至關重要。
本發明提供的同一基因型的野大麥愈傷組織高頻再生系的獲得方法,是以野大麥單株幼穗為外植體。野大麥為多分櫱型禾本科植物,一個單株在抽穗期可同時抽出多個幼穗,為獲得同一基因型的野大麥愈傷組織高頻再生系提供了必要物質條件。
同一基因型的野大麥愈傷組織高頻再生系的獲得方法如下:
一、愈傷組織系(以下簡稱為愈傷系)的誘導
1、選取飽滿的野大麥種子,播種於溫室中盛有營養土的花盆,待野大麥幼苗長至兩葉一心期時,移栽入北京市農林科學院科研試驗田。移栽後的第二年,待野大麥返青後充足澆水,對野大麥單株進行編號(見圖1中(a)),一個單株即為一個系(即同一基因型的材料),一個系所有幼穗誘導出的全部愈傷組織為一個愈傷系。待幼穗發育至1.5~2.5cm時,用剪刀從野大麥基部將莖剪下,剝除外部的葉鞘,得到幼穗(見圖1中(b),為保證野大麥幼穗生長狀態較好,取幼穗前再次澆水)。
2、完成步驟1後,將幼穗置於超淨工作檯,先用70%(體積百分比)的乙醇水溶液擦洗表面,然後用無菌解剖針劃開內部的葉鞘,輕輕轉動幼穗結節處,抽出被包裹的幼穗,用無菌鑷子將該外植體截成0.2cm~0.4cm的節段,接種於誘導培養基上(接種時以係為單位,並編號),25℃暗培養5周,得到白色且結構不緊實的愈傷組織。
二、愈傷系的繼代
完成步驟一後,以係為單位統計愈傷誘導率(愈傷誘導率=產生愈傷組織的外植體數/接種的外植體總數×100%),將愈傷誘導率高於75%以上的愈傷系的愈傷組織接種於繼代培養基上,25℃暗培養12周(繼代期間每隔3周換一次新的繼代培養基),得到黃色且結構緊實的胚性愈傷組織(圖1中(c))和非胚性愈傷組織。
通過掃描電鏡觀察胚性愈傷組織,結果表明,胚性愈傷組織表面有許多未分化的胚性細胞團結構(圖1中(d)),而非胚性愈傷組織表面無此結構。
三、愈傷系的分化
完成步驟二後,以係為單位統計胚性愈傷率(胚性愈傷率=產生胚性愈傷組織數/接種的外植體總數×100%),將胚性愈傷率高於70%以上的愈傷系的胚性愈傷組織接種於分化培養基甲上,光暗交替培養6周(分化培養期間每隔3周換一次新的分化培養基甲),得到分化苗(圖1中(e))。其中光暗交替培養(即光照培養和暗培養交替)條件為:25℃。光照培養時的光照強度為2000Lx,光暗交替培養的周期具體為:16小時光照培養/8小時黑暗培養。
四、愈傷系的生根和再生苗的獲得
完成步驟二後,以係為單位統計分化率(分化率=分化出苗的愈傷組織數/接種於分化培養基上的愈傷組織數×100%),將分化率高於80%以上的愈傷系的分化苗轉入生根培養基甲進行光暗交替培養,待根長長至3cm以上時(培養時間約4~7周)即完成再生苗的生根,獲得健壯的再生苗(圖1中(f)、(g)和(h))。其中光暗交替培養(即光照培養和暗培養交替)條件為:25℃。光照培養時的光照強度為2000Lx,光暗交替培養的周期具體為:16小時光照培養/8小時黑暗培養。
五、移栽
取步驟四獲得健壯的再生苗,去掉封口膜煉苗,然後將再生苗從三角瓶中取出,洗去根上附著的生根培養基甲,移栽入預先高壓滅菌的蛭石和草炭土1﹕1(體積比)基質中於溫室中培養(圖1中(i)),前期注意保溼遮陰,3~5天後逐漸增加透光量,一周後可常規管理,幼苗移栽成活率達90%以上。
經過上述步驟,獲得了3個高頻再生愈傷系(高頻再生愈傷系指的是愈傷誘導率高於75%以上、胚性愈傷率高於70%以上和分化率在80%以上的單株幼穗所誘導出的愈傷組織總稱),分別命名為愈傷系S1、愈傷系S2和愈傷系S3,以係為單位統計3個高頻再生愈傷系的發生頻率,結果發生頻率均為10%(發生頻率=高頻再生愈傷係數/接種的單株數)。
實施例2、運用實施例1的同一基因型的野大麥愈傷組織高頻再生系建立野大麥遺傳轉化方法
一、獲得胚性愈傷組織
1、取愈傷系S1的野大麥的幼穗,剝除外部葉鞘並置於超淨工作檯,先用70%(體積百分比)的乙醇水溶液擦洗表面,然後用無菌解剖針劃開幼嫩的葉鞘,輕輕轉動幼穗結節處,抽出被包裹的幼穗並作為外植體,用無菌鑷子將該外植體截成0.2cm~0.4cm的節段,接種於誘導培養基上,25℃暗培養4周,得到白色且結構不緊實的愈傷組織。
2、完成步驟1後,將白色且結構不緊實的愈傷組織接種於繼代培養基上,25℃暗培養9周(繼代期間每隔3周換一次新的繼代培養基),得到黃色且結構緊實的胚性愈傷組織。
二、農桿菌侵染液的製備
1、採用電擊法將質粒pTCK303轉化根癌農桿菌GV3101,挑取重組農桿菌,將該重組農桿菌命名為GV3101/pTCK303。
2、將步驟1獲得的GV3101/pTCK303單克隆接種到LB抗性培養基,28℃、160rpm振蕩培養12h,得到培養菌液。將該培養菌液5000rpm、離心10min,收集的菌體用侵染培養基重懸,得到農桿菌侵染液。以侵染培養基的OD600nm為參照,調整農桿菌侵染液的OD600nm值至0.4~0.6。
三、侵染胚性愈傷組織
將胚性愈傷組織轉移至鋪有無菌濾紙的無菌培養皿,然後用農桿菌侵染液進行滴染轉化,以保證每塊胚性愈傷組織被農桿菌侵染液浸染,但又不浸泡於農桿菌侵染液中。滴染轉化的操作步驟具體為:用移液器將農桿菌侵染液滴在胚性愈傷組織的表面(多餘的農桿菌侵染液即由鋪在無菌培養皿中的無菌濾紙吸掉),然後抽真空(0.4~0.6個大氣壓)處理10min。
實驗重複三次,每次重複侵染胚性愈傷組織至少30個。
四、幹化處理
完成步驟三後,將胚性愈傷組織移至鋪有無菌濾紙的無菌培養皿中,幹化處理1d(目的是使後期愈傷組織不出現水漬化和褐變現象)。
五、共培養
完成步驟四後,將胚性愈傷組織置於鋪有一層無菌濾紙的共培養基上共培養3天。共培養條件:25~27℃,暗培養。
六、篩選培養
1、完成步驟五後,將胚性愈傷組織用先滅菌水充分洗滌(即清洗至洗滌後的滅菌水清亮),然後用含有200mg/L的特美汀和0.02%(體積百分比)Tween20的水溶液洗滌1次,最後置於一次篩選培養基上,光暗交替培養三周,得到抗性愈傷組織。
2、完成步驟1後,將抗性愈傷組織置於二次篩選培養基上,光暗交替培養三周。
3、完成步驟2後,將抗性愈傷組織置於三次篩選培養基上,光暗交替培養三周。
上述光暗交替培養(即光照培養和暗培養交替)的條件均為:25~26℃。光照培養時的光照強度為2000Lx,光暗交替培養的周期具體為:16小時光照培養/8小時黑暗培養。
七、分化培養
完成步驟六後,將抗性愈傷組織置於分化培養基乙,光暗交替培養6~8周(分化培養期間每隔3周換一次新的分化培養基乙),得到分化苗。其中光暗交替培養(即光照培養和暗培養交替)條件為:25~26℃。光照培養時的光照強度為2000Lx,光暗交替培養的周期具體為:16小時光照培養/8小時黑暗培養。
八、生根和壯苗篩選培養
完成步驟六後,將分化苗置於生根培養基乙進行光暗交替培養。待根長長至1cm時,剪去根,再置於生根培養基丙進行光暗交替培養,待根長長至3cm以上時(培養時間約為4~7周)即完成再生苗的生根,獲得健壯的再生苗,即擬轉基因抗性植株。其中光暗交替培養(即光照培養和暗培養交替)條件為:25℃。光照培養時的光照強度為2000Lx,光暗交替培養的周期具體為:16小時光照培養/8小時黑暗培養。
九、野生型野大麥的獲得
取愈傷系S1的野大麥的幼穗,將幼穗剝除外部葉鞘並置於超淨工作檯,先用70%(體積百分比)的乙醇水溶液擦洗表面,然後用無菌解剖針劃開幼嫩的葉鞘,輕輕轉動幼穗結節處,抽出被包裹的幼穗並作為外植體,用無菌鑷子將該外植體截成0.2cm~0.4cm的節段,接種於誘導培養基上,25℃暗培養4~5周,得到胚性愈傷組織。然後按照實施例1中步驟二至四的方法,獲得健壯的再生苗,將該再生苗命名為野生型野大麥(即通過正常再生程序而非通過遺傳轉化而來的再生苗)。
十、擬轉基因抗性植株的檢測
1、擬轉基因抗性植株的分子檢測
分別提取擬轉基因抗性植株的葉片和野生型野大麥的葉片的基因組DNA並作為模板,以引物對1進行PCR擴增;用水代替擬轉基因抗性植株的葉片的基因組DNA,作為陰性對照;用質粒pTCK303代替擬轉基因抗性植株的葉片的基因組DNA,作為陽性對照。引物對1由P1:5』-aaggaatcggtcaatacactacatgg-3』和P2:5』-aacagttcctgattaaccacaaacc-3』組成。
分別提取擬轉基因抗性植株的葉片和野生型野大麥的葉片基因組DNA並作為模板,以引物對2進行PCR擴增;用水代替擬轉基因抗性植株的葉片的基因組DNA,作為陰性對照;用質粒pTCK303代替擬轉基因抗性植株的葉片的基因組DNA,作為陽性對照。引物對2由F1:5』-AAGCCAGACAGAGTGTGATATCT-3』和F2:5』-AACATTACATTGACGCAGGTGAT-3』組成。
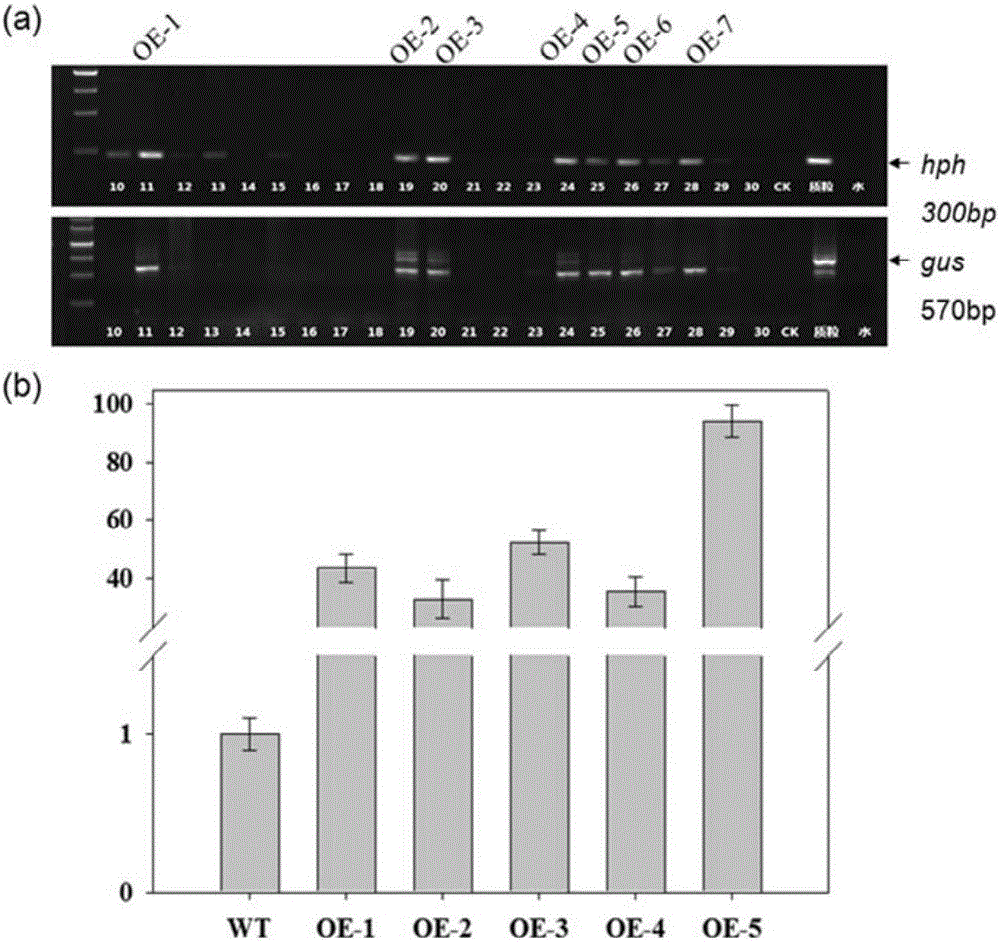
實驗結果見圖2中(a)(上圖為用引物對1進行PCR擴增的實驗結果,下圖為用引物對2進行PCR擴增的實驗結果,M為DNA Marker,泳道10至30為以擬轉基因抗性植株的葉片的基因組DNA為模板的實驗結果,CK為以野生型野大麥的葉片基因組DNA為模板的實驗結果,質粒為陽性對照,水為陰性對照)。如果擬轉基因抗性植株的基因組DNA用引物對1擴增出約300bp的條帶,同時用引物對2擴增出約570bp的條帶,則該擬轉基因抗性植株即為轉基因陽性植株;野生型野大麥和水用引物對1均不能擴增獲得300bp條帶,用引物對2均不能擴增出570bp條帶。結果表明,擬轉基因抗性植株中有七株為轉基因陽性植株,將其依次命名為OE-1~OE-7。
2、轉基因陽性植株的螢光定量PCR檢測
採用RNeasy Plant Mini試劑盒(QIAGEN公司產品)提取野生型野大麥、OE-1、OE-2、OE-3、OE-4或OE-5的總RNA並反轉錄為cDNA,並以此cDNA為模板,通過螢光定量PCR檢測GUS基因的相對表達量(以GAPDH基因為內參基因)。
鑑定GUS基因的引物為GUS-RT-F:5』-CTCCTACCGTACCTCGCATTAC-3』和GUS-RT-R:5』-ACGCGCTATCAGCTCTTTAATC-3』。
鑑定GAPDH基因的引物為GAPDH-RT-F:5』-TTTCGGAAGGATCGGGAG-3』和GAPDH-RT-R:5』-ACAGCCTTGGCAGCACCA-3』。
其中螢光定量PCR反應體系包括10μL SYBR Premix Ex Taq(TaKaRa公司產品)、正反向引物(10μM)各0.8μL,模板cDNA 3μL,ddH2O 5.4μL。PCR反應條件為:94℃預變性15min;94℃變性10s,60℃退火30s,72℃延伸30s,40個循環。
將野生型野大麥中GUS基因的相對表達量作為1,OE-1、OE-2、OE-3、OE-4和OE-5中GUS基因的相對表達量見圖2中(b)(其中WT為野生型野大麥)。OE-1、OE-2、OE-3、OE-4和OE-5中GUS基因的相對表達量分別為野生型野大麥中GUS基因的相對表達量的43倍、32倍、52倍、35倍和94倍。結果表明,GUS基因已成功整合到OE-1、OE-2、OE-3、OE-4和OE-5的基因組中並在轉錄水平上表達。
3、轉基因陽性植株的GUS染色分析
取野生型野大麥、非轉基因陽性植株、OE-1、OE-2、OE-3、OE-4或OE-5的葉片,將其充分浸沒在GUS反應混和液中,37℃溫育過夜,然後依次用50%乙醇水溶液、70%乙醇水溶液和100%乙醇溶液脫色,觀察葉片的染色情況。
實驗結果見圖3((a)中左為OE-4的葉片,右為野生型野大麥的葉片;(b)中左為OE-5的葉片,右為野生型野大麥的葉片;(c)為OE-1的葉片;(d)為OE-2的葉片;(e)為OE-3的葉片;(f)和(g)為非轉基因陽性植株的葉片;(h)為轉基因陽性植株的葉片(從左到右依次為OE-1、OE-2、OE-3、OE-4和OE-5);(i)為非轉基因陽性植株的葉片);(k)為轉基因陽性植株的葉鞘(從左到右依次為OE-1、OE-2、OE-3、OE-4和OE-5))。結果表明,OE-1、OE-2、OE-3、OE-4和OE-5的葉片和葉鞘經GUS染色後均可著色,且GUS染色強度與步驟2中的GUS基因的相對表達量基本一致。
根據GUS染色結果統計轉基因陽性植株的頻率,結果表明,按照本發明提供的遺傳轉化方法獲得的轉基因陽性植株的頻率約為5%。
