小麥抗白粉病相關蛋白TaEDS1‑D1及其編碼基因與應用的製作方法
2023-05-28 21:23:51 2
本發明屬於生物
技術領域:
,具體涉及一種小麥抗白粉病相關蛋白taeds1-d1及其編碼基因與應用。
背景技術:
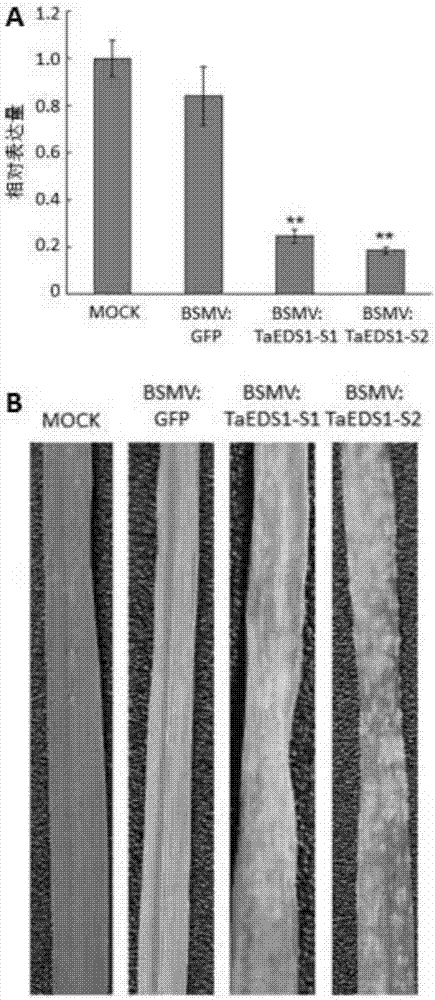
:小麥白粉病是由blumeriagraminisf.sp.tritici(bgt)引起的一種重要的真菌病害。小麥白粉病病菌可侵染小麥植株地上各個器官,但以危害葉片為主,嚴重時可侵染葉鞘、莖稈及穗部。白粉病主要影響葉片光合作用及植株的新陳代謝。發病較早、較重時導致植株不抽穗或抽出的穗短小,減少畝穗數、穗粒數和千粒重,一般可減產5%-10%,在嚴重流行年份,減產達30%以上(johnson,j.w.,baenziger,p.s.,yamazaki,w.t.,smith,r.t.effectsofpowderymildewonyieldandqualityofisogeniclinesof『chancellor』wheat,cropscience,1979,19(3):349-352.)。白粉病是小麥最嚴重的病害之一,在中國及世界各小麥生產國廣泛發生,這給白粉病的防治帶來非常大的困難和經濟成本。目前,對於小麥白粉病的防治仍以噴施化學農藥為主。雖然通過噴施農藥可在一定程度上減輕白粉病的危害,但是會帶來生產成本增加和環境汙染等問題。小麥白粉菌具有小種多、變異快、侵染時期長、氣流傳播、適應範圍廣等特點。新小種的出現常導致大批生產品種抗性的喪失。因此不斷培育和推廣抗病品種是減少病害損失最經濟、有效和環保的方法(莊巧生,中國小麥品種改良及系譜分析。北京。中國農業出版社,2003年第一版)。抗病基因的克隆與功能鑑定對於植物抗病分子機制的研究和進行分子抗病育種具有十分重要的意義。eds1(enhanceddiseasesusceptibility1)基因最初是parker等在篩選由prr(patternrecognitionreceptor)類基因介導的霜黴病敏感突變體過程中發現的(parker,j.e.,holub,e.b.,frost,l.n.,falk,a.,gunn,n.d.,anddaniels,m.j.characterizationofeds1,amutationinarabidopsissuppressingresistancetoperonosporaparasiticaspecifiedbyseveraldifferentrppgenes.plantcell,1996,8:2033-2046.)。後來,falk等通過轉座子標籤法克隆了該基因並證明該基因編碼一種酯酶(falk,a.,feys,b.j.,frost,l.n.,jones,j.d.,daniels,m.j.,andparker,j.e.eds1,anessentialcomponentofrgene-mediateddiseaseresistanceinarabidopsishashomologytoeukaryoticlipases.proc.natl.acad.sci.usa,1999,96:3292-3297.),並陸續證明eds1蛋白是抵禦活體和半活體寄生病原菌抗性的一種正調控因子(wiermer,m.,feys,b.j.,andparker,j.e.plantimmunity:theeds1regμlatorynode.currentopinioninplantbiology,2005,8:383-389.)。除了擬南芥以外,在其它雙子葉植物中也發現了eds1的同源基因,如菸草、番茄、葡萄、海島棉等。在單子葉植物玉米、水稻和大麥等植物中也發現了eds1類基因的存在。在小麥中該基因還未被克隆,因此在小麥中克隆eds1基因,並驗證其抗白粉病功能具有重要意義,可為培育小麥抗白粉病品種提供新的基因資源和抗源材料。技術實現要素:本發明的第一個目的是提供一種蛋白質。本發明提供的蛋白質,將其命名為taeds1-d1,是如下a)或b)或c)或d)的蛋白質:a)胺基酸序列是序列2所示的蛋白質;b)在序列2所示的蛋白質的n端和/或c端連接標籤得到的融合蛋白質;c)將序列2所示的胺基酸序列經過一個或幾個胺基酸殘基的取代和/或缺失和/或添加得到的具有相同功能的蛋白質;d)與序列2所示的胺基酸序列具有75%或75%以上的同源性且具有相同功能的蛋白質。其中,序列2由623個胺基酸殘基組成。為了使a)中的蛋白質便於純化,可在序列表中序列2所示的蛋白質的氨基末端或羧基末端連接上如表1所示的標籤。表1、標籤的序列標籤殘基序列poly-arg5-6(通常為5個)rrrrrpoly-his2-10(通常為6個)hhhhhhflag8dykddddkstrep-tagii8wshpqfekc-myc10eqkliseedl上述c)中的蛋白質,所述一個或幾個胺基酸殘基的取代和/或缺失和/或添加為不超過10個胺基酸殘基的取代和/或缺失和/或添加。上述c)中的蛋白質可人工合成,也可先合成其編碼基因,再進行生物表達得到。上述c)中的蛋白質的編碼基因可通過將序列1所示的dna序列中缺失一個或幾個胺基酸殘基的密碼子,和/或進行一個或幾個鹼基對的錯義突變,和/或在其5′端和/或3′端連上表1所示的標籤的編碼序列得到。上述d)中,「同源性」包括與本發明的序列2所示的胺基酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同源性的胺基酸序列。本發明的第二個目的是提供與taeds1-d1蛋白質相關的生物材料。本發明提供的與taeds1-d1蛋白質相關的生物材料為下述a1)至a12)中的任一種:a1)編碼taeds1-d1蛋白質的核酸分子;a2)含有a1)所述核酸分子的表達盒;a3)含有a1)所述核酸分子的重組載體;a4)含有a2)所述表達盒的重組載體;a5)含有a1)所述核酸分子的重組微生物;a6)含有a2)所述表達盒的重組微生物;a7)含有a3)所述重組載體的重組微生物;a8)含有a4)所述重組載體的重組微生物;a9)含有a1)所述核酸分子的轉基因植物細胞系;a10)含有a2)所述表達盒的轉基因植物細胞系;a11)含有a3)所述重組載體的轉基因植物細胞系;a12)含有a4)所述重組載體的轉基因植物細胞系。上述生物材料中,a1)所述核酸分子為如下1)或2)或3)所示的基因:1)其編碼序列是序列1所示的cdna分子或序列3所示的dna分子;2)與1)限定的核苷酸序列具有75%或75%以上同一性,且編碼taeds1-d1蛋白質的cdna分子或基因組dna分子;3)在嚴格條件下與1)或2)限定的核苷酸序列雜交,且編碼taeds1-d1蛋白質的cdna分子或基因組dna分子。其中,所述核酸分子可以是dna,如cdna、基因組dna或重組dna;所述核酸分子也可以是rna,如mrna或hnrna等。其中,序列1由1872個核苷酸組成,編碼序列2所示的胺基酸序列。本領域普通技術人員可以很容易地採用已知的方法,例如定向進化和點突變的方法,對本發明的編碼taeds1-d1的核苷酸序列進行突變。那些經過人工修飾的,具有編碼taeds1-d1的核苷酸序列75%或者更高同一性的核苷酸,只要編碼taeds1-d1且具有相同功能,均是衍生於本發明的核苷酸序列並且等同於本發明的序列。這裡使用的術語「同一性」指與天然核酸序列的序列相似性。「同一性」包括與本發明的編碼序列2所示的胺基酸序列組成的蛋白質的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或計算機軟體進行評價。使用計算機軟體,兩個或多個序列之間的同一性可以用百分比(%)表示,其可以用來評價相關序列之間的同一性。上述75%或75%以上同一性,可為80%、85%、90%或95%以上的同一性。上述生物材料中,所述載體可為質粒、黏粒、噬菌體或病毒載體。上述生物材料中,所述微生物可為酵母、細菌、藻或真菌,如農桿菌。上述生物材料中,所述轉基因植物細胞系、轉基因植物組織和轉基因植物器官均不包括繁殖材料。本發明的第三個目的是提供taeds1-d1蛋白質或上述相關生物材料的新用途。本發明提供了taeds1-d1蛋白質或上述相關生物材料在調控植物白粉病抗性中的應用。本發明還提供了taeds1-d1蛋白質或上述相關生物材料在培育白粉病抗性降低的轉基因植物中的應用。本發明還提供了taeds1-d1蛋白質或上述相關生物材料在培育白粉病抗性提高的轉基因植物中的應用。本發明的第四個目的是提供一種培育白粉病抗性降低的轉基因植物的方法。本發明提供的培育白粉病抗性降低的轉基因植物的方法包括將抑制taeds1-d1蛋白質表達的物質導入受體植物中,得到轉基因植物的步驟;所述轉基因植物的白粉病抗性低於所述受體植物。上述方法中,所述抑制權利要求1所述的蛋白質表達的物質為如下a)或b):a)bsmv病毒載體α、bsmv病毒載體β和含有序列1自5'端第1142-1433位所示的dna分子的bsmv病毒載體γ;b)bsmv病毒載體α、bsmv病毒載體β和含有序列1自5'端第1539-1792位所示的dna分子的bsmv病毒載體γ。上述方法中,所述轉基因植物的白粉病抗性低於所述受體植物具體體現在轉基因植物的白粉菌孢子堆比受體植物多。本發明的第五個目的是提供抑制taeds1-d1蛋白質表達的物質。本發明提供的抑制taeds1-d1蛋白質表達的物質為如下a)或b):a)bsmv病毒載體α、bsmv病毒載體β和含有序列1自5'端第1142-1433位所示的dna分子的bsmv病毒載體γ;b)bsmv病毒載體α、bsmv病毒載體β和含有序列1自5'端第1539-1792位所示的dna分子的bsmv病毒載體γ。本發明的第六個目的是提供一種培育白粉病抗性提高的轉基因植物的方法。本發明提供的培育白粉病抗性提高的轉基因植物的方法包括提高受體植物中taeds1-d1蛋白質的表達量和/或活性,得到轉基因植物的步驟;所述轉基因植物的白粉病抗性高於所述受體植物。上述方法中,所述轉基因植物的白粉病抗性高於所述受體植物體現在如下a1)或a2):a1)轉基因植物的白粉病菌的吸器指數低於受體植物;a2)轉基因植物的白粉病菌的分生孢子數低於受體植物。上述方法中,所述提高受體植物中taeds1-d1蛋白質的表達量和/或活性的方法為在受體植物中過表達taeds1-d1蛋白質;所述過表達的方法為將所述taeds1-d1蛋白質的編碼基因導入受體植物;所述taeds1-d1蛋白質的編碼基因的核苷酸序列是序列1所示的dna分子。在本發明的具體實施例中,所述taeds1-d1蛋白質的編碼基因是通過pegad-taeds1-d1導入受體植物中,所述pegad-taeds1-d1為將序列1所示的taeds1-d1基因編碼區全長cdna序列插入載體pegad的agei和xmai的酶切識別位點之間,且保持pegad載體其它序列不變的重組載體。上述方法中,所述受體植物為單子葉植物或雙子葉植物。所述單子葉植物可為小麥,具體為小麥品種山疙瘩;所述雙子葉植物可為擬南芥,具體為擬南芥突變體eds1。上述方法中,所述轉基因植物理解為不僅包含將所述taeds1-d1基因轉化目的植物得到的第一代轉基因植物,也包括其子代。對於轉基因植物,可以在該物種中繁殖該基因,也可用常規育種技術將該基因轉移進入相同物種的其它品種,特別包括商業品種中。所述轉基因植物包括種子、愈傷組織、完整植株和細胞。本發明從小麥農家品種山疙瘩中克隆到eds1基因,將其命名為taeds1-d1基因,並構建了用於沉默小麥中taeds1-d1基因的病毒誘導性載體和過表達taeds1-d1基因的pegad-taeds1-d1載體,分別得到沉默taeds1-d1小麥和轉taeds1-d1擬南芥。通過試驗證明:沉默taeds1-d1小麥接種白粉病菌後,小麥葉片上出現明顯的白粉病孢子堆,反應型為3-4級;轉taeds1-d1小麥中過表達的taeds1-d1基因可以互補部分擬南芥eds1基因的功能,使擬南芥突變體eds1植株由感白粉病轉為抗白粉病。由此證明小麥中的taeds1-d1基因具有抗白粉病的功能。附圖說明圖1為taeds1基因與大麥條紋花葉病毒(bsmv)重組載體的結構示意圖。分別將taeds1基因的沉默片段taeds1-s1和taeds1-s2反向插入γ鏈的限制性內切酶nhei酶切位點,分別構建得到taeds1-d1基因的兩個bsmv-vigs載體系統bsmv:taeds1-s1和bsmv:taeds1-s2,α和β鏈與重組載體bsmv:gf則共同構成gfp載體系統bsmv:gfp。圖2為bsmv-vigs的抗白粉病普通小麥地方品種山疙瘩植株中taeds1基因的相對表達量及接種白粉病菌系e18後的葉片表型。a.taeds1基因的相對表達量,說明沉默片段s1和s2均可極顯著下調taeds1基因的表達(「**」代表p≤0.01);b.接種白粉病菌系e18後的葉片表型,說明下調taeds1基因表達的山疙瘩植株失去對白粉病菌系e18的抗性,表現為感病(反應型為3~4級)。其中,mock:模擬接種的空白對照植株;bsmv:gfp:轉gfp基因的負對照植株;bsmv:taeds1-s1和bsmv:taeds1-s2分別代表利用沉默片段s1和s2下調taeds1基因表達的植株。圖3為載體pjit166-taeds1-d1的結構示意圖。taeds1-d1基因通過限制性內切酶ncoi和xmai(與smai是同尾酶)切割與載體pjit166連接。圖4為瞬時表達taeds1-d1基因的感白粉病普通小麥品種chancellor葉片表皮細胞接種白粉菌菌系e18後的吸器形成及吸器指數變化。a.共表達taeds1-d1基因和gus基因的抗病細胞,箭頭指示附著在細胞表面未萌發的分生孢子;b.只表達gus基因的感病細胞,箭頭指示白粉菌分生孢子萌發形成的吸器;c.瞬時表達taeds1-d1基因對吸器指數的影響。說明共表達taeds1-d1基因和gus基因細胞(gus+taeds1-d1)的吸器指數較只表達gus基因(gus)細胞的吸器指數顯著降低。圖5為載體pegad-taeds1-d1的結構示意圖。taeds1-d1基因通過限制性內切酶agei和xmai(與smai是同尾酶)切割與載體pegad連接。圖6為taeds1-d1基因在轉基因擬南芥突變體eds1中的表達及其對白粉病抗性的影響。a.taeds1-d1基因在轉基因擬南芥突變體eds1中的表達;b.taeds1-d1基因在擬南芥突變體eds1中表達對白粉病(大量接菌)抗性的影響,說明陽性轉taeds1-d1基因擬南芥植株葉片(eds1-taeds1-d1)對白粉病的抗性較受體植株(eds1)明顯增強,接近於野生型(ws);c.大量接菌條件下,taeds1-d1基因在擬南芥突變體eds1中表達對白粉病菌生長的影響,說明陽性轉taeds1-d1基因擬南芥植株(eds1-taeds1-d1)葉片組織中的白粉病菌絲和分生孢子較受體(eds1)明顯減少;c.擬南芥突變體eds1和陽性轉taeds1-d1基因擬南芥植株(eds1-taeds1-d1)少量接種白粉菌3天後分生孢子與受體植株(eds1)及野生型(ws)的比較。說明陽性轉taeds1-d1基因擬南芥植株(eds1-taeds1-d1)每菌落分生孢子數較擬南芥突變體eds1極顯著降低(p≤0.01)。具體實施方式下述實施例中所使用的實驗方法如無特殊說明,均為常規方法。下述實施例中所用的材料、試劑等,如無特殊說明,均可從商業途徑獲得。下述實施例中的定量實驗,均設置3次重複,結果取平均值。下述實施例中的pgem-teasyvector載體為promega公司的產品,貨號為a1360。下述實施例中的bsmv-vigs病毒載體(包括α、β和γ質粒)和gfp(bsmv:gfp)質粒在文獻「holzbergs.,brosiop.,grossc.,pogueg.barleystripemosaicvirus-inducedgenesilencinginamonocotplant.plantj.,2002,30:315-327.」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的白粉菌golovinomycescichoracearum(ucsc1)在文獻「張海泉,馬淑琴。34份粗山羊草抗白粉病性鑑定及遺傳分析。植物保護,2008,34(2):37-40。」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的小麥品種chancellor(triticumaestivumvar.chancellor)在文獻「翟雯雯,段霞瑜,周益林,馬慧乾。我國小麥地方品種螞蚱麥、小白冬麥、遊白蘭、紅卷芒抗白粉病性遺傳分析。植物保護,2008,1:37-40。」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的載體pjit166和pjit166-gus在文獻「frederica.,carolel.t.,carstenl.,niuy.,wangd.w.,andrewj.m.virusinductionofheatshockprotein70reflectsageneralresponsetoproteinaccumulationintheplantcytosol.plantphysiology,2005,138:529-536.」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的載體pegad載體在馬毅的碩士學位論文「擬南芥akin11基因的克隆、定位以及功能分析。湖南大學,2007。」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的小麥品種山疙瘩(triticumaestivumvar.shangeda)在文獻「薛飛,段霞瑜,周益林,吉萬全。部分小麥農家品種抗白粉病基因推導與遺傳多樣性分析。麥類作物學報,2009,29(2):228-235。」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的擬南芥野生型(ws型)和擬南芥突變體eds1均在文獻「parkerj.e.,holube.b.,frostl.n.,falka.,gunnn.d.,anddanielsm.j.characterizationofeds1,amutationinarabidopsissuppressingresistancetoperonosporaparasiticaspecifiedbyseveraldifferentrppgenes.plantcell,1996,8:2033-2046.」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的gkpbuffer含有50mm甘氨酸(glycine)、30mmk2hpo4(ph9.2)、1%(質量百分比)膨潤土(bentonite)和1%(質量百分比)硅藻土(celite)。下述實施例中的白粉病菌系e18在文獻「huashi,qiujingshen,yipingqi,haojieyan,haozhennie,yongfangchen,tingzhao,fumiakikatagiri,anddingzhongtang.br-signalingkinase1physicallyassociateswithflagellinsensing2andregulatesplantinnateimmunityinarabidopsis.theplantcell,2013,25:1143–1157.」中公開過。公眾可從中國科學院遺傳與發育生物學研究所獲得。下述實施例中的重組載體bsmv:gfp(holzbergs.,brosiop.,grossc.,pogueg.barleystripemosaicvirus-inducedgenesilencinginamonocotplant.plantj.,2002,30:315-327.),公眾可從中國科學院遺傳與發育生物學研究所獲得。實施例一、小麥taeds1-d1基因的克隆與序列結構分析一、小麥taeds1-d1基因編碼區cdna和基因組dna序列的獲得1、小麥基因組dna和總rna的提取(1)小麥基因組dna的提取按照常規的ctab法提取小麥基因組dna。具體步驟如下:取約0.2g新鮮的7天齡山疙瘩幼苗葉片,在液氮中研磨成精細的粉末,轉移到滅菌的2ml離心管中。加入1.0mlctab提取緩衝液(1.3%ctab,133mmtris/hclph8.0,13mmedta,0.93mnacl,0.66%pvp3600,0.18mβ-巰基乙醇),混勻。65℃溫浴1.0h,其間不時混合樣品,以充分提取。待樣品冷卻至室溫,加入1ml氯仿/異戊醇(v/v=24:1),輕輕顛倒混勻1h。4℃,12000rpm離心15min,將上清液轉移至一新的離心管中,加入等體積氯仿/異戊醇(v/v=24:1)重新抽提一次。吸取上清液至一新離心管,加入3μlrnasea(10mg/ml),室溫下在搖床上消化45min。緩慢加入420μl異丙醇,輕輕上下搖動,直到出現白色dna沉澱。用槍頭挑出dna,用1mlwashⅰ(76%乙醇、200mmnaac)溶液浸泡、洗滌15min。瞬時離心,棄上清,用washⅱ(76%乙醇,10mmnh4ac)溶液浸泡、洗滌5min。瞬時離心,棄上清,吸乾殘餘液體,將dna沉澱室溫吹乾至透明。加入100μl滅菌水,待dna充分溶解後,測定dna濃度和質量。(2)小麥總rna的提取及cdna的獲得採用trizol試劑按常規方法提取普通小麥農家品種山疙瘩(triticumaestivumvar.shangeda,高抗白粉病)的總rna,並利用常規反轉錄方法對獲得的山疙瘩總rna進行反轉錄,獲得cdna。trizol試劑購自invitrogen公司(貨號:15596-018),提取材料為山疙瘩7天齡幼苗的葉片,具體的提取操作程序和條件按產品說明書進行。反轉錄使用takara公司反轉錄試劑盒(貨號:rr047a),具體的操作程序和條件按試劑盒的說明書進行。2、taeds1-d1基因編碼區全長cdna和基因組dna序列的獲得(1)全長cdna的獲得以上述步驟1中獲得的cdna為模板,利用引物對taeds1-f和taeds1-r進行pcr擴增,得到pcr擴增產物。引物對taeds1-f和taeds1-r的核苷酸序列如下:taeds1-f:5'-atgccgatggacaccccgccgcc-3';taeds1-r:5'-ttacgaaggcacaagtctcgcgatg-3'。pcr反應體系:10×反轉錄緩衝液5.0μl,dntp4.0μl,taeds1-f(10μm)2.0μl,taeds1-r(10μm)2.0μl,cdna1.0μl,taq酶1.0μl(1.0u),最後用水補足至50.0μl。pcr反應條件:94℃1min;然後94℃30s,62℃30s,72℃2min,35個循環;最後72℃7min。將上述pcr擴增產物分離純化後連接到pgem-tvector(promega)載體上,得到重組質粒pgem-t-taeds1-d1,並對其進行測序。測序結果表明,pcr擴增得到大小為1872bp的dna序列即為普通小麥的一個eds1基因編碼區的全長cdna序列,將該基因命名為taeds1-d1。taeds1-d1的cdna序列即為序列表中的序列1。相應地將taeds1-d1基因編碼的蛋白命名為taeds1-d1蛋白。taeds1-d1蛋白由623個胺基酸殘基組成,其胺基酸序列即為序列表中的序列2。(2)基因組dna序列的獲得以步驟1獲得的基因組dna為模板,同樣利用引物對taeds1-f和taeds1-r進行pcr擴增。反應體系中除模板由cdna換成基因組dna外,其它成分和量均與cdna擴增相同,反應條件亦相同。將pcr擴增產物進行回收、克隆和測序。測序結果表明,pcr擴增得到大小為3149bp的dna序列,即為普通小麥的taeds1-d1基因編碼區的基因組序列,taeds1-d1基因編碼區的基因組dna序列為序列表中的序列3。二、小麥taeds1-d1基因的序列結構分析比較taeds1-d1基因編碼區的基因組dna序列與cdna序列,顯示taeds1-d1基因由3個外顯子和2個內含子組成。三、taeds1-d1基因的染色體定位在ensemblplants網站(http://plants.ensembl.org/hmmer/index.html)上比對證明taeds1-d1基因定位於小麥5al染色體臂上。實施例二、利用vigs技術驗證taeds1-d1基因的抗白粉病功能一、taeds1-d1基因沉默植株的獲得1、誘導taeds1-d1基因bsmv-vigs載體系統的構建(1)沉默序列的獲得1)沉默序列taeds1-s1的獲得以實施例1中製備的重組質粒pgem-t-taeds1-d1為模板,利用引物對taeds1-s1f和taeds1-s1r進行pcr擴增,得到大小為292bp的pcr擴增產物(對應於序列1自5』端起第1142-1433位核苷酸序列),將其命名為沉默序列taeds1-s1。上述引物對taeds1-s1-f和taeds1-s1-r的核苷酸序列如下(下劃線所示序列為限制性內切酶nhei的酶切識別位點):taeds1-s1-f:5'-tacgctagcgtggccttgaactgag-3';taeds1-s1-r:5'-tacgctagctctggaagctcacgcc-3'。2)沉默序列taeds1-s2的獲得以實施例一中製備的重組質粒pgem-t-taeds1-d1為模板,利用引物對taeds1-s2-f和taeds1-s2-r進行pcr擴增,得到大小為254bp(序列1自5』末端起第1539-1792位核苷酸的序列)的pcr擴增產物,將其命名為沉默序列taeds1-s2。上述引物對taeds1-s2-f和taeds1-s2-r的核苷酸序列如下(下劃線所示序列為限制性內切酶nhei的酶切識別位點):taeds1-s2-f:5'-tacgctagccaccggctcctacct-3';taeds1-s2-r:5'-tacgctagcagctgctcagaaacac-3'。(2)沉默載體的構建按照常規分子生物學方法,參見「顏子穎,王海林譯《精編分子生物學實驗指南》,2001,科學出版社」中介紹的方法構建沉默載體。具體操作步驟如下:1)γ-taeds1-s1沉默載體的構建將上述步驟(1)獲得的沉默序列taeds1-s1反向插入bsmv-vigs病毒載體γ的nhei酶切位點間,且保持bsmv-vigs病毒載體γ的其它序列不變,得到重組載體γ-taeds1-s1。以引物對taeds1-s1-f和γ-strain-p對重組載體γ-taeds1-s1進行pcr擴增和測序鑑定,陽性克隆即為將taeds1-d1基因編碼區cdna序列(序列表中的序列1)自5』末端起第1142-1433位核苷酸的序列按基因表達的相反方向插入bsmv-vigs病毒載體γ鏈的nhei酶切位點間,且保持bsmv-vigs病毒載體γ的其它序列不變,得到的載體。γ-strain-p引物序列如下:5'-caactgccaatcgtgagtagg-3'。2)γ-taeds1-s2沉默載體的構建將上述步驟(1)獲得的沉默序列taeds1-s2反向插入bsmv-vigs病毒載體γ的nhei酶切位點間,且保持bsmv-vigs病毒載體γ的其它序列不變,得到重組載體γ-taeds1-s2。以引物對taeds1-s2-f和γ-strain-p對重組載體γ-taeds1-s2進行pcr擴增和測序鑑定,陽性克隆為將序列表中的序列1自5』末端起第1539-1792位核苷酸的序列按基因表達的相反方向插入bsmv-vigs病毒載體γ的nhei酶切位點間,且保持bsmv-vigs病毒載體γ的其它序列不變得到的載體。(3)bsmv-vigs載體系統bsmv-vigs病毒載體α、β和γ-gfp載體共同構成病毒載體系統bsmv:gfp。bsmv-vigs病毒載體α、β和重組載體γ-taeds1-s1共同構成可沉默taeds1-d1基因的病毒沉默載體系統bsmv:taeds1-s1。bsmv-vigs系統載體α、β和重組載體γ-taeds1-s2共同構成可沉默taeds1-d1基因的病毒沉默載體系統bsmv:taeds1-s2。上述構建的大麥條紋花葉病毒誘導基因沉默(bsmv-vigs)的載體系統結構如圖1所示,分別為載體系統中α,β和γ鏈的結構。2、bsmv體外轉錄(1)載體的線性化用mlui酶切bsmv病毒載體α鏈、γ-gfp載體、重組載體γ-taeds1-s1和重組載體γ-taeds1-s2,用spei酶切bsmv病毒載體β鏈,分別得到線性化質粒。(2)以上述步驟(1)獲得的線性化質粒為模板進行體外轉錄,分別得到體外轉錄的bsmv病毒載體α、β、γ-gfp、γ-taeds1-s1和γ-taeds1-s2。體外轉錄反應按照ribomaxtmlargescalernaproductionsystem-t7(promega公司產品,貨號:p1300)說明書進行操作。轉錄反應體系和條件分別為:反應總體積20.0μl,包括線性化質粒6.5μl,5×transcriptionbuffer4.0μl,cap1.5μl(promega公司產品,貨號:p1718),rntppremix6.0μl,enzymemix2.0μl,37℃反應4h,轉錄產物置-70℃保存備用。3、bsmv接種將小麥山疙瘩播種於營養土中,待生長至二葉期,分別取8-10μlbsmv:taeds1-s1和bsmv:taeds1-s2重組病毒載體溶液塗抹接種於小麥山疙瘩平展的第二葉上,10min後用滅菌超純水噴施葉面,覆保鮮膜保溼24h。之後轉為22℃正常條件培養,分別得到轉bsmv:taeds1-s1植株和bsmv:taeds1-s2植株。同時,部分植株接種bsmv:gfp重組病毒載體溶液,得到轉bsmv:gfp植株,部分植株塗抹1×gkpbuffer,得到模擬接種植株。上述bsmv:taeds1-s1重組病毒載體溶液是將體外轉錄的bsmv-vigs載體α、β和γ-taeds1-s1經depc水稀釋3倍後等量混合,再加入等體積的2×gkpbuffer得到的溶液。上述bsmv:taeds1-s2重組病毒載體溶液是將體外轉錄的bsmv-vigs載體α、β和γ-taeds1-s2用depc水稀釋3倍後等體積混合,再加入等體積的2×gkpbuffer得到的溶液。上述bsmv:gfp重組病毒載體溶液是將體外轉錄的bsmv-vigs載體α、β和γ-gfp用depc水稀釋3倍後等量混合,再加入等體積的2×gkpbuffer得到的溶液。上述轉bsmv:taeds1-s1和bsmv:taeds1-s2的植株即為沉默taeds1-d1基因的小麥植株,轉bsmv:gfp的植株即為陰性對照植株,塗抹gkpbuffer的模擬接種植株即為空白對照植株。4、沉默taeds1-d1基因小麥的rt-pcr驗證bsmv-vigs系統沉默taeds1-d1基因效果的具體檢測方法如下:將上述步驟3獲得的轉bsmv:taeds1-s1和轉bsmv:taeds1-s2植株、轉bsmv:gfp植株及模擬接種植株(mock)在正常條件下培養10天後,取第三葉提取總rna,反轉錄後通過定量pcr檢測taeds1基因的相對表達量。設置actin為內參基因,相對表達量通過δδct法計算得到,由abi7500型螢光定量pcr儀自帶計算公式計算。檢測taeds1相對表達量的定量pcr引物對的核苷酸序列如下:rtaeds1-f:5'-ctggggacctcgtaccgc-3';rtaeds1-r:5'-gaaccatccaagtgcatcg-3';檢測內參基因taactin的引物對的核苷酸序列如下:actin-f:5'-caacgagctccgtgtcgca-3';actin-r:5'-gaggaagcgtgtatccctcatag-3'。taeds1基因的相對表達量的檢測結果如圖2a所示。從圖2a中可以看出,轉bsmv:taeds1-s1和轉bsmv:taeds1-s2植株中taeds1-d1基因的相對表達量較陰性對照植株(bsmv:gfp)和空白對照植株(mock)都極顯著地降低了,說明本實驗所選擇的兩個沉默序列taeds1-s1和taeds1-s2都是有效的。二、taeds1-d1基因沉默植株的白粉病抗性分析將有效沉默了taeds1-d1基因表達的植株(bsmv:taeds1-s1和bsmv:taeds1-s2)、陰性對照植株(bsmv:gfp),以及空白對照植株(mock)在第四葉展開後(約16天齡)接種白粉病菌菌系e18,接種14天後觀察第四葉發病情況。反應型鑑定按zhang(zhangh,luoh,etal.geneticstudyonstriperustresistanceofawheat-thinopyronintermediumsubstitutionline.[j]triticeaecrops2003,23(1):31-33)的六級分級標準:0級:免疫,葉片無病斑;0;級:近免疫,葉片出現過敏性壞死斑,無孢子堆;1級:高抗,葉片上有少量病斑(一般直徑小於1mm),菌絲層稀薄可見綠色葉面,偶見較大病斑,但仍透綠,產孢量極少;2級:中抗,葉片病斑較少(一般直徑小於1mm),但菌絲層較厚,不透綠,能產生一定量的孢子;3級:中感,葉片病斑較多(一般直徑大於1mm),菌絲層厚,產孢量大,但病斑不連片;4級:高感,葉片病斑多,菌絲層厚,病斑連片,產孢量大。結果如圖2b所示。模擬接種的空白對照植株(mock)的葉片沒有任何症狀,反應型為0級(免疫)。轉bsmv:gfp的陰性對照植株葉片可見明顯的病毒過敏反應(hr)斑,但沒有孢子產生,反應型為0;級。而taeds1基因沉默效果明顯的轉bsmv:taeds1-s1和轉bsmv:taeds1-s2植株沒有明顯的hr反應,出現大量的白粉病菌孢子堆,反應型為3-4級,呈感病表型。以上結果表明taeds1-d1基因表達量的降低使得小麥山疙瘩對白粉病菌菌系e18的抗性喪失,淪為感病。由此證明taeds1-d1是一個參與小麥抗白粉病反應過程的重要基因。實施例三、利用小麥葉片表皮細胞瞬時表達技術驗證taeds1-d1的功能小麥抗白粉病功能的發揮是單細胞的自主行為,並且白粉病菌只侵染寄主葉片的表皮細胞。因此,表皮細胞瞬時表達是驗證小麥抗白粉病基因功能的一項有效技術。將目標基因通過基因槍隨機導入到離體小麥葉片表皮細胞中,並同時共轉化一種報告基因來標記陽性轉化細胞,轉化後高密度接種白粉菌孢子,在單細胞水平上分析陽性細胞內抗病相關基因表達對白粉菌侵染的影響。具體實施步驟如下:1、小麥葉片表皮細胞瞬時表達載體構建1)以實施例1中製備的pgem-t-taeds1-d1質粒為模板,利用taeds1-d166-ncoi-f3和taeds1-d166-xmai-r2引物對進行pcr擴增,得到大小為1889bp的擴增產物,該序列含有taeds1-d1基因編碼區cdna全長序列(1872bp,如序列表中的序列1所示)。taeds1-d166-ncoi-f3和taeds1-d166-xmai-r2引物對的核苷酸序列如下(下劃線所示序列分別為ncoi和xmai的酶切識別位點):taeds1-166-ncoi-f3:5'-agtccatggctatgccgatggac-3';taeds1-166-xmai-r2:5'-tcacccgggttacgaaggcacaagtc-3'。2)用ncoi和xmai對步驟1)獲得的pcr擴增產物進行雙酶切,得到大小為1872bp的dna片段即為taeds1-d1基因編碼區cdna全長序列;用ncoi和xmai對載體pjit166進行雙酶切,得到載體大片段;將1872bp的cdna序列與載體大片段連接,得到重組載體pjit166-taeds1-d1,並對其進行測序驗證。正確的pjit166-taeds1-d1載體即為將完整的taeds1-d1基因編碼區cdna序列(序列表中序列1)插入pjit166載體的ncoi和xmai酶切位點之間,且保持pjit166載體的其它序列不變得到的載體,pjit166-taeds1-d1載體的結構圖如圖3所示。2、小麥葉片的基因槍轉化1)常規種植和培養感病小麥品種chancellor至7天齡,取幼苗第一片葉尖部,平鋪於苯板(1%瓊脂,滅菌,加入經過無菌過濾的苯並咪唑,至終濃度為85μm)中央,每板放5-7片葉子。2)稱取8.5毫克金粉(1.0μm,bio-rad公司)於1.5ml的離心管中,65℃烘乾4h。加入70%的乙醇水溶液,震蕩5min,靜置15min,離心2sec,棄上清;加入1.0ml無菌去離子水,震蕩2min,靜置1min,離心2sec,棄上清。重複3次;加入1.0ml50%(v/v)的甘油水溶液,震蕩充分混勻。置-20℃保存備用。3)取等摩爾的pjit166-gus質粒和pjit166-taeds1-d1質粒,共≤1.0μg,補無菌去離子水至5.0μl;取50.0μl製備好的金粉(使用前震蕩5min)加入混合好的質粒,震蕩3min,並邊震蕩邊逐滴加入50.0μl2.5mcacl2,再迅速加入20.0μl0.1m亞精胺,繼續震蕩3min,靜置1min,離心2sec,棄上清;加入140.0μl70%乙醇,震蕩混勻,離心2sec,棄上清;加入140.0μl100%乙醇,震蕩混勻,離心2sec,棄上清;加入15.0μl100%乙醇,震蕩混勻,置冰上備用。4)利用基因槍法(pds-100/hedeliverysystembio-red)轉化小麥葉片。將載體盤置於載體盤holder(購自bio-rad公司)中,再次震蕩混合上述金粉質粒混合物,輕輕塗於載體盤(購自bio-rad公司)上;將900psi可裂盤(購自bio-rad公司)放入螺旋頭上,旋緊,滴加異丙醇密封;將終止屏放入終止屏holder(購自bio-rad公司)上,倒置放入載體盤,旋緊固定旋鈕,置於基因槍內最上一層;將載有葉片的苯板放於託盤上,將託盤放在載體盤的下兩層;抽真空到27inch,轟擊葉片;將轟擊過的葉片排列整齊,用3m透氣膠帶封口,放入培養箱(白天22℃,16h,晚上18℃,8h)中培養4h,得到轉taeds1-d1基因的chancellor葉片。按照上述步驟1)-4)操作,分別將pjit166-gus載體和空pjit166載體共轉化離體小麥葉片表皮細胞中,分別獲得轉pjit166-gus載體的chancellor葉片和轉空pjit166載體的chancellor葉片作為對照。5)染色:培養48h後,將葉片放入15ml離心管中,倒入x-gluc染液,抽真空3次,每次5min,37℃放置24h。6)脫色:倒去染色液,儘量控幹染液。加入脫色液,室溫放置兩天。7)染菌:將葉片放入大量水中,浸泡清洗1h;用考馬斯亮藍染色幾秒鐘,清水衝洗兩次;將葉片置於載玻片上,用50%甘油固定,蓋上蓋玻片,鏡檢。8)統計:只統計被x-gulc染藍的細胞,對於有孢子附著,但是沒有吸器形成的細胞,記為抗病細胞;有明顯吸器形成的細胞記為感病細胞。按下列公式計算吸器指數:吸器指數=感病細胞/(感病細胞+抗病細胞)×100%。3、白粉病菌接種及吸器指數統計分別對轉taeds1-d1基因的chancellor葉片、轉pjit166-gus載體的chancellor葉片和轉空pjit166載體的chancellor葉片接種白粉病菌系e18。具體步驟如下:將上述轉基因葉片在苯板上培養4h,高密度接種白粉病菌系e18的分生孢子,繼續放入培養箱培養44h。將培養後的葉片放入15ml離心管中,加入x-gluc染液(0.1mna2hpo4/nah2po4,10mmna-edta,5mmk4fe[cn6],5mmk3fe[cn6],0.1%tritonx-100(v/v),20%甲醇(v/v),1g/lx-gluc,調至ph=7.0),抽真空3次,每次5min,37℃放置24h。棄乾淨染色液。加入脫色液(3倍儲液:50%甘油,25%乳酸,25%的ddh2o,使用前加入兩倍體積的100%乙醇),室溫放置48h。將葉片放入水中浸泡清洗1h;用考馬斯亮藍[0.6%(w/v)考馬斯亮藍(servabluer)溶於甲醇或乙醇中]染色幾秒鐘,清水衝洗兩次;將葉片置於載玻片上,用50%的甘油水溶液固定,加蓋玻片,鏡檢。統計被x-gluc染成藍色的細胞:有孢子附著,但沒有吸器形成的細胞記為抗病細胞,而有明顯吸器形成的細胞記為感病細胞,並按下列公式計算吸器指數:吸器指數=感病細胞/(感病細胞+抗病細胞)×100%。結果如圖4所示。圖4a為小麥葉片細胞瞬時表達實驗獲得的抗病細胞,箭頭為附著在細胞表面未萌發的白粉病菌系e18的分生孢子。圖4b為感病細胞,箭頭為白粉病菌系e18的分生孢子萌發形成的吸器。圖4c為吸器指數統計結果。由圖4c可見,瞬時表達taeds1-d1基因的感病小麥品種chancellor葉片表皮細胞(gus+taeds1-d1)的吸器指數(42.60%)較陰性對照細胞(gus)的吸器指數(63.92%)顯著降低。由此可見,taeds1-d1基因對白粉病菌的吸器形成具有明顯的抑制作用,說明taeds1-d1基因具有提高小麥抗白粉病的功能。實施例四、利用轉基因擬南芥驗證taeds1-d1基因的抗白粉病功能一、轉taeds1-d1基因擬南芥的獲得1、表達載體的構建(1)以實施例1中的pgem-t-taeds1-d1質粒為模板,利用eds1-agei-f和eds1-xmali-r引物對進行pcr擴增,得到pcr擴增產物。引物eds1-agei-f和eds1-xmali-r的核苷酸序列如下(下劃線序列分別為限制性內切酶agei和xmai的酶切識別位點):eds1-agei-f:5'-accggtatgccgatggacaccc-3';eds1-xmali-r:5'-tcacccgggttacgaaggcacaagtc-3'。上述pcr產物大小為1887bp的片段,該片段含有taeds1-d1基因編碼區全長cdna序列(1872bp,如序列表中的序列1所示)。(2)用限制性內切酶agei和xmai雙酶切上述pcr擴增片段(1887bp),得到酶切dna片段,即taeds1-d1基因編碼區全長cdna序列(1872bp,序列表中序列1)。同時用限制性內切酶agei和xmai雙酶切pegad載體(由美國加州大學林辰濤實驗室贈送),得到載體大片段。將上述酶切dna片段與載體大片段連接,得到重組質粒,命名為pegad-taeds1-d1(結構圖譜如圖5所示)。經測序表明,pegad-taeds1-d1即為將序列1所示的taeds1-d1基因編碼區全長cdna序列插入載體pegad的agei和xmai的酶切識別位點之間,且保持pegad載體其它序列不變的重組載體。2、農桿菌介導法轉化擬南芥(1)農桿菌轉化載體的構建採用液氮凍融法轉化農桿菌gv3101株系(由biovectorco.,ltd,質粒載體菌株細胞基因保藏中心購買,貨號為biovector008)。具體操作如下:取凍存的3管(eppendorf)感受態細胞系(每管200μl),融化後分別加入1μg重組質粒pegad-taeds1-d1,混勻後放置冰上20-30min,放入液氮中1min,轉入37℃(2-5min)融化後,加入1.0mllb液體培養基。28℃低速振蕩培養(150rpm)4-5h,10000rpm離心30sec,去上清。加入100μllb液體培養基,懸浮菌體後塗板(含50mg/ml卡那黴素,50mg/ml利福平),置28℃培養至轉化子長出。挑取單菌落進行pcr檢測,挑取陽性的單菌落接種於液體lb(含50mg/ml卡那黴素,50mg/ml利福平)中,28℃振蕩培養過夜。提取質粒,酶切,電泳檢測。取陽性克隆菌液700μl,加入等體積30%的甘油,置-70℃長期保存。(2)農桿菌介導法轉化擬南芥轉化受體材料為即將開花(約30天齡)的擬南芥突變體eds1。轉化前,將已授粉花以及莢果去掉,並把最上面的頂生花序去掉,只留下剛剛露白的小花。取步驟(1)獲得的陽性克隆於含抗生素的lb培養基中28℃活化1-2天。按1:100比例接入500mllb培養基中(kan+rip),振蕩培養至od600值0.8-1.5之間。室溫4000rpm離心8min,棄上清。將沉澱懸浮於相應體積的滲透培養基中,使od600值在0.8左右,即為轉化液。將種植有擬南芥的方盤倒置,使花序浸泡在轉化液中,3min後取出,用保鮮膜覆蓋,移到光照較弱處培養,第二天揭膜。培養3-4周後,收穫種子並在乾燥環境中存放1-2周。(3)轉化子的篩選篩選前先進行消毒,即用70%乙醇浸泡1分鐘,用無菌水洗3次。消毒後的種子均勻塗布在固體篩選培養基(ms+25%basta)表面。4℃低溫處理72h,移入22℃恆溫培養室,在16h光照/8h黑暗周期、光強2500lux條件下培養。由於只有含外源基因的轉基因種子才能在含有basta選擇培養基上萌發和生長,所以一般根據種子萌發和植株生長狀態即可初步判斷是否為轉化子。萌發後7-8天陽性苗為正常的綠色,並有較長的根系,而陰性苗則為較小的黃化苗,且基本不生根。陽性株移栽至花盆中繼續生長,成熟後分單株收穫種子(t1代)。收取的t1代種子分單株同樣在含basta選擇培養基上培養,觀察分離比例,挑取統計分離比符合3:1的轉基因系繼續繁殖,並分單株收穫t2代種子。t2代種子繼續播種於含basta選擇培養基上,從t3代的分離情況來推測t2代是否是純合株,即t3代不發生分離的t2代植株即為純合體。選取單拷貝插入的轉taeds1-d1基因擬南芥純合體家系進行後續研究。(4)轉基因植株的分子鑑定以轉基因植株基因組dna為模板,利用引物對taeds1-522f和taeds1-1275r進行pcr鑑定。引物對taeds1-522f和taeds1-1275r的核苷酸序列如下:taeds1-522f:5』-acagccattttgcgtgac-3』;taeds1-1275r:5』-ctcgttcagggacttgagggctt-3』。pcr反應條件為:94℃變性30sec、58℃退火30sec、72℃延伸60sec,擴增35個循環。由於小麥的taeds1-d1基因與擬南芥eds1基因同源性較低,所以只有在含有外源基因,即轉taeds1-d1基因擬南芥的陽性植株中才能夠擴增出相應的產物,而對照植株無任何擴增產物。二、轉taeds1-d1基因擬南芥的抗白粉病鑑定1、半定量rt-pcr檢測轉基因擬南芥中taeds1-d1基因的表達分別以擬南芥野生型(ws)、突變體eds1和陽性轉taeds1-d1基因擬南芥(eds1-taeds1-d1)的cdna為模板,利用taeds1-522f和taeds1-1275r引物對進行半定量rt-pcr擴增,檢測taeds1-d1的表達量。同時以擬南芥基因actin2作為內參,內參基因的擴增引物序列為actin2-f:5』-tcggtggttccattcttgct-3』和actin2-r:5』-gctttttaagcctttgatcttgagag-3』。對擴增產物進行1%瓊脂糖電泳分離和紫外分析,根據條帶亮度調節pcr擴增的上樣量,達到所有樣品亮度均一,並與內參基因actin2一致。設20、25、30和35梯度循環數來檢測pcr平臺期。選擇達到平臺期前的合適循環數擴增基因,上樣量與內參基因actin2一致,亮度的強弱即代表基因表達量的多少。rt-pcr檢測結果如圖6a所示,taeds1-d1基因在陽性轉taeds1-d1基因擬南芥(eds1-taeds1-d1)中具有較高的表達量,而在野生型ws和突變體eds1中沒有表達。2、轉taeds1-d1基因擬南芥白粉病抗性的大量接菌鑑定對生長4周左右(溫度為22℃,9h/15h光周期)的擬南芥野生型(ws)、突變體eds1和陽性轉taeds1-d1基因擬南芥(eds1-taeds1-d1)進行白粉菌g.cichoracearum(ucsc1)的大量接種,8天後觀察葉片表型。同時取部分葉片進行臺盼藍染色,觀察菌絲生長情況。臺盼藍染色步驟如下:所取葉片在酒精/乳粉/臺盼藍溶液(10ml水、20ml乙醇、10ml苯酚、10ml83%乳酸、10mg臺盼藍)中煮沸2min。水洗後加入水合三氯乙醛(2.5g/ml水)室溫放置4-5h。水洗,50%甘油浸泡,顯微鏡下觀察菌絲生長情況。大量接菌鑑定結果如圖6b所示。接種8天後,擬南芥野生型(ws)葉片上幾乎沒有白粉菌孢子出現,突變體eds1葉片上則有大量的白粉菌孢子堆出現,而轉taeds1-d1基因擬南芥株系(eds1-taeds1-d1)的葉片上與野生型擬南芥相似,僅有少量的白粉菌孢子堆。同時對葉片進行臺盼藍染色後,顯微鏡下觀察可見擬南芥野生型(ws)葉片上沒有白粉菌的分生孢子產生,甚至幾乎看不到菌絲生長。擬南芥突變體eds1葉片上則有大量的菌絲和分生孢子(無性繁殖的結構),而轉taeds1-d1基因擬南芥株系(eds1-taeds1-d1)的葉片上僅有較少的菌絲和少量的分生孢子(圖6c),與陰性對照植株(eds1)差異明顯。3、轉taeds1-d1擬南芥抗白粉病的微量接菌鑑定為定量描述轉taeds1-d1基因擬南芥對白粉病的抗性,在大量接菌實驗的基礎上進一步進行了微量接菌和單菌落分生孢子數統計。選取抗性好的轉taeds1-d1基因擬南芥株系與野生型(ws)和突變體eds1一同播種於恆溫培養箱中(溫度為22℃,9h/15h光周期),生長到28天時進行白粉菌g.cichoracearum(ucsc1)的微量接菌。5天後取葉片(每個樣品取30個葉片)進行臺盼藍染色(染色方法同大量接菌鑑定),顯微鏡下觀察並統計每個菌落的分生孢子數。統計結果如圖6d所示,野生型(ws)葉片上每個菌落的平均分生孢子數為14個,突變體eds1為103個,而轉taeds1-d1基因擬南芥的平均分生孢子數為22個。轉taeds1-d1基因擬南芥株系每菌落的平均分生孢子數較陰性對照突變體eds1呈極顯著減少。以上結果表明小麥taeds1-d1基因可以部分互補擬南芥eds1基因的功能,使擬南芥突變體eds1植株由感白粉病轉為抗白粉病。由此證明小麥的taeds1-d1基因具有抗白粉病的功能,在小麥抗病育種中有利用價值。序列表中國科學院遺傳與發育生物學研究所小麥抗白粉病相關蛋白taeds1-d1及其編碼基因與應用311872bpdna人工序列1atgccgatggacaccccgccgccgcgcggggcggcgctgtccgacgacgaccgcctcctc60gtcgcccactgcgccgcgctctccttcccctccgcctcccgctccccgccctccgccgcc120gccgcgtcctccgcctccttccaggcgcaccacgcgtcccacccctacccctgcgccgcc180ttcgtcttcccgcccacctggtccgccgccgcctggatgccttcctcccccgacgccggc240ggtcgcgcgccgttcggggacgcggaggtcgaccccgcgctcttcccgtcgctgcgcagc300gtcgggagcggcgtccccgcgcgcgccagcgccgccttcgtcgccgccttcagtggcctg360ctcgacggctcgccgctccagaccgaggtatctaaagcggtggcagaggagaaacgtgtc420gttttcacaggccattcgtctgggggctcaatagccacccttgccgccatatggtttctt480gagaactgcacaagacggggaagtgtcaatcaagcacagccattttgcgtgacctttggg540gcacctcttgttggcgataatgttttcaaccatgctgttagaagggagggctggtcacag600tgtattttgcatttcatcatgccactggacatcatcccacgaataccgctggcccccctt660tcatcctctagagaacaaattcagtctgttctggattggttatctcctcacagtccaaac720ttctcacctgttgggaattcgcttgttattccagagttttatgaaactttgttgagaagc780accctatctattgccagctacgaggcctgttctttcatgggatgcactagctcaatccta840ggaacgctgacttcctttattgagctatccccgtacagaccctgcgggacttaccttttc900ttgacaagtaccgatcaactgattattctcacaaactcagatgctgtattacagttgcta960ttttactgccttcaattggatccccaacaacaattgcttgatgccgccgccagaagttta1020agtgctcactgggaatatgaatcgattaagcaaagtgtgatgcaagagataggttgtgtg1080gattacctaagagcaatttcatcatcccttcctggtagacagatgaatgggacagcaatt1140ggtggccttgaactgagtaaggaagctatgctgagccttgctgctgctgcacaatgggag1200aagcaaagagagataaaccaagcaaagatagacgcaaactgcagtaaaattcaggaagcc1260ctcaagtccctgaacgagtacaaaagaacatgcgagctgcatgaagtgagctactatgat1320tccttcaagcttcagcgggaagtgcatgacttcaattcaaatgtacggaggctggaacta1380gccggcttttgggacgagataattgagatgttgcgaaggcgtgagcttccagacgcgttc1440gaagggcgagaagagtgggtgaacctggggacctcgtaccgccggctggttgagcccctg1500gacattgcaaactactacaggcattccaagaatgaggacaccggctcctacctctccaag1560ggcaggccgagacgttacaagtacacccagaaatggcgcgagcagtcgcaccgcatcccc1620ttgggttccagcctcgagtcgtgcttctgggcaatgtcggaggagctgcaggctgagatg1680atcaacggcaaatcattcgaggatctgaaagacagggtgggtaaactcgagagcgatgcg1740cttggatggttcacctcgggaaatcttggcagggatgtgtttctgagcagctcatccttt1800gtgatatggtggaagacactcccggagcagcacaggtccgcgtcttgcatcgcgagactt1860gtgccttcgtaa18722623prt人工序列2metprometaspthrproproproargglyalaalaleuseraspasp151015aspargleuleuvalalahiscysalaalaleuserpheproserala202530serargserproproseralaalaalaalaserseralaserphegln354045alahishisalaserhisprotyrprocysalaalaphevalphepro505560prothrtrpseralaalaalatrpmetproserserproaspalagly65707580glyargalapropheglyaspalagluvalaspproalaleuphepro859095serleuargservalglyserglyvalproalaargalaseralaala100105110phevalalaalapheserglyleuleuaspglyserproleuglnthr115120125gluvalserlysalavalalagluglulysargvalvalphethrgly130135140hisserserglyglyserilealathrleualaalailetrppheleu145150155160gluasncysthrargargglyservalasnglnalaglnprophecys165170175valthrpheglyalaproleuvalglyaspasnvalpheasnhisala180185190valargarggluglytrpserglncysileleuhispheilemetpro195200205leuaspileileproargileproleualaproleuserserserarg210215220gluglnileglnservalleuasptrpleuserprohisserproasn225230235240pheserprovalglyasnserleuvalileprogluphetyrgluthr245250255leuleuargserthrleuserilealasertyrglualacysserphe260265270metglycysthrserserileleuglythrleuthrserpheileglu275280285leuserprotyrargprocysglythrtyrleupheleuthrserthr290295300aspglnleuileileleuthrasnseraspalavalleuglnleuleu305310315320phetyrcysleuglnleuaspproglnglnglnleuleuaspalaala325330335alaargserleuseralahistrpglutyrgluserilelysglnser340345350valmetglngluileglycysvalasptyrleuargalaileserser355360365serleuproglyargglnmetasnglythralaileglyglyleuglu370375380leuserlysglualametleuserleualaalaalaalaglntrpglu385390395400lysglnarggluileasnglnalalysileaspalaasncysserlys405410415ileglnglualaleulysserleuasnglutyrlysargthrcysglu420425430leuhisgluvalsertyrtyraspserphelysleuglnarggluval435440445hisasppheasnserasnvalargargleugluleualaglyphetrp450455460aspgluileileglumetleuargargarggluleuproaspalaphe465470475480gluglyarggluglutrpvalasnleuglythrsertyrargargleu485490495valgluproleuaspilealaasntyrtyrarghisserlysasnglu500505510aspthrglysertyrleuserlysglyargproargargtyrlystyr515520525thrglnlystrparggluglnserhisargileproleuglyserser530535540leuglusercysphetrpalametserglugluleuglnalaglumet545550555560ileasnglylysserphegluaspleulysaspargvalglylysleu565570575gluseraspalaleuglytrpphethrserglyasnleuglyargasp580585590valpheleuserserserserphevaliletrptrplysthrleupro595600605gluglnhisargseralasercysilealaargleuvalproser 61061562033149bpdna人工序列3atgccgatggacaccccgccgccgcgcggggcggcgctgtccgacgacgaccgcctcctc60gtcgcccactgcgccgcgctctccttcccctccgcctcccgctccccgccctccgccgcc120gccgcgtcctccgcctccttccaggcgcaccacgcgtcccacccctacccctgcgccgcc180ttcgtcttcccgcccacctggtccgccgccgcctggatgccttcctcccccgacgccggc240ggtcgcgctccgttcggggacgcggaggtcgaccccgcgctcttcccgtcgctgcgcagc300gtcgggagcggcgtccccgcgcgcgccagcgccgccttcgtcgccgccttcagtggcctg360ctcgacggctcgccgctccagaccgaggtgagggcctcctgccatcgccacttcataaac420cattctgccgagaagccgtggttgccgcacagaagtgaagtgcagtctctgagagagacc480ttttgcgctttgctacttccttccgccgtaggatctaagagcatattgtttcaggaaacc540ttctccgtcttgtgtgtagaacaacagcttcattccggctgtgaaagaaacacttcaatt600ttcaaacgctccctttgcatcaagaagcccttgttgctctgaattctttacaggctacat660ttatattggttttggttcgcacgaaggattgttgtgagttgttgctgcagcaattgtgtc720atcccgagcaatggggtgcagtcatgtagacttggagatctgtgcagtggttctgtctag780aaagggaccacctccttttcttgtctgacatatatttgcccatattggtataatgctttt840gaagatttatgtctttttattccaaagatttatctctttggtcggttttgattttcatag900tgcttttgtggttcagttagtttgatttgagcttatgaaacataatgagggaggtgatga960gatccatggccactacagtttcagactgatagtagtagataaaaggctacaaggtagttt1020ggcttggtgtcgtttatgctccgtgaaaataggtaaaatgaactaggtgctttattaatt1080tgatgacaggaaaatgaaatggccactgtgattcagcaattctaccgaattcaactccac1140ttgctttttgctcttgctgtggtcatagacctttcatagtcttacctcatagtattatgt1200tatcttcatatcaacagagtgatagtcttgccattgtgaatttcagtgtaactgcatttt1260cgcctgaaagaaaagtggtgtttttttatcgctttgtattacaggtatctaaagcggtgg1320cagaggagaaacgtgtcgttttcacaggccattcgtctgggggttcaatagccacccttg1380ctgccatatggtttcttgagaactgcacaagacggggaagtgtcaatcaagcacagccat1440tttgcgtgacctttggggcacctcttgttggcgataatgttttcaaccatgctgttagaa1500gggagggctggtcacagtgtattttgcatttcatcatgccactggacatcatcccacgaa1560taccgctggcccccctttcatcctctagagaacaaattcagtctgttctggattggttat1620ctcctcacagtccaaacttctcacctgttgggaattcgcttgttattccagagttttatg1680aaactttgttgagaagcaccctatctattgccagctacgaggcctgttctttcatgggat1740gcactagctcaatcctaggaacgctgacttcctttattgagctatccccgtacagaccct1800gcgggacttaccttttcttgacaagtaccgatcaactgattattctcacaaactcagatg1860ctgtattacagttgctattttactgccttcaattggatccccaacaacaattgcttgatg1920ccgccgccagaagtttaagtgctcactgggaatatgaatcgattaagcaaagtgtgatgc1980aagagataggttgtgtggattacctaagagcaatttcatcatcccttcctggtagacaga2040tgaatgggacagcaattggtggccttgaactggtaagcaatgactcctcttcttccataa2100acaactgtggtttgccactgtaaacatctgttatgttggtgaactgtatgtgtgaaggca2160gtcttagtctggaaaccctcagtgttgcattttagcatctgatcattcatttagggtgta2220cccaaatgcaacagatgtttgtagcctaggataaatggtaatgtacacatcaaatttata2280tcagtaactgtttccgataacacaattctccagttactagttccatttccatctccataa2340aaggtgttttccctaggtttaaaccaccagtaaatttaataaccagtccagtccaatcac2400ataatattacagttgtcactttcatattacagagtaaggaagctatgctgagccttgctg2460ctgctgcacaatgggagaagcaaagagagataaaccaagcaaagatagacgcaaactgca2520gtaaaattcaggaagccctcaagtccctgaacgagtacaaaagaacatgcgagctgcatg2580aagtgagctactatgattccttcaagcttcagcgggaagtgcatgacttcaattcaaatg2640tacggaggctggaactagccggcttttgggacgagataattgagatgttgcgaaggcgtg2700agcttccagacgcgttcgaagggcgagaagagtgggtgaacctggggacctcgtaccgcc2760ggctggttgagcccctggacattgcaaactactacaggcattccaagaatgaggacaccg2820gctcctacctctccaagggcaggccgagacgttacaagtacacccagaaatggcgcgagc2880agtcgcaccgcatccccttgggttccagcctcgagtcgtgcttctgggcaatgtcggagg2940agctgcaggctgagatgatcaacggcaaatcattcgaggatctgaaagacagggtgggta3000aactcgagagcgatgcacttggatggttcacctcgggaaatcttggcagggatgtgtttc3060tgagcagctcatcctttgtgatatggtggaagacactcccggagcagcacaggtccgcgt3120catgcatcgcgagacttgtgccttcgtaa3149當前第1頁12
