一種兩階段發酵提高畢赤酵母產膽鹽水解酶的方法與流程
2023-06-26 07:50:01 3
本發明涉及一種兩階段發酵提高畢赤酵母產膽鹽水解酶的方法,屬於發酵工程技術領域。
背景技術:
膽鹽水解酶(BSH)是由bsh基因編碼的一種胞內酶,廣泛存在於腸道微生物中,是降解膽汁的主要組成成份——共軛膽酸第一步所需的酶。膽酸鹽水解酶可將共軛膽酸水解成牛磺酸或甘氨酸和游離膽酸,後者可由其它腸道微生物在腸道內作進一步降解。膽酸鹽水解酶的生理作用體現在兩個方面:一、影響宿主的脂肪代謝過程,減少脂肪的消化吸收和降低膽固醇水平等;二、膽汁的降解減少了膽汁對腸道微生物的毒性,改善了微生物生存的腸道環境;由降解產生的胺基酸和游離脂肪酸還可為微生物提供營養物質。
由於膽鹽水解酶通常來源於乳酸菌等微生物中,其生長環境和發酵強度不適合大規模工業化生產。另一方面,目前報導的多數膽鹽水解酶表達量低,易形成包涵體。因此,篩選一種能夠酶活較高並能高效表達的膽鹽水解酶基因對於工業化生產膽鹽水解酶,及運用膽鹽水解酶調節生物機體健康狀況具有重要意義。
畢赤酵母宿主雖然具有表達蛋白易於純化等優點,然而目前的膽鹽水解酶在畢赤酵母中表達時,存在表達量不高或者是外源基因原始核苷酸序列並不十分適合於畢赤酵母宿主的問題,從而限制了膽鹽水解酶在畢赤酵母中的高效表達,酵母真核表達系統中存在的糖基化現象對鹼性果膠酶的高效表達及性質存在極大影響。
技術實現要素:
本發明提供一種兩階段發酵生產膽鹽水解酶的方法,其特徵在於,採用表達膽鹽水解酶的重組畢赤酵母為出發菌株,兩階段控制策略發酵生產膽鹽水解酶;所述兩階段控制策略是:菌體生長階段控制溫度為28~30℃,pH7.0~7.5,攪拌轉速500~600rpm;產酶階段將發酵溫度降至25~28℃,pH 5.5~6.5,攪拌轉速500~600rpm。
在本發明的一種實施方式中,所述產膽鹽水解酶的畢赤酵母是以pichia pastoris GS115為宿主,以pPIC9K為載體,表達SEQ ID NO.1所示基因的重組畢赤酵母。
在本發明的一種實施方式中,所述重組畢赤酵母還具有α-MF信號肽。
在本發明的一種實施方式中,所述發酵是以按體積比10-15%的接種量將畢赤酵母接種至發酵培養基中,25~28℃,200~220rpm下發酵。
在本發明的一種實施方式中,所述發酵培養基配方包括:蛋白腖20g/L,酵母粉10g/L,7-10%甲醇,YNB 13.4g/L。
在本發明的一種實施方式中,所述發酵前還進行活化。
在本發明的一種實施方式中,所述活化是挑取畢赤酵母單菌落,接種至BMGY培養基中,30℃,200~220r/min培養16-24h。
在本發明的一種實施方式中,所述BMGY培養基含有蛋白腖20g/L,酵母粉10g/L,甘油40g/L,YNB 13.4g/L,
本發明還提供所述的方法在製備含膽鹽水解酶的產品中的應用。
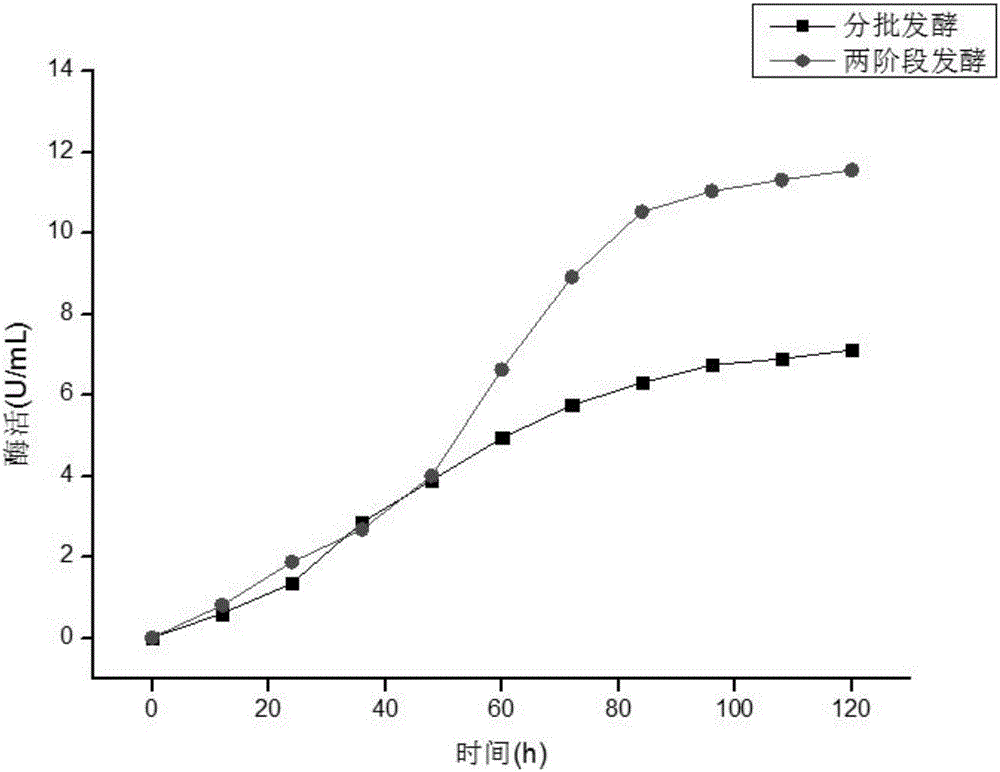
有益效果:本發明提供了一兩階段發酵提高畢赤酵母產膽鹽水解酶的方法,通過兩階段控制pH,使畢赤酵母發酵5d後,產膽鹽水解酶的酶活提高至11.54U/mL,與分批發酵相比提高了62.1%。
附圖說明
圖1為兩階段發酵畢赤酵母產膽鹽水解酶酶活。
具體實施方式
LB培養基:酵母提取物5g/L,蛋白腖10g/L,NaCl 10g/L。
YPD培養基:胰蛋白腖20g/L,酵母粉10g/L,葡萄糖20g/L。
BMGY培養基:蛋白腖20g/L,酵母粉10g/L,甘油40g/L,YNB 13.4g/L,pH6.0的0.1mol/L的磷酸鹽緩衝液。
BMMY培養基:蛋白腖20g/L,酵母粉10g/L,7-10%甲醇,YNB 13.4g/L,pH6.0的0.1mol/L的磷酸鹽緩衝液。
膽鹽水解酶酶活測定方法:將發酵液離心5min(10000×g,4℃)收集菌體,用0.1M磷酸鹽緩衝液(pH 7.0)洗滌離心2次,調整菌濃在600nm下吸光度為1。取1mL上述細胞懸濁液,超聲破碎1min(工作時間:間歇時間=1:2),離心10min(10,000×g,4℃)去除細胞碎片,得到無細胞提取物(cell free extract,CFE)。取0.1mL上清液加入1.8mL 0.1M磷酸鹽緩衝液(pH 6.0)和0.1mL膽鹽(200mmol·L-1)中混合,並置於37℃孵育30min,取0.5mL上述反應液加入0.5mL15%三氯乙酸(w/t)終止反應,混合均勻,離心10min(離心機最大轉速,4℃)取上清。將0.1mL上清液與1.9mL茚三酮顯色液(包括0.5mL 1%茚三酮(溶解於0.5M檸檬酸緩衝液(pH 5.5)中)、1.2mL甘油和0.2mL 0.5M的檸檬酸緩衝液(pH為5.5))混合,震蕩混勻,沸水浴14min。冷卻3min後測定570nm下的吸收值。膽鹽水解酶酶活定義為:單位時間內、單位體積的酶使結合型膽鹽水解產生胺基酸的物質的量,單位μmol·(min·mL)-1。
實施例1重組質粒的構建及鑑定
將植物乳桿菌來源的bsh基因(NCBI登錄號為)進行密碼自由化,並通過化學合成獲得序列如SEQ ID NO.1所示序列,設計引物,通過融合PCR將SEQ ID NO.1所示序列與信號肽α-MF連接,柱回收產物獲得融合片段。將融合片段αMF-bsh和pPIC9K質粒16℃過夜連接。連接產物pPIC9K-αMF-bsh化學法轉化至大腸桿菌JM109感受態細胞。將轉化液塗布於含50mg/L卡那黴素的LB平板,提取質粒測序驗證構建的重組質粒。將重組質粒pPIC9K-αMF-bsh線性化,電擊轉化至pichia pastoris GS115感受態細胞,構建獲得重組畢赤酵母Pichia pastoris GS115-pPIC9K-αMF-bsh。
實施例2重組畢赤酵母的分批發酵
將實施例1構建的工程菌作為生產菌株,在YPD平板活化。挑取單菌落,接種至50mL/250mL BMGY培養基,30℃,220r/min培養24h,以此作為種子液,按體積比以10%的接種量轉接至含1.5~2L BMMY培養基,並添加有10%甲醇的3L發酵培養基中,25~28℃,500~600rpm,pH 6.0~6.5,使溶氧濃度保持在10%以上,每24h流加終濃度5%的甲醇繼續發酵5d,每12h取樣檢測酶活,發酵結果如圖1所示,發酵5d酶活達7.12U/mL。
實施例3重組畢赤酵母的兩階段發酵
將實施例1構建的工程菌作為生產菌株,在YPD平板活化。挑取單菌落,接種至50mL/250mL BMGY培養基,30℃,220r/min培養24h,以此作為種子液,按體積比以10%的接種量轉接至含1.5~2L BMMY培養基的3L發酵罐中開始發酵,調整通氣量和攪拌轉數,第一階段(發酵前20~28h)控制溫度為28~30℃,pH7.0~7.5,攪拌轉速500~600rpm,補入終濃度10%的甲醇,;第二階段(發酵28h至發酵結束)將發酵溫度降至25~28℃,pH 6.0~6.5,攪拌轉速500~600rpm,並每24h流加終濃度5%甲醇進行誘導,每12h取樣檢測酶活,結果如圖1所示,兩階段控制pH發酵5d後,酶活提高至11.54U/mL,與分批發酵相比提高了62.1%。
雖然本發明已以較佳實施例公開如上,但其並非用以限定本發明,任何熟悉此技術的人,在不脫離本發明的精神和範圍內,都可做各種的改動與修飾,因此本發明的保護範圍應該以權利要求書所界定的為準。
SEQUENCE LISTING
吳銀娣
一種兩階段發酵提高畢赤酵母產膽鹽水解酶的方法
2
PatentIn version 3.3
1
972
DNA
人工序列
1
atgtgtactg ctatcactta ccaatcttac aacaactact tcggtagaaa cttcgactac 60
gaaatctctt acaacgaaat ggacactatc actccaagaa agtacccatt ggttttcaga 120
aaggttgaaa acttggacca ccactacgct atcatcggta tcactgctga cgttgaatct 180
tacccattgt actacgacgc tatgaacgaa aagggtttgt gtatcgctgg tttgaacttc 240
gctggttacg ctgactacaa gaagtacgac gctgacaagg ttaacatcac tccattcgaa 300
ttgatcccat ggttgttggg tcaattctct tctgttagag aagttaagaa gaacatccaa 360
aagttgaact tggttaacat caacttctct gaacaattgc cattgtctcc attgcactgg 420
ttggttgctg acaagcaaga atctatcgtt atcgaatctg ttaaggaagg tttgaagatc 480
tacgacaacc cagttggtgt tttgactaac aacccaaact tcgactacca attgttcaac 540
ttgaacaact acagagcttt gtctaactct actccacaaa actctttctc tgaaaaggtt 600
gacttggact cttactctag aggtatgggt ggtttgggtt tgccaggtga cttgtcttct 660
atgtctagat tcgttagagc tgctttcact aagttgaact ctttgtctat gcaaactgaa 720
tctggttctg tttctcaatt cttccacatc ttgggttctg ttgaacaaca aaagggtttg 780
tgtgaagtta ctgacggtaa gtacgaatac actatctact cttcttgttg tgacatggac 840
aagggtgttt actactacag aacttacgac aactctcaaa tcaactctgt ttctttgaac 900
cacgaacact tggacactac tgaattgatc tcttacccat tgagatctga agctcaatac 960
tacgctgtta ac 972
2
55
DNA
人工序列
2
atgagattcc ttcaatttta ctgctgtttt attcgcagca tcctccgcat tagct 55
