一種1‑芳(烷)基苯並[e][1,2,4]噻二唑‑1‑氧系列化合物的製備方法與流程
2023-06-23 02:05:26
本發明涉及一種含硫和雙氮雜環藥物骨架的衍生物,具體涉及1-芳(烷)基苯並[e][1,2,4]噻二唑-1-氧系列化合物的製備方法。
背景技術:
亞碸磺醯亞胺是一類重要的具有生物活性的有機分子。早在上世紀70年代,二苯基亞碸磺醯亞胺(diphenylsulfoximine)即被當作藥效團用於臨床藥物開發研究。目前,含有此類亞碸磺醯亞胺骨架並成功上市應用於臨床的藥物有:用於治療喘息平喘的藥物Suloxifen(舒洛昔芬);用於解除痙攣使用的藥物HE-HK 52[(a)Satzinger,G.Drug News Perspect.2001,14,197.(b)Pothmann,R.Drugs Future 1982,7,478.];驅蟲殺蟲劑Sulfoxaflor(氟啶蟲胺腈);抗過敏藥Sudexanox(RU 31156,舒地古諾);依賴於細胞周期蛋白(CDKs)致活酶的pan-CDK抑制劑ZK 304709[G.Siemeister,U.Luecking,C.Wagner,K.Detjen,C.McCoy,K.Bosslet,Biomed.Pharmacother.2006,60,269.];以及用於預防淋巴細胞HIV逆轉錄酶抑制劑的藥物NSC 287474[P.Stoss,G.Satzinger,Chem.Ber.1972,105,2575.]等。
苯並[e][1,2,4]噻二唑-1-氧衍生物含有苯並亞碸磺醯亞胺的雜環骨架結構,含有此類結構的分子被視作藥物研發的「優勢骨架(privileged structure)」。含有該核心結構的化合物廣泛存在於各類天然產物,或者具有重要生理藥理活性的有機分子當中。此外,在農藥和材料科學領域也有大量的有機分子含有苯並[e][1,2,4]噻二唑的結構[(a)Angew.Chem.Int.Ed.2013,52,9399-9408.(b)R.W.Buckheit Jr.,V.Fliakas-Boltz,W.D.Decker,J.L.Roberson,T.L.Stup,C.A.Pyle,E.L.White,J.B.McMahon,M.J.Currens,M.R.Boyd,J.P.Bader,AntiviralRes.1995,26,117.(c)A.Hizi,R.Tal,M.Shaharabany,M.J.Currens,M.R.Boyd,S.H.Hughes,J.B.McMahon,Antimicrob.Agents Chemother.1993,37,1037.(d)R.W.Buckheit,Jr.,V.-F.Boltz,W.D.Decker,J.L.Robertson,C.A.Pyle,E.L.White,B.J.Bowdon,J.B.McMahon,M.R.Boyd,J.P.Bader,D.G.Nickell,H.Barth,T.K.Antonucci,Antiviral Res.1994,25,43.(e)R.D.Dillard,T.T.Yen,P.Stark,D.E.Pavey,J.Med.Chem.1980,23,717.]。目前,已經臨床使用的特效抗焦慮和抗驚厥的藥物4962是一種基於苯並亞硫碸二氮雜的受體拮抗藥,其有效成分即含有苯並[e][1,2,4]噻二唑1-氧的結構骨架[(a)Bartoszyk,G.;Dooley,D.;Barth,H.;Hartenstein,J.;Satzinger,G.J.Pharm.Pharmacol.1987,39,407.(b)Bartoszyk,G.;Schoenherr,U.Behavioral&Neural Biology,1987,48(2):317-319]。另外一種含有雙硫代1-苯基苯並[e][1,2,4]噻二唑-1-氧的衍生物是一種優良的逆轉錄酶抑制劑,可用於保護血液和淋巴液中的淋巴細胞,因而可用於潛在的抗HIV藥物,引起了藥物化學家的關注[(a)G.Satzinger,Drug News Perspect.2001,14,197.(b)G.Satzinger(GodeckeAktiengesellschaft),US 5321024,1994.]。因此,發展一些高效快捷的方法合成含1-氧噻二唑結構的化合物具有十分重要的意義。
早在1964年,Wagner課題組首次報導了合成1-氧噻二唑骨架分子的方法[A.W.Wagner,G.Liebigs Ann.Chem.1964,675,189.],通過該方法合雖然能夠構建噻二唑基本骨架,但是轉化的效率卻不是很理想。1971年和1973年,Williams相繼報導了利用亞磺醯亞胺經過多步反應製備1-氧噻二唑的方法[(a)T.R.Williams,D.J.Cram,J.Am.Chem.Soc.1971,93,7333;(b)T.R.Williams,D.J.Cram,J.Org.Chem.1973,38,20.]。雖然此方法未使用過渡金屬,但其步驟繁多,整體收率低。同樣,1976年,Satzinger等報導了3號位各種取代的1-氧噻二唑衍生物方法[P.Stoss,G.Satzinger,Chem.Ber.1976,109,2097.]。此方法要用到不易製備的鄰氨基苯基亞碸亞磺醯胺,以及毒性較重的氰化溴(BrCN)和五氯化磷(PCl5)作為化工原料,因而大規模製備時對設備的要求較嚴格,生產成本高。
以上這些方法,為合成含亞碸磺醯亞胺結構的苯並[e][1,2,4]噻二唑系列化合物提供了可供選擇的途徑。然而,經過文獻調研我們發現,目前還沒有一種很有效的方法一步合成1-芳(烷)基苯並[e][1,2,4]噻二唑1-氧系列化合物。基於亞碸磺醯亞胺衍生物所具有的強效的生物或藥物活性,我們預計開發有效的方法合成含有該結構特徵的化合物將具有十分強大的可轉化能力,以及十分廣闊的應用前景。
基於此,本發明旨在通過發展一類短周期過渡金屬催化的高選擇性C-H/N-H活化反應,使用價格便宜而且低毒性的鈷配合物作為催化劑,結構上廉價易得的小分子化合物作為原料,在簡單的反應條件下高效率、高化學選擇性地合成含1-芳(烷)基苯並[e][1,2,4]噻二唑-1-氧系列化合物。本發明方法對於各類基團如滷素(氟、氯、溴、碘),不飽和基團(烯基、炔基),氰基、酯基、硝基等敏感基團具有良好的兼容性,這些基團本身具有良好的反應活性,因此所得產物能夠通過其他的有機化學反應發生進一步的轉化,從而在1-芳(烷)基苯並[e][1,2,4]噻二唑骨架上引入更多的官能團,同時還可構建其他一些新型結構的化合物。
技術實現要素:
本發明的目的在於提供一種1-芳(烷)基苯並[e][1,2,4]噻二唑-1-氧系列化合物的製備方法,該方法化學選擇性高,底物適用性廣,操作簡便,副產物少,適用於較大規模的製備。
本發明是這樣實現的,在有機混合溶劑中,採用亞碸磺醯亞胺和3-芳(烷)基-1,4,2-二唑-5-酮作為反應底物,在過渡金屬催化劑和共催化劑的共同催化作用下,在一定溫度下反應一段時間得到產物1-芳(烷)基苯並[e][1,2,4]噻二唑-1-氧系列化合物。反應通式如下:
其中R1、R2、R3為H或烷基、烷氧基、環烷基等各種供電子的基團,或氟、氯、溴、碘、酯基、硝基、氰基、醯胺基等各種吸電子的基團,或呋喃基、噻吩基、吡啶基、烯基、炔基、矽基等。
其中,所述的有機混合溶劑為叔戊醇/一氯甲烷、叔戊醇/二氯甲烷、叔戊醇/三氯甲烷、叔戊醇/四氯甲烷、叔丁醇/三氯甲烷或叔丁醇/1,2-二氯甲烷,其中,以叔戊醇/三氯甲烷為最佳。
所述的過渡金屬催化劑為環戊二烯二氯化鈷、一羰基環戊二烯基碘化鈷、二(乙腈)環戊二烯基二(六氟碲酸銀)化鈷、二氯環戊二烯化銠或二氯環戊二烯化銥,其中,以一羰基環戊二烯碘化鈷為最佳。
所述的共催化劑為六氟碲酸銀、三氟甲磺酸銀、雙三氟甲基磺醯亞胺銀、四氟硼酸銀。
反應的溫度控制可以採用微波反應器加熱、油浴加熱等加熱方式,採用微波反應器加熱時,反應溫度為100~120℃,反應時間為2~3小時;採用油浴加熱時,反應溫度為110~130℃,反應時間為15~18小時。
反應無須額外的惰性氣體保護作為反應環境,在空氣環境下即可進行,並且副產物僅為二氧化碳和水。
由上述方法製得的1-芳(烷)基苯並[e][1,2,4]噻二唑1-氧系列化合物分子中,骨架上1-位的芳基可以為各種帶有供電子基團的芳基、各種帶有吸電子基團的芳基、呋喃基、噻吩基、吡啶基;所述供電子基團有烷基、烷氧基、環烷基;所述吸電子基團有氟、氯、溴、碘、酯基、硝基、氰基、醯胺基;骨架上3-位的取代基可以為各種烷基、烷氧基、環烷基、芳基、萘基、呋喃基、噻吩基、吡啶基、矽基或滷素基團。
本發明的有益效果是:反應物亞碸磺醯亞胺與催化劑的比例為1:0.05就能非常順利地進行,所得的副產物僅為二氧化碳和水,不僅便於產物的分離提純,而且體現出良好的綠色化;反應的化學選擇性高,底物適用性廣,產物收率高;無須額外的惰性氣體保護作為反應環境,操作簡便,微波條件下的反應時間短,成本極低,可適用於較大規模的製備;由於產物對於滷素(氟、氯、溴、碘),不飽和基團(烯基、炔基),氰基、酯基、硝基等敏感基團具有良好的兼容性,這些基團本身具有良好的反應活性,因此所得產物能夠通過其他的有機化學反應發生進一步的轉化,構建其他一些新型的含亞碸磺醯亞胺結構的化合物,具有潛在的生物或藥物活性,在生物醫藥、農藥和材料科學等領域具有非常好的應用前景。
附圖說明
圖1是根據本發明方法所得產物1-芳(烷)基苯並[e][1,2,4]噻二唑-1-氧系列化合物的結構通式。
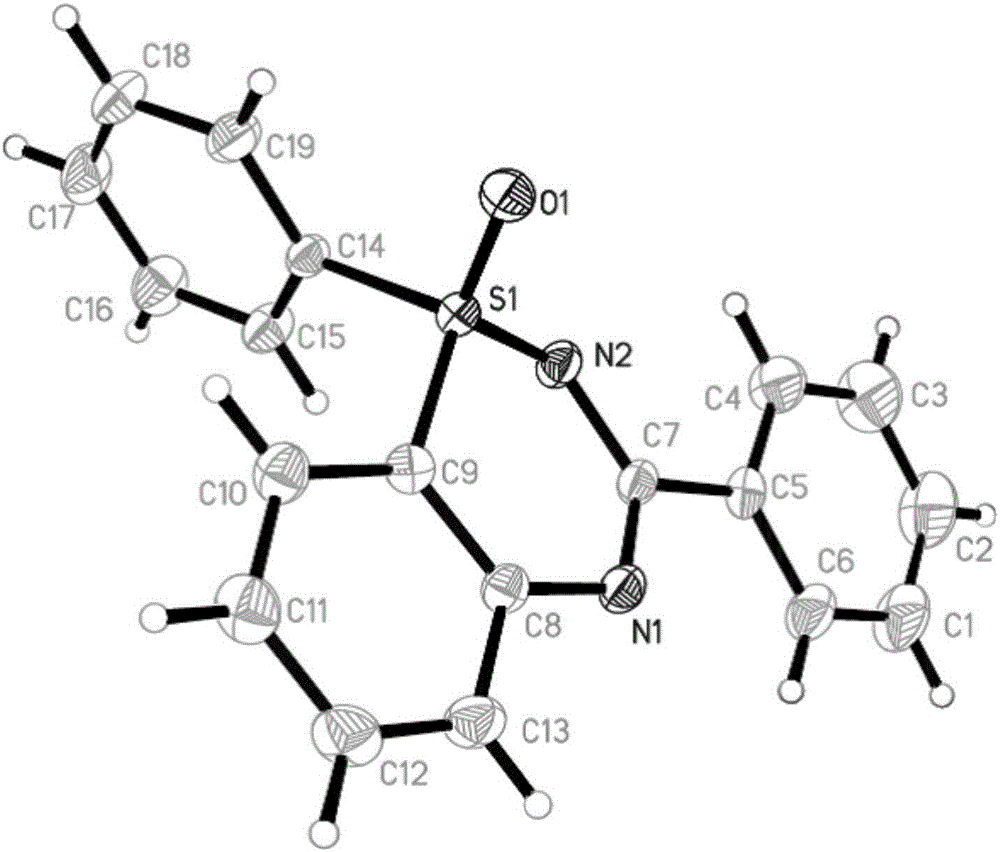
圖2是本發明實施例1的產物1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3a的單晶結構示意圖。
圖3是本發明實施例1的產物1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3a的化學結構式。
具體實施方式
下面的實施例是對本發明的進一步說明,而不是限制本發明的範圍。
實施例一:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,再滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)以及3-苯基-1,4,2-二唑-5-酮(64mg,0.4mmol)和混合溶劑(1.0mL)至反應體系中,於空氣氛圍下繼續反應2小時,TLC檢測完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3a。產率:85%。以下是產物3a的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ:8.47-8.40(m,2H),7.88(dd,J=5.4Hz,3.6Hz,2H),7.70-7.54(m,5H),7.49-7.41(m,4H),7.26(m,1H).
13C NMR(100MHz,CDCl3)δ:158.1,147.3,140.7,137.6,134.4,133.9,131.0,129.3,128.7,128.7,128.2,126.3,124.8,113.8.
實施例二:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(230mg,0.25mmol)雙三氟甲基磺醯亞胺銀(400mg,0.5mmol)溶於混合溶劑叔戊醇/三氯甲烷(25mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,再滴加反應物二苯基亞磺醯亞胺(1.09g,5.0mmol)以及3-苯基-1,4,2-二唑-5-酮(1.6g,10mmol)至反應體系中,於空氣氛圍下繼續反應3小時,TLC檢測完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3a。產率:80%。以下是產物3a的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ:8.47-8.40(m,2H),7.88(dd,J=5.4Hz,3.6Hz,2H),7.70-7.54(m,5H),7.49-7.41(m,4H),7.26(m,1H).
13C NMR(100MHz,CDCl3)δ:158.1,147.3,140.7,137.6,134.4,133.9,131.0,129.3,128.7,128.7,128.2,126.3,124.8,113.8.
實施例三:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(230mg,0.25mmol)雙三氟甲基磺醯亞胺銀(400mg,0.5mmol)溶於混合溶劑叔戊醇/三氯甲烷(25mL,v:v=1:1)中,在油浴反應器中加熱到120℃,再滴加反應物二苯基亞磺醯亞胺(1.09g,5.0mmol)以及3-苯基-1,4,2-二唑-5-酮(1.6g,10mmol)至反應體系中,於空氣氛圍下繼續反應16小時,TLC檢測完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3a。產率:69%。以下是產物3a的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ:8.47-8.40(m,2H),7.88(dd,J=5.4Hz,3.6Hz,2H),7.70-7.54(m,5H),7.49-7.41(m,4H),7.26(m,1H).
13C NMR(100MHz,CDCl3)δ:158.1,147.3,140.7,137.6,134.4,133.9,131.0,129.3,128.7,128.7,128.2,126.3,124.8,113.8.
實施例四:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,再滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲基)苯基-1,4,2-二唑-5-酮(71mg,0.4mmol)混合溶劑(1.0mL)溶至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3b。產率:87%。以下是產物3b的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.33(d,J=8.2Hz,2H),7.88(d,J=7.6Hz,2H),7.68-7.52(m,5H),7.44(d,J=7.9Hz,1H),7.29-7.19(m,3H),2.41(s,3H).
13C NMR(100MHz,CDCl3)δ158.2,147.5,141.4,140.9,134.9,134.3,133.8,129.3,128.9,128.7,128.6,126.0,124.8,113.7,21.6.
實施例五:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(230mg,0.25mmol)雙三氟甲基磺醯亞胺銀(400mg,0.5mmol)溶於混合溶劑叔戊醇/三氯甲烷(25mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,再滴加反應物二苯基亞磺醯亞胺(1.09g,5.0mmol)以及3-苯基-1,4,2-二唑-5-酮(1.78g,10mmol)至反應體系中,於空氣氛圍下繼續反應3小時,TLC檢測完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3b。產率:81%。以下是產物3b的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ:8.47-8.40(m,2H),7.88(dd,J=5.4Hz,3.6Hz,2H),7.70-7.54(m,5H),7.49-7.41(m,4H),7.26(m,1H).
13C NMR(100MHz,CDCl3)δ:158.1,147.3,140.7,137.6,134.4,133.9,131.0,129.3,128.7,128.7,128.2,126.3,124.8,113.8.
實施例六:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(230mg,0.25mmol)雙三氟甲基磺醯亞胺銀(400mg,0.5mmol)溶於混合溶劑叔戊醇/三氯甲烷(25mL,v:v=1:1)中,在油浴反應器加熱到120℃,再滴加反應物二苯基亞磺醯亞胺(1.09g,5.0mmol)以及3-苯基-1,4,2-二唑-5-酮(1.78g,10mmol)至反應體系中,於空氣氛圍下繼續反應18小時,TLC檢測完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3b。產率:72%。以下是產物3b的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ:8.47-8.40(m,2H),7.88(dd,J=5.4Hz,3.6Hz,2H),7.70-7.54(m,5H),7.49-7.41(m,4H),7.26(m,1H).
13C NMR(100MHz,CDCl3)δ:158.1,147.3,140.7,137.6,134.4,133.9,131.0,129.3,128.7,128.7,128.2,126.3,124.8,113.8.
實施例七:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,再滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲氧基)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC檢測至完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3c。產率:69%。以下是產物3c的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.41-8.38(m,2H),7.91-7.84(m,2H),7.60(m,5H),7.42(d,J=7.7Hz,1H),7.26-7.19(m,1H),6.97-6.92(m,2H),3.85(s,3H).
13C NMR(100MHz,CDCl3)δ162.2,157.8,147.6,140.9,134.3,133.8,130.4,130.2,129.3,128.6,128.5,125.8,124.8,113.6,113.5,55.4.
實施例八:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到100℃,再滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲氧基)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應4小時,TLC檢測至完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3c。產率:61%。以下是產物3c的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.41-8.38(m,2H),7.91-7.84(m,2H),7.60(m,5H),7.42(d,J=7.7Hz,1H),7.26-7.19(m,1H),6.97-6.92(m,2H),3.85(s,3H).
13C NMR(100MHz,CDCl3)δ162.2,157.8,147.6,140.9,134.3,133.8,130.4,130.2,129.3,128.6,128.5,125.8,124.8,113.6,113.5,55.4.
實施例九:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在油浴反應器加熱到130℃,再滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲氧基)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應15小時,TLC檢測至完全反應。後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3c。產率:60%。以下是產物3c的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.41-8.38(m,2H),7.91-7.84(m,2H),7.60(m,5H),7.42(d,J=7.7Hz,1H),7.26-7.19(m,1H),6.97-6.92(m,2H),3.85(s,3H).
13C NMR(100MHz,CDCl3)δ162.2,157.8,147.6,140.9,134.3,133.8,130.4,130.2,129.3,128.6,128.5,125.8,124.8,113.6,113.5,55.4.
實施例十:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-氟)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3d。產率:71%。以下是產物3d的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.51-8.38(m,2H),7.88(d,J=7.5Hz,2H),7.65-7.55(m,5H),7.44(d,J=7.9Hz,1H),7.33-7.21(m,1H),7.17-7.07(m,2H).
13C NMR(100MHz,CDCl3)δ166.1,163.6,157.0,147.2,140.6,134.5,133.9,130.9,130.8,129.4,126.3,124.8,115.2,115.0,113.7.
實施例十一:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-溴)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3e。產率:52%。以下是產物3e的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.31(d,J=8.6Hz,2H),7.91-7.85(m,2H),7.70-7.53(m,7H),7.44(d,J=7.8Hz,1H),7.33-7.23(m,1H).
13C NMR(100MHz,CDCl3)δ157.1,147.1,140.6,136.6,134.5,134.0,131.3,130.3,129.4,128.7,128.6,126.5,125.8,124.8,113.8.
實施例十二:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-碘)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3f。產率:48%。以下是產物3f的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.16(d,J=8.5Hz,2H),7.87(d,J=7.7Hz,2H),7.78(d,J=8.4Hz,2H),7.67-7.53(m,5H),7.44(d,J=7.8Hz,1H),7.27(m,1H).
13C NMR(100MHz,CDCl3)δ157.2,147.1,140.6,137.4,137.2,134.5,134.0,130.3,129.4,128.7,128.6,126.5,124.8,113.8,98.2.
實施例十三:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在Biotage微波反應器加熱到110℃,滴加反應物二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-萘基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3g。產率:73%。以下是產物3g的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.95(s,1H),8.57(dd,J=8.7Hz,1.2Hz,1H),8.00-7.82(m,5H),7.76-7.44(m,8H),7.28(dd,J=13.6Hz,5.8Hz,1H).
13C NMR(100MHz,CDCl3)δ158.0,147.4,140.8,135.0,134.9,134.4,133.9,133.1,129.4,129.3,128.8,128.7,127.7,127.7,127.2,126.3,126.1,125.4,124.9,113.9.
實施例十四:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-苯乙烯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3h。產率:72%。以下是產物3h的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ7.87(t,J=12.0Hz,3H),7.66-7.57(m,7H),7.42(d,J=7.9Hz,1H),7.38-7.29(m,3H),7.24(dd,J=11.0,5.0Hz,1H),7.06(d,J=15.8Hz,1H).
13C NMR(100MHz,CDCl3)δ158.5,147.2,140.7,139.7,135.9,134.5,133.9,129.4,129.2,128.8,128.7,128.2,127.8,126.3,125.0,114.4.
實施例十五:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-噻吩基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3i。產率:35%。以下是產物3i的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ7.96-7.87(m,3H),7.70-7.55(m,5H),7.48(dd,J=5.0,1.2Hz,1H),7.42(d,J=8.3Hz,1H),7.25-7.19(m,1H),7.11(dd,J=5.0,3.8Hz,1H).
13C NMR(100MHz,CDCl3)δ154.4,134.4,133.9,130.3,130.1,129.3,129.3,128.7,128.6,128.3,127.8,127.8,125.9,124.8,114.0.
實施例十六:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)以及三甲基乙酸(40mg,0.4mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有4,4-二氯二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2-3小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3j。產率:77%。以下是產物3j的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.41(dd,J=8.1,1.4Hz,2H),7.82-7.75(m,2H),7.67(d,J=2.0Hz,1H),7.56-7.42(m,5H),7.35(d,J=8.6Hz,1H),7.26-7.19(m,1H).
13C NMR(100MHz,CDCl3)δ159.0,148.6,141.1,140.8,139.0,137.0,131.5,130.0,129.8,128.8,128.3,128.2,126.9,126.0,111.8.
實施例十七:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有4,4-二氯二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲氧基)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3k。產率:83%。以下是產物3k的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.36(d,J=9.0Hz,2H),7.83-7.75(m,2H),7.63(d,J=2.0Hz,1H),7.53(d,J=8.7Hz,2H),7.34(d,J=8.6Hz,1H),7.18(dd,J=8.6,2.0Hz,1H),6.99-6.91(m,2H),3.86(s,3H).13C NMR(100MHz,CDCl3)δ162.6,158.7,148.9,141.0,140.7,139.2,130.6,129.9,129.7,129.5,128.0,126.4,126.0,113.6,111.6,55.4.
實施例十八:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有4,4-二甲基二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲氧基)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3l。產率:84%。以下是產物3l的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.45-8.38(m,2H),7.73(d,J=8.3Hz,2H),7.45(dd,J=7.3,6.5Hz,4H),7.33(dd,J=8.2,1.9Hz,3H),7.07(d,J=8.2Hz,1H),2.42(s,6H).
13C NMR(100MHz,CDCl3)δ158.2,147.4,145.3,144.9,138.2,137.8,130.8,129.9,128.6,128.5,128.3,128.1,127.6,124.6,111.5,21.8,21.6.
實施例十九:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有4,4-二甲基二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-(4-甲基)苯基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3m。產率:80%。以下是產物3m的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.31(d,J=8.2Hz,2H),7.73(d,J=8.3Hz,2H),7.44(s,1H),7.32(dd,J=8.2,2.2Hz,3H),7.24(d,J=7.9Hz,2H),7.04(d,J=8.2Hz,1H),2.41(s,3H),2.40(s,3H).
13C NMR(100MHz,CDCl3)δ158.3,147.5,145.2,144.8,141.2,138.3,135.1,129.9,128.9,128.6,128.5,128.2,127.4,124.6,111.4,21.8,21.6,21.5.
實施例二十:
空氣氛圍下將催化劑一羰基環戊二烯碘化鈷(9.2mg,0.01mmol)雙三氟甲基磺醯亞胺銀(16mg,0.02mmol)溶於混合溶劑叔戊醇/三氯甲烷(1.0mL,v:v=1:1)中,在微波爐110℃於磁力攪拌器中滴加含有4,4-二甲基二苯基亞磺醯亞胺(43.4mg,0.2mmol)及3-萘基-1,4,2-二唑-5-酮(64mg,0.04mmol)混合溶劑(1.0mL)溶液至反應體系中,於空氣氛圍下繼續反應2小時,TLC板檢測至完全反應。反應完畢,後處理時先通過裝有矽膠的砂芯漏鬥抽濾除掉催化劑,所得濾液通過快速柱層析分離得純淨的產品1,3-二苯基苯並[e][1,2,4]噻二唑1-氧化合物3n。產率:57%。以下是產物3n的核磁共振實驗數據:
1H NMR(400MHz,CDCl3)δ8.94(s,1H),8.56(dd,J=8.7,1.5Hz,1H),7.98-7.83(m,3H),7.77(d,J=8.3Hz,2H),7.53-7.45(m,3H),7.34(dd,J=7.9,6.3Hz,3H),7.07(d,J=8.1Hz,1H),2.43(s,3H),2.41(s,3H).
13C NMR(100MHz,CDCl3)δ158.1,147.4,145.4,144.9,138.2,135.2,134.9,133.1,129.9,129.3,129.2,128.6,128.3,127.7,127.7,127.1,126.1,125.4,124.6,118.2,111.6,21.8,21.6.
