利用受限空間中超分子水凝膠凍存雪旺細胞的方法與流程
2023-06-04 18:48:24
本發明屬於細胞低溫凍存技術領域,具體涉及一種雪旺細胞的低溫凍存方法。
背景技術:
近年來,隨著活體細胞和組織在醫學,生物學,藥學等多個領域的廣泛應用,對活體細胞和組織的需求也日益增長,而離體的細胞和組織在常溫下難以實現長期保存和長途運輸,且細胞的體外培養本身過於耗時耗材。因此,低溫凍存作為目前最常用的對活體細胞和組織的保存技術,逐漸成為近年來的研究熱點。在傳統的低溫凍存過程中,隨著溫度的下降,細胞的生理活動被迫停止,而當溫度恢復至生理溫度,細胞復甦,細胞又可恢復活性,發揮其生理功能。然而現有的凍存方法會對細胞造成一定程度的冰晶損傷,以及由於凍存保護劑的加入和難以去除帶來的毒性傷害,體積變化損傷和滲透損傷。
目前將凝膠應用於低溫凍存的研究報導中,多為利用水凝膠包埋活細胞的方法來減少低溫損傷。hang等研究了利用海藻酸-多聚賴氨酸-海藻酸微膠囊做微囊化肝細胞凍存相對於直接對肝細胞凍存的影響,復甦後的檢測結果表明,微囊化凍存組相對直接凍存組,生存能力更強,附件效率也更高。haishuihuang等發現海藻酸鹽水凝膠微囊化的細胞可以在凍存後的復甦過程中有效的抑制反玻璃化,從而保護細胞免受其內部的冰晶對細胞造成的傷害。但微膠囊的包裹會限制甚至阻礙貼附型細胞的貼壁、遷移、增殖和分化。例如:kuldipsidhu等研究了海藻酸鹽水凝膠微囊化的人體胚胎幹細胞(hescs)和未被包埋的胚胎幹細胞的活性和乾性。研究結果表明,被海藻酸鹽凝膠包埋的的活性和乾性都較未包埋的hescs低,且海藻酸鹽凝膠囊膜難以去除。
與傳統凝膠通過化學交聯的方法形成凝膠態不同,超分子水凝膠由低分子的有機化合物即凝膠因子在水中通過分子間非共價鍵作用(如氫鍵,靜電作用,π-π共軛)形成交聯得到三維網絡狀結構,進而形成凝膠態。因而超分子水凝膠的交聯方式屬於物理交聯,更加接近自然界中生物體的交聯結構。因此,超分子水凝膠的生物相容性極佳。此外,分子間非共價鍵的作用本身可逆,因而超分子凝膠通常也是可逆的,並且還可能具備自修復特性和刺激響應性。因此,作為一種軟物質材料,超分子水凝膠在藥物載體,生物醫學等領域的應用廣泛。
目前相關的報導多利用水凝膠微膠囊來凍存細胞或組織,而基於超分子凝膠在微流控裝置中的低溫保存研究卻很少。微流控技術作為一種可以在截面尺寸為微米級的微型通道內操控流體的中心技術,在許多微型系統包括化學,生物和醫藥等方面應用廣泛。常見的微通道包括由軟刻蝕技術製得的pdms矽膠通道和由毛細管構成的玻璃微通道。相比pdms矽膠微通道形成的微流控裝置,玻璃毛細管微流控裝置的製作成本更為低廉,方法更為簡便,且存儲量更大。
雪旺細胞最早是在1939年被theodorschwann發現和命名的一種膠質細胞。雪旺細胞通過在外周神經系統中增殖,遷移和分化等形成鞘突,鞘和軸突一起構成了一個神經纖維。研究表明,雪旺細胞對周圍神經的發育和再生等影響重大。wang等通過移植技術將雪旺細胞移植到坐骨神經損傷處,成功使坐骨神經再生。因此,雪旺細胞對神經修復有重要意義。對雪旺細胞進行冷凍保存可以幫助更好地研究其生物學特徵和臨床應用。
技術實現要素:
本發明目的在於提供一種雪旺細胞的低溫凍存方法,減少被包埋的雪旺細胞在凍存過程中受到的損傷,提高復溫後雪旺細胞的存活率,並保證其正常的增殖情況。
為達到上述目的,採用技術方案如下:
利用受限空間中超分子水凝膠凍存雪旺細胞的方法,包括以下步驟:
將已貼壁的雪旺細胞經消化,離心,加入溶有凝膠因子的細胞全培養基並吹散,得到含有凝膠因子的雪旺細胞懸浮液;
將所得細胞懸浮液和凍存保護劑導入微流控裝置中;
將微流控裝置置於0~2℃冰水浴中,平衡4~5min;
最後將微流控裝置直接置於程序降溫盒,並放入-82~-78℃冰箱。
按上述方案,所述的凝膠因子為低分子量的胺基酸類凝膠因子;其濃度為0.75g/l,相轉變溫度為6-7℃。
按上述方案,所述的細胞全培養基為含有10vol%胎牛血清和1vol%雙抗的rpmi1640全培養基。
按上述方案,所述的微通道裝置由圓形毛細管、方形毛細管、聚四氟乙烯管、聚氨酯管組裝而成:
將圓形毛細管一端插入到方形毛細管中,保證方形毛細管的內壁和圓形毛細管的外壁緊貼;所述方形毛細管的長度較長;
使用聚四氟乙烯管一端套住圓形毛細管的伸出端並密封;
使用聚氨酯管套住聚四氟乙烯管、圓形毛細管和方形毛細管;所述聚氨酯管與方形毛細管重合的一端縮小管口徑並密封,另一端即為凍存保護劑的入口;
所用聚氨酯管側面開有孔,聚四氟乙烯管口從孔中伸出,即為細胞懸浮液入口。
按上述方案,所述的凍存保護劑為二甲基亞碸;濃度為6-10vol%。
本發明低分子量的胺基酸類凝膠因子通過非共價鍵自組裝形成超分子水凝膠具有良好的生物相容性。由於非共價鍵具有熱可逆性,因此所得超分子水凝膠也是熱可逆的。該超分子水凝膠通過調節凝膠因子濃度可保證其在低溫時形成凝膠相,在復溫即37℃時由凝膠相轉變為液相,因此可通過離心與細胞分離。同時,在細胞培養基和傳統的凍存保護劑中加入超分子凝膠,利用超分子凝膠的三維網絡結構和熱可逆性來降低細胞在凍存和復溫過程中的損傷,並解決復溫後囊膜材料的去除問題。
本發明微流控裝置製備簡單,可提供超分子水凝膠的受限空間。使超分子水凝膠形成纖維網絡更為緊密的球形三維網絡結構,在凍存過程中對細胞起到更好的保護作用。具體表現為:束縛水分子,降低體系冰點,限制冰晶的生長空間,減少冰晶損傷;減小滲透速率,減緩由於凍存保護劑的加入和去除而引起的滲透壓的變化,從而減少細胞滲透和體積變化損傷,以提高細胞復溫後的存活率。
本發明與現有技術相比,主要具有以下優點:
在凍存過程中利用超分子水凝膠特殊的三維網絡多孔結構保護細胞免受凍存傷害,提高細胞復溫後的存活率,又保證了它在復溫後能完全去除,不影響細胞的貼壁,增殖和分化等活動。
由於超分子水凝膠在受限空間中形成的交聯網絡結構較非受限空間更加緊密,因此在微通道中的超分子水凝膠比微通道外的超分子水凝膠對細胞的冷凍保護更好。微流控技術作為一種微米規模的技術手段,其尺度剛好與細胞大小吻合,且相對傳統的細胞培養技術,微流控設備可以對細胞所處的微環境做更為靈活精準的控制。與軟刻蝕法得到的微通道裝置相比,利用玻璃毛細管得到的微流控裝置成本更低,製作更為簡單,且可凍存體積更大。
由於受限空間內超分子水凝膠的結構可起到很好的冷凍保護作用,因而可通過微流控精準調控凍存保護劑的用量,在傳統用量的基礎上適當降低所加入凍存保護劑的濃度,這樣就更進一步的減少了細胞的毒性傷害,再次提高細胞的存活率。
附圖說明
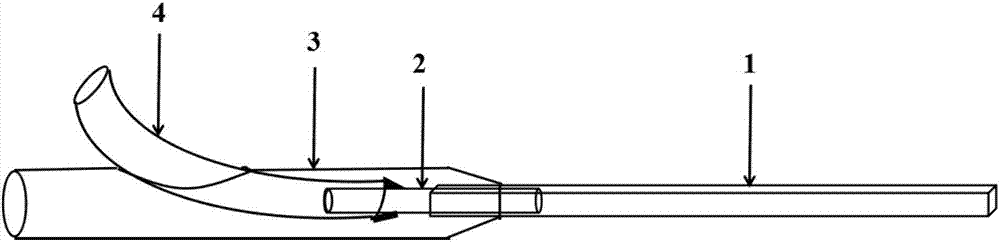
圖1:dsc分析圖;
圖2:微流控裝置的示意圖;
圖3:載玻片上的超分子水凝膠微觀形貌;
圖4:微流控裝置內超分子水凝膠的微觀形貌;
圖5:各組復溫後雪旺細胞的存活率;
圖6:各組復溫後細胞的存活和增殖情況;
其中:1-方形毛細管,2-圓形毛細管,3-聚氨酯管,4-聚四氟乙烯管。
具體實施方式
以下實施例進一步闡釋本發明的技術方案,但不作為對本發明保護範圍的限制。
實施例1:超分子水凝膠的製備及其性能研究
以boc-l-酪氨酸甲酯、dmf和溴代十二烷等為原料合成凝膠因子十二烷基-boc-l-酪氨酸,記為凝膠因子bdt。該凝膠因子的合成方法如下:
(1)十二烷基-boc-l-酪氨酸甲酯(bdte)的合成(boc-l-酪氨酸甲酯烷基化):
稱取3.998g(0.0135mol)boc-l-酪氨酸甲酯置於25ml圓底燒瓶中,加入10mldmf,待原料完全溶解後,再加入3.7113gk2co3(0.027mol)作為縛酸劑,後加入4ml溴代十二烷(0.0167mol),室溫反應12h。反應結束後加20ml水洗滌,抽濾、洗滌濾餅、真空乾燥24h後得到得白色固體。無水乙醇(20ml)重結晶1次,得純淨的白色固體。
(2)bdt的合成(bdte的水解反應):
將0.5007g(0.0011mol)bdte置於25ml燒瓶中用10ml乙醇溶解,在冰水浴下逐滴加入1mol/l的naoh溶液1.7ml(0.0017mol),在0℃左右反應1h,室溫反應5h。在強烈攪拌下向反應體系中逐滴加入0.2mol/l的冰鹽酸(25ml)溶液至ph為1~2,抽濾,真空乾燥24h得0.4858g白色固體。
該凝膠因子bdt可通過加熱溶於細胞培養基,並在低溫時形成具有三維網絡結構的超分子水凝膠,且該超分子水凝膠熱可逆,在溫度回升至其相轉變溫度以上時可恢復至液態。
將1.5g/l的bdt在50~55℃條件下溶於細胞培養基溶液,記為溶液s。通過倒置法確定溶液s可在3~5℃冰水浴中形成超分子水凝膠,記為凝膠g。通過升高體系溫度,利用落球法測試得到凝膠g的相轉變溫度為6.5℃,遠低於細胞復溫時的37℃。因此可選用溶液s導入到微通道作為細胞凍存時的培養基,使其在受限空間形成特殊的三維網絡結構以保護細胞。
以加入了10vol%的dmso的rpmi1640培養基作為空白組,在空白組的基礎上加入1.5g/l的bdt的混合溶液作為凝膠組,對兩組培養基溶液做dsc測試,結果如圖1所示,空白組體系冰點為-17.03℃,而加入了bdt的凝膠組體系冰點為-20.46℃,相比空白組冰點有所下降,說明g的空間網絡結構可有效降低體系冰點,減少細胞在凍存過程中的冰晶損傷。
實施例2:微流控裝置的製備和微流控裝置內超分子水凝膠的形貌
微流控裝置的製備主要採用購自北京中成石英玻璃製品有限責任公司的石英玻璃毛細管。具體製備過程如下:將長度為40mm的圓形毛細管(內徑0.4mm,外徑0.7mm)插入到聚四氟乙烯管(內徑1.0mm,外徑1.3mm,購自無錫海新塑料製品有限公司)中,連接處通過環氧樹脂膠和矽膠質量比為1:1的環氧結構膠(購自美國itwdevcon公司)粘接密封,固化約30min。用剪刀在聚氨酯管(內徑2.0mm,外徑2.8mm,購自無錫海新塑料製品有限公司)的上方開一小孔,將聚四氟乙烯管的另一端自聚氨酯管內部插入,從小孔處插出,連接處用環氧結構膠粘結密封。將圓形毛細管的另一端插入到長度為110mm的方形毛細管(內徑0.7mm,外徑0.9mm)中,兩管重合部分為20mm。方形毛細管的同一端插入到聚氨酯管有聚四氟乙烯管插入的一端中,連接處用環氧結構膠粘結密封,待環氧結構膠固化1~2h,微流控裝置製作完成。
如圖2所示,所述微流控裝置由方形毛細管1、圓形毛細管2、聚氨酯管3、以及聚四氟乙烯管4組裝而成。
用一次性注射器吸取0.5ml的溶液s,將一次性注射器針頭插入到聚四氟乙烯管中,將一次性注射器固定在微量注射器泵(購自美國farmingdale公司)上,調節流速為50μl/min,將溶液s導入微通道中。將微流控裝置置於0~2℃冰箱中20min,再置於光學顯微鏡下觀察。此外將溶液s滴在載玻片上,待其自然流平,置於4℃冰箱中20min,也置於光學顯微鏡下觀察。圖3和圖4分別為在s溶液在載玻片上以及微流控裝置中所形成的超分子水凝膠的形貌。
實施例3:低溫凍存大鼠雪旺細胞
1.細胞的獲得與培養:雪旺細胞(atcc:crl:2765)是由湖北生物材料工程技術研究中心從健康成年的雄性大鼠上提取並提供而得。用25ml的t型培養瓶將雪旺細胞培養在含有10vol%胎牛血清和1vol%雙抗的rpmi1640培養基中,將培養瓶放置在含有5%co2,且溫度可持續維持在37℃的細胞培養箱中。細胞在培養瓶中貼壁生長,增殖。當細胞增殖到培養瓶底部沒有空隙時,加入胰蛋白酶(0.25vol%)進行消化,使貼壁的細胞懸浮,將含有胰蛋白酶的細胞懸浮液移入離心管,以1000r/min的轉速離心8min,吸棄上清,再次加入全培養基並吹散細胞,將細胞接種到多個培養瓶中,繼續置於培養箱中培養。
2.添加凝膠因子的雪旺細胞的凍存管中凍存與復溫
(1)將已貼壁且處於對數期的細胞用0.25%胰蛋白酶消化,使細胞懸浮於全培養基中,將含有胰蛋白酶的細胞懸浮液分為等量兩組:空白組,凝膠組。將兩組細胞懸浮液分別移入離心管,每組均用高速離心機離心8min,(設定轉速為1000r/min),使細胞沉於底部,棄上清。
(2)空白組用全培養基吹散細胞,凝膠組用加入了1.5g/lbdt的全培養基吹散細胞,調整細胞濃度為2×106cells/ml,兩組分別取0.5ml細胞懸浮液置於2ml凍存管中,在4℃冰水浴中滴加0.5ml的冷凍保護劑i(在全培養基中加入20vol%dmso,得到冷凍保護劑i),在滴加冷凍保護劑過程同時應輕輕晃動凍存管使dmso和細胞懸浮液混合均勻,防止溶解放熱等因素對細胞造成損傷。
(3)將兩組凍存管放置於程序降溫盒中,再將降溫盒置於-80℃的恆溫冰箱,程序降溫盒可以使降溫速率保持在1℃/min。
(4)復溫:將程序降溫盒置於-80℃恆溫冰箱保存24h後,取出程序降溫盒中的兩組凍存管,並快速轉移到37℃恆溫水浴復溫,使整個體系恢復至液態。將兩組凍存管中的細胞懸浮液吸出,加入到15ml離心管中,加入9ml全培養基,經1000r/min的速度離心15min,使細胞沉澱在離心管下方,棄上清,再加入10ml全培養基,重複離心一次。棄上清,加入4ml全培養基,轉移到培養瓶中,在細胞培養箱中培養。
3.添加凝膠因子的雪旺細胞的微流控技術凍存與復溫
(1)在已貼壁的細胞中加入0.25%濃度的胰蛋白酶,使細胞消化後懸浮於全培養基中,將含有胰蛋白酶的細胞懸浮液吸出,加到離心管中,並用高速離心機離心8min,(設定轉速為1000r/min),棄上清。向細胞中加入含有1.5g/lbdt的全培養基並吹散,調整細胞濃度為:2×106cells/ml,得到純淨的細胞懸浮液。
(2)將微流控裝置分為a,b兩組。向a組微流控裝置中加入冷凍保護劑i,b組微流控裝置中加入冷凍保護劑ii(在全培養基中加入12vol%dmso,得到冷凍保護劑ii)。兩組操作步驟相同。具體操作過程如下:用注射器1吸取0.5ml冷凍保護劑,注射器2吸取0.5ml細胞懸浮液,注射器1和聚氨酯管相連,注射器2和聚四氟乙烯管相連。將兩注射器分別固定於兩臺微流量注射泵上,調節流速為5~7μl/min,將含有凝膠因子bdt的雪旺細胞懸浮液和冷凍保護劑同時導入微流控裝置中。將微流控裝置置於0~2℃冰水浴中,平衡4~5min。
(3)將兩組微流控裝置置於梯度降溫盒中,再將降溫盒置於-80℃的恆溫冰箱中,使整個體系以1℃/min的降溫速率降至-80℃。因此,凍存時的兩組含全培養基的細胞懸浮液中,加入的其他成分的最終配比分別為:微流控a組:0.75g/lbdt+10vol%dmso;微流控b組:0.75g/lbdt+6vol%dmso。
(4)復溫:將程序降溫盒置於-80℃恆溫冰箱保存24h後,取出程序降溫盒中的微流控裝置,並置於37℃恆溫水浴中解凍,使體系恢復至液態。用注射器吸取0.5ml全培養基,將聚四氟乙烯管和注射器相連,在方形毛細管出口端置於離心管中,再將注射器固定在微流量注射泵上,設定流速為30μl/min,將微流控裝置中的雪旺細胞衝洗到離心管中,衝洗3-5次,經1000r/min的速度離心15min,使細胞沉澱在離心管下方,棄上清,再加入10ml全培養基,重複離心一次。棄上清,加入4ml全培養基,轉移到培養瓶中,在細胞培養箱中培養。
實施例4:復溫後雪旺細胞的檢測
1.臺盼蘭排斥實驗
本發明使用臺盼藍排斥試驗來檢測復溫後大鼠雪旺細胞的死活,從而計算和比較不同的凍存方式下每組雪旺細胞的存活率。具體操作方法如下:
(1)接種雪旺細胞:取每組復溫後離心過的大鼠雪旺細胞懸浮液,調整細胞密度為6×103cells/ml。按照每孔90μl的體積標準接種於96孔培養板中,每組接種6個孔;
(2)臺盼藍染色:在接種了細胞的96孔培養板中,選擇一組中的一個孔,加入10μl0.4%的臺盼藍溶液(將4%臺盼藍母液用pbs緩衝溶液稀釋10倍製得),吹打混勻;
(3)計數:迅速將細胞懸浮液充入血球計數板,並移至倒置顯微鏡鏡頭下觀察,在染色後3分鐘內,於顯微鏡鏡下觀察,此時,淡藍色的細胞是被臺盼藍染色成功的死細胞,沒有被染上顏色的則是活細胞,快速記下死細胞和活細胞的數目。根據公式(4-1)求細胞存活率,並對其他每組各孔重複(2)、(3),取各組細胞存活率的平均值。
圖5為復溫後各組雪旺細胞的平均存活率。
對比在凍存管中凍存的對照組和凝膠組,顯然添加了0.75g/lbdt的凝膠組的雪旺細胞平均存活率更高。此外,在微流控裝置中凍存的兩組細胞復活率均高於凍存管中的兩組細胞。綜合比較來看,加入了6vol%dmso的微流控凍存組相比含有10vol%dmso的凍存管組的細胞平均存活率要更高。
2.mtt比色實驗
本發明使用mtt比色實驗的方法來檢測經凍存管凍存和微通道凍存兩種凍存方式凍存,復溫後各組大鼠雪旺細胞的存活與生長情況。具體實驗方法如下:
(1)接種雪旺細胞:雪旺細胞經兩種凍存方式凍存24h復溫並離心後,調整細胞懸浮液密度為6×103cells/ml,按照每孔100μl的體積標準接種到96孔細胞培養板中,其中每組需要接種5塊培養板,每塊培養板中每組細胞至少接種6個孔;
(2)96孔培養板中的培養:將96孔培養板放置在細胞培養箱中,培養0.5天,1天,2天,3天,5天後分別取出一塊培養板做後續測試和處理,培養過程中,若96孔板中全培養基顏色發生變化,則需立即更換全培養基,確保活細胞的正常生長和增殖;
(3)mtt呈色:將各組的96孔細胞培養板做相同mtt呈色處理:每孔加入20μlmtt溶液(5mg/ml,即0.5%mtt),隨後繼續放置在細胞培養箱中,4h後,取出96孔培養板,小心吸棄孔內培養上清液,每個孔都小心加入體積為150μl的dmso,孔底迅速出現紫色結晶。並將96孔細胞培養板置於搖床,震蕩15min左右至紫色結晶完全溶解;
(4)測定吸光值:將96孔板置於酶標儀中,先用連續波長測定一個孔吸收曲線,找出吸收的峰值對應的波長為550nm,用次波長測定吸光值。記錄數據;
(5)整理數據:將每組培養了0.5天,1天,2天,3天,5天的細胞經mtt比色實驗所測吸光值整理,以所測吸光值為y軸,以測定的生長時間為x軸,得到細胞的增殖曲線。
圖6為各組雪旺細胞復溫後0.5天到5天內的存活和增殖情況。
實驗結果顯示,加入了凝膠因子bdt後的凍存組其雪旺細胞存活率相比空白組更高,且凝膠因子的加入沒有影響到復溫後細胞的增殖情況,說明超分子水凝膠在復溫後被去除乾淨;在微通道中的凍存組復溫後的存活率顯然高於凍存管中的雪旺細胞。綜合比較來看,加入了6vol%dmso的微流控凍存組相比含有10vol%dmso的凍存管組有更好的凍存保護效果。這意味著利用受限空間內的超分子水凝膠既可以減少細胞的冷凍傷害,又可以通過降低冷凍保護劑的濃度,減小對細胞的毒性傷害。
