一種集成化藥物篩選與染色微流控晶片的製作方法
2023-10-29 01:20:35 4
本實用新型涉及微流控技術和聚合物晶片的設計、加工、製作和應用技術領域,特別提供了一種集成化藥物篩選與染色微流控晶片。
背景技術:
現有技術中,微流控晶片是一種在微小通道中操控微小體積流體流動的系統,其中通道的尺度為幾十到幾百微米,承載流體的量為10-9~10-18L。微流控晶片的各個操作單元通過微通道網絡內流體的流動相互聯繫。微流體控制是微流控晶片實驗室的操作核心,所涉及的進樣、混合、反應、分離等過程都是在可控流體的運動中完成的。無論是宏觀還是微觀流體,閥都是流體控制的核心部件。由於其重要性,微型閥的研製早在微流控晶片誕生之前引起人們的廣泛關注。理論上講,凡是能控制微通道閉合和開啟狀態的部件均可作為微流控晶片中的微閥使用。一個理想的微閥應該具備以下特徵:低洩漏、低功耗、響應速度快、線性操作能力和適應面廣。微流體和微型閥構成了一套完整的微流控晶片系統。
微流控分析的核心是利用微流控晶片將樣品預處理、生物和化學反應、分離檢測等基本操作單元集成在具有微米或納米微通道網絡的晶片上,通過操控流體完成複雜的分析過程,具有樣品和試劑消耗量少、分析時間短、高通量、容易實現大規模平行測定等優點。利用微流控分析技術可方便的實現分析系統的小型化、集成化和便攜化。目 前,該系統被廣泛應用在生命科學、疾病診斷與治療、藥物合成與篩選等領域。
細胞水平藥物篩選微流控晶片系統旨在通過設計有不同功能的晶片來培養細胞,對細胞施加藥物刺激,並配合自動化的檢測裝置,採集藥物與細胞相互作用的信號,收集數據,從而分析藥物的作用,進行篩選並得到篩選結果。該系統的優點在於通過對樣品全分析過程的微縮化和集成化,實現高靈敏的快速檢測,高通量輸出以及在線自動化操作等功能,較以往的細胞水平篩選技術表現出極大的優勢,非常適合藥物成分的篩選。
免疫螢光染色技術是將抗體分子與一些示蹤物質結合,利用抗原抗體反應進行組織或細胞內抗原物質定位的技術,是用於觀察細胞內蛋白質分布和定位的普遍方法。免疫螢光染色的傳統做法需要消耗大量的試劑,人力和時間,特別是某些珍貴抗體的消耗,限制了傳統方法的使用。微流控晶片技術以其大大減少樣品消耗,節省人工及時間成本,可在釐米見方的空間上實現自動化、高通量的實驗等優勢,受到了廣泛的關注。
人們迫切希望獲得一種技術效果優良的集成化藥物篩選與染色微流控晶片的製備方法。
技術實現要素:
本發明的目的是提供一種技術效果優良的集成化藥物篩選與染色微流控晶片的製備方法。以解決以往細胞藥物篩選與染色過程中存在的操作步驟繁瑣複雜、消耗大量試劑等局限。
本發明提供了一種集成化藥物篩選與染色微流控晶片,所述微流控晶片由上層、下層、底面三層順序串聯貼合布置組成,其中:上層為液路控制層,下層為氣路控制層,底面為空白玻璃底板;
所述液路控制層具體設置有下述結構:
——細胞螢光染色進樣口:位於在整個液路控制層的最上遊;其設置有至少兩個以其為入口的通道相互並聯並最終匯成一個共用的通道;最終匯成的共用通道還分別連接著下遊的細胞培養室和液體流出通道;
——螢光染色進樣通道區(P1):布置在細胞螢光染色進樣口和細胞進樣通道區(P2)之間用於溝通二者;
——細胞進樣口:其設置有至少兩個,每一個細胞進樣口都設置在細胞進樣通道區(P2)中的其中一條通道上,且前述細胞進樣通道區(P2)中的每一條通道都串接著一個細胞培養室;
——細胞進樣通道區(P2):設置在螢光染色進樣通道區(P1)和細胞培養室之間;
——細胞培養室:至少有二個,布置在細胞進樣通道區(P2)和藥物進樣通道區(P3)之間;
——藥物進樣通道區(P3):其為包括覆蓋所有細胞培養室和藥物進樣口之間的通道的區域;
——藥物進樣口:其數量和細胞培養室相等,各自布置在每一個細胞培養室下遊的通道上;
——液體流出通道區(P4):其布置在細胞培養室下遊通道的下 遊和整個液路最尾端的出液口(13)之間;
——出液口(13):布置在整個液路控制層所有結構的最下遊。
所述集成化藥物篩選與染色微流控晶片,其特徵在於:所述集成化藥物篩選與染色微流控晶片還滿足下述要求:
細胞培養室設置有四個,與之對應的在細胞進樣通道區(P2)上遊的細胞進樣口和下遊藥物進樣通道區(P3)的藥物進樣口也都有四個;每一條通道上從上遊開始依次串接布置有1個細胞進樣口、1個細胞培養室、1個藥物進樣口。
所述集成化藥物篩選與染色微流控晶片,其特徵在於:所述集成化藥物篩選與染色微流控晶片還滿足下述要求之一或其組合:
其一,細胞螢光染色進樣口設置有四個,所述集成化藥物篩選與染色微流控晶片中設置有四個以細胞螢光染色進樣口為入口的通道,其相互並聯並最終匯成一個共用的通道;最終匯成的共用通道再次一分為四,變成四條各自設置有一個細胞進樣口的四條通道,每個細胞進樣口還分別依次連接著下遊的細胞培養室、藥物進樣口和再之後的液體流出通道;
其二,液體流出通道區(P4):其是將細胞培養室下遊的至少兩條通道合併為最終的共用的一個出液口(13)的通道合併區域;
其三,所述微流控晶片的下層即氣路控制層具體由泵閥控制區組成,每個螢光染色液體入口有單獨的泵閥單元控制,以使進樣液體互 相不影響;氣路控制層具體包含有下述結構之一或其組合:設置在各個細胞進樣口上遊的控制用的閥;設置在各個藥物進樣口下遊的控制用的閥;設置在各個細胞螢光染色進樣口下遊通道上的控制用的閥;所述微晶片的所有控制用的閥均為常閉閥,使用時打開。
所述集成化藥物篩選與染色微流控晶片,其特徵在於:所述集成化藥物篩選與染色微流控晶片還滿足下述要求之一或其組合:
其一,每個細胞培養室由單獨的細胞培養液入口、藥物入口、螢光染色液入口、進樣通道組成;
其二,至少兩個並聯的細胞培養室(圖1中)共同組成液路層;
其三,所述上層晶片和下層晶片的材料均為聚二甲基矽氧烷PDMS聚合物,上層晶片厚1~5mm,下層晶片厚100~500μm;
其四,所述細胞培養室的尺寸為15mm×2mm×100μm的長梭形;
其五,所述晶片的氣路和液路通道高度相同,均為80~200μm;
其六,所述晶片的氣路和液路通道寬度不同,氣路通道寬度為100~300μm,液路通道寬200~600μm。
所述集成化藥物篩選與染色微流控晶片,其特徵在於:所述集成化藥物篩選與染色微流控晶片還滿足下述要求:
所述液路層為基於SU-8模板所得的PDMS模塊;氣路層是在製作成功的氣路SU-8模板上甩一層高於模板10~50μm的聚二甲基矽 氧烷PDMS膜,所述液路層的聚二甲基矽氧烷PDMS模板有結構一側封接到氣路層聚二甲基矽氧烷PDMS膜無結構一側,氣路層聚二甲基矽氧烷PDMS膜有閥結構一側等離子鍵合到潔淨的玻璃片上。
本發明還要求保護一種如上所述集成化藥物篩選與染色微流控晶片的製備方法,其特徵在於:所述集成化藥物篩選與染色微流控晶片的製備方法相關步驟依次要求如下:
(1)採用光刻和腐蝕方法製備出通道部分凸起的光刻膠SU-8模板;
(2)用乳酸乙酯對光刻膠SU-8模板進行顯影,165℃~180℃堅膜1~3h;
(3)將晶片下層的光刻膠SU-8模板用矽烷化試劑處理5~10min,使PDMS容易剝離模板底面;
(4)將聚二甲基矽氧烷PDMS與引發劑以體積比(5~20):1混合均勻,分別澆注於晶片上、下層結構光刻膠SU-8模板,80℃烘箱固化20~40min,將聚二甲基矽氧烷PDMS與晶片上層光刻膠SU-8模板剝離,得到帶有結構的聚二甲基矽氧烷PDMS晶片;
(5)將晶片上層帶有結構的一側與光刻膠SU-8模板上無結構的晶片下層進行氧等離子體處理1~3min,70~90℃熱烘30~60min,進行不可逆封接;
(6)將上述封接好的聚二甲基矽氧烷PDMS晶片與下層結構光刻膠SU-8模板剝離,與乾淨的空白玻璃片經過氧等離子體處理1~3 min,70~90℃熱烘30~60min進行不可逆封接,即得到集成化藥物篩選與染色微流控晶片。
所述集成化藥物篩選與染色微流控晶片的製備方法,其特徵在於:所述集成化藥物篩選與染色微流控晶片的製備方法還滿足下述要求:所述微流控晶片的細胞培養室中在接種細胞且細胞鋪滿培養區域底面後,在藥物進樣區加入藥物刺激;細胞培養周期結束,固定細胞,進行螢光染色。
本發明利用微流體與微型閥技術,製備了一種集細胞培養、藥物篩選與螢光染色為一體,三種檢測指標相繼進行的微流控晶片。整個晶片平臺結構簡單,操作方便,集成度高,分析速度快,效率高,無需任何複雜和昂貴的設備,無需大量細胞與試劑消耗。綜上所述,發明一種方便,快捷,集成度高,應用範圍廣的集成化藥物篩選與染色微流控晶片具有十分重要意義的。
本發明解決了以往細胞藥物篩選與染色過程中存在的操作步驟繁瑣複雜、消耗大量試劑等技術局限。本發明製備過程穩定,操作簡單,集成度高。
本發明所述集成化藥物篩選與染色微流控晶片的用途說明:該晶片可用於施加不同濃度藥物刺激對細胞生物學特性研究,並對該條件下的細胞狀態進行螢光染色檢測。所述集成化微流控晶片可進行不同種類的細胞培養,可進行不同種類或不同濃度的藥物刺激,可進行不 同種類的抗體染色。
本發明的優點在於:1、操作簡便、快捷;2、細胞與試劑用量少,實驗成本低廉;3、不接觸有毒有害試劑,環境友好;4、高度集成化、應用範圍廣泛。
附圖說明
下面結合附圖及實施方式對本發明作進一步詳細的說明:
圖1為集成化藥物篩選與染色微流控晶片結構示意簡圖;
圖2為集成化藥物篩選與染色微流控晶片上層結構示意圖;
圖3為集成化藥物篩選與染色微流控晶片下層結構示意圖。
具體實施方式
附圖標記含義如下:
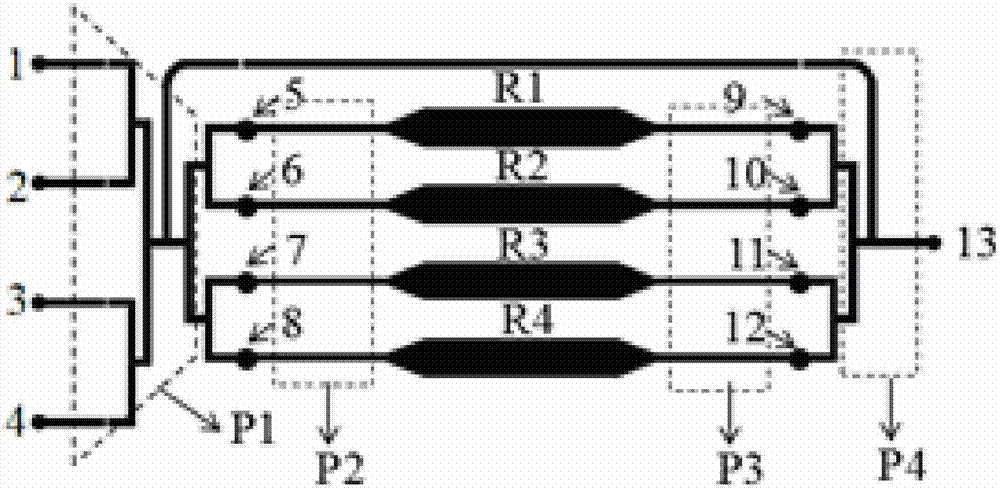
圖1中,附圖標記1~4均為細胞螢光染色進樣口,其具體分別為:一抗入口1、二抗入口2、細胞核染料入口3、PBS緩衝液入口4;螢光染色進樣通道P1;5~8分別為細胞進樣口一5、細胞進樣口二6、細胞進樣口三7、細胞進樣口四8;細胞進樣通道P1;R1~R4分別為:細胞培養室一R1、細胞培養室二R2、細胞培養室三R3、細胞培養室四R4,可同時培養4種不同種類細胞;9~12分別為:藥物進樣口一9、藥物進樣口二10、藥物進樣口三11、藥物進樣口四12;藥物進樣通道P3,可同時加入不同種類藥物或同種不同濃度藥物;液體流出通道P4,出液口13;A~D為分別控制附圖標記為1~4的四個細胞 螢光染色進樣口的閥,四者分別為:閥一A、閥二B、閥三C、閥四D;另有:控制染料排出的閥五E、控制藥物排出的閥六J;附圖標記F~I是分別控制附圖標記為5~8的各個細胞進樣口的閥,分別具體是:閥七F、閥八G、閥九H、閥十I;附圖標記K~N為分別控制附圖標記9~12這四個藥物進樣口的閥,其具體是:閥十一K、閥十二L、閥十三M、閥十四N;
圖1、圖2中,基體材料的邊界線省略未畫出,圖3中基體材料的邊界線即外部的矩形框僅為示意;特此說明。
實施例1
一種集成化藥物篩選與染色微流控晶片,所述微流控晶片由上層、下層、底面三層順序串聯貼合布置組成,其中:上層為液路控制層,下層為氣路控制層,底面為空白玻璃底板;
所述液路控制層具體設置有下述結構:
——細胞螢光染色進樣口:位於在整個液路控制層的最上遊;其設置有至少兩個以其為入口的通道相互並聯並最終匯成一個共用的通道;最終匯成的共用通道還分別連接著下遊的細胞培養室和液體流出通道;
——螢光染色進樣通道區(P1):布置在細胞螢光染色進樣口和細胞進樣通道區(P2)之間用於溝通二者;
——細胞進樣口:其設置有至少兩個,每一個細胞進樣口都設置在細胞進樣通道區(P2)中的其中一條通道上,且前述細胞進樣通道區(P2)中的每一條通道都串接著一個細胞培養室;
——細胞進樣通道區(P2):設置在螢光染色進樣通道區(P1)和細胞培養室之間;
——細胞培養室:至少有二個,布置在細胞進樣通道區(P2)和藥物進樣通道區(P3)之間;
——藥物進樣通道區(P3):其為包括覆蓋所有細胞培養室和藥物進樣口之間的通道的區域;
——藥物進樣口:其數量和細胞培養室相等,各自布置在每一個細胞培養室下遊的通道上;
——液體流出通道區(P4):其布置在細胞培養室下遊通道的下遊和整個液路最尾端的出液口(13)之間;
——出液口(13):布置在整個液路控制層所有結構的最下遊。
所述集成化藥物篩選與染色微流控晶片還滿足下述要求:細胞培養室設置有四個,與之對應的在細胞進樣通道區(P2)上遊的細胞進樣口和下遊藥物進樣通道區(P3)的藥物進樣口也都有四個;每一條通道上從上遊開始依次串接布置有1個細胞進樣口、1個細胞培養室、1個藥物進樣口。
所述集成化藥物篩選與染色微流控晶片還滿足下述要求之一或其組合:
其一,細胞螢光染色進樣口設置有四個,所述集成化藥物篩選與染色微流控晶片中設置有四個以細胞螢光染色進樣口為入口的通道, 其相互並聯並最終匯成一個共用的通道;最終匯成的共用通道再次一分為四,變成四條各自設置有一個細胞進樣口的四條通道,每個細胞進樣口還分別依次連接著下遊的細胞培養室、藥物進樣口和再之後的液體流出通道;
其二,液體流出通道區(P4):其是將細胞培養室下遊的至少兩條通道合併為最終的共用的一個出液口(13)的通道合併區域;
其三,所述微流控晶片的下層即氣路控制層具體由泵閥控制區組成,每個螢光染色液體入口有單獨的泵閥單元控制,以使進樣液體互相不影響;氣路控制層具體包含有下述結構之一或其組合:設置在各個細胞進樣口上遊的控制用的閥;設置在各個藥物進樣口下遊的控制用的閥;設置在各個細胞螢光染色進樣口下遊通道上的控制用的閥;所述微晶片的所有控制用的閥均為常閉閥,使用時打開。
所述集成化藥物篩選與染色微流控晶片還滿足下述要求之一或其組合:
其一,每個細胞培養室由單獨的細胞培養液、藥物刺激、螢光染色液體入口、進樣通道組成;
其二,至少兩個並聯的細胞培養室(圖1中)共同組成液路層;
其三,所述上層晶片和下層晶片的材料均為聚二甲基矽氧烷PDMS聚合物,上層晶片厚1~5mm,下層晶片厚100~500μm;
其四,所述細胞培養室的尺寸為15mm×2mm×100μm的長梭形;
其五,所述晶片的氣路和液路通道高度相同,均為80~200μm;
其六,所述晶片的氣路和液路通道寬度不同,氣路通道寬度為100~300μm,液路通道寬200~600μm。
所述集成化藥物篩選與染色微流控晶片還滿足下述要求:
所述液路層為基於SU-8模板所得的PDMS模塊;氣路層是在製作成功的氣路SU-8模板上甩一層高於模板10~50μm的聚二甲基矽氧烷PDMS膜,所述液路層的聚二甲基矽氧烷PDMS模板有結構一側封接到氣路層聚二甲基矽氧烷PDMS膜無結構一側,氣路層聚二甲基矽氧烷PDMS膜有閥結構一側等離子鍵合到潔淨的玻璃片上。
一種如上所述集成化藥物篩選與染色微流控晶片的製備方法,其相關步驟依次要求如下:
(1)採用光刻和腐蝕方法製備出通道部分凸起的光刻膠SU-8模板;
(2)用乳酸乙酯對光刻膠SU-8模板進行顯影,165℃~180℃堅膜1~3h;
(3)將晶片下層的光刻膠SU-8模板用矽烷化試劑處理5~10min,使PDMS容易剝離模板底面;
(4)將聚二甲基矽氧烷PDMS與引發劑以體積比(5~20):1混合均勻,分別澆注於晶片上、下層結構光刻膠SU-8模板,80℃烘箱固化20~40min,將聚二甲基矽氧烷PDMS與晶片上層光刻膠SU-8 模板剝離,得到帶有結構的聚二甲基矽氧烷PDMS晶片;
(5)將晶片上層帶有結構的一側與光刻膠SU-8模板上無結構的晶片下層進行氧等離子體處理1~3min,70~90℃熱烘30~60min,進行不可逆封接;
(6)將上述封接好的聚二甲基矽氧烷PDMS晶片與下層結構光刻膠SU-8模板剝離,與乾淨的空白玻璃片經過氧等離子體處理1~3min,70~90℃熱烘30~60min進行不可逆封接,即得到集成化藥物篩選與染色微流控晶片。
所述集成化藥物篩選與染色微流控晶片的製備方法還滿足下述要求:所述微流控晶片的細胞培養室中在接種細胞且細胞鋪滿培養區域底面後,在藥物進樣區加入藥物刺激;細胞培養周期結束,固定細胞,進行螢光染色。
本實施例利用微流體與微型閥技術,製備了一種集細胞培養、藥物篩選與螢光染色為一體,三種檢測指標相繼進行的微流控晶片。整個晶片平臺結構簡單,操作方便,集成度高,分析速度快,效率高,無需任何複雜和昂貴的設備,無需大量細胞與試劑消耗。綜上所述,發明一種方便,快捷,集成度高,應用範圍廣的集成化藥物篩選與染色微流控晶片具有十分重要意義的。
本實施例解決了以往細胞藥物篩選與染色過程中存在的操作步驟繁瑣複雜、消耗大量試劑等技術局限。本實施例製備過程穩定,操作簡單,集成度高。
本實施例所述集成化藥物篩選與染色微流控晶片的用途說明:該晶片可用於施加不同濃度藥物刺激對細胞生物學特性研究,並對該條件下的細胞狀態進行螢光染色檢測。所述集成化微流控晶片可進行不同種類的細胞培養,可進行不同種類或不同濃度的藥物刺激,可進行不同種類的抗體染色。
本實施例的優點在於:1、操作簡便、快捷;2、細胞與試劑用量少,實驗成本低廉;3、不接觸有毒有害試劑,環境友好;4、高度集成化、應用範圍廣泛。
實施例2
集成化藥物篩選與染色晶片採用光刻和腐蝕方法製備出通道部分突起的SU-8模板,晶片上下層結構分別由兩個SU-8模板反模PDMS組成;兩個SU-8模板同時製作,取兩塊潔淨的玻璃片,在甩膠機上甩SU-8膠厚度為100μm,95℃前烘20min,自然降溫,將晶片上下層結構的兩個掩膜置於SU-8膠平板上面,紫外曝光30s,95℃後烘20min,自然降溫;最後,採用乳酸乙酯將上述SU-8膠顯影5min,180℃堅膜2h,自然降溫,得到晶片模版。
實施例3
將晶片下層結構的SU-8模板用矽烷化試劑處理10min,使PDMS容易剝離模板底面;PDMS與引發劑以體積比10:1混合均勻,分別澆注於晶片上、下層結構SU-8模板,80℃烘箱固化40min,將PDMS 與晶片上層SU-8模板剝離,得到帶有結構的PDMS晶片;將晶片上層帶有結構的一側與SU-8模板上無結構的晶片下層進行氧等離子體處理2min,80℃熱烘1h,不可逆封接;將上述封接好的PDMS晶片與下層結構SU-8模板剝離,與乾淨的空白玻璃片經過氧等離子體處理2min,80℃熱烘1h進行不可逆封接,即得到集成化藥物篩選與染色微流控晶片。
圖1中,附圖標記1~4均為細胞螢光染色進樣口,其具體分別為:一抗入口1、二抗入口2、細胞核染料入口3、PBS緩衝液入口4;螢光染色進樣通道P1;5~8分別為細胞進樣口一5、細胞進樣口二6、細胞進樣口三7、細胞進樣口四8;細胞進樣通道P1;R1~R4分別為:細胞培養室一R1、細胞培養室二R2、細胞培養室三R3、細胞培養室四R4,可同時培養4種不同種類細胞;9~12分別為:藥物進樣口一9、藥物進樣口二10、藥物進樣口三11、藥物進樣口四12;藥物進樣通道P3,可同時加入不同種類藥物或同種不同濃度藥物;液體流出通道P4,出液口13;細胞螢光染色進樣通道將細胞螢光染色進樣口和細胞進樣口連接,細胞進樣通道將細胞進樣口和細胞培養室連接,藥物進樣通道將藥物進樣口和細胞培養室連接,液體流出通道將藥物進樣口和出液口連接;A~D為分別控制附圖標記為1~4的四個細胞螢光染色進樣口的閥,四者分別為:閥一A、閥二B、閥三C、閥四D;另有:控制染料排出的閥五E、控制藥物排出的閥六J;附圖標記F~I是分別控制附圖標記為5~8的各個細胞進樣口的閥,分別具體是:閥七F、閥八G、閥九H、閥十I;附圖標記K~N為分別控制 附圖標記9~12這四個藥物進樣口的閥,其具體是:閥十一K、閥十二L、閥十三M、閥十四N。
所有進樣口由單獨的閥控制,不同種類的細胞通過附圖標記分別為5~8的結構分別進入附圖標記分別為R1~R4的四個單獨的細胞培養室,待細胞生長穩定,從附圖標記分別為9~12的結構處加入不同藥物刺激細胞,分別將細胞固定液、細胞封閉液從附圖標記分別為5~8的結構處加入,隨後通過附圖標記分別為1~4的結構處分別加入一抗、二抗、細胞核染料和PBS衝洗後,進行螢光顯微鏡觀察。
