製備碳酸鋰的方法與流程
2023-09-22 21:45:45 2
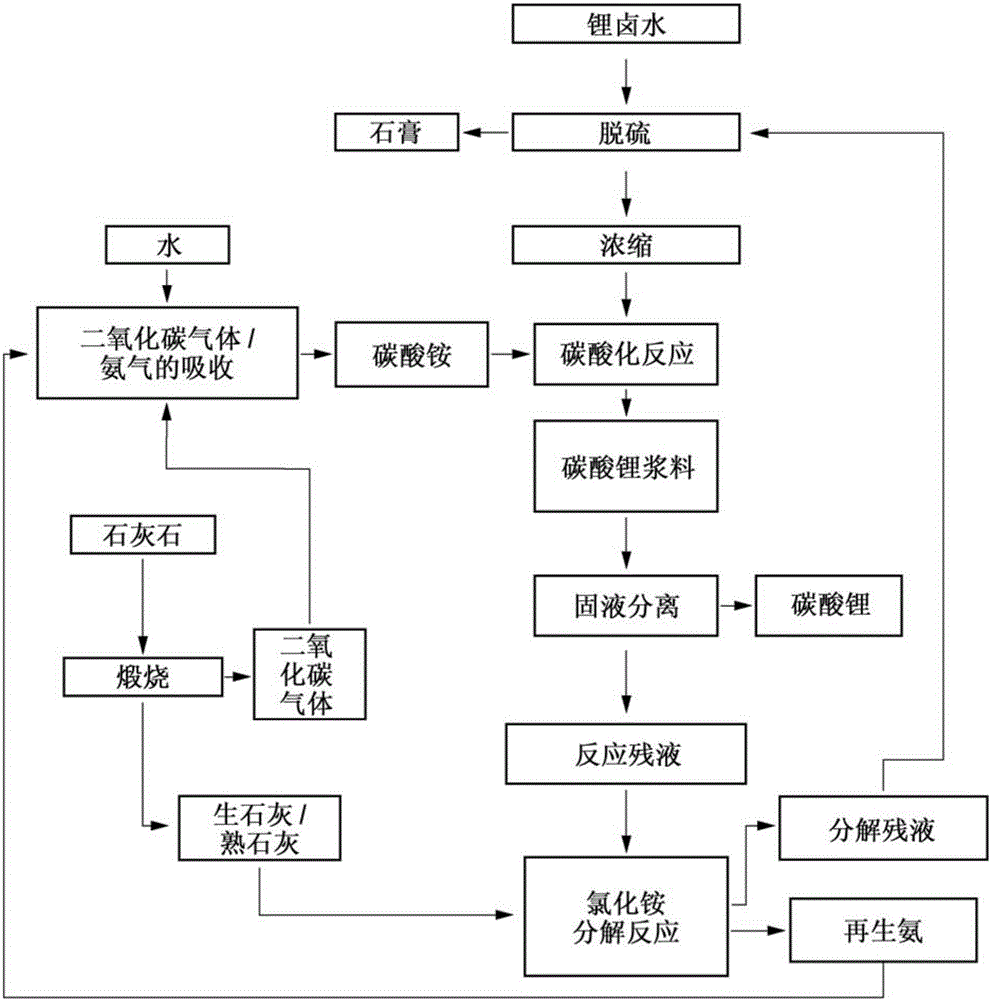
本發明涉及一種製備碳酸鋰的方法,該碳酸鋰特別可用作電子材料和光學工業材料的原料。更詳細地,本發明涉及一種製備碳酸鋰的方法,該方法由含碳酸鋰的滷水來有效地製造高純度碳酸鋰,該碳酸鋰具有特別可用作鋰電池材料的純度。更具體而言,本發明涉及一種製備碳酸鋰的方法,該方法在碳酸化反應中不會沉積能夠導致碳酸化反應裝置的操作中止的固定物(fixedmatters),能夠縮短製造時間並且具有優異的維護性能和生產效率。
背景技術:
:碳酸鋰被廣泛用作(例如)耐熱玻璃或光學玻璃的複合成分、陶瓷材料、行動電話或筆記本電腦的電池中所使用的鋰二次電池的原料、電解質的材料、以及半導體雷射器中所使用的鈮酸鋰單晶或鉭酸鋰單晶的原料。對於這些用途,碳酸鋰所需的性質(特性)是多樣的,並且根據應用目的的不同而變化。例如,當碳酸鋰用作電子材料或光學工業材料時,如果碳酸鋰含有大量的雜質,則電學性能或光學性能將會劣化。為此,需要含有較少雜質的高純度碳酸鋰。作為鋰二次電池的原料,需要純度為97%以上的碳酸鋰,優選純度為98%以上的碳酸鋰,更優選純度為99%以上的碳酸鋰,甚至還更優選純度為99.5%以上的碳酸鋰。此外,根據應用的目的,可能需要不同金屬和其他雜質的含量為若干ppm水平、特別地1ppm以下的高純度碳酸鋰。碳酸鋰由天然存在的鋰資源製備,並且其中鋰以高濃度大量存在的鋰資源的例子包括大陸鹽湖(intercontinentalsaltlakes)中的鋰礦床和滷水。在目前情況下,主要使用大陸鹽湖中的滷水來製備碳酸鋰(參見非專利文獻1和2)。關於由滷水製備碳酸鋰,隨著電動車輛開發的進展,鋰電池作為驅動動力能源而成為焦點,並且作為大量消耗的碳酸鋰的供給源,作為鋰源的滷水再次受到關注(參見非專利文獻1和2)。獲得滷水的鹽湖位於有限的區域,如中國、美國、智利、阿根廷和玻利維亞,並且分布不均勻。特別地,諸如智利(阿塔卡瑪(SalardeAtacama))、阿根廷(翁布雷穆埃爾託(SalardelHombreMuerto))和玻利維亞(烏尤尼(SalardeUyuni))等安第斯山脈區域的鹽湖中的鋰礦床更好(參見非專利文獻1)。事實上,使用這些區域中的滷水作為鋰原料來製備了大量的碳酸鋰(參見非專利文獻2)。在安第斯山脈中的鹽湖的滷水中,鋰(Li)濃度為約0.05重量%至0.3重量%,並且在通過陽光將滷水濃縮至濃度為約6%後,該濃縮的滷水被用於製備碳酸鋰。在這種情況下,在碳酸鋰的製備中使用了氯化鋰形式的鋰。除了鋰之外,滷水還含有高濃度的鈉、鉀、鎂等。為了製備高純度碳酸鋰,需要分離並除去這些成分,甚至在常規技術中,在碳酸化反應之前或之後分離這些成分。如上所述,需要碳酸鋰具有高純度,並且如上所述有時要求碳酸鋰的雜質含量為1ppm以下。這種高純度碳酸鋰的製備方法的例子包括:使粗碳酸鋰與二氧化碳反應而獲得含碳酸氫鋰的水溶液,對該水溶液進行微量過濾,然後對該含碳酸氫鋰的水溶液進行熱處理以沉積碳酸鋰的方法(參見專利文獻1);以及使粗碳酸鋰與二氧化碳反應而獲得含碳酸氫鋰的水溶液,利用離子交換組件處理該水溶液,然後對該含碳酸氫鋰的水溶液進行熱處理以沉積碳酸鋰的方法(參見專利文獻2)。在製備碳酸鋰中,通常使用作為鋰源的滷水中的氯化鋰以及作為碳酸化反應的原料的碳酸鈉。因此,在製備中,需要與氯化鋰(其為鋰的原料)的用量相當的碳酸鈉。其結果是,為了製備碳酸鋰,需要將碳酸鈉運輸到超過海平面3,000米的安第斯山脈高地,即,開採氯化鋰滷水的實際地點,或者將濃縮的滷水運輸到易於獲得反應原料(如碳酸鈉)的地方。在任何情況下,其運輸成本極大地影響了碳酸鋰的生產成本。當如後者那樣運輸濃縮的滷水時,與運輸碳酸鈉的情況相比,運輸量大大增加,並且成本進一步增加。通過對上述問題進行認真研究,本發明人最終成功開發了一種製備高純度碳酸鋰的方法,該方法降低了生產成本,由此解決了上述問題,本發明人已經提交了專利申請並獲得了一項專利(參見專利文獻3)。在製備方法中,通過儘可能多地使用本地資源和再利用碳酸化步驟中的副產物,而不用將碳酸鈉運輸到安第斯山脈的鹽湖周圍,從而成功地降低了運輸成本。具體而言,該方法是使用二氧化碳氣體和氨從而進行含鋰滷水的碳酸化反應,並且通過利用石灰石作為二氧化碳氣體的原料並使用副產物作為氨的原料,從而成功在開採氯化鋰滷水的實際地點提供了這兩種原料。以下具體說明製備方法。即,該製備方法包括:將氨和二氧化碳氣體(碳酸鹽氣體)與含氯化鋰的水溶液混合以進行碳酸化反應;以及通過固-液分離來回收所述反應後形成的固體,其中,作為所述二氧化碳氣體,使用通過在進行碳酸化反應的實際地方將石灰石熱分解而獲得的產物,並且使用了通過使氯化銨與生石灰或熟石灰反應而製得的產物作為氨,其中所述氯化銨是碳酸鋰生產中的副產物,所述生石灰是二氧化碳氣體製備中的副產物,所述熟石灰是通過將生石灰水合而獲得的。專利文獻1:JP-A-62-252315專利文獻2:JP-T-2002-505248專利文獻3:日本專利No.5406822(JP-A-2012-116681)專利文獻4:日本專利No.5406955(JP-A-2013-193940)非專利文獻1:GSJChishitsuNewsNo.670,第22至26頁,「LithiumResources(鋰資源)」非專利文獻2:GSJChishitsuNewsNo.670,第49至52頁,「ProductionofLithiumfromSalardeAtakama,Chile,andUseofLithiumCompounds(由智利薩拉阿塔卡瑪鹽湖製備鋰以及鋰化合物的應用)」技術實現要素:為了將該方法投入實際應用中,本發明人決定從許多方面進行認真的研究,首先開始研究碳酸化反應,其中將氯化鋰滷水(其為含氯化鋰的水溶液)、氨和二氧化碳氣體(碳酸鹽氣體)混合。碳酸化反應為使作為氣體的二氧化碳氣體、作為氣體的氨或作為液體的氨、和作為液體的氯化鋰滷水相互反應的氣-液接觸反應。因此,為了增加水溶液中二氧化碳氣體的吸收以及提高鋰的碳酸化的反應效率,使用具有多個塔板的反應塔進行碳酸鋰的製備反應,其中每個塔板配備有布置在其開口上的泡罩。由此,顯而易見的是,固定物沉積在反應塔中的每個位置,如反應塔的內壁、塔板的開口、泡罩和降液管中,並且還顯而易見的是,固定物是作為待製備目標物質的碳酸鋰的一部分。此外,顯而易見的是,固定量隨著反應時間的延長而增加,並且當反應持續進行約兩天兩夜時,固定量達到這樣的程度:二氧化碳氣體不能通過反應塔中的泡罩的開口、塔板的開口、降液管的開口等,即,達到了使碳酸化反應裝置操作中止的程度的量。此外,顯而易見的是,需要與反應時間相同的時間來清潔和去除固定物,並且仍然難以完全除去固定物。由此,該方法在維護性能和生產效率方面不是令人滿意的。鑑於以上所述,本發明要解決的問題是提供一種在碳酸鋰的製備中,在碳酸化反應裝置中不形成固定物,而且具有優異的維護性能和高生產效率的製備方法,並且本發明人對該問題從各方面進行了認真的研究。由本發明人做出的專利文獻3公開了關於氯化鋰滷水、氨和二氧化碳氣體(碳酸鹽氣體)的混合的兩個實施方案,其中一個實施方案是通過同時混合這些材料來進行的,而另一個實施方案是通過向水溶液中加入氨,然後向其中加入二氧化碳氣體來進行的。專利文獻3指出後一個實施方案是優選的。然而,任何這些混合方法都不能避免反應裝置中形成固定物。根據這一事實對碳酸化反應作了進一步研究。由此,本發明人認識到在任何這些方法中,將二氧化碳氣體和氯化鋰滷水兩者引入反應裝置中,並且在這兩種材料的共存下,在反應裝置中的反應塔的內壁、塔板的上表面、塔板的開口、降液管等上形成固定物,其中氯化鋰滷水通過反應裝置。換言之,本發明的發明人認識到在二氧化碳氣體和氯化鋰滷水共存的情況下,在與氯化鋰滷水接觸的反應裝置結構的表面上會形成固定物。鑑於以上所述,本發明人推測:通過採用在碳酸鋰形成期間不引入二氧化碳氣體的反應可以避免固定物的形成。具體而言,發明人推測:通過將反應分為氯化鋰滷水的碳酸化和二氧化碳氣體的引入(吸收),從而可以避免固定物的形成。對使這種假設成為可能的反應進行了認真的研究。結果獲得了這樣一種製備方法:通過將水、氨和二氧化碳氣體混合以形成碳酸銨水溶液,並將碳酸銨水溶液與氯化鋰滷水混合從而能夠製備碳酸鋰。此外,發明人能夠確認:通過這種兩階段反應,在反應裝置內不會形成固定物。在本發明中還可以發現的是:碳酸銨的形成反應(即氨的碳酸化反應)和氯化鋰的碳酸化反應是在兩階段反應中進行的,由此平穩地進行碳酸鋰的形成反應,因此能夠縮短製備碳酸鋰所需的時間並能夠提高生產效率。因此,與專利文獻3的反應相比,本發明採用在水中使氨與二氧化碳氣體反應以形成碳酸銨、然後使碳酸銨與氯化鋰反應的兩階段反應,並且本發明的目的在於在短時間內平穩地進行該兩階段反應以製備碳酸鋰。雖然以上已經描述了本發明要解決的問題,但是再次描述如下。本發明的目的在於提供一種製備碳酸鋰的方法,該方法能夠縮短製備碳酸鋰所需的時間並且具有優異的維護性能和生產效率,通過將反應分離為氨的碳酸化反應和氯化鋰的碳酸化反應,從而平穩地進行碳酸鋰的形成,而不會在碳酸化反應裝置中形成固定物,該固定物需要複雜的程序來去除並且降低了生產率。以下描述了根據發明的製備碳酸鋰的方法。即,該方法包括:將水、氨和二氧化碳氣體(碳酸鹽氣體)混合以形成碳酸銨水溶液(以下有時稱為「碳酸銨溶液」);將氯化鋰滷水與所述碳酸銨水溶液混合以進行碳酸化反應;以及通過固-液分離來回收所述碳酸化反應後形成的固體,其中,作為所述二氧化碳氣體,使用通過熱分解石灰石產生的二氧化碳氣體,作為所述氨,使用了通過使氯化銨與生石灰或熟石灰反應而製得的再生氨,其中所述氯化銨是碳酸化反應中的副產物,所述生石灰是二氧化碳氣體製備中的副產物,所述熟石灰是通過將生石灰(這些有時稱為「生石灰等」)水合而獲得的。本發明大體上包括兩個實施方案。第一實施方案為上述實施方案。在第一實施方案中,將全部量的碳酸銨水溶液與氯化鋰滷水混合以進行碳酸化反應。另一方面,第二實施方案包括:將從碳酸銨水溶液分出的一部分(少量)碳酸銨水溶液與氯化鋰滷水混合以進行一次碳酸化反應,由此僅將共存在滷水中的鎂離子沉積為碳酸鎂,而不沉積碳酸鋰,隨後進行固-液分離;將餘下的碳酸銨(大量)與固-液分離後得到的剩餘液體混合以進行二次碳酸化反應,由此沉積碳酸鋰;以及通過固-液分離來回收碳酸鋰。與專利文獻3中描述的製備碳酸鋰的方法不同,本發明採用了在碳酸鋰的形成期間不引入二氧化碳氣體的反應,並且該反應能夠避免在反應裝置中形成因製備方法形成的大量的固定物。換言之,與專利文獻3中描述的碳酸鋰的製備中不同,本發明在氯化鋰的碳酸化反應過程中不引入二氧化碳氣體,這能夠避免在碳酸化反應期間在反應裝置中形成固定物。為此,本發明能夠提供一種製備碳酸鋰的方法,該方法能夠避免像專利文獻3所描述的製備碳酸鋰的方法中那樣導致碳酸化反應裝置操作中止的情況,並且具有優異的維護性能和生產效率。此外,本發明採用兩階段反應,包括氨的碳酸化反應和氯化鋰的碳酸化反應,由此平穩地進行碳酸鋰的形成。其結果是能夠縮短碳酸鋰製備所需的時間並且能夠提高生產效率。具體而言,與專利文獻3的反應不同的是,本發明採用兩階段反應,包括:在水中使氨與二氧化碳氣體反應以形成碳酸銨,然後使碳酸銨與氯化鋰反應。在不存在氯化鋰的情況下進行作為第一階段的碳酸銨的形成反應,與同時使三種材料反應的專利文獻3的反應相比,該反應能夠平穩地進行,並且能夠在短時間內製備高純度碳酸銨。此外,作為後一階段的氯化鋰的碳酸化反應是液-液反應,並且在非常短的時間段內完成。附圖說明圖1為示出本發明的第一實施方案的流程圖。圖2為示出本發明的第二實施方案的流程圖。圖3示出了氨回收裝置的優選實施方案。具體而言,圖3示出了包括汽提塔和分解反應罐的氨回收裝置的實施方案,其中塔的上部為填料塔,塔的下部為板式塔,氯化銨在反應罐中被石灰乳分解,並且其殘液返回至塔的中部。具體實施方式根據本發明的製備碳酸鋰的方法包括如上所述的兩個實施方案。因此,基於圖1和圖2中示出的流程圖,對這兩個實施方案進行了具體描述。圖1為第一實施方案的流程圖。在吸收塔(以下稱為「二氧化碳氣體/氨氣吸收塔」)中,在水中吸收回收的氨(氣體)和二氧化碳氣體這兩種氣體,並且形成碳酸銨溶液。在碳酸化反應裝置中將碳酸銨溶液與氯化鋰滷水(濃縮滷水)混合,並通過以下反應(1)來形成碳酸鋰。2LiCl+(NH4)2CO3→Li2CO3+2NH4Cl(1)將所形成的碳酸鋰沉積並通過固-液分離回收。同時,形成氯化銨,其包含在反應殘液中。在碳酸銨溶液中,在水中吸收了大量的氨(水中的溶解度:0℃水,89.9g/100ml)。因此,氨不能通過與水反應而轉化成氫氧化銨,因此包含原樣氨,即未反應的氨。其結果是,氨保留在包含副產氯化銨的碳酸化反應殘液(以下簡稱為「反應殘液」)中。通過分解反應,從含有氯化銨的反應殘液中回收氨。對於回收而言,優選使用能夠進行分解反應和擴散(汽提)處理的氨回收裝置(以下簡稱為「回收裝置」)。換言之,優選地是,正如以下詳細描述的並且正如圖3所示出的,回收裝置包括汽提裝置(具體為汽提塔)和分解反應罐。同時,在回收裝置中回收殘留的氨。詳細地,在回收裝置中,形成的氯化銨被生石灰分解以形成氨,其中生石灰為在以下描述的二氧化碳氣體製備過程中的副產物。從分解後殘留的殘液(以下有時簡稱為「分解殘液」)中汽提氨,同時也從液體中清除並回收殘留的氨。將由此回收的再生氨再次用作為製備碳酸銨的原料。具體而言,在水中吸收回收的再生氨,同時或之後吸收二氧化碳氣體以製備碳酸銨。在本發明中,作為製備碳酸鋰的原料的氯化鋰滷水,其鋰濃度優選為2.0重量%至飽和濃度,更優選為4.5重量%至飽和濃度,並且還更優選為5.5重量%至飽和濃度。使用蒸發池,通過日曬蒸發濃縮含氯化鋰的鹽湖滷水,從而能夠製備這種高濃度氯化鋰滷水,這是最合理的。其中存在這種滷水的鹽湖的例子包括位於安第斯山脈中的薩拉阿塔卡瑪(智利)、薩拉翁布雷穆埃爾託(阿根廷)和薩拉烏尤尼(玻利維亞)。毋庸贅言,在此使用的鋰濃度是指鋰離子的濃度,而不是指氯化鋰的濃度。安第斯山脈中的鹽湖滷水包含濃度為0.05重量%至0.3重量%的鋰,並且通過日曬將這些滷水濃縮,可獲得鋰濃度為約6重量%的濃縮滷水。這些滷水優選作為製備高濃度氯化鋰用的滷水。事實上,如上所述,這些滷水已經被用作製備高純度碳酸鋰的原料。用於製備高濃度氯化鋰滷水的滷水並不限於上述安第斯山脈中鹽湖的滷水,並且能夠使用任意滷水,只要其能通過濃縮製備具有上述範圍內的高濃度的氯化鋰滷水即可,而對其沒有特別的限定。除了氯化鋰之外,這些鹽湖的滷水中包含各種雜質,並且所含鈉、鉀等的濃度遠高於鋰的濃度。鈉和鉀在濃縮過程中部分結晶並析出,濃縮後其相對於鋰的濃度降低。除了鹼金屬(如鈉)之外,鹽湖的滷水中還含有鎂、硼等。可在碳酸化反應前根據常規方法除去這些元素,並且這在非專利文獻2(參見第50頁,右欄)中有所描述。本發明的第一實施方案能夠在預先除去鎂之後,適當地獲得具有低鎂濃度的氯化鋰滷水。關於鎂的去除,如上所述,在本發明中研製了一種新的方法,並且在以下第二實施方案的描述中描述了其細節。已知除了上述雜質之外,在鹽湖滷水中還存在其他雜質,其例子包括硫酸根(SO42-)。已經知道,在濃縮氯化鋰滷水之前通過分離除去硫酸根,這在本申請的申請人指出的專利文獻4中公開。即使在本發明的第一實施方案中,在濃縮氯化鋰鹽滷水之前,可以使用殘留在回收裝置底部的分解殘液來除去硫酸根,並且優選使用此方法。詳細地,來自氯化銨的分解中所使用的生石灰的鈣組分殘留在分解殘液中。使用鈣組分形成石膏,並且可以將滷水脫硫。此外,還有這樣的優點:能夠通過使用分解殘液進行脫硫,從而回收殘液中存在的氯化鋰。可通過下述(2)的反應,通過煅燒存在於世界各地並且是普通資源的石灰石(其石也存在於安第斯山脈),從而製備待引入二氧化碳氣體/氨氣吸收塔中的二氧化碳氣體。因此,通過煅燒石灰石,能夠在開採氯化鋰滷水的實際地方供給二氧化碳氣體。CaCO3→CaO+CO2(2)換言之,二氧化碳氣體能夠不從其他區域搬運而供給,並且能夠在實際場所供給其他生產原料。因此,通過本發明能夠在實際地方製備碳酸鋰。在這種情況下,在開採氯化鋰滷水的實際地方設爐,並且根據常規方法在800℃至1,500℃的溫度下進行煅燒。煅燒爐的例子包括Beckenbach爐、Merz爐和迴轉爐,根據實際場所的周圍環境和製備規模來選擇爐。在碳酸銨溶液的製備反應中將水、氨和二氧化碳氣體混合。如圖1所示,可以通過將其同時引入二氧化碳氣體/氨氣吸收塔中而混合。或者,可以採用兩階段反應,使得水和氨混合以形成氨水,然後將二氧化碳氣體引入其中以形成碳酸銨水溶液。後者是優選的。作為氨,再次使用通過分解副產氯化銨並通過汽提回收穫得的氨。在二氧化碳氣體/氨氣吸收塔中進行氨和/或二氧化碳氣體與水之間的氣-液接觸反應,因此,優選使用具有高的氣-液接觸效率的裝置。這樣的裝置的例子包括鼓泡盤塔、泡罩塔、多孔板塔和填料塔。在二氧化碳氣體/氨氣吸收塔中使用的水可以是地下水或從位於實際地點的河流中收集的水,如果需要,可以將這些水淨化。在這種情況下,能夠使用離子交換、超濾、反滲透、用活性炭吸附等作為純化方法。氯化鋰滷水的碳酸化反應中所使用的碳酸銨水溶液的濃度優選為25重量%至飽和濃度,並且更優選為40重量%至飽和濃度。其反應溫度優選為40℃至70℃,並且更優選為55℃至65℃。氯化鋰滷水的碳酸化反應是液-液反應,並且反應迅速進行。因此,不需要像在碳酸銨的製備中那樣特別注意接觸效率,並且能夠使用各種類型的反應裝置。反應裝置的例子包括配備有攪拌葉片的反應裝置和配備有液體進料泵的反應裝置。在該反應中,碳酸鋰沉積為晶體,並通過固-液分離回收。因此,當然能夠使用各種結晶器。在本發明中,如上所述,通過進行分解反應和汽提處理,從而由副產氯化銨水溶液中回收氨,並將所述氨再次用作碳酸銨的生產原料。在氨回收過程中,進行氯化銨的分解、以及從其中溶解有形成的氨的分解殘液中汽提氨的汽提處理,其機理完全不同。由於上述原因,優選的是,如圖3所示,氨回收裝置具有這樣的結構:其中分解反應罐連接至汽提塔,在塔的上部汽提未反應的氨後得到反應殘液,將該反應殘液從塔的中部取出到分解反應罐,向其中供給生石灰等以進行氯化銨的分解反應,並且將分解殘液(具有溶解於其中的由分解反應形成的氨)返回至汽提塔。通過上述過程,在氨回收裝置中有效地進行反應殘液中未反應的氨的汽提、氯化銨的分解和由分解形成的氨的汽提,氨依次移動到汽提塔的頂部,在朝向上部的塔板的方向上氨濃度增加,分解殘液中的大部分氨從最上層的塔板中的塔的頂部排出。由此,從頂部排出的氣體包含高濃度的氨,並且還包含蒸汽和二氧化碳氣體。在回收裝置中,如上所述,氨、蒸汽和二氧化碳氣體從汽提塔的頂部流出。蒸汽通過冷凝器冷凝,並轉化為作為液體的水,其結果是,在形成的水中吸收了一部分氨以形成氨水。未被冷凝器形成的水吸收的許多剩餘的氨與二氧化碳氣體一起被回收,引入二氧化碳氣體/氨氣吸收塔中,並再循環。將通過冷凝器形成的氨水作為回流液返回至回收裝置中。一部分氨水可作為氨組分而返回至二氧化碳氣體/氨氣吸收塔中,並且可以用於與氯化鋰滷水混合。如圖3所示,將含氯化銨的反應殘液從汽提塔的頂部引入至回收裝置中。這是優選的,因為能夠延長反應殘液和蒸汽之間的逆流接觸並且能夠有效地對氨進行汽提。優選通過將反應殘液從汽提塔中取出到塔外,將其引入至與塔連接的分解反應罐中,並向分解反應罐中供給生石灰等,從而進行生石灰的引入。當然可以直接向汽提塔中引入生石灰等。此外,如上所述,將反應殘液從汽提塔中取出的取出位置優選為塔的中部。在回收裝置中引入生石灰等的情況的實施方案優選為這樣的實施方案:生石灰等不以固體的形式引入,而是以石灰乳等液化形式引入。由於汽提是反覆進行氣液接觸的方法,所以汽提塔的結構優選為豎直的長塔結構,即,優選使用上述汽提塔。該結構可以是在沒有引入氯化銨分解後的含石灰乳等的分解殘液的部位(即,塔的上部)中含有諸如價格低廉的Raschig環(該填料具有優異的接觸效率)等填料的填料塔結構。然而,對於比引入分解殘液的位置低的部位的塔結構存在這樣的擔心:由於石灰乳的存在,固體會附著在塔的內部。因此,優選避免使用填料塔結構,並且在這種情況下,優選使用板式塔結構。例如,在從塔的頂部引入其中溶解有形成的氨且含石灰乳的分解殘液的情況下,從塔的頂部至底部優選使用塔板結構。另一方面,在從塔的中部引入反應殘液的情況下,優選地是,上部具有填料塔結構並且下部具有板式塔結構(參見圖3)。特別地,後者的實施方案是優選的。在這種情況下優選這樣進行石灰乳的引入,使得從位於汽提塔的上部的填料塔下部取出液體並引導至分解反應罐,並向其中引入石灰乳(圖3)。汽提塔能夠在壓力下和在減壓下運行。在操作本實施方案的情況(其中在減壓下從塔的頂部引入含氯化銨的反應殘液並且從塔的中部引入含有作為生石灰的石灰乳等的分解殘液(圖3))下,以下示例了塔中的溫度控制。即,優選的是,供給蒸汽溫度為105℃至140℃,最下方的塔板處的液溫為105℃至140℃,分解殘液供給塔板處的液溫為85℃至95℃,最上方的塔板處的液溫為60℃至85℃,塔的底部的分解殘液的液溫為70℃至90℃。這種情況下的塔結構優選為上述結構。具體而言,從塔的中部引入石灰乳,因此,不用擔心在塔的頂部沉積固體。這能夠提供一種具有優異接觸效率的價格低廉的填料塔結構。通過上述裝置結構和溫度控制,氯化銨幾乎完全被分解,並且溶解的氨能夠充分被汽提。其結果是,氨的總體回收率能夠達到99%至99.9%。由分解反應副產的含氯化鈣的分解殘液殘留在回收裝置的底部。通過使用該分解殘液,存在於氯化鋰滷水中的硫酸根離子能夠被沉積為硫酸鈣,並且能夠通過固-液分離除去。該方法能夠降低氯化鋰滷水中的硫酸根的濃度。因此,優選在濃縮前使用該方法來進行低濃度氯化鋰滷水的脫硫。以下將參照圖2描述第二實施方案。在此描述中,主要描述與第一實施方案不同的方面,並且省略了相同方面的描述。圖2為第二實施方案的流程圖。與第一實施方案中相同,在二氧化碳氣體/氨氣吸收塔中,在水中吸收二氧化碳氣體和回收氨(氣體),並形成碳酸銨溶液。將從碳酸銨溶液中分出的一部分(少量)的碳酸銨溶液引入一次碳酸化反應裝置中。在一次碳酸化反應裝置中,碳酸銨溶液與氯化鋰滷水(濃縮滷水)混合,並與存在於氯化鋰滷水中的鎂化合物反應,以沉積碳酸鎂。通過固-液分離,將沉積的碳酸鎂分離並從氯化鋰滷水中除去。與氫氧化鎂相比,碳酸鎂具有優異的過濾性能。其結果是,與分離和除去作為氫氧化鎂的鎂化合物的常規技術相比,能夠在短時間內從氯化鋰滷水中分離出鎂,並且能夠獲得從其中有效地除去了鎂(以下稱為「脫鎂」)的氯化鋰滷水。脫鎂步驟的存在是與第一實施例的唯一區別。如上所述,從碳酸銨溶液中分出的用於引入一次碳酸化反應裝置的量是少量的。所述分出的量在這樣的範圍內:鎂化合物被沉積為碳酸鎂且氯化鋰不被沉積為碳酸鹽化合物。具體而言,在此使用的術語「少量」例如是指用於製備碳酸鋰的碳酸銨溶液用量的2重量%至8重量%。然後將已經經過脫鎂的氯化鋰滷水供給至二次碳酸化反應裝置,並與其中存留的碳酸銨溶液混合,以沉積碳酸鋰。通過固-液分離回收沉積碳酸鋰作為最終目標物質。在碳酸化反應中,氯化銨與碳酸鋰一起形成,並且包含在反應殘液中,該殘液為固-液分離後獲得的液體。與第一實施方案中相同,在回收裝置中,通過生石灰等(其為二氧化碳氣體製備中的副產物)來分解氯化銨,由此產生氨。從回收裝置的頂部回收作為氨(氣體)的氨,並且在回收後,將其引入二氧化碳氣體/氨氣吸收塔中,並進行再循環。來自分解氯化銨中所使用的生石灰等的鈣組分殘留在分解殘液中,並且與第一實施方案相同,優選在濃縮前用於氯化鋰滷水的脫硫。實施例下面,將參照實施例和參考例更加詳細地描述本發明,但是本發明並不局限於這些實施例。實施例1在實施例1中,製備碳酸銨水溶液。其製備是通過使用兩個吸收塔進行的,每個吸收塔具有泡罩塔板,在第一個塔中從頂部供應水並且從底部供應氨,在第二個塔中從頂部供應其中吸收有氨的水並且從底部供應二氧化碳氣體,並且在水中連續吸收氨和二氧化碳氣體。用於吸收的這兩個塔(即,第一個塔和第二個塔)是相同的,並且這些塔的結構、體積等如下所示。塔的總體結構:泡罩塔板數:8塔板的結構:塔板具有降液管並配備有一個泡罩吸收塔的全液保留體積:10L下表1示出了實施例1中製備碳酸鋰時採用的碳酸銨中的氨濃度、二氧化碳濃度、氯化鋰水溶液的鋰(Li)濃度和pH。表1碳酸銨溶液LiCl水溶液CO2含量(g/L)231-NH3含量(g/L)186-Li含量(g/L)-70pH10.215.53對於氨和二氧化碳氣體的濃度,採用上述條件的原因是:預先對氨和二氧化碳氣體的吸收量進行了試驗並且在有效吸收的情況下的最大值與上述相同。具體而言,關於各原料氣體氨和二氧化碳氣體,分別從塔的頂部供入液體(例如,水)並且從塔的底部供入氣體,繼續進行預吸收試驗,直到各個氣泡開始從塔頂部溢出,得到溢出起始點,由此各吸收量與上表1中的相同。下表2示出了實施例1中採用的液體(例如水)供給量、氣體(例如氨)供給量、反應時間、吸收液中的氣體濃度等。表2NH3的吸收CO2的吸收液體供給量(L/h)1010氣體供給量(g/h)2,2803,750吸收後的濃度(g/L)186231吸收時間(h)0.50.5在配備有攪拌葉片的反應裝置中,將上述獲得的碳酸銨水溶液與氯化鋰反應,並連續製備碳酸鋰。下表3中示出了各吸收操作時間、各反應時間、碳酸鋰的回收量、鋰的回收率、固定物的形成量、固定物的形成量與Li2CO3的回收量的百分比(在整個說明書中簡稱為「固定物形成比率」)等。製備碳酸鋰時使用的氯化鋰中的鋰濃度為70g/l(Li)。各操作時間和各反應時間以保留時間示出。其原因是:如上所述,各操作和各反應是連續進行的,因此以保留時間示出是合理的。表3參考例1如上所述,為了比較,通過專利文獻3中描述的方法來製備碳酸鋰,並且在下文中以參考例1示出。使用具有不同的兩個階段的裝置進行碳酸化反應。具體而言,在第一階段中,首先使用與實施例1相同的吸收塔,在氯化鋰水溶液中吸收氨,然後在第二階段中,使用配備有10個泡罩塔板的碳酸化塔將二氧化碳氣體供應到其中吸收有氨的氯化鋰水溶液中,以進行碳酸化反應。在這種情況下,將氯化鋰水溶液從頂部引入第一階段吸收塔,並從其底部向其中引入氨。此外,將其中吸收了氨的氯化鋰水溶液從頂部引入第二階段碳酸化塔,並從其底部向其中引入二氧化碳氣體。下表4中示出了參考例1中採用的製備條件,即,第一階段和第二階段中採用的液體供給量、氣體供給量、反應時間(保留時間)等。表3中示出了參考例1的試驗結果和實施例1的結果。具體而言,表3示出了反應時間、碳酸鋰(Li2CO3)的回收量、鋰的回收比、固定物的形成量、固定物形成比率等。表3進一步示出了參考例1的反應條件、操作條件等。在該比較用實驗中,為了便於實施例1的結果和參考例1的結果之間的比較,這樣選擇反應條件等,使得實施例1和參考例1中的碳酸鋰(Li2CO3)的回收量和鋰的回收比率幾乎相同。表4NH3的吸收碳酸化反應液體供給量(L/h)244.0氣體供給量(g/h)2960507吸收後的濃度(g/L)101-保留(所需)時間(h)0.422.5如上所述,表3中示出了比較用實驗的結果,如上所述,在比較用實驗中選擇反應條件,使得實施例和參考例之間的碳酸鋰(Li2CO3)的回收量和鋰的回收比率幾乎相同。具體而言,在這樣的條件下進行碳酸鋰的製備實驗,使得實施例1和參考例1中的碳酸鋰的回收量都為528g/h,且鋰的回收比率為約62%。從實驗的結果可以理解,與基於專利文獻3的描述的參考例1相比,在實施例1的碳酸鋰的製備方法中,能夠在短時間內製備碳酸鋰。具體而言,實施例1中製備碳酸鋰所需的時間為兩個步驟(碳酸銨的製備步驟和使用所述碳酸銨製備碳酸鋰的步驟)的總反應時間(表3中的「製備Li2CO3所需的總時間」),並且該總時間為1.06h。另一方面,參考例1中製備Li2CO3所需的總時間為2.92h。因此,在實施例1中的製備碳酸鋰所需的時間為大約1小時,而在參考例1中的所需時間為大約3小時。顯而易見的是,實施例1的碳酸鋰製備時間為參考例1中所需時間的1/3。因此,能夠理解的是本發明在生產效率方面是非常優異的。此外,與參考例1相比,實施例1中的固定物的形成量及固定物形成比率非常低。因此,基於專利文獻3的參考例1中所需的固定物的除去操作在實施例1中基本上是不需要的,並且實施例1的維護性能和生產效率優異。能夠理解的是實施例1在這一點上是優異的。具體而言,實施例1中的固定物的形成量及固定物形成比率分別為1.7g/h和0.32%,而參考例1中的固定物的形成量及固定物形成比率分別為53.8g/h和10.2%。因此,參考例1中的固定物的形成量及固定物形成比率是實施例1的約30倍,因此本發明在這一點上是優異的。此外,在實施例1中,其中形成有固定物的碳酸化反應裝置不具有如實施例1中使用的吸收塔和參考例1中使用的碳酸化反應塔那樣的配備8級氣泡塔板或10級氣泡塔板的複雜結構,而是具有在圓筒形容器中配備攪拌葉片的簡單結構。因此,即使發生需要除去固定物的情況,其除去是簡單的。在本發明中,具體而言,在實施例1中,與參考例1不同,碳酸鋰製備步驟被分為氣-液反應和液-液反應,這使得在後一階段的碳酸鋰的形成反應中可採用液-液反應。其結果是,能夠平穩地進行碳酸鋰的形成反應,能夠縮短製備中所需的時間並且能夠提高生產效率。此外,在前一階段中,由於第一階段的碳酸銨形成反應是在不存在氯化鋰的情況下進行的,所以與專利文獻3的情況(其中三種材料同時反應)相比,反應平穩地進行,並且可以在短時間內製備高濃度碳酸銨。本發明基於2015年10月26日提交的日本專利申請No.2015-209453,其內容通過引用方式併入本文。當前第1頁1 2 3 
