豬偽狂犬病病毒檢測試紙的製作方法
2023-09-22 00:12:50 1
本發明屬於獸用生物製品技術領域,具體涉及豬偽狂犬病病毒的檢測試紙。
背景技術:
豬偽狂犬病(Pseudorabies)又稱Aujeszky氏病,是由皰疹病毒科(Herpesviridae)α亞科中的豬皰疹病毒I型(Suid herpes virus I)所引起的豬、牛、羊等多種家畜及野生動物的一種以發熱、奇癢(除豬外)、腦脊髓炎為主要症狀的急性傳染病。豬是該病的主要貯存宿主和傳染源。豬偽狂犬病病毒可以感染不同年齡段的豬,但以妊娠母豬和哺乳仔豬感染最為嚴重:導致妊娠母豬流產、死胎和木乃伊胎;育肥豬感染豬偽狂犬病病毒時表現為呼吸道症狀,無併發症時死亡率低;哺乳仔豬出現神經症狀、麻痺、衰竭死亡,死亡率幾乎高達100%,斷奶仔豬發病率約40%,死亡率可達20%。
預防豬偽狂犬病主要通過豬偽狂犬病病毒gE基因缺失弱毒疫苗進行,通過酶聯免疫吸附試驗(ELISA)在被免疫的豬血清中不能檢測到針對gE蛋白的抗體,這一差異為利用血清進行偽狂犬野生毒株感染和gE基因缺失疫苗免疫接種進行鑑別診斷提供條件。
然而,此種方法必須在實驗室中完成,所用時間長,費用高,並且不能鑑別出未免疫、無感染的抗體陰性豬。而臨床上病情複雜,疫苗免疫豬、野毒株感染豬、無免疫無感染陰性豬常呈雜居狀態,臨床上迫切需要提供一種快速、方便、特異性高、靈敏度高、現場可用的檢測方法。
此外,現有技術中對於豬偽狂犬病病毒疫苗的免疫效果的檢測需要耗時較長的中和效價測定過程,臨床上存在簡便的、快速的檢測豬偽狂犬病病毒活疫苗免疫效果和活疫苗質量檢測的迫切需求。
技術實現要素:
為解決現有技術的不足,本發明提供了一種豬偽狂犬病病毒的檢測試紙,其中,所述檢測試紙硝酸纖維素檢測區5包括固定有豬偽狂犬病毒gD蛋白的疫苗毒株檢測線和質控線。
本發明的豬偽狂犬病病毒的檢測試紙的gD蛋白對於檢測樣品中gD抗體的檢測結果與中和抗體效價、攻毒保護結果之間保持一致,本發明的檢測試紙能用於評價豬偽狂犬病活疫苗的免疫效果;同時還能檢測豬偽狂犬病活疫苗質量。
本發明提供了一種豬偽狂犬病病毒的檢測試紙,其中,所述檢測試紙硝酸纖維素檢測區5包括固定有豬偽狂犬病毒gE蛋白的野毒株檢測線、固定有豬偽狂犬病毒gD蛋白的疫苗毒株檢測線和質控線。
本發明的豬偽狂犬病病毒的檢測試紙能夠在臨床上鑑別是否為未免疫、無感染的陰性豬;若非陰性豬,鑑別是否為野毒株感染或是疫苗免疫豬;若為疫苗免疫豬,鑑別抗體水平能否抵抗野毒株感染。根據檢測結果進行分析,使用本發明的檢測試紙檢測後,能夠幫助判斷豬只是否淘汰、隔離及免疫。本發明的檢測試紙特異、敏感、快捷、簡便,易在生產實踐中推廣應用。
本發明的另一個目的在於提供所述豬偽狂犬病病毒檢測試紙的製備方法。
本發明的另一個目的在於提供所述檢測試紙在檢測豬偽狂犬病病毒gE蛋白抗體中的應用。
本發明的另一個目的在於提供所述檢測試紙在檢測豬偽狂犬病病毒gD蛋白抗體中的應用。
本發明的另一個目的在於提供所述檢測試紙在用於非診斷目的的豬偽狂犬病病毒檢測中的應用。
附圖說明
圖1為本發明檢測試紙一種實施方式的主視圖;
圖2為本發明檢測試紙一種實施方式的俯視圖。
附圖標記:
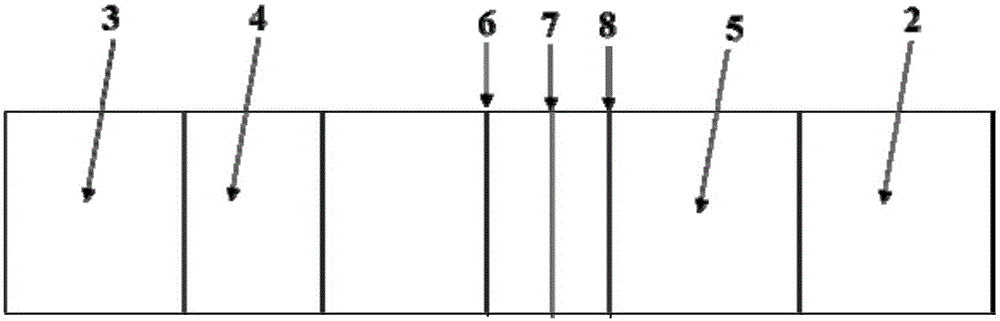
支撐用不吸水PVC底板1、吸水墊2、樣品墊3、金標墊4、硝酸纖維素檢測區5、固定有豬偽狂犬病毒gE蛋白的野毒株檢測線6、固定有豬偽狂犬病毒gD蛋白的疫苗毒株檢測線7、固定有金黃色葡萄球菌SPA的質控線8。
具體實施方式
以下,對本發明的實施方式進行說明。
本發明涉及一種豬偽狂犬病病毒的檢測試紙,包括硝酸纖維素檢測區5和金標墊4,其中,所述檢測試紙硝酸纖維素檢測區5包括固定有豬偽狂犬病毒gD蛋白的疫苗毒株檢測線7以及固定有金黃色葡萄球菌SPA的質控線8;所述金標墊4吸附膠體金標記的抗豬IgG的多克隆抗體;當檢測樣品在遷移過所述金標墊4以後,其能向硝酸纖維素檢測區5遷移並進行檢測。本發明的豬偽狂犬病病毒的檢測試紙的gD蛋白對於檢測樣品中gD抗體水平的檢測結果與中和抗體效價、攻毒保護結果之間保持一致,本發明的檢測試紙能用於評價豬偽狂犬病活疫苗的免疫效果;同時能檢測豬偽狂犬病活疫苗質量。
作為本發明的一種實施方式,本發明的檢測試紙中,所述檢測試紙硝酸纖維素檢測區5進一步包括固定有豬偽狂犬病毒gE蛋白的野毒株檢測線6。作為本發明的一種實施方式,本發明的檢測試紙中,所述固定的豬偽狂犬病毒gD蛋白為編碼序列SEQ.ID.NO.1的蛋白。作為本發明的一種實施方式,本發明的檢測試紙中,所述固定的豬偽狂犬病毒gD蛋白為序列SEQ.ID.NO.3編碼的蛋白。
作為本發明的一種實施方式,本發明的檢測試紙中,所述檢測試紙還包括樣品墊3,用於添加所述檢測樣品;以及吸水墊2,所述吸水墊2能促進所述檢測樣品經由樣品墊3、金標墊4、硝酸纖維素檢測區5向吸水墊2遷移;所述樣品墊3、金標墊4與所述吸水墊2分別位於所述硝酸纖維素檢測區5的兩端。作為本發明的一種實施方式,本發明的檢測試紙由支撐板1,金標墊4,硝酸纖維素檢測區5和吸水墊2構成,金標墊4吸附有膠體金標記兔抗豬IgG多克隆抗體,硝酸纖維素檢測區5上印跡有野毒株檢測線6、疫苗毒株檢測線7和質控線8的硝酸纖維素膜,由樣品端至手柄端的排列為野毒株感染檢測線6/疫苗毒株感染檢測線7/質控線8。
鑑別檢測時,當有豬偽狂犬野毒株感染,在硝酸纖維素檢測區5顯現野毒株檢測線6,,疫苗毒株檢測線7和質控8三條紅色條帶;當豬偽狂犬疫苗毒株免疫,在硝酸纖維素檢測區5顯現疫苗毒株感染檢測線7和質控線8二條紅色條帶;當豬偽狂犬野毒株和疫苗毒株均未感染,硝酸纖維素檢測區5隻顯現質控線8一條紅色條帶。
作為本發明的一種實施方式,本發明的檢測試紙中,所述金標墊4上吸附的膠體金標記的抗豬IgG的多克隆抗體包括兔抗豬IgG的多克隆抗體、或羊抗豬IgG的多克隆抗體、或鼠抗豬IgG的多克隆抗體、或馬抗豬IgG的多克隆抗體。
作為本發明的一種實施方式,本發明的檢測試紙中,所述固定的豬偽狂犬病毒gE蛋白為編碼序列SEQ.ID.NO.2的蛋白。
作為本發明的一種實施方式,本發明的檢測試紙中,所述固定的豬偽狂犬病毒gE蛋白為序列SEQ.ID.NO.4編碼的蛋白。
作為本發明的一種實施方式,本發明的檢測試紙中,所述檢測線6、7與質控線8在所述硝酸纖維素檢測區5上依次按照從由樣品墊3向吸水墊2的方向分布。
作為本發明的一種實施方式,本發明的檢測試紙中,所述檢測線6、7與質控線8任何兩條檢測線之間間隔距離≥3mm。
作為本發明的一種實施方式,本發明的檢測試紙中,所述檢測線6、7與質控線8任何兩條檢測線之間間隔距離≥5mm。
本發明還涉及所述檢測試紙在用於非診斷目的的豬偽狂犬病病毒檢測中的應用;其中,所述非診斷目的的豬偽狂犬病病毒檢測包括流行病學分析、對離體組織進行定性和定量豬偽狂犬病病毒的檢測、國際生豬貿易、進出口檢疫檢驗以及豬偽狂犬病活疫苗質量控制方面的應用。
本發明還涉及製備所述豬偽狂犬病病毒的檢測試紙的方法,所述方法包括:步驟(1),表達gD蛋白、gE蛋白,製備金黃色葡萄球菌SPA和兔抗豬IgG多克隆抗體,並使用膠體金標記所述製備的兔抗豬IgG多克隆抗體;步驟(2),將所述步驟(1)中製備的gD蛋白、gE蛋白、金黃色葡萄球菌SPA,分別固定在硝酸纖維素膜檢測區5的野毒株檢測線6、疫苗毒株檢測線7以及質控線8上,將所述製備的膠體金標記兔抗豬IgG多克隆抗體吸附在金標墊4上;以及步驟(3),依次設置用於添加所述檢測樣品的樣品墊3、金標墊4、硝酸纖維素膜檢測區5以及吸水墊2。
作為本發明的一種實施方式,所述豬偽狂犬病病毒的檢測試紙固定在支持物1上。
作為本發明的一種實施方式,所述豬偽狂犬病病毒的檢測試紙的方法步驟(2)中,將所述步驟(1)中表達的gD蛋白、gE蛋白和製備的金黃色葡萄球菌SPA分別調節濃度為0.55mg/ml、1.0mg/ml和3.0mg/ml,然後將所述調節濃度的gD蛋白、gE蛋白和金黃色葡萄球菌SPA包被固定於檢測線7、6和質控線8上。
作為本發明的一種實施方式,所述豬偽狂犬病病毒的檢測試紙的方法中,所述檢測線6、7與質控線8任何兩條檢測線之間間隔距離≥3mm。
作為本發明的一種實施方式,所述豬偽狂犬病病毒的檢測試紙的方法中,所述檢測線6、7與質控線8任何兩條檢測線之間間隔距離≥5mm。
本發明還涉及所述檢測試紙在檢測豬偽狂犬病病毒gE蛋白抗體中的應用。
本發明所述檢測試紙在臨床上能夠檢測感染了豬偽狂犬病野毒株後豬體所產生抗gE蛋白抗體,其靈敏度與商業上試劑盒靈敏度相當。
本發明還涉及所述檢測試紙在檢測豬偽狂犬病病毒gD蛋白抗體中的應用。
本發明的豬偽狂犬病病毒的檢測試紙的gD蛋白對於檢測樣品中gD抗體水平的檢測結果與中和抗體效價、攻毒保護結果之間保持一致,能夠評價豬偽狂犬病活疫苗的免疫效果,同時可用於檢測豬偽狂犬病活疫苗質量。
本發明的檢測試紙顯示檢測結果形象、直觀準確。鑑別檢測試紙以顯示紅棕色「│」、「││」和「│││」印跡作為檢測的陰性、疫苗毒株感染和野毒株感染陽性標記,即在硝酸纖維素檢測區5上顯示一條棕紅色條帶「│」為實驗成立,且豬偽狂犬病毒抗體陰性,表示被檢測樣品無疫苗毒株或強野毒株感染,同時提醒該養殖場需進行豬偽狂犬病疫苗免疫;兩條棕紅色條帶「││」為豬偽狂犬病毒疫苗gD抗體陽性,說明為豬偽狂犬疫苗毒株感染,表示該養殖場豬偽狂犬病疫苗免疫有效,能夠有效預防豬偽狂犬病野毒株攻擊,近期不需要進行疫苗免疫;三條棕紅色條帶「│││」為豬偽狂犬病毒gE抗體陽性,表示被檢樣品為野毒株感染風險,若為種豬需進行淘汰;若為商品豬需及時隔離和進行豬偽狂犬病疫苗緊急免疫接種。
下面結合具體實施例來進一步描述本發明,本發明的優點和特點將會隨著描述更為清楚。但這些實施例僅是範例性的,並不對本發明的範圍構成任何限制。本領域技術人員應該理解的是,在不偏離本發明的精神和範圍下可以對本發明技術方案的細節和形式進行修改或替換,但這些修改和替換均落入本發明的保護範圍內。
本發明實施例中所用到的化學試劑均為分析純,購自國藥集團。
為使本發明更加容易理解,下面結合具體實施例,進一步闡述本發明。本發明所述的實驗方法,若無特殊說明,均為常規方法;所述的生物材料,若無特殊說明,均可從商業途徑獲得。
實施例1 PRV gD蛋白的製備
1、病毒DNA的提取和PRV gD基因擴增
在生長良好的PK15細胞上接種PRV HN1201病毒(豬偽狂犬病病毒株為HN1201株(Pseudorabies virus,strain HN1201),保藏號為CCTCCNO.V201311;保藏於中國典型培養物保藏中心;保藏地址為中國武漢·武漢大學,保藏日期為2013年5月20日),收穫病毒後用TAKARA公司MiniBEST Viral RNA/DNA Extraction Kit Ver.3.0試劑盒提取PRV基因組DNA。取1μl基因組DNA作為模板,利用gD特異性引物:
gDSF:5′GTGATGGTGATGGTGATGGTGATGATGCTGCTCGCAGCGCTATTGGC3′
gDSR:5′CTACGGACCGGGCTGCGCTTTTAG3′
進行PCR擴增,利用TAKARA的高保真酶HS DNA Polymerase withGC Buffer,擴增條件為:94℃3min;94℃30s,68℃90s,30cycles;72℃5min。PCR產物命名為gD。其核苷酸序列見SEQ.ID.NO.3,推導其胺基酸序列為SEQ.ID.NO.1。
2、重組Bacmid的獲取及鑑定
將高保真酶擴增獲得的PCR產物gD克隆至pFastBac/HBM-TOPO載體(購自Invitrogen公司,貨號A11339),克隆體系如下:gD PCR產物4μl,Salt solution(鹽溶液)1μl,TOPO vector1μl,共6μl。混合均勻,室溫孵育5min,轉化One ShotR Mach1TMT1R感受態細胞,塗布氨苄青黴素抗性平板,挑取單克隆鑑定gD基因的插入方向,插入方向正確的質粒送Invitrogen公司測序,鑑定gD序列的正確性。測序正確的質粒命名為pFastBac/HBM-TOPO-gD。
pFastBac/HBM-TOPO-gD質粒轉化DH10Bac感受態細胞(購自Invitrogen,貨號10361012),pFastBac/HBM-TOPO-gD和感受態細胞中的穿梭質粒Bacmid進行轉座,用Invitrogen的PureLinkHiPure Plasmid DNA Miniprep Kit提取獲得的重組質粒,並用pUCM13Forward/pUCM13Reverse引物鑑定gD的插入,陽性Bacmid命名為Bacmid-gD。
3、轉染獲得重組杆狀病毒
按照Invitrogen公司Bac-to-Bac HBM TOPO Secreted Expression System的說明書提供的方法進行。6孔板每孔鋪8×105個sf9細胞,待細胞貼壁後按照Cellfectin Ⅱ轉染試劑的說明書進行轉染:分別稀釋8μl Cellfectin Ⅱ和1μg Bacmid-gD DNA到100ulSF-900 Ⅱ培養基中,Vortex混勻,混合稀釋後的DNA與稀釋後的Cellfectin Ⅱ(總體積約210μl),混合均勻室溫孵育15~30min,滴加到細胞中。轉染後72h待出現細胞病變後,收集細胞培養上清,記為P0代重組病毒vBac-gD。P0代重組病毒vBac-gD感染sf9細胞,經3代擴大培養後,獲得的P3代vBac-gD用於重組蛋白表達。
4、重組杆狀病毒感染High-five細胞獲得重組蛋白
將P3代重組杆狀病毒vBac-gD接種High-five細胞(購自Invitrogen,貨號B85502)。500ml三角瓶中懸浮培養High-five細胞,至細胞密度達到7.0×105cell/ml後,按照1MOI的量接種病毒,感染後72h收取細胞培養上清。利用Millipore的切向流過濾系統將體積濃縮為原來體積的1/10。用1%(體積比)的Triton X-100(購自sigma)滅活杆狀病毒,SDS-PAGE光密度法測定蛋白含量為200μg/ml,所製備PRV gD可用於檢測試紙疫苗毒株檢測線7印跡的印製。
實施例2PRV gE蛋白的製備
1、病毒DNA的提和PRV gE基因擴增
病毒DNA提取參照PRV gD蛋白的製備中1。取1μl基因組DNA作為模板,利用gE特異性引物:
gESF5'-GTGATGGTGATGGTGATGGTGATGGAGGCCCCG
AGCCTCTCCGCCG-3';和
gESR5'-CGCCAGCACAAACAGCCGCCCG-3'。
使用HS DNA Polymerase和設計的特異性引物對gE片段進行PCR擴增,PCR反應程序為:98℃2min;進入PCR循環,98℃10s,60℃5s,72℃1min30s,30個循環;72℃10min。PCR產物命名為gE。其核苷酸序列見SEQ.ID.NO.4,推導其胺基酸序列為SEQ.ID.NO.2。
2、重組Bacmid的獲取及鑑定
將高保真酶擴增獲得的PCR產物gE克隆至pFastBac/HBM-TOPO載體(購自Invitrogen公司,貨號A11339),克隆體系如下:gE PCR產物4μl,Salt solution(鹽溶液)1μl,TOPO vector1μl,共6μl。混合均勻,室溫孵育5min,轉化One ShotR Mach1TMT1R感受態細胞,塗布氨苄青黴素抗性平板,挑取單克隆鑑定gE基因的插入方向,插入方向正確的質粒送Invitrogen公司測序,鑑定gE序列的正確性。測序正確的質粒命名為pFastBac/HBM-TOPO-gE。
pFastBac/HBM-TOPO-gE質粒轉化DH10Bac感受態細胞(購自Invitrogen,貨號10361012),pFastBac/HBM-TOPO-gE和感受態細胞中的穿梭質粒Bacmid進行轉座,用Invitrogen的PureLinkHiPure Plasmid DNA Miniprep Kit提取獲得的重組質粒,並用pUCM13Forward/pUCM13Reverse引物鑑定gE的插入,陽性Bacmid命名為Bacmid-gE。
3、轉染獲得重組杆狀病毒
按照Invitrogen公司Bac-to-Bac HBM TOPO Secreted Expression System的說明書提供的方法進行。6孔板每孔鋪8×105個sf9細胞,待細胞貼壁後按照Cellfectin Ⅱ轉染試劑的說明書進行轉染:分別稀釋8μl Cellfectin Ⅱ和1μg Bacmid-gD DNA到100ulSF-900 Ⅱ培養基中,Vortex混勻,混合稀釋後的DNA與稀釋後的Cellfectin Ⅱ(總體積約210μl),混合均勻室溫孵育15~30min,一滴滴加到細胞中。轉染後72h待出現細胞病變後,收集細胞培養上清,記為P0代重組病毒vBac-gE。P0代重組病毒vBac-gE感染sf9細胞,經3代擴大培養後,獲得的P3代vBac-gE用於重組蛋白表達。
4、重組杆狀病毒感染High-five細胞獲得重組蛋白
將P3代重組杆狀病毒vBac-gE接種High-five細胞(購自Invitrogen,貨號B85502)。500ml三角瓶中懸浮培養High-five細胞,至細胞密度達到7.0×105cell/ml後,按照1MOI的量接種病毒,感染後72h收取細胞培養上清。採用Ni柱親和層析純化蛋白,用BCA蛋白質定量試劑盒測定蛋白含量為12mg/ml,所製備PRV gE蛋白可用於檢測試紙豬偽狂犬野毒株感染檢測線6印跡的印製。
實施例3兔抗豬IgG多克隆抗體製備
1、豬IgG製備
購買SPF仔豬,無菌採血,分離血清,用辛酸-硫酸銨法純化IgG。取20ml血清,加生理鹽水20ml,再逐滴加入(NH4)2SO4飽和溶液10ml,使成20%(NH4)2SO4溶液,邊加邊攪拌,充分混合後,靜置30min;3000r/min離心20min,棄去沉澱,以除去纖維蛋白;在上清液中再加(NH4)2SO4飽和溶液30ml,使成50%(NH4)2SO4溶液,充分混合,靜置30min;3000r/min離心20min,棄上清;於沉澱中加20ml生理鹽水,使之溶解,再加(NH4)2SO4飽和溶液10ml,使成33%(NH4)2SO4溶液,充分混合後,靜置30min;3000r/min離心20min,棄上清,以除去白蛋白。重複步驟5,2~3次;用10ml生理鹽水溶解沉澱,裝入透析袋;透析除鹽,在常溫水中透析過夜,再在生理鹽水中於4℃透析24h,中間換液數次,以1%BaCl2檢查透析液中的SO42-或以納氏試劑檢查NH4+(取3~4ml透析液,加試劑1~2滴,出現磚紅色即認為有NH4+存在),直至無SO42-或NH4出現為止(也可採用Sephadex G25或電透析除鹽);離心去沉澱(去除雜蛋白),上清液即為粗提IgG;過DEAE-纖維素層析柱,以0.01mol/L pH7.4PBS(0.03mol/L NaCl)洗脫,收集洗脫液(也可採用SephadexG150或G200柱);用BCA蛋白質定量試劑盒測定純化豬IgG的蛋白含量,達到5.1mg/ml以上。
2、兔抗豬IgG多克隆抗體
以純化的豬IgG與等量弗氏完全佐劑乳化後採用多點注射方式免疫SPF兔子,每隔兩周加強免疫,加強免疫2次,加強免疫時用純化的豬IgG與等量弗氏不全佐劑乳化。
以瓊脂擴散試驗(AGP)測定免疫血清抗體效價高於1:64時,採集高免兔全血,分離血清,以辛酸-硫酸銨法純化兔抗豬IgG多克隆抗體方法參考3.1,測定IgG蛋白濃度6.2mg/ml),所製備兔抗豬IgG多克隆抗體可用於膠體金標記。
實施例4兔抗豬IgG多克隆抗體的膠體金標記
1、將HAuC14先配製成0.01%水溶液,取100ml加熱至沸。
2、攪動下準確加入1.0ml的1%檸檬酸三鈉(Na3C6H5O7·2H2O)水溶液。
3、繼續加熱煮沸15min。此時可觀察到淡黃色的氯金酸水溶液在檸檬酸鈉加入後很快變灰色,續而轉成黑色,隨後逐漸穩定成紅色,全過程約2~3min。冷卻至室溫後用蒸餾水恢復至原體積100ml,置於4℃保存。
4、用0.2mol/LK2CO3調節膠體金溶液的pH至8.2,勻速攪拌30min。
5、將1/10體積的1.0mg/ml兔抗豬IgG多克隆抗體溶液加於膠體金溶液中,勻速攪拌30min,逐滴加入適量的10%BSA,勻速攪拌30min。
6、置於4℃2小時後,4℃2000r/min離心30min,棄去沉澱,上清於10000r/min繼續離心30min,棄去上清,沉澱即為膠體金標記的抗體,-20℃保存。
實施例5豬偽狂犬病病毒膠體金檢測試紙條的製備
1、硝酸纖維素檢測膜的製備
包被將PRV gE蛋白用PB工作液(1L雙蒸水溶解5.80g Na2HPO4·12H2O和0.59gNaH2PO4·2H2O)稀釋至1mg/ml,用噴膜儀包被於硝酸纖維素膜靠近金標墊4處,作為豬偽狂犬野毒株檢測線6;PRV gD蛋白用PB工作液稀釋至0.55mg/ml,用噴膜儀包被於6檢測線下方,作為豬偽狂犬疫苗毒株檢測線7;金黃色葡萄球菌SPA用PB工作液稀釋至3.0mg/ml,用噴膜儀包被於7檢測線下方,作為質控線8;膜的寬度為18mm,兩線間距為5mm,置乾燥間乾燥。
2、乾燥與封裝
將包被好的硝酸纖維素膜置於乾燥間(溫度為20~25℃,溼度低於20%)乾燥3小時。將乾燥的硝酸纖維素膜貼於塑料底板的中間,用自動斬切機裁成合適大小(長為60mm,寬為4mm),乾燥間密封保存。
3、金標墊的製備
取稀釋好的金標單兔抗豬IgG多克隆抗體,均勻加到玻璃纖維濾膜上,乾燥間(溫度為20~25℃,溼度低於20%)乾燥12~16小時。用自動斬切機裁成合適大小(長為70mm,寬為4mm)。常溫密封乾燥保存。
4、樣品墊的製備
將玻璃纖維濾膜用自動斬切機裁成合適大小(長為15mm,寬為4mm),常溫密封乾燥保存。
5、吸水墊的製備
將吸水濾紙用自動斬切機裁成合適大小(長為25mm,寬為4mm),常溫密封乾燥保存。
6、試紙條的製備
本發明豬偽狂犬病病毒的檢測試紙設置參見圖1、圖2進行,圖中,1為支撐板用不吸水PVC底板,2為吸水墊,3為樣品墊,4為吸附膠體金標記的兔抗豬IgG多克隆抗體的金標墊,5為採用硝酸纖維素膜製備的檢測區,6為用特異識別豬偽狂犬病毒強毒株但不與疫苗毒株反應的gE蛋白在硝酸纖維素膜上印製的豬偽狂犬強毒檢測線印跡「|」,7為特異識別豬偽狂犬病毒野毒株以及疫苗毒株反應的gD蛋白在硝酸纖維素膜上印製的豬偽狂犬疫苗毒株檢測線印跡「|」,8為金黃色葡萄球菌SPA在硝酸纖維素膜上印製的質控線印跡「|」,在硝酸纖維素檢測區5上的強毒檢測線印跡、疫苗毒株檢測線印跡和質控線印跡組合排列為「|||」。以上組分之間交界處纖維互相交叉滲透。
本發明試紙的檢測原理為:將試紙條樣品墊3上滴加三蒸水,室溫下作用10~15min,只在質控線8線出現一條紅線,檢測線6、7線不顯紅色,表明陰性結果成立。鑑別檢測豬血清時試紙以顯示紅棕色「│」、「││」和「│││」印跡作為檢測的陰性、疫苗毒株免疫和野毒株感染陽性標記,即在硝酸纖維素檢測區5上顯示一條棕紅色條帶「│」為試驗成立,表明豬偽狂犬病毒抗體陰性,表示被檢測樣品無疫苗毒株或強野毒株感染,同時提醒該養殖場豬偽狂犬病毒抗體陰性,有爆發豬偽狂犬病風險,需進行豬偽狂犬病疫苗免疫;兩條棕紅色條帶「││」為豬偽狂犬病毒疫苗gD抗體陽性,表示該養殖場豬偽狂犬病疫苗免疫有效,能夠有效預防豬偽狂犬病野毒株攻擊;三條棕紅色條帶「│││」為豬偽狂犬病毒gE抗體陽性,表示被檢樣品為野毒株感染風險,若為種豬需進行淘汰;若為商品豬需及時隔離和進行豬偽狂犬病疫苗緊急免疫接種。
實施例6豬偽狂犬病病毒膠體金檢測試紙條檢測結果與攻毒保護相關實驗
將21日齡PRV抗體陰性仔豬25頭隨機分成5組,5頭/組。第1組頸部肌肉免疫豬偽狂犬活疫苗,1ml(含106.0TCID50),第2組頸部肌肉免疫豬偽狂犬活疫苗,1ml(含105.0TCID50),第3組頸部肌肉免疫豬偽狂犬活疫苗,1ml(含104.0TCID50),第4組頸部肌肉免疫豬偽狂犬活疫苗,1ml(含103.0TCID50),第5組不免疫為對照組。免疫後28日採血,用豬偽狂犬病gB抗體檢測試劑盒和豬偽狂犬病病毒膠體金檢測試紙條檢測抗體,參照GB/T18641-2002方法血清中和試驗的方法測定中和抗體。免疫28日後攻毒,攻毒劑量為豬偽狂犬病病毒HN1201株106.0TCID50/頭,試驗結果:豬偽狂犬病gB抗體檢測試劑盒、豬偽狂犬病病毒膠體金檢測試紙條、中和抗體及攻毒保護之間關係見表1。
攻毒0日、5日、7日、11日、14日採血,用豬偽狂犬病病毒gE抗體檢測試劑盒和豬偽狂犬病病毒膠體金檢測試紙條檢測gE抗體。攻毒觀察至14日,統計各組疫苗保護情況。試驗結果:豬偽狂犬病病毒gE抗體檢測試劑盒和豬偽狂犬病病毒膠體金檢測試紙條gE抗體結果比較見表2。
表1免疫期28天後抗體檢測結果及攻毒保護統計
結果顯示,豬偽狂犬病病毒膠體金檢測試紙檢測的陽性率與攻毒保護結果一致性較高,有研究報導豬偽狂犬活疫苗中和抗體效價在1:10以上可對豬偽狂犬野毒株產生保護(Engel M,Wierup M.Eradication of ADV from a Swedish pig herd using gI-/TK-Vaccine[J].VetREC,1997,140(19)493~495.。豬偽狂犬病gB抗體檢測試劑盒、豬偽狂犬病病毒膠體金檢測試紙、中和抗體及攻毒保護之間存在一致性,研究結果顯示本發明的豬偽狂犬病病毒檢測試紙可以用來評價豬偽犬病活疫苗免疫效果評價以及豬偽犬病活疫苗質量評價。
表2攻毒後gE抗體檢測結果
試驗結果顯示,鑑別豬偽狂犬病毒檢測試紙在攻毒後7日能檢測到野毒株,與豬偽狂犬病病毒gE抗體檢測試劑盒檢測結果相近。從檢測結果分析豬偽狂犬病病毒檢測試紙能特異性區分豬只為疫苗毒株或者野毒株感染。
表1和表2表明,豬偽狂犬病病毒檢測試紙能快速、簡便評價豬偽狂犬活疫苗免疫後的免疫效果及特異性區分豬只是否感染野毒株,可以用於養殖場對疫苗免疫後評價及種豬PRV淨化。
實施例7豬偽狂犬病病毒膠體金檢測試紙條應用
某養殖場免疫豬偽狂犬活疫苗28天後採集血清,包括種公豬、種母豬和仔豬。
檢測結果及分析結果如表3:
表3檢測結果及分析
註:「│」代表gE、gD抗體陰性;「││」代表gE抗體陰性、gD抗體陽性;「│││」代表gE、gD抗體陽性。
將上述仔豬36#、38#、39#、40#、41#、42#、43#、44#進行攻毒,攻毒劑量為豬偽狂犬病病毒HN1201株106.0TCID50/頭,攻毒後觀察臨床症狀,結果見表4。
表4仔豬攻毒結果
同時對上述仔豬37#和45#通過PCR進行鑑定,結果顯示均為偽狂犬野毒株感染。
上述田間實驗結果進一步說明,在臨床上本發明的豬偽狂犬病病毒檢測試紙檢測結果準確,能有效區分疫苗毒株與野毒株感染,準確判定疫苗免疫保護效力,對於疫苗免疫後的效果評價及PRV淨化有著重要的作用。
以上全面描述了本發明的優選實施例,但是可對它們進行各種替代和修改。因此,不應參照以上描述來決定本發明的範圍,而是應參照所附權利要求書及其全部等同物來決定本發明的範圍。任何特徵,(不論是否為優選)均可與任何其他特徵(不論是否為優選)相結合。本發明的權利要求書不應被理解為具有方法+功能的限制,除非在某一權利要求中通過術語「…的方法」明確地列舉出此類限制。
