一種長非編碼RNA及其在診斷/治療T2DM中的應用的製作方法
2023-09-17 13:52:05
本發明屬於基因工程領域,特別涉及一種長非編碼RNA及其在診斷/治療T2DM中的應用。
背景技術:
糖尿病是嚴重影響人群健康的慢性疾病,發病率呈現逐年升高的趨勢,不僅給個體帶來軀體和精神上的損害,還給個人、國家帶來經濟負擔。胰腺複雜的組織結構和胰島生理功能以及臨床上高居不下的糖尿病發病率使得對胰島功能的研究尤為重要,胰島功能的維持是目前糖尿病的研究重點之一。
越來越多的報導顯示,lncRNA參與胰島細胞的發育、功能維持、糖尿病及其併發症的發生發展。有課題組通過對人類胰島beta細胞轉錄組分析發現,在人胰島中鑑定出1128條lncRNA,且具有組織特異性,同時還發現胰島中長鏈的表達具有嚴格的時空特異性,參與了胰島beta細胞的分化成熟過程,研究發現一些lncRNA可以受到葡萄糖的調控以及在人T2DM的胰島中表達異常,HI-LNC25能調控GLIS3,GLIS3是胰島細胞中的轉錄因子,含有T2DM易感位點,提示HI-LNC25在維持胰島功能起到重要作用。同一課題組近期發現lncRNAβlinc1通過調控胰島特異性轉錄因子來維持胰島功能,敲除之後會引起beta細胞發育缺陷及成年小鼠糖耐量受損。另外,有全基因組關聯分析(Genome-wi de association study,GWAS)發現大量非編碼區域含有T2DM的易感位點,如lncRNA ANRIL及K CNQ1OT1含有T2DM的易感位點。在非肥胖性糖尿病(non-obese diabetic,NOD)小鼠胰島中發現了異常表達的lncRNA,過表達後引起beta細胞凋亡。GWAS分析發現PVT1與糖尿病腎病顯著相關,而且PVT1能增加糖尿病腎病發生的機率。本課題組在前期研究發現,Tug1及Meg3在小鼠胰腺組織中相對高表達,在T1DM及T2DM小鼠胰島中表達下調,通過調控轉錄因子影響胰島素合成及分泌。以上結果提示lncRNA參與成年beta細胞的功能維持及糖尿病的發生發展。然而,lncRNA在be ta細胞中作用的分子機制還要進一步探索。
鑑於lncRNAs在T2DM中的重要性,我們探究了lncRNA Lincpint,首先通過定量PCR檢測了Li ncpint在小鼠胰腺、心、肝、脾、肺、肌、腎中的表達,同時檢測在db/db小鼠胰島中的表達情況。隨後我們在體內及體外水平用RNA幹擾方式下調Lincpint的表達,並採用實時定量PCR技術、流式細胞術、Western blot、RIA、ELISA等技術研究Lincpint在小鼠胰島功能中的作用,旨在初步探討L incpint對胰島beta細胞增殖、凋亡以及胰島素的合成和分泌功能的作用,研究Lincpint在T2DM小鼠beta細胞損傷中所發揮的作用,進而豐富和完善胰島功能的基因調控網絡,提示lncRNA可能作為診斷和治療糖尿病的新的分子靶標。
技術實現要素:
本發明的目的是提供用於診斷T2DM(T2DM)發病情況或作為治療T2DM藥物靶點的lncRNA Lincpint,其基因位於6A3.3,總長度為1714bp,其核苷酸序列為SEQ ID NO:1,
SEQ ID NO:1:
ATGATGGACA TGATATAATG AAACAACATT GTGGAGAGGA AAGCATTAGGGGAGCCCACG GCTACAAAAC AAGTGAGAAG AGGTGGGAGA AAGAGAAACT ACGCCACCTCCTCTGCAGCC GAGCGCACGC AGCAGCCTGG CGTGACAAGT GGGCGACGCC AGGGACAGAGAGTGGGGGTC CTCCGCCCGC TCCGGGGACC CTGTCGCCCA CCGTGGTGCG CTGAGCAACTTTTAGCCGGC AGCCCCGCAC CTGTCTCAGA GTCCCCATCG CTCCCCACCA ACCATCATGGGAAAATTCTA GAAGAATACG CTCTCGGAAT CTACGTGCGC ATCATTTTCC TCCTCACTCCAGAGGAAGGA ACCAGAAAAG AGAGCAAAGC GGTGTAGTGT TCAGCCTCAA GAACCCCCGTGCATCCCAGG GATGGCGCCC TCTACAGGAG GGTCCTTGCC TCACTTTCGG GAGTCTCTTAACTGCATCTC GTTGATTCCT AGCGTTAGAA GAACTGAGCT AACAGGAGTC TGCCACCTCTCTGCCTTGCTGATGCACCCA GGCAGGGCTC ACTGGTTTGC AGGAGTACAT GACCACAGATCAGAGCCATT GGCTGCACAG ATACCTGACT CTGGGCTCTC AGGAAGACTC AGGCAGAGATGGGGAGTCGG CCTGCAAGCT GGGACGCTAG AGCTCACGTG CAGTTCTCCA TTTAGCTAGGAGGTTTCCAG GGCAACCACC GAAGCAGTAA TTAAAGATGA AGAGCTAAAA GGTAAGTACTTCCAAACCTG AATCCTGAAG GAGGTGGTCC GCAGGCTGGT GTCACAGTGT GCACTCTTATTCACTTAACA ATTAGGATGT TCATGCTCTG CTTTGATTTG TATCTTTTCA CGCGCGCACGTATTCTTGTA TGTACGTACA CACCACACAC ACACACACAC ATTTTTATGC TTCCACCAGCCAGTCATGGG ACCAGGCATT GGGATACCAG GGCTTAAGGT GTCTTTCGGG TTCCTGTTTTGAACGTCCTA GCATGCATGT ATATATATAT ACATACATAC ATATATATAT ATACACATTTAAGGCATGCA AACGAGCAAC TGCAGAGGCG TCTACAGTAC TTAGCGTGTA GCAGGAACATCCAGGCTCTC CAGGCAGTTC ACGGGTGCTT ACACAGCCTG ACGAGGTGCT CGCCGTGCCGCCATCCTTTC CTTGAGCGAA CTGTACCCTG GGTTATGAAC CTTGTTTGCC TGATAGTTCAGGGCATCAGT GCAGTAACAG GGCTGATGAG AGAGAGCTCC ACCAAAGCAG CAGCGCCATTGAGAAGGTAG AAGACAGCTA TTTTAACGGA AGCTTCAGAA GCTCATGAGT CTATTCCCAGGAGTATGGGT AAAGTTTGCT CATGCAAATG CTGCATTTCA TGAGTCCATG GGTTAAAGCAGTTACGGACC CTGGAAGATG GGAGATACTT ACAAAAAGCA AAGCCCAGAT CTCCACACCTTCAAAGAGAA GATGCTCAAA TCTCCAATTT TCAGACCAGT GCTTTTTTCA GTTATGCACTGGTATATGGC TGAAACTGTA GGTGGCATGG GAGACTTTGG TAAGTGTAGG CCCTAGGATATCTGTCCCAC CATTTTCCCT GTAACAAAAG TAAGGAATCT GTAA
本發明還涉及識別所述的長非編碼RNA的標記物在製備判斷T2DM發病和治療情況的診斷產品中的應用,所述的標記物包括但不限於:
(1)結合所述長非編碼RNA的引物/引物組或螢光標記的結合所述長非編碼RNA的引物/引物組;
(2)結合所述長非編碼RNA的小分子化合物;
(3)結合所述長非編碼RNA的生物大分子,所述的生物大分子包括但不限於:抗體或抗體功能片段、螢光標記的抗體或抗體功能片段、RNA結合蛋白或其功能片段、螢光標記的RNA結合蛋白或其功能片段。
優選的,所述的引物組或螢光標記的引物組的核苷酸序列如SEQ ID NO.2和SEQ ID NO.3所示,
Lincpint Primer F(SEQ ID NO:2):5'ACGCTCTCGGAATCTACGTG3',
Primer R(SEQ ID NO:3):5』-CTCCCGAAAGTGAGGCAAGG-3』。
beta-actin Primer F(SEQ ID NO:4):5'AGGTCATCACTATTGGCAACGA 3',
Primer R(SEQ ID NO:5):5'CACTTCATGATGGAATTGAATGTAGTT 3'。
本發明還涉及包含所述的識別所述的長非編碼RNA的標記物的用於判斷T2DM發病情況的試劑或試劑盒。
本發明還涉及所述的識別所述的長非編碼RNA的標記物或包含所述標記物的試劑或試劑盒在判斷T2DM的發病情況中的應用。
本發明還涉及所述的長非編碼RNA在製備治療T2DM的藥物中的應用;
本發明還涉及所述的長非編碼RNA在作為篩選判斷T2DM發病情況的診斷試劑中的應用。
本發明還涉及所述的長非編碼RNA在作為篩選治療T2DM的藥物中的應用。
技術方案
實驗動物
採用8周齡的雄性B6.BKS-Leprdb(db/db)小鼠和對照小鼠各40隻,體重在30g左右,從南京大學模式動物研究所(MARC)購買。6-8周大小的雄性Balb/c小鼠,各50隻,體重25g左右,從南京醫科大學動物中心購買。所有實驗均經過南京醫科大學動物保護和倫理委員會(IACUC)批准。
細胞培養
胰島beta細胞系(MIN6細胞)用高糖DMEM培養基培養,加入15%FBS,2.5mMβ-巰基乙醇,100U/毫升青黴素和100毫克/毫升的鏈黴素,在37℃,含5%CO2恆溫培養箱中培養。NIT-1細胞用RPMI 1640培養基培養,10%FBS,加入雙抗,在37℃,含5%CO2的恆溫培養箱中培養。每天換培養基,當細胞密度達80%-90%時傳代。是從中國科學院上海細胞庫購買(上海,中國)。NCIH1299,NCI-H1975,SK-MES-1和16HBE細胞在RPMI 1640培養基中培養;SPC-A1和PC9細胞在D MEM培養基中培養。完全培養基中含有10%的胎牛血清,的,在37℃,5%CO2的培養箱中培養。
RNA提取和定量PCR分析
根據試劑的使用說明,用Trizol試劑分離總RNA。逆轉錄反應應用TaKaRa Prime Script試劑盒(TaKaRa,大連,中國)。逆轉錄試劑盒對1μg總RNA進行逆轉錄,最終體積為20μl。結果分析:分析引物的特異性及擴增效率,根據溶解曲線判斷引物的反應特異性。根據擴增曲線得到Ct值,採用相對量法與內參beta-actin進行目的基因相對表達量的分析。計算公式為:2^(-△Ct),△Ct=Ct gene-Ct control。
細胞轉染
根據操作說明用脂質體Lipofectamine 2000轉染試劑轉染Lincpint-siRNA和control-siRNA。MIN6和NIT-1細胞融合滿了就接種到六孔板裡,然後根據說明操作。轉染48小時後,收集細胞,用於qRT-PCR或免疫印跡分析。
細胞增殖和細胞凋亡實驗
MTT法檢測細胞增殖活力:首先轉染細胞,24h後按每孔8000個細胞種在96孔培養板,每孔200μl,設置5個復孔。12h後,棄去培養基,20μl的MTT反應液加入每孔,37℃避光孵育4h。棄上清,150μl的二甲亞碸(DMSO)加入每孔,震蕩10min,測定490nm波長處的吸光值。流式細胞儀檢測細胞周期:將細胞種於6孔培養板,培養12h後,進行轉染。48h後,用不含EDTA的胰酶將細胞消化下來,4℃,1000g離心,棄上清,PBS洗2遍。將預冷的75%乙醇吹勻細胞後離心,在-20℃過夜。離心棄去上清,PBS洗2遍。每個樣品取450μl PBS吹勻離心,50μl的碘化丙錠加入其中,混勻後放在37℃水浴箱30 min。離心棄去上清,PBS吹勻離心,用流式細胞儀(BD公司)測量並分析。流式細胞儀檢測細胞凋亡:將細胞種於6孔培養板,培養12h後,進行轉染。48h後,用不含EDTA的胰酶將細胞消化下來,4℃,1000g離心,棄上清,PBS洗2遍。吸盡細胞沉澱殘留的PBS,振蕩30s,使細胞懸浮。將200μl含鈣離子的結合緩衝液加入,再將10μl Annexin V-FITC螢光探針加入,輕輕振蕩混勻,避光放置30min。5μl的碘化丙錠加入細胞中,振蕩混勻,避光放置5min。400μl結合緩衝液加入其中,振蕩混勻後,用流式細胞儀檢測。
葡萄糖刺激的胰島素分泌實驗(GSIS)
將MIN6細胞種於48孔培養板,待細胞密度達60-70%,棄去培養基,進行轉染。48h後,進行GSIS實驗。配製glucose-free Krebs-Ringer bicarbonate(Krb)(115mM NaCl,4.7mM KCl,1.2mM MgSO4.7H2O,1.2mM KH2PO4,20mM NaHCO3,16mM HEPES,2.56mM CaCl2,0.2%BSA)溶液,根據實驗孔數配製低糖液(2mM)、高糖液(20mM)。加入低糖液200ul,棄掉。加200ul的低糖液,37℃培養1h後棄掉,每孔加入200ul低糖液,37℃培養1h,收集上清至EP管中。加200ul高糖液,37℃培養1h收集上清至EP管中。加200ul的酸乙醇,4℃過夜,取上清至EP管中,放在-80℃。用放免法(RIA)檢測胰島素含量。
小鼠胰島細胞的分離和培養及轉染
小鼠胰島的提取及純化:配HBSS溶液(KCl 0.4g,KH2PO 40.06g,MgCl2.6H2O 0.1g,MgSO4.7H2O0.1g,CaCl2 0.1g,NaCl 8g,NaHCO3 0.35g,NaHPO4.7H2O 0.09g去離子水至IL,PH7.4)配製膠原酶(膠原酶V用HBSS溶液配製,1mg/ml),小鼠禁食12h以上,配製戊巴比妥鈉,麻醉小鼠。剖腹開胸,找到胰總管,用線結紮。剪心臟放血,擦乾血跡,找到胰總管,進行插管。推注射器先慢後快。胰腺充盈一般需2ml。將胰腺剝離下來,放在滅菌的50ml離心管中,隨後放在冰上。向50ml離心管中加膠原酶V至5ml。37度水浴25min。把離心管取出,放置冰上。渦旋離心管,將組織渦旋成泥沙狀。加入帶血清的HBSS溶液2倍體積,混勻終止消化。用篩子除去未消化的組織塊至新的離心管。1000g(加速度9,減速度9),2分鐘,4度。棄上清,加入不含血清的HBSS,離心洗一遍。棄上清。加入Histopaque 5ml,吹打混勻,放入10ml玻璃管中,用巴氏吸管緩慢加入HBSS,5ml。2000g(加9,減1),20分鐘,4度。離心後,將中間的白色顆粒層吸出到大皿中待挑。在顯微鏡下粗挑。原代胰島細胞的培養:原代胰島細胞用RPMI-1640培養基,10%FBS,雙抗培養,於培養箱中培養,過夜細挑。原代胰島細胞轉染:培養12h後,將每孔200個胰島分配在6孔板裡。取10μl脂質體,100pmol si-Lincpint,si-NC加在OPTI-MEMI 200μl中,吹打混勻。室溫下放置5分鐘。將脂質體與si-Lincpint混合,及脂質體和si-NC混合,吹打混勻。室溫下放置20分鐘。在6孔板中加入1.6ml OPTI-MEMI,將混合液均勻滴入,將胰島挑至每孔。6h後更換培養基,將胰島挑至每孔。
在動物體內幹擾Lincpint
選擇幹擾效率最高的si-Lincpint#1,Invitrogen公司合成活體的小幹擾序列。將50nmol的si-Lincpint溶於200ul PBS的用針頭通過尾靜脈(hydrodynamic intravenous(IV)tail vein injections)注射入成年小鼠體內,作為si組,另取相同體積的亂序注入成年小鼠,作為NC組。48h後,進行實驗。
腹腔注射的葡萄糖耐量實驗(IPGTT)
將si-NC和si-Lincpint小鼠禁食12h。按照每g體重需2mg葡萄糖,腹腔注射葡萄糖。體積(ml)=體重(g)/100。用75%乙醇消毒動物腹部,並用棉球乾燥。牢牢抓住受試動物背部並用注射器腹腔注射葡萄糖。分別在注射前0,15,30,60,90,120時,剪尾來測血糖。
免疫印跡分析和抗體
細胞蛋白裂解產物通過10%SDS-PAGE分離開,轉移到0.22μm NC膜,用特定的抗體孵育。放射自顯影用密度測定法從而被量化。Beta-actin抗體被用來作為對照。EZH2,beta-actin抗體(1:1000)從CST公司購買。
ELISA法測小鼠血清胰島素
活體小鼠,眼眶靜脈採血。取0,15,30,60,90,120時間點的血液,室溫放置30min,離心3000g,15min。收集上層血清,可保存於-20℃。將試劑盒中試劑放置室溫。用ddH2O把10X wash buffer稀釋至1X,每孔加300微升wash buffer,洗3次。對照和樣品加10微升assay buffer,對照和標準孔(0.2,0.5,1,2,5,10ng/ml)加10微升matrix solution;標準孔中加入10微升的各濃度的標準液,在樣品孔中加10微升的血清樣品,所有孔加80微升detection Ab,搖床上室溫孵育2小時(此步之前的所有操作儘量在1個小時內完成)。wash buffer清洗3次,每孔300微升;每孔100微升enzyme solution,搖床室溫孵育30min。吸出,wash buffer清洗6次,每孔300微升;吸出,每孔100微升substrate;搖床室溫孵育15min,會出現藍色。吸出,每孔100微升stop solution,藍色變黃色,在450nm波長下酶標儀中讀數。
數據處理
數據用SPSS軟體分析,用雙尾Student’s T檢驗組間差異,相關性分析用線性回歸模型分析。P<0.05,P<0.01或P<0.001為顯著差異。
附圖說明
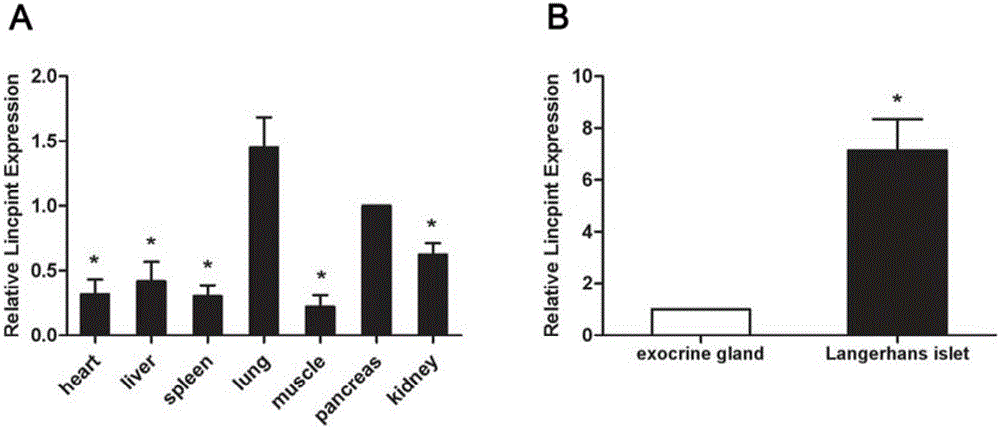
圖1.在正常Balb/c小鼠中,Lincpint的表達情況
1A:相對於心、肝、脾、肌、腎,Lincpint在胰腺組織中相對高表達;
1B:Lincpint在小鼠胰島中是外分泌部的7倍
圖2.在db/db小鼠胰島中,Lincpint表達下調
2A採用8周齡及12周齡對照小鼠和db/db小鼠,同時檢測了隨機血糖變化:與對照小鼠相比,db/db小鼠的隨機血糖都有升高(P<0.05);
2B-2C提取對照小鼠和db/db小鼠的胰島,通過qPCR技術檢測了Ins1,Ins2,Lincpint的表達情況:與8周齡及12周齡對照小鼠相比,Lincpint在相同周齡的db/db小鼠胰島中表達下調37±3%及49±5%(P<0.05),
2D:在MIN6細胞中給予棕櫚酸鹽(palmitate 0.5mM)處理48h後,通過qPCR檢測Lincpint的表達水平,結果顯示:與對照組相比,palmitate處理組中Lincpint的表達水平下調37±2%(P<0.01)
圖3.Lincpint的表達受到葡萄糖的調控
3A-B:與正常糖濃度25mM相比,Ins2,MafA在5.5,11.1,33.3mM表達下調
3C:與正常糖濃度25mM相比,Lincpint在5.5,11.1,33.3mM表達下調28%±2%,32%±7%,32%±3%,與Ins2及MafA的表達趨勢一致
圖4.在小鼠細胞系中,下調Lincpint抑制胰島素的分泌
4A,4B:與對照相比,Lincpint siRNA#1的幹擾效率達80±3%及68±3%;
4C,4D:幹擾組中,在低糖濃度2mM刺激下,胰島素的分泌無明顯差異,但高糖濃度20mM刺激下,幹擾組的胰島素分泌下調42%,同時下調Lincpint後,與對照組相比,細胞內的胰島素content減少22%。
圖5.在小鼠細胞系及原代胰島中,下調Lincpint的表達抑制胰島素合成相關轉錄因子的表達
5A,5C,5E:幹擾組中Ins1和Ins2表達均下調;
5B,5D,5F:幹擾Lincpint後,轉錄因子MafA,Pdx1,Glut2mRNA水平表達下調;
5G-H:幹擾組轉錄因子MafA,Pdx1,Glut2的蛋白表達減少,與mRNA表達水平一致
圖6.在MIN6細胞中,下調Lincpint的表達會抑制細胞增殖促進凋亡
6A:幹擾Lincpint後,細胞活力受到抑制;
6B-C:幹擾組中,細胞周期不受影響;
6D-E:幹擾組中,細胞凋亡增加了8.5%;
6F-G:幹擾Lincpint後,促凋亡蛋白Bax,剪切型caspase3,caspase9表達增加,抗凋亡蛋白Bcl-2表達減少。
圖7.在正常成年Balb/c小鼠中,下調Lincpint的表達會減弱胰島素分泌能力
7A:與對照組相比,幹擾組胰腺中的幹擾效率為55±7.9%;
7B-C:與對照組相比,15min,30min幹擾組的血糖都有升高,0min,15min,60min幹擾組的胰島素水平有所下降;
7D:與對照組相比,Ins1,Ins2,MafA,Pdx1,Glut2的表達下調,與細胞水平的結果一致。
具體實施方式
以下通過實施例對本發明作進一步的闡述,但不限制本發明。
一般性說明:
實施例中末註明具體條件的的實驗方法,基本上都按照Sambrook,J等人編著的《分子克隆實驗指南(第3版)》(MolecularCloning:ALaboratoryManual,3rded.黃培堂等譯,科學出版社.2002.8)中所述的條件及方法或按照材料提供商所建議的條件及方法進行,其它沒有詳細描述的技術相應於本領域人員來說是熟知的標準方法。
本發明的材料:本申請中提及的細胞株、siRNA幹擾序列以及培養基均有商品供應或以別的途徑能為公眾所得,它們僅作舉例,對本發明不是唯一的,可分別用其它適合的工具和生物材料來代替。
實施例1檢測Lincpint在正常Balb/c小鼠中的表達情況
原代胰島細胞的提取,配HBSS溶液(KCl 0.4g,KH2PO 40.06g,MgCl2.6H2O 0.1g,MgSO4.7H2O0.1g,CaCl2 0.1g,NaCl 8g,NaHCO3 0.35g,NaHPO4.7H2O 0.09g去離子水至IL,PH7.4;配製膠原酶(膠原酶V用HBSS溶液配製,1mg/ml);小鼠禁食12h以上,配製戊巴比妥鈉,麻醉小鼠。;剖腹開胸,找到胰總管,用線結紮;剪心臟放血,擦乾血跡,找到胰總管,進行插管;推注射器先慢後快。胰腺充盈一般需2ml。將胰腺剝離下來,放在滅菌的50ml離心管中,隨後放在冰上;向50ml離心管中加膠原酶V至5ml。37度水浴25min;把離心管取出,放置冰上;渦旋離心管,將組織渦旋成泥沙狀。加入帶血清的HBSS溶液2倍體積,混勻終止消化;用篩子除去未消化的組織塊至新的離心管。1000g(加速度9,減速度9),2分鐘,4度;棄上清,加入不含血清的HBSS,離心洗一遍;棄上清,加入Histopaque 5ml,吹打混勻,放入10ml玻璃管中,用巴氏吸管緩慢加入HBSS,5ml;2000g(加9,減1),20分鐘,4度;離心後,將中間的白色顆粒層吸出到大皿中待挑。在顯微鏡下粗挑。原代胰島細胞用RPMI-1640培養基,10%FBS,雙抗培養,於培養箱中培養,過夜細挑。
取0.1g組織,液氮研磨充分(成粉末狀)或手挑的胰島細胞,預冷的PBS潤洗2次。加入1ml的Trizol裂解液,以無酶槍頭吹打混勻,靜置5min,將裂解液移入預先標記好的無菌無酶1.5ml的離心管中。4℃7500g離心5分鐘,取上清加入1/5體積的氯仿,顛倒混勻30s,靜置2-4min。4℃,12000g離心,15min。溶液分三層(水相-白色沉澱-紅色有機物),轉移水相層至新的1.5ml離心管中,儘量不要吸到白色沉澱。加入等體積異丙醇,輕輕顛倒混勻,放置5-10min。4℃,12000g離心,10min。吸棄上清,加入1ml 75%的乙醇(現配),洗滌RNA沉澱。4℃,7500g離心,5min,棄上清。儘量去除75%的酒精,於室溫中晾乾,約15min。用無RNA酶水(20-25μl)溶解RNA沉澱。
紫外吸收測定法測定RNA的濃度。使用紫外分光光度計測定RNA濃度和純度,測量前先用溶解RNA用的DEPC水調零。在260nm處讀值1為表示40ng/μl,RNA溶液的A260/A280的比值用於RNA純度的檢測,比值範圍在1.8到2.1表明符合要求。瓊脂糖凝膠電泳鑑定RNA的完整性。配製1%的瓊脂糖膠。加熱溶解瓊脂糖,冷卻,加入1μl溴化乙錠(EB,10mg/ml)。搖勻後倒膠,待膠冷凝後,置於電泳槽中,浸於1×TAE緩衝液中平衡10min,待用。點樣。按1:4(v/v)將5×核酸電泳上樣緩衝液與樣本混合,準確將各樣本含有1μg的RNA加入凝膠孔中。80V恆壓電泳50min。電泳結束後,在凝膠成像儀上觀察結果。
Tris-乙酸(TAE)緩衝液配方(1L)50×:
實時定量PCR
Balb/c小鼠各個組織,原代胰島細胞及外分泌細胞的總RNA,逆轉錄反應應用TaKaRa PrimeScript 試劑盒(大連寶生物工程有限公司)。逆轉錄反應體系如下:
反轉錄反應條件如下:37℃15min(反轉錄反應);85℃5sec(反轉錄酶的失活反應)。根據Genebank提供的基因序列,設計引物序列,
QPCR應用7300PCR系統(Applied Biosystems,Warrington,UK)。cDNA樣品採用三部法PCR擴增標準程序。反應體系:
反應條件:
結果分析:分析引物的特異性及擴增效率,根據溶解曲線判斷引物的反應特異性。根據擴增曲線得到Ct值,採用相對量法與內參beta-actin進行目的基因相對表達量的分析。計算公式為:2^(-△Ct),△Ct=Ct gene-Ct control。
Lincpint的引物如下:
Primer F(SEQ ID NO:2):
5』-ACGCTCTCGGAATCTACGTG-3』,
Primer R(SEQ ID NO:3):
5』-CTCCCGAAAGTGAGGCAAGG-3』。
結果表明,相對於心、肝、脾、肌、腎,Lincpint在胰腺組織中相對高表達(P<0.05)(圖1A)。利用實時定量PCR檢測了Lincpint在小鼠胰腺內外分泌部中的表達情況。結果顯示Lincpint在小鼠胰島中是外分泌部的7倍(P<0.05)(圖1C)。。
實施例2在db/db小鼠胰島中,Lincpint表達下調
db/db(diabetes)小鼠是T2DM小鼠模型,在小鼠4號常染色體的db基因發生隱性突變,是由瘦素受體缺陷導致的自發二型糖尿病小鼠,是研究T2DM較好的動物模型。
db/db小鼠在2周左右開始出現高血糖、高胰島素血症、胰島素抵抗,隨後出現肥胖,一般到了4周以後血糖明顯增高,胰島beta細胞遭到明顯的破壞,八周以後隨機血糖達到20mmol/L以上,出現典型的糖尿病症狀。8周齡及12周齡對照小鼠和db/db小鼠,同時檢測了隨機血糖變化(Fig2.A):與對照小鼠相比,db/db小鼠的隨機血糖都有升高(P<0.05)。提取對照小鼠和db/db小鼠的胰島,通過qPCR技術檢測了Ins1,Ins2,Lincpint的表達情況(Fig2.B-C):與8周齡及12周齡對照小鼠相比,Lincpint在相同周齡的db/db小鼠胰島中表達下調37±3%及49±5%(P<0.05),與Ins1和Ins2的mRNA水平變化一致,提示Lincpint可能參與了T2DM的發生發展。
有研究報導,T2DM的發生與脂肪酸的聚集有關,在體內長期的脂肪酸水平的升高會引起beta細胞功能損傷以及beta細胞的死亡,從而引起糖尿病的發生。在體外細胞系中給予脂肪酸處理,會抑制GSIS功能及insulin的轉錄[38]。我們在MIN6細胞中給予棕櫚酸鹽(palmitate 0.5mM)處理48h後,通過qPCR檢測Lincpint的表達水平,結果顯示(Fig.2D):與對照組相比,palmitate處理組中Lincpint的表達水平下調37±2%(P<0.01),提示Lincpint可能與T2DM中胰島beta細胞功能損傷有關。
實施例3在小鼠細胞系中,下調Lincpint抑制胰島素的分泌
為了檢測Lincpint對胰島細胞功能的影響,Invitrogen公司設計和合成小鼠Lincpint的三條幹擾序列,併合成了相應的亂序做對照。我們在MIN6及NIT-1細胞中轉染了Lincpint的3個幹擾序列,實時定量PCR檢測它們的幹擾效率,結果顯示(Fig.4A-B):與對照相比,Lincpint siRNA#1的幹擾效率達80±3%及68±3%(P<0.01)。
將MIN6細胞種於48孔培養板,待細胞密度達60-70%,棄去培養基,進行轉染。48h後,進行GSIS實驗。配製glucose-free Krebs-Ringer bicarbonate(Krb)(115mM NaCl,4.7mM KCl,1.2mM MgSO4.7H2O,1.2mM KH2PO4,20mM NaHCO3,16mM HEPES,2.56mM CaCl2,0.2%BSA)溶液,根據實驗孔數配製低糖液(2mM)、高糖液(20mM)。加入低糖液200ul,棄掉。加200ul的低糖液,37℃培養1h後棄掉,每孔加入200ul低糖液,37℃培養1h,收集上清至EP管中。加200ul高糖液,37℃培養1h收集上清至EP管中。加200ul的酸乙醇,4℃過夜,取上清至EP管中,放在-80℃。用放免法(RIA)檢測胰島素含量。
首先檢測了Lincpint對胰島素合成及分泌的影響,我們使用了胰島素分泌功能最強的MIN6細胞。在MIN6細胞中幹擾Lincpint 48h後,檢測胰島素分泌量及胰島素總量的變化結果顯示(Fig.4C-D):幹擾組中,在低糖濃度2mM刺激下,胰島素的分泌無明顯差異(P=0.66),但高糖濃度20mM刺激下,幹擾組的胰島素分泌下調42%(P<0.05),同時下調Lincpint後,與對照組相比,細胞內的胰島素content減少22%(P<0.05)。以上結果提示Lincpint的下調會損傷胰島素分泌功能。
實施例4在小鼠細胞系及原代胰島中,下調Lincpint的表達抑制胰島素合成相關轉錄因子的表達蛋白質免疫印跡(Western blot)
蛋白質的變性:樣本按1:4的體積比例加入5×十二烷基硫酸鈉(SDS)蛋白質電泳上樣緩衝液,混勻,99℃加熱10min,-20℃保存。
蛋白電泳:將變性完成的蛋白樣品按40μg/孔,加入預先制好的變性聚丙烯醯氨凝膠(SDS-PAGE)的加樣孔中;先以80V電壓恆壓使蛋白樣本經濃縮膠壓縮,待樣品進入分離膠後,切換成120V電壓 恆壓繼續電泳45-50min,使樣本中的蛋白分離。
SDS-PAGE膠配方:
4%濃縮膠(總4ml):
10%分離膠(總6ml):
12.5%分離膠(8ml):
5×Tris-甘氨酸電泳緩衝液(1L):
轉膜:電泳結束後按蛋白marker根據目的蛋白的大小,將特定位置的膠條切至合適大小(切角標記),用轉膜緩衝液浸泡10min。膜處理:預先裁好與膠條同樣大小的濾紙(上下各兩層)和醋酸纖維素(NC)膜(剪角標記),轉膜緩衝液中浸泡10min。半乾轉轉膜:轉膜裝置從下至上依次按照陽極碳板、濾紙、NC膜、凝膠、濾紙、陰極不鏽鋼板的順序放好,濾紙、凝膠、NC膜精確對齊,每一步均需去除氣泡,蓋上陰極不鏽鋼板。接通電源,恆流1mA/cm2,根據不同蛋白分子量的大小選擇合適的轉膜時間。
1×半乾轉轉膜緩衝液配方(1L):
封閉:待轉膜結束後,將轉移了蛋白的NC膜取出,用1×TBST衝洗膜一次。隨後用1×TBST緩衝液(20mM Tris-HCl,150mM NaCl,0.05%Tween-20,pH7.6)配製的5%脫脂牛奶於室溫中封閉2h,以封閉膜上非特異性蛋白的結合位點。
抗體孵育:用1×TBST緩衝液配製的5%脫脂牛奶稀釋一抗(EZH2,GAPDH,1:1000),4℃,輕搖過夜。1×TBST緩衝液洗膜,5min×3次。分別加入1×TBST緩衝液配製的5%脫脂牛奶稀釋的抗兔或小鼠的辣根過氧化物偶聯IgG,室溫中振搖孵育2h。1×TBST緩衝液洗膜,10min×3次。
ECL檢測:避光配製ECL-plus顯色液,混勻後滴加在放置平整的塑封膜上,待反應1min,隨即將NC膜夾入塑封膜中。在暗室中覆蓋感光膠片,根據螢光的強度決定曝光的時間。
為了探討Lincpint對胰腺beta細胞胰島素合成和分泌的影響是否是由於beta細胞中相關轉錄因子變化引起的,我們首先在MIN6、NIT-1細胞及原代胰島中幹擾Lincpint後檢測beta細胞中insulin的兩個轉錄本Ins1及Ins2的變化,結果顯示(Fig.5A、C、E):幹擾組中Ins1和Ins2表達均下調(P<0.05)。隨後檢測了與insulin合成相關的轉錄因子的表達情況,結果顯示(Fig.5B、D、F):幹擾Lincpint後,轉錄因子MafA,Pdx1,Glut2mRNA水平表達下調(P<0.05)。在MIN6細胞檢測了轉錄因子的蛋白表達情況(Fig.5G-H):幹擾組轉錄因子MafA,Pdx1,Glut2的蛋白表達減少(P<0.05),與mRNA表達水平一致。以上結果提示下調Lincpint會引起insulin合成的減少。
實施例5在正常成年Balb/c小鼠中,下調Lincpint的表達會減弱胰島素分泌能力
選擇幹擾效率最高的si-Lincpint#1,Invitrogen公司合成活體的小幹擾序列。將50nmol的si-Lincpint溶於200ul PBS的用針頭通過尾靜脈(hydrodynamic intravenous(IV)tail vein injections)注射入成年小鼠體內,作為si組,另取相同體積的亂序注入成年小鼠,作為NC組。48h後,進行實驗。
腹腔注射的葡萄糖耐量實驗(IPGTT):將si-NC和si-Lincpint小鼠禁食12h。按照每g體重需2mg葡萄糖,腹腔注射葡萄糖。體積(ml)=體重(g)/100。用75%乙醇消毒動物腹部,並用棉球乾燥。牢牢抓住受試動物背部並用注射器腹腔注射葡萄糖。分別在注射前0,15,30,60,90,120時,剪尾來測血糖。
ELISA法測小鼠血清胰島素:活體小鼠,眼眶靜脈採血。取0,15,30,60,90,120時間點的血液,室溫放置30min,離心3000g,15min。收集上層血清,可保存於-20℃。將試劑盒中試劑放置室溫,用ddH2O把10X wash buffer稀釋至1X。每孔加300微升wash buffer,洗3次;對照和樣品加10微升assay buffer。對照和標準孔(0.2,0.5,1,2,5,10ng/ml)加10微升matrix solution,標準孔中加入10微升的各濃度的標準液,在樣品孔中加10微升的血清樣品。所有孔加80微升detection Ab,搖床上室溫孵育2小時(此步之前的所有操作儘量在1個小時內完成),wash buffer清洗3次,每孔300微升;每孔100微升enzyme solution。搖床室溫孵育30min,吸出,wash buffer清洗6次,每孔300微升;吸出,每孔100微升substrate。搖床室溫孵育15min,會出現藍色,吸出,每孔100微升stop solution,藍色變黃色,在450nm波長下酶標儀中讀數。
將50nmol siRNA溶於0.2ml PBS中,通過尾靜脈快速注入小鼠體內,在成年小鼠中外源性封閉Lincpint的表達。同時將相同體積的亂序注入對照組小鼠體內。48h後,檢測其在胰腺中的幹擾效率,結果顯示(Fig.7A):與對照組相比,幹擾組胰腺中的幹擾效率為55±7.9%(P<0.05)。
幹擾48h後,進行葡萄糖耐量實驗(IPGTT),檢測注射葡萄糖前0min及注射後15min,30min,60min,90min,120min的血糖及胰島素水平,結果顯示(Fig.7B-C):與對照組相比,15min,30min幹擾組的血糖都有升高(P<0.05),0min,15min,60min幹擾組的胰島素水平有所下降(P<0.05)。
在活體水平中,通過qPCR檢測相關轉錄因子的變化,結果顯示(Fig.7D):與對照組相比,Ins1,Ins2,MafA,Pdx1,Glut2的表達下調(P<0.05),與細胞水平的結果一致。
實施例6Lincpint在機制方面的初步研究
核質分離實驗:大皿裡的細胞用PBS洗2次;胰酶將細胞消化下來,2mL培養基終止消化,吸入2mL無菌無酶管,4℃,500g,5分鐘;加入1mL PBS,棄上清,加入500μL Cell fractionation Buffer,輕輕吹打,冰上放5~10分鐘後,4℃,500g,5分鐘;上清移入新2mL無菌無酶管,4℃,500g,5分鐘;沉澱中加入500μL Cell fractionation Buffer,混勻後,加入500μL 2×Lysis/binding solution,吹打混勻,靜置後棄去上清,加入預冷的500μL Cell Disruption Buffer,渦旋混勻;加入500μL無水乙醇,吹打混勻,把吸附柱放到收集管中,加入700μL反應液,12,000g,30s,棄掉收集管內液體,並按照以下步驟進行:加入700μL Wash solutionⅠ,12,000g,30s,棄掉收集管,然後加入500μL Wash solution 2/3,12,000g,30s,棄收集管,最大轉速離心空柱1min,棄掉收集管;吸附柱放到新收集管中,加入40μL Elution solution(水浴到95℃)12,000g,30s洗脫,再加入10μL進行洗脫;測定RNA濃度,去DNA逆轉錄,qPCR。
在MIN6細胞中,通過核質分離實驗檢測Lincpint的表達情況,結果顯示(Fig.8A):Lincpint主要表達於細胞核中,提示其主要在轉錄水平調控基因的表達。在MIN6細胞中幹擾Ezh2,檢測轉錄因子的表達,結果顯示(Fig.8C-D):幹擾組Ins1,Ins2,轉錄因子MafA,Pdx1,Glut2的mRNA和蛋白水平下調,與幹擾Lincpint組的結果一致。提示Lincpint可能通過綁定Ezh2,沉默下遊靶基因,引起轉錄因子表達改變,從而影響beta細胞功能。
