鑑定紫花苜蓿MsPDS基因的VIGS沉默體系及其構建和鑑定方法與流程
2023-05-30 12:48:31 1
本發明涉及生物技術領域,具體涉及一種紫花苜蓿MsPDS沉默體系。
背景技術:
病毒誘導的基因沉默(VIGS)是植物體中天然存在的一種抵禦外源核酸入侵的防禦系統,正常情況下保護植物免受病毒的侵染。植物的這種防禦機制可被病毒RNA激活,屬於轉錄後基因沉默現象。如果在病毒載體中插入目標片段,侵染寄主植物後,植物會表現出目標基因功能喪失或表達水平下降的表型。利用這種機制,可以確定基因功能。這種技術是一種簡單、快速、高通量的分析已知序列基因功能的方法。
類胡蘿蔔素是一種由異戊二烯組成的萜類化合物,在動植物中都有重要的生理功能和生物活性。類胡蘿蔔素在光合作用中起著至關重要的作用,它們是光能的吸收與傳遞和光反應中心的重要結構成分。類胡蘿蔔素既是重要的輔助色素,幫助葉綠素接收光能,它們在高溫、強光下還能通過葉黃素循環,以非輻射的方式耗散PSII的過剩能量,保護反應中心、天線色素蛋白複合物、Chl等免受破壞。其數量的變化必將給光合作用帶來影響。而PDS(八氫番茄紅素脫氫酶)基因是影響胡蘿蔔素合成通路上的關鍵基因,具有保護葉綠素免受漂白的作用。若PDS基因發生沉默,其mRNA轉錄水平顯著降低,會導致類胡蘿蔔素合成途徑被阻斷,從而使被侵染的植物新生葉片表現出白化效應,可以直接用肉眼觀察,常被作為各種病毒VIGS體系的指示基因,來驗證VIGS體系在植物中沉默成功。
紫花苜蓿(Medicago sativa L.)素有「牧草之王」的美稱,是世界上利用最早、栽培最廣的一種優良的豆科牧草,在我國西北乾旱半乾旱地區的畜牧業發展和生態環境建設中發揮著極其重要的作用,研究紫花苜蓿抗病,抗旱,耐寒等抗逆基因對於紫花苜蓿的遺傳改良,高效育種具備重要意義。目前在紫花苜蓿中使用的轉基因方法鑑定基因功能耗時較長,耗費較大,缺乏一種快速,高效的鑑定體系。在國際上,尚未有利用VIGS體系鑑定紫花苜蓿基因功能的報導。
技術實現要素:
為了解決現有技術中存在的問題,實現簡單、快速、高通量分析、鑑定紫花苜蓿MsPDS基因,本發明提供以下技術方案:
1、鑑定紫花苜蓿MsPDS基因的VIGS沉默體系;
2、紫花苜蓿MsPDS基因的VIGS沉默體系的構建方法;
3、鑑定紫花苜蓿MsPDS基因的方法。
為實現本發明的技術目的,本發明第一方面提供的一種鑑定紫花苜蓿MsPDS的VIGS沉默體系,具有如SEQ ID NO.1所示的基因序列。
為實現本發明的技術目的,本發明第二方面提供的一種構建第一方面所述的沉默體系的方法,包括:
利用添加了Spe I酶切位點和Pst I酶切位點的特異性引物進行紫花苜蓿cDNA片段PCR擴增,純化後得到cDNA片段;
利用VIGS病毒載體構建具有紫花苜蓿MsPDS基因的重組質粒,經驗證成功後,得到具有如SEQ ID NO.1所示的基因序列的沉默體系。
其中,所述特異性引物由以下步驟得到:
根據蒺藜苜蓿MtrPDS基因設計擴增引物;
利用提取的紫花苜蓿RNA得到紫花苜蓿cDNA為模板,依次進行使用擴增引物PCR擴增、RACE處理、與T載體連接,得到如SEQ NO.2、SEQ NO.3、SEQ NO.4所示的紫花苜蓿PDS基因的三種剪接體序列;
將得到的剪接體序列通過與蒺藜苜蓿MtrPDS基因序列比對找到保守區域,根據保守區域基因序列設計得到特異性引物。
特別是,所述RACE處理時設計的RACE引物序列為:
5』RACE-PDS:GACAAGCCAGCCAGTCCTGCACCAGC
3』RACE-PDS:AGAAGCATGGTTCTAAGATGGCCTT。
特別是,所述擴增引物包括:
第一擴增引物:MsPDS 1F:GGCAAATTGGGCCAAAAACC
MsPDS 1R:CACCGCCCAAGGACTGAATA
第二擴增引物:MsPDS 2F:CAGGACTGGCTGGTTTGTCAA
MsPDS 2R:ACCTGTACAATAGCCTGTGCA
尤其是,所述添加了Spe I酶切位點和Pst I酶切位點的特異性引物為:
pMsPDS 1F:GGACTAGTGGCAAATTGGGCCAAAAACC;
pMsPDS 1R:AACTGCAGCACCGCCCAAGGACTGAATA。
特別是,所述VIGS病毒載體為豌豆早褐病毒。
為實現本發明的技術目的,本發明第三方面提供的一種鑑定紫花苜蓿MsPDS基因的方法,其尤其使用了第一方面所述的沉默體系。
其中,第三方面提供的鑑定紫花苜蓿MsPDS基因的方法包括:
將沉默體系的重組質粒轉化到農桿菌感受態細胞,經PCR鑑定陽性後,注射到已展開兩片子葉的植株上;
將所述植株採用水培方式進行培養後,對植株進行表型觀察及檢測。
尤其是,所述將植株採用水培方式進行培養還包括23℃條件下光照培養16h,19℃條件下黑暗培養8h。
其中,將所述植株採用水培方式進行培養僅需26天。
有益效果:
1、本發明在本領域中首次實現了紫花苜蓿MsPDS基因沉默體系的構建,獲得了具有使紫花苜蓿MsPDS基因沉默的沉默體系。
2、本發明使用添加了Spe I酶切位點和Pst I酶切位點的特異性引物成功利用蒺藜苜蓿的MtrPDS基因來克隆紫花苜蓿MsPDS基因,並利用豌豆早褐病毒成功構建紫花苜蓿MsPDS基因沉默體系,通過對植株RNA進行檢測發現,利用豌豆早褐病毒構建的沉默體系確實在植株內進行了繁殖傳播,如圖4所示,注射了菌液的植株都可以檢測到病毒條帶,可見本發明構建的沉默體系可以在植株內發生繁殖傳播。
3、本發明構建的沉默體系侵染植株26天後,植株便開始出現了漂泊症狀,白化現象沿葉脈向四周蔓延,可見其效果顯著,沉默作用明顯,可見,沉默體系不但在植株發生了繁殖傳播,而且使植株的PDS基因表達水平下降,葉綠素被漂白。
附圖說明
圖1是本發明實施例1製備的紫花苜蓿MsPDS基因三種剪接體的序列圖譜示意圖;
圖2是本發明實施例1構建的紫花苜蓿的pCAPE Ms PDS沉默載體結構示意圖;
圖3是本發明實施例2將沉默載體侵染蒺藜苜蓿後出現的表型形狀,其中A、B為試驗組植株,C為對照組植株;
圖4是本發明實施例2檢測侵染植株內的病毒表達結果的瓊脂糖凝膠電泳圖;
圖5是本發明實施例2採用qRT-PCR檢測pCAPE病毒表達的MsPDS片段的表達量結果;
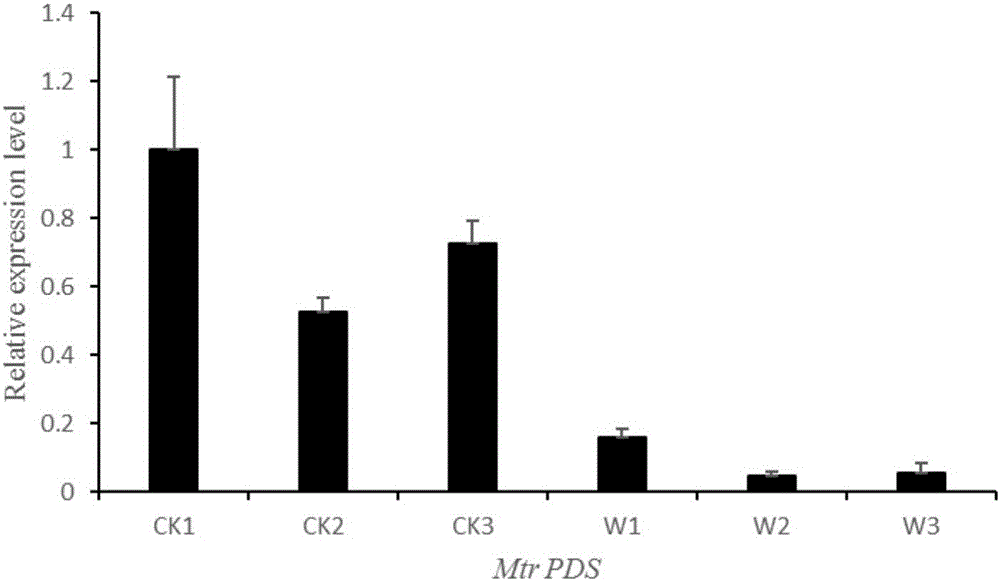
圖6是本發明實施例2採用qRT-PCR檢測蒺藜苜蓿Mtr PDS沉默效果。
具體實施方式
下面結合具體實例,進一步闡述本發明。應理解,這些實施例僅用於說明本發明而不用於限制本發明的範圍。此外應理解,在閱讀了本發明所講授的內容之後,本領域技術人員可以對本發明作各種改動或修改,這些等價形式同樣落於本申請所附權利要求書所限定的範圍。
本發明所用的試劑及儀器如無特別說明,均為市售產品,其中,本發明使用的質粒由丹麥奧胡斯大學提供。
實施例1沉默體系的構建
1、紫花苜蓿MsPDS基因的克隆
現有技術中並沒有公開紫花苜蓿基因組,更沒有涉及紫花苜蓿MsPDS基因序列的相關資料報導,因此本發明利用蒺藜苜蓿MtrPDS基因來克隆紫花苜蓿MsPDS基因,具體操作方法如下:
1.1設計引物
根據蒺藜苜蓿MtrPDS基因mRNA序列(NCBI登錄號:XM_003601686,XM_003601688)設計兩對特異引物,分別為:
MsPDS 1F:GGCAAATTGGGCCAAAAACC
MsPDS 1R:CACCGCCCAAGGACTGAATA
MsPDS 2F:CAGGACTGGCTGGTTTGTCAA
MsPDS 2R:ACCTGTACAATAGCCTGTGCA。
1.2基因克隆
使用Takara試劑盒提取紫花苜蓿RNA,提取步驟按照試劑盒說明書進行,並按照Takara反轉錄試劑盒說明書將RNA反轉錄成cDNA,反轉錄引物使用混合引物。以紫花苜蓿cDNA為模板,利用MsPDS 1F/1R為引物進行PCR擴增,測序得到982bp的片段,利用MsPDS 2F/2R為引物PCR擴增,測序得到1291bp的片段,其中,PCR酶使用天根公司生產的Tiangen master mix,PCR反應程序為:94℃預變性3min;94℃變性30s,55℃退火30s,72℃延伸90s,34個循環;72℃復性5min;4℃保存。分析得到兩個PCR片段並拼接得到紫花苜蓿PDS基因大部分的編碼區序列1604bp。
由於紫花苜蓿PDS基因的全長未拿到,進一步使Takara公司生產的RACE試劑盒RACE 5』/3』Kit User Manual來繼續擴增片段,方法參照試劑盒說明書,設計的RACE引物序列如下:
5『RACE-PDS:GACAAGCCAGCCAGTCCTGCACCAGC
3'RACE-PDS-1:AGAAGCATGGTTCTAAGATGGCCTT
RACE產物連接T載體後測序,其中5』RACE產物存在一種,3』RACE存在兩種,再結合之前得到的編碼區序列,分析認為紫花苜蓿PDS基因應該存在三種剪接體,分別命名為MsPDS 1,MsPDS 2,MsPDS 3,序列如Seq NO 1,全長2007bp,Seq NO 2,全長1446bp,Seq NO 3,全長1756bp,序列圖譜示意圖見圖1。
將得到的剪接體序列與蒺藜苜蓿MtrPDS基因序列比對找到保守區域,發現下述引物即可作為保守區域的特異性引物:
MsPDS 1F:GGCAAATTGGGCCAAAAACC
MsPDS 1R:CACCGCCCAAGGACTGAATA。
2沉默體系的構建
2.1目的基因的獲得
在步驟1.1設計的MsPDS 1F/1R引物上添加酶切位點,具體是在MsPDS 1F上添加Spe I酶切位點,在MsPDS 1R上添加Pst I酶切位點,添加後得到引物如下所示:
pMsPDS 1F:GG ACTAGTGGCAAATTGGGCCAAAAACC;
pMsPDS 1R:AACTGCAGCACCGCCCAAGGACTGAATA。
以步驟2.1反轉錄得到的紫花苜蓿cDNA為模板,使用加入酶切位點的pMsPDS 1F/1R為引物進行PCR擴增得到PCR產物,約1000bp左右片段,其中,PCR酶使用天根公司生產的Tiangen master mix,PCR反應程序為:94℃,3min;94℃,30s,55℃,30s,72℃,90s,34個循環;72℃,5min;4℃,∞。使用Takara PCR產物純化試劑盒純化回收PCR產物,得到紫花苜蓿基因片段,即目的基因,純化方法參照試劑盒說明書。
2.2重組質粒
本發明使用的VIGS病毒載體為豌豆早褐病毒,該病毒為RNA病毒,具有兩條RNA鏈,RNA1和RNA2,分別構建在兩個質粒上:pCAPE-1和pCAPE-2,用於沉默的片段構建在RNA2鏈上,原有質粒為pCAPE-PsPDS,一般將PsPDS片段切下來,再將要研究的基因片段連接上去。具體實施方法如下:
使用NEB公司生產的酶切酶Spe I,Pst I同時對步驟2.1.1獲得的目的基因產物和質粒pCAPE-PsPDS進行雙酶切,酶切體系50uL,酶切溫度37℃,時間30min,對目的基因酶切產物進行純化處理,對質粒使用Takara膠回收試劑盒切膠回收載體片段,方法參照試劑盒說明書。
然後使用NEB T4快速連接酶連接載體和基因片段,方法參照試劑盒說明書,反應體系:20uL,連接溫度25℃,連接時間10min,得到連接產物。取5uL連接產物轉化大腸桿菌(DH5α,天根公司),菌液PCR鑑定陽性克隆後,提取質粒測序驗證,得到連接成功的重組質粒,並命名為pCAPE-MsPDS,得到沉默體系,如圖2所示。
實施例2紫花苜蓿MsPDS基因的鑑定
1、質粒轉化
將實施例1製備的沉默體系,即實施例1中步驟2.2構建的重組質粒pCAPE-MsPDS和pCAPE-1各lμg分別加入到0.1mL農桿菌感受態細胞中,冰浴30min,使重組質粒進入細胞中,再將其放入液氮中速凍1min,立即37℃水浴5min,使細胞融化,再向細胞中加800μL無抗生素的液體LB液體培養基,28℃培養2~3h,轉速為150r/min。然後在4000r/min轉速條件下離心1min,棄去上清,使其重新懸浮於100μLLB培養基中,得到質粒轉化後的農桿菌菌液。取100μL菌液均勻地塗於含50mg/L卡那黴素(kana,Sigma)和50mg/L利福平(rif,Sigma)的抗性LB平板上,28℃培養2天,挑取單菌落接種到1mL相應抗性液體LB中,28℃震蕩培養過夜,對其進行PCR鑑定陽性克隆菌液後,得到GV3101-pCAPE MsPDS農桿菌菌液,及GV3101-pCAPE 1農桿菌菌液,將其直接接種至新鮮LB中,準備侵染。
2、侵染植株
2.1材料準備
取乾淨培養皿,鋪上濾紙,用蒸餾水潤溼,撒上若干打磨過的蒺藜苜蓿種子,放置於光照培養箱中,培養條件為:光照16h,24℃,黑暗8h,20℃。發芽後7天,等兩片子葉完全展開後,可用於侵染實驗。
2.2侵染菌液準備
將農桿菌菌液GV3101-pCAPE MsPDS和GV3101-pCAPE MsPDS接種至50~100mL,50mg/L卡那黴素,25mg/L利福平LB液體培養基裡,28℃,過夜培養。離心收集菌體後,去除上清液,分別使用含200uM乙醯丁香酮,10mMMES和10mM MgCl2的重懸液重懸菌體至OD=1.0左右,28℃,避光靜置3h以上。
2.3菌液注射植株
將GV3101-pCAPE 1和GV3101-pCAPE MsPDS重懸液都按體積比1:1混合。先用1mL注射器針頭在蒺藜苜蓿幼苗子葉背面輕輕劃線,再用去掉針頭的1mL注射器,將GV3101-pCAPE 1和GV3101-pCAPE MsPDS混合液注射入子葉內,設為實驗組,僅注射不含菌液的重懸液設為對照組。將注射後的植株使用水培方式培養,培養條件為光照16h,23℃,黑暗8h,19℃,溼度70%,定期更換培養液。
3、表型觀察及檢測
3.1注射菌液26天後,蒺藜苜蓿實驗組開始出現了漂白症狀,白化現象沿葉脈向四周蔓延,說明沉默載體開始發揮作用,如圖3A和3B所示,而對照組沒有任何變化如圖3C所示,沒有出現白化現象。
3.2病毒檢測
取對照組葉片,編為CK組,取實驗組白化葉片編為W(White)組,每組設3個重複,使用Takara RNA提取試劑盒分別提取CK組與W組葉片的RNA,並反轉錄成cDNA,方法參照試劑盒說明書,反轉錄引物使用混合引物。設計特異引物用於PCR檢測病毒,引物如下:
pCAPE 1F:GTGTTGTCAAACGTGGCTGG
pCAPE 1R:CCGACTTCATCTCAGCGTGT
PCR反應程序:94℃,3min;94℃,30s,55℃,30s,72℃,30s,34cycles;72℃,5min;4℃,∞。
檢測結果如圖4,沒有注射菌液的CK1~3都沒有檢測到病毒條帶,注射了菌液的W1~3都能檢測到病毒條帶,說明該病毒載體確實在蒺藜苜蓿實驗組裡進行了繁殖傳播。
3.3病毒載體沉默效果檢測
為了檢測病毒載體的沉默效果,採用螢光定量的實驗來檢測,設計兩對引物qPDS 1F/1R,qPDS 2F/2R,qPDS 1F/1R設計在病毒表達MsPDS片段上,用於檢測病毒表達基因片段的表達量,也反映了病毒的具體積累量,qPDS 2F/2R用於檢測蒺藜苜蓿PDS的表達量,來反映病毒載體的沉默效果,內參使用actin 2,引物序列如下:
qPDS 1F:GGGCATTCCTGAACGGGTAA
qPDS 1R:CACCGCCCAAGGACTGAATA
qPDS 2F:TACTAACTAATGGGAAGGTG
qPDS 2R:TCTGGAAATAAGGAACCC
actin F:GATGCTGAGGATATTCAACCCC
actin R:CCATGACACCAGTATGACGAGG
螢光定量儀器為7500,酶為Takara公司的GreenⅡ。
檢測結果如圖5和圖6所示,由圖5可以看出蒺藜實驗組病毒表達的MsPDS片段的表達量是對照組的幾十倍,也反映了病毒在實驗組葉片裡得到了大量的積累,由圖6可以看出蒺藜苜蓿實驗組的MtrPDS基因的表達量相對於對照組顯著降低,表明蒺藜MtrPDS的表達被抑制,結合蒺藜苜蓿實驗組的表型,說明本實驗裡克隆的紫花苜蓿MsPDS基因是正確的,本體系確實可以用於鑑定紫花苜蓿的基因功能。
儘管上述對本發明做了詳細說明,但不限於此,本技術領域的技術人員可以根據本發明的原理進行修改,因此,凡按照本發明的原理進行的各種修改都應當理解為落入本發明的保護範圍。
