一種pH敏感響應的N、S共摻雜石墨烯量子點的製備及脲酶活性的測定的製作方法
2024-02-19 18:04:15 1
本發明涉及碳納米材料的製備領域,具體地,涉及一種N、S共摻雜石墨烯量子點的製備方法及其在脲酶活性檢測中的應用。
背景技術:
(1)石墨烯量子點(Graphene Quantum Dots, GQDs),作為一種新型零維碳納米材料,由於量子限域和尺寸、邊緣效應,石墨烯量子點具有許多奇特的光學性質:很強的光致發光特性以及可以根據量子點的尺寸和元素組成對其顏色的可調控性;又具有極其窄且對稱的PL發射。同時具有良好的生物相容性,低細胞毒性,環境友好,製備成本低。由於 GQDs的光學性質,可應用於體內小分子物質和陰(陽)離子等的檢測、生物成像、藥物運輸以及藥物示蹤等方面,而且基於GQDs的檢測具有高選擇性,特異性,幹擾小等優點。
(2)目前製備石墨烯量子點的主要方法是自上而下和自下而上兩類方法。前者是指利用物理或化學方法將大塊的含碳物質分解直至納米尺度,包括電弧放電法、雷射刻蝕法、電化學合成法等;後者是指主要利用化學合成方法,將前體小分子縮合成量子點,包括燃燒水熱法、模板法、微波法等水熱法。但是許多方法都無法避免原料獲取困難,設備昂貴,操作麻煩耗時,工藝繁瑣,成品率低等因素影響,從而限制了石墨烯量子點的廣泛應用。
(3)近年來,研究者發現將石墨烯量子點經化學摻雜異原子後,石墨烯量子點共軛平面的電荷密度和帶寬能隙可得到有效調節,從而改變電子的流動密度和躍遷方式,進而實現對螢光量子產率、光學性質、反應活性、催化性能等的調節,從而拓展石墨烯量子點的應用。目前對石墨烯量子點的摻雜主要是B、P、N、S等單種或多種異元素摻雜的方式。
(4)脲酶存在於大多數細菌、真菌和高等植物裡,它是一種醯胺酶、能促進有機物質分子中酶鍵的水解。根據土壤脲酶活性可以表徵土壤的氮素狀況,反映土壤中各種生物化學過程的強度和方向,對改善土壤生態環境,提高土壤肥力有重要意義。脲酶還廣泛存在食物當中,檢測脲酶活性對食品安全有重要的意義。細菌脲酶的存在通常會導致人體許多疾病的發生,如肝性腦病、組織感染和胃潰瘍等,故脲酶的活性檢測為我們提供醫學疾病診斷和治療的基礎。然後,很多文獻報導的是脲酶的定性檢測,或者在測定過程中酶的活性破壞或降低,過程也是比較繁瑣。
(5)因此,提供一種操作簡便、靈敏度高,能有效測得脲酶活性的石墨烯量子點及其製備方法是本發明亟需解決的問題。
技術實現要素:
(1)針對現有技術不足,本發明的目的是通過兩步加熱熔融製得一種新的N、S共摻雜石墨烯量子點,該物質具有激發波長不依賴性,pH敏感性,對小分子具有高選擇性和幹擾小等優點。
(2)為了實現上述目的,本發明所述的一種pH敏感響應的N、S共摻雜石墨烯量子點的製備方法,其特徵在於,包括如下步驟:將碳源化合物和含氮、硫元素的氮硫源化合物進行第一步加熱熔融反應,之後加入另一種氮源化合物進行第二步反應,反應後的混合物待自然冷卻後加入一定體積的丙酮溶液,待白色沉澱析出後,離心獲得白色沉澱利用截留分子量為2000 Da的透析膜透析上述的白色沉澱得到N、S共摻雜石墨烯量子點,即為具有pH響應的石墨烯量子點。
所述碳源化合物至少有一種選自檸檬酸、蘋果酸。
所述氮硫源化合物為穀胱甘肽,所述另一種氮源化合物為多乙烯多胺。
所述碳源化合物、含氮、硫元素的氮硫源化合物和另一種氮源化合物之間的比例是2:0.6:10。
所述混合物的第一步加熱溫度為140-170℃,反應時間為15-25 min。
所述混合物的第二步加熱溫度為180-200℃,反應時間為0.5-1 h。
本發明還包括對截留得到的N、S共摻雜石墨烯量子點進行冷凍乾燥。
本發明上述的製備方法得到的N、S共摻雜石墨烯量子點。
本發明所述的一種脲酶活性的檢測方法,通過螢光分光光度法進行脲酶濃度的檢測,其特徵在於,所述螢光分光光度法中使用的溶劑由緩衝溶液、尿素和權利要求8所述的N、S共摻雜石墨烯量子點混合而成。
通過所述螢光分光光度法繪製的吸收光譜曲線方程為:y=-0.2788x+485.57,y為螢光強度;x為脲酶活性濃度,最低檢測限(LOD)=2.5 U/L;所述溶劑中各組分的含量為:尿素的濃度為0.5 mol/L,緩衝溶液的濃度為0.003 mol/L,且所述緩衝溶液的pH為6.0。
具體地說,本發明提供了一種石墨烯量子點的製備方法,其特徵在於,所述製備方法包括:將碳源化合物和含氮、硫元素化合物進行第一步加熱熔融反應,再加入多乙烯多胺,得到具有pH響應的石墨烯量子點。其中,原料獲取簡單,對生產設備要求低,具有一定工業化生產要求。
(3)反應得到的石墨烯量子點溶液待自然冷卻後加入一定體積的丙酮溶液,待白色沉澱析出後,離心得到淡黃色的石墨烯量子點固體。
(4)製備得到的N、S共摻雜石墨烯量子點溶液可能存在粒徑分布較寬的特點,為獲得具有較窄螢光發射的N、S共摻雜石墨烯量子點,需要對反應產物進行尺寸分級。作為優選,利用截留分子量為2000 Da的透析膜對N、S共摻雜石墨烯量子點進行透析。
(5)產物透析提純方法為:反應產物經截留分子量為2000 Da的透析袋充分透析3天,每隔6h換水,透析袋內溶液即為N、S共摻雜石墨烯量子點溶液。經3天透析進行尺寸截留的N、S共摻雜石墨烯量子點具有相對均一的粒徑分布。
(6)作為優選,本發明的製備方法還包括對透析截留得到的N、S共摻雜石墨烯量子點進行冷凍乾燥。
(7)本發明還提供了一種根據上述所述的製備方法製得的石墨烯量子點。
(8)本發明製備方法合成的N、S共摻雜石墨烯量子點具有單層結構,尺寸粒徑約為6 nm。在365 nm紫外光照射下發射藍色螢光,且該發光為激發波長不依賴的螢光發射。當用290—390nm激發波長進行激發時,螢光最大發射峰位置幾乎不發生變化,這說明本發明方法合成的N、S共摻雜石墨烯量子點質量高、具有均一的發光性質。
(9)針對上述現有技術,本發明的目的在於克服現有技術中脲酶活性側重於定性檢測,或者在測定過程中酶的活性容易被破壞或降低,過程也是比較繁瑣的問題,提供一種操作簡便、靈敏度高,能有效測得脲酶活性的石墨烯量子點及其製備方法。
(10)為了實現上述目的,本發明還提供了一種脲酶活性的定量檢測方法,通過螢光分光光度法進行脲酶活性的檢測,其特徵在於,所述螢光分光光度法中的溶劑通過緩衝溶液、尿素和根據上述所述的石墨烯量子點混合而成。
(11)本發明的有益效果是,本發明將碳源化合物和氮、硫源化合物進行兩步加熱反應,得到具有pH響應的石墨烯量子點,同時脲酶水解尿素會生成OH-和NH4+,使得整個體系中pH值升高,進而通過該石墨烯量子點的pH敏感性測定其螢光強度的變化程度,用於脲酶活性的檢測獲得了良好的效果,操作方便,靈敏度高,並且脲酶的最低檢出限可達到2.5 U/L。
(12)本發明的其他特徵和優點將在隨後的具體實施方式部分予以詳細說明。
附圖說明
附圖是用來提供對本發明的進一步理解,並且構成說明書的一部分,與下面的具體實施方式一起用於解釋本發明,但並不構成對本發明的限制。在附圖中:
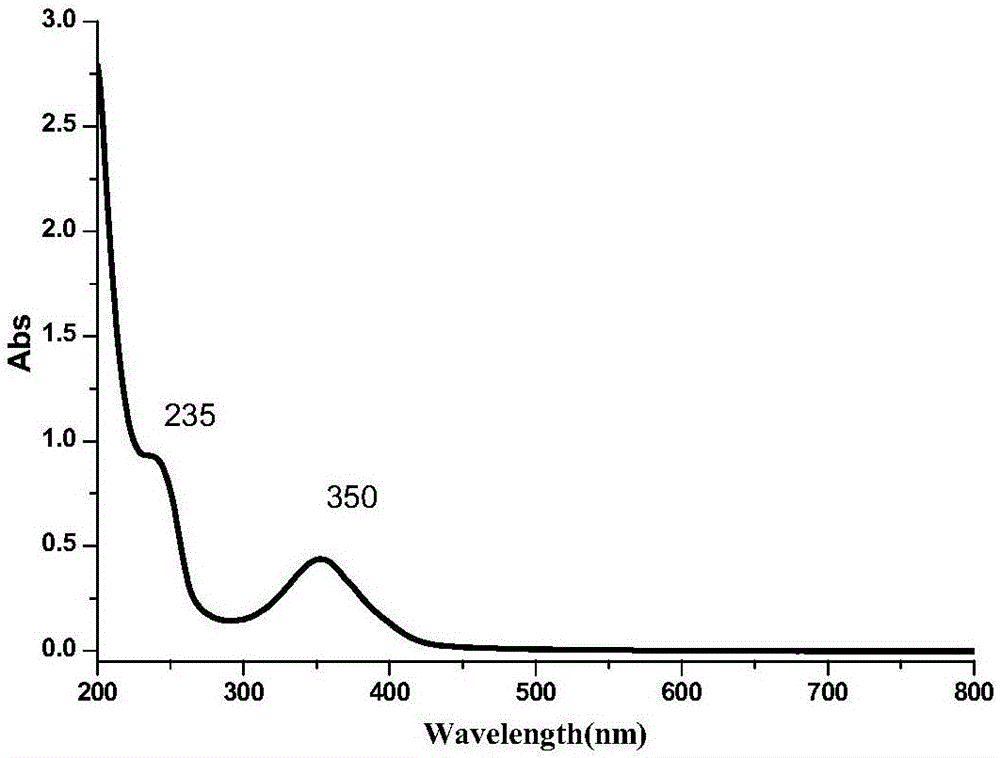
圖1a是N、S共摻雜石墨烯量子點的紫外光譜圖;
圖1b是N、S共摻雜石墨烯量子點的螢光光譜圖;
圖2是N、S共摻雜石墨烯量子點290nm到390nm激發波長下得到的發射光譜(EM290,EM300,EM310,EM320,EM330,EM340,EM350,EM355,EM360,EM370,EM380,EM390);
圖3是N、S共摻雜石墨烯量子點溶液在自然光和紫外光照射下的結果圖,其中a為自然光照射,b為365nm紫外光激發;
圖4是N、S共摻雜石墨烯量子點的透射電鏡照片;
圖5是N、S共摻雜石墨烯量子點的原子力顯微鏡照片;
圖6是N、S共摻雜石墨烯量子點的XPS圖;
圖7是N、S共摻雜石墨烯量子點在不同pH下的螢光強度圖譜;
圖8a是N、S共摻雜石墨烯量子點的螢光強度與pH值之間的關係圖;
圖8b是N、S共摻雜石墨烯量子點的螢光強度與pH值之間的線性關係圖;
圖9是N、S共摻雜石墨烯量子點在加入不同活性的脲酶後的螢光強度圖譜;
圖10是N、S共摻雜石墨烯量子點的螢光強度和脲酶活性濃度之間的線性關係圖。
具體實施方式
(1)下面結合具體實施方式和附圖對本發明進行詳細說明。應當理解的是,此處所描述的具體實施方式僅用於說明和解釋本發明,並不用於限制本發明。
(2)實施例1(N,S-GQDs的合成)
本實施例的N、S共摻雜石墨烯量子點通過以下步驟製得:
精確稱取2.0 g檸檬酸和0.6 g穀胱甘肽,置於50ml圓底燒瓶中,在150℃的油浴鍋中反應20min,20min後,檸檬酸和穀胱甘肽已完全液化,顏色由無色變成黃褐色,再加入10ml的多乙烯多胺,溫度調為200℃,繼續攪拌反應1h。反應結束後,取出得到的棕黃色粘稠液體,自然冷卻後,加入50ml丙酮溶液,待有白色固體析出後,離心得到淡黃色的N,S-GQDs粉末,將離心得到的石墨烯量子點用0.5mL蒸餾水溶解,並透析提純後經冷凍乾燥製得石墨烯量子點固體。其中,產物透析提純方法為:反應、離心所得的產物經截留分子量為2000Da的透析袋中充分透析3天,每隔6h換水一次,透析袋內溶液即為N、S共摻雜石墨烯量子點溶液。
(3)對本實施例製得的N、S共摻雜石墨烯量子點進行測試:
①圖1a表明N, S-GQDs水溶液的紫外一可見光吸收光譜分別在235nm和350nm處有兩個典型吸收峰,推測為 C=C的 π-π*躍遷和 C=O的 n-π*躍遷。圖1b表明N, S-GQDs水溶液的最大激發波長和發射波長分別為350nm和452nm,基本對稱。圖2是N, S-GQDs在290nm至390nm變化的激發波長條件下的發射譜圖,N,S-GQDs的最大發射波長保持穩定,表現出激發波長不依賴的特徵,這說明本發明方法合成的N,S-GQDs尺寸均勻,質量高。
②圖3 a所示N, S-GQDs在自然光照射下為棕黃色,在紫外光(365nm)的照射條件下,為亮藍色螢光見圖3b。
③圖4為本實施例製得的N,S-GQDs的透射電鏡圖,如圖4所示,N,S-GQDs顆粒分布均勻,尺寸為6 nm。
④圖5為本實施例製得的N,S-GQDs的原子力顯微鏡圖,如圖5所示,N,S-GQDs的尺寸均一,且高度為~2.1 nm,表現出6層石墨原子層的特點。
⑤圖6為本實施例製得的N,S-GQDs的XPS結果,如圖6所示,N,S-GQDs主要表現出C, N,O三種元素和少量的S元素的信息,C, N, O和S的原子百分比分布為73.01%,14.12%,12.6%和0.27%。
⑥圖7中,曲線自上而下對應的pH值分別為3.0,3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0,8.5,
9.0,9.5,10,10.5,11,11.5,12,可以看出,N,S-GQDs螢光強度依賴於pH值,受pH的影響較大,在pH值變化範圍內隨著pH值的增大,螢光強度逐漸減小,且螢光強度與pH值有良好的規律(圖8a)。然而,當pH值大於9時,N,S-GQDs螢光強度幾乎穩定不變,pH值對N,S-GQDs螢光強度的影響過程可以理解為質子化一去質子化導致的表面電荷改變。在pH值範圍3-9內,螢光強度與pH值呈線性關係,擬合方程為:y = -97.204x+1038.4,且R為0. 9957(圖8b)。
(4)本發明還提供了一種脲酶活性的檢測方法,通過螢光分光光度法進行脲酶活性的檢測,其中,所述螢光分光光度法中的溶劑通過緩衝溶液、尿素和上述所述的石墨烯量子點混合而成。
①將步驟(1)製得的石墨烯量子點配成均勻分散的水溶液,得到N,S-GQDs溶液的濃度為22.4ug/ml。
②先將300µL尿素溶液和100µL一系列不同活性濃度的脲酶溶液避光反應20min,再加入上述步驟①配置的N,S-GQDs溶液100µL,保持總體積為500µL,避光反應1h後將所得溶液置於螢光分光光度計中。其中,所有的組分溶液都是用磷酸鹽緩衝液配的。
③在激發波長350nm條件下,讀取發射波長452處螢光強度值,根據螢光強度數據可以得出已知脲酶活性的螢光強度值,繪製標準曲線。
④在本發明提供的一種優選的實施方式中,所述溶劑中各組分的含量具體為:尿素的濃度為0. 5M/L,緩衝溶液(緩衝溶液由Na2HPO4﹒7H2O、NaH2PO4﹒2H2O、NaCl組成)的濃度為0. 003mol/L,且所述緩衝溶液的pH為6.0。圖9中的曲線自上而下對應的脲酶濃度為0U/L, 5U/L, 20U/L, 40U/L, 60U/L, 80U/L, 100U/L, 200U/L, 300U/L, 400U/L, 600U/L, 800U/L, 1000U/L,從而可以看出,隨著脲酶活性濃度的增大,螢光強度逐漸減弱,圖10中縱坐標為溶劑螢光強度,通過該圖可以看出,待測脲酶活性濃度在5-800U/L時,其活性濃度與螢光強度值有著良好的線性關係,線性方程為:y = -0.2809x+487.28,且R為0. 9960,最低檢測限(LOD)=2.5U/L(S/N=3)。
⑤本發明考察基於N,S-GQDs測定不同活性濃度脲酶的重現性,在步驟④的測定條件下,重複、獨立分別測定5 U/L和40 U/L六次,測定的RSD分別為1.5%和2.1%。
以上實施例僅僅為本發明的優選實施例,並非全部。基於實施方式中的實施例,本領域技術人員在沒有做出創造性勞動的前提下所獲得其它實施例,都屬於本發明的保護範圍。
