治療劑的選擇方法與流程
2023-05-24 21:09:46 1
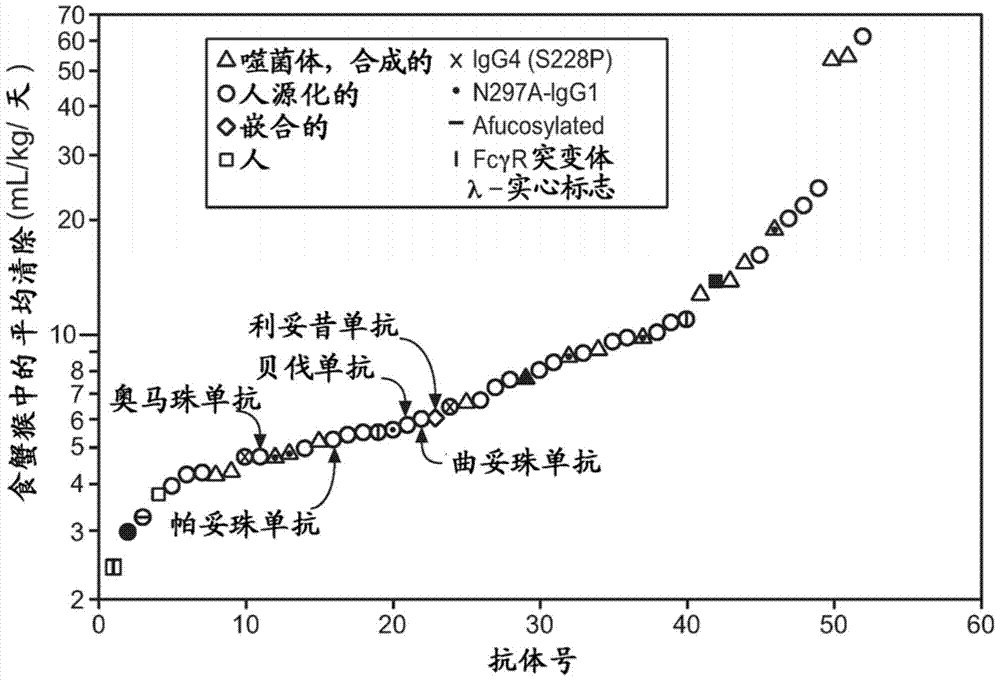
治療劑的選擇方法相關申請的交叉參考本申請要求2012年5月23日提交的美國臨時申請號61/650,964的權益,所述臨時申請以其整體併入本文作為參考。技術領域本發明涉及用於鑑定治療劑的選擇方法,所述治療劑具有在人或人和食蟹猴中具有快速清除的增加的風險,和降低此類治療劑的清除的方法。背景人或人源化單克隆抗體已經廣泛地成功用作人類疾病的治療劑。多於30種抗體已經收到了FDA許可用於治療多種病症,同時上百種更多的抗體目前處於臨床開發中1。除了使用抗體治療劑能夠達到的精確的選擇性和高效價之外,抗體作為藥物的成功很大地得益於其通常長的循環半壽期。從血液中緩慢清除使得能夠以不頻繁的給藥實現期望的藥物濃度。抗體藥物通常經由靜脈內輸注或皮下注射施用,並且較不頻繁的施用提高了患者依從和因此臨床益處。抗體可以通過若干種機制從全身循環中消除-液相內吞作用後的細胞內分解代謝(非特異性清除),抗原介導的清除4,和在一些情況下由於形成抗治療抗體(ATA)。抗原介導的清除通常在抗體結合與細胞結合的抗原時觀察到,並且在低濃度抗體時最為明顯,並且通常可以通過增加抗體劑量飽和。已經觀察到ATA在給藥後4-7天出現,涉及形成免疫複合物,所述免疫複合物可以被快速清除,並且有些時候可以從抗體的血漿濃度-時間譜的非典型形狀容易地檢測到。通過FcRn依賴性回收機制減緩抗體消除。當抗體穿過內吞作用途徑時,其可以在pH7)快速釋放。這些特徵導致人或人源化抗體在人中半壽期為6-32天(Keizer,R.J.,Huitema,A.D.R.,Schellens,J.H.M.,Beijnen,J.H.ClinicalPharmacokineticsofTherapeuticMonoclonalAntibodies.ClinicalPharmacokinetics49,493-507(2010))。在12種IgG1抗體的藥物代謝動力學數據的基礎上,測定了人中清除的平均值為3.9±1.2(S.D.)mL/kg/天,範圍為~2-6mL/kg/天(Deng,R.等人.Projectinghumanpharmacokineticsoftherapeuticantibodiesfromnonclinicaldata:Whathavewelearned?mAbs3,61-66(2011))。相似地,這些抗體在食蟹猴中的研究得到了6.5±2.9(S.D.)mL/kg/天的平均清除。增加pH6.0時與FcRn結合的抗體Fc區的改造能夠增加潛在治療抗體在食蟹猴和小鼠中的半壽期(Dall'Acqua,W.F.,Kiener,P.A.&Wu,H.PropertiesofhumanIgG1sengineeredforenhancedbindingtotheneonatalFcreceptor(FcRn).TheJournalofbiologicalchemistry281,23514-23524(2006);Hinton,P.R.等人AnEngineeredHumanIgG1AntibodywithLongerSerumhalflife.JImmunol176,346-356(2006);Yeung,Y.A.等人EngineeringhumanIgG1affinitytohumanneonatalFcreceptor:impactofaffinityimprovementonpharmacokineticsinprimates.JImmunol182,7663-7671(2009);Zalevsky,J.等人Enhancedantibodyhalflifeimprovesinvivoactivity.Naturebiotechnology28,157-159(2010))。潛在治療抗體在相關的非人物種中的臨床前測試對於獲得對人中預期的給藥治療方案的理解,以及評價潛在毒性是必須的。考慮到人和非人靈長動物(NHP)之間的高靶抗原序列同源性,和對於回收FcRn受體的相似的結合親和力(Dall'Acqua,Kiener&Wu,見上文),食蟹猴是臨床前藥物代謝動力學(PK)和毒理學研究的優選的物種。先前我們已經顯示在人中測定的治療IgG1抗體的非特異性清除通常是在食蟹猴中測量的約一半(Deng,R.等人,見上文)8。快於預期的清除的一個潛在機制是脫靶(off-target)結合13-16。儘管有時可以鑑定並消除高特異性的脫靶結合,14通常脫靶結合的來源是未知的並且難以用增加劑量來飽和。尚未建立評價和預測抗體的體內吸收、分布、代謝,和消除機制或體內藥物代謝動力學行為的體外系統。我們尋求開發非特異性結合的體外測定法,所述測定法可用於鑑定可能表現出快速體內清除的抗體。附圖簡述圖1是顯示了在人和食蟹猴中測量的抗體清除值的關聯的圖(ρ=0.74,n=16)。對於我們的分析,選擇的抗體劑量被認為是飽和任何靶依賴性清除。實線是人清除的對數對於食蟹猴清除的對數的線性回歸擬合。對於顯示的大多數抗體,人清除比對應的食蟹猴清除慢大約2倍。相比之下,對於抗NRP1,人中清除(9.2mL/kg/天)比食蟹猴中清除(4.3mL/kg/天)快~2倍。圖2是顯示食蟹猴中抗體(n=52)的清除值的圖。顯示了來自給藥組的幾何平均值,其中假定任何特異性清除對報導的清除的貢獻是可忽略的。除了4個研究之外,平均值來自3或更多隻動物。顯示了人源化的(圓圈)、人(方形)、合成的人噬菌體衍生的(三角),和嵌合的(菱形)抗體。實心標誌提示抗體具有λ輕鏈,全部其他具有κ輕鏈。具有鉸鏈穩定突變體S228P的IgG4同種型抗體用「x」標記,全部其他為IgG1同種型。幾何學形狀內的水平線提示afucosylated抗體。通過幾何形狀內的點提示經由用Ala替換Asn297得到的aglycosylated抗體。通過幾何形狀內的垂直線提示具有調節FcγR結合的Fc胺基酸替換的抗體。圖3是顯示人源化的和衍生自噬菌體展示文庫的合成的人抗體在食蟹猴中的清除值的比較的盒形圖。未顯示嵌合抗體(n=1)和來自非噬菌體來源的人抗體(n=3)因為非常小量的數據集。圖顯示被盒形圖覆蓋的單個數據值。盒形圖矩形顯示第一四分位數(第25百分位)和第三四分位數(第75百分位)之間的四分位數間距(IQR);盒形圖矩形內較粗的水平線處於中位數(第50百分位)。下盒形圖線延伸至仍在下四分位數的1.5IQR之內的最低的數據值,而上線延伸至上四分位數的1.5IQR之內的最高數據值。圖4說明了食蟹猴中抗體清除和對於食蟹猴FcRn的結合親和力(KD,pH5.8)之間的關係。使用如圖2中定義的標誌。如Yeung等人,2010所述從SPR數據的穩態分析測定了nM的解離常數(KD)。使用的標誌與圖2相同。圖5說明了A)食蟹猴和B)人中抗體清除值與歸一化的BVELISA分數的關聯。BVELISA分數>5與食蟹猴中增加的快速清除的風險有關(ρ=0.53,n=45)。從6次測定的平均計算BV分數;通過除以相同測定板上的非包被的孔觀察到的信號歸一化每次測定。BV分數10mL/kg/天,而BV分數>5的抗體中的75%清除超過10mL/kg/天。比值比的最大似然估計為19.5(費希爾精確檢驗,95%置信區間(3.3,165.7))。置信區間提示對於BV>5更快清除的機率增加3.3至166倍;區間不含有1提示了統計顯著性。B)BVELISA分數>5與人中增加的快速清除的風險相關(ρ=0.83,n=16)。圖6-8顯示食蟹猴中的抗體清除和抗體之間分別關於A)pI,B)如HIC測定的疏水性,和C)Fv結構域計算的電荷的關係。圖9顯示食蟹猴清除和BVELISA分數是相關聯的。圖10顯示食蟹猴清除和歸一化的BV分數之間的關聯在測試為具有HIII和κ1框架和不同CDR和遊標位置的IgG1抗體之間仍然存在。圖11顯示人清除和BVELISA分數之間的關聯甚至對於抗NRP-1抗體依然存在。圖12顯示了降低快速清除風險的可能的篩選級聯。詳細描述在此我們描述了基於檢測與杆狀病毒(BV)顆粒結合的測定法,其可用於評價治療劑的脫靶結合。此測定法尤其可以在抗體先導物生成或優化過程中使用以增加獲得合適的藥物的概率。通過在本發明的測定法中測試一大組抗體並使用食蟹猴和,如果可獲得的,人中的相同抗體的藥物代謝動力學數據分析測試結果,我們測定了與回收FcRn受體相互作用的改變並不導致這些抗體觀察到的比預期更快的清除。我們未發現如其他人所報導的清除與完整抗體的等電點(pI)或疏水性相關。我們認為脫靶結合導致許多抗體的快速清除,儘管在大多數情況下並未鑑定此類脫靶。在非人靈長動物和人中進行藥物代謝動力學研究是耗時且昂貴的。在本發明之前,在進行此類體內藥物代謝動力學研究之前,難以預測潛在的脫靶結合對藥物代謝動力學譜的貢獻。我們開發了便宜的、更高通量的體外測定法,其易於使用並且可用於幫助選擇具有更高的具有適當的藥物代謝動力學性質的可能性的治療候選物並且不選擇具有更高的在非人靈長動物和人中具有不適當的藥物代謝動力學性質的可能性的治療候選物。現在將通過使用以下定義和實例僅作為參考的方式詳細描述本發明。本文參考的全部專利和出版物,包括此類專利和出版物中公開的全部序列明確併入作為參考。「治療劑」指可用於治療疾病的活性劑。在一個實施方案中,治療劑包含一個或多個多肽序列。在另一個實施方案中,治療劑包含抗體的序列。在另一個實施方案中,治療劑是免疫綴合物。如本文所用的「BV」指杆狀病毒顆粒。如本文所用的「BV分數」指從來自多個(2個或更多個)結合測定法的平均值計算的值,所述結合測定法測量治療劑與杆狀病毒顆粒的結合水平。「歸一化的BV分數」指這樣的BV分數,其中來自每個結合測定法的值在計算平均值之前已經被歸一化。在一個實施方案中,通過用來自每個結合測定法的值除以在非治療的(即,沒有BV)的測定法中觀察到的值實現歸一化。在一個實例中,用來自具有BV的每個結合法測定的OD值除以對於非包被的孔觀察到的OD值的平均值。「增加的風險」或「增加的可能性」指事件將發生的更大的概率。「快速清除」指活性劑在人或食蟹猴中的清除速率。在一個實施方案中,快速清除速率是高於10mL/kg/天的任何速率。在另一個實施方案中,快速清除速率是高於12mL/kg/天的任何速率。「理想的清除」指活性劑在人或食蟹猴中的理想的清除速率。在一個實施方案中,理想的清除速率是8.5mL/kg/天或更低的速率。在另一個實施方案中,理想的清除速率是12mL/kg/天或更低的速率。如本文所用,術語「免疫粘附素」指抗體樣分子,其組合了異源蛋白質(「粘附素」)的結合特異性與免疫球蛋白恆定結構域的效應子功能。結構上,免疫粘附素包含具有期望的結合特異性的胺基酸序列和免疫球蛋白恆定結構域序列的融合物,所述胺基酸序列不是抗體的抗原識別和結合位點(即,是「異源的」)。免疫粘附素分子的粘附素部分通常是連續的胺基酸序列,至少包含受體或配體的結合位點。免疫粘附素中的免疫球蛋白恆定結構域序列可以從任何免疫球蛋白獲得,諸如IgG-1、IgG-2、IgG-3,或IgG-4亞型、IgA(包括IgA-1和IgA-2)、IgE、IgD或IgM。「融合蛋白」和「融合多肽」指具有至少兩個共價連接在一起的部分的多肽,其中每個部分是具有不同性質的多肽。性質可以是生物學性質,諸如體外或體內活性。性質也可以是簡單的化學或物理性質,諸如結合靶分子、催化反應等。所述部分可以通過單肽鍵或通過含有一個或多個胺基酸殘基的肽接頭直接連接。一般而言,所述部分和接頭彼此符合讀框。術語「抗體」在本文以最廣泛的含義使用並且涵蓋多種抗體結構,包括但不限於單克隆抗體、多克隆抗體、多特異性抗體(例如,雙特異性抗體),和抗體片段只要其展示出期望的抗原結合活性。「抗體片段」指不是完整抗體的分子,其包含完整抗體的部分,所述部分結合完整抗體結合的抗原。抗體片段的實例包括但不限於Fv、Fab、Fab'、Fab』-SH、F(ab')2;雙抗體;線性抗體;單鏈抗體分子(例如scFv);和從抗體片段形成的多特異性抗體。與參照抗體「結合相同表位的抗體」指在競爭測定法中阻斷參照抗體與其抗原的結合的50%或更多的抗體,並且相反地,參照抗體在競爭測定法中阻斷所述抗體與其抗原的結合的50%或更多。本文提供了示例性的競爭測定法。術語「嵌合的」抗體指這樣的抗體,其中重鏈和/或輕鏈的一部分源自特別的來源或物種,而重鏈和/或輕鏈的剩餘部分源自不同的來源或物種。抗體的「類別」指其重鏈所具有的恆定結構域或恆定區的類型。有五種主要的抗體類別:IgA、IgD、IgE、IgG,和IgM,並且這些中的若干可進一步分為亞類(同種型),例如IgG1、IgG2、IgG3、IgG4、IgA1,和IgA2。對應於不同類別的免疫球蛋白的重鏈恆定結構域分別被稱作α、δ、ε、γ,和μ。如本文所用的術語「細胞毒性劑」指抑制或阻止細胞功能和/或導致細胞死亡或破壞的物質。細胞毒性劑包括,但不限於,放射性同位素(例如,At211、I131、I125、Y90、Re186、Re188、Sm153、Bi212、P32、Pb212和Lu的放射性同位素);化療劑或藥物(例如,甲氨蝶呤、阿黴素、長春花生物鹼類(長春新鹼、長春花鹼、依託泊苷)、多柔比星、美法侖、絲裂黴素C、瘤可寧、道諾黴素或其他嵌入劑);生長抑制劑;酶及其片段諸如核解酶;抗生素;毒素諸如小分子毒素或細菌、真菌、植物或動物來源的酶促活性毒素,包括其片段和/或變體;和下文公開的多種抗腫瘤或抗癌劑。「效應子功能」指可以歸因於抗體的Fc區的那些生物學活性,其可以隨抗體同種型而變化。抗體效應子功能的實例包括:C1q結合和補體依賴性細胞毒性(CDC);Fc受體結合;抗體依賴性細胞介導的細胞毒性(ADCC);吞噬作用;細胞表面受體(例如B細胞受體)的下調;和B細胞激活。活性劑,例如藥物製劑的「有效量」指必要的劑量和時間段的,有效達到期望的治療或預防結果的量。本文的術語「Fc區」用於定義至少含有恆定區的一部分的免疫球蛋白重鏈的C末端區。此術語包括天然序列Fc區和變體Fc區。在一個實施方案中,人IgG重鏈Fc區從Cys226,或從Pro230延伸至重鏈的羧基末端。然而,Fc區的C末端賴氨酸(Lys447)可或可不存在。除非本文另外說明,Fc區或恆定區中的胺基酸殘基的編號是根據EU編號系統,也稱為EU索引,如Kabat等人,SequencesofProteinsofImmunologicalInterest,第5版PublicHealthService,NationalInstitutesofHealth,Bethesda,MD,1991中所述。「框架區」或「FR」指非超變區(HVR)殘基的可變結構域殘基。可變結構域的FR通常由4個FR結構域組成:FR1、FR2、FR3,和FR4。因此,HVR和FR序列通常在VH(或VL)中的下列序列中出現:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。術語「全長抗體」、「完整抗體」,和「整個抗體」在本文可互換地使用以指具有與天然抗體結構基本相同的結構或具有含有如本文定義的Fc區的重鏈的抗體。術語「宿主細胞」、「宿主細胞系」,和「宿主細胞培養物」可互換使用並指其中已經導入了外源核酸的細胞,包括此類細胞的後代。宿主細胞包括「轉化體」和「轉化的細胞」,其包括原代轉化的細胞和源自其的後代而不論傳代次數。後代與親本細胞在核酸內容上可以不是完全相同的,但可以含有突變。本文包括具有與初始轉化的細胞中所篩選的或選擇的相同的功能或生物學活性的突變體後代。「免疫綴合物」是與一個或多個異源分子綴合的抗體,包括但不限於細胞毒性劑或檢測劑。術語「檢測」旨在包括測定物質的存在或不存在或對物質的量進行定量。此術語因此指本發明的材料、組合物和方法用於定性和定量測定的用途。「個體」或「對象」是哺乳動物。哺乳動物包括,但不限於馴養動物(例如牛、綿羊、貓、狗和馬),靈長動物(例如人和非人靈長動物諸如猴),兔,和齧齒動物(例如小鼠和大鼠)。在某些實施方案中,個體或對象是人。「分離的」抗體是已經從其天然環境的組分中分離出的抗體。在一些實施方案中,將抗體純化至大於95%或99%的純度,這是如通過,例如,電泳(例如,SDS-PAGE、等電點聚焦(IEF)、毛細電泳)或色譜(例如,離子交換或反相HPLC)所測定的。對於評估抗體純度的方法的綜述,參見,例如,Flatman等人,J.Chromatogr.B848:79-87(2007)。「分離的」核酸指已經從其天然環境的組分中分離出的核酸分子。分離的核酸分子包括通常含有核酸分子的細胞中含有的核酸分子,但核酸分子存在於染色體外或與其天然染色體位置不同的染色體位置處。「編碼抗體的分離的核酸」指編碼抗體重鏈和輕鏈(或其片段)的一種或多種核酸分子,包括在單個載體或不同的載體中的(一種或多種)此類核酸分子,和存在於宿主細胞中的一個或多個位置處的(一種或多種)此類核酸分子。如本文所用的術語「單克隆抗體」指從基本均質的抗體的群體中獲得的抗體,即構成群體的單個抗體相同和/或結合相同表位,除了可能的變體抗體,例如,含有天然存在的突變或在生產單克隆抗體製劑的過程中出現,此類變體通常以少量存在。與通常包括針對不同決定簇(表位)的不同抗體的多克隆抗體製劑不同,單克隆抗體製劑的每個單克隆抗體針對抗原上的單個決定簇。因此,修飾語「單克隆」提示抗體的特徵為從基本均質的抗體群體中獲得,並且不被理解為需要通過任何特別的方法生產抗體。例如,待根據本發明使用的單克隆抗體可以通過多種技術製備,包括但不限於雜交瘤方法、重組DNA方法,噬菌體展示方法,和利用含有全部或部分人免疫球蛋白基因座的轉基因動物的方法,本文描述用於製備單克隆抗體的此類方法和其他示例性方法。「裸露的抗體」指未與異源部分(例如,細胞毒性部分)或放射標籤綴合的抗體。裸露的抗體可以存在於藥物製劑中。「天然的抗體」指具有不同結構的天然存在的免疫球蛋白分子。例如,天然IgG抗體是約150,000道爾頓的異四聚體糖蛋白,由二硫鍵結合的兩條相同的輕鏈和兩條相同的重鏈組成。從N至C端,每條重鏈具有重鏈可變區(VH),也稱為可變重鏈結構域或重鏈可變結構域,其後為三個恆定結構域(CH1、CH2,和CH3)。相似地,從N至C末端,每條輕鏈具有可變區(VL),也稱為可變輕鏈結構域或輕鏈可變結構域,其後為恆定輕鏈(CL)結構域。抗體的輕鏈可以指定為兩種類型中的一種,稱為κ和λ,基於其恆定結構域的胺基酸序列。術語「包裝說明書」用於指習慣上包括在治療產品的商業包裝中的說明,其含有關於適應症、用法、劑量、施用、組合療法、禁忌症和/或關於此類治療產品的使用的警告的信息。術語「藥物製劑」指這樣的製劑,其處於允許其中含有的活性成分的生物學活性有效的形式,並且不含有對製劑將施用的對象具有不可接受的毒性的額外組分。「可藥用的載體」指藥物製劑中的成分,其非活性成分,對於對象無毒。可藥用的載體包括,但不限於,緩衝液、賦形劑、穩定劑,或防腐劑。如本文所用,「治療(treatment)」(及其語法變化諸如「治療(treat)」或「治療(treating)」)指嘗試改變受治療的個體的自然過程的臨床幹預,並且可以用於預防或在臨床病理性的過程中進行。治療的理想的效果包括但不限於,防止疾病的發生或復發,減輕症狀,減少疾病的任何直接的或間接的病理學結果,防止轉移,降低疾病進展速度,緩和或減輕疾病狀態,和緩解或改善的預後。在一些實施方案中,本發明的抗體用於延遲疾病的發展或減緩疾病的進程。術語「可變區」或「可變結構域」指涉及抗體與抗原的結合的抗體重鏈或輕鏈結構域。天然抗體的重鏈和輕鏈的可變結構域(分別為VH和VL)大體上具有相似的結構,每個結構域包含四個保守的框架區(FR)和三個超變區(HVR)(參見,例如,Kindt等人KubyImmunology,第6版,W.H.FreemanandCo.,第91頁(2007))。單個VH或VL結構域可足以賦予抗原結合特異性。此外,結合特別抗原的抗體可以使用來自結合該抗原的抗體的VH或VL結構域分離以分別篩選互補VL或VH結構域的文庫。參見,例如,Portolano等人,J.Immunol.150:880-887(1993);Clarkson等人,Nature352:624-628(1991)。如本文所用的術語「載體」指能夠增殖與其連接的另一核酸的核酸分子。此術語包括作為自我複製性的核酸結構的載體以及併入其導入的宿主細胞的基因組中的載體。某些載體能夠指導與其有效連接的核酸的表達。此類載體在本文中稱為「表達載體」。在其他方面,根據以上實施方案中的任一種的抗體可以單獨或組合地包括如以下章節1-7中所述的任何特徵。1.抗體親和力在某些實施方案中,本文提供的抗體具有≤1μM、≤100nM、≤10nM、≤1nM、≤0.1nM、≤0.01nM、或≤0.001nM(例如10-8M或更低,例如從10-8M至10-13M,例如,從10-9M至10-13M)的解離常數(Kd)。在一個實施方案中,通過放射標記的抗原結合測定法(RIA)測量Kd,所述測定法是如以下測定法所述使用目標抗體的Fab形式及其抗原進行的。通過在未標記的抗原的滴定系列物的存在下用最低濃度的(125I)-標記的抗原平衡Fab,然後用抗Fab抗體包被的平板捕獲結合的抗原,測量Fab對抗原的溶液結合親和力(參見,例如,Chen等人,J.Mol.Biol.293:865-881(1999))。為了建立此測定法的條件,用在50mM碳酸鈉(pH9.6)中的5μg/ml的捕獲抗Fab抗體(CappelLabs)過夜包被多孔板(ThermoScientific),並隨後用PBS中的2%(w/v)牛血清白蛋白在室溫(約23℃)封閉2至5小時。在非吸收性板(Nunc#269620)中,將100pM或26pM[125I]-抗原與目標Fab的系列稀釋液混合(例如,與Presta等人,CancerRes.57:4593-4599(1997)中的抗VEGF抗體、Fab-12的評估一致)。然後過夜孵育目標Fab;然而,孵育可以繼續更長的時間(例如,約65小時)以確保達到平衡。此後,將混合物轉移到捕獲板上用於在室溫孵育(例如,1小時)。然後移除溶液並用PBS中的0.1%聚山梨醇酯20洗板8次。當板已經乾燥時,添加150μl/孔的閃爍劑(MICROSCINT-20TM;Packard),並在TOPCOUNTTMγ計數器(Packard)上對板計數10分鐘。選擇給出少於或等於20%的最大結合的每個Fab濃度用於競爭性結合測定法中。根據另一個實施方案,使用表面等離子共振測定法測量Kd,所述表面等離子共振測定法在25℃使用具有~10響應單元(RU)的固定化的抗原CM5晶片的或BIACORE(BIAcore,Inc.,Piscataway,NJ)。簡而言之,根據供應商的說明使用N-乙基-N』-(3-二甲基氨基丙基)-碳化二亞胺鹽酸鹽(EDC)和N-羥基琥珀醯亞胺(NHS)激活羧甲基化的葡聚糖生物傳感器晶片(CM5,BIACORE,Inc.)。用10mM醋酸鈉,pH4.8將抗原稀釋至5μg/ml(~0.2μM),然後以5μl/分鐘的流速注射以達到約10響應單元(RU)的偶聯的蛋白質。在注射抗原後,注射1M乙醇胺以封閉未反應的基團。對於動力學測量,在25℃以約25μl/min的流速在具有0.05%聚山梨醇酯20(TWEEN-20TM)表面活性劑的PBS(PBST)中注射Fab的2倍系列稀釋物(0.78nM至500nM)。使用簡單一對一Langmuir結合模型(simpleone-to-oneLangmuirbindingmodel)(評價軟體版本3.2)通過同時擬合締合和解離傳感圖計算締合速率(kon)和解離速率(koff)。平衡解離常數(Kd)計算為比例koff/kon。參見,例如,Chen等人,J.Mol.Biol.293:865-881(1999)。如果通過以上的表面等離子共振測定法締合速率超過106M-1s-1,則可以通過使用螢光淬滅技術測定締合速率,所述螢光淬滅技術在如分光光度計(諸如配有停留的分光光度計(AvivInstruments)或具有攪拌的比色杯的8000系列SLM-AMINCOTM分光光度計(ThermoSpectronic))測量的增加的濃度的抗原的存在下,測量25℃時PBS,pH7.2中的20nM抗-抗原抗體(Fab形式)的螢光發射強度(激發=295nm;發射=340nm,16nm帶通)的增加或降低。2.抗體片段在某些實施方案中,本文提供的抗體是抗體片段。抗體片段包括,但不限於,Fab、Fab』、Fab』-SH、F(ab』)2、Fv,和scFv片段,和下文描述的其他片段。某些抗體片段的綜述參見Hudson等人Nat.Med.9:129-134(2003)。scFv片段的綜述參見例如Pluckthün,ThePharmacologyofMonoclonalAntibodies,vol.113,Rosenburg和Moore編,(Springer-Verlag,NewYork),第269-315頁(1994);也參見WO93/16185;和美國專利號5,571,894和5,587,458。關於包含補救受體結合表位殘基和具有增加的體內半壽期的Fab和F(ab')2片段的討論,參見美國專利號5,869,046。雙抗體是具有兩個抗原結合位點的抗體片段,其可為二價的或雙特異性的。參見,例如,EP404,097;WO1993/01161;Hudson等人,Nat.Med.9:129-134(2003);和Hollinger等人,Proc.Natl.Acad.Sci.USA90:6444-6448(1993)。三鏈抗體和四鏈抗體也在Hudson等人,Nat.Med.9:129-134(2003)中描述。單結構域抗體是包含抗體的全部或部分重鏈可變結構域或全部或部分輕鏈可變結構域的抗體片段。在某些實施方案中,單結構域抗體是人單結構域抗體(Domantis,Inc.,Waltham,MA;參見,例如,美國專利號6,248,516B1)。可以通過多種技術製備抗體片段,包括但不限於完整抗體的蛋白水解消化以及通過重組宿主細胞(例如大腸桿菌或噬菌體)生產,如本文所述。3.嵌合和人源化的抗體在某些實施方案中,本文提供的抗體是嵌合抗體。例如,在美國專利號4,816,567;和Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))中描述了某些嵌合抗體。在一個實例中,嵌合抗體包含非人可變區(例如,源自小鼠、大鼠、倉鼠、兔、或非人靈長動物,諸如猴的可變區)和人恆定區。在另外的實例中,嵌合抗體是「類別交換的」抗體,其中類別或亞類已經從親本抗體的類別或亞類改變。嵌合抗體包括其抗原結合片段。在某些實施方案中,嵌合抗體是人源化的抗體。通常,非人抗體經人源化以降低對人的免疫原性,同時保持親本非人抗體的特異性和親和力。一般地,人源化的抗體包含一個或多個可變結構域,其中HVR,例如,CDR(或其部分)源自非人抗體,並且FR(或其部分)源自人抗體序列。人源化的抗體任選地也包含至少一部分人恆定區。在一些實施方案中,人源化的抗體中的一些FR殘基被來自非人抗體(例如,HVR殘基源自的抗體)的對應的殘基替換,例如,以恢復或提高抗體特異性或親和力。人源化的抗體和製備其的方法在例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008)中綜述,並在例如,Riechmann等人,Nature332:323-329(1988);Queen等人,Proc.Nat』lAcad.Sci.USA86:10029-10033(1989);美國專利號5,821,337,7,527,791,6,982,321,和7,087,409;Kashmiri等人,Methods36:25-34(2005)(描述了SDR(a-CDR)移植);Padlan,Mol.Immunol.28:489-498(1991)(描述了「表面重修」);Dall』Acqua等人,Methods36:43-60(2005)(描述了「FR改組」);和Osbourn等人,Methods36:61-68(2005)和Klimka等人,Br.J.Cancer,83:252-260(2000)(描述了FR改組的「導向選擇」方法)中進一步描述。可用於人源化的人框架區包括但不限於:使用「最適」方法選擇的框架區(參見,例如,Sims等人J.Immunol.151:2296(1993));源自特別亞組的輕鏈或重鏈可變區的人抗體的共有序列的框架區(參見,例如,Carter等人Proc.Natl.Acad.Sci.USA,89:4285(1992);和Presta等人J.Immunol.,151:2623(1993));人成熟(體細胞突變的)框架區或人種系框架區(參見,例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008));和源自篩選FR文庫的框架區(參見,例如,Baca等人,J.Biol.Chem.272:10678-10684(1997)和Rosok等人,J.Biol.Chem.271:22611-22618(1996))。4.人抗體在某些實施方案中,本文提供的抗體是人抗體。可以使用本領域已知的多種技術生產人抗體。在vanDijk和vandeWinkel,Curr.Opin.Pharmacol.5:368-74(2001)和Lonberg,Curr.Opin.Immunol.20:450-459(2008)中大體地描述了人抗體。可以通過對轉基因動物施用免疫原製備人抗體,所述轉基因動物已被修飾以應答抗原攻擊而生產完整人抗體或具有人可變區的完整抗體。此類動物通常含有人免疫球蛋白基因座的全部或一部分,其取代了內源性疫球蛋白基因座,或存在於染色體外或隨機整合到動物的染色體中。在此類轉基因小鼠中,內源性免疫球蛋白基因座通常已被失活。獲取來自轉基因動物的人抗體的方法的綜述參見Lonberg,Nat.Biotech.23:1117-1125(2005)。也參見,例如,描述了XENOMOUSETM技術的美國專利號6,075,181和6,150,584;描述了技術的美國專利號5,770,429;描述了K-M技術的美國專利號7,041,870,和描述了技術的美國專利申請公開號US2007/0061900)。來自由此類動物生成的完整抗體的人可變區可例如,通過與不同的人恆定區組合進一步修飾。也可以通過基於雜交瘤的技術生產人抗體。已經描述了用於生產人單克隆抗體的人骨髓瘤和小鼠-人雜骨髓瘤細胞系(參見,例如,KozborJ.Immunol.,133:3001(1984);Brodeur等人,MonoclonalAntibodyProductionTechniquesandApplications,第51-63頁(MarcelDekker,Inc.,NewYork,1987);和Boerner等人,J.Immunol.,147:86(1991))。經由人B細胞雜交瘤技術生成的人抗體也在Li等人,Proc.Natl.Acad.Sci.USA,103:3557-3562(2006)中描述。額外的方法包括,例如,在美國專利號7,189,826(描述了從雜交瘤細胞系生產單複製人IgM抗體)和Ni,XiandaiMianyixue,26(4):265-268(2006)(描述了人-人雜交瘤)中描述的那些。人雜交瘤技術(Trioma技術)也在Vollmers和Brandlein,HistologyandHistopathology,20(3):927-937(2005)以及Vollmers和Brandlein,MethodsandFindingsinExperimentalandClinicalPharmacology,27(3):185-91(2005)中描述。也可以通過分離選自源自人的噬菌體展示文庫的Fv克隆可變結構域序列生成人抗體。此類可變結構域序列然後可以與期望的人恆定結構域組合。下文描述了從抗體文庫選擇人抗體的技術。5.源自文庫的抗體可通過篩選組合文庫的具有期望的一種或多種活性的抗體分離本發明的抗體。例如,本領域已知用於生成噬菌體展示文庫和篩選此類文庫的具有期望的結合特徵的抗體的多種方法。此類方法在例如Hoogenboom等人MethodsinMolecularBiology178:1-37(O』Brien等人,編輯,HumanPress,Totowa,NJ,2001)中綜述並在,例如,McCafferty等人,Nature348:552-554;Clackson等人,Nature352:624-628(1991);Marks等人,J.Mol.Biol.222:581-597(1992);Marks和Bradbury,MethodsinMolecularBiology248:161-175(Lo,編輯,HumanPress,Totowa,NJ,2003);Sidhu等人,J.Mol.Biol.338(2):299-310(2004);Lee等人,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Natl.Acad.Sci.USA101(34):12467-12472(2004);和Lee等人,J.Immunol.Methods284(1-2):119-132(2004)中進一步描述。在某些噬菌體展示方法在,VH和VL基因的庫通過聚合酶鏈式反應(PCR)分別克隆並在噬菌體文庫中隨機重組,其然後可以篩選抗原結合噬菌體如Winter等人,Ann.Rev.Immunol.,12:433-455(1994)中所述。噬菌體通常展示抗體片段,作為單鏈抗體Fv(scFv)片段或作為Fab片段。來自經免疫的來源的文庫提供了對免疫原高親和力的抗體而不需要構建雜交瘤。備選地,可以克隆幼稚庫(例如,從人)以對廣泛範圍的非自身以及自身抗原提供單個來源的抗體而沒有任何免疫如Griffiths等人,EMBOJ,12:725-734(1993)所述。最後,也可以通過克隆來自幹細胞的未重排的V基因區段,並使用含有隨機序列的PCR引物以編碼高度可變的CDR3區並且實現體外重排,合成地製備幼稚文庫,如Hoogenboom和Winter,J.Mol.Biol.,227:381-388(1992)所述。描述人抗體噬菌體文庫的專利公開包括,例如:美國專利號5,750,373,和美國專利公開號2005/0079574、2005/0119455、2005/0266000、2007/0117126、2007/0160598、2007/0237764、2007/0292936,和2009/0002360。從人抗體文庫分離的抗體或抗體片段在本文被認為是人抗體或人抗體片段。6.多特異性抗體在某些實施方案中,本文提供的抗體是多特異性抗體,例如雙特異性抗體。多特異性抗體是具有對於至少兩個不同位點的結合特異性的單克隆抗體。在某些實施方案中,結合特異性之一是對於[[PRO]]而另一種是對於任何其他抗原。在某些實施方案中,雙特異性抗體可結合[[PRO]]的兩種不同表位。雙特異性抗體也可用於將細胞毒性劑定位至表達[[PRO]]的細胞。雙特異性抗體可以作為全長抗體或抗體片段製備。用於製備多特異性抗體的技術包括,但不限於,重組共表達具有不同特異性的兩條免疫球蛋白重鏈-輕鏈對(參見,Milstein和Cuello,Nature305:537(1983))、WO93/08829,和Traunecker等人,EMBOJ.10:3655(1991)),和「節入孔(knob-in-hole)」改造(參見,例如,美國專利號5,731,168)。也可以通過改造靜電轉向效應以製備抗體Fc異二聚體分子(WO2009/089004A1);交聯兩個或多個抗體或片段(參見,例如,美國專利號4,676,980,和Brennan等人,Science,229:81(1985));使用亮氨酸拉鏈生產雙特異性抗體(參見,例如,Kostelny等人,J.Immunol.,148(5):1547-1553(1992));使用用於製備雙特異性抗體片段的「雙抗體」技術(參見,例如,Hollinger等人,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993));和使用單鏈Fv(sFv)二聚體(參見,例如Gruber等人,J.Immunol.,152:5368(1994));和例如,如Tutt等人J.Immunol.147:60(1991)中所述製備三特異性抗體,來製備多特異性抗體。本文也包括具有三種或更多種功能性抗原結合位點的經改造的抗體,包括「章魚抗體」(參見,例如US2006/0025576A1)。本文的抗體或片段也包括「雙作用Fab」或「DAF」,其包含結合[[PRO]]以及另一個,不同抗原的抗原結合位點(參見,US2008/0069820,例如)。7.抗體變體在某些實施方案中,設想本文提供的抗體的胺基酸序列變體。例如,提高抗體的結合親和力和/或其他生物學性質可以是理想的。可以通過將適當的修飾引入編碼抗體的核苷酸序列,或者通過肽合成製備抗體的胺基酸序列變體。此類修飾包括,例如,在抗體的胺基酸序列內缺失,和/或插入和/或替換殘基。可以使得缺失、插入,和替換的任意組合達到最終的構建體中,前提是最終構建體擁有期望的特徵,例如,抗原結合。a)替換、插入,和缺失變體在某些實施方案中,提供了具有一個或多個胺基酸替換的抗體變體。替換誘變的目標位點包括HVR和FR。在表1中標題「保守替換」下顯示保守替換。在表1中標題「示例性替換」下提供更實質的改變,並如參考胺基酸側鏈類別在下文進一步描述的。可以將胺基酸替換引入到目標抗體中並篩選產物的期望的活性,例如,保留的/提高的抗體結合,降低的免疫原性,或提高的ADCC或CDC。表1可以根據共同的側鏈性質將胺基酸分組:(1)疏水的:正亮氨酸、Met、Ala、Val、Leu、Ile;(2)中性親水的:Cys、Ser、Thr、Asn、Gln;(3)酸性的:Asp、Glu;(4)鹼性的:His、Lys、Arg;(5)影響鏈取向的殘基:Gly、Pro;(6)芳香族:Trp、Tyr、Phe。非保守替換將使得這些類別中之一的成員與另一類別交換。一類替換變體涉及替換親本抗體(例如人源化的或人抗體)的一個或多個超變區殘基。一般而言,選擇用於進一步研究的(一種或多種)獲得的變體將在某些生物學性質(例如增加的親和力、降低的免疫原性)中相對於親本抗體具有修飾(例如提高)和/或具有基本保留的親本抗體的某些生物學性質。示例性的替換變體是親和力成熟的抗體,其可以方便地生成,例如,使用諸如那些本文描述的基於噬菌體展示的親和力成熟技術。簡而言之,突變一個或多個HVR殘基並且在噬菌體上展示變體抗體並就特別的生物學活性(例如結合親和力)進行篩選。可以在HVR中製造變異(例如,替換),例如,以提高抗體親和力。此類變異可以在HVR「熱點」,即由在體細胞成熟過程中以高頻率經歷突變的密碼子所編碼的殘基(參見,例如,Chowdhury,MethodsMol.Biol.207:179-196(2008)),和/或SDR(a-CDR)中製造,測試獲得的變體VH或VL的結合親和力。通過構建並從第二文庫重新選擇的親和力成熟已經在,例如Hoogenboom等人MethodsinMolecularBiology178:1-37(O』Brien等人,編輯,HumanPress,Totowa,NJ,(2001).)中描述。在親和力成熟的一些實施方案中,通過多種方法中的任何一種(例如,易錯PCR、鏈改組、或寡核苷酸定向誘變)將多樣性引入到選擇用於成熟的可變基因中。然後製造第二文庫。然後篩選文庫以鑑定具有期望的親和力的任何抗體變體。引入多樣性的另一種方法涉及HVR定向方法,其中隨機化若干HVR殘基(例如,一次4-6個殘基)。可以特異性地鑑定抗原結合中涉及的HVR殘基,例如使用丙氨酸掃描誘變或建模。特別地通常靶向CDR-H3和CDR-L3。在某些實施方案中,替換、插入、或缺失可以在一個或多個HVR內發生,只要此類變異不實質性地降低抗體結合抗原的能力。例如,可以在HVR中製備不實質性地降低結合親和力的保守的變異(例如,如本文提供的保守替換)。此類替換可以在HVR「熱點」或SDR之外。在以上提供的變體VH和VL序列的某些實施方案中,每個HVR或未改變,或含有不多於一個、兩個或三個胺基酸替換。鑑定可被靶向用於誘變的抗體的殘基或區域的可用的方法稱為「丙氨酸掃描誘變」,如Cunningham和Wells(1989)Science,244:1081-1085所述。在此方法中,鑑定殘基或靶殘基的組(例如,帶電的殘基諸如arg、asp、his、lys,和glu)並使用中性或帶負電的胺基酸(例如丙氨酸或多聚丙氨酸)將其取代以測定是否影響抗體與抗原的相互作用。可以在表現出對於初始替換功能性敏感的胺基酸位置處引入其他替換。備選地,或額外地,抗原抗體複合物的晶體結構鑑定抗體和抗原之間的接觸點。可以作為替換候選對象靶向或消除此類接觸殘基和相鄰殘基。可以篩選變體以測定其是否含有期望的性質。胺基酸序列插入片段包括長度範圍從一個殘基至含有100個或更多殘基的多肽的氨基或羧基末端融合物,以及單個或多個胺基酸殘基的序列內插入片段。末端插入片段的實例包括具有N末端甲硫氨醯基殘基的抗體。抗體分子的其他插入變體包括抗體的N或C末端與酶(例如ADEPT)或增加抗體的血清半壽期的多肽的融合。b)糖基化變體在某些實施方案中,本文提供的抗體被改變以增加或降低抗體被糖基化的程度。對抗體添加或刪除糖基化位點可以通過改變胺基酸序列從而使得創造或移除一個或多個糖基化位點而方便地實現。當抗體包含Fc區時,可以改變附著於其的糖。由哺乳動物細胞生產的天然抗體通常包含分支的、二天線的寡糖,所述寡糖一般通過N連接附著於Fc區的CH2結構域的Asn297。參見,例如,Wright等人TIBTECH15:26-32(1997)。寡糖可包括多種糖,例如甘露糖、N-乙醯基葡糖胺(GlcNAc)、半乳糖,和唾液酸,以及附著於二天線寡糖結構的「幹」中的GlcNAc的巖藻糖。在一些實施方案中,可以製造本發明的抗體中寡糖的修飾以創造具有某些提高的性質的抗體變體。在一個實施方案中,提供的抗體變體具有缺少(直接或間接)附著於Fc區的巖藻糖的糖結構。例如,此類抗體中巖藻糖的量可以為從1%至80%,從1%至65%,從5%至65%或從20%至40%。通過計算糖鏈內Asn297處的平均巖藻糖的量相對於如通過MALDI-TOF質譜法測量的附著於Asn297的全部糖基結構的總和(例如,複合,雜合和高甘露糖結構)測定巖藻糖的量,如WO2008/077546中所述,例如。Asn297指位於Fc區中約297位(Fc區殘基的Eu編號)的天冬醯胺殘基;然而,Asn297也可位於297位的約±3個胺基酸上遊或下遊,即位置294和300之間,由於抗體中微小的序列變異。此類巖藻糖化變體可具有提高的ADCC功能。參見,例如,美國專利公開號US2003/0157108(Presta,L.);US2004/0093621(KyowaHakkoKogyoCo.,Ltd)。涉及「去巖藻糖化的」或「巖藻糖缺陷的」抗體變體的公開的實例包括:US2003/0157108;WO2000/61739;WO2001/29246;US2003/0115614;US2002/0164328;US2004/0093621;US2004/0132140;US2004/0110704;US2004/0110282;US2004/0109865;WO2003/085119;WO2003/084570;WO2005/035586;WO2005/035778;WO2005/053742;WO2002/031140;Okazaki等人J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等人Biotech.Bioeng.87:614(2004)。能夠生產去巖藻糖化的抗體的細胞系的實例包括蛋白質巖藻糖化缺陷的Lec13CHO細胞(Ripka等人Arch.Biochem.Biophys.249:533-545(1986);US專利申請號US2003/0157108A1,Presta,L;和WO2004/056312A1,Adams等人,特別在實施例11中),和敲除細胞系,諸如α-1,6-巖藻糖轉移酶基因,FUT8,敲除CHO細胞(參見,例如,Yamane-Ohnuki等人Biotech.Bioeng.87:614(2004);Kanda,Y.等人,Biotechnol.Bioeng.,94(4):680-688(2006);和WO2003/085107)。提供的抗體變體還具有二分的寡糖,例如,其中附著於抗體Fc區的二天線寡糖被GlcNAc二分。此類抗體變體可具有降低的巖藻糖化和/或提高的ADCC功能。此類抗體變體的實例描述於例如WO2003/011878(Jean-Mairet等人);美國專利號6,602,684(Umana等人);和US2005/0123546(Umana等人)中。也提供了在附著於Fc區的寡糖中具有至少一個半乳糖殘基的抗體變體。此類抗體變體可具有提高的CDC功能。此類抗體變體描述於例如WO1997/30087(Patel等人);WO1998/58964(Raju,S.);和WO1999/22764(Raju,S.)中。c)Fc區變體在某些實施方案中,可以將一個或多個胺基酸修飾引入到本文提供的抗體的Fc區中,從而生成Fc區變體。Fc區變體可以包含人Fc區序列(例如,人IgG1、IgG2、IgG3或IgG4Fc區),所述序列在一個或多個胺基酸位置處包含胺基酸修飾(例如替換)。在某些實施方案中,本發明設想具有一些但並非全部效應子功能的抗體變體,這使得其是這樣的應用的理想的候選者,所述應用中抗體的體內半壽期是重要的然而某些效應子功能(諸如補體和ADCC)是不必要的或有害的。可以進行體外和/或體內細胞毒性測定法以確認CDC和/或ADCC活性的降低/耗盡。例如,可以進行Fc受體(FcR)結合測定法以確保抗體缺少FcR結合(因此可能缺少ADCC活性)但保留FcRn結合能力。介導ADCC的主要細胞,NK細胞,僅表達FcRIII,然而單核細胞表達FcRI、FcRII和FcRIII。造血細胞上的FcR表達在Ravetch和Kinet,Annu.Rev.Immunol.9:457-492(1991)的464頁上的表3中總結。用於評估目標分子的ADCC活性的體外測定法的非限制性實例描述於美國專利號5,500,362(參見,例如Hellstrom,I.等人Proc.Nat』lAcad.Sci.USA83:7059-7063(1986))和Hellstrom,I等人,Proc.Nat』lAcad.Sci.USA82:1499-1502(1985);5,821,337(參見Bruggemann,M.等人,J.Exp.Med.166:1351-1361(1987))中。備選地,可以採用非放射性測定法(參見,例如,流式細胞術的ACTITM非放射性細胞毒性測定法(CellTechnology,Inc.MountainView,CA;和CytoTox非放射性細胞毒性測定法(Promega,Madison,WI)。用於此類測定法的有用的效應子細胞包括外周血單核細胞(PBMC)和天然殺傷(NK)細胞。備選地,或額外地,目標分子的ADCC活性可以在體內評估,例如在動物模型中,諸如Clynes等人Proc.Nat』lAcad.Sci.USA95:652-656(1998)中公開的。也可以進行C1q結合測定法以確認抗體不能結合C1q並因此缺少CDC活性。參見,例如,WO2006/029879和WO2005/100402中的C1q和C3c結合ELISA。為了評估補體激活,可以進行CDC測定法(參見,例如,Gazzano-Santoro等人,J.Immunol.Methods202:163(1996);Cragg,M.S.等人,Blood101:1045-1052(2003);和Cragg,M.S.和M.J.Glennie,Blood103:2738-2743(2004))。FcRn結合和體內清除/半壽期測定也可以使用本領域已知的方法進行(參見,例如,Petkova,S.B.等人,Int』l.Immunol.18(12):1759-1769(2006))。具有降低的效應子功能的抗體包括在Fc區殘基238、265、269、270、297、327和329中的一個或多個具有替換的那些抗體(美國專利號6,737,056)。此類Fc突變體包括在胺基酸位置265、269、270、297和327中的兩個或多個處具有替換的Fc突變體,包括具有殘基265和297替換為丙氨酸的所謂的「DANA」Fc突變體(美國專利號7,332,581)。描述了具有提高的或減弱的與FcR結合的某些抗體變體。(參見,例如,美國專利號6,737,056;WO2004/056312,和Shields等人,J.Biol.Chem.9(2):6591-6604(2001)。)在某些實施方案中,抗體變體包含具有提高ADCC的一個或多個胺基酸替換的Fc區,例如Fc區的位置298、333,和/或334處(殘基的EU編號)的替換。在一些實施方案中,在Fc區製造改變,其導致改變的(即提高的或減弱的)C1q結合和/或補體依賴性細胞毒性(CDC),例如,如美國專利號6,194,551,WO99/51642,和Idusogie等人J.Immunol.164:4178-4184(2000)中所述。具有增加的半壽期和提高的與新生兒Fc受體(FcRn)的結合的抗體在US2005/0014934A1(Hinton等人)中描述,所述新生兒Fc受體負責母體IgG轉移至胎兒(Guyer等人,J.Immunol.117:587(1976)和Kim等人,J.Immunol.24:249(1994))。那些抗體包含其中具有提高Fc區與FcRn的結合的一個或多個替換的Fc區。此類Fc變體包括在Fc區殘基:238、256、265、272、286、303、305、307、311、312、317、340、356、360、362、376、378、380、382、413、424或434中的一個或多個處具有替換的那些,例如Fc區殘基434的替換(美國專利號7,371,826)。關於Fc區變體的其他實例也參見Duncan&Winter,Nature322:738-40(1988);美國專利號5,648,260;美國專利號5,624,821;和WO94/29351。d)半胱氨酸改造的抗體變體在某些實施方案中,創造半胱氨酸改造的抗體是理想的,例如,「thioMAb」,其中抗體的一個或多個殘基被半胱氨酸殘基替換。在特別的實施方案中,被替換的殘基存在於抗體的易接近的位點處。通過用半胱氨酸替換那些殘基,從而將反應性硫醇基團放置於抗體的可接近位點處並可用於綴合抗體與其他部分,諸如藥物部分或接頭藥物部分,以創造免疫綴合物,如本文另外所述。在某些實施方案中,以下殘基中的任何一個或多個可被半胱氨酸替換:輕鏈的V205(Kabat編號);重鏈的A118(EU編號);和重鏈Fc區的S400(EU編號)。可以如,例如美國專利號7,521,541中所述地生成半胱氨酸改造的抗體。e)抗體衍生物在某些實施方案中,還可進一步修飾本文提供的抗體以含有本領域已知的並且容易獲得的非蛋白質部分。適合於抗體的衍生化的部分包括但不限於水溶性聚合物。水溶性聚合物的非限制性實例包括,但不限於,聚乙二醇(PEG)、乙二醇/丙二醇的共聚物、羧甲基纖維素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊環、聚-1,3,6-三惡烷、乙烯/順丁烯二酸酐共聚物、聚胺基酸(同聚物或隨機共聚物),和葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、聚丙二醇同聚物、聚環氧丙烷/環氧乙烷共聚物、聚氧乙烷化多元醇(例如丙三醇)、聚乙烯醇,及其混合物。聚乙二醇丙醛可在生產中具有優勢由於其在水中的穩定性。多聚物可具有任意分子量,並且可為分支的或無分支的。附著於抗體的多聚物的數目可不同,並且如果附著多於一個多聚物,它們可以是相同或不同的分子。一般而言,用於衍生化的多聚物的數量和/或類型可以基於如下考慮確定,包括,但不限於,待改善的抗體的特別的性質或功能,抗體衍生物是否將在定義的條件下用於療法中,等。在另一個實施方案中,提供了抗體和可以通過暴露於輻射選擇性地加熱的非蛋白質部分的綴合物。在一個實施方案中,非蛋白質部分是碳納米管(Kam等人,Proc.Natl.Acad.Sci.USA102:11600-11605(2005))。輻射可以具有任何波長,並且包括,但不限於,這樣的波長,所述波長不傷害普通細胞,但將非蛋白質部分加熱至殺死抗體-非蛋白質部分臨近的細胞的溫度。重組方法和組合物可以使用重組方法和組合物生產抗體,例如,如美國專利號4,816,567中所述。在一個實施方案中,提供了編碼本文描述的抗體的分離的核酸。此類核酸可編碼包含VL的胺基酸序列和/或包含抗體的VH的胺基酸序列(例如,抗體的輕鏈和/或重鏈)。在另外的實施方案中,提供了包含此類核酸的一個或多個載體(例如,表達載體)。在另外的實施方案中,提供了包含此類核酸的宿主細胞。在一個此類實施方案中,宿主細胞包含(例如已經轉化有):(1)包含核酸的載體,所述核酸編碼包含抗體的VL的胺基酸序列和包含抗體的VH的胺基酸序列,或(2)包含編碼包含抗體的VL的胺基酸序列的核酸的第一載體和包含編碼包含抗體的VH的胺基酸序列的核酸的第二載體。在一個實施方案中,宿主細胞是真核生物,例如中國倉鼠卵巢(CHO)細胞或淋巴樣細胞(例如,Y0、NS0、Sp20細胞)。在一個實施方案中,提供了製備抗體的方法,其中所述方法包括在適於表達抗體的條件下培養如上文提供的包含編碼抗體的核酸的宿主細胞,和任選地從宿主細胞(或宿主細胞培養基)回收抗體。為了重組生產抗體,例如,如上文描述的編碼抗體的核酸被分離並插入到一個或多個載體中用於進一步克隆和/或在宿主細胞中表達。使用常規流程可容易地分離和測序此類核酸(例如,通過使用寡核苷酸探針,所述探針能夠特異性地結合編碼抗體的重鏈和輕鏈的基因)。用於編碼抗體的載體的克隆或表達的合適的宿主細胞包括本文描述的原核或真核細胞。例如,可以在細菌中生產抗體,特別是當不需要糖基化和Fc效應子功能時。對於在細菌中表達抗體片段和多肽,參見,例如,美國專利號5,648,237,5,789,199,和5,840,523(也參見Charlton,MethodsinMolecularBiology,Vol.248(B.K.C.Lo,編輯,HumanaPress,Totowa,NJ,2003),第245-254頁,描述了在大腸桿菌中表達抗體)。在表達後,抗體可以從可溶級分的細菌細胞糊中分離並可進一步純化。除了原核微生物,真核微生物諸如絲狀真菌或酵母是編碼抗體的載體的合適的克隆或表達宿主,包括其糖基化途徑已經被「人源化」,導致生產具有部分或全部人糖基化模式的抗體的真菌和酵母菌株。參見Gerngross,Nat.Biotech.22:1409-1414(2004),和Li等人,Nat.Biotech.24:210-215(2006)。適於表達糖基化的抗體的宿主細胞也源自多細胞生物(無脊椎生物和脊椎生物)。無脊椎生物細胞的實例包括植物和昆蟲細胞。已經鑑定了多種杆狀病毒株,其可以與昆蟲細胞共同使用,特別地用於轉染草地貪夜蛾(Spodopterafrugiperda)細胞。也可以使用植物細胞培養物作為宿主。參見,例如,美國專利號5,959,177,6,040,498,6,420,548,7,125,978,和6,417,429(描述了用於在轉基因植物中生產抗體的PLANTIBODIESTM技術)。也可以使用脊椎生物細胞作為宿主。例如,可以使用調整適合於懸浮生長的哺乳動物細胞系。可用的哺乳動物宿主細胞系的其他實例是被SV40轉化的猴腎CV1系(COS-7);人胚胎腎系(293或293細胞,如例如Graham等人,J.GenVirol.36:59(1977)中描述的);幼倉鼠腎細胞(BHK);小鼠支持細胞(TM4細胞,如例如,Mather,Biol.Reprod.23:243-251(1980)中描述的);猴腎細胞(CV1);非洲綠猴腎細胞(VERO-76);人宮頸癌細胞(HELA);犬腎細胞(MDCK;布法羅大鼠肝細胞(BRL3A);人肺細胞(W138);人肝細胞(HepG2);小鼠乳腺腫瘤(MMT060562);TRI細胞,如例如,Mather等人,AnnalsN.Y.Acad.Sci.383:44-68(1982)中所述;MRC5細胞;和FS4細胞。其他有用的哺乳動物宿主細胞系包括中國倉鼠卵巢(CHO)細胞,包括DHFR-CHO細胞(Urlaub等人,Proc.Natl.Acad.Sci.USA77:4216(1980));和骨髓瘤細胞系諸如Y0、NS0和Sp2/0。適於抗體生產的某些哺乳動物宿主細胞系的綜述參見,例如,Yazaki和Wu,MethodsinMolecularBiology,第248卷(B.K.C.Lo,編輯,HumanaPress,Totowa,NJ),第255-268頁(2003)。在以下實驗公開內容中,使用以下縮寫:eq(當量);M(摩爾);μM(微摩爾);N(正常);mol(摩爾);mmol(毫摩爾);μmol(微摩爾);nmol(納摩爾);g(克);mg(毫克);kg(千克);μg(微克);L(升);ml(毫升);μl(微升);cm(釐米);mm(毫米);μm(微米);nm(納米);℃.(攝氏度);h(小時);min(分鐘);sec(秒);msec(毫秒);Ci(居裡)mCi(毫居裡);μCi(微居裡);TLC(薄層層析);Ts(甲苯磺醯基);Bn(苄基);Ph(苯基);Ms(甲磺醯基);Et(乙基),Me(甲基)。實施例本發明在以下實施例中進一步詳細描述,所述實施例不以任何方式旨在限制所要求保護的本發明的範圍。所附的附圖意在被認為是本發明的說明書和描述的整體部分。本文引用的全部參考具體地作為引用全部併入本文。提供以下實施例以說明,但並非限制所要求保護的發明。本申請通過引用以整體併入本文所引述的專利申請和專利和出版物,特別地包括Hotzel等人,(2012),「AStrategyforRiskMitigationofAntibodieswithFastClearance」,mAbs4:6,1-8。實施例1測定食蟹猴中的清除此實施例說明用於測定非人靈長動物中抗體清除的標準方法。在食蟹猴中靜脈內施用單次劑量或多次劑量的治療抗體後,測定抗體藥物代謝動力學。從在多個時間點收集的血液製備血清樣品並通過ELISA測定抗體濃度。在大多數情況下ELISA由用經包被的抗原捕獲隨後用抗人Fc抗體檢測組成。抗體26的ELISA測定法採用抗個體型抗體用於捕獲。抗體14、17、24、33和44使用抗人Fc夾心ELISA用於測定血清濃度。使用非隔室分析對血清濃度對時間譜進行分析以計算總清除(Deng,R.等人Pharmacokineticsofhumanizedmonoclonalanti-tumornecrosisfactor-{alpha}antibodyanditsneonatalFcreceptorvariantsinmiceandcynomolgusmonkeys.Drugmetabolismanddisposition:thebiologicalfateofchemicals38,600-605(2010))。每種抗體測試的最高劑量時的清除報導為非特異性清除,並假定特異性清除對總清除的貢獻是可以忽略的。使用稍大於先前可用的數據集(Deng,R.等人Projectinghumanpharmacokineticsoftherapeuticantibodiesfromnonclinicaldata:Whathavewelearned?mAbs3,61-66(2011)),我們確認了在食蟹猴和人中測量的清除數值之間的強烈關聯。(圖1,Spearman關聯繫數(ρ)=0.74)。獲得簡單的縮放準則,其在於人中測量的清除比在食蟹猴中測量的清除慢約2倍,抗NRP1抗體作為異常值。實施例2測定FcRn親和力以下實施例詳述了可如何測定平衡解離常數(KD)。通過在4000儀器(GEHealthcare)上的表面等離子共振(SPR)測量測定食蟹猴FcRn與固定的抗體的結合的平衡解離常數(KD)。如先前所述製備食蟹猴FcRn(Yeung,Y.A.等人EngineeringhumanIgG1affinitytohumanneonatalFcreceptor:impactofaffinityimprovementonpharmacokineticsinprimates.JImmunol182,7663-7671(2009))。使用由生產商提供的方案,安裝、歸一化、並製備一系列S傳感器晶片用於進行水動力學研究。通過暴露於EDC/NHS溶液(0.2MN-乙基-N』-(3-二乙基氨基丙基)-碳化二亞胺(EDC)和0.05MN-羥基琥珀醯亞胺(NHS))10分鐘激活4個流動池中每一個的全部五個點用於胺偶聯。通過暴露於含有2μg/mL抗體和10mMNaOAc,pH5的溶液7分鐘將抗體偶聯至點1、2、4和5。然後通過將全部5個點暴露於1M乙醇胺7分鐘封閉未反應的位點。在此形式中點3是參照池,每個流動池偶聯4種不同抗體,每個傳感器晶片共16種。偶聯密度在200-1000RU抗體的範圍。單獨的實驗提示計算的KD在此範圍內不隨偶聯密度變化(數據未顯示)。在含有25mMMES、25mMHEPES、150mMNaCl、0.05%聚山梨醇酯-20,pH5.8的運行緩衝液中製備濃度從10μM至0.04μM以2倍增加變化的食蟹猴FcRn的一系列溶液。收集以30μL/min的流速在傳感器晶片上注射60μL這些溶液,和僅對照緩衝液的傳感圖。測量溫度是25℃,監控解離180秒並然後通過注射30μL含有50mMTris-HCl、150mMNaCl、0.05%聚山梨醇酯-20,pH8的溶液洗脫保持結合的任何FcRn。使用Biacore4000評價軟體1.0從穩態親和力分析計算解離常數。實施例3生產用於ELISA的抗原此實施例描述了生產用於包被本文描述的測定法中使用的微量滴定板的底物。通過在600ml的無血清ESF921培養基(Expressionsystems,Davis,CA)中用表達綠色螢光蛋白的重組苜蓿銀紋夜蛾核型多角體病毒(Bac-to-Bac,Invitrogen)以約1的感染複數感染1.8x109Sf9昆蟲細胞獲得杆狀病毒顆粒。在旋轉(200rpm)下在27℃孵育感染的培養物40小時,收穫並通過在5,000xg離心10分鐘移除細胞。上清中的病毒通過在4℃在25,000xg離心4小時沉澱,在PBS緩衝液(150mMNaCl,10mM磷酸鈉,pH7.4)中重懸、在4mlPBS中的35%(w/v)蔗糖墊上鋪層、並在SW40Ti離心機(Beckman)中在4℃以30,000rpm離心1小時。丟棄帶有碎片的上清,用PBS輕輕清洗病毒沉澱一次,在具有蛋白酶抑制劑混合物(Roche)的1.2mlPBS中重懸並在4℃貯藏多至4個月。從未感染的細胞獲得粗Sf9細胞膜級分。將在無血清ESF培養基中生長的共2x108個未感染的Sf9細胞在PBS中洗滌一次並在4ml冰冷裂解緩衝液(1mMEDTA,50mMHEPES緩衝液,pH7.4,完全蛋白酶抑制劑混合物)中重懸。將細胞轉移至Dounce均質器中並以寬大的杵擊打8次破碎細胞。對裂解的細胞添加含有0.5M蔗糖的額外4ml裂解緩衝液並以緊貼的杵擊打8次進一步破碎細胞。在4℃以500xg離心裂解液10分鐘以移除線粒體、細胞核和粗糙碎片。沉澱用裂解緩衝液潤洗一次並使用具有緊貼的杵的Dounce均質器在5ml相同的緩衝液中重懸。通過在4℃以500xg離心移除大碎片。實施例4ELISA測定法通過對每個孔添加25μl的50mM碳酸鈉緩衝液pH9.6中的1%杆狀病毒懸液,將抗原(例如,杆狀病毒顆粒)固定在384孔ELISA板(NuncMaxisorp)上,允許顆粒在4℃吸附於板過夜。用50μl封閉緩衝液(含有0.5%BSA的PBS)在室溫封閉孔1小時。在用PBS潤洗板三次後,在封閉緩衝液中系列稀釋純化的抗體,一式兩份地添加25μl至ELISA孔並在室溫孵育1小時。用PBS洗滌板6次並將25μl的10ng/ml與辣根過氧化物酶(Jackson)綴合的山羊抗人IgG(Fcγ片段特異性的)添加至每個孔。在室溫孵育板1小時,在PBS中洗6次並將25μlTMB底物添加至每個孔。通過將25μl的1M磷酸添加至每個孔在15分鐘後終止反應並在450nm處閱讀吸光度,參照在620nm處。從6次光密度測定的平均值計算BV分數,其中每次已經通過除以非包被的孔觀察到的平均信號歸一化。對於使用Sf9細胞膜的測定法,使用2%粗膜懸液代替杆狀病毒顆粒包被ELISA板。不在任何步驟中向緩衝液添加洗滌劑。實施例5FACS分析HEK293細胞在DMEM-10%胎牛血清中以5x106細胞/ml重懸並在U形底96孔板中以100μl/孔分配。將在PBS(150mMNaCl,10mM磷酸鈉,pH7.4)中稀釋的等體積的IgG(30至50nM終濃度)添加至細胞並在4℃孵育1h。細胞然後用冰冷的PBS洗滌3次,用抗人IgGFc-R-藻紅蛋白綴合物(JacksonImmunoresearch)或抗人IgG-Alexa488(MolecularProbes)綴合物在4℃孵育30分鐘,在冰冷的PBS中洗滌兩次並在具有0.1%多聚甲醛的PBS中固定。在具有高通量取樣器的FACSCalibur流式細胞儀(BDBiosciences)中分析細胞。實施例6統計分析使用R(RDevelopmentCoreTeam(2011).R:Alanguageandenvironmentforstatisticalcomputing.RFoundationforStatisticalComputing,Vienna,Austria.ISBN3-900051-07-0,於R-project[dot]org在線可獲得)進行全部統計分析。使用如圖5的圖例中描述的比值比,BV分數在正確鑑定快速和緩慢清除的抗體中的表現的評估是樂觀的因為其是使用用於測定BV=5的裝箱(binning)閾值的相同的數據集進行的。使用5倍交叉驗證和回歸建模以測定BV分數閾值獲得了10mL/kg/天的清除閾值的體外測定法用途的更保守的評估;此方法給出了更適度的比值比估計14.1(95%置信區間(2.4,113.3))。實施例7從猴中清除預測性縮放人清除使用稍大於先前可用的數據集8,我們確認了在食蟹猴和人中測量的清除值之間的強烈關聯(圖1,Spearman關聯繫數(ρ)=0.74)。獲得簡單的縮放準則,在於人中測量的清除比食蟹猴中測量的清除慢約2倍,抗NRP1抗體作為異常值。實施例8治療抗體組的結構變體的表徵和食蟹猴中的清除在正常的臨床前開發過程中,已經收集了52種人源化的和人抗體在食蟹猴中的藥物代謝動力學數據。這些抗體的主要的同種型是IgG1,κ(n=46)。此抗體組也包括4種IgG1,λ,和2種IgG4,κ抗體。IgG4抗體併入S228P鉸鏈穩定性替換17。對52種抗體中的5種aglycosylate以降低效應子功能,1種afucosylate以增加ADCC活性,並且3種具有Fc胺基酸替換以消除或增加FcγR結合。這些抗體的可變結構域是人源化的(n=32),源自合成的人抗體噬菌體文庫18(n=16),人的(n=3),或小鼠的(n=1;利妥昔單抗)。這些抗體顯示廣泛的清除數值(圖2),15種(29%)抗體具有快於10mL/kg/天的清除。研究了快速清除與合成的文庫抗體相關聯的假設。選擇源自合成的人抗體噬菌體文庫的抗體並通過體外選擇18優化。這些中的大多數需要通過在其互補決定區(CDR)中的胺基酸改變的親和力成熟以達到需要的親和力和效價。儘管許多人源化的抗體相對於嚙齒類序列也具有CDR替換以提高親和力或化學穩定性,一般而言已經對人源化的抗體進行更少的體外優化。體外選擇需要關注的是其可能無意地導致脫靶相互作用因為可以在體外進行的陰性選擇比可以在體內進行的更少13。然而,人源化的和合成的文庫來源的抗體的比較提示清除數值的重疊範圍(圖3)。人源化的抗體的中位清除數值是6.5mL/kg/天而來自合成的噬菌體文庫的人抗體是9.0mL/kg/天。這些數據不提供合成的文庫抗體和快速清除之間的關聯的證據(P=0.28,Wilcoxon測試)。實施例9對食蟹猴的結合親和力為了測試FcRn結合的變異是否能導致觀察到的清除數值的範圍,我們使用表面等離子共振(SPR)方法以測定pH5.8時這些抗體與純化的食蟹猴FcRn的結合的KD值。因為IgG-FcRn結合是相對弱的相互作用,我們使用先前描述的穩態方法11以測定結合常數。通過固定分析可用的每種抗體(n=44)避免來自2:1FcRn:IgG相互作用的抗體親抗原性作用。在此方式中測定的KD值範圍從約250nM至1,500nM。因為使用隨機偶聯經由氨基基團單獨固定每種抗體,以及在傳感器晶片表面上的定向中相伴的不確定性,KD值的範圍不是意外的。帕妥珠單抗的KD的多次(n=7)測定提示940±140(S.D.)nM的平均值。測量方法可以檢測FcRn親和力的改變因為我們能夠再現Fc突變體的結合作用(數據未顯示),所述Fc突變體已知增加對於FcRn的親和力19。一些抗體觀察到的較快的清除不是由於對於食蟹猴FcRn的改變的低pH結合親和力(Fig.4)。事實上,具有大約相同FcRn結合親和力的若干種抗體的比較給出了清除數值中近30倍的範圍。單獨的實驗(數據未顯示)提示pH7.4時食蟹猴FcRn從這些抗體解離的速率是快速的並且在測試的組中是等同的。儘管這些實驗不足以排除一些抗體的回收途徑的改變作為觀察到的快速清除的解釋,pH5.8時的結合親和力或中性pH時的釋放動力學中的顯著改變看起來似乎不太可能在快速清除中起主要作用。實施例10開發用於快速清除風險降低的體外測定法已經將一些抗體觀察到的快速清除與特異性14,15或非特異性13,16脫靶結合相關聯。在抗體生成和優化過程中,就缺少與緊密相關的抗原同源物的結合篩選我們的組中的大多數抗體。此外,在存在添加劑的情況下選擇經由噬菌體展示獲得的許多抗體以防止富集非特異性結合20。如Wu等人注意到的13,通過使用有限種的抗原的ELISA篩選可能無法檢測可影響體內行為的特異性或非特異性脫靶結合的種類。因此,我們尋找開發可用於鑑定可能顯示快速清除的候選抗體的體外測定法。在使用具有特異性膜結合的靶的完整BV顆粒作為ELISA測定法中的抗原21的實驗的過程中,我們注意到一些抗體結合併未表達靶的杆狀病毒顆粒。通過FACS也顯示這些抗體中的許多非特異性地結合非表達人293細胞(數據未顯示)。然而,一些同族抗原在293細胞上的表達使得區分特異性和非特異性結合是困難的。針對選自圖2的組的15種抗體的測試組的初始篩選提示在杆狀病毒(BV)ELISA中快速清除的抗體非特異性地結合。隨後,在測定法中測試45種抗體的更大的組。儘管有相當多的可變性,體外測定法中較高的分數與食蟹猴中的較快清除相關聯(圖5)。「快速」清除的>10mL/kg/天的閾值和歸一化的BV分數的>5的閾值可用於定量這些數據。10mL/kg/天的清除數值比猴中12種人IgG1抗體測定的平均值標準差(6.5±2.9)8高1。使用這些閾值,正確地鑑定了9種抗體(「真陽性」)為在猴中具有快速清除,只有僅3個「假陽性」–具有5的抗體。四種抗體是「假陰性」,具有大於10mL/kg/天的清除和<5的BV分數。剩餘的29種抗體正確鑑定為「真陰性」。儘管數據集(n=16)較小,人中增加的快速清除的風險也與高BV分數相關(圖5B;Spearmanρ=0.83)。在測定法中正確地鑑定了在人中具有快於5mL/kg/天的清除的五種抗體。值得注意的是,在食蟹猴中具有5mL/kg/天的清除,和在食蟹猴中>10mL/kg/天的一種抗體。剩餘的10種抗體被正確分類為在人中具有緩慢清除。通過進一步改造抗體47我們測試了BVELISA是否能夠預期性地用於幫助候選物選擇。這是人源化的抗體,在CDR中具有胺基酸改變,用於親和力提高和移除潛在的序列缺陷。食蟹猴是抗體47的非靶結合物種。使用抗體47未在猴中觀察到可再現的組織染色,但是測定了此抗體在食蟹猴中清除為20.2mL/kg/天。抗體47的變體(抗體47b)在BVELISA中顯示降低的結合(表2),所述變體保留了親和力成熟改變中的2個,和移除在重鏈CDR中之一中的潛在N-連接的糖基化位點的胺基酸改變。抗體47c僅保留了移除潛在的N-連接的糖基化位點的胺基酸改變並也具有降低的BV結合。單獨的實驗提示移除潛在Asp-Gly異構化位點的VL-D27cS改變對抗體47的BV結合有大貢獻。抗體47b和47c在食蟹猴中具有相對抗體47更慢的清除(表2)。實施例11對此組抗體測量的食蟹猴中的清除數值的廣泛分布,和15種抗體觀察到的較快清除(>10mL/kg/天)是出乎意料的。因為52種抗體中的40種具有相同的人IgG1Fc序列,預期較快的清除不與FcRn相互作用的改變相關聯。事實上,儘管在pH5.8測量的FcRn結合的KD在7倍範圍中變化,這不與清除數值中的趨勢相關聯。考慮到pH5.8FcRn親和力的相對大的增加導致清除的適度提高19,此處測定的FcRn親和力中的小差別對清除沒有影響不是令人驚訝的。測試的全部抗體在中性pH時顯示等同的並且快速的從FcRn釋放。與由Wang等人22報告的結果相反,我們並未檢測到清除和中性pH時抗體的Fab部分對FcRn釋放動力學的影響之間的關聯。我們的研究使用較大組抗體和不同取向的SPR實驗以最小化抗體親抗原性對結合的影響。考慮到我們的組中的抗體之間最大的差異在可變結構域中,並且特別地在CDR中,可能這些結構域的組成的差異對清除行為中的變異性有貢獻。其他組已經觀察到了與CDR序列中的改變相關聯的對清除的影響,所述改變不與對靶抗原13、16的結合親和力的差異相關。我們並未發現清除與等電點(pI)或完整抗體的疏水性相關。Igawa等人23先前已經顯示食蟹猴中的人IgG1抗體的清除可以通過導致較低的pI的可變結構域中的改變降低。此作用在這樣的劑量下觀察到,在所述劑量下進行顯著的抗原依賴性清除。假定機制為非FcRn依賴性的。對於大組抗體的比較,使用在半壽期是FcRn依賴性的劑量時收集到的藥物代謝動力學數據,清除率不依賴於pI。對於此結論的提醒是此分析中多數抗體聚簇在相對狹窄的pI值範圍(7.5-9.5)因此也許將觀察到趨勢如果測試更寬的pI範圍。此外,我們發現清除不與抗體Fv計算的總電荷相關聯。因此,導致快速清除的抗體物理化學性質不能從單獨的序列比較簡單地識別並且可需要更多細節的結構功能分析。我們在這裡顯示了可以用於鑑定在人和食蟹猴中具有增加的快速清除的風險的抗體的簡單非特異性結合測定法。該測定法,基於抗體與從杆狀病毒感染的昆蟲細胞製備的病毒顆粒的結合,採用簡單的ELISA形式並且可以以高通量形式應用。因為在哺乳動物物種中測定藥物代謝動力學數據,基於與哺乳動物細胞非特異性結合的測定法可能預期顯示與快速清除的更強的關聯。初步結果提示快速清除和由FACS檢測到的與人293細胞非特異性結合之間的關聯,但排除了此測定法廣泛的應用因為此抗體集合的許多同族抗原在293細胞上表達。我們開發的BLELISA測定法不受此靶表達限制。對於使用兩種測定法都能夠評估的抗體,觀察到了非特異性結合中的相似的趨勢(數據未顯示)。芽殖杆狀病毒病毒體是模擬被感染的細胞表面的穩定的納米顆粒,呈現磷脂、糖、糖蛋白、胞外基質和核酸以及病毒衣殼的混合物24,25。假定抗原也含有包括蛋白質、膜和核酸的一些昆蟲細胞碎片。缺乏治療抗體的特異性靶同時保留與人細胞和組織相同的整體生物化學複雜性的此類混合物在非特異性結合測定法中有優勢,因為其可檢測不同抗體中的不同種類的相互作用,例如靜電對疏水相互作用。對於食蟹猴中的抗體清除和與BV顆粒結合的關聯的重要提醒是,除了對於抗體47外,其是基於通過正常臨床前發展,而非其中BV顆粒結合系統性變化的設計的實驗收集到的數據的觀察。從具有廣泛不同的劑量水平並且使用不同的PK測定法類型的單獨的研究中獲得清除數值。然而,當可獲得充足數據用於進行評價時,發現食蟹猴中的快速清除和BV結合之間的關聯跨越劑量水平、測定法類型和抗體來源和靶類型存在。可以通過使用測定法以最小化在抗體的改造過程中非特異性結合的引入降低快速清除的風險。在抗體47中,電荷減少和增加的疏水性與增加的與BV顆粒的非特異性結合相關。具有降低的非特異性結合的變體具有較慢的清除。不預期BVELISA是特異性脫靶作用的可靠的測定法。例如,先前顯示由於與補體蛋白非計劃的特異性結合而在小鼠中具有快速清除的人源化的抗體14與BV顆粒不具有可檢測的結合(未顯示)。以我們的經驗,特異性脫靶作用不如具有更廣泛的脫靶結合的抗體普遍。此外,特異性脫靶作用通常可以通過快速清除的機制研究鑑定。BV顆粒ELISA檢測大多數但並不是全部的在食蟹猴中快速清除的抗體,有少數假陽性。因此,測定法應當被認為是降低需要在NHPPK實驗中測試的治療抗體數目的篩選工具而不是一致地預測食蟹猴中的清除的測定法。當可以獲得具有相似的針對靶的效價的多種候選者時,使得少數但非零的假陽性率是可以接受的,此測定法是最小化快速清除風險的有成本效益的工具。能夠增強BVELISA測定法如果能夠鑑定假陰性結果的基礎。相對於來自哺乳動物細胞的膜,昆蟲細胞膜的磷脂組成富含磷脂醯肌醇、磷脂醯膽鹼,和磷脂醯乙醇胺,具有較低水平的酸性磷脂磷脂醯絲氨酸、膽固醇、鞘糖脂和鞘脂24。較高量的中性磷脂可導致測定法中的假陰性如果這些抗體的較快的清除與結合哺乳動物膜上的酸性磷脂相關。4個假陰性抗體中的兩個的Fv結構域計算具有高淨負電荷。探索BV顆粒的磷脂組成是否能夠通過生長條件或細胞系差異操縱同時提高非特異性結合測定法的精確性是感興趣的。這些研究能夠進一步闡明應在抗體改造過程中避免的特徵以保持可接受的藥物代謝動力學行為。實施例12抗體清除優化在該實施例中我們測試了BVELISA是否能夠通過進一步改造預測性地用於幫助候選物選擇。抗體47是人源化的抗體,在CDR中具有胺基酸改變,用於親和力提高和移除潛在的序列缺陷。食蟹猴是抗體47的非靶結合物種。使用抗體47在猴中沒有觀察到可再現的組織染色,但測定了此抗體在食蟹猴中的清除為20.2mL/kg/天。保留了親和力成熟改變中的2個,和移除在重鏈CDR中之一中的潛在N-連接的糖基化位點的胺基酸改變的抗體47的變體(抗體47b)在BVELISA中顯示降低的結合(表1)。抗體47c僅保留了移除潛在的N-連接的糖基化位點的胺基酸改變並也具有降低的BV結合。單獨的實驗提示移除潛在Asp-Gly異構化位點的改變對抗體47的BV結合有大貢獻。抗體47b和47c在食蟹猴中具有相對抗體47更慢的清除(表1)。因此,此測定法可以用作清除的快速評估並幫助開發相對於親本抗體具有更低的清除的臨床相關的抗體。引用文獻1.Reichert,J.M.Marketedtherapeuticantibodiescompendium.mAbs4(2012).2.Wang,W.,Wang,E.Q.&Balthasar,J.P.Monoclonalantibodypharmacokineticsandpharmacodynamics.Clinicalpharmacologyandtherapeutics84,548-558(2008).3.Tabrizi,M.A.,Tseng,C.M.&Roskos,L.K.Eliminationmechanismsoftherapeuticmonoclonalantibodies.Drugdiscoverytoday11,81-88(2006).4.Mager,D.E.Target-mediateddrugdispositionanddynamics.Biochemicalpharmacology72,1-10(2006).5.Mould,D.R.&Green,B.PharmacokineticsandPharmacodynamicsofMonoclonalAntibodies:ConceptsandLessonsforDrugDevelopment.Biodrugs24,23-39(2010).6.Kuo,T.T.&Aveson,V.G.NeonatalFcreceptorandIgG-basedtherapeutics.mAbs3,422-430(2011).7.Keizer,R.J.,Huitema,A.D.R.,Schellens,J.H.M.,Beijnen,J.H.ClinicalPharmacokineticsofTherapeuticMonoclonalAntibodies.ClinicalPharmacokinetics49,493-507(2010).8.Deng,R.等人.Projectinghumanpharmacokineticsoftherapeuticantibodiesfromnonclinicaldata:Whathavewelearned?mAbs3,61-66(2011).9.Dall'Acqua,W.F.,Kiener,P.A.&Wu,H.PropertiesofhumanIgG1sengineeredforenhancedbindingtotheneonatalFcreceptor(FcRn).TheJournalofbiologicalchemistry281,23514-23524(2006).10.Hinton,P.R.等人.AnEngineeredHumanIgG1AntibodywithLongerSerumHalf-Life.JImmunol176,346-356(2006).11.Yeung,Y.A.等人.EngineeringhumanIgG1affinitytohumanneonatalFcreceptor:impactofaffinityimprovementonpharmacokineticsinprimates.JImmunol182,7663-7671(2009).12.Zalevsky,J.等人.Enhancedantibodyhalf-lifeimprovesinvivoactivity.Naturebiotechnology28,157-159(2010).13.Wu,H.等人.Developmentofmotavizumab,anultra-potentantibodyforthepreventionofrespiratorysyncytialvirusinfectionintheupperandlowerrespiratorytract.Journalofmolecularbiology368,652-665(2007).14.Bumbaca,D.等人.Highlyspecificoff-targetbindingidentifiedandeliminatedduringthehumanizationofanantibodyagainstFGFreceptor4.mAbs3,376-386(2011).15.Vugmeyster,Y.等人.Complexpharmacokineticsofahumanizedantibodyagainsthumanamyloidbetapeptide,anti-abetaAb2,innonclinicalspecies.Pharmaceuticalresearch28,1696-1706(2011).16.Vugmeyster,Y.等人.Invitropotency,pharmacokineticprofilesandphamacologicalactivityofoptimizedanti-IL-21Rantibodiesinamousemodeloflupus.mAbs2,335-346(2010).17.Angal,S.等人.Asingleaminoacidsubstitutionabolishestheheterogeneityofchimericmouse/human(IgG4)antibody.Molecularimmunology30,105-108(1993).18.Lee,C.V.等人.High-affinityhumanantibodiesfromphage-displayedsyntheticFablibrarieswithasingleframeworkscaffold.Journalofmolecularbiology340,1073-1093(2004).19.Yeung,Y.A.等人.Atherapeuticanti-VEGFantibodywithincreasedpotencyindependentofpharmacokinetichalf-life.Cancerresearch70,3269-3277(2010).20.Dennis,M.S.&Lowman,H.B.inPhageDisplay,Vol.266.(eds.T.Clackson&H.B.Lowman)61-94(OxfordUniversityPress,Oxford,UK;2004).21.Hotzel,I.等人.Efficientproductionofantibodiesagainstamammalianintegralmembraneproteinbyphagedisplay.Proteinengineering,design&selection:PEDS24,679-689(2011).22.Wang,W.等人.MonoclonalantibodieswithidenticalFcsequencescanbindtoFcRndifferentiallywithpharmacokineticconsequences.Drugmetabolismanddisposition:thebiologicalfateofchemicals39,1469-1477(2011).23.Igawa,T.等人.ReducedeliminationofIgGantibodiesbyengineeringthevariableregion.Proteinengineering,design&selection:PEDS23,385-392(2010).24.Marheineke,K.LipidCompositionofSpodopterafrugiperda(Sf9)andTrichplusiani(Tn)insectcellsusedforbaculovirusinfection.FEBSLetters441,4(1998).25.Wang,R.等人.ProteomicsoftheAutographacalifornicanucleopolyhedrovirusbuddedvirions.Journalofvirology84,7233-7242(2010).26.Deng,R.等人.Pharmacokineticsofhumanizedmonoclonalanti-tumornecrosisfactor-{alpha}antibodyanditsneonatalFcreceptorvariantsinmiceandcynomolgusmonkeys.Drugmetabolismanddisposition:thebiologicalfateofchemicals38,600-605(2010).27.Stone,M.Cross-validatorychoiceandassessmentofstatisticalpredictions.JournaloftheRoyalStatisticalSocietySer.B36,111-147(1974).28.Geisser,S.ThepredictivesamplereusemethodwithapplicationsI.Amer.Stat.Assoc.70,320-328(1975).
