受體靶向構造物和其使用的製作方法
2023-05-12 00:43:31 6
本申請請求Lali K.MEDINA-KAUWE等人於2014年1月17日提交的且名稱為「c-MET TARGETING CONSTRUCT AND USES THEREOF」的美國臨時申請系列號61/928,903,該專利的全部公開內容(包括附圖)以引用的方式併入本文。
政府權利
本文公開的主題是在國家健康研究所/國家癌症研究所授予的基金CA140995和CA129822下由政府支助所進行。政府對所公開主題具有某些權利。
發明領域
本發明涉及生物技術的領域。特定而言,本發明涉及將治療劑遞送至靶細胞(諸如癌細胞)的組合物。
發明背景
抵抗臨床中所用的當前靶向治療或獲得對該其靶向治療的耐受性的許多腫瘤顯示出蛋白質(諸如c-Met)的表面水平升高。例如,肺癌獲得對EGF-R抑制劑(諸如Tarceva)的耐受性。諸如Tarceva之類抑制劑旨在阻斷受體酪氨酸激酶的活性(稱為酪氨酸激酶抑制劑,或TKI's),但大多數情況對TK抑制不響應。這些腫瘤的特徵在於細胞表面蛋白質(諸如c-Met)水平升高,並且因此變成用於本文所述治療方法的極好候選者,該方法可靶向過表達蛋白質並且滲透腫瘤細胞。
本領域中,目前正試圖研發出旨在阻斷通過c-Met的信號的c-Met抗體或抑制劑。然而,過往歷史表明大多數情況將對信號阻斷抗體或小分子無響應,因為該腫瘤採用替代性方式來連續增生,而不論信號抑制如何。
本文所述組合物規避了使用細胞表面受體(例如c-Met)作為入口來將毒性分子遞送至腫瘤細胞中並且從內部殺死腫瘤以便阻斷信號的需要。配體導向遞送允許靶向結合至對特定細胞表面受體(例如c-Met)呈陽性的腫瘤,並且遞送分子中的膜滲透結構域允許在細胞表面受體介導的胞吞作用之後跨體內膜進行滲透和溶解。遞送蛋白經改性以通過(例如)離子相互作用來與某些治療性分子組裝並且運送所述某些治療性分子。
發明概述
本文公開的是藥物遞送分子,其包括:配體,其靶向細胞表面分子;膜滲透結構域;和有效負載結合結構域;以及包含所述藥物遞送分子的藥物組合物。還公開了在有需要的受試者中治療癌症、抑制癌症的進展、預防癌症轉移、和向腦部遞送治療性化合物,所述方法包括:鑑別需要該方法的受試者;提供包含本文公開的藥物遞送分子的組合物;以及向受試者施用有效量的所述組合物。
附圖簡述
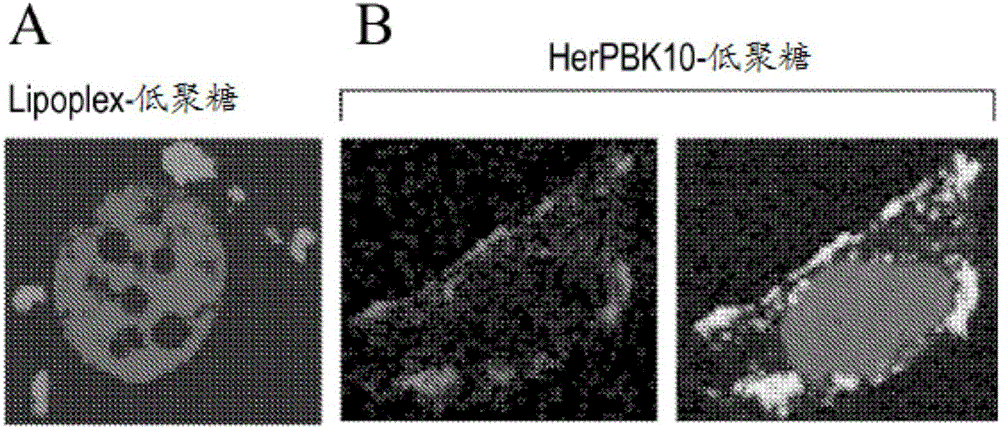
圖1示出使用作為對照物的Lipofectamine(圖1A)以及HerPBK10(圖1B)來攝取單鏈低聚核苷酸的結果。
圖2示出PBK10可遞送編碼GFP的合成mRNA。圖2A提供本實驗中所用的mRNA的概要。圖2B示出來自由Lipofectin遞送的mRNA(右)和與其比較的由Lipofectin遞送的GFP表達質粒(左)的GFP表達。圖2C是PBK10-mRNA複合物的示意圖。圖2D示出用於PBK10-mRNA複合物的細胞結合數據。圖2E示出細胞結合複合物的攝取的結果。圖2F示出GFP表達的結果的圖像,而圖2G以圖表形式描繪相同數據。
圖3是以下的示意圖:(A)Inlb321,其涵蓋用於c-MET受體結合的最小結構域;(B)InlB321,其結合至c-MET的胞外結構域。
圖4是示出重組基因構造物被組裝以編碼新融合蛋白(InlB-PBK10)的示意圖。A.pRSET-InlB-PBK10的構造。B.pRSET-GFP-InlB的構造。C.通過限制性消化證實克隆插入物。
圖5是Western印跡的結果,其表明在細菌中產生了重組蛋白InlB、InlB-PBK10和GFP-InlB。
圖6是示出在不同腫瘤和非腫瘤細胞系之間c-MET的表面水平變化的圖表。示出了通過以96孔格式執行的細胞表面ELISA來測得的在非透化細胞表面上的相對受體水平。ELISA結果表明H1993(肺癌細胞系)和MDA-MB-231(乳腺癌細胞系)是具有c-MET的最高細胞表面水平的細胞。RANKL(前列腺癌細胞系)和MDA-MB-435(乳腺癌細胞系)顯示中等水平,而LN-GFP(前列腺癌細胞系)和Cos-7(非洲綠猴腎成纖維細胞)顯示細胞表面c-MET的較低水平。
圖7示出實驗結果,該結果表明InlB衍生肽識別出c-MET。A.InlB321肽展示出對c-MET陽性(而不是低c-MET)細胞的優先結合。使用螢光激化細胞分選(FACS)來測量結合至c-MET陽性細胞的InlB(由免疫螢光識別)的相對水平。FACS數據示出與低c-MET細胞(LN GFP)相比,結合至高c-MET細胞(H1993)的InlB的水平相對更高。B.通過競爭性抑制證實c-MET結合。當在結合至細胞之前,採用來源於c-MET(MET)的胞外配體結合結構域的可溶解肽來預培育游離InlB時,可抑制InlB向H1993結合。InlB和MET在1:1摩爾比率(MET:InlB)下培育,如果InlB對MET具有特異性,則預測受體結合降低50%。C.通過InlB-PBK10的細胞結合與c-MET水平成比例。InlB-PBK10表明:如通過細胞表面ELISA所測量,與表達相對低c-MET水平的細胞(Cos-7)相比,具有更高c-MET細胞表面表達的細胞(MDA-MB-231)的結合水平更高。D.通過競爭性配體抑制對c-MET+細胞的結合。當濃度增加的InlB被預結合至細胞時,在添加InlB-PBK10之前,經1h在冰上使濃度逐步升高的游離InlB配體預結合至MDA-MB-231細胞。E.InlB-PBK10在混懸液中經歷向c-MET+細胞的受體特異性結合。混懸液中的MDA-MB-435細胞用濃度增加的游離InlB配體來培育,並且在移除未結合InlB之後,用InlB-PBK10培育細胞。選擇游離InlB配體的濃度,以使得InlB-PBK10與InlB的摩爾比率為1:1、1:5和1:10。執行Western印跡以測量與細胞團塊共沉澱的相對InlB-PBK10水平。免疫印跡條帶的密度計測量表明,InlB-PBK10結合的水平隨InlB的濃度增加而降低,這與向c-MET結合的InlB-PBK10相一致。
圖8示出InlB-PBK10內化入c-MET+細胞中。
圖9示出InlB-PBK10可向c-MET+細胞遞送毒性分子。A.製備InlB-PBK10-Ga顆粒。示意圖示出在將InlB-PBK10與Ga-咔咯(Ga-corrole)混合以促進非共價組裝之後通過超濾作用分離顆粒的程序。B.InlB-PBK10-Ga顆粒的DLS。C.InlB-PBK10介導咔咯(corrole)有效負載的細胞溶質入口。D.I-Dox降低c-MET陽性腫瘤細胞的存活率。E.游離InlB抑制I-Dox毒性。
圖10示出在攜帶皮下雙側脅腹MDA-MB-435腫瘤的nu/nu小鼠中全身性(尾靜脈)遞送之後,InlB-PBK10的生物分布的Xenogen Spectum圖像。A.在尾靜脈注射之後所示時間點處的整個小鼠的圖像。藍色箭頭指向腎。白色箭頭指向腫瘤。B.從4h時間點之後處死的相同小鼠中收穫的腫瘤和組織的圖像。
圖11描繪HerMn的組裝。A.HerPBK10蛋白的示意圖,突出顯示了功能域。B.Mn-咔咯的化學結構(S2Mn)。C非共價組裝的示意圖。D.溶液中HerMn顆粒的TEM(插入物)和動態光散射(DSL)測量。
圖12是一組圖表,其示出HerPBK10結合至HER3並且未受患者血清抑制。A.對HerPBK10結合至固定化HER3(人類ErbB3胞外結構域;Prospec)的ELISA-/+用可溶解HER3肽作為競爭性抑制劑(HER3阻斷)來預培育。Un∶無HerPBK10。B.對HerPBK10結合至HER2+細胞的ELISA-/+用1x和10x摩爾比率的可溶解HER3肽、可溶解HER4肽(ERBB4肽,Abnova)、β細胞素(10μg/mL)、或帕妥珠單抗(Pz)作為競爭性抑制劑進行預培育。C.在來自5位HER2+患者和年齡匹配對照物(HER2-)的血清中,對HerPBK10結合到HER2+(MDA-MB-435)細胞的ELISA。對照樣品在牛血清中結合,並且通過與重組體heregulin配體(+Her)的競爭性抑制進行受體結合檢驗。N=3.*,p<0.05,與對照物相比(-Her:無競爭性抑制劑)。
圖13示出HerPBK10結合至小鼠HER3的結果。A.人類和小鼠HER3的結構域I-II(aa 20-239,heregulin結合結構域)的胺基酸序列比對。藍色殘基指示胺基酸差異。B.使用與人類和小鼠HER3交叉反應的抗HER3抗體(1B2E;細胞信號技術)通過ELISA(無透化作用)檢測的相對HER3水平。C.HerPBK10向4T1小鼠乳房腫瘤細胞的結合。N=3.*,p<0.05,與單獨HerPBK10相比
圖14是示出HerMn毒性對人類HER2+和HER2-腫瘤細胞的數據的圖表。
圖15是示出HerMn細胞毒性的機制的圖片。A.共焦螢光圖像,示出通過MDA-MB-435細胞中的HerMn使線粒體膜電勢降低。B.共焦螢光圖像,通過HerMn示出肌動蛋白(紅色)和微管蛋白(綠色)的超氧化物介導瓦解。
圖16示出S2Ga與TSPO相互作用的數據。A-B.通過測量吸光率和螢光光譜,針對TSPO結合咔咯的存在,評估滲餘物。C-D.HerGa與TSPO原位相互作用的證據。當積累到線粒體中時,C中所用的綠色螢光JC-1染料發紅色螢光。D是對C中紅色螢光的定量。*,p<0.05。
圖17示出荷瘤小鼠中的生物分布。在尾靜脈注射之後對Alexa680標記HerMn、曲妥單抗(Tz)和BSA(12nmol ea)進行Xenogen成像和定量。圖表平均螢光-/+SEM。
圖18示出HerMn的治療效力的數據。A.雌性裸小鼠中的HER2+MDA-MB-435腫瘤生長,該雌性裸小鼠接受HerMn或S2Mn的每日IV(經由尾靜脈)注射(5nmole咔咯/注射),每日一次,持續6個連續日。對照組接受與HerMn等同濃度的鹽水或HerPBK10。治療在約200mm3平均腫瘤體積時開始。在試劑注射之前(第1天),在試劑注射期間(第3天),以及在試劑注射之後(第8天、第15天和第22天),測量腫瘤體積。N=8-10腫瘤/組。*p<0.05(單向ANOVA)。B.在持續2天(實線)或5天(虛線)暴露於HerMn、S2Mn、HerPBK10、或阿黴素(Dox)期間,人類CDC生活力。N=3per conc,來自3次單獨實驗
圖19示出在無腫瘤的小鼠中HerPBK10的組織分布。
實施方案的詳述
定義∶
為了方便起見,在此收集了在說明書、實施例和附加權利要求書中採用的某些術語。除非另行指出或從上下文暗示,下列術語和短語包括下面提供的含義。除非另外明確說明或從上下文明顯可見,以下術語和短語不排除術語或短語在其所述的領域獲取的含義。提供定義是為了有助於描述特定實施方案,並且不旨在限制要求保護的發明,因為本發明的範圍僅受權利要求書限制。除非另外定義,否則本文中所用的所有技術和科學術語均具有與本發明所屬領域一般技術人員通常所理解含義相同的含義。
「有益的結果」可以包括,但決不限於,減輕或緩和該疾病狀態的嚴重程度、預防該疾病狀態惡化、治癒該述疾病狀態、預防該疾病狀態發展、降低患者發展該疾病狀態的機率以及延長患者壽命或預期壽命。在一個實施方案中,疾病狀態是癌症。在一些實施方案中,疾病狀態為自身免疫疾病。
「癌症」和「癌性」是指或描述哺乳動物的特徵通常在於細胞生長不受調控的生理病狀。癌症的實例包括但不限於:白血病、骨髓瘤、B細胞淋巴瘤(霍奇金淋巴瘤和/或非霍奇金淋巴瘤)、腦癌、乳腺癌、結腸直腸癌、肺癌、肝細胞癌、腎癌、胃癌、胰癌、宮頸癌、卵巢癌、肝癌、膀胱癌、尿道癌、甲狀腺癌、腎臟癌、癌腫、黑素瘤、頭頸癌、腦癌、前列腺癌、雄激素依賴性前列腺癌、和雄激素非依賴性前列腺癌。
如本文所用的「化學治療藥物」或「化學治療劑」是指用於治療癌症的藥物,所述藥物包括但不限於:白蛋白結合紫杉醇(nab-紫杉醇)、放線菌素、阿利類視色素(Alitretinoin)、全反式視黃酸、阿扎胞苷、硫唑嘌呤、貝伐珠單抗、貝沙羅汀(Bexatotene)、博萊黴素、硼替佐米、卡鉑、卡培他濱、西妥昔單抗、順鉑、苯丁酸氮芥、環磷醯胺、阿糖胞苷、柔紅黴素、多西他賽、去氧氟尿苷、阿黴素、表柔比星、埃博黴素、埃羅替尼、依託泊苷、氟尿嘧啶、吉非替尼、吉西他濱、羥基脲、伊達比星、伊馬替尼、易普利單抗(Ipilimumab)、伊立替康、氮芥、美法侖、巰基嘌呤、甲氨蝶呤、米託蒽醌、阿侖單抗(Ocrelizumab)、奧法木單抗、奧沙利鉑、紫杉醇、帕尼妥單抗(Panitumab)、培美曲塞、利妥昔單抗、他氟泊苷(Tafluposide)、替尼泊苷、硫鳥嘌呤、託泊替康、類視色素、戊柔比星、威羅菲尼、長春花鹼、長春新鹼、長春地辛、長春瑞濱、伏立諾他、羅米地辛、5-氟尿嘧啶(5-FU)、6-巰基嘌呤(6-MP)、克拉屈濱、氯法拉濱、氟尿苷、氟達拉濱、噴司他丁、絲裂黴素、伊沙匹隆、雌莫司汀或其組合。
「受試者」或「個體」或「動物」或「患者」或「哺乳動物」意指任何受試者,具體是哺乳動物受試者,希望對它們進行診斷、預後或治療。在一些實施方案中,受試者患有癌症。在一些實施方案中,受試者受試者在該受試者壽命中某一時間點患有癌症。在各種實施方案中,受試者的癌症處於緩解期,是復發的或是非復發的。
如本文所用"哺乳動物"是指哺乳綱的任何成員,其包括但不限於:人類,家畜,農場動物,動物園動物,運動會動物,寵物動物,諸如狗、貓、豚鼠、兔子,大鼠,小鼠,馬,牛,奶牛;靈長類動物,諸如類人猿、猴子、猩猩和黑猩猩;犬科動物,諸如狗和狼;貓科動物,諸如貓、獅子、和老虎;馬科動物,諸如馬、驢和斑馬;食品動物,諸如奶牛、豬和羊;有蹄類動物,諸如鹿和長頸鹿;齧齒動物,諸如小鼠、大鼠、倉鼠和豚鼠;等等。在某些實施方案中,哺乳動物為人類受試者。所述術語不指示特定年齡或性別。因此,成年和新生受試者以及胎兒無論雄性或雌性都意欲包括在這個術語的範圍內。
如本文所用的「治療(Treatment/treating/therapy)」或「治療性(therapeutic)是指治療性治療和預防性或防止性措施,其中目的是預防或減緩(減輕)針對的病理性病狀、預防該病理性病狀、追求或獲得有益的結果或降低個體發展所述病狀的機率,即使治療最終不成功。需要治療的對象包括已經患有病狀的對象,以及易患所述病狀的對象或要預防所述病狀的對象。具體的程序或施用被認為是治療性的,即便在施用之後受試者未感覺更佳。因此,認為受試者疾病狀態的任何改善、或疾病進展的任何減緩是治療性的。癌症治療的實例包括但不限於:主動監測,觀察,手術介入,化學療法,免疫療法,輻射療法(諸如外線束輻射,立體定位輻射手術(伽馬刀),和分次立體定向輻射治療(FSR)),局部療法,全身性療法,疫苗療法,病毒療法,分子靶向療法,或其組合。
如本文所用的「腫瘤」是指所有贅生性細胞生長和增殖(無論惡性或良性)以及所有癌前和癌性細胞和組織。
如本文所用的「治療劑」是指用於(例如)治療、抑制、預防、減輕疾病的影響,降低疾病的嚴重程度,降低疾病發展的可能性,減緩疾病進展和/或治癒疾病的藥劑。治療劑靶向的疾病包括但不限於:癌腫、肉瘤、淋巴瘤、白血病、生殖細胞腫瘤、胚細胞瘤各種免疫者細胞上表達的抗原以及在與各種血液疾病、自身免疫疾病和/或炎性疾病相關的細胞上表達的抗原。
在本公開的背景下,「約」某一值意指本公開涵蓋所列值±25%,或者所列值±15%,或者所列值±10%,或者所列值±5%。因此,例如,「約50個胺基酸」意指50±25%胺基酸(即,37至63個胺基酸的範圍),或者50±15%胺基酸(即,42至58個胺基酸的範圍),或者50±10%胺基酸(即,45至55個胺基酸的範圍),或者50±5%胺基酸(即,47至53個胺基酸的範圍)。
藥物遞送分子
本文所述的是藥物遞送分子。藥物遞送分子包括靶向細胞表面分子、膜滲透結構域和有效負載結合結構域的配體。藥物遞送分子中的配體將分子遞送至靶細胞,諸如癌細胞。膜滲透結構域介導靶細胞的細胞溶質滲透。有效負載結合結構域形成具有治療劑的複合物。在具有治療性分子的複合物中的藥物遞送分子將治療劑遞送至靶細胞,諸如癌細胞。在各種實施方案中,所述癌細胞以下中的任何一種或多種:白血病、骨髓瘤、B細胞淋巴瘤(霍奇金淋巴瘤和/或非霍奇金淋巴瘤)、腦癌、乳腺癌、結腸直腸癌、肺癌、肝細胞癌、腎癌、胃癌、胰癌、宮頸癌、卵巢癌、肝癌、膀胱癌、尿道癌、甲狀腺癌、腎臟癌、癌腫、黑素瘤、頭頸癌、腦癌、前列腺癌、雄激素依賴性前列腺癌、和雄激素非依賴性前列腺癌。
在一些實施方案中,由此公開的藥物遞送分子形成直徑為約5nm至約50nm的納米顆粒。在一些實施方案中,納米顆粒患有約10至約30nm的大小。有效負載(即,治療劑)隨後結合至該納米顆粒。在一個實施方案中,納米顆粒包含金屬化咔咯,例如錳(Mn)、鐵(Fe)、或鎵(Ga)咔咯。在其他實施方案中,納米顆粒包含蛋白質或蛋白質片段。在一些實施方案中,治療劑向納米顆粒的結合是通過選自由以下組成的組的方法進行:靜電相互作用、疏水性相互作用、親水性相互作用、氫鍵以及共價鍵。一旦納米顆粒治療劑組合進入細胞,則納米顆粒與治療劑之間的結合斷裂,這要麼是因為該細胞破壞納米顆粒與治療劑的締合,要麼是因為這兩者間的共價鍵被酶水解。
在一些實施方案中,細胞表面分子是涉及到導致細胞程序死亡減少或消除的信號轉導路徑的受體。在本文所述藥物遞送分子中可能被配體靶向的細胞表面分子的實例包括但不限於以下中的任何一種或多種:4-1BB、5T4、腺癌抗原、α-胎兒球蛋白、BAFF、B淋巴瘤細胞、C242抗原、CA-125、碳酸酐酶9(CA-IX)、c-MET、CCR4、CD152、CD19、CD20、CD200、CD22、CD221、CD23(IgE受體)、CD28、CD30(TNFRSF8)、CD33、CD4、CD40、CD44v6、CD51、CD52、CD56、CD74、CD80、CEA、CNTO888、CTLA-4、DR5、EGFR、EpCAM、CD3、FAP、纖連蛋白額外結構域-B、葉酸鹽受體1、GD2、GD3神經節苷脂、糖蛋白75、GPNMB、HER2/neu、肝細胞生長因子(HGF)、人類分散因子受體激酶、IGF-1受體、IGF-I、IgGl、L1-CAM、IL-13、IL-6、胰島素樣生長因子I受體、整聯蛋白α5β1、整聯蛋白αvβ3、MORAb-009、MS4A1、MUC1、粘蛋白CanAg、N-羥乙醯神經氨酸、NPC-1C、PDGF-Rα、PDL192、磷脂醯絲氨酸、前列腺癌腫細胞、RANKL、RON、ROR1、SCH 900105、SDC1、SLAMF7、TAG-72、腱生蛋白C、TGFβ2、TGF-β、TRAIL-R1、TRAIL-R2、腫瘤抗原CTAA16.88、VEGF-A、VEGFR-1、VEGFR2、波形蛋白或其組合。對癌症特異性的其他靶向分子或顆粒將對本領域技術人員顯而易見,並且可結合本發明的替代性實施方案來使用。在實施方案中,配體靶向癌細胞上的c-MET。在一個實施方案中,配體是HGF。在實施方案中,配體是內化蛋白B或其片段或其變型。在另一實施方案中,配體是細菌侵襲素(Inv)蛋白質。
因此,在一些實施方案中,配體是天然結合配偶體,或可結合至細胞表面分子的分子。在一些實施方案中,配體是蛋白質、蛋白質片段、多肽、或低聚肽。在其他實施方案中,配體是抗體或抗體片段。在某些其他實施方案中,配體是結合至細胞表面分子的有機小分子。在一些實施方案中,有機小分子模仿用於靶細胞表面分子的天然結合配偶體的結構,並且競爭性結合至該靶細胞表面分子,而在其他實施方案中,該有機小分子非競爭性結合至靶細胞表面分子。
在一些實施方案中,膜滲透結構域是蛋白質、蛋白質片段、多肽、或低聚肽。在某些實施方案中,膜滲透結構域是具有約3至約35個胺基酸的多肽。
在實施方案中,所述膜滲透結構域是五鄰體基底蛋白或其得自腺病毒的片段。五鄰體基底蛋白通常在感染早期期間介導腺病毒(例如腺病毒血清型5)的細胞結合、進入和細胞溶質滲透。五鄰體基底可包括RGD基元(Arg-Gly-Asp)。如本文所用,「PB」是指五鄰體基底片段。
在一些實施方案中,有效負載結合結構域是蛋白質、蛋白質片段、多肽、或低聚肽。在某些實施方案中,膜滲透結構域是具有約3至約35個胺基酸的多肽。
在一個實施方案中,有效負載結合結構域是十賴氨酸基元,也稱為「K10」。十賴氨酸基元包含十個賴氨酸殘基。
在一些實施方案中,結合至有效負載結合結構域的有效負載結合的是核酸。在一些實施方案中,核酸選自由以下組成的組:雙鏈脫氧核糖核酸(dsDNA),單鏈脫氧核糖核酸(ssDNA),核糖核酸(RNA),信使核糖核酸(mRNA),轉移核糖核酸(tRNA),核糖體核糖核酸(rRNA),小幹擾核糖核酸(siRNA),單鏈核糖核酸(ssRNA),和低聚核苷酸(無論單鏈或雙鏈)。
在某些實施方案中,有效負載結合結構域向有效負載的結合是通過選自由以下組成的組的方法進行:靜電相互作用、親電子相互作用、親水性相互作用(範德瓦耳斯力)、氫鍵或共價鍵。
在各種實施方案中,藥物遞送分子中的配體靶向癌細胞上的細胞表面分子。在實施方案中,細胞表面分子是癌細胞上的受體。
在實施方案中,本文所述的是藥物遞送分子,其包括靶向細胞表面分子的配體、膜滲透結構域和有效負載結合結構域,其中所述配體是內化蛋白B(InlB)或其片段或其變型,所述膜滲透結構域是五鄰體基底蛋白或其片段並且所述有效負載結合結構域是十賴氨酸基元。內化蛋白B靶向細胞表面蛋白質c-Met。c-Met的天然配體是肝細胞生長因子(HGF)。HGF形成四聚物並且需要二硫鍵形成。得自核細胞增生利斯特氏菌(Listeria monocytogenes)的內化蛋白B也識別並且結合c-MET,但不四聚化或不需要二硫鍵形成。內化蛋白B可表達為融合蛋白質,並且該融合蛋白質也結合至c-Met。InlB未與HGF競爭。在一些實施方案中,包含InlB、五鄰體基底蛋白和十賴氨酸基元的藥物遞送分子可能還包含細胞毒素劑,諸如咔咯化合物。咔咯化合物是卟啉樣分子。這些化合物可螯合大量不同金屬(諸如鐵、鎵、錳等等),非共價結合載體蛋白質,是細胞毒素,並且在無載體蛋白質情況下不能滲透細胞。
在其他實施方案中,配體靶向細胞表面分子CD4,或者CD19或CD20。在其他實施方案中,配體靶向人類表皮生長因子受體(HER)中的一個,例如HER2或HER3。在另一實施方案中,配體靶向整聯蛋白。
在各種實施方案中,藥物遞送分子還包含治療劑。治療劑形成具有有效負載結合結構域的複合物。在各種實施方案中,治療劑包括但不限於烷基化劑、抗代謝物、抗腫瘤抗菌素、有絲分裂抑制劑、皮質類固醇、細胞毒素劑或其組合。治療劑與有效負載結合結構域之間的複合物可能是共價的或非共價的。在一些實施方案中,非共價複合物可能是經由範德瓦耳斯力、氫鍵、靜電相互作用、疏水性/親水性相互作用來形成。在一些實施方案中,治療劑與有效負載結合結構域之間的相互作用可通過聯結子介導。在一些實施方案中,治療劑是阿黴素或咔咯化合物。
本文還描述了用於在有需要的受試者中治療癌症的方法。所述方法包括鑑別需要治療的受試者和提供包括藥物遞送分子的組合物以及向受試者施用有效量的組合物以便治療癌症。在各種實施方案中,藥物遞送分子包括靶向細胞表面上的受體的配體,膜滲透結構域以及有效負載結合結構域,並且還包括本文所述的治療劑。
本文還描述了用於在有需要的受試者中抑制癌症進展的方法。所述方法包括鑑別需要治療的受試者和提供包括藥物遞送分子的組合物以及向受試者施用有效量的組合物以便抑制癌症進展。在各種實施方案中,藥物遞送分子包括靶向細胞表面上的受體的配體,膜滲透結構域以及有效負載結合結構域,並且還包括本文所述的治療劑。
本文還描述了用於在有需要的受試者中預防癌症轉移的方法。所述方法包括鑑別需要預防的受試者和提供包括藥物遞送分子的組合物以及向受試者施用有效量的組合物以便預防癌症轉移。在各種實施方案中,藥物遞送分子包括靶向細胞表面上的受體的配體,膜滲透結構域以及有效負載結合結構域,並且還包括本文所述的治療劑。
本文還提供了用於治療、抑制或預防藥物抗性癌症的轉移(例如,抗EGFR酪氨酸激酶抑制劑的癌症)。所述方法包括鑑別需要治療的受試者和提供包括藥物遞送分子的組合物以及向受試者施用有效量的組合物以便治療、抑制或預防藥物抗性癌症的轉移。在各種實施方案中,藥物遞送分子包括靶向細胞表面上的受體的配體,膜滲透結構域以及有效負載結合結構域,並且還包括本文所述的治療劑。在實施方案中,藥物抗性癌症過表達選自由c-Met、HER2、CD4和CD20組成的組的受體。
本文還提供了向腦部遞送治療性化合物的方法。所述方法包括鑑別需要此類遞送的受試者和提供包括藥物遞送分子的組合物以及向受試者施用有效量的組合物。在各種實施方案中,藥物遞送分子包括靶向細胞表面上的受體的配體,膜滲透結構域以及有效負載結合結構域,並且還包括本文所述的治療劑。本文所述組合物令人意外地越過血腦屏障並且向腦部中細胞遞送有效負載。因此,這些組合物獨一無二適合於治療腦部中的癌症(例如轉移性癌症)。
在本文所述治療性方法的各種方面中,組合物中的藥物遞送分子包括靶向細胞表面上受體的配體、膜滲透結構域和有效負載結合結構域,其中該配體是內化蛋白B(InlB)或其片段或其變型,該膜滲透結構域是五鄰體基底蛋白或其片段並且該有效負載結合結構域是十賴氨酸基元。藥物遞送分子還包含治療劑,諸如阿黴素或咔咯化合物。
療法
本發明的另一方面涉及通過施用有效量的組合物來治療癌症(例如白血病、骨髓瘤、B細胞淋巴瘤(霍奇金淋巴瘤和/或非霍奇金淋巴瘤)、腦癌、乳腺癌、結腸直腸癌、肺癌、肝細胞癌、腎癌、胃癌、胰癌、宮頸癌、卵巢癌、肝癌、膀胱癌、尿道癌、甲狀腺癌、腎臟癌、癌腫、黑素瘤、頭頸癌、腦癌、前列腺癌、雄激素依賴性前列腺癌和雄激素非依賴性前列腺癌),所述組合物包括與本文所述治療劑複合的藥物遞送分子。在一些實施方案中,治療劑可以是適用於治療特定類型癌症的任何化學治療藥物。治療劑可以是有機分子、生物分子(例如肽或核酸)、或其組合。在各種實施方案中,治療劑包括但不限於烷基化劑、抗代謝物、抗腫瘤抗菌素、有絲分裂抑制劑、皮質類固醇、細胞毒素劑或其組合。在一個實施方案中,治療劑是咔咯化合物。在實施方案中,治療劑是siRNA分子。
在一些實施方案中,將包含有效量的與治療劑複合的藥物遞送分子的組合物與諸如本文所述那些的一種或多種化學治療劑一起施用。有效量的組合物和化學治療劑可以順序地或同時地施用。
在一些實施方案中,施用是全身性的。在一些實施方案中,施用是局部的。向受試者施用組合物的各種方式是本領域技術人員已知的。在本發明的所有實施方案的一些方面中,組合物是通過包括眼部、經口、胃腸外、靜脈內、肌內、皮下、經皮膚、氣道(氣溶膠)、肺部、皮膚、局部、或注射施用的途徑來施用。
可以與包含有效量的與治療劑複合的藥物遞送分子的組合物一起使用來治療癌症的另外的療法包括但不限於外科手術、輻射、免疫療法、疫苗或其組合。可以與包括施用有效量的包含有效量的與治療劑複合的藥物遞送分子的組合物的療法順序地或同時地,施用所述另外的療法來治療癌症(例如,黑素瘤或卵巢癌腫)。
在一些實施方案中,化學治療劑可以選自以下中任何一種或多種:細胞毒素抗菌素、抗代謝物、抗有絲分裂劑、烷基化劑、砷化合物、DNA局部異構酶抑制劑、紫杉烷、核苷類似物、植物生物鹼和毒素;以及其合成衍生物。示例性化合物包括但不限於:烷基化劑∶蘇消安,和曲洛磷胺;植物生物鹼∶長春花鹼,紫杉醇,多西紫杉醇;DNA局部異構酶抑制劑∶阿黴素,表柔比星,依託泊苷,喜樹鹼,託泊替康,依立替康,替尼泊苷,克立那託,和絲裂黴素;抗葉酸劑∶氨甲喋呤,黴酚酸,和羥基脲;嘧啶模擬物∶5-氟尿嘧啶,去氧氟尿苷,和阿糖胞苷;嘌呤模擬物∶巰基嘌呤和硫鳥嘌呤;DNA抗代謝物∶2'-脫氧-5-氟尿苷,阿非迪黴素甘氨酸鹽,和吡唑並咪唑;和抗有絲分裂劑∶軟海綿素,秋水仙鹼,和根黴素。還可以使用包含一種或多種化學治療劑(例如FLAG、CHOP)的組合物。FLAG包含氟達拉濱、阿糖胞苷(Ara-C)和G-CSF。CHOP包含環磷醯胺、長春新鹼、阿黴素和強的松。在另一實施方案中,使用PARP(例如PARP-1和/或PARP-2)抑制劑,並且此類抑制劑是本領域眾所周知的(例如,Olaparib,ABT-888,BSI-201,BGP 15(N-Gene Research Laboratories,Inc.);INO-1001(Inotek Pharmaceuticals Inc.);PJ34(Soriano等人,2001;Pacher等人,2002b;3-氨基苯甲醯胺(Trevigen);4-氨基-1,8-萘醯亞胺;(Trevigen);6(5H)-菲啶酮(Trevigen);苯甲醯胺(美國專利Re.36,397);和NU1025(Bowman等))。
如本文所述,在各種實施方案中,療法包括例如輻射療法。輻射療法中所用輻射可能是電離輻射。輻射療法還可以是伽馬射線、X射線、或質子束。輻射療法的實例包括但不限於:外線束輻射療法、放射性同位素(I-125、鈀、銥)的間質植入、諸如鍶-89的放射性同位素、胸部輻射療法、腹膜內P-32輻射療法,和/或全腹部和骨盆輻射療法。對於輻射療法的總體概述,參見Heilman,Chapter 16:Principles of Cancer Management:Radiation Therapy,第6版,2001,DeVita等人編,J.B.Lippencott Company,Philadelphia。輻射療法可作為外線束輻射或遠距療法來施用,其中所述輻射是從遠端源引導出。輻射治療還可以作為內部療法或短距療法來施用,其中輻射源被放置在身體內部接近於癌細胞或腫瘤塊。還涵蓋了使用光動力療法,所述光動力療法包括施用光敏劑,諸如血卟啉和其衍生物,維替泊芬(Vertoporfin)(BPD-MA),酞菁,光敏劑Pc4,去甲氧基-竹紅菌甲素;和2BA-2-DMHA。
如本文所述,在各種實施方案中,療法包括例如免疫療法。免疫療法可以包括例如使用癌症疫苗和/或敏化的抗原遞呈細胞。免疫療法可涉及用於對宿主進行短期保護的被動免疫,其通過施用針對癌症抗原或疾病抗原的預形成抗體來實現(例如,向腫瘤抗原施用任選地連接至化學治療劑或毒素的單克隆抗體)。免疫療法還可以集中於使用癌細胞系的細胞毒素淋巴細胞識別表位。
如本文所述,在各種實施方案中,,療法包括例如激素療法。激素治療性治療可包括例如:激素激動劑,激素拮抗劑(例如氟他米特、比卡魯胺、三苯氧胺、雷洛昔芬、乙酸亮脯利特(LUPRON)、LH-RH拮抗劑),激素生物合成和加工的抑制劑,和類固醇(例如地塞米松、類視色素、類三角醇(deltoid)、倍他米松、考的索、考的松、強的松、去氫睪酮、糖皮質激素、鹽皮質激素、雌激素、睪酮、孕酮),維生素A衍生物(例如全反式視黃酸、(ATRA));維生素D3模擬物;抗促孕激素(例如米非司酮、奧那司酮),或抗雄激素(例如,乙酸環丙孕酮)。
用抗癌療法進行治療的持續時間和/或劑量可能根據具體抗癌劑或其組合來變化。具體癌症治療劑的恰當治療時間將是熟練技術人員所了解的。本發明涵蓋對各癌症治療劑的最佳治療日程表的連續評價,其中由本發明方法確定的受試者的癌症的基因籤字是確定最佳治療劑量和日程表的因子。
在各種實施方案中,用於確定抗癌療法的預測效力的受試者是哺乳動物(例如小鼠,大鼠,靈長類,非人類哺乳動物,家畜,諸如狗、貓、母牛、馬),並且優選是人類。在本發明方法的另一實施方案中,受試者未經歷化學療法或輻射療法。在替代性實施方案中,受試者經歷化學療法或輻射療法(例如,諸如採用順鉑、卡鉑、和/或紫杉烷)。在相關實施方案中,受試者未暴露於超過受試者物種一般或平均遭遇的輻射或化學毒性劑的水平。在某些實施方案中,受試者必須採用外科手術來移除癌性或癌前組織。在其他實施方案中,癌性組織沒有被移除,例如,癌性組織可能位於身體的不宜手術區域,諸如在生命所必需的組織中,或處於手術操作將對患者造成相當的傷害風險的區域中,或例如,所述受試者在移除癌性組織之前被給予抗癌療法。
藥物組合物
在各種實施方案中,本發明提供藥物組合物,所述藥物組合物包括藥學上可接受的賦形劑以及治療有效量的本文所述藥物遞送分子,以便治療癌症(例如白血病、骨髓瘤、B細胞淋巴瘤(霍奇金淋巴瘤和/或非霍奇金淋巴瘤)、腦癌、乳腺癌、結腸直腸癌、肺癌、肝細胞癌、腎癌、胃癌、胰癌、宮頸癌、卵巢癌、肝癌、膀胱癌、尿道癌、甲狀腺癌、腎臟癌、癌腫、黑素瘤、頭頸癌、腦癌、前列腺癌、雄激素依賴性前列腺癌以及雄激素非依賴性前列腺癌)。在各種實施方案中,藥物遞送分子包括靶向細胞表面上的受體的配體,膜滲透結構域和有效負載結合結構域。藥物遞送分子還包括與本文所述藥物遞送分子複合的治療劑。在各種實施方案中,藥物遞送分子遞送治療劑以靶向癌細胞。
「藥學上可接受的的賦形劑」是指適用於製備藥物組合物的通常安全、無毒且合乎需要的賦形劑,並且包括可為獸醫學用途以及人醫藥用途所接受的賦形劑。此類賦形劑可為固體、液體、半固體,或在氣溶膠組合物的情況下可為氣體。
在各種實施方案中,根據本發明的藥物組合物可被配製來通過任給藥途徑進行遞送。「施用途徑」可指本領域中已知的任何施用途徑,包括但不限於氣溶膠、經鼻、經口、經黏膜、經皮膚、胃腸外或腸內。「胃腸外」是指通常與注射相關的施用途徑,包括眶內、眼內、輸注、動脈內、囊內、心內、皮內、肌內、腹膜內、肺內、脊椎內、胸骨內、鞘內、子宮內、靜脈內、蛛網膜下、囊下、皮下、經黏膜或經氣管。通過胃腸外途徑,組合物可呈用於輸注或用於注射的溶液或混懸液形式,或呈凍乾粉末形式。通過胃腸外途徑,組合物可呈用於輸注或用於注射的溶液或混懸液形式。通過經腸途徑,藥物組合物可呈片劑、凝膠膠囊、糖包衣片劑、糖漿、混懸液、溶液、粉末、顆粒劑、乳劑、允許控釋的微球或納米球或脂質囊泡或聚合物囊泡形式。通常,組合物通過靜脈內地或腹膜內地注射來施用。對於本領域的技術人員而言,這些施用的方法使已知的。
根據本發明的藥物組合物還可含有任何藥學上可接受的載體。如本文所用的「藥學上可接受的載體」是指涉及自身體的一種組織、器官或部分攜帶或運送目標化合物至身體的另一組織、器官或部分的藥學上可接受的物質、組合物或媒介物。舉例而言,載體可為液體或固體填充劑、稀釋劑、賦形劑、溶劑或包封物質或其組合。載體的各組分必須是「藥學上可接受的」,因為它必須與配方的其他成分相容。它還必須適用於與它可能與之接觸的任何組織或器官接觸,這意味著它必須不攜有毒性、刺激、過敏反應、免疫原性或過度超過其治療益處的任何其他併發症的風險。
根據本發明的藥物組合物也可被包載、製片或以乳劑或糖漿形式製備以供口服施用。可添加藥學上可接受的固體或液體載體以增強或穩定組合物,或有助於製備組合物。液體載體包括糖漿、花生油、橄欖油、甘油、鹽水、醇和水。固體載體包括澱粉、乳糖、硫酸鈣、二水合物、白土、硬脂酸鎂或硬脂酸、滑石粉、果膠、阿拉伯膠、瓊脂或明膠。載體還可以包括持續釋放物質,如單獨或與蠟組合的單硬脂酸甘油酯或二硬脂酸甘油酯。
藥物製劑是遵循常規製藥技術製備的,所述技術涉及研磨、混合、粒化和必要時壓制(針對片劑形式);或研磨、混合和填充(針對硬質明膠膠囊形式)。當使用液體載體時,製劑將呈糖漿、酏劑、乳劑或水性或非水性混懸液形式。此類液體製劑可直接經口施用或填充至軟質明膠膠囊中。
根據本發明的醫藥組合物可以以治療有效量遞送。精確的治療有效量是就在給定受試者中的治療療效而言,組合物將產生最有效的結果的那個量。這個量將取決於多種因子而變化,所述因子包括但不限於治療化合物的特徵(包括活性、藥物動力學、藥效學和生物利用度)、受試者的生理狀況(包括年齡、性別、疾病類型和階段、一般身體狀況、對給定劑量的反應性和藥物類型)、製劑中一種或多種藥學上可接受的載體的性質以及施用途徑。臨床和藥理學領域的技術人員將能夠通過常規實驗,例如通過監測受試者對施用化合物的反應以及相應調整劑量來確定治療有效量。對於其他指導,參見Remington:The Science and Practice of Pharmacy(Gennaro編,第20版,Williams&Wilkins PA,USA)(2000)。
在施用到受試者之前,可將製劑組分添加到藥劑。液體製劑可能是優選的。例如,這些製劑組分可包括油、聚合物、維生素、碳水化合物、胺基酸、鹽、緩衝劑、白蛋白、表面活性劑、增量劑或其組合。
碳水化合物製劑組分包括糖或糖醇,諸如單糖、二糖或多糖,或水溶性葡聚糖。糖或葡聚糖可包括果糖、右旋糖、乳糖、葡萄糖、甘露糖、山梨糖、木糖、麥芽糖、蔗糖、右旋糖酐、支鏈澱粉、糊精、α-環糊精和β-環糊精、可溶性澱粉、羥乙基澱粉和羧甲基纖維素,或其混合物。「糖醇」定義為具有--OH基團的C4-C8烴,並且包括半乳糖醇、肌醇、甘露糖醇、木糖醇、山梨糖醇、甘油、和阿拉伯糖醇。上述這些糖或糖醇可單獨使用或聯合使用。用量沒有固定的限制,只要糖或糖醇在液體製備物中可溶。在一個實施方案中,糖或糖醇濃度在1.0重量/體積%和7.0重量/體積%之間,更優選在2.0和6.0重量/體積%之間。
胺基酸製劑組分包括肉毒鹼、精氨酸和甜菜鹼的左旋(L)形式;然而,可添加其他胺基酸。
在一些實施方案中,作為製劑組分的聚合物包括平均分子量在2,000和3,000之間的聚乙烯吡咯烷酮(PVP)或平均分子量在3,000和5,000之間的聚乙二醇(PEG)。
還優選在組合物中使用緩衝液以將凍幹前或復水後溶液的pH變化最小化。可使用大多數任何生理緩衝液,包括但不限於檸檬酸鹽、磷酸鹽、琥珀酸鹽和穀氨酸鹽緩衝液或其混合物。在一些實施方案中,濃度為0.01至0.3摩爾。可添加到製劑的表面活性劑示於歐洲專利號270,799和268,110中。
另外,例如,組合物可通過共價軛合至聚合物來化學改性以增加其循環半衰期。優選聚合物以及將它們連接至肽的方法示於美國專利號4,766,106;4,179,337;4,495,285;以及4,609,546中,所述專利全文藉此以引用方式併入本文。優選聚合物是聚氧乙烯化多元醇和聚乙二醇(PEG)。PEG在室溫下可溶於水,並且在一些實施方案中,具有1000至40,000之間、2000至20,000之間、或3,000至12,000之間的平均分子量。在一些實施方案中,PEG具有至少一個羥基基團,諸如羥端基基團。羥基基團可能被激活以與抑制劑上的游離氨基基團反應。然而,應理解,反應性基團的類型和量可能變化,從而實現本發明的共價軛合的PEG/抗體。
水溶性聚氧乙烯化多元醇也可用於本發明。它們包括聚氧乙烯化山梨糖醇、聚氧乙烯化葡萄糖、聚氧乙烯化甘油(POG)等等。POG是優選的。一個原因是因為聚氧乙烯化甘油的甘油主鏈是以單酸甘油酯、二酸甘油酯、三酸甘油酯天然存在於例如動物和人類中的相同主鏈。因此,這種支化在身體內不會必然地被視作外來作用劑。POG具有與PEG相同範圍的分子量。用於POG的結構示於Knauf等人,1988,J.Bio.Chem.263:15064-15070,並且POG/IL C 2軛合物的討論見於美國專利號4,766,106中,這兩份文獻皆以其全文藉此以引用方式併入本文。
液體藥物組合物被製備後,可凍幹以防止降解並保持無菌。用於凍幹液體組合物的方法是本領域普通技術人員已知的。在使用之前,組合物可用無菌稀釋劑(例如林格氏溶液,蒸餾水,或無菌鹽水)復水,其可包括額外成分。復水後,使用對於本領域的技術人員已知的那些方法將組合物施用給受試者。
施用的劑量和模式將取決於個體。一般而言,施用組合物,以使得以1μg/kg至20mg/kg之間、20μg/kg至10mg/kg之間、1mg/kg至7mg/kg之間的劑量給予抗體。在一些實施方案中,其作為單次劑量給予,以將循環水平增加10至20倍並且在單次劑量之後持續4至6小時。也可在單次劑量之後使用連續輸注。倘若如此,抗體可以以5μg/kg/分鐘至20μg/kg/分鐘、或7μg/kg/分鐘至15μg/kg/分鐘之間的劑量輸注。
試劑盒
本發明還提供試劑盒來在有需要的受試者中治療、抑制和/或預防癌症的轉移。該試劑盒包括:組合物,該組合物包含與本文所述治療劑複合的藥物遞送分子;和用於在有需要的受試者中治療、抑制和/或預防癌症的轉移的組合物的使用說明書。
試劑盒是包括至少一種本發明組合物的材料或組分的集合物。因此,在一些實施方案中,試劑盒含有包括與如上所述治療劑複合的藥物遞送分子的組合物。
本發明試劑盒中配置的組分的準確性質取決於所述試劑盒的預定目的。在一個實施方案中,試劑盒是特別針對人類受試者配置的。在其他實施方案中,試劑盒被配置來用於治療諸如但不限於農場動物、家畜和實驗室動物的受試者的獸醫學應用。
使用說明書可包括在試劑盒中。「使用說明書」通常包括描述在使用試劑盒的組分來實現所需結果時採用的技術的明確表述,以便治療受試者中的中性粒細胞減少症、減輕其嚴重程度、抑制或預防。任選地,試劑盒還含有其它適用組分,如測量工具、稀釋劑、緩衝劑、藥學上可接受的載體、注射器或將易於由本領域技術人員認識到的其它適用附件。
可向從業者提供試劑盒中組裝的以保持材料或組分的可操作性和效用的任何便利和適合方式儲存的材料或組分。舉例而言,組分可呈溶解、脫水或凍幹形式;它們可提供在室溫、冷藏溫度或冷凍溫度下。組分通常包含於合適的包裝材料中。如本文所用的短語「包裝材料」是指一種或多種用於容納試劑盒的內容物(如本發明組合物等)的物理結構。包裝材料是通過熟知方法構造的,優選提供無菌、無汙染物的環境。如本文所用的術語「包裝」是指諸如玻璃、塑料、紙、箔等能夠容納個別試劑盒組分的合適的固體基質或材料。因此,例如,包裝可以是用於容納合適數量的發明組合物,所述發明組合物含有由本文所述方法產生的具有唾液酸酶活性的催化活性抗體。包裝材料通常具有指示試劑盒和/或其組分的內容物和/或目的的外部標籤。
實施例
提供以下實施例以更好說明要求保護的本發明且不應解釋為限制本發明的範圍。就提及的特定材料而言,僅出於說明目的且不意圖限制本發明。本領域技術人員可在不行使本發明的能力和不脫離本發明的範圍下開發等效手段或反應物。
實施例1∶單鏈低聚核苷酸和合成mRNA的遞送
合成mRNA的遞送是對基因遞送的改進替代方式。基因遞送載體必須破壞細胞核以允許基因表達,而mRNA僅需要遞送到用於翻譯蛋白質產物的細胞質中。諸如將方法用於表達(例如)用於誘發體細胞中的多潛能的所謂山中因子(Yamanaka factor)。雖然傳統「脂質轉染法」可用於活體外遞送mRNA,但這種系統和類似系統在活體內無效。
所公開的靶細胞滲透蛋白(HerPBK10)已證明了用於活體內核酸和藥物遞送的效力。還為基因和藥物遞送發展了相關蛋白質(PBK10)。HerPBK10經由與人類表皮生長因子受體(HER3)的相互作用來促進細胞的靶向結合和滲透,並且PBK10經由整聯蛋白相互作用來促進細胞的靶向結合和滲透。
下文中,證明了HerPBK10和PBK10用於遞送單鏈低聚核苷酸和合成mRNA的效用。
HerPBK10在MDA-MB-435細胞中運送標記的低聚核苷酸。為確定HerPBK10是否可以介導單鏈低聚核苷酸遞送,採用HerPBK10(5μg)或Lipofectamine 2000(Invitrogen,Carlsbad,CA,USA)、商用轉染試劑作為比較性對照物,在0.1M HEPES/Optimem I(Invitrogen;Carlsbad,CA,USA)中,室溫下培育Cy3標記低聚核苷酸(50pmol)20分鐘。將合成混合物加入MDA-MB-435細胞,其表達HER,並且在37℃下培育1h。細胞在室溫下固定於4%PFA中15分鐘,並且針對HerPBK10為免疫螢光法進行處理。用DAPI復染色細胞以鑑別細胞核。使用Leica SP2雷射掃描共焦顯微鏡獲得圖像。正如所料,脂質體介導攝取導致低聚核苷酸定位在細胞內部(圖1A)。重要地,HerPBK10在HerPBK10低聚複合物的結合和攝取期間與低聚核苷酸共存(圖1B),從而HerPBK10介導低聚核苷酸向細胞中的運送。
PBK10介導mRNA遞送。將編碼GFP的1kb合成mRNA(圖2A)用於測試PBK10介導向用於蛋白質表達的細胞中遞送的能力。將來自由Lipofectin遞送的mRNA的GFP表達與由Lipofectin遞送的GFP表達質粒相比較。當由Lipofectin遞送時,mRNA在HeLa細胞中以可由螢光顯微術檢測到的水平表達GFP(圖2B)。PBK10和編碼GFP的合成mRNA以PBK10:mRNA為20:1的體重比在室溫下於HEPES-緩衝鹽水(HBS)中混合約20分鐘,並隨後以約50至70%匯合度被添加至附著HeLa細胞。因此,PBK10形成具有mRNA的複合物,該複合物類似於先前發展PBK10來遞送的基因遞送複合物(圖2C)。
通過首先評價在PBK10與mRNA之間製得的複合物的細胞結合,檢驗PBK10介導遞送的能力。在HeLa細胞上在冰上培育PBK10-mRNA複合物,以促進受體結合而不是內化,隨後所述細胞被洗滌以移除游離(未結合)複合物並且通過ELISA處理以使用針對PBK10的一級抗體鑑別細胞表面結合複合物。細胞表面結合的基於ELISA的檢測表明複合物(PBK10+mRNA)結合至細胞(圖2D)。在細胞上培育PBK10(無mRNA)之後,還為免疫螢光法單獨針對PBK10處理細胞。為驗證細胞結合複合物(E)的攝取,細胞如早前描述在冰上用複合物培育,洗滌,隨後在37℃下溫熱以促進內化。細胞在溫熱之後指示時間點處固定,並且為免疫螢光法針對PBK10(綠色)進行處理。細胞用羅丹明鬼筆環肽與DAPI分別地復染色以鑑別肌動蛋白(紅色)和細胞核(藍色)。使用Leica SPE雷射掃描共焦顯微鏡獲得圖像。該發現表明複合物經歷向HeLa細胞內進行的時間依賴性內化(圖2E)。在用PBK10-mRNA複合物培育細胞之後約24h時,固定一組單獨的HeLa細胞並且為免疫螢光法針對GFP進行處理。該發現表明GFP表達可在PBK10介導的mRNA遞送之後檢測到,雖然頻率很低(極少細胞)(圖2D)。允許充分GFP表達(可被免疫螢光法檢測)的PBK10:mRNA的最佳體重比是20(圖2E)。這些發現總而言之表明有可能通過PBK10或HerPBK10來遞送mRNA,因為兩種蛋白質皆以類似方式與核酸相互作用。
實施例2∶靶向c-Met的蛋白質納米構造物
受體酪氨酸激酶(RTK)、c-MET以及其內源性配體、肝細胞生長因子(HGF)有助於細胞遷移、形態發生分化、和三維管狀結構的機化以及在正常組織發育期間的細胞生長和血管生成。然而,c-MET和HGF的調節異常可有助於腫瘤進展,並且在此類環境中,與大量人類癌症中的不良預後有關。
c-MET的細胞表面上升與耐藥性相關,包括獲得的對電信號阻斷療法的耐受性,並因此變為RTK靶向療法的重要生物標記。然而,大多數靶向RTK的療法被設計成抑制支持腫瘤存活的下遊信號路徑,初始響應此類治療的腫瘤幾乎普遍獲得對信號抑制的耐受性,同時大量組體已內在地抵抗此類信號阻斷療法。
不需要信號抑制的腫瘤靶向策略可證明對c-MET陽性癌細胞更有效。可通過配體識別c-MET以觸發附屬治療的的細胞攝取,從而省略對阻斷信號的需要,解決這一問題。雖然HGF有潛力完成此舉,但其對四聚體化和二硫鍵的需要對治療學發展構成技術難題。一種用於c-MET靶向的替代性和潛在更優配體可能來源於導致食物中毒的細菌。
人類病原體(核細胞增生利斯特氏菌)結合c-MET,從而通過其稱為內化蛋白的表面蛋白質來侵襲寄主細胞。特定而言,在c-Met結合之後,內化蛋白B(InlB)觸發受體介導胞吞作用。InlB和HGF識別c-Met的不同區域,並且InlB不需要用於結合的四聚體化或二硫鍵。因此,InlB可能適宜於我們先前建立來用於靶向諸如人類表皮生長因子受體(HER)之類其他受體的用於腫瘤靶向的納米生物策略。
PBK10是來源於腺病毒衣殼五鄰體基底的重組蛋白,所述腺病毒衣殼五鄰體基底可通過五鄰體基底的膜滲透活性來介導進入細胞中的基因和藥物遞送。已表明,當融合至腫瘤特異性配體時,PBK10可靶向腫瘤細胞。在該研究中,InlB的受體-結合位點是作為與PBK10的重組融合體來產生,以產生新蛋白質(InlB-PBK10),其介導細胞毒素劑向c-MET陽性癌細胞的靶向遞送。
該發現表明,InlB-PBK10可作為可溶解融合蛋白質產生,可溶解融合蛋白質識別各種腫瘤細胞系上的c-MET,並且在細胞結合之後經歷迅速內化。InlB-PBK10形成具有毒性化合物(諸如咔咯)的直徑約10至20nm的納米簇,並且在細胞進入之後介導咔咯滲透入向細胞質中,導致腫瘤細胞死亡。因此,Inl-PBK10是用於毒性分子向MET表達腫瘤的靶向遞送的新穎構造物。
背景
作為腫瘤生物標記的c-MET。間充質上皮轉變因子或MET是首先作為激活癌基因發現的受體酪氨酸激酶(RTK)。用於MET、肝細胞生長因子(HGF)的內源性配體(又名成纖維細胞衍生細胞運動因子或分散因子(SF))通常激活MET以誘發細胞增殖、運動性、存活和分化路徑。MET和HGF主要分別在上皮和間充質來源的細胞中表達。HGF和MET之間的旁分泌信號介導上皮-間充質相互作用,該相互作用調控組織生長和形態發生分化。正常組織中的HGF-MET信號有助於胚胎發生、器官發生、血管生成、傷口癒合和組織再生,而這種路徑的異常信號是與腫瘤發展和進展、腫瘤細胞侵襲和轉移相關。
c-MET由胺基(N)-端胞外結構域、跨膜片段和羧基(C)-端胞內激酶結構域組成。胞外區域由接近PSI結構域(存在於plexin、semaphorin和整聯蛋白中)的胺基(N)-端Semaphorin(Sema)結構域以及4種免疫球蛋白(Ig)-樣結構域組成,這4種免疫球蛋白(Ig)-樣一起組成HGF的結合部位。通過HGF的受體結合,導致MET的二聚作用,激活了通過ERK1/2、AKT和STAT3、磷脂醯肌醇3-激酶(PI-3K)、Ras-Raf-MAPK和磷脂酶C的信號。配體觸發的MET胞吞作用通過發動蛋白和網格蛋白依賴性路徑發生,所述路徑介導通過降解和再循環胞吞途徑的運輸(trafficking)。
c-MET信號的調節異常通過若干機制發生,包括有或者沒有基因擴增的過表達和組成性激酶活化,激酶結構域突變,以及通過過表達HGF對c-MET的旁分泌/自分泌激活。c-MET的配體獨立性激活還破壞正常HGF-MET信號,並且可由導致組成性二聚作用的突變以及缺氧條件引起。後者可激活MET的HIF-1α-誘發轉錄,導致蛋白水平升高,擴增HGF信號並且促進侵襲。
一般而言接受的是,跨腫瘤的各種RTK的異源表達是許多種癌症中耐受性的主要機制。旨在抑制一種特異性RTK的療法常常因為其他RTK的上調或配體刺激而不成功,所述上調或配體刺激又維持對於細胞存活關鍵性的因子的信號,所述因子包括PI3K和促分裂原激活蛋白質激酶(MAPK)。研究中對這種耐受性機制的鑑別表明,對EGFR抑制劑的耐受性與非小細胞肺癌以及其他腫瘤(包括乳腺癌)中MET信號的補償上調相關。總而言之,c-MET是治療性幹預的有效候選者,因為其與各種類型的癌症、不良預後和轉移相關,並且可能是用於抗鑑別和靶向腫瘤的有用生物標記。
臨床中目前靶向HGF/MET路徑的療法是由針對HGF(Ficlatuzumab)或MET(Onartuzumab)的抗體、或導向MET激酶結構域的小分子抑制劑(Tivantinib或ARQ197)組成。所有這些方法的問題在於它們對治療效力的信號抑制的依賴,這可能造成先前提及的補償性RTK串饋,促進耐受性的發展。存在著對使用組合療法來阻斷或破壞多個RTK、尤其EGF-R和MET的功能的日益增加的興趣,條件是這兩個受體之間有顯著串饋。雖然測試這種方法的活體外研究已顯示出對腫瘤細胞系諸如肺癌、乳腺癌、胃癌和結腸直腸癌的前景,但測試這個方法的臨床試驗尚在進行中並且還有不確定性。
細菌病原體蛋白質用作潛在c-MET靶向劑。內化蛋白B(InlB)是在人類細菌病原體(單核細胞增生性李斯特菌(L.monocytogenes;Lm))的表面上顯示的蛋白質,並且通過結合至c-MET來促進Lm進入到非吞噬性細胞中。InlB是Lm內化蛋白的大家族的成員,所述Lm內化蛋白包含N端螺旋帽結構域,以及不同數目的富白氨酸重複(LRR),所述重複接近於免疫球蛋白樣內重複(IR)區域。與其他內化蛋白不同,InlB結構還在C端含有B重複和3個GW模塊。InlB321(InlB的能夠以高親合力結合至c-MET的片段)由稱為Cap、LRR(蛋白-蛋白相互作用域)和IR區域的蛋白結構域組成。InlB321向MET的結合通過其兩個結構域發生∶LRR和IR,其分別結合至MET的Ig1和Sema結構域。
InlB作為潛在腫瘤靶向配體比HGF具有若干優點。HGF是含有20個硫化物鍵的異源二聚蛋白,並且需要將前蛋白分裂成組裝亞基,這可能使重組體生產變得複雜,尤其是作為向外源蛋白結構域的融合體時。相比之下,InlB321已經在大腸桿菌(Escherichia coli)中作為重組可溶解配體產生,並且可容忍向其他蛋白質的融合(圖3A)。活體外研究已證明,InlB321肽可在MET結合之後觸發受體介導內化,這有助於其作為納米遞送劑來使用。同樣重要的是注意到,MET的HGF結合部位與InlB321的HGF結合部位之間不存在重疊(圖3B);因此,用於結合至MET的這兩個配體之間不存在競爭。
在目前研究中,通過將這種肽作為向Ad5五鄰體基底(PB)的重組融合體來產生它,使其重塑,所述Ad5五鄰體基底在羧基(C)端由十賴氨酸序列(K10)修飾。所得多結構域蛋白質(InlB-PBK10)包含用於以下的功能:運送陰離子裝載物,如核酸或咔咯(由K10結構域介導);靶向結合和內化(由InlB321結構域介導);以及膜滲透和胞內運輸(由PB結構域介導)。提供了針對以下的結果:InB-PBK10融合基因的構造,由這種重組基因編碼的融合蛋白質的生產,針對該蛋白質結合至MET和進入細胞的能力進行表徵,和估價其在活體外遞送細胞毒素有效負載的能力。
結果
可構造重組基因以編碼InlB-PBK10。產生InlB-PBK10基因構造物的策略涉及兩步克隆法,所述兩步克隆法必須包括InlB 321的聚合酶鏈式反應(PCR)擴增以克隆進入pRSET-A細菌表達質粒中,隨後在InlB321序列的3』端處插入PBK10。為完成此舉,設計低聚核苷酸引物以通過PCR將限制性內切位點引入InlB321中來將這種序列與PBK10接合以用於「框內」插入表達質粒pRSET-A中。
我們的正向和反向低聚核苷酸引物分別包含以下序列∶
5』-AGTGAGCTCGAGACTATCACTGTG-3』(SEQ ID NO:1)和5』-GTTGGTGACTTTCTCCCACCTTCACCACCTTCTCTAGATATCCATGGTAT-3』(SEQ ID NO:2)。
將限制性內切位點SacI引入正向引物,以將InlB321閱讀框放置成與由pRSET-A編碼的N端聚組氨酸序列毗連。BglII和KpnI限制性內切位點被引入反向引物中。SacI和KpnI被用於將InlB321插入pRSETA中,並且BglII被用於隨後將PBK10插入InlB321編碼序列的3』端。編碼Gly-Gly-Ser-Gly-Gly-Ser(SEQ ID NO:3)胺基酸基元的序列被包括在反向引物中以在InlB321和PBK10之間摻入短的柔性聯結子。使用高保真度聚合酶來確保不將突變引入InlB321PCR產物。
800bp InlB321PCR產物在SacI和KpnI限制性內切位點連接到pRSETA中,產生質粒構造物,pRSETA-InlB。PBK10隨後被在限制性內切位點BglII和HindIII處插入pRSETA-InlB中。為此,在限制性內切位點BamHI和HindIII處從質粒構造物pRSETA-PBK10中切除PBK10,並且連接到兩倍消化pRSETA-InlB中,產生pRSETA-InlB-PBK10構造物(圖4A)。我們還生產了構造物pRSETA-GFP-InlB,其將InlB321編碼為綠色螢光蛋白(GFP)的羧基[C]端融合以用於將來可能的活體外和活體內成像實驗。該構造物通過消化先前用SacI和BglII描述的800bp InlB PCR產物來製得,並且將它連接到pRSETA-GFP質粒中,這將InlB插入物放置成與GFP的編碼序列在框內(圖4B)。所有構造物被兩倍消化並且使用1%瓊脂糖凝膠通過電泳來評估以確認預期條帶的存在(圖4C)。另外,所有3種構造物被測序以確認其同一性以及驗證突變未被引入閱讀框中。
重組蛋白InlB、InlB-PBK10和GFP-InlB可在細菌中產生。先前描述的所有3種質粒構造物(pRSET-InlB、pRSET-InlB-PBK10和pRSET-GFP-InlB)被轉變成大腸桿菌菌株,BLR(DE3)pLysS,以用於隨後的蛋白表達和純化,如所述方法中描述。與更傳統的(即BL21)表達菌株相反,該菌株更加容忍重複序列,因此實現獲得包含C端聚賴氨酸的全長蛋白質的能力。同時,pRSET-A質粒將蛋白質編碼為多組氨酸序列的N端融合。這種組氨酸(His)標記實現使用鎳螯合樹脂的親合力純化,並且通過抗His標記抗體提供用於識別的表位。
所有3種構造物在細菌中產生可溶解蛋白質(InlB、InlB-PBK10和GFP-InlB),所述可溶解蛋白質可使用鎳-軛合樹脂通過金屬螯合物親和色譜法分離,如所述方法中描述。抗His標記抗體識別所有3種蛋白質,其通過在約37kDa(InlB)、約100kDa(InlB-PBK10)和約63kDa(GFP-InlB)的預測分子量處使凝膠電泳變性來遷移(圖5)。
c-MET的表面水平在不同腫瘤細胞系之間不同。表徵InlB-PBK10的第一目標是確定該蛋白質是否識別腫瘤細胞上的c-MET。大部分針對與不同腫瘤細胞系相關的c-MET水平的文獻是基於總c-MET蛋白質表達或者RNA表達,且因此不提供關於在細胞表面上顯示的c-MET的水平的信息。因此,重要的是首先在可為我們所用的細胞系的圖上確定c-MET的相對細胞表面水平。這經證明是最初的挑戰,因為大多數可用於此類評價的抗體已針對c-MET的細胞溶質結構域被產生,並且用於評估c-MET表達和激活的機制。為了該研究,使用特別針對細胞表面c-MET研發的MET3抗體。我們使用細胞表面ELISA來測量c-MET在各種細胞系上的相對細胞表面水平。簡單地說,這種方法實現我們在非透化細胞上測量表面上相對受體水平,並且可以以96孔格式執行,允許多重複制以及保存貴重試劑。我們的ELISA結果表明H1993(肺癌細胞系系)和MDA-MB-231(乳腺癌細胞系系)是具有最高的c-MET細胞表面水平的細胞系。RANKL(前列腺癌細胞系)和MDA-MB-435(乳腺癌細胞系)顯示中等水平,而LN-GFP(前列腺癌細胞系)和Cos-7(非洲綠猴腎成纖維細胞)顯示細胞表面c-MET的較低水平(圖6)。
InlB衍生肽識別c-MET。為了評價靶向配體的受體特異性,我們使用螢光激化細胞分選(FACS)來測量InlB結合至c-MET陽性細胞的相對水平。測試兩種腫瘤細胞系對InlB的結合∶一種腫瘤細胞系具有高表達的c-MET(H1993),並且另一種腫瘤細胞系具有低表達的c-MET(LN GFP)。與LN GFP相比,InlB顯示出相應更高水平的對H1993細胞的結合(圖7A)。為驗證InlB是否特異性結合至c-MET,我們使用來源於MET的胞外、配體結合結構域的可溶解肽(MET肽)作為InlB結合的競爭性抑制劑。抑制劑與配體的等摩爾比率預測受體結合降低50%。一致同意,MET:InlB的等摩爾(1:1)濃度使InlB對H1993細胞的結合減少50%,指示c-MET選擇性結合。(圖7B)。
InlB-PBK10的細胞結合與c-MET水平相關,並且被游離配體競爭性抑制。在上述部分中,我們展示了InlB具有通過c-MET結合至c-MET陽性腫瘤細胞系的能力。下一個目標是測試當具體化為融合蛋白質的一部分時,通過InlB的受體結合是否將被影響。為評估此狀況,我們使用細胞表面ELISA評價InlB-PBK10對表達高c-MET(MDA-MB-231)和低c-Met(Cos-7)的細胞系的結合。與表達相對低c-MET水平的細胞(Cos-7)相比,InlB-PBK10展示出對具有更高c-MET細胞表面表達(MDA-MB-231)的細胞的更高結合水平(圖7C)。為進一步確認InlB-PBK10識別c-MET,將游離InlB配體用作競爭性抑制劑。在增加濃度的InlB存在下,InlB-PBK10展示出對MDA-MB-231細胞的結合減少,表明InlB-PBK10通過c-MET結合這種細胞(圖7D)。
InlB-PBK10在懸浮液中顯示對細胞上c-MET的結合。作為對c-MET識別的進一步確認,我們測試InlB-PBK10是否可在懸浮液中結合至細胞(與評價結合至附著細胞的上述試驗相反)。我們執行拉下實驗,其中我們在作為競爭性抑制劑的增加濃度的游離InlB配體存在下,在具有InlB-PBK10的懸浮液中培育c-MET陽性細胞系(MDA-MB-435)。選擇游離InlB配體的濃度,以使得InlB-PBK10:InlB的摩爾比率為1:1、1:5和1:10。與細胞團塊共沉澱的InlB-PBK10水平隨後通過Western印跡使用對InlB-PBK10特異性的抗體(Ad5抗體,其識別五鄰體基底)來評價。Inl-PBK10結合的水平隨InlB的濃度增加而降低,其中結合幾乎被完全抑制,從而驗證InlB-PBK10在懸浮液中可識別和結合c-MET(圖7E)。
InlB-PBK10內化到c-MET+細胞中。為檢驗細胞攝取之後InlB-PBK10的存活率和檢測性,我們首先在4℃下培育具有3種不同細胞類型(MDA-MB-231、MDA-MB-435和H1993)的InlB-PBK10以促進受體結合而不是內化。為誘發胞吞作用,我們隨後在37℃下經歷指示時間培育細胞並且在特定時間點固定所述細胞至多30分鐘。免疫螢光著色和共焦顯微術表明在所有3種細胞系中,InlB-PBK10(以綠色示出)聚集在細胞膜上,並且在結合的首個5分鐘內集合到細胞膜上的焦點中。InlB-PBK10隨後經30分鐘積累在核周區域中。這些數據表明InlB-PBK10可在細胞結合之後30分鐘內在細胞內部內在化和積累(圖8)。細胞在特定時間點固定至多30分鐘,並且通過雷射掃描共焦顯微術成像。紅色,肌動蛋白;藍色,細胞核。比例尺,約10微米。
InlB-PBK10向c-MET+細胞遞送毒性分子。為評估InlB-PBK10的內涵體溶解能力,我們評價其是否可介導自身先天不能夠滲透細胞膜的細胞毒素劑進行細胞質進入。包含鎵(III)(S2Ga或Ga-咔咯)的磺化咔咯是強螢光化合物,其可自發地與蛋白質組裝。在沒有膜滲透載體來將這些化合物遞送到細胞中以觸及毒性的細胞質靶標的情況下,所述化合物不可能跨越細胞膜。20-22Medina-Kauwe實驗室先前已顯示單獨的Ga-咔咯是無毒的,但當通過HerPBK10遞送到HER2+腫瘤細胞中時可促進細胞死亡。
為了該研究,將InlB-PBK10與Ga-咔咯混合以促進非共價組裝,並且所得InlB-PBK10-Ga複合物通過透射電子顯微術(TEM)和動態光散射來表徵(圖9A和9B)。TEM(圖9A的右圖)顯示,與單獨的InlB-PBK10(-S2Ga)相比,當Ga-咔咯(+S2Ga)添加至InlB-PBK10時,形成球形組裝物。該圖像顯示所述蛋白和咔咯形成10至20nm直徑的簇。用於測量粒度的動態光散射顯示,單獨的InlB-PBK10形成平均直徑8.4nm的顆粒,而InlBPBK10-Ga直徑為約16.4nm。
為檢驗InlB-PBK10-Ga是否可滲透細胞以及誘發c-MET陽性癌細胞系中的咔咯介導毒性,我們將MDA-MB-435細胞暴露於1μM、5μM和10μM的以下各者:InlB-PBK10、S2Ga和InlB-PBK10-Ga。在1μm濃度下,InlB-PBK10-Ga使細胞存活率減少60%,而1μm和更高濃度的單獨S2Ga和單獨InlB-PBK10不影響細胞存活率。這些數據確認InlB-PBK10具有內涵體溶解能力,並且表明該構造物能夠遞送諸如Ga-咔咯的細胞毒素劑到表達細胞表面c-MET的細胞中(圖9C)。
為進一步評估InlB-PBK10的治療性能力,評價該蛋白是否可用於遞送更多主流化學治療分子。阿黴素(Dox)是FDA批准的用於大量癌症類型的細胞毒素劑。如果此類藥物可主要地靶向腫瘤細胞,則其就減少副作用而言將是有益的。在該方法中,Dox首先被插入到雙鏈低聚中以形成DNA-Dox,其隨後可結合至InlB-PBK10的聚賴氨酸(經由與DNA磷酸鹽主鏈的電荷相互作用)並且形成我們稱為I-Dox的複合物。I-Dox複合物(相對於Dox濃度5μM)是在所述方法中描述的條件下在指示細胞系上培育。InlB-PBK10是在與I-Dox複合物等同的濃度下培育。細胞存活率是通過在治療之後24h的代謝(MTT)分析來評價。當與具有低c-MET表達的細胞(LAPC4)相比時,I-Dox複合物誘發具有高c-MET表達的細胞(H1993)顯著的毒性(圖9D)。H1993細胞首先用游離InlB配體處理以阻斷c-MET,隨後在如上相同條件下暴露於I-Dox。單獨的InlB-PBK10似乎稍微而不是顯著地減少細胞數量,表明細胞死亡的主要機制是通過Dox的遞送發生作用。另外,游離InlB配體通過I-Dox抑制細胞毒性,表明I-Dox-介導的細胞毒性通過用於遞送Dox的c-MET結合和進入來發生(圖9E)。
實驗程序
細胞。人類乳腺癌細胞系(MDA-MB-435*和MDA-MB-231)是得自國家癌症研究所(National Cancer Institute)。人類肺癌(H1993)和非洲綠猴腎成纖維細胞(Cos-7)細胞系是得自ATCC。人類卵巢癌細胞(A2780)是得自Sigma-Aldrich。前列腺癌細胞系(LNCaPNeo/RANKL,LNCaPNeo)由Leland Chung博士友情提供(Cedars-Sinai醫療中心)。MDA-MB-435和MDA-MB-231被維持在DMEM中(5%CO2下,10%v/v胎牛血清(FBS,Sigma-Aldrich),和1%v/v青黴素/鏈黴素(Sigma-Aldrich))。H1993和A2780細胞被維持在RPMI中(5%CO2下,10%v/v FBS和1%v/v青黴素/鏈黴素)。Cos-7細胞維持在DMEM/F12培養基中(5%CO2下,20%v/v非加熱鈍化胎牛血清(ATCC 30-2020)和1%v/v青黴素/鏈黴素(Sigma-Aldrich))。LNCaPNeo/RANKL、LNCaPNeo被維持在RPMI培養基中(10%v/v FBS,和1%v/v青黴素/鏈黴素和200μg G418重硫酸鹽溶液(Sigma Aldrich G8168))。將200μg/mL潮黴素(GEMINI生物產物400-123)添加至LNCaPNeo/RANKL細胞的培養基以維持RANKL表達質粒。為了維持細胞系之間的等同匯合度,在某些分析中,根據其生長率來塗覆它們。
DNA構建體。靶向構造物(InlB-PBK10)是通過兩步克隆法產生(圖8A中概括),其中編碼InlB和PBK10的序列順序地一起被連接到蛋白表達質粒pRSET-A(Invitrogen,Carlsbad,CA,USA)中。編碼內化蛋白B的aa 36-321的質粒構造物(pMET-30-InlB321)(CeBiTec),Bielefeld University,Germany)被用作聚合酶鏈式反應(PCR)擴增的模板,使用分別包含序列5』-AGTGAGCTCGAGACTATCACTGTG-3』(SEQ ID NO:1)和5』-GTTGGTGACTTTCTCCCACCTTCACCACCTTCATCTAGATATCCATGGTAT-3』(SEQ ID NO:2)的正向和反向低聚核苷酸引物。SacI限制性內切位點被引入正向引物中以用於框內插入p RSET-A中。BglII和KpnI限制性內切位點被引入反向引物以用於P BK10隨後框內插入InlB編碼序列的3』。反向引物還包含位於InlB和PBK10序列中間的編碼柔性聯結子(GlyGlySerGlyGlySer)(SEQ ID N O:3)。800bp InlB PCR產物用SacI和KpnI消化以連接到pRSET-A中。所得構造物pRSETA-InlB隨後用BglII和HindIII消化以容納與I nlB在框內的PBK10的插入。使用BamHI和HindIII限制酶從質粒p RSET-PBK10中切除PBK10,並且插入pRSETA-InlB的BglII-HindII I位點中,產生pRSET-InlB-PBK10構造物。
通過用SacI和BglII消化先前描述的800bp InlB PCR產物並且將其連接到pRSETA-GFP質粒中以用於InlB321的框內克隆,製得pRSETA-GFP-InlB構造物,其將InlB321編碼為綠色螢光蛋白(GFP)的羧基[C]端融合。
細菌的蛋白表達和純化。將BLR(DE3)pLysS(Novagen,Madison WI,USA)細菌轉化體的過夜培養物1:50接種於包含0.5mg/ml氨苄西林和0.034mg/mL氯黴素和0.0125mg/ml四環素的LB中。當培養物在600nm光密度波長(OD 600)下達到0.6的吸光率讀數時,培養物用0.4mM IPTG誘發並且在37℃下伴隨振動進一步生長3小時。收穫培養物並且壓成丸。細胞團塊再懸浮於溶解緩衝液(50mM Tris,pH 8.0,50mM NaCl,2mM EDTA,pH 8.0)中,並且通過添加0.1%Triton X-100和一個循環的凝固-解凍將其溶解,其中1mM苯基甲基磺醯氟化物(PMSF)在解凍期間添加。解凍之後,溶解產物接受10mM MgCl2,和0.01mg/mL DNase,並且溶解產物在室溫下搖晃10分鐘以允許在溶解產物恢復至冰之前消化基因組DNA,此後它們接受300mM NaCl和10mM咪唑。溶解產物轉移至預冷卻離心管,配平,並且在4℃下於預冷卻轉子中以39,000x g離心1小時。回收上清液,添加至用MCAC-10(50mM NaH2PO4,300mM NaCl,10mM imidazole,和1%Triton X-100,pH 8.0)預平衡的Ni-NTA樹脂(Qiagen,Valencia,CA,USA),並且在冰上培育1小時。將包含結合蛋白的樹脂洗滌,一次用20mL MCAC-10緩衝液在冰上10分鐘搖晃,三次用MCAC-20(50mM NaH2PO4,500mM NaCl,20mM咪唑,和10%甘油,pH 8.0),隨後用50mM Na-磷酸鹽(pH 8.0)、300mM NaCl、250mM咪唑和10%甘油的2mL溶液洗提。蛋白質同時地緩衝交換到低鹽緩衝液中並且通過超濾作用濃縮(Amicon Ultra Centrifugal Filters-Ultracel-50K(Millipore,Bedford,MA,USA),並且使用BioRad蛋白定量分析(BioRad Laboratories,Hercules,CA,USA)測量其濃度。
蛋白質檢測。在本領域已知的不連續凝膠緩衝系統中執行變性聚丙烯醯胺凝膠電泳。使用設定在恆壓(20V)下的BioRad半乾轉移細胞中的192mM甘氨酸、25mM Tris和20%甲醇,歷時40分鐘,將蛋白質電學轉移到硝化纖維上。印跡用Tris-緩衝鹽水中的3%牛血清白蛋白(10mM Tris,pH 7.5,150mM NaCl)阻斷。印跡以阻斷緩衝液中以1:1500稀釋用抗RGS-His Tag抗血清(Qiagen)過夜培育。抗體-抗原複合物通過以下方式檢測:用辣根過氧化酶(HRP)軛合二級抗體(Sigma,St Louis,MO USA)培育,隨後與HRP底物和化學發光檢測試劑(Thermo Fisher)反應,以及暴露於膜(Hyperfilm ECL;Amersham Pharmacia Biotech)。
用於c-MET細胞表面表達的基於ELISA的分析。為確定細胞系上的c-MET水平,使用以下細胞數量將細胞塗覆於96孔板中:每孔8x103MDA-MB-231、MDA-MB-435、A2780、LNCaPNeo/RANKL、LNCaPNeo以及9x103H1993和LAPC4。48小時後培養基被吸出,並且細胞簡單用包含1mM MgCl2和1mM CaCl2(PBS+)的磷酸鹽緩衝鹽水(PBS)洗滌,隨後在室溫下(RT)用12分鐘固定於PBS中的4%PFA內,隨後用PBS+(200μL每孔)洗滌3次,然後在阻斷溶液中(3%BSA/PBS,100μL每孔)在室溫下培育1小時。抗c-MET抗體(小鼠單克隆抗c-MET,按0.87μg/mL使用;Knudson博士)一式三孔地添加(100μL每孔)並且在室溫下培育1小時。細胞用PBS+洗滌3次,並且在室溫下用HRP-軛合二級抗體以1:2000稀釋培育1小時。細胞用PBS+洗滌3和用蒸餾水洗滌一次,並且根據製造商指示,將100μL TMB(eBioscience)溶液添加至各孔。所述板用底物在黑暗中培育30分鐘(或直至看就藍色顯色),並且通過添加100μL的1N HC1來終止。在450nm處於Spectra MaxM2板式讀數器(Molecular Devices Corp.)中測量吸光率。隨後執行結晶紫分析以確定相對細胞數量。簡單地說,細胞用PBS+(200μL/孔)洗滌一次並且用0.1%結晶紫(100μL/孔)在室溫下培育15分鐘。細胞用PBS+(200μL/孔)徹底洗滌4次,並且在室溫下用95%乙醇(100μL/孔)培育10分鐘。在490nm處測量吸光率。
細胞結合分析。為確定不同濃度InlB-PBK10對細胞的結合,按以下濃度將細胞塗覆於96孔板中∶每孔8x103LNCaPNeo/RANKL、LNCaPNeo和9x103H1993和LAPC4。在48小時後,培養基被吸出並且細胞簡單用100μL緩衝液A(無血清DMEM,20mM HEPES,pH 7.4,2mM MgCl2,3%BSA)洗滌。細胞用包含指示濃度的InlB-PBK10的50μL緩衝液A在4℃下在冰上伴隨攪動培育1小時。細胞用PBS+(200μL/孔)洗滌一次,並且經受先前描述的細胞表面ELISA(用於c-MET的細胞表面表達ELISA),並作以下更改∶為檢測InlB-PBK10,板用一級抗體(RGS-His;Qiagen)以1:1500稀釋過夜培育,並且用二級抗體(山羊抗小鼠,1:2000稀釋)在室溫下培育1小時。
為了競爭性抑制分析,在添加InlB-PBK10之前,使指示濃度的InlB在細胞上培育。特定而言,按先前描述塗覆的細胞系簡單地用100μL緩衝液A洗滌,隨後在包含1μM、5μM或10μM InlB的50μL緩衝液A中在4℃下伴隨攪動培育1小時。細胞用緩衝液A(100μL/孔)洗滌一次,並隨後用包含1μM InlB-PBK10的50μL緩衝液A以4℃下伴隨攪動在冰上培育1小時。細胞用PBS+(200μL/孔)洗滌一次,並且處理以用於先前描述的表面結合的免疫檢測,不同的是板用識別InlB-PBK10的五鄰體基底域的抗體(Ad5抗體;Abcam)以1:5000稀釋培育。板用二級抗體(山羊抗兔,1:2000稀釋)在室溫下培育1小時。如解釋針對c-MET細胞表面表達ELISA解釋的那樣檢測結合。
細胞存活率分析。MDA-MB-435細胞以8x103細胞每孔塗覆於96孔板中。48小時後的培養基被吸出,並且用包含不同濃度的InlB-PBK10-Ga和S2Ga(1、5和10μM)的30至50μL培養基在5%CO2培育箱中37℃下在搖擺器上培育4小時。4小時培育周期之後,添加額外的培養基來使每孔總容量達到100μL,並且細胞在不搖晃的情況下培育大約24小時。使用Promega CellTiter 96水性非放射性細胞增殖分析來測量細胞生活力。移除培養基,並且將100μL新鮮培養基添加至孔。根據製造商指示,將2.0mL MTS溶液與100μL PMS溶液混合併且添加20μL至各孔。板在37℃下經5%CO2培育,並且在添加MTT試劑之後1小時和2小時,在490nm處讀取吸光率。隨後執行結晶紫著色以確定相對細胞數量。簡單地說,細胞用包含1mM Ca2+和1mM Mg2+的PBS+洗滌,隨後用0.1%結晶紫(100μl/孔)在室溫下培育15分鐘並隨後用PBS+(200μL/孔)洗滌4次。板用95%乙醇(100μL/孔)在室溫下培育10分鐘,並且在590nm處測量吸光率。
InlB-PBK10攝取/胞內運輸分析。為了InlB-PBK10攝取分析,細胞以1x105細胞/孔塗覆在12孔盤中的蓋片上並且生長2天。在治療當天,將盤轉移在冰上並且細胞針對所示實驗根據以下方法進行處理。為研究攝取的時間過程,細胞用冷PBS洗滌兩次,並隨後將含8μg的InlB-PBK10的0.4mL緩衝液A添加至各孔。在冰上培育盤1小時並在4℃下搖晃以促進受體結合而不是內化,並隨後用冷PBS洗滌細胞以移除未結合蛋白質。孔隨後接受預溫熱完全培養基,並且以37℃下以5%CO2培育盤至指示時間點。個別蓋片隨後被移除,用PBS/1%MgCl2洗滌3次,隨後在室溫下用4%多聚甲醛固定於PBS中15分鐘。蓋片用PBS洗滌3次,隨後在室溫下,用PBS中50mM氯化銨培育5分鐘,用PBS中0.1%Triton X-100培育5分鐘,並隨後用PBS中1%BSA阻斷30分鐘。蓋片上細胞用一級抗體在4℃下過夜培育,用PBS洗滌3次並且在室溫下在黑暗中用二級抗體培育1小時。在有指示的情況下,針對肌動蛋白和細胞核而復染色的細胞在二級抗體培育期間用Texas Red x-鬼筆環肽(Invitrogen T7471)以1:100稀釋培育,隨後在DAPI中以300nM最終濃度培育5分鐘。鬼筆環肽、DAPI和一級和二級抗體全部烯釋於PBS中1%BSA內。在二級抗體和DAPI治療之後,蓋片上細胞用PBS洗滌3次並且在Prolong Antifade封固劑(Molecular Probes,Eugene,OR,USA)中封固。為檢測InlB-PBK10,以1:150稀釋使用RGS-His抗體(Qiagen),並且將螢光團軛合山羊抗小鼠(FITC-軛合)以1:500稀釋用於在488nm處螢光檢測InlB-PBK10,在405nm處(DAPI)螢光檢測細胞核以及在532nm處(Texas red)螢光檢測F-Actin。
InlB-PBK10-Dox(I-Dox)組裝。病毒衣殼衍生融合蛋白質InlB-PBK10遵循嚴格建立的程序與阿黴素組裝。簡單地說,通過將等於摩爾濃度的30鹼基低聚核苷酸、LLAA-5(5'-CGCCTGAGCAACGCGGCGGGCATCCGCAAG-3')(SEQ ID NO:4)和其對應反向補充物LLAA-3混合到一起來製備互補低聚核苷酸雙鏈。混合物沸騰5分鐘並且歷時30分鐘冷卻至室溫以促進低聚核苷酸的退火。雙鏈低聚糖以1:10摩爾比率(DNA:Dox)與Dox混合,並且在室溫下(RT)培育30分鐘,隨後用InlB-PBK10以6:1摩爾比率的InlB-PBK10:DNA-Dox於HBS中培育,並且使用50k MW截止(mwco)過濾膜進行超濾(其通過用10%甘油預培育2小時至過夜來製備)以從不完全組裝的組分中分離I-Dox。複合物以4000x g離心15分鐘或直至體積減少≥80%。I-Dox中的Dox濃度通過依照Dox吸光率或螢光校準曲線(SpectraMax,Molecular Devices,USA)推斷480nm處的測得吸光率或590nm處的螢光來確定(Ex:480nm)。Dox的濃度通過應用Beer-Lambert公式來計算∶(在λ最大/Dox消光係數下的吸光率)×稀釋因子=濃度(M),使用的Dox係數為11,500M-1cm-1。實驗中所用I-Dox劑量是基於I-Dox中Dox濃度計。
InlB-PBK10-Ga組裝。通過用InlB-PBK10在黑暗中4℃下伴隨輕輕攪動培育10x摩爾過量咔咯達1h,使InlB-PBK10與磺化鎵咔咯(S2Ga)非共價地組裝。通過50K MW截止旋轉柱過濾器(Millipore Corporation,Billerica,MA,USA)根據製造商的過濾程序進行超濾來移除未結合的咔咯,並且複合物用PBS洗滌,直至濾液澄清。滲餘物在過濾法中保持其亮綠色(指示咔咯顏料)。滲餘物再懸浮於PBS中並且在咔咯的λ最大處測量吸光率以獲得先前描述的咔咯濃度。然而,當結合至蛋白質時,S2Ga的λ最大(例如)從424nm移動至429nm,這未顯著地改變對複合物中咔咯濃度的估計。
FACS分析。為評估InlB321的結合,將H1993和Ln GFP細胞培養48小時。在用PBS洗滌兩次之後,通過在2mM EDTA中37C下培育5至10分鐘分離細胞。將包含0.01%MgCl2和CaCl2(0.01%PBS+)的PBS添加至所述細胞,並且以2000rpm旋轉4分鐘。細胞再用0.01%PBS+洗滌3次,再懸浮,計數,並且分入Eppendorf管中。所述管以300x g旋轉2分鐘,並且用包含指示濃度InlB的PBS中3%牛奶再懸浮,並且在低溫室中在冰上培育1小時。細胞隨後用PBS洗滌4次並且在室溫下用PBS中3%BSA內烯釋150倍的RGS-His抗體培育30分鐘。細胞洗滌4次,然後用二級抗體抗體(Alexa Fluor647、山羊抗小鼠IgG(H+L))在3%BSA中再懸浮,並且在室溫下培育30分鐘。細胞洗滌4次,用0.1%PFA培育15分鐘,並隨後再洗滌4次,並且用Beckman Cyan ADP FACS機器分析。
為驗證由InlB321進行的細胞結合是通過c-MET進行,InlB321和MET肽(YCP2247SPEED BioSystems.Rockville,MD)在冰上在1xPBS中3%牛奶內培育30至40分鐘,然後結合至細胞。結合分析如以下所述進行。
細胞拉下實驗。使用1x PBS中2mM EDTA在37℃下伴隨攪動5至10分鐘,提升生長48小時的MDA-MB-435細胞。在以300x g將細胞旋轉5分鐘之後,將細胞洗滌一次並且再懸浮於緩衝液A+3%BSA並且分入4個Eppendorf管(2x 106細胞/管)。細胞再旋轉並且再懸浮到500μL的緩衝液A+3%BSA中。在3個管中,添加0.4μM、2μM和4μM,並且未添加蛋白質至第四管;所有管皆在冰上培育1小時。在洗滌和旋轉所有細胞以移除未結合InlB之後,將500ul緩衝液A中0.4μM的InlB-PBK10添加至所有4個管,隨後在冰上搖晃2小時以促進受體結合而不是內化。如先前描述,細胞洗滌並且旋轉3次。團塊隨後懸浮在50μL SDS-PAGE樣本緩衝液中,並且通過SDS-PAGE/Wesrten印跡使用對InlB-PBK10特異性的抗體(Ad5抗體,其識別五鄰體基底)以1:5000稀釋來評估。
實施例3∶攜帶雙側脅腹MDA-MB-435腫瘤的nu/nu小鼠中的Inl-PBK10生物分布
背景
如圖6中名稱為「靶向c-Met的蛋白質納米構造物」的先前實例所示,MDA-MB-435細胞顯示出細胞表面上c-MET的標記水平。此外,如圖7E所示,c-MET靶向蛋白質構造物InlB-PBK10通過被c-MET配體InlB競爭性抑制的相互作用來結合這些細胞,表明該構造物可通過c-MET結合這些細胞。圖8示出InlB-BK10在受體結合之後進入這些細胞,並且圖9C示出該蛋白質可介導膜不可滲透毒性分子(鎵金屬化咔咯)遞送到這些細胞中,導致細胞死亡(從而還驗證Inl-PBK10能夠體內膜分裂)。
結果
在此,我們評估了用MDA-MB-435腫瘤評估Inl-PBK10在小鼠中的生物分布,以評價其是否能夠在活體內在這些腫瘤上積累。為此,攜帶MDA-MB-435腫瘤的雙側脅腹異種移植的雌性nu/nu小鼠接受單次尾靜脈注射Alexa680標記InlB-PBK10(2nmol蛋白質),並且使用640nm激發和700nm發射過濾器,通過在注射之後所示時間點的Xenogen成像來成像。整體動物成像顯示出在注射之後4小時,動物中的螢光完全清除(圖10A)。4小時時間點之後,將小鼠處死並且移除腫瘤和組織用於進一步成像。雖然腫瘤顯示一些螢光累積,但顯著比例的注入材料經4小時被排除至腎臟,同時可在肝臟檢測到一些螢光(圖10B)。剩餘組織,包括心臟、脾、肺、腦和骨骼肌,未顯示可檢測螢光(圖10B)。進一步研究將必需在較早和較晚時間點的組織收穫來確定向腎的遞送是否是迅速清除的結果,以及確定在競爭性抑制劑情況下確定生物分布以驗證腫瘤遞送經由c-MET發生。
實施例4∶腦轉移性乳腺腫瘤的納米生物靶向
人類表皮生長因子受體亞基3(HER3)的細胞表面水平升高與轉移性乳腺腫瘤相關,包括擴散至腦部的那些乳腺腫瘤。然而,大量靶向療法當前是使用來與周圍性乳腺腫瘤鬥爭,這些分子向腦轉移的遞送受血腦屏障(BBB)限制。這通過轉移至腦部的HER2+乳腺腫瘤來例證∶這些腫瘤雖然在中樞神經系統(CNS)外可由HER2抗體(諸如曲妥單抗)靶向,但不能由這些相同抗體觸及,因為HER2亞基雖然存在於腦部內皮上,但不介導跨血管壁的抗體轉胞吞。
在另一方面,HER3在配體結合時經歷跨腦部內皮的迅速轉胞吞,所述迅速轉胞吞通常發生來介導對神經調節蛋白生長因子的遞送以用於神經生長和維持。我們已研發出自組裝納米生物學顆粒HerMn,其使用HER3作為入口以用於毒性分子向腫瘤細胞中的靶向進入。HerMn是10至20nm直徑的血清穩定顆粒,其由受體靶向細胞滲透蛋白HerPBK10組成。所述HerPBK10與磺化錳(III)咔咯(S2Mn或Mn-咔咯)非共價組裝(圖11)。HerPBK10的靶向結構域來源於配體(調蛋白α),其特異性地與人類表皮生長因子受體亞基3(HER3)相互作用並且誘發迅速受體介導胞吞作用。因為HER3是HER2的優選二聚作用配偶體,並且HER2-3異源二聚體在HER2+上很普遍,我們先前已展示HerPBK10可將治療性和成像分子靶向至小鼠中的HER2+腫瘤,與化學療法藥劑(阿黴素)相比,在>10x的更低劑量下介導腫瘤生長消融,同時節約心臟和肝臟組織,並且沒有可檢測的免疫原性。HerMn的腫瘤靶向毒性通過線粒體膜分裂和對細胞骨架的超氧化物介導損害來發生。由於咔咯的順磁性質,HerMn還可以通過磁共振成像(MRI)引出腫瘤選擇性檢測。
HerMn似乎在全身性注射於小鼠之後分布至腦部,另外顯示出優先歸巢和對皮下HER2+腫瘤的毒性。有趣地,由於其在正常組織上的抗氧化劑活性,錳咔咯已知顯示出神經保護作用。在支持中,HerMn支持人類心臟病細胞活體外存活率。總而言之,有趣的是猜測HerMn可能具有對腦轉移性乳腺腫瘤的靶向毒性,同時節約脫靶組織,因為其具有靶向能力和向正常組織諸如腦部和心臟提供有益保護效應的能力。
背景
腦轉移是嚴重臨床問題。乳腺癌轉移至腦部的患者平均倖存小於1年。雖然已出現不斷增長的靶向療法用於治療周圍性腫瘤,但大多數都不適合於治療腦轉移,因為它們不能跨越血腦屏障(BBB)。對此的實例為使用單克隆抗體(曲妥單抗(Tz)),其是針對人類表皮生長因子受體亞基2(HER2)用於治療HER2+乳腺癌。HER2+癌症與侵襲性腫瘤、對標準療法的不順應性、轉移、和死亡率增加相關。轉移至腦部的HER2+腫瘤不可能用Tz治療,因為HER2雖然存在於腦內皮上,但不跨血管壁胞吞轉運(transcytose)。三陰性乳腺癌(TNBC)是HER2-轉移性以及腦轉移性的,並且因為缺乏特異性細胞表面生物標記而具有甚至更少的選擇。雖然拉帕替尼(Lapatinib;Lp)(HER2和EGFR的小分子酪氨酸激酶抑制劑(TKI))可以容易地透過細胞膜以靶向這兩種腫瘤類型,但這些腫瘤可能部分地由於HER3升高而抗此類抑制劑。
結果
HerPBK10對HER3具有特異性。HerPBK10包含HER3配體的受體結合區域,調蛋白-α(胺基酸35-239,包含Ig樣和EGF樣結構域),融合至來源於腺病毒五鄰體基底衣殼蛋白質的膜滲透部分(圖11A)。HerPBK10初始設計為非病毒基因轉移載體,在單個多疇蛋白質分子內包含有效負載組裝、靶向、內化和體內滲透功能。因為HER3是HER2的優選二聚作用配偶體,並且HER2-3異源二聚體在HER2+上很普遍,已表明HerPBK10可將治療性和成像分子靶向至小鼠中的HER2+腫瘤,與化學療法藥劑(阿黴素)相比,在>10x的更低劑量下介導腫瘤生長消融,同時節約心臟和肝臟組織,並且沒有可檢測的免疫原性。
HerPBK10對HER3的特異性由其結合至包含人類HER3的胞外結構域的固定化肽的能力支持(圖12A)。這受到在活體外游離HER3肽情況下HerPBK10的預吸附的抑制(圖12A)。相同肽還抑制對人類(圖12B)和小鼠(圖13B-C)HER3+細胞兩者的結合。特別地,小鼠和人類HER3的配體結合結構域享有很高(94%)序列同一性(圖13A)。雖然HER2-3異源二聚體在HER2+腫瘤細胞上很普遍,但異源二聚化抑制抗體(帕妥珠單抗(Pz))不阻止HerPBK10對細胞HER3的結合(圖12B),從而表明HER2-3二聚作用並非HerPBK10結合所必要的。結合也不受HER4肽或β細胞素(其阻斷HER4)抑制(圖12B),從而表明HerPBK10是HER3特異性的。
在培養物中,來自HER2+患者和年齡匹配對照物的血清未阻止HerPBK10對HER2+細胞的結合(並且表明彼此之間無顯著差異),與添加過量重組配體(+Her)用作競爭性抑制劑形成對比(圖12C)。先前研究已表明HerPBK10在免疫能力小鼠中的重複劑量未產生針對該蛋白質的可檢測中和抗體形成。此外,在培養物中,可識別HerPBK10的針對整體腺病毒產生的多克隆抗體未阻止受體結合至細胞。
HerPBK10與Mn-咔咯自組裝以形成HerMn納米顆粒。HerPBK10的羧基[C]-端包含十賴氨酸尾部(圖11A),其可以介導對陰離子分子(包括咔咯)的親電子結合。咔咯是與卟啉具有結構相似性的大環分子,並且同樣地可以包含金屬配體(圖11B)。磺化咔咯是兩親的,可溶於生理溶液,並且可以通過非共價相互作用(包括親電子和疏水性相互作用)自發地結合蛋白質。因為受帶負電細胞膜的排斥,陰離子磺酸基團阻止非特異性細胞進入,從而實現經由載體蛋白質將咔咯引導到靶細胞中的可能性。我們已將HerPBK10與磺化錳(III)咔咯(S2Mn或Mn-咔咯)組合以形成稱為HerMn的迅速自組裝10-20nm直徑顆粒(圖11C-D)。這些顆粒包含結合至單個蛋白質(25-35咔咯/蛋白質)的多個咔咯分子,並且可以經得起高速超濾作用。這些發現與我們先前的研究和我們合作者的研究相一致,表明咔咯可以以可忽略解離結合於蛋白質袋(pockets)中,並且一旦結合至HerPBK10,則抵抗轉移至血清蛋白質。
HerMn靶向HER3+腫瘤。在培養物中,HerMn顯示出對HER2+/HER3+而不是HER2-/HER3-腫瘤細胞的靶向毒性,同時Mn-咔咯對細胞存活率無影響。數據示於圖14中,其中各細胞系接受指示濃度的HerMn或S2Mn,並且在24小時後經由結晶紫(CV)著色評價存活率。每個濃縮物的N=3,來自3個單獨實驗。已表明,HerPBK10的靶向配體誘發受體結合之後的迅速胞吞作用。因為磺化咔咯不可能自主破壞體內膜,HerPBK10的五鄰體基底部分實現胞吞攝取之後的有效膜分裂,以及向細胞質中的進入。
在一個實驗中,細胞接受10μM S2Mn或HerMn,隨後在24小時後接受HBSS中TMRM(30nM)。結果示於圖15A中,其中對照物是PBS治療。共焦螢光圖像(圖15B)示出在MDA-MB-435細胞上培育24小時之後,肌動蛋白(紅色)和微管蛋白(綠色)通過HerMn(5μM)而超氧化物介導瓦解。S2Mn(5μM)、HerPBK10(與HerMn等同的蛋白質濃度)和PBS充當對照物。另外的細胞接受Tiron(5mM)1小時,然後HerMn治療。藍色,細胞核。比例尺=10μm
一旦處於細胞質中,HerMn瓦解(collapse)線粒體膜電勢(圖15A)以及通過超氧化物升高和對細胞骨架(圖15B)的氧化損害使這些細胞骨架瓦解,與鎵(III)咔咯(S2Ga或Ga-咔咯)一致。
人們發現,Ga-咔咯直接結合線粒體外部膜蛋白TSPO。圖16中展示結果。可溶解重組TSPO蛋白用S2Ga在室溫下以等同摩爾濃度(1μM)培育約20分鐘,隨後超濾以移除游離、未結合S2Ga。通過測量吸光率和螢光光譜,針對TSPO蛋白結合咔咯的存在,評估滲餘物。在有指示的情況下,將PK11195用作用於TSPO上卟啉結合部位的競爭性抑制劑(圖16A-B)。存在HerGa與TSPO原位相互作用的證據。在細胞用HerGa處理並且檢驗HerGa-介導線粒體分裂之前24小時,MDA-MB-435細胞用表達外源TSPO的質粒(作為內源性TSPO結合的競爭性抑制劑)轉染,證據為線粒體中的紅色螢光染料累積減少並且細胞質中綠色螢光積累(圖16C-D)。
TSPO移位卟啉和其他代謝物到線粒體中以用於處理,與線粒體磁導率轉變核孔複合物的組分相互作用,並且有助於細胞體內平衡。Ga-咔咯特異性識別TSPO上的卟啉結合部位(圖16A-B),因為咔咯結合可以受PK11195競爭性抑制,這抑制卟啉結合至TSPO。重組可溶解TSPO於MDA-MB-435細胞中的過表達阻止線粒體膜電勢的咔咯-介導分裂(圖16C-D),表明咔咯與TSPO原位相互作用。因為Mn-咔咯顯示與Ga-咔咯類似的線粒體膜分裂,很可能TSPO是Mn-咔咯的分子靶標。在異種移植小鼠腫瘤模型中,HerMn在全身性遞送之後活體內歸巢至腫瘤,繞過包括心臟在內的大多數正常組織(圖17),並且以極低藥理學劑量(0.008mg/kg)消融腫瘤生長(圖18A)。Mn-咔咯還是順磁的,從而可用於MRI。
已發現,除在小鼠中全身性遞送之後積累於腫瘤中以外,與曲妥單抗(Tz)相反,HerMn可以分布至腦部(圖17)注入無腫瘤小鼠的尾靜脈中的HerPBK10還示出腦定位,而PBK10的全身性遞送(其缺乏HER3靶向配體)未示出可檢測的腦部遞送(圖19)。已發現,HerMn不但對人類心球衍生細胞(CDC)無毒,而且在逐步升高劑量與延長暴露的情況下,增加培養物中CDC存活率,這與阿黴素(其具有已知的心肌毒性)以及單獨的HerPBK10相反,所述HerPBK10對腫瘤細胞或CDC不具有毒性或生長促進作用(圖18B)。這支持在活體外和活體內的視神經病變模型中的先前發現,表明Mn-咔咯可以是神經保護性的。這似乎對Mn-咔咯是獨特的,因為Ga-咔咯未展示此類神經保護作用。
一同地,這些發現表明HerMn給予正常組織有益作用,同時使毒性靶向腫瘤組織,尤其靶向具有升高HER3的腦轉移。HerMn的靶向特異性使得這一點不那麼相關,因為全身性顆粒的少數似乎分布至非腫瘤組織(圖17)。但是,因為相對低的咔咯水平提供神經保護,以及腫瘤毒性(圖18A),這種潛在雙活性值得探索。
應用
HerMn具有遞送毒性至腦轉移性乳腺腫瘤同時節約脫靶組織的能力,因為其具有靶向能力以及向正常組織諸如腦部和心臟提供保護的能力。
實施例5∶使用小腸結腸炎耶爾森氏菌(Yersinia enterocolitica)侵襲素衍生肽靶向β-1整聯蛋白
小腸結腸炎耶爾森氏菌是細菌病原體,其侵襲腸內上皮,尤其是腸內壁的集合淋巴結(Peyer’s patch),以及導致食物中毒。對腸內上皮的結合和進入是通過細菌侵襲素(Inv)蛋白與β-1整聯蛋白的相互作用來發生,所述β-1整聯蛋白主要表達在覆蓋集合淋巴結的上皮細胞上。
包含編碼侵襲素的核苷酸序列的質粒(pHIT123-Inv)被用作PCR模板,並且將低聚核苷酸引物設計來擴增編碼β-1整聯蛋白結合部位的最小序列(約600bp),同時將用於框內克隆的限制性內切位點引入到用於靶向遞送的外源肽中。所用引物包括以下序列∶5』-ACAGAGCTCATAACCGGCATTAACGTGAAT-3』(SEQ ID NO:6);5』-CTGTGTGCGGAGCCGCAATAGGAATTCATC-3』(SEQ ID NO:7);和5』-GATGAATTCCTATTGCGGCTCCGCACACAG-3』(SEQ ID NO:8)。這些引物被用於向Inv插入物中擴增和添加SacI和EcoRI限制性內切位點。另外的引物包括以下序列∶5』-GTCCAAAACCAAGAAAAGGCGGAGCAGCTGTAC-3』(SEQ ID NO:9);5』-ACAATGACGCGTGTACAGCTGCTCCGCCTTTTCTTGGTTTTGGAC-3』(SEQ ID NO:10);5』-CCGCTGTGTGCGGAGCCGCAAGGAGGAACGCGTACACAC-3』(SEQ ID NO:11);5』-GTGTGTACGCGTTCCTCCTTGCGGCTCCGCACACAGCGG-3』(SEQ ID NO:12);和5』-ACACACGGATCCTTGCGGCTCCGC ACACAGCGG-3』(SEQ ID NO:13)。這些引物引入MluI或BamHI限制性內切位點以用於克隆到鼓起(Knob)或全長纖維構造物中。
外源肽編碼腺病毒(Ad)衣殼纖維和鼓起蛋白質。該纖維勾劃出從Ad衣殼伸出的各個觸角樣突出物,所述突出物介導一級細胞結合以開始感染,並且包含N端長纖維軸結構域以及隨後的C端球狀鼓起域。鼓起域與細胞表面受體特異性相互作用,並且作為在不存所述軸的情況下作為可溶解蛋白質產生。當融合至PBK10時,Inv是有效配體。
使用由Inv替換鼓起亞域的兩種策略來將Inv序列插入該鼓起中,產生重組鼓起構造物:ABCJ-Inv和AGJ-Inv。重組蛋白是在細菌中從表達這些構造物的pRSET載體中產生,如N端GFP標記蛋白(GFP-ABCJ-Inv和GFP-AGJ-Inv)和未標記蛋白。在第三策略中,Inv被插入該鼓起的DG環中並且用於體外翻譯中以產生S35標記蛋白。非變性凝膠電泳示出該重組蛋白維持形成類似於野生型可溶解鼓起的低聚物(二聚物和三聚物)(從而表明該Inv插入物未混淆融合蛋白質的三級結構)。在所有情形下,產生全長可溶解蛋白質。
還產生其中Inv將全長纖維蛋白質的鼓起替換的構造物。使用杆狀病毒載體來在細菌中表達該蛋白質。產生第二纖維構造物以在全長纖維蛋白質的軸和鼓起域中間表達Inv,並且FactorX分裂位點被引入Inv和鼓起之間。
實施例6∶CD4的配體
來源於人類免疫缺陷病毒(HIV)gp120包膜蛋白的CD4結合結構域的胺基酸序列TITLPCRIKQFINMWQEVGKAMYAPPISGQIRCSS NITGLLLTR(SEQ ID No:5)足以結合至CD4。使用標準分子生物學技術獲得該序列。編碼SEQ ID NO:5的核酸序列(約132nt)被克隆到pBluescript(PSK)質粒中。溴化乙錠著色電泳凝膠示出通過BamH I-EcoRI消化從載體(約3kb)上切除了插入物(約132nt)。所得產物隨後隨後與諸如PBK10的外源肽框內插入以用於將此類遞送蛋白靶向至表達CD4的細胞(即,「助手」T-細胞)。
