具染料協同降解作用的毛栓孔菌漆酶的培養製備法及用途的製作方法
2023-12-06 11:56:01 3
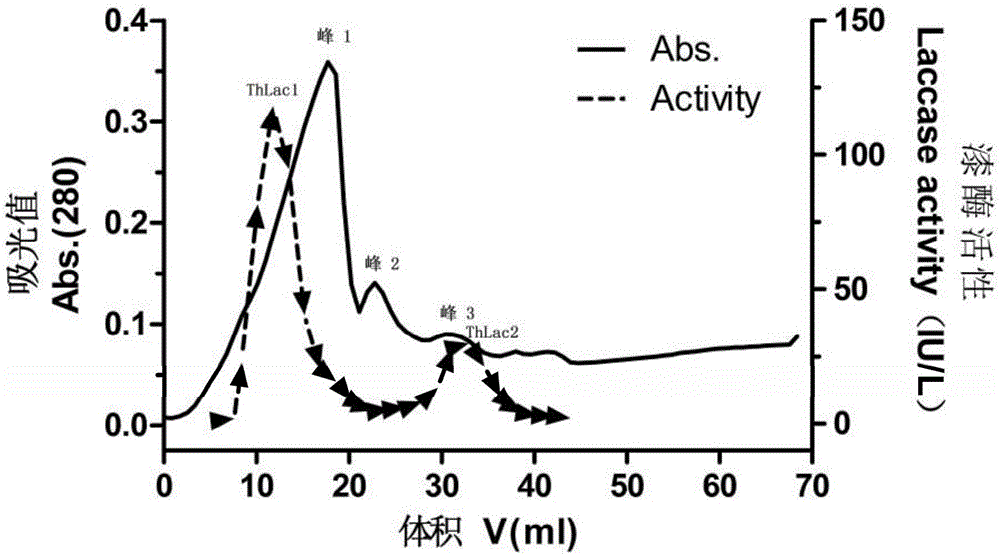
本發明涉及微生物酶學領域,具體涉及一種具有染料降解協同作用的毛栓孔菌漆酶的培養及其製備方法。
背景技術:
:漆酶(laccase,EC1.10.3.2)是一種含銅的多酚氧化酶,與植物中的抗壞血酸氧化酶、哺乳動物血漿中的銅藍蛋白一起同屬於銅藍氧化酶家族。漆酶能從底物或介體中獲得電子,然後再把電子傳遞給分子氧,最後形成水。由於漆酶催化機理的特殊性,使得其作用底物非常廣泛。據統計漆酶能催化氧化6大類250餘種化合物,包括酚類及其衍生物、芳胺類及其衍生物、羧酸及其衍生物、甾體激素和生物色素、金屬有機化合物、以及其他的非酚類物質等。漆酶底物的廣泛性及其在環境中的穩定性,所以它在造紙工業、染料脫色、食品和飲料工業、生物傳感器和環境汙染物的治理等方面具有較大的應用價值。染料工業中的廢水處理是目前漆酶應用具有較大前景的領域之一。當前,世界染料年產量約為9×105噸,其中約有10%-15%的染料隨著廢水排入環境中,造成水體透光率低,導致水體生態系統的破壞。國內外常用的處理方法包括物理化學法和生物法。物理化學法包括絮凝沉降法、吸附法、化學氧化法、離子交換法和電解技術等,但是處理費用高,可能造成二次汙染的問題。生物法是利用生物體或者酶來降解廢水中的染料。相比之下,生物法是一種經濟有效的處理方法。其中,漆酶被認為是一種非常有效環保的方法,因為漆酶可在有氧條件下,降解不同結構的多種染料,並最終將它們轉化為CO2和H2O。真菌(特別是白腐真菌)是漆酶的主要生產者,是目前研究漆酶最廣泛和深入的生物體,主要集中在革蓋菌(Coriolus)、栓菌(Trametes)、原毛平革菌屬(Phanerochaete)和密孔菌(Pycnoporus)等各屬中。目前對於真菌漆酶的研究主要表現在漆酶活性誘導、漆酶理化性質研究、漆酶的固定化、以及漆酶在汙染物降解、生物質轉化、生物傳感器等方面。對於同種真菌中漆酶同工酶的誘導培養研究較少,特別是同種真菌菌株中不同漆酶蛋白相互間的協同脫色能力未有報導。技術實現要素:本發明要解決的技術問題是提供一種具有染料降解協同作用的毛栓孔菌漆酶的培養製備法,其屬於誘導毛栓孔菌產生多種漆酶同工酶的培養方法以及對於染料降解具有協同作用的漆酶製備技術。為了解決上述技術問題,本發明提供一種具染料協同降解作用的毛栓孔菌漆酶的培養製備法,包括如下步驟:1)、毛栓孔菌TrameteshirsutaMX2先在固體培養基上於28±0.5℃恆溫培養7±1天,從而實現活化;將活化後的毛栓孔菌放入發酵培養基中,於150±10r/min、28±0.5℃下恆溫振蕩培養13±1天,所得的發酵液離心(4000±200rpm/min離心30±5min),離心後所得上清液為粗酶液;2)、將上述粗酶液分離純化,得到兩種漆酶同工酶,分別記為ThLac1和ThLac2;所述分離純化包括超濾濃縮、硫酸銨沉澱透析、離子交換層析和凝膠層析;①、所述超濾濃縮為:將所述粗酶液放入濾膜孔徑為10kDa的超濾管中,離心(4℃、4000±200rpm/min離心30±5分鐘),得超濾液;②、所述硫酸銨沉澱透析為:在超濾液中加入(緩慢加入)硫酸銨,使溶液中硫酸銨的質量濃度達到80±2%,4℃過夜(即,12小時),離心(4000±200rpm/min離心30±5分鐘),將沉澱用少量(即,為只需使沉澱溶解的量)0.05mol/L醋酸鈉緩衝液(pH4.8)溶解,得酶液;將酶液裝入孔徑為12~14kDa的透析袋中,用50±5體積倍於酶液的0.05mol/L醋酸鈉緩衝液(pH4.8)透析24±1h,透析過程中更換相同體積量的醋酸鈉緩衝液2~4次(較佳為3次);得透析液;③、所述離子交換層析為:將上述透析液上層析柱(例如以0.4mL/min的流速),所述層析柱為DEAE-SepharoseFF層析柱(25×16mm);用0~0.5mol/LNaCl溶液和0.05mol/L醋酸鈉緩衝液(pH4.8)進行洗脫(梯度洗脫),流速0.8mL/min,將具有相同活性的組分進行合併;收集由5.8%體積含量的NaCl溶液和94.2%體積含量的醋酸鈉緩衝液組成的洗脫液對應的所得物,超濾濃縮,得ThLac1離子交換液;收集由13.3%體積含量的NaCl溶液和86.7%體積含量的醋酸鈉緩衝液組成的洗脫液對應的所得物,超濾濃縮,得ThLac2離子交換液;④、所述凝膠層析為:將ThLac1離子交換液、ThLac2離子交換液分別進行以下操作:將其(離子交換液)加入層析柱,所述層析柱為SephacrylS-200層析柱(90×1.6cm);用0.05mol/L醋酸鈉緩衝液(pH4.8)以0.15mL/min的流速洗脫,將有活性的組分合併後超濾濃縮;ThLac1離子交換液對應所得的為純化漆酶ThLac1;ThLac2離子交換液對應所得的為純化漆酶ThLac2。作為本發明的具染料協同降解作用的毛栓孔菌漆酶的培養製備法的改進:步驟1)中的發酵培養基為:碳源20克,酵母提取物10克,磷酸二氫鉀2克,硫酸銨2克,七水硫酸鎂0.5克,氯化鈣0.1克,蒸餾水1000ml。備註說明:該發酵培養基pH自然。需常規滅菌(即,1.0×105Pa、121℃滅菌30min滅菌)。作為本發明的具染料協同降解作用的毛栓孔菌漆酶的培養製備法的進一步改進:碳源為白楊、毛竹、或者木質素磺酸鈉。具體而言:上述白楊、毛竹為過60目篩的木屑或竹屑。作為本發明的具染料協同降解作用的毛栓孔菌漆酶的培養製備法的進一步改進:所述步驟1)的固體培養基為馬鈴薯葡萄糖培養基。配方為:馬鈴薯(去皮)200克,葡萄糖20克,瓊脂15克,蒸餾水1000ml,pH自然。1.0×105Pa、121℃滅菌30min滅菌即可。該配方屬於常規配方。作為本發明的具染料協同降解作用的毛栓孔菌漆酶的培養製備法的進一步改進:所述步驟2)的步驟③和步驟④中的超濾濃縮均為:放入10kDa的超濾管中,離心(4℃、4000±200rpm/min離心30±5分鐘)。作為本發明的具染料協同降解作用的毛栓孔菌漆酶的培養製備法的進一步改進:所述步驟1)中:取1×1cm大小的活化後毛栓孔菌的菌餅放入至100mL發酵培養基中進行培養。在本發明的培養製備法中,步驟③的離子交換層析具體為:將DEAE-SepharoseFF層析柱(25×16mm)接入AKTApurifier蛋白純化系統,以5mL/min流速的0.05mol/L醋酸鈉緩衝液(pH4.8)平衡,使記錄儀上的UV信號與基線重合;再將上述透析液以0.4mL/min的流速上層析柱,待UV信號返回基線後,用0-0.5mol/LNaCl溶液和0.05mol/L醋酸鈉緩衝液(pH4.8)進行洗脫(梯度洗脫),流速0.8mL/min,FractionCollectorFrac-920收集器收集70管,每管1mL;測定每管的漆酶活性,將具有相同活性的組分進行合併,即,將第6~11管合併(對應的洗脫液中,NaCl溶液的體積含量為5.8%,醋酸鈉緩衝液的體積含量為94.2%),將第19~23管合併(對應的洗脫液中,NaCl溶液的體積含量為13.3%,醋酸鈉緩衝液的體積含量為86.7%);將2種合併後的所得物分別進行超濾濃縮,從而分別對應的獲得ThLac1離子交換液和ThLac2離子交換液;步驟④的凝膠層析具體為:將SephacrylS-200層析柱(90×1.6cm)接入AKTApurifier蛋白純化系統,以1mL/min流速的0.05mol/L醋酸鈉緩衝液(pH4.8)平衡,使記錄儀上的UV信號與基線重合;將上述離子交換液加入層析柱,然後用0.05mol/L醋酸鈉緩衝液(pH4.8)以0.15mL/min的流速洗脫,FractionCollectorFrac-920收集器收集120管,每管1mL;測定每管的漆酶活性,將有活性的組分合併,具體為:ThLac1離子交換液凝膠層析收集第59~64管,ThLac2離子交換液凝膠層析收集第57~62管,將2種合併後的所得物分別進行超濾濃縮,從而分別得純化漆酶ThLac1、純化漆酶ThLac2。即,ThLac1離子交換液凝膠層析超濾濃縮後的為ThLac1,ThLac2離子交換液凝膠層析超濾濃縮後的為ThLac2。本發明中是以ABTS作為底物來測定漆酶活性。本發明還同時提供了利用方法製備所得的毛栓孔菌漆酶進行的染料脫色法:將ThLac1與ThLac2混合,所述ThLac1佔混合酶總酶活的50~80%,然後混合酶放入染料中直至含量為50IU/L,然後進行脫色;脫色時間為≥3小時。本發明所用的毛栓孔菌為毛栓孔菌TrameteshirsutaMX2(駱靜怡,傅威銳,潘程遠.2015.木腐真菌的鑑定及對不同木材的腐朽能力.浙江農林大學學報,32(1):1-10)是一種白腐真菌,於2012年12月採自浙江臨安馬溪木材廠,現保存於浙江農林大學植物保護學科微生物實驗室。在本發明中,步驟③對兩種漆酶同工酶進行了分離,步驟④對兩種漆酶同工酶進一步純化,剔除雜蛋白。本發明利用不同碳源對毛栓孔菌TrameteshirsutaMX2漆酶進行誘導培養,產生兩個漆酶蛋白,通過分離純化,發現兩個漆酶蛋白的理化性質不同以及對染料具有協同脫色作用。本發明所得的ThLac1漆酶具有如下一種或多種特性:①蛋白分子量61.4kDa,②以2,2-聯氮-二(3-乙基-苯並噻唑-6-磺酸)二銨鹽(ABTS)為底物的最適pH值為2.0,最適溫度為60℃,③以2,6-二甲氧基苯酚(DMP)為底物的最適pH值為4.0,最適溫度為40℃,④對ABTS的Km值為0.0224mM,對DMP的Km值為0.7417mM,⑤以ABTS為底物,在pH6.0環境中,保溫72h後的酶活保持在80%以上。本發明所得的ThLac2漆酶具有如下一種或多種特性:①蛋白分子量59.1kDa,②以ABTS為底物的最適pH值為2.5,最適溫度為50℃,③以DMP為底物的最適pH值為4.0,最適溫度為70℃,④對ABTS的Km值為0.0234mM,對DMP的Km值為0.6130mM,⑤最適pH條件下,以ABTS作為底物,在60℃中保溫300min後的酶活保持在30%左右,其半衰期為3.12h。本發明具有如下技術優勢:(1)以白楊木屑或竹屑為碳源比直接用葡萄糖為碳源誘導漆酶的活性要高出18.6-20.8倍,而且白楊木屑或竹屑多為廢棄物,方便易得,可以降低發酵成本。(2)以白楊木屑或竹屑為碳源可以誘導毛栓孔菌TrameteshirsutaMX2產生兩種理化性質各異的漆酶同工酶,ThLac1和ThLac2。ThLac1具有耐偏中性pH環境的能力(pH6.0下,保持72小時,殘餘活性達80%以上),而ThLac2具有較好的熱穩定性。(3)ThLac1和ThLac2按一定比例混合使用對染料的降解脫色率顯著的高於單獨使用的脫色率。附圖說明下面結合附圖對本發明的具體實施方式作進一步詳細說明。圖1為不同碳源對毛栓孔菌(TrameteshirsutaMX2)漆酶活性的影響對比圖;圖2是毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和Thlac2離子交換層析後的吸光值和漆酶活性圖;圖3是含漆酶活性離子交換液的凝膠層析後的吸光值和漆酶活性圖;A:離子交換柱峰1(ThLac1)漆酶活性收集液;B:離子交換柱峰3(ThLac2)漆酶活性收集液;圖4是native-PAGE(A)和SDS-PAGE(B)測定毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和Thlac2的分子量及酶譜的電泳圖;其中,M為蛋白質分子量Marker,泳道1為粗酶液,泳道2為超濾液,泳道3為經硫酸銨沉澱透析後的透析液,泳道4為經DEAE-SepharoseFF離子交換層以及SephacrylS-200層析後純化的漆酶ThLac1,泳道5為經DEAE-SepharoseFF離子交換層以及SephacrylS-200層析後純化的漆酶ThLac2;圖5為pH對漆酶ThLac1(A)和ThLac2(B)活性的影響對比圖;圖6為pH對漆酶ThLac1(A)和ThLac2(B)穩定性的影響對比圖;圖7為溫度對漆酶ThLac1(A)和ThLac2(B)活性的影響對比圖;圖8為溫度對漆酶ThLac1(A)和ThLac2(B)穩定性的影響對比圖;圖9為蒽醌類染料AB129化學式圖。具體實施方式下面結合具體實施例對本發明進行進一步描述,但本發明的保護範圍並不僅限於此:實施例1、毛栓孔菌(TrameteshirsutaMX2)漆酶的誘導培養將馬鈴薯葡萄糖(PDA)斜面培養基保存的毛栓孔菌(TrameteshirsutaMX2)接種到固體培養基上活化,28℃恆溫培養箱培養7d,然後取1塊1*1cm的正方菌餅到含100mL發酵培養基的250mL錐形瓶中,在150r/min、28℃下恆溫振蕩培養,每隔1天取1mL培養液到離心管中,4℃低溫10000r/min離心5min,得到上清液作為粗酶液測定漆酶活性。以ABTS作為底物來測定漆酶活性。活性測定在3mL反應體系中:2.8mL濃度為0.5mmol/LABTS(2,2-聯氮-二(3-乙基-苯並噻唑-6-磺酸)二銨鹽)的0.05mol/L醋酸鈉緩衝液(pH4.8),加入200μL粗酶液。25℃啟動反應,測定反應3min內420nm處吸光度的變化,已知420nm處ABTS摩爾消光係數ε420=3.6×104L/(mol·cm)。以1min轉化1μmolABTS所需的酶量為一個酶活力單位(IU)。活化用的固體培養基配方為:馬鈴薯(去皮)200克,葡萄糖20克,瓊脂15克,蒸餾水1000ml,pH自然。1.0×105Pa、121℃滅菌30min滅菌即可。發酵培養基,配方為:碳源20克,酵母提取物10克,磷酸二氫鉀2克,硫酸銨2克,七水硫酸鎂0.5克,氯化鈣0.1克,蒸餾水1000ml,pH自然。1.0×105Pa、121℃滅菌30min滅菌即可。本漆酶誘導培養是通過改變發酵培養基中的碳源種類來實現,碳源類型分別為:過60目篩子的白楊木屑、過60目篩子的毛竹屑、木質素磺酸鈉、葡萄糖、蔗糖和澱粉。各種碳源在14天連續發酵培養下對漆酶活性的影響如圖1所示。根據圖1,我們得知:當蔗糖和澱粉作為碳源時,毛栓孔菌產漆酶活力在第3、4d達到高峰,酶活27.40和40.51IU/L,之後逐步下降,葡萄糖作為碳源時,毛栓孔菌產漆酶活力在第11天達到高峰,酶活為15.3IU/L。白楊、毛竹和木質素磺酸鈉作為碳源時,毛栓孔菌產漆酶活明顯優於葡萄糖、蔗糖和澱粉,其中,白楊在第13天達到高峰,漆酶活性為318.70IU/L。毛竹、木質素磺酸鈉作為碳源時,毛栓孔菌產漆酶活力較白楊效果次之。實施例2-1、毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和ThLac2的分離純化以白楊木屑作為發酵培養基的碳源,在150r/min、28℃下恆溫振蕩培養13天,將發酵液在4000rpm/min離心30min,離心後上清液即為粗酶液。將粗酶液經過超濾濃縮、硫酸銨沉澱透析、離子交換層析和凝膠層析等步驟進行分離純化,具體過程如下:①、超濾濃縮:將粗酶液放入濾膜孔徑為10kDa的超濾管中,在4℃、4000rpm/min離心30分鐘,即為超濾液。②、硫酸銨沉澱透析:在超濾液中緩慢加入硫酸銨,使溶液中硫酸銨的最終濃度達到80%,4℃過夜,4000rpm/min離心30min,將沉澱用少量0.05mol/L醋酸鈉緩衝液(pH4.8)溶解;將溶解的酶液裝入透析袋(孔徑為12-14kDa)中,用50倍於酶液的0.05mol/L醋酸鈉緩衝液(pH4.8)透析24h,中間緩衝液更換3次,之後即為透析液。③、離子交換層析:將透析液以0.4mL/min的流速上樣到已平衡過的DEAE-SepharoseFF層析柱(25*16mm)中,在AKTApurifier蛋白純化系統用0.5mol/LNaCl和0.05mol/L醋酸鈉緩衝液(pH4.8)梯度洗脫,流速0.8mL/min,用FractionCollectorFrac-920收集器每1mL收集1管,同時測定每管漆酶活性,洗脫曲線如圖2共出現3個峰,用ABTS分別檢測各峰值處洗脫液,發現峰1和峰3處具有很高的漆酶活性,分別記為ThLac1和ThLac2,並對ThLac1和ThLac2分別超濾濃縮,即為離子交換液。上述梯度洗脫時,0.5mol/LNaCl、0.05mol/L醋酸鈉緩衝液(pH4.8)的體積含量如下表1所示。表1具體為:將第6~11管洗脫液合併(對應的洗脫液中,NaCl溶液的體積含量為5.8%,醋酸鈉緩衝液的體積含量為94.2%),放入10kDa的超濾管中,離心(4℃、4000rpm/min離心30分鐘),得ThLac1的離子交換液。將第19~23管洗脫液合併(對應的洗脫液中,NaCl溶液的體積含量為13.3%,醋酸鈉緩衝液的體積含量為86.7%),放入10kDa的超濾管中,離心(4℃、4000rpm/min離心30分鐘),得ThLac2的離子交換液。④凝膠層析為:分別對ThLac1和ThLac2的離子交換液上樣已平衡的SephacrylS-200層析柱(90×1.6cm),用0.05mol/L醋酸鈉緩衝液(pH4.8)以0.15mL/min的流速洗脫,用FractionCollectorFrac-920收集器每1mL收集1管,同時測定每管漆酶活性。ThLac1離子交換液洗脫後在59~64管僅有一個漆酶活性峰(見圖3A),將之合併,放入10kDa的超濾管中,離心(4℃、4000rpm/min離心30分鐘),成為最終的純化漆酶ThLac1。ThLac2離子交換液洗脫後在57~62管也僅有一個漆酶活性峰(見圖3B),將之合併,放入10kDa的超濾管中,離心(4℃、4000rpm/min離心30分鐘),成為最終的純化漆酶ThLac2。在本發明中,針對粗酶液、超濾濃縮、硫酸銨沉澱透析、離子交換層析和凝膠層析等各步驟收集一定樣品進行總蛋白含量測定及漆酶活性測定,蛋白質含量測定使用Bradford原理,通過蛋白質定量檢測試劑盒(上海生工)測定,漆酶活性使用ABTS為底物來測定。最終的純化漆酶ThLac1的比活力為29.80IU/mg,活性回收率為4.26%,純化倍數為22.25;漆酶ThLac2的比活力為12.22IU/mg,活性回收率為1.35%,純化倍數為9.12,見表2。表2、毛栓孔菌(TrameteshirsutaMX2)漆酶ThLac1和Thlac2的分離純化實施例2-2、將實施例2-1中的碳源由白楊木屑改成毛竹屑(過60目篩),其餘類同於實施例2-1;結果如下:最終的純化漆酶ThLac1的比活力為27.5IU/mg,活性回收率為4.02%,純化倍數為21.2;漆酶ThLac2的比活力為11.5IU/mg,活性回收率為1.02%,純化倍數為8.17。實施例2-3、將實施例2-1中的碳源由白楊木屑改成木質素磺酸鈉,其餘類同於實施例2-1;結果如下:最終的純化漆酶ThLac1的比活力為2.64IU/mg,活性回收率為0.57%,純化倍數為3.41;漆酶ThLac2的比活力為1.47IU/mg,活性回收率為0.15%,純化倍數為1.24。實施例2-4、將實施例2-1中的碳源由白楊木屑分別改成葡萄糖、蔗糖、澱粉;其餘類同於實施例2-1;結果如下:當碳源為葡萄糖時,所得結果為:僅能獲得ThLac1,而不能獲得ThLac2;當碳源為蔗糖時,所得結果為:僅能獲得ThLac1,而不能獲得ThLac2;當碳源為澱粉時,所得結果為:僅能獲得ThLac1,而不能獲得ThLac2。實施例3、漆酶ThLac1和ThLac2分子量測定及酶譜分析純化漆酶ThLac1和ThLac2的分子量測定採用10%分離膠(w/v)和5%濃縮膠(w/v)的十二烷基磺酸鈉-聚丙烯醯胺凝膠電泳(SDS-PAGE)進行測算。凝膠電泳後經考馬斯亮藍R-250染色並顯示拍照保存,再根據膠中標準蛋白質Marker估算分子量。純化漆酶ThLac1和ThLac2的酶譜分析採用10%分離膠(w/v)和5%濃縮膠(w/v)的非變性聚丙烯醯胺凝膠電泳(native-PAGE)進行,其中,凝膠配製中不添加SDS,而且酶液不經過加熱變性直接上樣進行電泳,電泳之後,取出凝膠放入含有0.5mmol/LABTS的染色液中活性染色,並顯示拍照保存。圖4(A)顯示的是毛栓孔菌(TrameteshirsutaMX2)漆酶的native-PAGE酶譜圖,其中第1,2,3泳道中分別是粗酶液、濃縮液(即,超濾液)、透析液的酶譜圖,因為沒經過分離,所以各泳道中都顯示出了ThLac1和ThLac2的圖譜(上為ThLac1,下為ThLac2),第4,5泳道是經凝膠層析過柱後最終的純化漆酶ThLac1和ThLac2的酶譜圖;圖4(B)顯示的是毛栓孔菌(TrameteshirsutaMX2)漆酶的SDS-PAGE電泳圖,其中第1,2,3泳道中分別是粗酶液、濃縮液(即,超濾液)、透析液的電泳圖,第4,5泳道是經凝膠層析過柱後最終的純化漆酶ThLac1和ThLac2的電泳圖。實施例4、pH和溫度對漆酶ThLac1和ThLac2活性及穩定性的影響1.pH對漆酶ThLac1和ThLac2活性及穩定性的影響在25℃條件下,將純化漆酶ThLac1和ThLac2分別加入不同pH2.0-7.0的0.1mol/L檸檬酸-磷酸鹽緩衝液中,測定不同pH下對ABTS和DMP的相對酶活性;pH對漆酶穩定性的影響通過漆酶與不同pH2.0-7.0的0.1mol/L檸檬酸-磷酸鹽緩衝液混合保溫放置0~72h後,分別測定其對ABTS和DMP的殘餘酶活性。以ABTS作為底物來測定漆酶活性。活性測定在3mL反應體系中:2.8mL1mmol/LABTS和相應pH的0.1mol/L檸檬酸-磷酸鹽緩衝液,加入200μL粗酶液。25℃啟動反應,測定反應3min內420nm處吸光度的變化,已知420nm處ABTS摩爾消光係數ε420=3.6×104L/(mol·cm)。以1min轉化1μmolABTS所需的酶量為一個酶活力單位(IU)。以DMP為底物,反應體系和步驟同ABTS,不同處在於,測定470nm處吸光度的變化以及470nm處DMP摩爾消光係數ε470=1.48×104L/(mol·cm)。pH對漆酶ThLac1和ThLac2活性影響如圖5所示。在25℃條件下,在酸性環境中(pH2.0-4.0),ThLac1和ThLac2表現出較好的活性。以ABTS作為底物,ThLac1的最適反應pH值為2.0,ThLac2的最適反應pH值為2.5;以DMP作為底物,ThLac1和ThLac2的最適反應pH值均為4.0。圖5中也可以發現,ABTS作為底物時,ThLac1在pH2-3.5範圍內酶活受pH影響不大,相對酶活力保持在90%以上,而ThLac2酶活受pH值影響較大,當pH大於2.5時,酶活隨pH上升酶活力不斷下降。pH對漆酶ThLac1和ThLac2穩定性影響如圖6所示。在偏中性環境中(pH6.0),ThLac1和ThLac2均表現出較好的pH穩定性。以ABTS作為底物,在pH6.00.1mol/L檸檬酸-磷酸鹽緩衝液中保溫72h後,ThLac2的殘餘活性保持在55%左右,而ThLac1表現出更穩定的特性,殘餘活性保持在80%以上,說明在偏中性環境中,ThLac1的穩定性優於ThLac2的穩定性。2.溫度對漆酶ThLac1和ThLac2活性及穩定性的影響在最適pH條件下,將純化漆酶ThLac1和ThLac2分別加入不同溫度10~85℃的緩衝液中,測定ABTS和DMP為底物的酶活性;溫度對漆酶熱穩定性的影響通過漆酶在不同溫度50~80℃的緩衝液中,混合保溫放置0~300min後,然後迅速冷卻至室溫,分別測定其對ABTS和DMP的殘餘酶活性。漆酶對ABTS和DMP的活性測定同上所述。溫度對漆酶ThLac1和ThLac2活性影響如圖7所示。最適pH條件下,ThLac1和ThLac2的活性先隨著溫度的升高而增加,基本上高於50℃達到最適反應溫度,然後漆酶活性隨著溫度的升高開始下降。以ABTS作為底物,ThLac1的最適反應溫度為60℃,ThLac2的最適反應溫度為50℃;以DMP作為底物,ThLac1的最適反應溫度為40℃,ThLac2的最適反應溫度為70℃。圖7中也可以發現,ABTS作為底物時,ThLac1在60-85℃範圍內酶活受溫度影響較大,相對酶活力快速下降,而ThLac2酶活受高溫影響不大,在85℃時,相對酶活力仍有65%左右,遠高於Lac1的16.4%。以DMP作為底物時,在高溫條件下,ThLac2同樣表現出優於ThLac1的活性。溫度對漆酶ThLac1和ThLac2穩定性影響如圖8所示。最適pH條件下,以ABTS作為底物,在60℃0.1mol/L檸檬酸-磷酸鹽緩衝液中保溫300min後,ThLac2的殘餘活性保持在30%左右,而ThLac1的殘餘活性只有1.9%,說明ThLac2表現出優於ThLac1的熱穩定性。表3顯示了不同溫度下,ThLac1和ThLac2的半衰期。在50℃和60℃條件下,ThLac1的半衰期是4.19h和0.88h,而ThLac2在相同溫度下表現出更好的熱穩定性,半衰期是9.58h和3.12h。表3、不同溫度下漆酶ThLac1和ThLac2的失活常數和半衰期實施例5、漆酶ThLac1和ThLac2對ABTS和DMP米氏常數Km的測定在最適pH和最適溫度下,測定純化漆酶ThLac1和ThLac2對底物ABTS和DMP的米氏常數。底物的濃度範圍在0.01~1.0mmol/L之間,酶活測定方法同實施例4,然後作Lineweaver-Burk雙倒數圖求Km值。與其他真菌漆酶一樣,ThLac1和ThLac2能催化氧化不同的漆酶底物,並對底物表現出相似的特異性。表4顯示了漆酶ThLac1和ThLac2分別催化非酚類底物ABTS和酚類底物DMP時的動力學參數。ABTS的米氏常數較小,分別為0.0224mmol/L和0.0234mmol/L,而DMP的米氏常數達到0.7417mmol/L和0.613mmol/L,表明ThLac1和ThLac2與ABTS的親和性較好。另外,兩種漆酶對ABTS的催化效率也較高,達到4092.86S-1mM-1和1547.72S-1mM-1。表4、漆酶ThLac1和ThLac2對ABTS和DMP的酶動力學常數實施例6、漆酶ThLac1和ThLac2對染料的協同脫色作用本實施例中所用染料為蒽醌類的AcidBlue129(AB129),化學式見圖9。該染料的最大吸收波長為629nm,在吸光度OD629為1時的濃度為208.3mg/L。脫色反應步驟為:在1mL的含有208.3mg/LAB129的醋酸鈉緩衝液(0.05mol/L,pH4.8)中加入50IU/L按一定比例配製的ThLac1和ThLac2混合酶量,啟動脫色反應,3小時後,分別測定反應前後吸光度OD629,計算漆酶對染料的脫色率D%。A0是反應前吸光值,A是反應後吸光值。脫色率計算公式為:D%=(A0-A)/A0×100。其中,ThLac1和ThLac2的比例(在總酶活為0.05IU中的酶活比例)配製為:0:10、1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1、10:0。漆酶ThLac1和ThLac不同比例下對AB129染料3小時後的降解脫色率見表5。當單獨用漆酶ThLac1和ThLac2時對AB129的脫色率分別為44.6%和10.1%,顯然,ThLac1的脫色效果要好於ThLac2。但是當兩種漆酶以不同比例混合後,其脫色率都要高於兩種漆酶單獨使用時脫色率之和。特別是,當ThLac1和ThLac2比例在5:5-8:2之間時,混合脫色率都在80%以上,明顯高於兩種漆酶單獨使用時脫色率之和的54.7%,表現出了兩種漆酶對AB129脫色的協同增效作用,這為以後染料脫色工業或者染料廢水處理提供了一條新的思路。表5、漆酶ThLac1和ThLac不同比例下對AB129染料3小時後的降解脫色率(平均值±標準差)ThLac1:ThLac2比例降解脫色率(%)0:1010.1±2.41:961.6±2.22:868.4±3.83:770.6±3.64:675.6±2.85:580.5±1.96:485.3±3.37:386.8±2.68:285.4±4.29:172.3±1.810:044.6±3.2對比例1-1、將實施例2-1「離子交換層析」步驟中的洗脫流速工藝參數由0.8mL/min改成1.6mL/min或者更快的流速,其餘等同於實施例2-1。所得結果為:兩種漆酶同工酶會一起脫洗下來,達不到分離效果,具體表現為:脫洗液中只產生一個漆酶活性波峰,或者兩個漆酶活性波峰緊密相連,不易分離。對比例1-2、將實施例2-1「離子交換層析」步驟中的脫洗液中醋酸鈉緩衝液的pH值工藝參數由4.8改成4.3或者更低,其餘等同於實施例2-1。所得結果為:漆酶蛋白不能有效的結合到離子交換層析柱中,具體表現為:離子交換層析後漆酶的回收率偏低,由目前的(當醋酸鈉緩衝液pH為4.8時)8.25%(ThLac1)和6.16%(ThLac2)減少到1.34%(ThLac1)和0.67%(ThLac2)或者更低。對比例2-1、將實施例2-1「凝膠層析」步驟中的醋酸鈉緩衝液的脫洗流速工藝參數由0.15mL/min改成0.4mL/min或者更快的流速,其餘等同於實施例2-1。所得結果為:漆酶中的雜蛋白不能有效分離,達不到凝膠層析的目的,具體表現為:脫洗液中蛋白質吸收峰僅表現為一個,或者波峰緊密相連。對比例2-2、將實施例2-1「凝膠層析」步驟中的醋酸鈉緩衝液的脫洗流速工藝參數由0.15mL/min改成0.05mL/min或者更慢的流速,其餘等同於實施例2-1。所得結果為:凝膠層析時間過長,更加費時;具體表現為:當流速為0.05mL/min或者更慢時,由目前0.15mL/min流速下7.7小時就可以分離出的ThLac1或者ThLac2,則需要23.3小時左右才能分離出ThLac1或者ThLac2,層析用時要增加2倍。最後,還需要注意的是,以上列舉的僅是本發明的若干個具體實施例。顯然,本發明不限於以上實施例,還可以有許多變形。本領域的普通技術人員能從本發明公開的內容直接導出或聯想到的所有變形,均應認為是本發明的保護範圍。當前第1頁1 2 3 
