一種幽門螺桿菌的快速鑑定及毒力分析方法與流程
2023-08-01 01:04:06 2
本發明涉及醫學領域,尤其涉及幽門螺桿菌的快速鑑定及毒力分析方法。
背景技術:
幽門螺桿菌(helicobacterpylori,h.pylori)是一種主要寄生在人體胃部的杆狀革蘭陰性菌,h.pylori感染是萎縮性胃炎、消化性潰瘍、胃癌和胃黏膜相關淋巴組織淋巴瘤的重要危險因素。目前h.pylori鑑定和毒力檢測有以下方法:1)生化鑑定;2)組織病理切片染色法;3)尿素呼氣試驗(ureabreathtest,ubt);4)快速尿素酶實驗(rapidureasetest,rut);5)常規核酸分析法:包括測序、pcr、寡核苷酸探針雜交等。生化鑑定法耗時長,準確性低;組織病理切片染色法受h.pylori載量影響明顯,且操作繁瑣、費時,不適於大通量樣本的檢測;尿素呼氣試驗費用高、易受抑菌藥物和抑酸藥物的影響、敏感度低;快速尿素酶實驗反應結果受到標本中h.pylori密度、環境溫度以及反應較弱時缺乏明確客觀的判斷標準等影響,敏感性、特異性和準確性均較低;常規核酸分析法,通量小,成本較高,對操作者的要求比較高。
技術實現要素:
為了克服上述現有技術的不足,本發明提供了一種快速、準確、高效及低成本的h.pylori的快速鑑定及毒力分析方法。
本發明提供的h.pylori的快速鑑定及毒力分析方法,包括以下步驟:
(1):採用基質輔助雷射解吸電離飛行時間質譜對h.pylori標準菌株、臨床分離菌株進行特徵性鑑定,得到數據;
(2):使用maldi-biotyper和clinprotools軟體對所述的數據進行處理分析用於區分h.pylori菌株不同的毒力。
同時,通過系統地比對和優化,確定了採用70%甲酸作為基質輔助雷射解吸電離飛行時間質譜鑑定前的預處理。
與現有技術相比,本發明的有益效果如下:
其為一種快速、準確、高效及低成本的h.pylori鑑定和毒力的新型診斷方法,能夠提高maldi-tofms確定h.pylori菌株的毒力的能力,預測胃腸道疾病的發展以指導臨床採用合理的幹預措施,早期根治高危型的h.pylori感染,預防和治療h.pylori感染相關疾病。
附圖說明:
圖1為本發明實施例在使用不同試劑處理菌種後後獲得的圖譜。
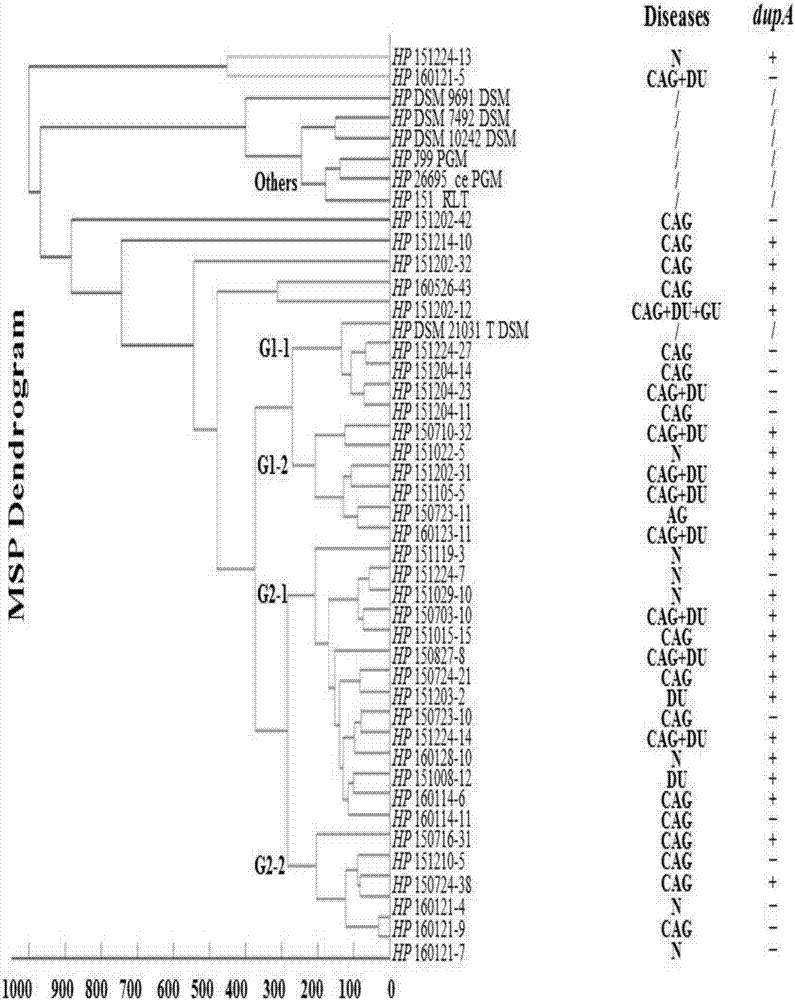
圖2為本發明實施例37株臨床h.pylori菌株和7株標準h.pylori菌株聚類分析圖。
具體實施方式
下面結合具體的實施例對本發明作進一步地說明,以更好地理解本發明。
實施例
1材料
1.1樣本來源
2016年1月至2016年7月在華東醫院就診的且需行胃鏡檢查的胃十二指腸疾病患者350例,其中男性185例,女性165例,平均年齡(50.3±13.8)歲。
1.2對照菌株
對照菌株為一株經形態學和生化鑑定、並經16srrna測序確認的臨床菌株。
1.3材料與試劑
1.4儀器與設備
其他:數據採集軟體為德國布魯克道爾頓公司的flexcontrol;鑑定軟體為德國布魯克道爾頓公司的maldibiotyper軟體,圖譜分析軟體為德國布魯克道爾頓公司的flexanalysis軟體。
1.5主要試劑的配製
1.5.1混合抗生素工作液:用電子天平稱量5mg甲氧苄氨嘧啶(tmp)加入到50ml滅菌蒸餾水中,攪拌混勻並加入2滴乳酸,加熱煮沸。降至室溫後加入萬古黴素100mg,兩性黴素b3.8mg,多粘菌素b20mg,混合均勻之後將混合抗生素溶液用0.45μm針筒濾器進行過濾,分裝至滅菌ep管中,4℃保存備用。
1.5.2h.pylori選擇性培養基
(1)用電子天平稱量30.5g哥倫比亞血瓊脂乾粉,在1000ml錐形瓶內溶於780ml蒸餾水中,用玻棒攪拌均勻,蓋上橡膠塞。
(2)121℃,高溫高壓蒸汽滅菌20分鐘。
(3)待溫度降至70℃左右,將培養基轉移至已到達設定溫度的水浴鍋內(50~55℃),平衡2小時左右備用。
(4)向溫度已降至52.5℃的培養基中添加3.9ml混合抗生素工作液,然後用5ml移液器向錐形瓶內加入70mll新鮮無菌脫纖維羊血,混合均勻後將其倒入無菌空平板中,高度約4mm。
(5)待平板冷卻凝固後放入4℃環境下冷藏待用,2周內使用完畢。
1.5.3凍存液:用電子天平稱量布氏肉湯乾粉2.8g,溶解於70ml蒸餾水中,用量筒量取甘油30ml添加其中,用玻棒攪拌均勻後置入滅菌鍋內高壓蒸汽滅菌20分鐘;待凍存液冷卻至室溫,分裝於無菌凍存管中,每管分裝的量大約1ml,4℃條件下保存備用。
1.5.4基質液配置:取適量基質溶解液加入到chca基質中,配置成chca過飽和溶液,常溫下保存備用;基質溶解液:50%超純水,47.5%乙腈,2.5%三氟乙酸(tfa)。
2方法
2.1h.pylori的分離培養
徵得患者同意並籤署知情同意書後,由華東醫院消化內鏡室醫師經胃鏡用活檢鉗於近胃幽門部、胃竇部或病變臨近處採集患者胃活檢組織樣本,置保存液(0.9%生理鹽水)中及時送檢(4h內)。胃黏膜組織經全自動研磨儀(65hz,60s)充分研磨形成組織勻漿後,取100μl密集均勻塗布在h.pylori選擇培養基上。在6%o2、10%co2的微需氧條件下,35℃培養5~7天。剩餘的組織勻漿置於-80℃冰箱保存。
2.2h.pylori的鑑定
挑取在h.pylori選擇性平板上生長的疑似菌落(圓形,無色半透明呈露滴狀,直徑約0.5~1mm)進行革蘭染色鏡檢,顯微鏡下呈革蘭陰性弧形、螺旋形、s形、海鷗形或者是彎曲短杆狀,氧化酶和觸酶均陽性、脲酶強陽性,根據上述的特徵,即可判斷為h.pylori。傳代後培養48~72h,用無菌棉拭子刮取足量平板上的菌落,置於凍存液中-80℃凍存。
2.3h.pylori菌株的復甦
將-80℃凍存的菌株恢復至室溫後,取100μl菌液接種於h.pylori選擇性平板上均勻塗布,在6%o2、10%co2的條件下,35℃培養3~5天。
2.4細菌基因組總dna抽提
(1)取適量平板上生長的h.pylori菌落轉移至含有1ml無菌生理鹽水的ep管內,13000rpm離心60s,收集菌體沉澱;
(2)參照北京天根公司細菌dna抽提試劑盒說明書中的步驟抽提細菌基因組總dna;
(3)將提取好的h.pylori總dna收集到離心管中;用nanodrop分光光度計測量其濃度和純度後放入-20℃保存備用,以進行後續的pcr反應。
2.5h.pylori鑑定基因16srrna和毒力基因dupa的擴增與測序
引物序列16srrna(正向引物:tctaacgaataagcaccggcta;反向引物:gtgcagcacctgttttcaagg),擴增長度為576bp;dupa(正向引物:agcgactcttttagctgagatt;反向引物:ggactttctatgataaatacgcagt),擴增長度為1940bp。以h.pylori臨床分離株總dna為模板,用以上引物進行pcr擴增反應。總反應體系為25μl,模板dna為1μl。pcr反應條件:94℃預變性3min,94℃預變性30s,52~60℃退火30s,72℃延伸1min,共35個循環;最後72℃延伸10min。然後將獲得的pcr產物進行進行基因測序(上海桑尼生物科技公司),測序結果與ncbi基因庫進行比對,選擇符合率>99%的為鑑定結果。
2.6檢測前處理條件的優化
採用70%甲酸、甲酸和乙腈(1:1)、50%異丙醇(含有0.1%三氟乙酸)和ddh2o(陰性對照),對臨床菌株進行前處理(每個檢測樣本添加1μl的前處理試劑),自然乾燥後,進行質譜分析,比較上述不同試劑的細菌前處理能力,以選擇h.pylori最佳的前處理方法。
2.7h.pylori樣本準備及maldi-tofms分析
microflexlt儀器參數設置為:線性陽離子模式,n2雷射,λ=355nm,脈衝持續時間:150ns,雷射頻率為200hz,採集的質量範圍為m/z=2000-20,000da,每張圖譜採集200個shots。在進行檢測前,用細菌實驗標本品(bts)進行外部校準,校準後的誤差小於200ppm。然後用flexanalysis軟體查看獲得的圖譜,評價圖譜的質量。
臨床分離菌株樣品按照以下程序進行製備:用竹籤挑取在哥倫比亞血瓊脂上生長良好的h.pylori菌落,然後將其均勻塗布在靶板上,將1μl預處理試劑覆蓋在樣品上,在室溫下完全乾燥後,向靶板中加入1μlchca基質液並在常溫下乾燥。處理好的樣品隨後進行maldi-tofms分析。每個樣本做2個復孔,每個樣本孔採集≥3張質譜圖。flexcontrol(brukerdaltonics,germany)軟體用於獲取質譜圖。
2.8細菌鑑定結果解讀
maldibiotyper:使用biotyper軟體將獲得的質譜圖與參考圖譜資料庫進行比對,判斷標準採用廠商的標準:分值≥2.000表示鑑定到種水平,分值為1.700~1.999表示鑑定到屬水平,分值<1.700表示未鑑定。
2.9建立參考資料庫
本發明maldibiotyper平臺上建立了參考資料庫用於臨床h.pylori的鑑定:使用biotyper3.1軟體對37株臨床h.pylori分離株構建主圖譜預測(mainspectralprojection,msp)。msp的構建基於平滑,基線減法,正常化,和峰值抓取處理後的原始圖譜。每個菌株獲得6張原始圖譜用於構建一個msp,共得到37個msps。將所有新建的msp添加到biotyper參考資料庫中。軟體參數為默認設置。
2.10maldi-tofms用於h.pylori毒力分析模型(dupa+/dupa-)的建立
mspdendrogram是一種在各種規模均能進行的通過創建一個集群功能樹或樹狀圖的分組方法。用44張msps(包括原始資料庫中的7張msps和來自臨床分離株的37張msps)建立mspdendrogram。基於mspdendrogram的結果,具有共同特徵的菌株可以被分到同一個組。然後基於mspdendrogram的分組結果,使用clinprotools建立毒力分類模型以區分dupa(+)/dupa(-)臨床h.pylori分離株。clinprotools軟體主要操作設置如下:信噪比(s/n)的閾值設置為5,相對強度閾值為1.5%,用於區分的峰的個數設置為10。
結果
1.h.pylori的分離鑑定結果
為了構建新的參考資料庫和毒力分析模型,從350例臨床活檢樣本中共分離出68株h.pylori菌株,總的陽性分離率為19.4%。所有的h.pylori臨床分離株均對其高度保守和穩定的基因16srrna進行測序確認。其中31株h.pylori菌株用於建立maldi-tofms參考資料庫和毒力類型(dupa+/dupa-)分析模型,其餘37株用於評估參考資料庫和毒力類型(dupa+/dupa-)分析模型的臨床應用能力。
2.h.pylori毒力基因dupa鑑定
共有37株h.pylori菌株被添加到biotyper原始資料庫中並用於建立mspdendrogram和clinprotools毒力類型(dupa+/dupa-)分析模型,其中,24株為dupa陽性,13株為dupa陰性。所有菌株的遺傳和臨床背景見表1-1。
表1-1臨床h.pylori菌株的臨床和基因背景
註:cag:慢性萎縮性胃炎;n:非萎縮性胃炎;du:十二指腸潰瘍;gu:
胃潰瘍;hp:幽門螺桿菌。
3.細菌前處理條件的優化結果
maldibiotyper:1株已知遺傳背景的臨床h.pylori分離株被用於maldi-tofms檢測預處理條件的優化。圖1顯示了在使用不同試劑處理後獲得的圖譜:無處理、ddh2o、50%異丙醇(含有0.1%tfa)、70%甲酸和乙腈(1:1)和70%甲酸。與其他三種預處理試劑相比,70%甲酸處理後獲得的圖譜顯示了最高的峰強度和最多的h.pylori特異性峰。此外,在16000da後的位置依然可以觀察到離子峰。因此,70%甲酸作為優化的預處理試劑用於h.pylori後續的maldi-tofms檢測。
註:maldi-tof分析前加入各種預處理試劑用於優化檢測效率。圖2顯示了每種試劑處理後獲得的圖譜。70%甲酸處理後可以獲得最佳的圖譜。m/z:質荷比;maldi基質:α-chca。
4.h.pylori菌株參考資料庫和毒力類型(dupa+/dupa-)分析模型的建立
maldibiotyper參考資料庫:37株臨床h.pylori分離株被加入到原有資料庫中,每株h.pylori菌株採集六張圖譜,然後將其用於構建一個msp,共獲得37張msps加入到biotyper資料庫中。
mspdendrogram的建立:7株h.pylori標準菌株和37株臨床h.pylori分離株構建了一張mspdendrogram。基於它們的親緣性遠近可以將這些菌株分成幾個不同的組。原始biotyper資料庫中的7株標準菌株中有6株被分為一個單獨的組,如圖2所示。37株臨床h.pylori分離株中的30株被分為2組:組1(10株)和組2(20株),每個組可分為2個亞組:組1-1(g1-1),組1-2(g1-2),組2-1(g2-1)和組2-2(g2-2)。g1-2和g2-1中菌株導致十二指腸/胃潰瘍的比例顯著高於g1-1和g2-2(90%vs10%)。相應地,g1-2和g2-1中的dupa(+)分離株的數目也顯著高於g1-1和g2-2(85%vs20%)。這種現象表明dupa(+)和dupa(-)菌株可能存在著不同的圖譜模式,並且與不同的臨床特徵相關。g1-1和g2-2組dupa(-)菌株比例較大,患有十二指腸潰瘍的概率小,臨床危險性低;g1-2和g2-1組dupa(+)菌株比例較大,患有十二指腸潰瘍的概率大,臨床危險性高,需要根除治療。
註:mspdendrogram由maldibiotyper3.1軟體使用默認設置生成。37株臨床分離株中的30株可被分為4組。g1-1:第1-1組;g1-2:第1-2組;g2-1:第2-1組;g2-2:第2-2組。其餘的7株臨床h.pylori分離株和7株標準菌株參考圖譜為「其他」組;hp:幽門螺桿菌。
clinprotools毒力類型(dupa+/dupa-)分析模型的建立:除了mspdendrogram,clinprotools(v.3.0.22;brukerdaltonics)被進一步用於建立毒力分類模型以區分dupa(+)和dupa(-)臨床h.pylori分離株。24株dupa(+)分離株和13株dupa(-)分離株用於創建分類模型。由遺傳算法(geneticalgorithm,ga)建立clinprotools模型獲得的用於分類dupa(+)和dupa(-)菌株的10個譜峰的質荷比(masstochargeratio,m/z)為:7767、8391、7286、6069、2789、6272、7668、13880、6554和14019。使用flexanalysis軟體進一步確認發現,m/z=8391、7286和7684為dupa(-)菌株的特異峰,m/z=7767和14019為dupa(+)菌株的特異峰。clinprotools所建立的遺傳算法模型的識別能力(recognitioncapability,rc)為99.29%,交叉驗證能力(crossvalidation,cv)為94.32%,表明了dupa(+)/dupa(-)臨床h.pylori分離株可以被較好地區分。rc是指模型能正確分類用於建立模型的圖譜的能力的一種度量。它通過檢測用於相對於模型本身用於建立模型的每個圖譜並將能正確分類的圖譜數除以總數來計算。vc是模型可靠性的一種度量,並可用於預測其未來性能。它是通過將建立模型的圖譜隨機分成模型子集和測試子集來進行計算的。該過程重複多次以計算出一個歸一化的交叉驗證值。
與現有技術相比,本發明的有益效果如下:
其為一種快速、準確、高效及低成本的h.pylori鑑定和毒力的新型診斷方法,能夠提高maldi-tofms確定h.pylori菌株的毒力的能力,預測胃腸道疾病的發展以指導臨床採用合理的幹預措施,早期根治高危型的h.pylori感染,預防和治療h.pylori感染相關疾病。
以上對本發明的具體實施例進行了詳細描述,但其只是作為範例,本發明並不限制於以上描述的具體實施例。對於本領域技術人員而言,任何對本發明進行的等同修改和替代也都在本發明的範疇之中。因此,在不脫離本發明的精神和範圍下所作的均等變換和修改,都應涵蓋在本發明的範圍內。
