降低系統性調節性T細胞水平或活性來治療CNS疾病和損傷的製作方法
2023-06-14 03:09:35 3
本發明一般性地涉及用於通過短暫地降低循環中系統性免疫抑制的水平來治療中樞神經系統(Central Nervous System,CNS)的疾病、障礙、病症或損傷的方法和組合物。
背景技術:
大部分的中樞神經系統(CNS)病理共有共同的神經炎性組分,其是疾病發展的一部分並且導致疾病惡化。在這些病理中,阿爾茨海默病(Alzheimer’s disease,AD)(一種年齡相關性神經變性疾病)以記憶和認知功能的進行性喪失為特徵,其中提出澱粉樣蛋白-β(Aβ)聚集體的累積在CNS內的炎性級聯反應中起關鍵作用,最終導致神經元損傷和組織破壞(Akiyama等,2000;Hardy和Selkoe,2002;Vom Berg等,2012)。儘管神經變性疾病中發生慢性神經炎性應答,但是在過去十年內研究基於免疫抑制的神經變性疾病治療的臨床和臨床前研究已提出為什麼抗炎性藥物達不到要求的問題(Breitner等2009;Group等,2007;Wyss-Coray和Rogers,2012)。我們提供了新的解決方案,其克服了AD以及類似CNS疾病和損傷的現有治療的缺點;該方法基於我們對不同的系統性和中樞免疫系統組分在CNS維持和修復中的作用的獨特了解。
技術實現要素:
在一個方面,本發明提供了用於治療不包括自身免疫性神經炎性疾病—復發-緩解型多發性硬化(relapsing-remitting multiple sclerosis,RRMS)的CNS的疾病、障礙、病症或損傷的藥物組合物,其包含引起個體中系統性免疫抑制的水平降低的活性劑,其中所述藥物組合物用於通過包括至少兩個治療過程的給藥方案來施用,每個治療過程順序地包括治療期,之後是非治療的間隔期。
在另一個方面,本發明提供了用於治療不包括自身免疫性神經炎性疾病—復發-緩解型多發性硬化(RRMS)的中樞神經系統(CNS)的疾病、障礙、病症或損傷的方法,所述方法包括向有此需要的個體施用根據權利要求1至24中任一項所述的藥物組合物,其中所述藥物組合物通過包括至少兩個治療過程的給藥方案來施用,每個治療過程順序地包括治療期,之後是非治療期的間隔期。
附圖說明
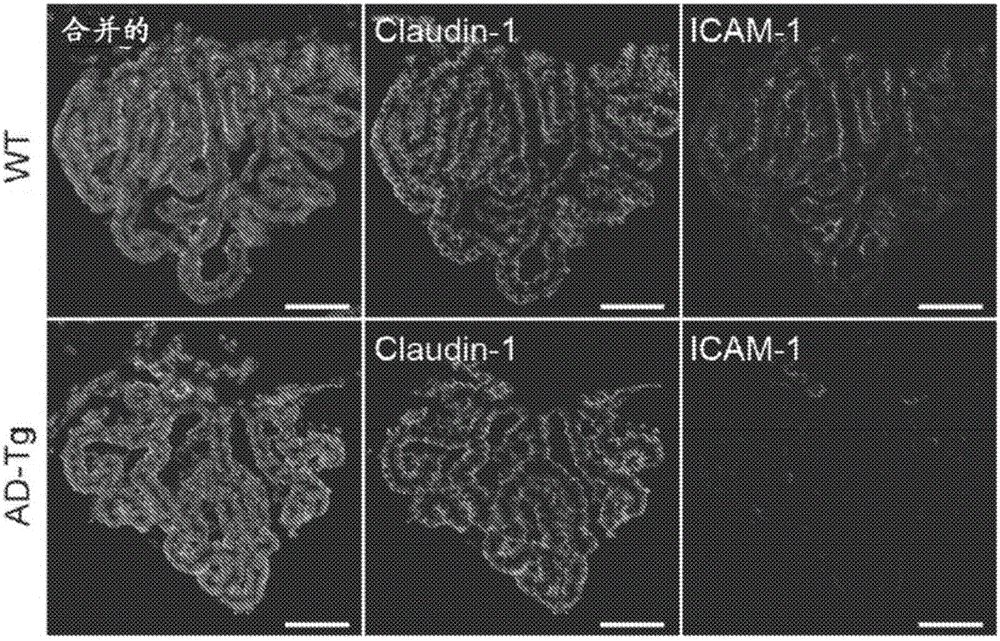
圖1A至1B描繪了在AD的5XFAD轉基因小鼠模型(AD-Tg)中隨疾病進程的脈絡叢(choroid plexus,CP)活性。(A)從1、2、4和8個月大AD-Tg小鼠分離的CP中通過RT-qPCR測量的基因icam1、vcam1、cxcl10和ccl2的mRNA表達水平,示為與年齡匹配WT(野生型)對照相比的倍數變化(n=6-8/組;學生t檢驗,針對每個時間點)。(B)經針對上皮緊密連接分子Claudin-1(Hoechst核染色)和整聯蛋白配體ICAM-1免疫染色的8個月大AD-Tg小鼠和年齡匹配WT對照的CP的代表性顯微鏡圖像(比例尺,50μm)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖2A至2C示出了(A)未患CNS疾病的年輕人和年長人以及AD患者的人死後CP中ICAM-1免疫反應性的量化(n=5/組;單向ANOVA,接著是Newman–Keuls事後分析);(B)8個月大AD-Tg小鼠和年齡匹配WT對照的CP中表達IFN-γ的免疫細胞的流式細胞術分析(細胞內染色,並且對CD45預先門控)。陰影的直方圖表示同型對照(n=4-6/組;學生t檢驗);以及(C)與年齡匹配WT對照相比的、從4和8個月大AD-Tg小鼠分離的CP組織中通過RT-qPCR測量的ifn-γ的mRNA表達水平(n=5至8/組;學生t檢驗針對每個時間點)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖3A至3B描繪了(A)8個月大AD-Tg小鼠和WT對照小鼠中CD4+Foxp3+脾細胞頻率(對TCRβ預先門控)的代表性流式細胞術圖;以及(B)對來自1、2、4和8個月大AD-Tg小鼠和WT對照小鼠的脾細胞的定量分析(n=6-8/組;學生t檢驗針對每個時間點)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖4示出了門控策略和在最後一次注射DTx後1天來自AD-Tg/Foxp3-DTR+/-小鼠的脾細胞的代表性流式細胞術圖。連續4天腹膜內(i.p.)注射DTx,實現Foxp3+細胞的約99%消耗。
圖5A至5G示出了在AD-Tg小鼠中短暫地消耗Treg的作用。(A)將AD-Tg/Foxp3-DTR+(其表達DTR轉基因)和非DTR表達AD-Tg同窩出生小鼠(AD-Tg/Foxp3-DTR-)對照組用DTx處理連續4天。在最後一次DTx注射後1天,6個月大經DTx處理的AD-Tg小鼠中通過RT-qPCR測量的基因icam1、cxcl10和ccl2的CP mRNA表達水平(n=6-8/組;學生t檢驗)。(B-D)在最後一次DTx注射後3周,6個月大經DTx處理的AD-Tg小鼠和對照的腦實質(不包括脈絡叢,將其單獨切除)的流式細胞術分析。經DTx處理的AD-Tg/Foxp3-DTR+小鼠和AD-Tg/Foxp3-DTR-對照的腦實質中CD11b高/CD45高mo-MΦ細胞和CD4+T細胞數目增加的定量流式細胞術分析(B)以及CD4+Foxp3+Treg頻率的代表性流式細胞術圖(C)和定量分析(D)(n=3-7/組;學生t檢驗)。(E)在最後一次DTx注射後3周,6個月大經DTx處理的AD-Tg AD-Tg/Foxp3-DTR+和AD-Tg/Foxp3-DTR-對照的腦實質中foxp3和il10的mRNA表達水平(n=6-8/組;學生t檢驗)。(F)GFAP免疫染色的定量分析,其顯示在最後一次DTx注射後3周,來自6個月大經DTx處理的AD-Tg/Foxp3-DTR+小鼠和AD-Tg/Foxp3-DTR-對照小鼠的海馬切片中的星形神經膠質增生(astrogliosis)減輕(比例尺,50μm;n=3-5/組;學生t檢驗)。(G)在最後一次DTx注射後3周,腦實質中il-12p40和tnf-α的mRNA表達水平(n=6-8/組;學生t檢驗)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖6A至6E示出了短暫地消耗Treg對Aβ斑學習/記憶表現的作用。在最後一次DTx注射後3周,5個月大經DTx處理的AD-Tg/Foxp3-DTR+小鼠和AD-Tg/Foxp3-DTR-對照小鼠的腦的(A)代表性顯微鏡圖像和(B)定量分析,針對Aβ斑和Hoechst核染色來進行免疫染色(比例尺,250μm)。量化海馬齒狀回(dentate gyrus,DG)和大腦皮質的第5層中的平均Aβ斑面積和數目(在6μm腦切片中;n=5至6/組;學生t檢驗)。圖6C至6E示出了在最後一次DTx注射後3周,6個月大經DTx處理的AD-Tg/Foxp3-DTR+小鼠和對照小鼠的Morris水迷宮(Morris water maze,MWM)測試表現。在短暫的Treg消耗之後,AD-Tg小鼠相對於AD-Tg對照在MWM的(C)獲得、(D)探索和(E)反向相位中表現出較佳的空間學習/記憶表現(n=7-9/組;針對各成對比較雙向重複測量ANOVA接著是Bonferroni事後分析;*:對於整體的獲得、探索和反向P<0.05,)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖7示出了與年齡匹配WT對照相比的、從6個月大和12個月大APP/PS1AD-Tg小鼠(阿爾茨海默病的小鼠模型(參見材料和方法))分離的CP中通過RT-qPCR測量的ifn-γ的mRNA表達水平(n=5-8/組;學生t檢驗)。誤差棒表示平均值±s.e.m.;*:P<0.05。
圖8A至8I示出了在AD-Tg小鼠中施用每周醋酸格拉替雷(Glatiramer acetate,GA)的治療效果。(A)每周GA治療方案的示意圖。向小鼠(5個月大)皮下(s.c.)注射GA(100μg),在第一周期間注射兩次(第1和4天),此後每周一次地注射,持續總共4周的時間。在最後一次注射後1周(MWM)、1個月(RAWM)和2個月(RAWM,使用不同的實驗空間設置)檢測小鼠的認知表現,並且檢測海馬炎症。圖8B至8D示出了在6m齡時,未經治療的AD-Tg小鼠和經每周-GA治療的AD-Tg小鼠海馬中基因的mRNA表達水平,其顯示在經每周-GA治療的小鼠中(B)諸如TNF-α、IL-1β和IL-12p40的促炎細胞因子的表達降低;(C)抗炎細胞因子IL-10和TGF-β升高,以及(D)神經營養因子IGF-1和BDNF升高(n=6-8/組;學生t檢驗)。在圖8E至8G中,用每周-GA或者用載劑(PBS)處理AD-Tg小鼠(5個月大)並在6m齡時與年齡匹配的WT同窩出生小鼠在MWM任務中進行比較。相對於對照,經治療的小鼠在MWM的(E)獲得、(F)探索和(G)反向相位中表現出較佳的空間學習/記憶表現(n=6-9/組;針對各成對比較雙向重複測量ANOVA接著是Bonferroni事後分析)。圖8H至8I示出了在最後一次GA注射後1個月(H)或2個月(I),相同小鼠在RAWM任務中的認知表現(n=6-9/組;針對各成對比較雙向重複測量ANOVA接著是Bonferroni事後分析)。數據是至少三次獨立實驗的代表。所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖9A至9H進一步示出了在AD-Tg小鼠中施用每周-GA的治療效果。A至B示出了經每周-GA或載劑(PBS)處理並在施用方案的第1周結束時(在總共兩次GA注射之後)檢測的5XFAD AD-Tg小鼠。與年齡匹配WT對照相比的、經處理的6個月大AD-Tg小鼠中CD4+Foxp3+脾細胞頻率(A)和CP IFN-γ表達免疫細胞(B;經細胞內染色並對CD45預先門控)的流式細胞術分析(n=4-6/組;單向ANOVA,之後是Newman–Keuls事後分析)。(C)4個月大AD-Tg小鼠的CP中通過RT-qPCR測量的基因icam1、cxcl10和ccl2的mRNA表達水平,所述小鼠用每周-GA或載劑處理並在每周-GA方案的第1周或第4周結束時進行檢測(n=6-8/組;單向ANOVA,之後是Newman–Keuls事後分析)。圖9D至9E示出了在每周-GA之後、來自6個月大AD-Tg/CX3CR1GFP/+BM嵌合體的腦切片的代表性圖像。CX3CR1GFP細胞位於經每周-GA處理的AD-Tg小鼠中的第三腦室的CP(3V;i)、鄰近腦室間隙(ii)和側腦室的CP(LV;iii)(D;比例尺,25μm)。共聚焦z軸疊加的代表性正交投影,其顯示在經每周-GA處理的7個月大AD-Tg/CX3CR1GFP/+小鼠的CP中GFP+細胞與髓系標誌物CD68共存,而在對照經PBS處理的AD-Tg/CX3CR1GFP/+小鼠中不共存(E;比例尺,25μm)。(F)CX3CR1GFP細胞與髓系標誌物IBA-1共位於經GA處理的AD-Tg/CX3CR1GFP/+小鼠的腦中的Aβ斑附近,並且共表達髓系標誌物IBA-1(比例尺,25μm)。圖9G至9H示出了在每周-GA方案的第2周從4個月大WT小鼠、未經處理AD-Tg小鼠和AD-Tg小鼠的海馬分離的細胞的代表性流式細胞術圖。對CD11b高/CD45高mo-MΦ門控(G)並量化(H;n=4-5/組;單向ANOVA,之後是Newman–Keuls事後分析)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖10A至10H描繪了在AD-Tg小鼠中施用p300抑制劑(C646)的治療效果。在圖10A至10B中,用p300i或載劑(DMSO)處理年長小鼠(18個月)持續1周的時間並在終止處理後1天進行檢測。顯示在p300i處理之後脾中表達IFN-γ的CD4+T細胞的頻率升高(A)和CP中表達IFN-γ的免疫細胞數目升高(B)的代表性流式細胞術圖。圖10C至10E示出了10個月大AD-Tg小鼠腦中的Aβ斑負荷的代表性顯微鏡圖像(C)和定量分析,所述小鼠接受p300i或載劑(DMSO)持續1周的時間並且隨後在另外的3周之後進行檢測。針對Aβ斑並通過Hoechst核染色對腦進行免疫染色(n=5/組;比例尺,250μm)。在海馬DG(D)和大腦皮質的第5層(E)中量化平均Aβ斑面積和斑數目(在6μm腦切片中;n=5-6/組;學生t檢驗)。(F)對不同組的7月齡AD-Tg小鼠的p300i處理(或作為載劑的DMSO)施用方案(1或2個時期)的示意圖。圖10G至10H示出了相對於未經處理AD-Tg組的大腦皮質(第5層)的Aβ斑覆蓋百分比的變化平均值(G)以及大腦可溶性Aβ1-40和Aβ1-42蛋白平均水平的變化(H)(未處理組中的Aβ1-40和Aβ1-42平均水平分別為90.5±11.2和63.8±6.8pg/mg總分數;n=5-6/組;單向ANOVA,之後是Newman–Keuls事後分析)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖11A至11B示出了在AD-Tg小鼠中施用抗PD1抗體的治療效果。(A)實驗組的小鼠、其年齡、處理施用方案以及檢測小鼠的時間點的示意圖。在10月齡時,在實驗的第1天和第4天向5XFAD阿爾茨海默病(AD)轉基因(Tg)小鼠腹膜內(i.p.)注射250μg抗PD1抗體(RMP1-14)或對照IgG(大鼠)抗體並在3周後通過放射臂水迷宮(radial arm water maze,RAWM)空間學習和記憶任務來檢測它們的認知表現。使用年齡匹配的未經處理WT和AD-Tg小鼠作為對照。(B)示出了通過放射臂水迷宮(RAWM)空間學習和記憶任務評估的認知表現。通過雙向重複測量ANOVA來分析數據並使用Bonferroni事後程序來進行後續成對比較。n=6-12/組。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖12A至12B示出了在AD-Tg小鼠中施用抗PD1抗體對產生IFN-γ+的T細胞的系統性作用。(A)實驗組的小鼠、其年齡、處理施用方案以及檢測小鼠的時間點的示意圖。在實驗的第1天和第4天向小鼠腹膜內注射250μg抗PD1抗體(RMP1-14)或對照IgG(大鼠)抗體並在第7天檢測。(B)經PD-1或IgG處理的AD-Tg小鼠以及未經處理的AD-Tg和WT對照中CD4+IFN-γ+T細胞脾細胞頻率(經細胞內染色並且對CD45和TCR-β預先門控)的流式細胞術分析(n=4-6/組;單向ANOVA,之後是Newman–Keuls事後分析;**:P<0.01,指定的處理組之間;誤差棒表示平均值±s.e.m.)。
圖13A至13B示出了在AD-Tg小鼠中進行抗PD1處理之後對CP的作用。將10月齡的AD-Tg小鼠用PD-1、IgG進行處理或者不予處理。在實驗的第1天和第4天向小鼠腹膜內注射250μg抗PD1抗體(RMP1-14)或對照IgG(大鼠)抗體並在第7天檢測。(A)通過實時定量PCR(RT-qPCR)測量的CP IFN-γ水平,與通過流式細胞術測量的CD4+IFN-γ+T細胞脾細胞頻率成正相關(皮爾遜r=0.6284,P<0.05)和負相關。當將CP IFN-γ水平與CD4+Foxp3+CD25+Treg脾細胞頻率(n=3-4/組)進行比較時,在相同小鼠中觀察到相反的負趨勢。(B)相同小鼠的CP中通過RT-qPCR測量的基因cxcl10和ccl2的mRNA表達水平(n=3-4/組;單向ANOVA,之後是Newman–Keuls事後分析)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05。
圖14A至14B示出了當比較1個處理療程相對於2個處理療程時,在AD-Tg小鼠中施用抗PD1抗體的治療效果。使接受了1個抗PD1處理療程的圖11A至11B中所述的小鼠組中的一半小鼠在第一RAWM任務之後再接受一個抗PD1處理療程,或者不予處理。在另外的3周之後,通過RAWM使用用於認知學習和記憶的空間線索的不同且新的實驗設置來測試所有小鼠。(A)實驗組的小鼠、其年齡、處理施用方案以及檢測小鼠的時間點的示意圖。對於每個處理過程,向小鼠腹膜內注射250μg抗PD1抗體(RMP1-14)或對照IgG(大鼠)抗體。(B)示出了通過RAWM空間學習和記憶任務評估的認知表現。使用雙向重複測量ANOVA來分析數據並使用Bonferroni事後程序來進行後續成對比較。n=6-12/組。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖15A至15H示出了通過全反式視黃酸(all-trans retinoic acid,ATRA)提高的系統性Treg水平對AD病理的不利影響。圖15A至15B示出了顯示5個月大AD-Tg小鼠中CD4+/Foxp3+/CD25+Treg脾細胞的頻率升高的代表性流式細胞術圖(A)和定量分析(B),所述小鼠接受ATRA或載劑(DMSO)持續1周的時間(n=5/組;學生t檢驗)。圖15C至15F示出了AD-Tg小鼠腦中的Aβ斑負荷和星形神經膠質增生的代表性顯微鏡圖像(C)和定量分析(D、E、F),所述小鼠在5月齡時接受ATRA或載劑(DMSO)持續1周時間的處理,並且隨後在另外的3周之後進行檢測。針對Aβ斑、GFAP(標記星形神經膠質增生)並通過Hoechst核染色對腦進行免疫染色(n=5/組;比例尺,250μm)。在海馬DG和大腦皮質的第5層中量化平均Aβ斑面積和斑數目,並在海馬中測量GFAP免疫反應性(在6μm腦切片中;n=5-6/組;學生t檢驗)。(G)AD-Tg小鼠大腦腦實質中通過ELISA量化的可溶性Aβ1-40和Aβ1-42的水平,所述小鼠在5月齡時用ATRA或載劑(DMSO)處理1周的時間並且隨後在另外的3周之後進行檢測(n=5-6/組;學生t檢驗)。(H)AD-Tg小鼠在RAWM任務中的認知表現,所述小鼠在5月齡時用ATRA或載劑(DMSO)處理1周的時間並且隨後在另外的3周之後進行檢測(n=5/組;雙向重複測量ANOVA,之後是針對各成對比較的Bonferroni事後分析)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
圖16A至16F示出了通過每周-GA施用提高的系統性Treg水平對AD病理的不利影響。(A)與每周-GA方案相比的每日-GA處理方案的圖示。在每日-GA處理組中,每日向小鼠皮下注射100μg GA,持續1個月的時間。(B)與年齡匹配WT和未經處理AD-Tg小鼠相比,經每日-GA和每周-GA處理的7個月大AD-Tg小鼠的認知表現,其如通過在RAWM學習和記憶任務中每天的平均錯誤次數所評估(n=6-8/組;單向ANOVA,之後是Newman–Keuls事後分析)。(C)未經處理AD-Tg小鼠和經每日或每周-GA處理的AD-Tg小鼠的大腦皮質和海馬(HC)的代表性顯微鏡圖像,所述小鼠經針對Aβ斑和Hoechst核染色進行免疫染色(比例尺,250μm)。圖16D-16F示出了經GA處理的AD-Tg小鼠(每日-GA和每周-GA組)和未經處理AD-Tg小鼠中的Aβ斑尺寸和數目(每6μm切片)的量化。經每周-GA處理的AD-Tg小鼠顯示作為其海馬齒狀回(DG)總面積百分比的Aβ斑負荷降低,以及平均Aβ斑數目減少(n=6/組;單向ANOVA,之後是Newman–Keuls事後分析)。在所有圖中,誤差棒均表示平均值±s.e.m.;*:P<0.05;**:P<0.01;***:P<0.001。
具體實施方式
根據本發明已發現,在阿爾茨海默病的小鼠模型(AD-Tg小鼠)中短期地暫時消耗Foxp3+調節性T細胞(Treg)導致白細胞通過腦脈絡叢向CNS的募集提高、CNS浸潤性抗炎單核細胞源性巨噬細胞mo-MΦ和CD4+T細胞的數量升高並且在腦中聚集的Foxp3+Treg顯著富集。此外,單一治療期的長期作用導致海馬神經膠質增生減輕並且腦中促炎細胞因子的mRNA表達水平降低。重要的是,對疾病病理的作用包括AD-Tg小鼠中表現出穩健Aβ斑病理的兩個腦區域海馬齒狀回和大腦皮質(第5層)中的大腦澱粉樣蛋白β(Aβ)斑負荷減小。最重要的是,在Treg的短期暫時消耗之後空間學習和記憶顯著改善,達到與野生型小鼠近似的認知表現(實施例2和3)。總而言之,這些發現證明,短期Treg消耗接著無幹擾時期導致短暫地破壞AD-Tg小鼠中Treg介導的系統性免疫抑制,其使得消炎細胞mo-MΦ和Treg能夠向腦募集並且導致神經炎性應答消退、Aβ清除和認知下降逆轉。這些發現強烈反駁該研究領域中的常識,根據所述常識,提高系統性免疫抑制將導致神經炎性應答減輕。相反,我們的發現顯示需要通過短期地、短暫地且暫時地降低Treg介導的系統性抑制來加強系統性應答以在腦中實現消炎免疫細胞聚集(包括Treg自身),由此抵抗AD病理。
如下文所詳述的,已通過使用數個獨立的實驗範例來證明本文中提供的發明人方法的特異性。簡言之,首先發明人在兩個不同的施用方案中使用了免疫調節性化合物,所述施用方案對外周Treg水平、CP活化和疾病病理產生相反的作用:每日施用方案,其增強外周Treg水平(Weber等,2007);和每周施用方案,發明人發現其降低外周Treg水平(實施例3和實施例5)。當在AD-Tg小鼠中通過Treg的短暫體內基因消耗(實施例2)或者通過其Foxp3功能的藥理學抑制(實施例3和4)來證明這些操作導致CP活化促進白細胞向CNS運輸、在病理部位發生消炎免疫細胞聚集、大腦Aβ斑清除和腦實質的免疫環境偏向炎症消退時,發明人還提供了外周Treg水平和疾病病理之間的直接功能性聯繫。
根據本發明還已發現,不頻繁地施用通用抗原Copolymer-1持續有限的時間(代表1個治療期)降低Treg介導的系統性免疫抑制並且通過提高腦脈絡叢門活性而改善白細胞向CNS中的選擇性浸潤,從而對阿爾茨海默病病理產生顯著的有益作用(實施例3),而增強Treg免疫抑制的Copolymer1的每日施用(Hong等,2005;Weber等,2007)顯示對疾病病理無有益作用或者甚至有一定程度的不利影響(實施例5)。本發明的發明人在本文中還表明,通過用特異性小分子抑制劑(p300i)抑制p300或者使PD-1-抗體與PD-1受體相互作用來直接幹擾Foxp3Treg活性提高AD-Tg小鼠中的脈絡叢門活性並且減輕阿爾茨海默病病理(實施例4)。
重要的是,發明人提供的這些實例分別證明了導致系統性免疫抑制短期減低的不同幹預:Copolymer-1充當免疫調節性化合物,p300i充當降低Foxp3乙醯化和Treg功能的小分子,而抗PD-1用作Treg上表達的PD-1的中和抗體。這些治療方法用於短暫地增強外周中的免疫應答的短期治療,其主要通過升高外周IFN-γ水平和IFN-γ產生細胞,由此活化腦脈絡叢,從而允許T細胞和單核細胞向CNS中選擇性地浸潤並且這些細胞向病理和神經炎症部位歸巢。在本文中還發現,間插有非治療間隔期的重複治療期相對於單一治療期而言顯著提高治療效力(實施例4)。緊接著的非治療時間間隔允許腦中的Treg水平和活性短暫地增強,促進神經炎症消退並且誘導有利於CNS癒合和修復的環境條件,隨後導致組織恢復。在所有這些情況下,對腦病理的作用均是穩健的,涉及神經炎性應答消退、澱粉樣蛋白β斑從AD小鼠腦清除和認知下降逆轉。還已在AD的轉基因小鼠模型中使用Foxp3+調節性T細胞的短暫消耗的遺傳模型來證明當前方法的特異性(實施例2)。
因此,根據本發明已發現Foxp3+CD4+Treg介導的系統性免疫抑制幹擾抵抗AD病理的能力,其至少部分地通過抑制協調消炎白細胞向CNS募集所需的IFN-γ依賴性CP活化來起作用(Schwartz和Baruch,2014b)。系統性Treg是維持自身免疫穩態並保護免受自身免疫性疾病的關鍵(Kim等,2007)。然而,我們的發現表明:在神經變性病症下,當腦中需要修復性免疫應答時,引發該應答的能力被系統性Treg幹擾。儘管如此,根據我們的結果,腦中需要Treg,其向神經病理部位歸巢並且局部執行抗炎活性。本發明代表針對在抵抗如AD的進行性神經元死亡方面的明顯矛盾需求的獨特且意料之外的解決方案:為了增加患病腦中的Treg而短暫地降低/抑制循環中的Treg。因此,短期且暫時降低外周免疫抑制對病理產生長期作用,所述降低允許抗炎細胞(包括Treg和mo-MΦ)向腦斑部位募集。然而,顯著的是,短暫地降低系統性Treg水平或活性可有助於經由另外機理的疾病減輕,所述機理包括支持CNS特異性的保護性自身免疫應答(Schwartz和Baruch,2014a),或提高在清除血管Aβ中發揮作用的循環單核細胞的水平(Michaud等,2013)。
儘管病因不同的神經變性疾病共有共同的局部神經炎性組分,但是我們的結果強烈反駁將所有的CNS病理簡單化地表徵為會一律從系統性抗炎治療受益的疾病。因此,儘管例如復發-緩解型多發性硬化(RRMS)的自身免疫性炎性腦病理受益於連續地系統性施用抗炎藥物和免疫抑制性藥物來實現持久的外周免疫抑制,但在慢性神經變性疾病例如在AD、原發性進行性多發性硬化(primary progressive multiple sclerosis,PP-MS)和繼發性進行性多發性硬化(secondary-progressive multiple sclerosis,SP-MS)的情況下這將是無效的或者對病理產生不利影響(實施例5)。此外,我們的發現揭示了關於系統性Treg相對於組織相關性Treg在這些病理中的作用的錯誤認知(He和Balling,2013)。由於免疫-腦軸是終身腦可塑性的一部分(Baruch等,2014)並且神經變性疾病主要是年齡相關性的,因此我們的本發現還表明更具一般性的現象,其中系統性免疫抑制幹擾腦功能。因此,短期的周期性降低系統性免疫抑制過程可代表適用於廣泛範圍腦病理(包括AD和年齡相關性痴呆)的治療方法或者甚至預防方法。
重要的是,本文中在AD小鼠模型中提供的發明人方法和發現不是直接地靶向AD中的任何疾病特異性因子(例如澱粉樣蛋白β或tau病理學)而是證明了預期在臨床上適用於廣泛範圍CNS病理的新方法-短暫地降低Treg介導的系統性免疫抑制以增強消炎免疫細胞向CNS內的病理部位募集。
鑑於上述意想不到的結果,本發明提供了一種用於治療不包括自身免疫性神經炎性疾病—復發-緩解型多發性硬化(RRMS)的CNS的疾病、障礙、病症或損傷的藥物組合物,其包含導致個體中系統性免疫抑制的水平降低的活性劑,其中所述藥物組合物用於通過包括至少兩個治療過程的給藥方案來施用,每個治療過程順序地包括治療期,之後是非治療的間隔期。
在某些實施方案中,對所述給藥方案進行校正使得短暫地降低系統性免疫抑制的水平。
本文中使用的術語「治療」指獲得期望生理效應的手段。就部分或完全地治療疾病和/或由該疾病引起的症狀而言,所述效應可以是治療性的。該術語指抑制疾病,即停止或減慢其發展;或者改善疾病,即促使疾病消退。
術語「非治療期」在本文中可與術語「無治療時期」互換使用,並且指在此期間不向所治療的個體施用活性劑的時期。
本文中使用的術語調節性T細胞的「系統性存在」指調節性T細胞在循環免疫系統(即,血液、脾和淋巴結)中的存在(如通過其水平或活性所測量的)。免疫學領域中眾所周知的事實是:脾中的細胞群譜反映在血液中的細胞群譜(Zhao等,2007)。
本發明的治療適用於表現出系統性免疫抑制升高的患者和未表現出這樣的升高的患者二者。有時,需要根據本發明的治療的個體具有一定的外周免疫抑制水平,其反映在循環中Treg的頻率或數目升高,和/或Treg的功能活性增強和/或IFNγ產生白細胞減少和/或響應於刺激的白細胞增殖降低。Treg頻率或數目的升高可以以總數目計或者作為總CD4細胞的百分比計。例如,根據本發明已發現,與野生型小鼠相比,阿爾茨海默病動物模型的CD4細胞中具有較高的Foxp3頻率。然而,在所述個體中,即使系統性Treg細胞的水平未升高、其功能活性未增強、IFNγ產生白細胞的水平未降低或者響應於刺激的白細胞增殖未降低,降低系統性免疫抑制水平或活性的本發明方法仍有效地治療不包括自身免疫性神經炎性疾病—RRMS的CNS的疾病、障礙、病症或損傷。重要的是,所述系統性免疫抑制還可涉及除Treg之外的另外免疫細胞類型,例如髓源性抑制細胞(myeloid-derived suppressor cell,MDSC)(Gabrilovich和Nagaraj,2009)。
系統性免疫抑制的水平可通過本領域普通技術人員公知的多種方法來進行檢測。例如,可通過如下對外周血單核細胞和T淋巴細胞進行流式細胞術來測量Treg的水平:針對Treg的細胞表面標誌物或核細胞內標誌物(Chen&Oppenheim,2011)、CD45、TCR-β或淋巴細胞的CD4標誌物進行免疫染色並測量與所述細胞特異性結合的抗體的量。Treg的功能活性可通過多種測定來測量;例如,常用的是胸苷摻入測定,其中通過[3H]胸苷摻入或者通過使用CFSE(5-(和6)-羧基螢光素二乙酸琥珀醯亞胺酯(其能夠進入細胞)來測量針對抗CD3mAb刺激的CD4+CD25-T細胞(傳統T細胞)增殖的抑制;以CFSE螢光強度的連續減半來測量細胞分裂)。IFNγ產生白細胞的數目或者其活性或其增殖能力可容易地由技術人員使用本領域中已知的方法來評估;例如,可如下測量IFNγ產生白細胞的水平:在短暫的離體刺激和golgi-stop並通過IFNγ細胞內染色進行免疫染色(使用例如BD Biosciences Cytofix/cytopermTM固定/透化試劑盒)之後對外周血單核細胞進行流式細胞術分析;收集這些細胞的條件培養基並使用ELISA來量化分泌的細胞因子的水平;或者比較條件培養基中不同細胞因子(例如IL2/IL10、IL2/IL4、INFγ/TGFβ)的比率等。人外周血中MDSC的水平可容易地由技術人員例如通過使用DR-/LIN-/CD11b+、DR-/LIN-/CD15+、DR-/LIN-/CD33+和DR(-/低)/CD14+細胞頻率的流式細胞術分析來評估,如(Kotsakis等,2012)所述的。
在人中,當循環中Treg的總數比健康對照群體中高10%、20%、30%、40%、50%、60%、70%、80%、90%或100%或者更多;與健康對照群體中相比Treg細胞在總CD4+細胞中的百分比升高10%、20%、30%、40%、50%、60%、70%、80%、90%或100%或者更多;或者與健康對照群體中相比Treg的功能活性升高10%、20%、30%、40%、50%、60%、70%、80%、90%或100%或者更多時,可認為外周/系統性免疫抑制是升高的。或者,當IFNγ產生白細胞的水平或其活性相對於健康對照群體降低10%、20%、30%、40%、50%、60%、70%、80%、90%或100%;或者響應於刺激的白細胞增殖相對於健康對照群體降低10%、20%、30%、40%、50%、60%、70%、80%、90%或100%時,可認為外周/系統性免疫抑制是升高的。
當將藥劑施用於個體之後,該個體的循環中Treg的總數與施用該藥劑之前的水平相比降低10%、20%、30%、40%、50%、60%、70%、80%、90%或100%;Treg細胞在總CD4+細胞中的百分比相對於健康對照群體下降10%、20%、30%、40%、50%、60%、70%、80%、90%或100%,或者Treg的功能活性與施用該藥劑之前的水平相比降低10%、20%、30%、40%、50%、60%、70%、80%、90%或100%時,可認為該藥劑是導致系統性免疫抑制的水平降低的藥劑。或者,當將藥劑施用於個體之後,相對於健康對照群體IFNγ產生白細胞的總數或其活性增加10%、20%、30%、40%、50%、60%、70%、80%、90%或100%;或者響應於刺激的白細胞增殖增加10%、20%、30%、40%、50%、60%、70%、80%、90%或100%時,可認為該藥劑是導致系統性免疫抑制的水平降低的藥劑。
根據本發明使用的藥劑可以是下調調節性T細胞的水平或活性或者幹預其活性的任何藥劑,但是可替代性地限於不包括選自以下組成組的藥劑:(i)多巴胺或其藥學可接受鹽;(ii)多巴胺前體或其藥學可接受鹽;(iii)多巴胺受體1型家族的激動劑(D1-R激動劑)或其藥學可接受鹽;和(iv)多巴胺受體2型家族的拮抗劑(D2-R拮抗劑)或其藥學可接受鹽,即使不知道這些藥劑依照根據本發明的治療過程來使用。
在某些實施方案中,治療期包括向個體施用藥物組合物,並且治療期被維持至少直至所述水平下降至參考值以下,在間隔期期間暫停施用,並且只要所述水平低於參考值就一直維持間隔期。所述參考值可選自(a)在於所述施用之前從所述個體獲得的最新血樣中測量的調節性T細胞或髓源性抑制細胞的系統性存在水平或活性水平;或者(b)患有CNS的疾病、障礙、病症或損傷的個體群特徵性的調節性T細胞或髓源性抑制細胞的系統性存在水平或活性水平。
或者,治療期包括向個體施用藥物組合物並且治療期被維持至少直至IFNγ產生白細胞的系統性存在或水平或者響應於刺激的白細胞增殖速率上升至參考值以上,在間隔期期間暫停施用,並且只要所述水平高於所述參考值就一直維持間隔期,其中所述參考值選自(a)在於所述施用之前從所述個體獲得的最新血樣中測量的IFNγ產生白細胞的系統性存在水平或活性水平或者響應於刺激的白細胞增殖速率;或者(b)患有CNS的疾病、障礙、病症或損傷的個體群特徵性的IFNγ產生白細胞的系統性存在水平或活性水平或者響應於刺激的白細胞增殖速率。
治療期和間隔期的時長可由醫生在臨床試驗中針對特定患者群來確定,並且隨後可一致地適用於該患者群而無需根據個人監測免疫抑制的水平。
在某些實施方案中,治療期可時長為3天至4周,例如時長1周至4周。
在某些實施方案中,間隔期可為1周至6個月,例如時長2周至6個月,特別是時長3周至6個月。
在治療期中,藥物組合物的施用可以是重複施用,例如藥物組合物可每日或者每2、3、4、5或6天一次地,每周一次地,每兩周一次地,每三周一次地或者每4周一次地施用。這些頻率適用於任何活性劑、可基於本領域中的常用實踐並且可最終由醫生在臨床試驗中確定。或者,可根據活性劑的性質來調整治療期中重複施用的頻率,其中例如小分子可每日施用;抗體可每3天一次地施用;而copolymer 1可每周、每兩周一次地、每三周一次地或每四周一次地施用。應理解,當在治療期期間以相對低的頻率(例如在1個月的治療期期間每周一次或者在六個月的治療期期間每月一次)施用諸如copolymer 1的藥劑時,在該治療期之後是非治療間隔期,其時長長於治療期期間的重複施用之間的時間(即,在該實例中分別長於1周或1個月)。該實例中治療期期間的施用之間的一周或一個月暫停不視為間隔期。
可相對於施用頻率來調整治療期和間隔期的時長使得例如每3天一次地施用活性劑的頻率可產生6天或9天的治療期和相應開始的間隔期。
作為預定一般性治療方案的替代方案,可如下針對所治療的每個患者將免疫抑制水平校正至期望的水平(個性化醫療):個別地監測Treg細胞的水平或活性(或者IFN-γ產生白細胞的水平或活性,或者響應於刺激的白細胞增殖速率)並如由監測結果所確定的憑經驗且個性地調整治療期、施用頻率和間隔期。
因此,可如下確定治療期的時長:(a)通過測量在所述施用之後的預定時間段內從個體獲得的血樣中的水平來監測該個體中調節性T細胞的系統性存在水平或活性水平;(b)將(a)中測量的水平與上述參考值進行比較並確定該水平是否與參考值不同;(c)基於(a)中測量的所述水平與所述參考值的關係來決定是通過重複施用繼續治療期還是通過制止重複施用來開始接下來的間隔期;以及(d)根據(c)中的決定來重複施用或開始接下來的間隔期。或者,可監測IFN-γ產生白細胞的水平或響應於刺激的白細胞增殖速率並與上述合適的參考值進行比較。
類似地,可如下確定間隔期的時長:(a)通過測量在所述施用之後的預定時間段內從個體獲得的血樣中的水平來監測該個體中調節性T細胞的系統性存在水平或活性水平;(b)將(a)中測量的水平與上述參考值進行比較並確定該水平是否與參考值不同;(c)基於(a)中測量的所述水平與所述參考值的關係來決定是通過重複施用以及步驟(a)和(b)來開始新的治療過程還是通過僅重複驟(a)和(b)來延長間隔期;以及(d)根據(c)中的決定來重複施用以及步驟(a)和(b)或者僅重複步驟(a)和(b)。或者,可監測IFN-γ產生白細胞的水平或響應於刺激的白細胞增殖速率並與上述合適的參考值進行比較。
在任何情況下,均將給藥方案(即治療期和間隔期的時長)校正成使得免疫抑制水平的降低(例如,如通過個體中調節性T細胞的系統性存在水平或活性水平的降低所測量的)是短暫的。
在某些實施方案中,所述預定時間段,即在最近施用活性劑和監測步驟之間經過的時間為2天至6個月。
在某些實施方案中,所監測的調節性T細胞是選自以下的CD4+細胞:表達CD25、CD127、GITR、CTLA-4或PD-1中一種或更多種的FoxP3+細胞;或者表達CD25、CD127、GITR、CTLA-4或PD-1表面分子中一種或更多種的FoxP3-細胞。特別地,常見的調節性T細胞表型是CD4+CD25+FoxP3+細胞或CD4+CD25+FoxP3-細胞。
能夠降低調節性T細胞的水平的藥劑在本領域中是已知的(Colombo和Piconese,2007)並且這些藥劑可根據本發明使用。下文所引用的出版物各自通過引用併入,如同在本文中完全公開一樣。
因此,所述藥劑可選自但並非必需限於:(i)諸如以下的抗體:(a)抗PD-1、(b)抗PD-L1、(c)抗PD-L2(Coyne和Gulley,2014;Duraiswamy等,2014;Zeng等,2013)、(d)抗CTLA-4(Simpson等,2013;Terme等,2012)、(e)與幹擾素α組合的抗PD-1(Terawaki等,2011)、(f)與抗CTLA4組合的抗PD-1、(g)抗CD47(Tseng等,2013)、(h)抗OX40(Voo等,2013)、(i)抗VEGF-A(貝伐單抗)(Terme等,2013)、(j)抗CD25(Zhou等,2013)、(k)抗GITR(觸發GITR的mAb(DTA-1))(Colombo和Piconese,2007)、(l)抗CCR4、(m)抗TIM-3/半乳凝集素9(Ju等,2014)、(n)抗-殺傷細胞免疫球蛋白樣受體(killer-cell immunoglobulin-like receptor,KIR)、(o)抗LAG-3;或(p)抗4-1BB;(ii)(a)至(p)的任意組合;(iii)與佐劑組合的(a)至(p)的任意組合,例如與抗OX40抗體和TLR9配體(例如CpG)組合的抗CTLA-4抗體(Marabelle等,2013);(iv)選自以下的小分子:(a)p300抑制劑(Liu等,2013),例如吉西他濱(低劑量)(Shevchenko等,2013),或者C646或其類似物,即式I的化合物:
其中
R1選自H、-CO2R6、-CONR6R7、-SO3H或-SO2NR6R7;
R2選自H、-CO2R6或滷素,優選Cl;
R3選自滷素(優選F)、-NO2、-CN、-CO2R6(優選CO2CH3或CO2CH2CH3)或-CH2OH;
R4和R5各自獨立地是H或-C1-C6烷基,優選甲基;
R6是H或-C1-C6烷基,優選H、甲基或乙基;並且
R7是H或-C1-C6烷基,優選H或甲基[參見(Bowers等,2010)];
(b)舒尼替尼(Terme等,2012);(c)多金屬氧酸鹽-1(Polyoxometalate-1,POM-1)(Ghiringhelli等,2012);(d)α,β-亞甲基腺苷5』–二磷酸(α,β-methyleneadenosine 5』-diphosphate,APCP)(Ghiringhelli等,2012);(e)三氧化二砷(As2O3)(Thomas-Schoemann等,2012);(f)GX15-070(Obatoclax)(Kim等,2014);(g)視黃酸拮抗劑,例如Ro 41-5253(一種合成的類視黃醇和選擇性小分子拮抗劑)(Galvin等,2013)或LE-135(Bai等,2009);(h)SIRPα(CD47)拮抗劑,例如CV1-hIgG4(SIRPα變體),其作為單一藥劑或與抗CD47抗體組合(Weiskopf等,2013);(i)CCR4拮抗劑,例如AF399/420/18025,其作為單一藥劑或與抗CCR4抗體組合(Pere等,2011);(j)腺苷A2B受體拮抗劑,例如PSB603(Nakatsukasa等,2011);(k)吲哚胺-2,3-加雙氧酶(indoleamine-2,3-dioxygenase,IDO)的拮抗劑;或(l)HIF-1調節劑;(v)選自以下的蛋白質:(a)印楝葉糖蛋白(Neem leaf glycoprotein,NLGP)(Roy等,2013);或(b)sCTLA-4(CTLA-4的可溶性同工型);(vi)沉默分子,例如miR-126反義分子(Qin等,2013)和抗-半乳凝集素-1(galectin-1,Gal-1)(Dalotto-Moreno等,2013);(vii)OK-432(釀膿鏈球菌(Streptococcus pyogenes)的凍幹製劑)(Hirayama等,2013);(viii)IL-12和抗CTLA-4的組合;(ix)Copolymer 1或者調節Treg活性或水平的共聚物;(x)抗生素劑,例如萬古黴素(Brestoff和Artis,2013;Smith等,2013);或者(xi)(i)至(x)的任意組合。
在某些實施方案中,所述藥劑是抗PD-1抗體,即對PD-1具有特異性的抗體。
很多抗PD-1抗體在本領域中是已知的。例如,根據本發明使用的抗PD-1抗體可選自Ohaegbulam等(Ohaegbulam等,2015)(其全部內容均在此通過引用併入本文)中公開的那些,即CT-011(pidilizumab;人源化IgG1;Curetech)、MK-3475(lambrolizumab、派姆單抗(pembrolizumab);人源化IgG4;Merck)、BMS-936558(納武單抗(nivolumab);人IgG4;Bristol-Myers Squibb)、AMP-224(PD-L2IgG2a融合蛋白;AstraZeneca)、BMS-936559(人IgG4;Bristol-Myers Squibb)、MEDI4736(人源化IgG;AstraZeneca)、MPDL3280A(人IgG;Genentech)、MSB0010718C(人IgG1;Merck-Serono),或者根據本發明使用的抗體可以是MEDI0680(AMP-514;AstraZeneca),一種人源化IgG4mAb。
在某些實施方案中,CT-011抗體可以以0.2mg/kg至6mg/kg或以1.5mg/kg至6mg/kg的劑量施用於人;MK-3475抗體可以以1mg/kg至10mg/kg的劑量施用於人;BMS-936558可以以0.3mg/kg至20mg/kg、0.3mg/kg至10mg/kg、1mg/kg至10mg/kg的劑量或者以1mg/kg或3mg/kg的劑量施用於人;BMS-936559可以以0.3mg/kg至10mg/kg的劑量施用於人;MPDL3280A可以以1mg/kg至20mg/kg的劑量施用於人;MEDI4736可以以0.1mg/kg至15mg/kg的劑量施用於人;MSB0010718C可以以1mg/kg至20mg/kg的劑量施用於人。
抗CTLA4抗體可以是Tremelimumab(Pfizer),一種全人IgG2單克隆抗體;或易普利姆瑪(ipilimumab),一種全人人IgG1單克隆抗體。
抗-殺傷細胞免疫球蛋白樣受體(KIR)抗體可以是Lirilumab(BMS-986015;由Innate Pharma開發並特許給Bristol-Myers Squibb),一種全人單克隆抗體。
抗LAG-3抗體針對淋巴細胞活化基因-3。可根據本發明使用的一種這樣的抗體是單克隆抗體BMS-986016(派姆單抗);人源化IgG4;Merck)。
抗4-1BB抗體可以是靶向4-1BB的PF-05082566(Pfizer Oncology),一種全人源化IgG2激動劑單克隆抗體;或Urelumab(BMS-663513;Bristol-Myers Squibb),一種全人IgG4單克隆抗體。
在某些實施方案中,可使用抗體組合,其例如但不限於與利妥昔單抗(商品名Rituxan、MabThera和Zytux)(一種針對CD20蛋白的嵌合單克隆抗體)組合的CT-011,例如各自為3mg/kg;與易普利姆瑪(例如3mg/kg)組合的BMS-936558(例如1mg/kg);或者與HLA-A*0201限制性多肽疫苗組合的BMS-936558(例如1mg/kg至10mg/kg)(Weber等,2013)。
表1*
*基於Bowers等(2010)
在某些實施方案中,所述藥劑是p300抑制劑,其式列於表1中,即C646(4-(4-((5-(4,5-二甲基-2-硝基苯基)呋喃-2-基)亞甲基)-3-甲基-5-氧代-4,5-二氫-1H-吡唑-1-基)苯甲酸)、C146(4-羥基-3-(((2-(3-碘苯基)苯並[d]唑-5-基)亞氨基)甲基)苯甲酸)或C375(2-氯-4-(5-((2,4-二氧代-3-(2-氧代-2-(對甲苯基氨基)乙基)噻唑烷-5-亞基)甲基)呋喃-2-基)苯甲酸)。特別地,p300抑制劑是C646。
在某些實施方案中,吲哚胺-2,3-雙加氧酶通路的小分子抑制劑可以是Indoximod(NLG-9189;NewLink Genetics)、INCB024360(Incyte)或NLG-919(NewLink Genetics)。
HIF-1調節劑可以是Zheng等(Zheng等,2015)中所述的M30,即5-[N-甲基-N-炔丙基氨基甲基]-8-羥基喹啉。
在某些實施方案中,所述藥劑可來源於靶向革蘭氏陽性細菌和革蘭氏陰性細菌並且從而有利於Treg的免疫調節的廣譜抗生素,例如靶向革蘭氏陽性細菌並且已顯示降低Treg水平/活性的萬古黴素(Brestoff和Artis,2013;Smith等,2013)。
在某些實施方案中,所述藥劑可以是在某一方案中將導致Treg下調的任何共聚物,例如YFAK、VYAK、VWAK、VEAK、FEAK、FAK、VAK或WAK。本文中使用的術語「Cop-1」和「Copolymer 1」可互換使用。
本發明的藥物組合物可包含調節Treg活性或水平的無規共聚物作為活性劑,所述無規聚合物包含適量的帶正電荷胺基酸(例如賴氨酸或精氨酸),其與帶負電荷胺基酸(優選較少量)(例如穀氨酸或天冬氨酸)組合、任選地與不帶電荷的中性胺基酸(例如丙氨酸或甘氨酸)(充當填料)並且任選地與適於賦予共聚物免疫原性的胺基酸(例如芳族胺基酸,如酪氨酸或色氨酸)組合。這樣的組合物可包括WO 00/05250中公開的任意那些共聚物,其全部內容均在此通過引用併入本文。
更特別地,用於本發明的組合物包含選自由無規共聚物組成的組的至少一種共聚物,所述無規共聚物含有選自以下至少三組中每一組的一個胺基酸:(a)賴氨酸和精氨酸;(b)穀氨酸和天冬氨酸;(c)丙氨酸和甘氨酸;以及(d)酪氨酸和色氨酸。
用於本發明的共聚物可由L-胺基酸或D-胺基酸或者其混合物構成。本領域技術人員知曉,L-胺基酸存在於大多數天然蛋白質中。然而,D-胺基酸可商購獲得並且可替換用於製備用於本發明的三元共聚物及其他共聚物的一些或全部胺基酸。本發明考慮使用包含D-和L-胺基酸二者的共聚物以及基本由L-或D-胺基酸組成的共聚物。
在某些實施方案中,本發明的藥物組合物包含Copolymer 1,其是基本上由胺基酸L-穀氨酸(E)、L-丙氨酸(A)、L-酪氨酸(Y)和L-賴氨酸(K)以1.5:4.8:1:3.6的近似比組成的無規多肽的混合物、具有淨總正電荷並且分子量為約2KDa至約40KDa。在某些實施方案中,Cop 1的平均分子量為約2KDa至約20KDa、約4,7KDa至約13K Da、約4KDa至約8.6KDa、約5KDa至9KDa或者約6.25KDa至8.4KDa。在另一些實施方案中,Cop 1的平均分子量為約13KDa至約20KDa、約13KDa至約16KDa或者約15KDa至約16KDa。本發明還涵蓋Cop 1的低於40KDa的其他平均分子量。所述分子量範圍的Copolymer 1可通過本領域中已知的方法,例如通過美國專利No.5,800,808中所述的方法來製備,其全部內容均在此通過引用整體併入本文。Copolymer 1可以是長度上包含約15至約100或者約40至約80個胺基酸的多肽。在某些實施方案中,Cop 1為以通用名稱醋酸格拉替雷為人知曉的其醋酸鹽的形式,其已以商品名(Teva Pharmaceuticals Ltd.,Petach Tikva,Israel的商標)在數個國家被批准用於治療多發性硬化(MS)。如果進行以下一種或更多種替換,預期Copolymer 1對本文所公開藥物組合物的活性仍得以保留:天冬氨酸替換穀氨酸、甘氨酸替換丙氨酸、精氨酸替換賴氨酸和色氨酸替換酪氨酸。
在本發明的某些實施方案中,調節Treg活性或水平的共聚物是三種不同胺基酸的共聚物,所述不同胺基酸各自來自於組(a)至(d)中三個組的不同組。本文中將這些共聚物稱為三元共聚物。
在一個實施方案中,調節Treg活性或水平的共聚物是包含酪氨酸、丙氨酸和賴氨酸的三元共聚物(在下文命名為YAK),其中所述胺基酸的平均摩爾分數可改變:酪氨酸可以以約0.05至0.250的摩爾分數存在、丙氨酸以約0.3至0.6的摩爾分數存在;並且賴氨酸以約0.1至0.5的摩爾分數存在。酪氨酸、丙氨酸和賴氨酸的摩爾比可分別為約0.10:0.54:0.35。用精氨酸替換賴氨酸、甘氨酸替換丙氨酸和/或色氨酸替換酪氨酸是可能的。
在某些實施方案中,調節Treg活性或水平的共聚物是包含酪氨酸、穀氨酸和賴氨酸的三元共聚物(在下文命名為YEK),其中所述胺基酸的平均摩爾分數可改變:穀氨酸可以以約0.005至0.300的摩爾分數存在、酪氨酸可以以約0.005至0.250的摩爾分數存在並且賴氨酸可以以約0.3至0.7的摩爾分數存在。穀氨酸、酪氨酸和賴氨酸的摩爾比可分別為約0.26:0.16:0.58。用天冬氨酸替換穀氨酸、精氨酸替換賴氨酸和/或色氨酸替換酪氨酸是可能的。
在某些實施方案中,調節Treg活性或水平的共聚物是包含賴氨酸、穀氨酸和丙氨酸的三元共聚物(在下文命名為KEA),其中所述胺基酸的平均摩爾分數可改變:穀氨酸可以以約0.005至0.300的摩爾分數存在、丙酸以約0.005至0.600的摩爾分數存在並且賴氨酸以約0.2至0.7的摩爾分數存在。穀氨酸、丙氨酸和賴氨酸的摩爾比可分別為約0.15:0.48:0.36。用天冬氨酸替換穀氨酸、甘氨酸替換丙氨酸和/或精氨酸替換賴氨酸是可能的。
在某些實施方案中,調節Treg活性或水平的共聚物是包含酪氨酸、穀氨酸和丙氨酸的三元共聚物(在下文命名為YEA),其中所述胺基酸的平均摩爾分數可改變:酪氨酸可以以約0.005至0.250的摩爾分數存在、穀氨酸可以以約0.005至0.300的摩爾分數存在並且丙氨酸以約0.005至0.800的摩爾分數存在。穀氨酸、丙氨酸和酪氨酸的摩爾比可分別為約0.21:0.65:0.14。用色氨酸替換酪氨酸、天冬氨酸替換穀氨酸和/或甘氨酸替換丙氨酸是可能的。
三元共聚物YAK、YEK、KEA和YEA的平均分子量變化範圍可為約2KDa至40KDa,優選約3KDa至35KDa,更優選約5KDa至25KD不等。
Copolymer 1及調節Treg活性或水平的其他共聚物可通過本領域中已知的方法來製備,例如在縮合條件下在溶液中使用期望摩爾比的胺基酸或者通過固相合成操作。縮合條件包括用於使一個胺基酸的羧基與另一胺基酸的氨基縮合形成肽鍵的合適的溫度、pH和溶劑條件。可使用縮合劑(例如二環己基碳二亞胺)來促進肽鍵的形成。可使用封閉基團來保護官能團(例如側鏈部分和一些氨基或羧基)免受不期望的副反應。
例如,可通過美國專利3,849,550中公開的方法來製備共聚物,其中在環境溫度下(20℃至26℃)在無水二氧六環中以二乙胺作為引發劑使酪氨酸、丙氨酸、穀氨酸γ-苄酯和Nε-三氟乙醯基-賴氨酸的N-羧酸酐聚合。穀氨酸的γ-羧基可通過溴化氫在冰醋酸中去封閉。三氟乙醯基通過1M哌啶來從賴氨酸中脫除。本領域技術人員容易理解,可通過選擇性地消除涉及穀氨酸、丙氨酸、酪氨酸或賴氨酸中任一個的反應來對所述方法進行調整以製備包含期望胺基酸(即,Copolymer 1中四種胺基酸中的三種)的肽和多肽。
共聚物的分子量可在多肽合成期間或者在共聚物已製備之後進行調節。為了在多肽合成期間調節分子量,對合成條件或胺基酸量進行調整使得當多肽達到期望的近似長度時合成停止。在合成之後,可通過任何可利用的尺寸選擇操作(例如,在分子量篩分柱或凝膠上對多肽進行色譜)並收集期望的分子量範圍來獲得具有期望分子量的多肽。還可例如通過酸或酶促水解來使共聚物部分水解以消除高分子量物類,然後純化以除去酸或酶。
在一個實施方案中,可通過包括以下的方法來製備具有期望分子量的共聚物:使受保護的多肽與氫溴酸反應以形成具有期望分子量譜的三氟乙醯基-多肽。在通過一個或更多個測試反應預先確定的時間和溫度下進行該反應。在測試反應期間,改變時間和溫度並確定給定受試多肽批次的分子量範圍。將對所述多肽批次提供最佳分子量範圍的測試條件用於該批次。因此,可通過包括以下的方法來合成具有期望分子量譜的三氟乙醯基-多肽:在通過測試反應預先確定的時間和溫度下使受保護的多肽與氫溴酸反應。然後,用哌啶水溶液進一步處理具有期望分子量譜的三氟乙醯基-多肽以形成具有期望分子量的低毒性多肽。
在某些實施方案中,使來自給定批次的受保護多肽的受試樣品與氫溴酸在約20℃至28℃的溫度下反應約10小時至50小時。用於該批次的最佳條件通過進行數個測試反應來確定。例如,在一個實施方案中,使受保護的多肽與氫溴酸在約26℃的溫度下反應約17小時。
由於Cop 1與MS相關性HLA-DR分子的結合基序是已知的(Fridkis-Hareli等,1999),因此可容易地製備具有限定序列的多肽並測試與HLA-DR分子的肽結合槽的結合,如Fridkis-Hareli等(1999)出版物中所述的。這樣的肽的實例是WO 00/05249和WO 00/05250(其全部內容均在此通過引用併入本文)中公開的那些並且包括SEQ ID NO.1-32的肽(表2)。
預期這樣的肽及其他類似肽與Cop1具有類似的活性。這樣的肽及其他類似肽還被視為在與CNS髓鞘抗原交叉反應的共聚物的定義之內並且認為其使用是本發明的一部分。
表2
根據本發明的「調節Treg活性或水平的共聚物」的定義意指涵蓋其他的合成胺基酸共聚物,例如Fridkis-Hareli等,2002和美國專利8,017,125所述的無規四胺基酸共聚物(作為用於治療多發性硬化的候選物),即以下共聚物:包含胺基酸纈氨酸(V)、苯丙氨酸(F)、丙氨酸(A)和賴氨酸(K)的VFAK;包含胺基酸纈氨酸(V)、酪氨酸(Y)、丙氨酸(A)和賴氨酸(K)的VYAK;包含胺基酸纈氨酸(V)、色氨酸(W)、丙氨酸(A)和賴氨酸(K)的VWAK;包含胺基酸纈氨酸(V)、穀氨酸(E)、丙氨酸(A)和賴氨酸(K)的VEAK;包含胺基酸苯丙氨酸(F)、穀氨酸(E)、丙氨酸(A)和賴氨酸(K)的FEAK;包含胺基酸苯丙氨酸(F)、丙氨酸(A)和賴氨酸(K)的FAK;包含胺基酸纈氨酸(V)、丙氨酸(A)和賴氨酸(K)的VAK;以及包含胺基酸色氨酸(W)、丙氨酸(A)和賴氨酸(K)的WAK。
根據本發明的藥物組合物可用於治療為選自以下的神經變性疾病、障礙或病症的CNS疾病、障礙或病症:阿爾茨海默病(Alzheimer’s disease);肌萎縮側索硬化;帕金森病(Parkinson’s disease);亨廷頓病(Huntington’s disease);原發性進行性多發性硬化;繼發性進行性多發性硬化;皮質基底節變性(corticobasal degeneration);雷特症候群(Rett syndrome);選自年齡相關性黃斑變性和視網膜色素變性的視網膜變性病症;前部缺血性視神經病變;青光眼;葡萄膜炎;抑鬱;創傷相關性應激或創傷後應激障礙;額顳痴呆;路易體痴呆(Lewy body dementias);輕度認知受損;後大腦皮質萎縮;原發性進行性失語或進行性核上性麻痺。在某些實施方案中,所述CNS病症是年齡相關性痴呆。
在某些實施方案中,所述CNS病症是阿爾茨海默病、肌萎縮側索硬化、帕金森病、亨廷頓病。
根據本發明的藥物組合物還可用於治療選自以下的CNS損傷:脊髓損傷、閉合性頭部損傷、鈍傷、穿透性創傷、出血性卒中、缺血性卒中、腦缺血、視神經損傷、心肌梗死、有機磷中毒和由腫瘤切除引起的損傷。
如上所述,發明人已發現,本發明改善模擬阿爾茨海默病的小鼠中的認知功能。因此,所述藥物組合物可用於改善CNS運動和/或認知功能,例如用於減輕可發生於無診斷疾病的個體中以及患有神經變性疾病的人中的年齡相關性認知功能喪失。此外,所述藥物組合物可用於減輕由急性應激或創傷性事件引起的認知功能喪失。上文中提及的認知功能可包括學習、記憶或二者。
本文中使用的術語「CNS功能」尤其指接收和處理感覺信息、思考、學習、記憶、感覺、生成和理解語言、控制運動功能以及聽覺和視覺響應、維持平衡和均衡、運動協調、傳導感覺信息和控制諸如呼吸、心率和消化的自主功能。
術語「認知」、「認知功能」和「認知表現」在本文中可互換使用並且與涉及但不限於以下的任何智力過程或狀況相關:學習、記憶、意象生成、思考、意識、推理、空間能力、說話和語言技能、語言獲取和判斷注意能力。認知形成於多個腦區域,例如海馬、皮質及其他腦結構中。然而,認為長期記憶至少部分地儲存於皮質中,並且已知感覺信息通過特定的皮質結構(存在於島葉皮質中的味覺皮質)來獲取、鞏固和檢索。
在人中,認知功能可通過任何已知的方法來測定,所述方法例如但不限於通過臨床總體印象變化量表(CIBIC-補充量表);簡易智力狀況檢查(Mini Mental State Exam,MMSE);神經精神症狀問卷(Neuropsychiatric Inventory,NPI);臨床痴呆評定量表(Clinical Dementia Rating Scale,CDR);劍橋自動化成套神經心理測試(Cambridge Neuropsychological Test Automated Battery,CANTAB)或Sandoz老年臨床評估(Sandoz Clinical Assessment-Geriatric,SCAG)。還可使用諸如以下成像技術來間接測量認知功能:正電子發射斷層顯像(Positron Emission Tomography,PET)、功能性磁共振成像(functional magnetic resonance imaging,fMRI)、單光子發射計算機斷層顯像(Single Photon Emission Computed Tomography,SPECT)或允許測量腦功能的任何其他成像技術。
患者中影響認知的一個或更多個過程的改善將意味著所述患者中認知功能的改善,因此在某些實施方案中,改善認知包括改善學習、可塑性和/或長期記憶。術語「改善」和「增強」在本文中可互換使用。
術語「學習」涉及獲取或獲得新的知識、行為、技能、價值或偏好,或者改變和增強現有的知識、行為、技能、價值或偏好。
術語「可塑性」涉及與腦隨學習而改變和改變已獲取記憶的能力相關的突觸可塑性、腦可塑性或神經可塑性。反映可塑性的一個可測量參數是記憶消退。
術語「記憶」涉及其中編碼、儲存和檢索信息的過程。記憶具有三種可區別的類別:感覺記憶、短期記憶和長期記憶。
術語「長期記憶」是長時間或無限時間地保持信息的能力。長期記憶包括兩個主要部分:外顯記憶(陳述性記憶)和內隱記憶(非陳述性記憶)。長期記憶通過記憶鞏固來實現,記憶鞏固是在記憶痕跡初始獲取之後使其穩定的一類過程。鞏固區分為兩個特定過程:突觸鞏固,其發生於學習之後的前幾個小時;和系統鞏固,其中海馬依賴性記憶歷經數周至數年的時間變得不依賴於海馬。
在另一個方面,本發明涉及用於治療不包括自身免疫性神經炎性疾病—復發-緩解型多發性硬化(RRMS)的中樞神經系統(CNS)的疾病、障礙、病症或損傷的方法,所述方法包括向有此需要的個體施用如上限定的根據本發明的藥物組合物,其中所述藥物組合物通過包括至少兩個治療過程的給藥方案來施用,每個治療過程順序地包括治療期,之後是間隔期。
在某些實施方案中,治療期包括向個體施用藥物組合物並且治療期被維持至少直至所述水平下降到參考值以下,在間隔期期間暫停施用,並且只要所述水平低於參考值就一直維持間隔期。所述參考值可選自(a)在於所述施用之前從所述個體獲得的最新血樣中測量的調節性T細胞或髓源性抑制細胞的系統性存在水平或活性水平;或者(b)患有CNS的疾病、障礙、病症或損傷的個體群特徵性的調節性T細胞或髓源性抑制細胞的系統性存在水平或活性水平。
或者,治療期包括向個體施用藥物組合物並且治療期被維持至少直至IFNγ產生白細胞的系統性存在或水平或者響應於刺激的白細胞增殖速率上升至參考值以上,在間隔期期間暫停施用,並且只要所述水平高於所述參考值就一直維持間隔期,其中所述參考值選自(a)在於所述施用之前從所述個體獲得的最新血樣中測量的IFNγ產生白細胞的系統性存在水平或活性水平或者響應於刺激的白細胞增殖速率;或者(b)患有CNS的疾病、障礙、病症或損傷的個體群特徵性的IFNγ產生白細胞的系統性存在水平或活性水平或者響應於刺激的白細胞增殖速率。
描述本發明藥物組合物的不同特徵的上述實施方案也與本發明的方法相關,因為所述方法採用相同的藥物組合物。
在又一個方面,本發明提供了用於治療不包括自身免疫性神經炎性疾病—RRMS的CNS的疾病、障礙、病症或損傷的藥物組合物,所述藥物組合物包含引起個體中系統性免疫抑制的水平降低的活性劑,所述活性劑選自:(i)對(a)CD47、(b)OX40、(c)VEGF-A(貝伐單抗)、(d)CD25、(e)GITR(觸發GITR的mAb(DTA-1))、(f)CCR4或(g)TIM-3/半乳凝集素9具有特異性的抗體;(h)抗殺傷細胞免疫球蛋白樣受體、(i)抗LAG-3或(j)抗4-1BB;(ii)(a)至(j)的任意組合;(iii)與佐劑組合的(a)至(j)的任意組合,所述佐劑例如TLR9配體,例如CpG;(iv)選自以下的蛋白質:(a)印楝葉糖蛋白(NLGP)或(b)sCTLA-4;(v)選自以下的小分子:(a)舒尼替尼;(b)多金屬氧酸鹽-1(POM-1);(c)α,β-亞甲基腺苷5』-二磷酸(APCP);(d)三氧化二砷(As2O3);(e)GX15-070(Obatoclax);(f)視黃酸拮抗劑,例如Ro 41-5253或LE-135;(g)SIRPα(CD47)拮抗劑,例如CV1-hIgG4,其作為單一藥劑或與抗CD47抗體組合;(h)CCR4拮抗劑,例如AF399/420/18025,其作為單一藥劑或與抗CCR4抗體組合;或者(i)腺苷A2B受體拮抗劑,例如PSB603;(j)吲哚胺-2,3-加雙氧酶的拮抗劑;(k)HIF-1調節劑;(vi)沉默分子,例如miR-126反義分子和抗半乳凝集素-1(Gal-1);(vii)OK-432;(viii)IL-12和抗CTLA-4的組合;(ix)抗生素劑,例如萬古黴素;或者(x)(i)至(ix)的任意組合。
根據本發明使用的藥物組合物可使用一種或更多種生理學上可接受的載體或賦形劑以常規方式配製。所述載體就與組合物的其他成分相容並且對其賦形劑無害而言必需是「可接受的」。
列舉了載體、施用模式、劑型等的以下實例作為從其可選擇用於本發明的載體、施用模式、劑型等的已知可能性。然而,本領域技術人員將了解,所選的任何給定製劑和施用模式均應首先進行測試以確定其獲得期望的結果。
施用方法包括但不限於胃腸外,例如靜脈內、腹膜內、肌內、皮下、經黏膜(例如,經口、鼻內、經頰、經陰道、經直腸、眼內)、鞘內、局部和皮內途徑。施用可以是系統性的或局部的。
術語「載體」指與活性劑一起施用的稀釋劑、佐劑、賦形劑或載劑。藥物組合物中的載體可包含粘合劑,例如微晶纖維素、聚乙烯吡咯烷酮(聚維酮或聚乙烯吡咯酮)、黃蓍膠、明膠、澱粉、乳糖或乳糖單水合物;崩解劑,例如褐藻酸、玉米澱粉等;潤滑劑或表面活性劑,例如硬脂酸鎂或月桂基硫酸鈉;以及助流劑,例如膠體二氧化矽。
對於經口施用,所述藥物製劑可以是液體形式,例如溶液、糖漿或混懸劑;或者可提供為在使用之前與水或其他合適載劑重構的藥物產品。這樣的液體製劑可使用諸如以下藥學可接受的添加劑通過常規方式來製備:助懸劑(例如,山梨糖醇糖漿、纖維素衍生物或氫化可食用脂肪)、乳化劑(例如,卵磷脂或阿拉伯膠)、非水性載劑(例如,杏仁油、油性脂或分級植物油)和防腐劑(例如,對-羥基苯甲酸甲酯或對-羥基苯甲酸丙酯或者山梨酸)。所述藥物組合物可採用例如片劑或膠囊劑,其使用諸如以下藥學可接受的賦形劑通過常規方式製備:粘合劑(例如,預膠化玉米澱粉、聚乙烯吡咯烷酮或羥丙基甲基纖維素)、填料(例如,乳糖、微晶纖維素或磷酸氫鈣)、潤滑劑(例如,硬脂酸鎂、滑石或二氧化矽)、崩解劑(例如,馬鈴薯澱粉或羥乙酸澱粉鈉)或潤溼劑(例如月桂基硫酸鈉)。可通過本領域中已知的方法對片劑進行包被。
用於經口施用的製劑可適當地配製成提供活性化合物的受控釋放。
對於經頰施用,所述組合物可採用以常規方式配製的片劑或錠劑的形式。
所述組合物可配製成用於通過注射,例如通過推注或連續輸注來腸胃外施用。注射用製劑可以以單位劑形,例如在已添加有防腐劑的安瓿或多劑量容器中提供。所述組合物可採用諸如在油性或水性載劑中的混懸劑、溶液劑或乳劑的形式,並且可包含配製劑,例如助懸劑、穩定劑和/或分散劑。或者,活性成分可以是在使用之前與合適載劑(例如,無菌的無熱原的水)重構的粉末形式。
所述組合物還可配製成經直腸組合物,例如栓劑或保留型灌腸劑,例如其含有常規的栓劑基質,例如可可油或其他甘油酯。
對於通過吸入的施用,使用合適的拋射劑由加壓包裝或噴霧器以氣霧噴霧劑的形式來方便地遞送根據本發明使用的組合物,所述合適的拋射劑例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合適的氣體。在加壓氣霧劑的情況下,可通過設置遞送計量量的閥來決定劑量單位。用於吸入器或吹入器中的膠囊劑或藥筒(例如明膠的膠囊劑或藥筒)可配製成包含化合物和合適粉末基質(例如乳糖或澱粉)的粉末混合物。
用於人使用的活性成分劑量的確定基於本領域中的常用實踐,並且最終將由醫生在臨床試驗中確定。用於施用於人的預期大約當量劑量可使用已知的公式基於下文中公開的體內實驗證據來計算(例如,Reagan-Show等(2007)Dose translation from animal to human studies revisited.The FASEB Journal 22:659-661)。根據該範例,成人的當量劑量(mg/kg體重)等於給予小鼠的劑量(mg/kg體重)乘以0.081。
現在將通過以下非限制性實施例對本發明進行舉例說明。
實施例
材料和方法
動物.5XFAD轉基因小鼠(Tg6799)和AD雙轉基因B6.Cg-Tg(APPswe,PSEN1dE9)85Dbo/J小鼠(Borchelt等,1997)購買自傑克遜實驗室(The Jackson Laboratory),所述5XFAD轉基因小鼠在神經元特異性小鼠Thy-1啟動子(Oakley等,2006)的轉錄控制之下共-過表達人APP(Swedish型突變:K670N/M671L;佛羅裡達型突變:I716V;和倫敦型突變:V717I)和PS1(M146L/L286V)轉基因的家族性AD突變體形式。基因分型如先前所述(Oakley等,2006)通過尾DNA的PCR分析來進行。使用雜合突變體cx3cr1GFP/+小鼠(Jung等,2000)(B6.129P-cx3cr1tm1Litt/J,其中CX3CR1趨化因子受體等位基因之一被替換成編碼GFP的基因)作為BM嵌合體的供體。使Foxp3.LuciDTR小鼠(Suffner等,2010)與5XFAD小鼠交配以能夠實現Foxp3+Treg的條件性消耗。通過魏茨曼科學研究所的動物繁育中心(Animal Breeding Center of the Weizmann Institute of Science)來繁育和維持動物。本文中詳述的所有實驗均遵守由魏茨曼科學研究所的機構動物照管及使用委員會制定(Institutional Animal Care and Use Committee,IACUC)的規則。
RNA純化、cDNA合成和定量實時PCR分析.海馬齒狀回(DG)的總RNA用TRI試劑(Molecular Research Center)提取並使用RNeasy試劑盒(Qiagen)從裂解液純化。脈絡叢的總DNA使用RNA MicroPrep試劑盒(Zymo Research)來提取。使用高容量cDNA逆轉錄試劑盒(Applied Biosystems)來將mRNA(1μg)轉化為cDNA。特定mRNA的表達使用基於螢光的定量實時PCR(real-time PCR,RT-qPCR)來測定。RT-qPCR反應使用Fast-SYBR PCR Master Mix(Applied Biosystems)來進行。量化反應使用標準曲線方法對每份樣品以一式三份方式進行。選擇肽醯脯氨醯異構酶A(peptidylprolyl isomerase A,ppia)作為參照(管家)基因。擴增循環為95℃5秒、60℃20秒和72℃15秒。在測定結束時,構建熔解曲線以評價反應的特異性。對於ifn-γ和ppia基因分析,根據生產商的方案(PreAmp Master Mix Kit;Applied Biosystems),用非隨機PCR引物預擴增cDNA 14個PCR循環,從而提高後續實時PCR分析的靈敏度。mRNA表達使用TaqMan RT-qPCR根據生產商的說明(Applied Biosystems)來確定。所有的RT-qPCR均使用StepOne軟體V2.2.2(Applied Biosystems)來進行並分析。使用下述TaqMan Assays-on-DemandTM探針:Mm02342430_g1(ppia)和Mm01168134_m1(ifn-γ)。
對於所有其他的檢測基因,使用以下引物:
ppia正向5』-AGCATACAGGTCCTGGCATCTTGT-3'(SEQ ID NO:33)和反向5'-CAAAGACCACATGCTTGCCATCCA-3』(SEQ ID NO:34);
icam1正向5』-AGATCACATTCACGGTGCTGGCTA-3』(SEQ ID NO:35)和反向5』-AGCTTTGGGATGGTAGCTGGAAGA-3』(SEQ ID NO:36);
vcam1正向5』-TGTGAAGGGATTAACGAGGCTGGA-3』(SEQ ID NO:37)和反向5』-CCATGTTTCGGGCACATTTCCACA-3』(SEQ ID NO:38);
cxcl10正向5'-AACTGCATCCATATCGATGAC-3'(SEQ ID NO:39)和反向5'-GTGGCAATGATCTCAACAC-3'(SEQ ID NO:40);
ccl2正向5』-CATCCACGTGTTGGCTCA-3』(SEQ ID NO:41)和反向5'-GATCATCTTGCTGGTGAATGAGT-3』(SEQ ID NO:42);
tnf-γ正向5』-GCCTCTTCTCATTCCTGCTT-3』(SEQ ID NO:43)和反向CTCCTCCACTTGGTGGTTTG-3』(SEQ ID NO:44);
il-1β正向5』-CCAAAAGATGAAGGGCTGCTT-3』(SEQ ID NO:45)和反向5』-TGCTGCTGCGAGATTTGAAG-3』(SEQ ID NO:46);
il-12p40正向5』-GAAGTTCAACATCAAGAGCA-3』(SEQ ID NO:47)和反向5』-CATAGTCCCTTTGGTCCAG-3』(SEQ ID NO:48);
il-10正向5』-TGAATTCCCTGGGTGAGAAGCTGA-3』(SEQ ID NO:49)和反向5』-TGGCCTTGTAGACACCTTGGTCTT-3』(SEQ ID NO:50);
tgfβ2正向5』-AATTGCTGCCTTCGCCCTCTTTAC-3』(SEQ ID NO:51)和反向5』-TGTACAGGCTGAGGACTTTGGTGT-3』(SEQ ID NO:52);
igf-1正向5』-CCGGACCAGAGACCCTTTG(SEQ ID NO:53)和反向5』-CCTGTGGGCTTGTTGAAGTAAAA-3』(SEQ ID NO:54);
bdnf正向5』-GATGCTCAGCAGTCAAGTGCCTTT-3』(SEQ ID NO:55)和反向5』-GACATGTTTGCGGCATCCAGGTAA-3』(SEQ ID NO:56)。
免疫組織化學.對石蠟包埋的經切片小鼠腦(6μm厚)和人腦(10μm厚)進行組織處理和免疫組織化學。對於人ICAM-1染色,使用第一小鼠抗ICAM(1:20Abcam;ab2213)抗體。將載玻片用3%H2O2溫育10分鐘,並使用第二生物素綴合的抗小鼠抗體,然後用Vectastain ABC試劑盒(Vector Laboratories)進行生物素/抗生物素擴增。隨後,施加3,3』-二氨基聯苯胺(DAB底物)(Zytomed試劑盒);將玻片脫水並用基於二甲苯的封固溶液封固。對於組織染色,在組織切除和固定之前,經心臟向小鼠灌注PBS。在解剖顯微鏡下(Stemi DV4;Zeiss)從腦的側腦室、第三腦室和第四腦室分離CP組織。對於全標本CP染色(whole mount CP staining),將組織用2.5%多聚甲醛(PFA)在4℃下固定1小時,隨後轉移至含有0.05%疊氮化鈉的PBS。在染色之前,將解剖的組織用PBS洗滌並在室溫下封閉(20%馬血清、0.3%Triton X-100和PBS)1小時。在室溫下進行第一抗體(在含有2%馬血清和0.3%Triton X-100的PBS中)或第二抗體的全標本染色1小時。在每個步驟之後在PBS中進行三次洗滌。將組織施加至載玻片,用Immu-mount(9990402,來自於Thermo Scientific)封固並用蓋玻片密封。對於經切片腦的染色,如先前所述(Baruch等,2013;Kunis等,2013)採用兩種不同的組織製備方案(石蠟包埋的切片或用切片機切成的自由浮動切片)。使用以下第一抗體:小鼠抗-Aβ(1:300,Covance,#SIG-39320);兔抗-GFP(1:100,MBL,#598);大鼠抗-CD68(1:300,eBioscience,#14-0681);大鼠抗-ICAM-1(1:200,Abcam,#AB2213);山羊抗-GFP(1:100,Abcam,#ab6658);兔抗-IBA-1(1:300,Wako,#019-19741);山羊抗-IL-10(1:20,R&D systems,#AF519);大鼠抗-Foxp3(1:20,eBioscience,#13-5773-80);兔抗-CD3(1:500,Dako,#IS503);小鼠抗-ZO-1、小鼠抗-E-Cahedrin和兔抗-Claudin-1(全部均為1:100,Invitrogen,#33-9100,#33-4000,#51-9000);兔抗-GFAP(1:200,Dako,#Z0334)。第二抗體包括Cy2/Cy3/Cy5-綴合的驢抗-小鼠/山羊/兔/大鼠抗體(1:200;全部均來自於Jackson Immunoresearch)。對載玻片進行Hoechst核染色(1:4000;Invitrogen Probes)1分鐘。在免疫染色操作中常規使用兩個陰性對照:用同種型對照抗體染色接著用第二抗體染色;或者僅用第二抗體染色。對於Foxp3細胞內染色,使用Retreivagen試劑盒(#550524,#550527;BD PharmingenTM)來進行經石蠟包埋載玻片的抗原修復。使用螢光顯微鏡(E800;Nikon)或雷射掃描共聚焦顯微鏡(Carl Zeiss,Inc.)來進行顯微分析。螢光顯微鏡裝備有數碼像機(DXM 1200F;Nikon)並且裝備有20×NA 0.50物鏡或40×NA0.75物鏡(Plan Fluor;Nikon)。共聚焦顯微鏡裝備有LSM 510雷射掃描能力(三種雷射:Ar 488、HeNe 543和HeNe 633)。使用採集軟體(NIS-Elements,F3[Nikon]或LSM[Carl Zeiss,Inc.])來對固定後的組織進行記錄。對於染色強度的量化,如先前所述(Burgess等,2010),使用ImageJ軟體(NIH)來測量總細胞染色和背景染色並計算特異性染色的強度。將圖像使用Photoshop CS6 13.0(Adobe)剪裁、合併和優化,並使用Illustrator CS5 15.1(Adobe)進行排列。
人CP的經石蠟包埋切片.年輕和年長的死後非CNS患病個體以及AD患者的人腦切片在正當同意和倫理委員會批准(TW220)之下從Oxford Brain Bank(之前稱為Thomas Willis Oxford Brain Collection(TWOBC))獲得。涉及這些切片的實驗均經魏茨曼科學研究所生物倫理委員會(Weizmann Institute of Science Bioethics Committee)批准。
流式細胞術、樣品製備和分析.經心臟向小鼠灌注PBS並如先前所述(Baruch等,2013)處理組織。在PBS中在解剖顯微鏡下(Stemi DV4;Zeiss)將腦解剖並取出不同的腦區域,使用gentleMACSTM解離器(Miltenyi Biotec)解離組織。從腦的側腦室、第三腦室和第四腦室分離脈絡叢組織,在含有400U/ml IV型膠原酶(Worthington Biochemical Corporation)的PBS(具有Ca2+/Mg2+)中在37℃下孵育45分鐘,然後通過吹吸人工均化。將脾用注射器的柱塞搗碎並用ACK(氯化銨鉀)裂解緩衝液處理以除去紅細胞。在所有情況下,均根據生產商的方法來染色樣品。將所有的樣品通過70μm尼龍網過濾並用抗Fc CD16/32(1:100;BD Biosciences)封閉。對於IFN-γ的細胞內染色,將細胞與對甲氧基安非他明(10ng/ml;Sigma-Aldrich)和離子黴素(250ng/ml;Sigma-Aldrich)一起孵育6小時,添加布雷菲德菌素-A(10μg/ml;Sigma-Aldrich)用於最後4小時。用BD Cytofix/CytopermTM Plus固定/透化試劑盒(目錄號555028)來進行細胞因子的細胞內標記。對於Treg染色,使用eBioscience FoxP3染色緩衝液套裝(目錄號00-5523-00)。以下經螢光染料標記的單克隆抗體購買自BD Pharmingen,BioLegend,R&D Systems或eBiosciences,並且根據生產商的方案使用:PE或Alexa Fluor 450綴合的抗-CD4;PE綴合的抗-CD25;PerCP-Cy5.5-綴合的抗-CD45;FITC-綴合的抗-TCRβ;APC-綴合的抗-IFN-γ;APC-綴合的抗-FoxP3;亮紫綴合的抗-CD45。使用FlowJo軟體在LSRII細胞計數器(BD Biosciences)上對細胞進行分析。在每個實驗中,使用相關的陰性對照組、陽性對照和每個組織的單染色樣品來鑑定目的群體並排除其他群體。
BM嵌合體的製備.BM嵌合體如先前所述(Shechter等,2009;Shechter等,2013)來製備。簡言之,使性別匹配的受體小鼠在防護頭部的同時經受致死性全身照射(950拉德)(Shechter等,2009)。然後,向小鼠靜脈內注射來自CX3CR1GFP/+供體的5×106個BM細胞。在BM移植之後,使小鼠靜置8周至10周以使得能夠重建造血譜系,之後將其用於實驗。通過對血樣進行FACS分析根據GFP表達細胞在循環單細胞(CD11b+)中的百分比來確定嵌合性百分比。在這一防護頭部的模型中,實現平均60%嵌合性,並且證實CNS浸潤性GFP+骨髓細胞是CD45高/CD11b高,表示單核細胞源性巨噬細胞而非小膠質細胞(Shechter等,2013)。
Morris水迷宮.每天對小鼠進行三次試驗,持續連續4天以學習發現池(直徑為1.1m)中位於水表面1.5cm下的隱藏平臺。使水溫保持在21℃至22℃。用奶粉使水變成不透明的。在測試室內,小鼠僅可利用遠端的視覺形狀和物體線索來幫助定位浸沒的平臺。記錄逃避潛伏期(即,發現並爬上平臺所需的時間),持續長達60秒。允許每隻小鼠在平臺上停留15秒,然後從迷宮移至其養籠中。如果小鼠在60秒內未發現平臺,則人工將其放置在平臺上並在15秒後返回至其養籠中。每隻小鼠的試驗間間隔時間為10分鐘。在第5天,移出平臺,並在無法逃避下對小鼠進行單獨實驗,持續60秒。在第6天和第7天,將平臺放置在與原始訓練象限相對的象限內,並每天重新訓練小鼠三次。使用EthoVision V7.1自動化追蹤系統(Noldus Information Technology)來記錄數據。使用方差分析(ANOVA)和Bonferroni事後檢驗來進行統計學分析。所有的MWM測試均在關燈階段期間在10a.m.和5p.m.期間進行。
放射臂水迷宮.使用放射臂水迷宮(RAWM)來測試空間學習和記憶,如先前詳細描述的(Alamed等,2006)。簡言之,將六個不鏽鋼插入物放置在箱中,形成從敞開中心區域發散的六個遊泳臂。將逃避平臺放置在直徑為1.1m的池中水平面1.5cm下一個臂(目標臂)的端部。使水溫保持在21℃至22℃。用奶粉使水變成不透明的。在測試室內,小鼠僅可利用遠端的視覺形狀和物體線索來幫助定位浸沒的平臺。對於給定的小鼠,目標臂的位置保持不變。在第1天,對小鼠訓練15次試驗(歷經3小時),其中試驗在可見平臺和隱藏平臺之間交替進行,最後4次試驗僅用隱藏平臺進行。在第2天,用隱藏平臺對小鼠訓練15次試驗。將進入不正確臂或者在15秒內未能選擇臂記錄為錯誤。通過計數小鼠在每次試驗中的臂進入錯誤次數和逃避潛伏期來測量空間學習和記憶。訓練數據分析為連續三次試驗對訓練塊的平均錯誤數或逃避潛伏期。
GA施用.向每隻小鼠皮下(s.c.)注射溶解於200μl PBS中的100μg總劑量的GA(批號P53640;Teva Pharmaceutical Industries,Petah Tiqva,Israel)。根據每周-GA方案(Butovsky等,2006)或每日-GA施用來注射小鼠(圖8和圖16)。根據每個實驗的指示,在最後一次GA注射後1周或者在處理之後1個月對小鼠實施安樂死。
Treg的條件性消融.每天向Foxp3.LuciDTR小鼠(Suffner等,2010)腹膜內(i.p.)注射白喉毒素(DTx;8ng/g體重;Sigma),持續連續4天。通過對血液和脾中的免疫細胞進行流式細胞術分析來確定DTx的效力,實現GFP表達FoxP3+CD4+Treg細胞的幾乎完全(>99%)消耗(圖4)。
P300抑制.小鼠中p300的抑制類似於先前所述的來進行(Liu等,2013)。將p300i(C646;Tocris Bioscience)溶解於DMSO中並每天i.p.注射(8.9mg kg-1d-1,i.p.),持續1周。類似地,向載劑處理的小鼠注射DMSO。
ATRA處理.向小鼠的全反式視黃酸(all-trans retinoic acid,ATRA)施用類似於先前所述的來進行(Walsh等,2014)。將ATRA(Sigma)溶解於DMSO中並每隔一天地i.p.注射(8mg kg-1d-1),歷經1周的療程。類似地,向載劑處理的小鼠注射DMSO。
可溶性Aβ(sAβ)蛋白的分離和量化.組織均化和sAβ蛋白提取如先前所述來進行(Schmidt等,2005)。簡言之,將大腦腦實質解剖,急速冷凍並保存在-80℃直至均化。順序地從樣品提取蛋白質以獲得包含溶解度不同的蛋白質的分離級分。將樣品在Dounce均化器中使用研磨用玻璃杵在10體積的冰冷組織均化緩衝液中進行均化,所述緩衝液包含250mM蔗糖、20mM Tris鹼、1mM乙二胺四乙酸(EDTA)和1mM乙二醇四乙酸(pH7.4)。在六個衝程之後,將均漿與100-mM NaCl溶液中的0.4%二乙胺(DEA)1:1混合,之後再進行六個衝程,然後在4℃下以135,000g離心45分鐘。收集上清液(含有細胞外蛋白質和細胞溶質蛋白質的DEA可溶性級分)並用10%的0.5M Tris-HCl(pH 6.8)中和。通過酶聯免疫吸附測定(ELISA)使用可商購獲得的試劑盒(Biolegend;分別為#SIG-38954和#SIG-38956)根據生產商的說明從可溶性級分單獨測量Aβ1-40和Aβ1-42。
Aβ斑量化.從每個腦收集6μm的冠狀切片,並對每隻小鼠來自貫穿目的區域(齒狀回或脈絡叢)的4個不同預定深度的8個切片進行免疫染色。使用Image-Pro Plus軟體(Media Cybernetics,Bethesda,MD,USA)來進行陽性染色像素的基於直方圖的分割。將分割算法人工地應用於齒狀回區域中或皮層V中的每個圖像,並確定總Aβ免疫染色所佔據面積的百分比。由相同的6μm冠狀腦切片來量化斑數目並表示為每個腦區域的平均斑數目。在量化之前,對切片進行編碼以掩蓋實驗組的身份,並通過對組身份盲態的觀察者來量化斑負荷。
統計學分析.用於分析每個實驗組的特定測試在圖例中進行了說明。在兩個組之間進行比較使用雙尾學生t檢驗來分析數據,單向ANOVA用於比較數個組,接著在拒絕無效假設(P<0.05)之後進行Newman–Keuls事後程序以對組進行逐對比較。行為測試的數據使用雙向重複測量ANOVA來進行分析,並使用Bonferroni事後程序來進行後續逐對比較。基於文獻和過往經歷來選擇具有充分統計學效力的樣品尺寸並根據年齡、性別和基因型將小鼠分配至實驗組。研究者對實驗期間的組身份和結果評估呈盲態。所有的入選標準和排除標準都根據IACUC指導方針預先確立。結果表示為平均值±s.e.m。在圖表中,y軸誤差棒表示s.e.m。統計學計算使用GraphPad Prism軟體(GraphPad Software,San Diego,CA)來進行。
簡介.阿爾茨海默病(AD)是一種年齡相關性神經變性疾病,其以中樞神經系統(CNS)中的神經元損傷、澱粉樣蛋白β(Aβ)斑形成和慢性炎症為特徵,導致認知功能逐漸喪失和腦組織破壞(Akiyama等,2000;Hardy和Selkoe,2002)。在這些病症下,CNS的循環骨髓細胞和駐留骨髓細胞、小膠質細胞在減緩神經炎性應答方面起非冗餘作用(Britschgi和Wyss-Coray,2007;Cameron和Landreth,2010;Lai和McLaurin,2012)。特別地,當小膠質細胞未能最終清除Aβ沉積物,則CNS浸潤性單核細胞源性巨噬細胞(mo-MΦ)在限制Aβ斑形成和抵抗AD樣病理方面發揮有益作用(Butovsky等,2007;Koronyo-Hamaoui等,2009;Mildner等,2011;Simard等,2006;Town等,2008)。已鑑定上皮層形成血液-CSF-屏障(blood-CSF-barrier,BCSFB)的腦脈絡叢(CP)為白細胞進入CNS使得能夠在神經組織損傷之後募集mo-MΦ和T細胞的選擇性門(Kunis等,2013;Shechter等,2013)。在此,我們假設:在AD中,消炎免疫細胞向患病實質的次最佳募集是涉及CP門功能障礙的系統性免疫失效的結果。
實施例1.小鼠AD模型中隨疾病進程的脈絡叢(CP)門活性
我們首先對AD的5XFAD轉基因小鼠模型(AD-Tg)中隨疾病進程的CP活性進行了檢測;這些小鼠共表達與家族性AD相關的五種突變並且在早至2月齡時發生腦Aβ病理和神經膠質增生(Oakley等,2006)。我們發現:隨著疾病病理的進展期,與年齡匹配的野生型(WT)對照相比,AD-Tg小鼠的CP表達顯著更低水平的白細胞歸巢和運輸決定簇,包括icam1、vcam1、cxcl10和ccl2(圖1A),所述決定簇顯示響應於急性CNS損傷而被CP上調並且是白細胞經上皮遷移所需要的(Kunis等,2013;Shechter等,2013)。對整聯蛋白配體ICAM-1進行免疫組織化學染色確定其經由AD-Tg小鼠CP上皮的降低表達(圖1b)。另外,對人死後腦中的ICAM-1進行染色顯示其在CP上皮中的年齡相關性降低,這與我們之前的觀察結果一致(Baruch等,2014),並且對該效應進行量化評估揭示與未患CNS疾病的年長個體相比在AD患者中進一步降低(圖2A)。由於CP對白細胞運輸決定簇的誘導依賴於上皮幹擾素(IFN)-γ信號傳導(Kunis等,2013),因此我們接下來測試了所觀察到的效應是否可反映CP處喪失IFN-γ可用性。使用流式細胞術細胞內染色對5XFAD AD-Tg小鼠的CP進行檢測揭示該隔室中具有顯著更低數目的IFN-γ產生細胞(圖2B),並且定量實時PCR(RT-qPCR)分析確定與年齡匹配的WT對照相比,AD-Tg小鼠CP處ifn-γ的mRNA表達水平較低(圖2C)。
實施例2.Treg介導的系統性免疫抑制、CP門活性和AD病理之間的功能關係
調節性T細胞(Treg)在抑制系統性效應免疫應答中起關鍵作用(Sakaguchi等,2008)。我們設想Treg介導的系統性免疫抑制影響CP處的IFN-γ可用性,並且因此集中於Treg在AD病理中的參與。與AD患者中Treg水平和抑制活性升高的先前報導一致(Rosenkranz等,2007;Saresella等,2010;Torres等,2013),相對於其年齡匹配的WT同窩出生小鼠來評價5XFAD AD-Tg小鼠脾細胞中的Foxp3+Treg頻率揭示其水平隨疾病進程升高(圖3A、3B)。為了研究Treg介導的系統性免疫抑制、CP門活性和AD病理之間的功能關係,我們使5XFAD AD-Tg小鼠與Foxp3-白喉毒素受體(DTR+)小鼠雜交,使得通過施用白喉毒素(DTx)來實現AD-Tg/DTR+小鼠中Foxp3+Treg的短暫條件性體內消耗(圖4A)。Treg的短暫消耗導致相對於經DTx處理的AD-Tg/DTR-同窩出生小鼠,AD-Tg/DTR+小鼠中CP對白細胞運輸分子的mRNA表達升高(圖5A)。分析短暫Treg消耗對腦實質的長期作用(3周後)揭示腦中的免疫細胞累積,包括代表浸潤性mo-MΦ的CD45高/CD11b高骨髓細胞(Shechter等,2013)和CD4+T細胞的數量升高(圖5B)。另外,Treg的短期暫時消耗導致聚集在腦中的CD4+T細胞中Foxp3+Treg顯著富集,如通過流式細胞術所評估的(圖5C、5D)。對海馬的RT-qPCR分析顯示foxp3和il10mRNA的表達增加(圖5E)。
接下來,我們研究了短期Treg消耗、之後免疫調節細胞在腦病理部位聚集是否對腦功能產生長期效果。我們觀察到海馬神經膠質增生減輕(圖5F)並且促炎細胞因子(例如il-12p40和tnf-α)的mRNA表達水平降低(圖5G)。此外,5XFAD AD-Tg小鼠中表現出穩健Aβ斑病理的兩個腦區域海馬齒狀回和大腦皮質(第5層)(Oakley等,2006)中的大腦Aβ斑負荷減小(圖6A、6B)。使用Morris水迷宮(MWM)測試來評價對認知功能的作用揭示:相對於經DTx處理的AD-Tg/DTR-年齡匹配小鼠,在Treg消耗之後AD-Tg/DTR+小鼠中的空間學習和記憶得到顯著改善,達到與WT小鼠近似的表現(圖6C至6E)。總而言之,這些數據表明在AD-Tg小鼠中短暫地破壞Treg介導的系統性免疫抑制導致消炎細胞(包括mo-MΦ和Treg)在腦中聚集,並且在其之後神經炎性應答消退、Aβ清除且認知下降逆轉。
實施例3.每周施用Copolymer-1降低Treg介導的系統性免疫抑制、提高CP門活性並且減輕AD病理。
為了進一步證實系統性免疫抑制、CP功能和AD病理之間的相反關係的因果性質,我們接下來使用了免疫調節性化合物醋酸格拉替雷(GA;還稱為Copolymer-1或在每周施用方案中發現其在AD的APP/PS1小鼠模型(Butovsky等,2006)中具有治療效果;該效果與mo-MΦ向大腦疾病病理部位的募集功能性相關(Butovsky等,2007)。在此,我們首先檢驗了:是否與我們在5XFAD AD-Tg小鼠中的觀察結果類似,APP/PS1AD-Tg小鼠中的CP也在IFN-γ表達水平方面具有缺陷。我們發現:相對於年齡匹配的WT對照,在APP/PS1AD-Tg小鼠中CP處的IFN-γ水平降低(圖7A)。這些結果激勵我們測試每周-GA在APP/PS1小鼠中的治療效果(Butovsky等,2006)是否可在5XFAD AD-Tg中重現,並且倘若如此,則其是否會影響系統性Treg和CP對mo-MΦ運輸的活化。因此,我們用GA的每周施用方案來處理5XFAD AD-Tg小鼠,歷經4周的時間(在下文為「每周-GA」,示意性地描繪於圖8A中)。我們發現,經每周-GA處理的5XFAD AD-Tg小鼠表現出減輕的神經炎症(圖8B至8D)和改善的認知表現,這在處理之後持續長達2個月(圖8E至8I)。通過流式細胞術來檢測每周-GA對系統性免疫和CP的作用,我們發現在經處理5XFAD AD-Tg小鼠中脾細胞Foxp3+Treg水平降低(圖9A)並且CP處的IFN-γ產生細胞增加,達到與在WT對照中所觀察到的那些的近似水平(圖9B)。在經每周-GA處理的小鼠中,CP處IFN-γ表達細胞的水平升高伴隨著白細胞運輸分子的上皮表達上調(圖9C)。
為了檢測浸潤性mo-MΦ向CNS的進入,我們使用了5XFAD AD-Tg/CX3CR1GFP/+骨髓(BM)嵌合小鼠(利用頭部保護來製備),從而使循環(綠色螢光蛋白(GFP)+標記的)骨髓細胞能夠可視化(Shechter等,2009;Shechter等,2013)。我們發現:與經載劑處理的AD-Tg/CX3CR1GFP/+對照相比,在每周-GA處理之後GFP+mo-MΦ向CP以及向鄰近腦室間隙的歸巢增加(圖9D至9E)。腦實質的免疫組織化學揭示,在腦斑形成部位存在GFP+mo-MΦ聚集(圖9F),並且通過對AD-Tg非嵌合小鼠中的海馬進行流式細胞術分析來量化浸潤性骨髓細胞顯示,CD11b高CD45高表達細胞的數目增加(圖9G、9H)。總而言之,這些結果證實了mo-MΦ向AD病理部位募集、系統性Treg水平降低和IFN-γ依賴性CP活化之間的功能聯繫。
實施例4.短期地直接幹預Treg活性提高CP門活性並且減輕AD病理。
4.1使用小分子組蛋白乙醯轉移酶抑制劑的Treg活性幹預。表明Treg介導的系統性免疫抑制幹預抵抗AD病理的能力的上述發現使人想到Treg在癌症免疫治療中所貢獻的功能,其中這些細胞阻礙免疫系統引發有效的抗腫瘤應答的能力(Bos和Rudensky,2012;Nishikawa和Sakaguchi,2010)。因此,我們考慮,直接幹預Foxp3+Treg細胞活性的處理在AD方面可能是有利的。我們測試了p300i(C646(Bowers等,2010)),即p300的非肽抑制劑,p300是一種調節Treg功能的組蛋白乙醯轉移酶(Liu等,2013);該抑制劑顯示影響Treg的抑制活性而同時使保護性T效應細胞應答不受幹擾(Liu等,2013)。我們發現:與經載劑(DMSO)處理的對照相比,經p300i處理的小鼠顯示脾(圖10A)以及CP(圖10B)中系統性IFN-γ表達細胞的水平升高。接下來,我們用p300i或載劑處理AD-Tg小鼠,歷經1周的療程,並在3周後檢測其大腦Aβ斑負荷。免疫組織化學分析揭示,在經p300i處理的AD-Tg小鼠中大腦Aβ斑載荷顯著減小(圖10C至10E)。我們還測試了一個處理療程之後對斑病理的效應是否能夠持續超過3周,並且倘若如此,額外的處理療程是否有助於持久效應。因此,我們將接受單個p300i處理療程並在2個月後檢測的AD-Tg小鼠與在此期間接受兩個處理療程(之間具有1個月的間隔時間)的年齡匹配小組進行了比較(示意性地描繪於圖10F中)。我們發現,腦斑的減小甚至在單個處理療程之後兩個月仍明顯,但是在接受兩個處理療程(之間具有1個月的間隔時間)的小鼠中更強(圖10G)。由於AD中的突觸可塑性和記憶受損與可溶性Aβ1-40/Aβ1-42(sAβ)水平的大腦水平升高有關(Shankar等,2008),因此我們還測量了在單個和重複周期的p300i處理之後的sAβ水平。同樣地,我們發現1個療程和兩個療程(之間具有1個月的間隔之間)二者均有效地降低大腦sAβ,但是就對sAβ1-42的效應而言,在重複療程之後,該效應較為更強(圖10H)。這些結果表明,儘管單個的短期處理療程有效,但是重複的治療療程將有利於維持持久的治療效果,這與我們在每周-GA處理之後的觀察結果類似。
4.2.使用抗PD1抗體的Treg活性幹預。在10月齡時,在實驗的第1天和第4天,向5XFAD阿爾茨海默病(AD)轉基因(Tg)小鼠i.p.注射250μg的抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)或對照IgG抗體(IgG2a;#BE0089;Bioxcell Lifesciences Pvt.LTD.),並在3周後(示意性地描繪於圖11A中)通過放射臂水迷宮(RAWM)空間學習和記憶任務來檢測其認知表現,如先前所詳細描述的(Alamed等,2006)。簡言之,在RAWM任務的第1天,對小鼠訓練15次試驗(歷時3小時),其中試驗在可見平臺和隱藏平臺之間交替進行並且最後4次試驗僅用隱藏平臺進行。在第2天,用隱藏平臺對小鼠訓練15次試驗。將進入到不正確臂中或者在15秒內未能選擇臂評分為錯誤。通過計數小鼠在每次試驗中的臂進入錯誤次數和逃避潛伏期來測量空間學習和記憶。使用年齡匹配的未經處理WT和AD-Tg小鼠作為對照。我們發現:如在3周後所評估的,處理1個治療期的5XFAD AD-Tg小鼠顯示在RAWM中的空間認知表現顯著改善(圖11B),所述1個治療期包括兩次抗PD1注射(第1天和第4天)。
接下來,我們檢驗了對疾病病理的效果是否與系統性免疫抑制的降低有關。我們重複了上述實驗,但這次在處理期結束時對小鼠進行檢測(實驗的第7天;示意性地描繪於圖12A中)。我們觀察到:在該時間點,經PD-1處理的AD-Tg小鼠中系統性免疫抑制的減弱伴隨著IFN-γ產生CD4脾細胞升高的系統性效應(圖12B),其與CP處IFN-γmRNA水平升高(圖13A)和CP白細胞運輸分子(趨化因子CCL2和CXCL10)的表達升高(圖13B)的局部效應相關。這些數據表明,在AD-Tg小鼠中的短時期抗PD-1處理與如所預期的減弱Treg介導之免疫抑制的系統性應答(Naidoo等,2014)以及白細胞向CNS運輸之CP門活性的活化相關。
最後,我們檢驗了對AD-Tg小鼠中疾病病理的作用以及額外的處理期是否有利於其對病理的作用。為此,如上所述使10個月大的AD-Tg小鼠接受1個時期的抗PD-1處理,或者間隔3周再接受處理。將對照組用IgG進行處理或者保持不處理,並在3周之後測試所有組小鼠的認知表現(示意性地描繪於圖14A中)。我們發現,儘管處理1個抗-PD-1時期(「AD-Tg+PD-1X1」)並且在2個月後檢測的AD-Tg小鼠相比較於經IgG處理和未經處理的AD-Tg小鼠表現出顯著的認知改善,但是與提前一個月評估認知表現的相同小鼠相比,該效果較不穩健。相比之下,與接受1個時期的AD-Tg小鼠相比以及與經IgG處理和未經處理的AD-Tg小鼠相比,接受第二時期抗PD-1處理(「AD-Tg+PD-1X2」)的AD-Tg小鼠在RAWM中表現出顯著更佳的空間學習和記憶能力(圖14B)。這些發現揭示:為了維持持久的治療效果,需要重複的時期。
4.3使用抗PD1抗體和抗CTLA4抗體的組合的Treg活性幹預
在10月齡時,在實驗的第1天和第4天向5XFAD阿爾茨海默病(AD)轉基因(Tg)小鼠i.p.注射250μg抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)和250μg抗CTLA4抗體(InVivoMAb抗-mCD152;#BE0131;Bioxcell Lifesciences Pvt.LTD.)或者對照IgG抗體(IgG2a,#BE0089或Polyclonal Syrian Hamster IgG,#BE0087;Bioxcell Lifesciences Pvt.LTD.),並在3周後通過放射臂水迷宮(RAWM)空間學習和記憶任務來檢測其認知表現,如上所述。
使一些小鼠以3周的間隔期再接受一個處理期。將對照組用IgG進行處理或者不作處理,並且在3周後測試所有組小鼠的認知表現。
預期,與經IgG處理和未經處理的AD-Tg小鼠相比,經抗體組合處理的小鼠表現出顯著的認知改善以及顯著的腦斑載荷減小。
實施例5.Treg活性增強對AD病理具有不利影響。
為了確定Treg介導的系統性免疫抑制在AD中的不利影響,我們接下來研究了增強系統性Treg水平是否可對AD病理具有相反的不利影響。為了對此進行測試,我們通過施用全反式視黃酸(ATRA)來增強AD-Tg小鼠中的Treg抑制功能,全反式視黃酸誘導Treg分化(Mucida等,2007),穩定Treg表型(Zhou等,2010)並且使Treg更具抑制性(Zhou等,2010)。我們使用了處於疾病進程的相對早期階段的5XFAD AD-Tg小鼠,並且用ATRA或載劑(DMSO)對其進行處理。經ATRA處理的AD-Tg小鼠顯示出顯著更高的脾細胞Foxp3+CD25+Treg頻率(圖15A、15B)。在最後一次ATRA注射後3周對小鼠進行檢測揭示大腦Aβ斑負荷和神經膠質增生較高(約增加2倍至3倍;圖15C至15E),並且評估sAβ揭示在增強系統性Treg之後大腦sAβ1-40和sAβ1-42水平升高(圖15F至15G)。使用RAWM來評估認知表現顯示:相對於經載劑處理的AD-Tg小鼠,在經ATRA處理的AD-Tg小鼠中空間記憶缺損加重(圖15H)。
鑑於我們在系統性Treg對AD病理的不利影響方面的目前發現,綜合已知每日GA施用誘導Treg並且在臨床上用於治療多發性硬化(multiple sclerosis,MS)的事實(Haas等,2009;Hong等,2005;Weber等,2007),我們測試了每日GA方案(在1個月的時期內)相比較於每周-GA是否可能對AD-Tg小鼠的疾病病理具有不利影響。我們比較了每日-GA施用相對於每周-GA施用(示意性地描繪於圖16A中)在5XFAD AD-Tg小鼠中的效果。通過RAWM任務來評估認知表現揭示,相比較於每周-GA處理的有益效果,在接受每日-GA的AD-Tg小鼠中,或者未觀察到對空間記憶的有益作用,或者未觀察到效應惡化的傾向(圖16B)。另外,不同於每周-GA施用對斑清除的穩健作用,經每日-GA處理的AD-Tg小鼠未表現出任何有益效應或者表現出對斑載荷的適度不利作用(圖16C至16F)。這些發現突出了,用每日-GA進行相同的免疫調節治療可如何相對且獨特地影響著與神經炎症相關的兩種CNS病理MS和AD(Schwartz和Baruch,2014a)。
實施例6.直接幹預Treg活性提高CP門活性並且防止或減輕PTSD病理。
嚴重應激條件或慢性應激可導致創傷後應激障礙(posttraumatic stress disorder,PTSD)和抑鬱。我們之前表明CP門活性對處理精神性應激可至關重要,並且在CP的次最佳功能的情況下,精神創傷性事件可導致PTSD(Schwartz和Baruch,2012)。我們還假設,在創傷後進行有助於調節CP應答的及時系統性幹預可防止PTSD的慢性病症的發生。我們發現短期地減弱Treg介導的系統性免疫抑制對腦病理具有長期作用,所述發現啟示在創傷性事件之後立即進行這種幹預可防止PTSD發生。
為了測試我們的工作假設:CP參與處理創傷性應激並且在創傷性應激導致發生PTSD的情況下其可能功能障礙,我們採用了生理性PTSD樣動物模型,在該模型中小鼠表現出高度警戒行為、注意力缺損、風險評估增加和睡眠不良(Lebow等,2012)。在PTSD誘發的這一實驗模型中,使小鼠習慣顛倒的晝/夜循環10天,施以兩個電擊事件(創傷和觸發)(稱為「PTSD誘發」)並在創傷之後的不同時間點進行評價。在創傷性事件之後,向小鼠注射所述化合物,其短暫地降低外周免疫抑制。根據以下一種或更多種方案來對小鼠進行處理:
·在創傷性事件後的第1天和第4天向小鼠i.p.注射250μg的抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)或對照IgG抗體(IgG2a;#BE0089;Bioxcell Lifesciences Pvt.LTD.),並在另外的兩周間隔期之後進行檢測;
·在實驗的第1天和第4天向小鼠i.p.注射250μg抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)和250μg抗CTLA4抗體(InVivoMAb抗-mCD152;#BE0131;Bioxcell Lifesciences Pvt.LTD.)或者對照IgG抗體(IgG2a,#BE0089或Polyclonal Syrian Hamster IgG,#BE0087;Bioxcell Lifesciences Pvt.LTD.),並在兩周的間隔期之後進行檢測;
·在創傷性事件之後如上所述向小鼠i.p.注射每周-GA,並在兩周的間隔期之後進行檢測;
·在創傷性事件之後用p300i或載劑處理小鼠,歷經一周的時間,並如上所述在3周後進行檢測。
使一些小鼠以適當的間隔期再接受一個處理期。
在預期之內,接受處理的小鼠在該實驗模型中不表現與PTSD相關的焦慮行為,如在(Lebow等,2012)中所述的通過在晝/夜迷宮中探索和風險評估所花費的時間或其他行為任務所評估。
實施例7.短暫地降低系統性免疫抑制減輕帕金森病病理。
在這些實驗中使用帕金森病(PD)轉基因(Tg)小鼠。根據以下一種或更多種方案在疾病的進展期對小鼠進行處理:
·在創傷性事件後的第1天和第4天向小鼠i.p.注射250μg的抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)或對照IgG抗體(IgG2a;#BE0089;Bioxcell Lifesciences Pvt.LTD.),並在另外的兩周間隔期之後進行檢測;
·在實驗的第1天和第4天向小鼠i.p.注射250μg抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)和250μg抗CTLA4抗體(InVivoMAb抗-mCD152;#BE0131;Bioxcell Lifesciences Pvt.LTD.)或者對照IgG抗體(IgG2a,#BE0089或Polyclonal Syrian Hamster IgG,#BE0087;Bioxcell Lifesciences Pvt.LTD.),並在兩周的間隔期之後進行檢測;
·在創傷性事件之後如上所述向小鼠i.p.注射每周-GA,並在兩周的間隔期之後進行檢測;
·在創傷性事件之後用p300i或載劑處理小鼠,歷經一周的時間,並如上所述在3周後進行檢測。
使一些小鼠以適當的間隔期(約3周至1個月)再接受一個處理期。
使用例如評估小鼠停留在旋轉杆上的能力的旋轉杆表現測試來評價運動神經功能。
在預期之內,與經IgG處理或經載劑處理的對照組或者未處理組相比,處理一個治療期的PD-Tg小鼠表現出顯著改善的運動表現。接受兩個治療過程並且在適當的間隔期之後檢測的PD-Tg小鼠預期表現出持久的治療效果。為了維持這一治療效果,使小鼠接受活動的處理期,其中每個時期之間具有適當的間隔期。
實施例8.短暫地降低系統性免疫抑制減輕亨廷頓病病理。
這些實驗中使用的模型可以是亨廷頓病(HD)R6/2轉基因小鼠(Tg)測試系統。R6/2轉基因小鼠在疾病的進展期過表達突變的人亨廷頓基因,其包括多個CAG重複片段的插入。這些小鼠從早至5周至6周齡開始表現出進行性行為-運動缺損,並且在10周至13周時導致過早死亡。症狀包括體重輕、抱攏、震顫和驚厥。
在小鼠45天大時根據以下一種或更多種方案對其進行處理:
·在創傷性事件後的第1天和第4天向小鼠i.p.注射250μg的抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)或對照IgG抗體(IgG2a;#BE0089;Bioxcell Lifesciences Pvt.LTD.),並在另外的兩周間隔期之後進行檢測;
·在實驗的第1天和第4天向小鼠i.p.注射250μg抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)和250μg抗CTLA4抗體(InVivoMAb抗-mCD152;#BE0131;Bioxcell Lifesciences Pvt.LTD.)或者對照IgG抗體(IgG2a,#BE0089或Polyclonal Syrian Hamster IgG,#BE0087;Bioxcell Lifesciences Pvt.LTD.),並在兩周的間隔期之後進行檢測;
·在創傷性事件之後如上所述向小鼠i.p.注射每周-GA,並在兩周的間隔期之後進行檢測;
·在創傷性事件之後用p300i或載劑處理小鼠,歷經一周的時間,並如上所述在3周後進行檢測。
使一些小鼠以適當的間隔期(約3周至1個月)再接受一個處理期。
使用例如評估小鼠停留在旋轉杆上的能力的旋轉杆表現測試來評價運動神經功能。
在預期之內,與經IgG處理或經載劑處理的對照組或者未處理組相比,處理一個治療期的HD-Tg小鼠表現出顯著改善的運動表現。接受兩個治療過程並且在適當的間隔期之後檢測的HD-Tg小鼠預期表現出持久的治療效果。為了維持這一治療效果,使小鼠接受活動的處理期,其中每個時期之間具有適當的間隔期。
實施例9.短暫地降低系統性免疫抑制減輕肌萎縮側索硬化病理。
該實驗中使用的模型可以是過表達含有Gly93→Ala(G93A)基因的缺陷型人突變體SOD1等位基因的轉基因小鼠(B6SJL-TgN(SOD1-G93A)1Gur(本文中為「ALS小鼠」)。該模型發生運動神經元疾病並且因此構成用於測試ALS的公認動物模型。
在小鼠75天大時根據以下一種或更多種方案對其進行處理:
·在創傷性事件後的第1天和第4天向小鼠i.p.注射250μg的抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)或對照IgG抗體(IgG2a;#BE0089;Bioxcell Lifesciences Pvt.LTD.),並在另外的兩周間隔期之後進行檢測;
·在實驗的第1天和第4天向小鼠i.p.注射250μg抗PD1抗體(RMP1-14;#BE0146;Bioxcell Lifesciences Pvt.LTD.)和250μg抗CTLA4抗體(InVivoMAb抗-mCD152;#BE0131;Bioxcell Lifesciences Pvt.LTD.)或者對照IgG抗體(IgG2a,#BE0089或Polyclonal Syrian Hamster IgG,#BE0087;Bioxcell Lifesciences Pvt.LTD.),並在兩周的間隔期之後進行檢測;
·在創傷性事件之後如上所述向小鼠i.p.注射每周-GA,並在兩周的間隔期之後進行檢測;
·在創傷性事件之後用p300i或載劑處理小鼠,歷經一周的時間,並如上所述在3周後進行檢測。
使一些小鼠以適當的間隔期(約3周至1個月)再接受一個處理期。
評價運動神經功能,所述評價使用例如評估小鼠停留在旋轉杆上的能力的旋轉杆表現測試,或者允許小鼠抓在和握在下端帶有小環的垂直線(直徑2mm)上。垂直線允許小鼠利用前肢和後肢二者抓住線。使線維持24rpm的垂直取向的圓周運動(圓半徑為10cm)。用計時器記錄小鼠能夠懸掛到線上的時間。
在預期之內,與經IgG處理或經載劑處理的對照組或者未處理組相比,處理一個治療期的ALS小鼠表現出顯著改善的運動表現。接受兩個治療過程並且在適當的間隔期之後檢測的ALS小鼠預期表現出持久的治療效果。為了維持這一治療效果,使小鼠接受活動的處理期,其中每個時期之間具有適當的間隔期。
參考文獻
Akiyama H,Barger S,Barnum S,Bradt B,Bauer J,Cole GM,Cooper NR,Eikelenboom P,Emmerling M,Fiebich BL,Finch CE,Frautschy S,Griffin WS,Hampel H,Hull M,Landreth G,Lue L,Mrak R,Mackenzie IR,McGeer PL,O'Banion MK,Pachter J,Pasinetti G,Plata-Salaman C,Rogers J,Rydel R,Shen Y,Streit W,Strohmeyer R,Tooyoma I,Van Muiswinkel FL,Veerhuis R,Walker D,Webster S,Wegrzyniak B,Wenk G,Wyss-Coray T(2000)Inflammation and Alzheimer's disease.Neurobiology of aging 21:383-421
Alamed J,Wilcock DM,Diamond DM,Gordon MN,Morgan D(2006)Two-day radial-arm water maze learning and memory task;robust resolution of amyloid-related memory deficits in transgenic mice.Nature protocols 1:1671-1679
Bai A,Lu N,Guo Y,Liu Z,Chen J,Peng Z(2009)All-trans retinoic acid down-regulates inflammatory responses by shifting the Treg/Th17profile in human ulcerative and murine colitis.Journal of leukocyte biology 86:959-969
Baruch K,Deczkowska A,David E,Castellano JM,Miller O,Kertser A,Berkutzki T,Barnett-Itzhaki Z,Bezalel D,Wyss-Coray T,Amit I,Schwartz M(2014)Aging.Aging-induced type I interferon response at the choroid plexus negatively affects brain function.Science 346:89-93
Baruch K,Ron-Harel N,Gal H,Deczkowska A,Shifrut E,Ndifon W,Mirlas-Neisberg N,Cardon M,Vaknin I,Cahalon L,Berkutzki T,Mattson MP,Gomez-Pinilla F,Friedman N,Schwartz M(2013)CNS-specific immunity at the choroid plexus shifts toward destructive Th2inflammation in brain aging.Proceedings of the National Academy of Sciences of the United States of America 110:2264-2269
Borchelt DR,Ratovitski T,van Lare J,Lee MK,Gonzales V,Jenkins NA,Copeland NG,Price DL,Sisodia SS(1997)Accelerated amyloid deposition in the brains of transgenic mice coexpressing mutant presenilin 1and amyloid precursor proteins.Neuron 19:939-945
Bos PD,Rudensky AY(2012)Treg cells in cancer:a case of multiple personality disorder.Science translational medicine 4:164fs144
Bowers EM,Yan G,Mukherjee C,Orry A,Wang L,Holbert MA,Crump NT,Hazzalin CA,Liszczak G,Yuan H,Larocca C,Saldanha SA,Abagyan R,Sun Y,Meyers DJ,Marmorstein R,Mahadevan LC,Alani RM,Cole PA(2010)Virtual ligand screening of the p300/CBP histone acetyltransferase:identification of a selective small molecule inhibitor.Chemistry&biology 17:471-482
Breitner JC,Haneuse SJ,Walker R,Dublin S,Crane PK,Gray SL,Larson EB(2009)Risk of dementia and AD with prior exposure to NSAIDs in an elderly community-based cohort.Neurology 72:1899-1905
Brestoff JR,Artis D(2013)Commensal bacteria at the interface of host metabolism and the immune system.Nature immunology 14:676-684
Britschgi M,Wyss-Coray T(2007)Immune cells may fend off Alzheimer disease.Nature medicine 13:408-409
Burgess A,Vigneron S,Brioudes E,Labbe JC,Lorca T,Castro A(2010)Loss of human Greatwall results in G2 arrest and multiple mitotic defects due to deregulation of the cyclin B-Cdc2/PP2A balance.Proceedings of the National Academy of Sciences of the United States of America 107:12564-12569
Butovsky O,Koronyo-Hamaoui M,Kunis G,Ophir E,Landa G,Cohen H,Schwartz M(2006)Glatiramer acetate fights against Alzheimer's disease by inducing dendritic-like microglia expressing insulin-like growth factor 1.Proceedings of the National Academy of Sciences of the United States of America 103:11784-11789
Butovsky O,Kunis G,Koronyo-Hamaoui M,Schwartz M(2007)Selective ablation of bone marrow-derived dendritic cells increases amyloid plaques in a mouse Alzheimer's disease model.The European journal of neuroscience 26:413-416
Cameron B,Landreth GE(2010)Inflammation,microglia,and Alzheimer's disease.Neurobiology of disease 37:503-509
Chen X,Oppenheim JJ(2011)Resolving the identity myth:key markers of functional CD4+FoxP3+regulatory T cells.International immunopharmacology 11:1489-1496
Colombo MP,Piconese S(2007)Regulatory-T-cell inhibition versus depletion:the right choice in cancer immunotherapy.Nature reviews Cancer 7:880-887
Coyne GO,Gulley JL(2014)Adding fuel to the fire:Immunogenic intensification.Human vaccines&immunotherapeutics 10:3306-3312
Dalotto-Moreno T,Croci DO,Cerliani JP,Martinez-Allo VC,Dergan-Dylon S,Mendez-Huergo SP,Stupirski JC,Mazal D,Osinaga E,Toscano MA,Sundblad V,Rabinovich GA,Salatino M(2013)Targeting galectin-1 overcomes breast cancer-associated immunosuppression and prevents metastatic disease.Cancer research 73:1107-1117
Duraiswamy J,Freeman GJ,Coukos G(2014)Dual blockade of PD-1 and CTLA-4 combined with tumor vaccine effectively restores T-cell rejection function in tumors--response.Cancer research 74:633-634;discussion 635
Gabrilovich DI,Nagaraj S(2009)Myeloid-derived suppressor cells as regulators of the immune system.Nature reviews Immunology 9:162-174
Galvin KC,Dyck L,Marshall NA,Stefanska AM,Walsh KP,Moran B,Higgins SC,Dungan LS,Mills KH(2013)Blocking retinoic acid receptor-alpha enhances the efficacy of a dendritic cell vaccine against tumours by suppressing the induction of regulatory T cells.Cancer immunology,immunotherapy:CII 62:1273-1282
Ghiringhelli F,Bruchard M,Chalmin F,Rebe C(2012)Production of adenosine by ectonucleotidases:a key factor in tumor immunoescape.Journal of biomedicine&biotechnology 2012:473712
Group AR,Lyketsos CG,Breitner JC,Green RC,Martin BK,Meinert C,Piantadosi S,Sabbagh M(2007)Naproxen and celecoxib do not prevent AD in early results from a randomized controlled trial.Neurology 68:1800-1808
Haas J,Korporal M,Balint B,Fritzsching B,Schwarz A,Wildemann B(2009)Glatiramer acetate improves regulatory T-cell function by expansion of naive CD4(+)CD25(+)FOXP3(+)CD31(+)T-cells in patients with multiple sclerosis.Journal of neuroimmunology 216:113-117
Hardy J,Selkoe DJ(2002)The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics.Science 297:353-356
He F,Balling R(2013)The role of regulatory T cells in neurodegenerative diseases.Wiley interdisciplinary reviews Systems biology and medicine 5:153-180
Hirayama M,Nishikawa H,Nagata Y,Tsuji T,Kato T,Kageyama S,Ueda S,Sugiyama D,Hori S,Sakaguchi S,Ritter G,Old LJ,Gnjatic S,Shiku H(2013)Overcoming regulatory T-cell suppression by a lyophilized preparation of Streptococcus pyogenes.European journal of immunology 43:989-1000
Hong J,Li N,Zhang X,Zheng B,Zhang JZ(2005)Induction of CD4+CD25+regulatory T cells by copolymer-I through activation of transcription factor Foxp3.Proceedings of the National Academy of Sciences of the United States of America 102:6449-6454
Ju Y,Shang X,Liu Z,Zhang J,Li Y,Shen Y,Liu Y,Liu C,Liu B,Xu L,Wang Y,Zhang B,Zou J(2014)The Tim-3/galectin-9 pathway involves in the homeostasis of hepatic Tregs in a mouse model of concanavalin A-induced hepatitis.Molecular immunology 58:85-91
Jung S,Aliberti J,Graemmel P,Sunshine MJ,Kreutzberg GW,Sher A,Littman DR(2000)Analysis of fractalkine receptor CX(3)CR1 function by targeted deletion and green fluorescent protein reporter gene insertion.Molecular and cellular biology 20:4106-4114
Kim JM,Rasmussen JP,Rudensky AY(2007)Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice.Nature immunology8:191-197
Kim PS,Jochems C,Grenga I,Donahue RN,Tsang KY,Gulley JL,Schlom J,Farsaci B(2014)Pan-Bcl-2 inhibitor,GX15-070(obatoclax),decreases human T regulatory lymphocytes while preserving effector T lymphocytes:a rationale for its use in combination immunotherapy.Journal of immunology 192:2622-2633
Koronyo-Hamaoui M,Ko MK,Koronyo Y,Azoulay D,Seksenyan A,Kunis G,Pham M,Bakhsheshian J,Rogeri P,Black KL,Farkas DL,Schwartz M(2009)Attenuation of AD-like neuropathology by harnessing peripheral immune cells:local elevation of IL-10 and MMP-9.Journal of neurochemistry 111:1409-1424
Kotsakis A,Harasymczuk M,Schilling B,Georgoulias V,Argiris A,Whiteside TL(2012)Myeloid-derived suppressor cell measurements in fresh and cryopreserved blood samples.Journal of immunological methods 381:14-22
Kunis G,Baruch K,Rosenzweig N,Kertser A,Miller O,Berkutzki T,Schwartz M(2013)IFN-gamma-dependent activation of the brain's choroid plexus for CNS immune surveillance and repair.Brain:a journal of neurology 136:3427-3440
Lai AY,McLaurin J(2012)Clearance of amyloid-beta peptides by microglia and macrophages:the issue of what,when and where.Future neurology 7:165-176
Lebow M,Neufeld-Cohen A,Kuperman Y,Tsoory M,Gil S,Chen A (2012)Susceptibility to PTSD-like behavior is mediated by corticotropin-releasing factor receptor type 2 levels in the bed nucleus of the stria terminalis.The Journal of neuroscience:the official journal of the Society for Neuroscience 32:6906-6916
Liu Y,Wang L,Predina J,Han R,Beier UH,Wang LC,Kapoor V,Bhatti TR,Akimova T,Singhal S,Brindle PK,Cole PA,Albelda SM,Hancock WW(2013)Inhibition of p300 impairs Foxp3(+)T regulatory cell function and promotes antitumor immunity.Nature medicine 19:1173-1177
Marabelle A,Kohrt H,Sagiv-Barfi I,Ajami B,Axtell RC,Zhou G,Rajapaksa R,Green MR,Torchia J,Brody J,Luong R,Rosenblum MD,Steinman L,Levitsky HI,Tse V,Levy R(2013)Depleting tumor-specific Tregs at a single site eradicates disseminated tumors.The Journal of clinical investigation 123:2447-2463
Michaud JP,Bellavance MA,Prefontaine P,Rivest S(2013)Real-time in vivo imaging reveals the ability of monocytes to clear vascular amyloid beta.Cell reports 5:646-653
Mildner A,Schlevogt B,Kierdorf K,Bottcher C,Erny D,Kummer MP,Quinn M,Bruck W,Bechmann I,Heneka MT,Priller J,Prinz M(2011)Distinct and non-redundant roles of microglia and myeloid subsets in mouse models of Alzheimer's disease.The Journal of neuroscience:the official journal of the Society for Neuroscience 31:11159-11171
Mucida D,Park Y,Kim G,Turovskaya O,Scott I,Kronenberg M,Cheroutre H(2007)Reciprocal TH17 and regulatory T cell differentiation mediated by retinoic acid.Science 317:256-260
Naidoo J,Page DB,Wolchok JD(2014)Immune modulation for cancer therapy.British journal of cancer 111:2214-2219
Nakatsukasa H,Tsukimoto M,Harada H,Kojima S(2011)Adenosine A2B receptor antagonist suppresses differentiation to regulatory T cells without suppressing activation of T cells.Biochemical and biophysical research communications 409:114-119
Nishikawa H,Sakaguchi S(2010)Regulatory T cells in tumor immunity.International journal of cancer Journal international du cancer 127:759-767
Oakley H,Cole SL,Logan S,Maus E,Shao P,Craft J,Guillozet-Bongaarts A,Ohno M,Disterhoft J,Van Eldik L,Berry R,Vassar R(2006)Intraneuronal beta-amyloid aggregates,neurodegeneration,and neuron loss in transgenic mice with five familial Alzheimer's disease mutations:potential factors in amyloid plaque formation.The Journal of neuroscience:the official journal of the Society for Neuroscience 26:10129-10140
Ohaegbulam KC,Assal A,Lazar-Molnar E,Yao Y,Zang X(2015)Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway.Trends in molecular medicine 21:24-33
Pere H,Montier Y,Bayry J,Quintin-Colonna F,Merillon N,Dransart E,Badoual C,Gey A,Ravel P,Marcheteau E,Batteux F,Sandoval F,Adotevi O,Chiu C,Garcia S,Tanchot C,Lone YC,Ferreira LC,Nelson BH,Hanahan D,Fridman WH,Johannes L,Tartour E(2011)A CCR4 antagonist combined with vaccines induces antigen-specific CD8+T cells and tumor immunity against self antigens.Blood 118:4853-4862
Qin A,Wen Z,Zhou Y,Li Y,Li Y,Luo J,Ren T,Xu L(2013)MicroRNA-126 regulates the induction and function of CD4(+)Foxp3(+)regulatory T cells through PI3K/AKT pathway.Journal of cellular and molecular medicine 17:252-264
Rosenkranz D,Weyer S,Tolosa E,Gaenslen A,Berg D,Leyhe T,Gasser T,Stoltze L(2007)Higher frequency of regulatory T cells in the elderly and increased suppressive activity in neurodegeneration.Journal of neuroimmunology 188:117-127
Roy S,Barik S,Banerjee S,Bhuniya A,Pal S,Basu P,Biswas J,Goswami S,Chakraborty T,Bose A,Baral R(2013)Neem leaf glycoprotein overcomes indoleamine 2,3 dioxygenase mediated tolerance in dendritic cells by attenuating hyperactive regulatory T cells in cervical cancer stage IIIB patients.Human immunology 74:1015-1023
Sakaguchi S,Yamaguchi T,Nomura T,Ono M(2008)Regulatory T cells and immune tolerance.Cell 133:775-787
Saresella M,Calabrese E,Marventano I,Piancone F,Gatti A,Calvo MG,Nemni R,Clerici M(2010)PD1 negative and PD1 positive CD4+T regulatory cells in mild cognitive impairment and Alzheimer's disease.Journal of Alzheimer's disease:JAD 21:927-938
Schmidt SD,Nixon RA,Mathews PM(2005)ELISA method for measurement of amyloid-beta levels.Methods in molecular biology 299:279-297
Schwartz M,Baruch K(2012)Vaccine for the mind:Immunity against self at the choroid plexus for erasing biochemical consequences of stressful episodes.Human vaccines&immunotherapeutics 8:1465-1468
Schwartz M,Baruch K(2014a)Breaking peripheral immune tolerance to CNS antigens in neurodegenerative diseases:boosting autoimmunity to fight-off chronic neuroinflammation.Journal of autoimmunity 54:8-14
Schwartz M,Baruch K(2014b)The resolution of neuroinflammation in neurodegeneration:leukocyte recruitment via the choroid plexus.The EMBO journal 33:7-22
Shankar GM,Li S,Mehta TH,Garcia-Munoz A,Shepardson NE,Smith I,Brett FM,Farrell MA,Rowan MJ,Lemere CA,Regan CM,Walsh DM,Sabatini BL,Selkoe DJ(2008)Amyloid-beta protein dimers isolated directly from Alzheimer's brains impair synaptic plasticity and memory.Nature medicine 14:837-842
Shechter R,London A,Varol C,Raposo C,Cusimano M,Yovel G,Rolls A,Mack M,Pluchino S,Martino G,Jung S,Schwartz M(2009)Infiltrating blood-derived macrophages are vital cells playing an anti-inflammatory role in recovery from spinal cord injury in mice.PLoS medicine 6:e1000113
Shechter R,Miller O,Yovel G,Rosenzweig N,London A,Ruckh J,Kim KW,Klein E,Kalchenko V,Bendel P,Lira SA,Jung S,Schwartz M(2013)Recruitment of beneficial M2 macrophages to injured spinal cord is orchestrated by remote brain choroid plexus.Immunity 38:555-569
Shevchenko I,Karakhanova S,Soltek S,Link J,Bayry J,Werner J,Umansky V,Bazhin AV(2013)Low-dose gemcitabine depletes regulatory T cells and improves survival in the orthotopic Panc02 model of pancreatic cancer.International journal of cancer Journal international du cancer 133:98-107
Simard AR,Soulet D,Gowing G,Julien JP,Rivest S(2006)Bone marrow-derived microglia play a critical role in restricting senile plaque formation in Alzheimer's disease.Neuron 49:489-502
Simpson TR,Li F,Montalvo-Ortiz W,Sepulveda MA,Bergerhoff K,Arce F,Roddie C,Henry JY,Yagita H,Wolchok JD,Peggs KS,Ravetch JV,Allison JP,Quezada SA(2013)Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma.The Journal of experimental medicine 210:1695-1710
Smith PM,Howitt MR,Panikov N,Michaud M,Gallini CA,Bohlooly YM,Glickman JN,Garrett WS(2013)The microbial metabolites,short-chain fatty acids,regulate colonic Treg cell homeostasis.Science 341:569-573
Suffner J,Hochweller K,Kuhnle MC,Li X,Kroczek RA,Garbi N,Hammerling GJ(2010)Dendritic cells support homeostatic expansion of Foxp3+regulatory T cells in Foxp3.LuciDTR mice.Journal of immunology 184:1810-1820
Terawaki S,Chikuma S,Shibayama S,Hayashi T,Yoshida T,Okazaki T,Honjo T(2011)IFN-alpha directly promotes programmed cell death-1transcription and limits the duration of T cell-mediated immunity.Journal of immunology 186:2772-2779
Terme M,Colussi O,Marcheteau E,Tanchot C,Tartour E,Taieb J(2012)Modulation of immunity by antiangiogenic molecules in cancer.Clinical&developmental immunology 2012:492920
Terme M,Tartour E,Taieb J(2013)VEGFA/VEGFR2-targeted therapies prevent the VEGFA-induced proliferation of regulatory T cells in cancer.Oncoimmunology 2:e25156
Thomas-Schoemann A,Batteux F,Mongaret C,Nicco C,Chereau C,Annereau M,Dauphin A,Goldwasser F,Weill B,Lemare F,Alexandre J(2012)Arsenic trioxide exerts antitumor activity through regulatory T cell depletion mediated by oxidative stress in a murine model of colon cancer.Journal of immunology 189:5171-5177
Torres KC,Araujo Pereira P,Lima GS,Bozzi IC,Rezende VB,Bicalho MA,Moraes EN,Miranda DM,Romano-Silva MA(2013)Increased frequency of T cells expressing IL-10 in Alzheimer disease but not in late-onset depression patients.Progress in neuro-psychopharmacology&biological psychiatry 47:40-45
Town T,Laouar Y,Pittenger C,Mori T,Szekely CA,Tan J,Duman RS,Flavell RA(2008)Blocking TGF-beta-Smad2/3 innate immune signaling mitigates Alzheimer-like pathology.Nature medicine 14:681-687
Tseng D,Volkmer JP,Willingham SB,Contreras-Trujillo H,Fathman JW,Fernhoff NB,Seita J,Inlay MA,Weiskopf K,Miyanishi M,Weissman IL(2013)Anti-CD47 antibody-mediated phagocytosis of cancer by macrophages primes an effective antitumor T-cell response.Proceedings of the National Academy of Sciences of the United States of America 110:11103-11108
Vom Berg J,Prokop S,Miller KR,Obst J,Kalin RE,Lopategui-Cabezas I,Wegner A,Mair F,Schipke CG,Peters O,Winter Y,Becher B,Heppner FL(2012)Inhibition of IL-12/IL-23 signaling reduces Alzheimer's disease-like pathology and cognitive decline.Nature medicine 18:1812-1819
Voo KS,Bover L,Harline ML,Vien LT,Facchinetti V,Arima K,Kwak LW,Liu YJ(2013)Antibodies targeting human OX40 expand effector T cells and block inducible and natural regulatory T cell function.Journal of immunology 191:3641-3650
Walsh JT,Zheng J,Smirnov I,Lorenz U,Tung K,Kipnis J(2014)Regulatory T cells in central nervous system injury:a double-edged sword.Journal of immunology 193:5013-5022
Ward FJ,Dahal LN,Wijesekera SK,Abdul-Jawad SK,Kaewarpai T,Xu H,Vickers MA,Barker RN(2013)The soluble isoform of CTLA-4 as a regulator of T-cell responses.European journal of immunology 43:1274-1285
Weber JS,Kudchadkar RR,Yu B,Gallenstein D,Horak CE,Inzunza HD,Zhao X,Martinez AJ,Wang W,Gibney G,Kroeger J,Eysmans C,Sarnaik AA,Chen YA(2013)Safety,efficacy,and biomarkers of nivolumab with vaccine in ipilimumab-refractory or-naive melanoma.Journal of clinical oncology:official journal of the American Society of Clinical Oncology 31:4311-4318
Weber MS,Hohlfeld R,Zamvil SS(2007)Mechanism of action of glatiramer acetate in treatment of multiple sclerosis.Neurotherapeutics:the journal of the American Society for Experimental NeuroTherapeutics 4:647-653
Weiskopf K,Ring AM,Schnorr PJ,Volkmer JP,Volkmer AK,Weissman IL,Garcia KC(2013)Improving macrophage responses to therapeutic antibodies by molecular engineering of SIRPalpha variants.Oncoimmunology 2:e25773
Wyss-Coray T,Rogers J(2012)Inflammation in Alzheimer disease-a brief review of the basic science and clinical literature.Cold Spring Harbor perspectives in medicine 2:a006346
Zeng J,See AP,Phallen J,Jackson CM,Belcaid Z,Ruzevick J,Durham N,Meyer C,Harris TJ,Albesiano E,Pradilla G,Ford E,Wong J,Hammers HJ,Mathios D,Tyler B,Brem H,Tran PT,Pardoll D,Drake CG,Lim M(2013)Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas.International journal of radiation oncology,biology,physics 86:343-349
Zhao L,Sun L,Wang H,Ma H,Liu G,Zhao Y(2007)Changes of CD4+CD25+Foxp3+regulatory T cells in aged Balb/c mice.Journal of leukocyte biology 81:1386-1394
Zheng H,Fridkin M,Youdim M(2015)New approaches to treating Alzheimer's disease.Perspectives in medicinal chemistry 7:1-8
Zhou S,Chen L,Qin J,Li R,Tao H,Zhen Z,Chen H,Chen G,Yang Y,Liu B,She Z,Zhong C,Liang C(2013)Depletion of CD4+CD25+regulatory T cells promotes CCL21-mediated antitumor immunity.PloS one 8:e73952
Zhou X,Kong N,Wang J,Fan H,Zou H,Horwitz D,Brand D,Liu Z,Zheng SG(2010)Cutting edge:all-trans retinoic acid sustains the stability and function of natural regulatory T cells in an inflammatory milieu.Journal of immunology 185:2675-2679
165282PCT-CN-ELLA序列表
耶達研究與開發有限公司
M·埃森巴赫-施瓦茨
K·巴魯克
N·羅森茨魏希
降低系統性調節性T細胞水平或活性來治療CNS疾病和損傷
YEDA-127 PCT
61/951,783,
2014-03-12
62/030,164
2014-07-29
56
PatentIn 3.5版
1
15
PRT
人工序列
合成的
1
Ala Ala Ala Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
2
15
PRT
人工序列
合成的
2
Ala Glu Lys Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
3
15
PRT
人工序列
合成的
3
Ala Lys Glu Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
4
15
PRT
人工序列
合成的
4
Ala Lys Lys Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
5
15
PRT
人工序列
合成的
5
Ala Glu Ala Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
6
15
PRT
人工序列
合成的
6
Lys Glu Ala Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
7
15
PRT
人工序列
合成的
7
Ala Glu Glu Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
8
15
PRT
人工序列
合成的
8
Ala Ala Glu Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
9
15
PRT
人工序列
合成的
9
Glu Lys Ala Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
10
15
PRT
人工序列
合成的
10
Ala Ala Lys Tyr Glu Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
11
15
PRT
人工序列
合成的
11
Ala Ala Lys Tyr Ala Glu Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
12
15
PRT
人工序列
合成的
12
Glu Ala Ala Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
13
15
PRT
人工序列
合成的
13
Glu Lys Lys Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
14
15
PRT
人工序列
合成的
14
Glu Ala Lys Tyr Ala Ala Ala Ala Ala Ala Lys Ala Ala Ala Ala
1 5 10 15
15
15
PRT
人工序列
合成的
15
Ala Glu Lys Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
16
15
PRT
人工序列
合成的
16
Ala Lys Glu Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
17
15
PRT
人工序列
合成的
17
Ala Lys Lys Tyr Glu Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
18
15
PRT
人工序列
合成的
18
Ala Lys Lys Tyr Ala Glu Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
19
15
PRT
人工序列
合成的
19
Ala Glu Ala Tyr Lys Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
20
15
PRT
人工序列
合成的
20
Lys Glu Ala Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
21
15
PRT
人工序列
合成的
21
Ala Glu Glu Tyr Lys Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
22
15
PRT
人工序列
合成的
22
Ala Ala Glu Tyr Lys Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
23
15
PRT
人工序列
合成的
23
Glu Lys Ala Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
24
15
PRT
人工序列
合成的
24
Ala Ala Lys Tyr Glu Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
25
15
PRT
人工序列
合成的
25
Ala Ala Lys Tyr Ala Glu Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
26
15
PRT
人工序列
合成的
26
Glu Lys Lys Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
27
15
PRT
人工序列
合成的
27
Glu Ala Lys Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
28
15
PRT
人工序列
合成的
28
Ala Glu Tyr Ala Lys Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
29
15
PRT
人工序列
合成的
29
Ala Glu Lys Ala Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
30
15
PRT
人工序列
合成的
30
Glu Lys Tyr Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
31
15
PRT
人工序列
合成的
31
Ala Tyr Lys Ala Glu Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
32
15
PRT
人工序列
合成的
32
Ala Lys Tyr Ala Glu Ala Ala Ala Ala Ala Ala Ala Ala Ala Ala
1 5 10 15
33
24
DNA
人工序列
合成的
33
agcatacagg tcctggcatc ttgt 24
34
24
DNA
人工序列
合成的
34
caaagaccac atgcttgcca tcca 24
35
24
DNA
人工序列
合成的
35
agatcacatt cacggtgctg gcta 24
36
24
DNA
人工序列
合成的
36
agctttggga tggtagctgg aaga 24
37
24
DNA
人工序列
合成的
37
tgtgaaggga ttaacgaggc tgga 24
38
24
DNA
人工序列
合成的
38
ccatgtttcg ggcacatttc caca 24
39
21
DNA
人工序列
合成的
39
aactgcatcc atatcgatga c 21
40
19
DNA
人工序列
合成的
40
gtggcaatga tctcaacac 19
41
18
DNA
人工序列
合成的
41
catccacgtg ttggctca 18
42
23
DNA
人工序列
合成的
42
gatcatcttg ctggtgaatg agt 23
43
20
DNA
人工序列
合成的
43
gcctcttctc attcctgctt 20
44
20
DNA
人工序列
合成的
44
ctcctccact tggtggtttg 20
45
21
DNA
人工序列
合成的
45
ccaaaagatg aagggctgct t 21
46
20
DNA
人工序列
合成的
46
tgctgctgcg agatttgaag 20
47
20
DNA
人工序列
合成的
47
gaagttcaac atcaagagca 20
48
19
DNA
人工序列
合成的
48
catagtccct ttggtccag 19
49
24
DNA
人工序列
合成的
49
tgaattccct gggtgagaag ctga 24
50
24
DNA
人工序列
合成的
50
tggccttgta gacaccttgg tctt 24
51
24
DNA
人工序列
合成的
51
aattgctgcc ttcgccctct ttac 24
52
24
DNA
人工序列
合成的
52
tgtacaggct gaggactttg gtgt 24
53
19
DNA
人工序列
合成的
53
ccggaccaga gaccctttg 19
54
23
DNA
人工序列
合成的
54
cctgtgggct tgttgaagta aaa 23
55
24
DNA
人工序列
合成的
55
gatgctcagc agtcaagtgc cttt 24
56
24
DNA
人工序列
合成的
56
gacatgtttg cggcatccag gtaa 24
