木糖甙木糖醇寡聚物的生產方法與流程
2023-06-06 07:57:16 2
本申請要求2014年6月24日提交的美國臨時申請第62/016,555號的權益,其全部內容通過引用併入本文。
提交ASCII文本文件的序列表
下列以ASCII文本文件提交的內容通過引用全部併入本文:序列表的計算機可讀形式(CRF)(文件名稱:416272008040SEQLIST.TXT,記錄日期:2015年6月18日,大小:25KB)。
發明領域
本公開總體來說涉及木糖甙-木糖醇寡聚物(xylosyl-xylitol oligomer)的生產,更具體地涉及在宿主細胞中利用生物法生產木糖甙-木糖醇寡聚物。
背景技術:
源自植物細胞壁的木質纖維生物質是用於生產生物能源和可再生化合物最豐富的原材料。半纖維素約佔木質纖維生物質總重量的30%。半纖維素的主要形式是雜木聚糖(heteroxylan),其含有1,4-連接的β-D-木糖聚合物的主鏈和各種裝飾的阿拉伯糖、阿魏酸、半乳糖、葡糖醛酸和乙醯酯。與纖維素相比,在預處理過程中,半纖維素組分容易解聚成短的寡聚物釋放到液相中。將釋放出來的半纖維素組分轉化成燃料或其它高附加值的化合物,對構建經濟的生物質轉化過程是非常有意義的。
據估計,在健康成人中微生物的數量比人類細胞多十倍(Savage et al.,1977)。人們日益認識到,微生物菌群和人體器官之間的共生對健康十分重要。源自半纖維素的低聚木糖(Xylooligosaccharides)和木糖醇,分別對腸道菌群和口腔菌群大有卑益。
低聚木糖(XOS,也稱為木寡糖、木糖糊精)是在竹筍、水果、蔬菜、牛奶和蜂蜜中發現的天然存在的低聚糖(Vazquez et al.,2000)。工業上,可以通過水熱法或酶水解法處理價格低廉的木質纖維素原料進行大規模生產XOS(Aachary et al.,2011)。XOS的廣泛應用已被證實,包括作為功能性食品、預防和治療胃腸道感染、魚類和家禽的動物飼料、農業增產和催熟劑、治療骨質疏鬆、皮膚瘙癢症症、耳炎、皮膚和頭髮失調等藥物的活性劑。在當前市場上,XOS最重要的應用是作為益生元或調配的合生元等功能性食品的配料(Schrezenmeir et al.,2001)。益生元(Prebiotics)是「一種不可被消化的食品成分,它通過選擇性的刺激一種或少數幾種結腸中的細菌生長和/或活性,對宿主產生有益的影響,從而改善宿主健康」(Gibson et al.,1995)。XOS已證實能夠在體外(Okazaki et al.,1990)和體內(Hsu et al.,2004)促進有益菌青春雙歧桿菌(Bifidobacterium adolescentis)的生長。據估計,到2018年益生元的市場將達到48億美元。目前XOS最大的生產商(山東龍力生物科技股份有限公司)年產量達1萬噸。
木糖醇是另一種源自半纖維素、對人體健康有益的化合物。對於許多細菌和酵母來說,攝入無法利用的木糖醇將會妨礙己糖的利用,這有助於人體重建一個健康的微生物菌群。木糖醇已經用於預防中耳炎(Azarpazhooh et al.,2011)和蛀牙(Maguire et al.,2003; et al.,1992)。此外,木糖醇與蔗糖具有相似的甜度,但其卡路裡含量卻比蔗糖少33%(Hyvonen et al.,1982),已被廣泛用於甜味劑的替代品。雖然工業上主要是通過木糖的化學氫化來生產木糖醇,但是由於轉化成本低,微生物發酵法在新建的工廠中變得更加普遍。根據2007年的一份報告,木糖醇的年產量在2萬至4萬噸( et al.,2007)。因此,改進低聚木糖及其相關化合物如含有木糖醇組分的低聚木糖的生產方法非常有必要。
發明簡述
一種生產木糖甙-木糖醇寡聚物(xylosyl-xylitol oligomer)的方法,所述方法包括:a)提供宿主細胞,其包含一種重組的木寡糖轉運蛋白多肽和一種包含木寡糖還原酶活性的重組木糖還原酶多肽,其中所述木寡糖轉運蛋白多肽可將木寡糖轉運到宿主細胞中;和b)在含有木寡糖的培養基中培養所述宿主細胞,所述的宿主細胞能利用木寡糖生產木糖甙-木糖醇寡聚物。在一些實施方案中,宿主細胞是一種真菌宿主細胞。在一些實施方案中,宿主細胞是釀酒酵母(Saccharomyces cerevisiae)。在一些可能與上述任一個實施方案相結合的實施方案中,重組木寡糖轉運蛋白多肽包含與來自粗糙脈孢黴(Neurospora crassa)的CDT-2具有至少80%胺基酸一致性的胺基酸序列。在一些可能與上述任一個實施方案相結合的實施方案中,重組木糖還原酶多肽包含與來自樹幹畢赤酵母(Scheffersomyces stipitis)的XYL1具有至少80%胺基酸一致性的胺基酸序列。在一些可能與上述任一個實施方案相結合的實施方案中,一種或多種的木寡糖是指木二糖或木三糖。在一些可能與上述任一個實施方案相結合的實施方案中,至少一種木糖甙-木糖醇寡聚物是木糖甙-木糖醇或木二糖甙-木糖醇。在一些可能與上述任一個實施方案相結合的實施方案中,與相應的對照細胞相比,在宿主細胞中一種或多種β-木糖苷酶多肽的木糖甙-木糖醇水解酶活性降低。在一些實施方案中,與相應的對照細胞相比,一種或多種β-木糖苷酶多肽的活性降低是由於一種或多種多肽的豐度降低。在一些實施方案中,一種或多種β-木糖苷酶多肽的豐度由於一種或多種多肽的表達降低而降低。在一些實施方案中,一種或多種β-木糖苷酶多肽的表達由於一種突變而降低。在一些可能與上述任一個實施方案相結合的實施方案中,與相應的對照細胞相比,宿主細胞中一種或多種木糖醇脫氫酶多肽的活性降低。在一些實施方案中,一種或多種木糖醇脫氫酶多肽的豐度由於一種或多種多肽的表達降低而降低。在一些實施方案中,一種或多種木糖醇脫氫酶多肽的表達由於一種突變而降低。在一些可能與上述任一個實施方案相結合的實施方案中,所述的方法還包括在b)之後從培養基中初步純化木糖甙-木糖醇寡聚物的方法。
另一方面,本公開涉及一種組合物,包括用前述方法純化得到的木糖甙-木糖醇寡聚物。在一些實施方案中,組合物至少包括一種從木糖甙-木糖醇和木二糖甙-木糖醇中初步純化的木糖甙-木糖醇寡聚物。
另一方面,本公開涉及一種生產木糖甙-木糖醇寡聚物的方法,所述方法包括:a)提供宿主細胞,其包含一種木寡糖轉運蛋白多肽,其中所述木寡糖轉運蛋白多肽將木寡糖轉運到宿主細胞中和一種包含木寡糖還原酶活性的木糖還原酶多肽,其中與相應的對照細胞相比,在宿主細胞中一種或多種β-木糖苷酶多肽的木糖甙-木糖醇水解酶活性降低;和b)在含有木寡糖的培養基中培養所述宿主細胞,其中宿主細胞能利用木寡糖生產木糖甙-木糖醇寡聚物。在一些實施方案中,宿主細胞是真菌宿主細胞。在一些實施方案中,宿主細胞是粗糙脈孢黴(Neurospora crassa)。在一些可能與上述任一個實施方案相結合的實施方案中,與相應的對照細胞相比,所述一種或多種β-木糖苷酶多肽的活性由於所述一種或多種多肽的豐度降低而降低。在一些實施方案中,一種或多種β-木糖苷酶多肽的豐度由於所述一種或多種多肽的表達降低而降低。在一些實施方案中,一種或多種β-木糖苷酶多肽的表達由於一種突變而降低。在一些可能與上述任一個實施方案相結合的實施方案中,與相應的對照細胞相比,所述宿主細胞中一種或多種木糖醇脫氫酶多肽的活性降低。在一些實施方案中,一種或多種木糖醇脫氫酶多肽的豐度由於所述一種或多種多肽的表達降低而降低。在一些實施方案中,一種或多種木糖醇脫氫酶多肽的表達由於一種突變而降低。在一些可能與上述任一個實施方案相結合的實施方案中,一種或多種的木寡糖是木二糖或木三糖。在一些可能與上述任一個實施方案相結合的實施方案中,至少一種木糖甙-木糖醇寡聚物是木糖甙-木糖醇或木二糖甙-木糖醇。在一些可能與上述任一個實施方案相結合的實施方案中,所述的方法還包括在b)之後從培養基中初步純化木糖甙-木糖醇寡聚物的方法。
另一方面,本公開涉及一種組合物,包括用前述方法純化得到的木糖甙-木糖醇寡聚物。在一些實施方案中,組合物至少包括一種從木糖甙-木糖醇和木二糖甙-木糖醇中初步純化的木糖甙-木糖醇寡聚物。
附圖說明
本專利或申請文件包含至少一張彩色附圖。具有彩色附圖的本專利或申請公開的專利副本由專利局根據請求並支付必要費用後提供。
圖1說明了表達粗糙脈孢黴轉運蛋白的釀酒酵母將木寡糖轉運到細胞質中。每種純化組分的木寡糖起始濃度為100μM。培養基中殘餘的木糖(X1)和木寡糖是用帶有空質粒的釀酒酵母(vector)或單獨表達CDT-1或CDT-2轉運蛋白的釀酒酵母來表示。所用的木寡糖所括木二糖(X2)、木三糖(X3)、木四糖(X4)和木五糖(X5)。
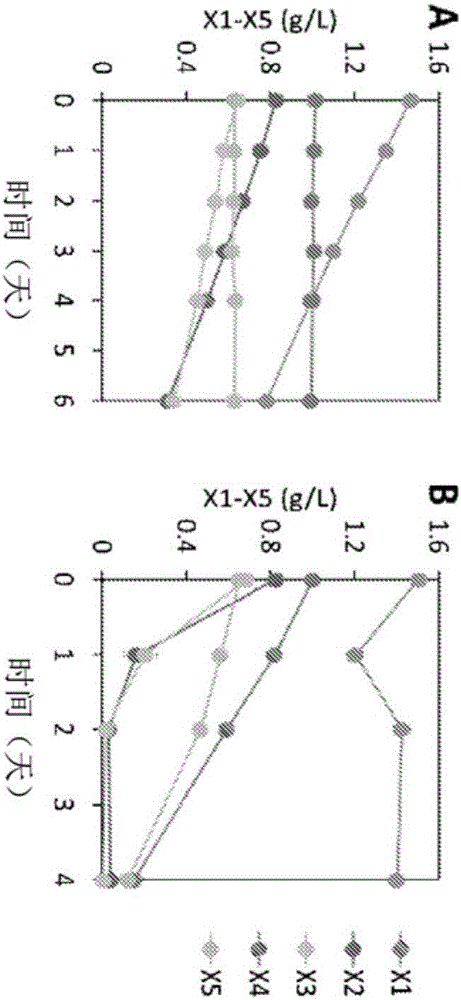
圖2A-2B說明了通過改造的釀酒酵母消耗木寡糖。圖2A顯示了以木糖和木寡糖為碳源,在好氧條件下,以OD600=1的起始細胞密度接種表達了XR/XDH木糖消耗途徑(CDT-2和GH43-2)的釀酒酵母培養物。圖2B顯示了圖2A的培養條件,只是起始細胞密度OD600=20。兩張圖中,顯示了在不同時間段後培養液的木糖(X1)和具有較高聚合度(DP)的木寡糖(X2-X5)的濃度。
圖3A-3D說明了釀酒酵母中木寡糖消耗途徑的組分。圖3A顯示了菌株WT D452-2在起始細胞密度OD600=1時,在不同時間段後培養液中殘糖濃度。圖3B顯示了具有樹幹畢赤酵母木糖利用途徑(質粒pLNL78)的菌株D452-2在起始細胞密度OD600=1時,在不同時間段後培養液中殘糖濃度。圖3C顯示了菌株WT D452-2在起始細胞密度OD600=20時,在不同時間段後培養液中殘糖濃度。圖3D顯示了具有樹幹畢赤酵母木糖利用途徑(質粒pLNL78)的菌株D452-2在起始細胞密度OD600=20時,在不同時間段後培養液中殘糖濃度。在所有圖中,顯示了木糖(X1)和高級DP的木糖糊精(X2-X5)。
圖4A-4B說明了木糖甙-木糖醇的液相色譜-質譜(LC-MS)和液相色譜-質譜/質譜(LC-MS/MS)譜圖。圖4A顯示了木糖甙-木糖醇的LC-MS和LC-MS/MS譜圖(結構已示)。高解析度的MS譜圖說明了負離子模式的m/z(質荷比)。分別以0.32和0.33ppm的精確度測定去質子化和甲酸鹽加合物離子。下圖中的MS/MS譜圖顯示與預測片段匹配的產物離子。母離子[xylosyl-xylitol-H]-用黑色的菱形標記。圖4B顯示了木二糖甙-木糖醇的LC-MS和LC-MS/MS譜圖(結構已示)。分別以0.51和0.37ppm的精確度測定去質子化和甲酸鹽加合物離子。下圖中的MS/MS譜圖顯示與預測片段匹配的產物離子。母離子[xylosyl-xylosyl-xylitol-H]-用黑色的菱形標記。
圖5說明了用共培養酵母菌株的木寡糖代謝來鑑定生產木糖甙-木糖醇所需要的酶的來源。將起始細胞密度OD600=1.0的木糖利用菌株(SR8)和起始細胞密度OD600=20木寡糖水解菌株(含有表達CDT-2和FH43-2基因的pXD8.4質粒的D452-2)在含有2%木寡糖的培養基上共培養。
圖6A-6B說明了在體外用來自粗糙脈孢黴的木糖還原酶XRY-1生產木糖甙-木糖醇寡聚物。圖6A顯示了在加入XYR-1之前反應液中木寡糖X1-X4的含量。圖6B顯示了反應之後木寡糖和木糖甙-木糖醇寡聚物的濃度。木糖、聚合度2-4的木寡糖以及它們還原的產物木糖甙-木糖寡聚物分別標記為X1-X4(木寡糖)和xlt1-xlt4(木糖甙-木糖寡聚物)。
圖7說明了粗糙脈孢黴Δcdt-2菌株在木聚糖培養上清液中的木寡糖含量。在CarboPac PA200柱上通過HPAEC分析25μL 1:200稀釋的粗糙脈孢黴木聚糖培養上清液。在野生型菌株(品紅色線)培養上清液中沒有檢測到可溶性的糖,而在Δcdt-2菌株(藍色線)培養上清液中存在高濃度的未修飾和修飾的木寡糖。此外,還發現少量的木糖,意味著木糖是通過不同轉運蛋白轉運的。
圖8A-8B說明了GH43-2和GH43-7β-木糖苷酶對各種木寡糖或木糖甙-木糖醇底物的活性。圖8A顯示了GH43-7對木糖甙-木糖醇的水解。將純化的GH43-2或GH43-7與木糖甙-木糖醇和木二糖孵育通過離子排阻HPLC測量所得產物的濃度(mM)。圖8B顯示了如圖8A所示的β-木糖苷酶對木糖甙-木糖醇的水解產物色譜圖。酶促反應的產物通過離子排阻HPLC進行解析。使用峰面積對反應結束後的底物和產物濃度進行定量。
圖9A-9H說明了各種工程化酵母生長和代謝情況。圖9A顯示了好氧條件下酵母細胞濃度OD600=1,以木寡糖為唯一碳源的生長曲線。圖中是顯示了無質粒的SR8或轉化了表達CDT-2和GH43-2的質粒(pXD8.4)的酵母的生長。圖9B顯示了微好氧條件下帶有pXD8.4的酵母在起始細胞濃度OD600=20,以木寡糖為唯一碳源的情況下木二糖的消耗。圖9C顯示了微好氧條件下帶有pXD8.6的酵母在起始細胞濃度OD600=20,以木寡糖為唯一碳源的情況下,木二糖消耗。圖9D顯示了在微好氧條件下帶有pXD8.7的酵母在起始細胞濃度為OD600=20,以木寡糖為唯一碳源的情況下木二糖的消耗。圖9E顯示了微好氧條件下帶有pXD8.4的酵母在起始細胞濃度OD600=80,以木寡糖為唯一碳源的情況下木二糖的消耗情況。圖9F顯示了微好氧條件下帶有pXD8.6的酵母在起始細胞濃度OD600=80,以木寡糖為唯一碳源的情況下木二糖的消耗情況。圖9G顯示了微好氧條件下帶有pXD8.7的酵母在起始細胞濃度OD600=80,以木寡糖為唯一碳源的情況下木二糖的消耗情況。圖9H顯示了微好氧條件下帶有pXD8.4、pXD8.6或pXD8.7的酵母在起始細胞濃度OD600=80,以木寡糖為唯一碳源的情況下乙醇的生產。所有的生長實驗都進行三次生物學重複實驗,誤差線表示實驗間的標準差。
圖10說明了酵母生長過程中碳水化合物及其衍生物的分布。酵母以木寡糖為唯一碳源,在好氧條件下起始細胞密度OD600=20或在微好氧條件下起始細胞密度OD600=80的生長。圖上顯示了轉化了表達CDT-2和GH43-2的pXD8.4質粒、表達CDT-2和GH43-7的pXD8.6質粒或者表達CDT-2、GH43-2和GH43-7的pXD8.7質粒的酵母SR8菌株。所有的生長實驗都進行三次生物學重複實驗,誤差線表示實驗間的標準差。
圖11說明了GH43-2(NCU01900)和GH43-7(NCU09652)家族中β-木糖苷酶的系統發生分布。用於構建系統發生樹的序列的NCBI GI編號在物種名稱旁邊指示。分支上顯示的是進行1000次拔靴法重複取樣計算獲得的支持率。比例尺顯示了每個胺基酸殘基有0.2個取代。右邊顯示了使用Phyre2伺服器對GH43-2和GH43-7進行的同源建模的模型。GH43-7與GH43-2相比,雖然都具有十分相似的催化結構域(綠色),但GH43-7具有一個額外的C-末端輔助結構域(品紅色),這可能導致它對木糖甙-木糖醇底物的選擇性。
圖12說明了在釀酒酵母中重建粗糙脈孢黴的兩條寡糖消耗途徑。細胞內纖維二糖的利用需要CDT-1或CDT-2與β-葡萄糖苷酶一起(Galazka et al.,2010),經過己糖激酶(HXK)的磷酸化後進入糖酵解途徑形成葡萄糖-6-磷酸(Glc-6-P)。細胞內木寡糖的利用同樣也需要CDT-2與細胞內的GH43-2和GH43-7β-葡萄糖苷酶。所得的木糖可以通過含有木糖/木寡糖還原酶(XR)、木糖醇脫氫酶(XDH)和木酮糖激酶(XK)的磷酸戊糖途徑同化。
圖13A-13B說明了酵母轉化木寡糖生成木糖甙-木糖醇(xlt2)和木二糖甙-木糖醇(xlt3)。圖13A顯示了工程改造的(木糖甙)n-木糖醇生產途徑。木寡糖通過木寡糖轉運蛋白進入細胞,木糖還原酶將木寡糖轉化為木糖甙-木糖醇寡聚物。圖13B顯示了工程改造的釀酒酵母其(木糖甙)n-木糖醇發酵曲線。
圖14說明了通過工程改造的釀酒酵母發酵生產高級的木糖甙-木糖醇寡聚物。
圖15說明了芽孢桿菌(BsGH43-7)和大腸桿菌(EcGH43-7)兩種細菌GH43-7在木二糖底物(X2)或木糖甙-木糖醇底物(xlt2)的酶活(μM/min)。
圖16說明了木糖、XOS(低聚木糖)、木糖醇和(木糖甙)n-木糖醇的結構。R1和R2代表一個羥基基團或β-1,4-連接的木糖單體。
圖17說明了木二糖與假絲酵母木糖還原酶(CtXR)的計算機對接模型。木二糖是黃色,NADH輔因子是品紅色,蛋白的二級結構是深綠色,活性位點的殘基是亮綠色並顯示側鏈。部分CtXR表面顯示為描繪活性位點口袋的形狀。黑色的虛線顯示的是CtXR和木二糖非還原末端殘之間預測的氫鍵。
圖18A顯示了來源於植物細胞壁的兩個寡糖組分。來自纖維素的纖維糊精是葡萄糖的主要來源。來自半纖維素的木寡糖是木糖的主要來源。6-甲氧基(藍色)是區分葡萄糖衍生物和木糖的基團。R1、R2=H、纖維二糖或木二糖;R1=高度聚合的纖維糊精中β-1,4-連接的葡萄糖單體;R2=高度聚合的木寡糖中β-1,4-連接的木糖單體。圖18B顯示了在不同碳源生長的粗糙脈孢黴中表達的轉運蛋白的轉錄水平。轉錄水平用發表在(Coradetti et al.,2012;Sun et al.,2012)上的FPKM表示,即每1百萬個reads中map到外顯子上的每1K個鹼基上的片段數來表示。*CBT-1轉運纖維二糖,它是溶解性多糖單加氧酶(LPMOs或CaZy家族AA9和AA10)的反應產物(Xiong et al.,2014)。
圖19說明了不同碳源培養基中粗糙脈孢黴的生長情況。野生型(WT)粗糙脈孢黴,或敲除了轉運蛋白cdt-1(Δcdt-1)或cdt-2(Δcdt-2)的粗糙脈孢黴在含有奇崗(Miscanthus giganteus)植物細胞壁,或純化的植物細胞壁的培養基上生長。Avicel是一種源自植物細胞壁的纖維素。黑框表示Δcdt-2菌株在木聚糖培養基上生長遲緩的表型。
圖20A-20B說明了所預測的β-木糖苷酶GH43-2的木二糖酶活性。圖20A顯示了GH43-2對聚合度至少為2-8(X2-X8)的木寡糖的水解。為了更清楚地對比說明,將30min後的色譜圖進行了偏移。圖20B顯示了通過測定木二糖到木糖的水解程度優化GH43-2的最適pH值。圖上顯示木糖的HPAEC色譜峰面積變化。
圖21說明了預測的絲狀真菌胞內β-木糖苷酶GH43-2的系統發生分布。通過與NCBI蛋白資料庫的Blast查詢(Altschul et al.,1997),確認GH43-2(NCU01900)的同源蛋白。選擇來自多樣化分類的、具有代表性的序列用MUSCLE(Edgar 2004)算法進行比對。使用MEGA v6.05(Tamura et al.,2013)軟體,根據Jones-Taylor-Thornton比對模型構建了最大可能性進化樹。木聚糖誘導的胞外GH43-3(NCU05965)為外類群。用於構建系統發生樹的序列的NCBI GI編號在物種名稱旁邊指示。分支上顯示的是進行1000次拔靴法重複取樣計算獲得的支持率。比例尺顯示了每個胺基酸殘基有0.2個取代。
圖22說明了表達CDT-2和GH43-7(質粒pXD8.4)的SR8U菌株培養基上清液的碳水化合物情況,這些化合物通過HPAEC分離,其縮寫如下:X1,木糖;X2,木二糖;X3,木三糖;X4,木四糖;xlt,木糖醇;xlt2,木糖甙-木糖醇;xlt3,木二糖甙-木糖醇。
圖23說明了GH43-7的系統進化。脈孢黴GH43-2作為外類群。分支上顯示的是進行1000次拔靴法重複取樣計算獲得的支持率。比例尺顯示了每個胺基酸殘基有0.2個取代。用於構建系統發生樹的序列的NCBI GI編號在物種名稱旁邊指示。
圖24A-24B說明了通過一系列微生物生產的木糖甙-木糖醇和木二糖甙-木糖醇。圖24A顯示色譜圖上粗糙脈孢黴、裡氏木黴、構巢麴黴和芽孢桿菌胞內代謝物中木寡糖衍生的碳水化合物水平。化合物的縮寫如下:X1,木糖;X2,木二糖;X3,木三糖;X4,木四糖;xlt,木糖醇;xlt2,木糖甙-木糖醇;xlt3,木二糖甙-木糖醇。圖24B顯示了在本文所描述的實驗中,在木寡糖培養上能生產木糖甙-木糖醇的微生物系統進化樹。年代數據來自(Wellman et al.,Osterloff,and Mohiuddin 2003;Galagan et al.,2005;Hedges,Dudley,and Kumar 2006)。
圖25說明了用液體色譜-質譜/質譜(LC-MS/MS)檢測生長在木寡糖培養基上的微生物的培養基上清液中木糖甙-木糖醇含量的色譜圖。圖上所示的是,對生長在木寡糖培養基上的脈孢黴、裡氏木黴、構巢麴黴和芽孢桿菌胞內代謝物用液相色譜分離後,用MS/MS對木糖甙-木糖醇的轉變(紅色,m/z 283.1035→151.0612轉變)和木二糖甙-木糖醇的轉變(綠色,m/z 415.1457→151.0612轉變)進行分析的結果。
圖26說明了酵母生長在木寡糖培養基上碳水化合物及其衍生物分布。酵母在好氧條件下細胞密度OD600=20,以木寡糖為唯一碳源(g/L)。酵母SR8菌株分別轉化了表達CDT-2和GH43-2的質粒(pXD8.4)、表達CDT-2和GH43-7的質粒(pXD8.6)或者表達CDT-2、GH43-2和GH43-7的質粒(pXD8.7)。所有的生長實驗都進行三次生物學重複實驗,誤差線表示實驗間的標準差。
圖27A-27B說明了木寡糖與木糖或葡萄糖的共厭氧發酵。圖27A顯示了在分批補料反應器中進行的木寡糖與木糖的厭氧發酵。表達CDT-2、GH43-2和GH43-7(質粒pXD8.7)的SR8U菌株起始OD600為20。實線代表培養基中化合物的濃度。藍色虛線顯示了隨時間推移添加到培養物中的木糖的總量。誤差線代表生物學重複實驗的標準差。圖27B顯示了在分批補料反應器中進行的木寡糖與葡萄糖的厭氧發酵。在發酵液中未能檢測到葡萄糖。誤差線代表生物學重複實驗的標準差。
圖28說明了在木糖存在時,厭氧條件下木寡糖的利用。帶有完整木寡糖途徑(CDT-2,GH43-2,GH43-7,XR/XDH)的菌株厭氧條件下在含有4%木糖和3%木寡糖的oMM培養基上(Lin et al.,2014)生長。木糖耗盡後木二糖(X2)和木三糖(X3)的消耗停止,在48小時補充木糖後又繼續消耗。
圖29A-29B說明了厭氧控制條件下,表達完整木寡糖途徑的釀酒酵母發酵情況。使用的是帶有表達CDT-2、GH43-2和GH43-7質粒pXD8.7的菌株SR8,起始OD600為20。實線代表培養基中化合物的濃度。藍色虛線顯示了隨時間推移添加到培養物中的木糖的總量。圖29A顯示了反應器中,菌株在含有4%木寡糖的oMM培養基中,不補加木糖的發酵曲線。圖29B顯示了反應器中,菌株在含有4%木寡糖的oMM培養基中,持續補加木糖的發酵曲線。
圖30說明了XI和XR/XDH途徑發酵性能的比較。圖上顯示了使用菌株SR8(XR/XDH途徑)和SXA-R2P-E(XI途徑),在不同細胞起始接種濃度條件下木糖的發酵情況。所用的發酵培養基為oMM。縱坐標,g/L;橫坐標,時間(小時)。
圖31說明了使用對數生長期的培養物為種子,菌株SR8(XR/XDH)和SXA-R2P-E(XI)木糖發酵性能。菌株和起始OD600都標記在每張圖上方。所用的發酵培養基為oMM。縱坐標,g/L;橫坐標,時間(小時)。
圖32說明了使用oMM或YSC培養基,菌株SR8(XR/XDH)和SXA-R2P-E(XI)木糖發酵性能。培養基、菌株和起始OD600都標記在每張圖上方。縱坐標,g/L;橫坐標,時間(小時)。
圖33A-33B木寡糖和蔗糖共發酵情況。圖33A是蔗糖的發酵。縱坐標,g/L;橫坐標,時間(小時)。圖33B是使用帶有表達CDT-2、GH43-2和GH43-7(質粒pXD8.7)的SR8U菌株進行木寡糖和蔗糖的分批共發酵。縱坐標,g/L;橫坐標,時間(小時)。以10g/L提供包含木二糖(4.2g/L)和木三糖(2.3g/L)的木寡糖。在該實驗時間內未能發酵的,除半纖維素改性劑如乙酸酯之外,木寡糖樣品還包括木四糖和木五糖。
發明詳述
以下提供的描述能夠讓本領域普通技術人員製作和使用各種實施方案。所描述的具體設備、技術和應用僅作為示例提供。對本文描述的示例的各種修改對於本領域普通技術人員將是顯而易見的,並且在不脫離各種實施例的精神和範圍的情況下,本文定義的一般原理可以應用於其他示例和應用。因此,各種實施例並不旨在限於本文所描述和示出的示例,而是符合與權利要求一致的範圍。
本公開總體來說涉及木糖甙-木糖醇寡聚物(xylosyl-xylitol oligomer)的生產,更具體地涉及在宿主細胞中利用生物法生產木糖甙-木糖醇寡聚物。
本公開是基於,或者至少部分基於申請人發現含有木寡糖轉運蛋白和木糖還原酶的重組釀酒酵母能夠生產和積累木糖甙-木糖醇寡聚物。申請人的發現是特別令人驚訝的。因為最初認為,該重組菌株可以通過代謝低聚木糖為相應的單體,如木糖和木糖醇,從而利用木寡糖為能源。相反,申請人發現在這些酵母細胞內的木糖還原酶可將木寡糖轉化為木糖甙-木糖醇寡聚物,而不會進一步將這些化合物代謝為相應的單體。由於木糖甙-木糖醇寡聚物具有許多潛在的有益用途,比如作為甜味劑,申請人已經證明建立了利用活細胞生物法生產木糖甙-木糖醇寡聚物的生物平臺。
因此,申請人在此提供在宿主細胞中生產木糖甙-木糖醇寡聚物的方法。同時還提供適合生產木糖甙-木糖醇寡聚物的宿主細胞。將本公開的宿主細胞培養在含有木寡糖或木寡糖來源的生長培養基上,可以生產木糖甙-木糖醇寡聚物。
本公開的多肽
本公開涉及使用宿主細胞生產木糖甙-木糖醇寡聚物。本公開的宿主細胞具有生產和/或積累木糖甙-木糖醇寡聚物的特徵。在一些實施方案中,本公開的宿主細胞含有促進木糖甙-木糖醇寡聚物產生的多肽。在一些實施方案中,本公開的宿主細胞具有降低的蛋白質活性,否則其將起作用阻礙木糖甙-木糖醇寡聚物生產和/或積累。
如本文所用,「多肽」是包括多個連續聚合的胺基酸殘基(例如,至少約15個連續的聚合胺基酸殘基)的胺基酸序列。如本文所用,「多肽」是指胺基酸序列,寡肽,肽,蛋白質或其部分,術語「多肽」和「蛋白質」可互換使用。
木寡糖轉運蛋白多肽
本公開的宿主細胞含有一種木寡糖轉運蛋白多肽。木寡糖轉運蛋白多肽通常是指能夠將木寡糖轉運穿過細胞膜的任何一種糖轉運蛋白。如本文所用,「木寡糖」,是指各種長度的木糖聚合物,例如,包括木二糖(木糖二聚體)、木三糖(木糖三聚體)、木四糖(木糖四聚體)、木五糖(木糖五聚體)、木六糖(木糖六聚體)等。在一些實施方案中,本公開的木寡糖轉運蛋白多肽,可以具有一種或多種的木二糖轉運活性、木三糖轉運活性、木四糖轉運活性、木五糖轉運活性、木六糖轉運活性等。「木寡糖」和「低聚木糖」在本文中可互換使用。
各種木寡糖轉運蛋白在本領域是已知,並且可以用於本公開的方法中。此外,還可以用本領域熟知的任何合適的方法,例如本文公開的那些,篩選假定的木寡糖轉運蛋白多肽的活性。
例如,適宜的木寡糖轉運蛋白可以包括主要協同轉運蛋白超家族的糖轉運蛋白家族成員,例如NCU08114。主要協同轉運蛋白超家族(MFS,轉運蛋白分類#2.A.1)的轉運蛋白成員,大多包含12個跨膜的α-螺旋、在胞內的N-末端和C-末端(S.S.Pao,I.T.Paulsen,M.H.Saier,Jr.,Microbiol Mol Biol Rev 62,1.Mar.1998)。儘管MFS轉運蛋白的一級結構差異很大,但都認為它們與大腸桿菌乳糖通透酶(LacY)(J.Abramson et al.,Science 301,610,Aug.2003)和Pi/3-磷酸甘油轉運蛋白(GlpT)(Y.Huang,M.J.Lemieux,J.Song,M.Auer,D.N.Wang,Science 301,616,Aug.2003)具有共同的三級結構。在這些實施例中,6個N-和C-末端螺旋形成通過螺旋6和7之間的長胞質環連接的兩個不同的結構域。這種對稱結構與被認為產生MFS的複製事件相對應。底物與N-末端結構域的第1、2、4和5螺旋以及C-末端結構域的第7、8、10和11螺旋形成的親水空腔結合。該空腔通過第3、6、9和12螺旋穩定。在某些實施方案中,本公開的木寡糖轉運蛋白可以包含12個跨膜的α-螺旋,1個位於第6和第7α-螺旋的環,並且具有位於胞內的N-和C-末端。
具有木寡糖轉運活性的MFS糖轉運蛋白被一種或多種、兩種或多種、三種或多種、四種或多種、五種或多種或六種下列的PROSITE模體所鑑定:R-x-L-Y-T-G-Y-D-G(SEQ ID NO:7);G-F-G-N-S-x(2)-Q(SEQ ID NO:8);L-L-x(1,30)-H-P-Q-H-R(SEQ ID NO:9);E-[FY]-x-E-I-[RK]-[DE]-T(SEQ ID NO:10);W-S-G-L(SEQ ID NO:11);和G-P-T-L-E-E(SEQ ID NO:12)。因此,在某些實施方案中,本公開的木寡糖轉運蛋白可以包括以下模體:R-x-L-Y-T-G-Y-D-G(SEQ ID NO:7),G-F-G-N-S-x(2)-Q(SEQ ID NO:8),L-L-x(1,30)-H-P-Q-H-R(SEQ ID NO:9),E-[FY]-x-E-I-[RK]-[DE]-T(SEQ ID NO:10),W-S-G-L(SEQ ID NO:11),和/或G-P-T-L-E-E(SEQ ID NO:12)。
在某些實施方案中,連接具有木寡糖轉運活性的MFS糖轉運蛋白的跨膜螺旋1和跨膜螺旋2的環可以包含R-x-L-Y-T-G-Y-D-G(SEQ ID NO:7)模體。在其它的實施方案中,具有木寡糖轉運活性的MFS糖轉運蛋白的跨膜螺旋4可以包含G-F-G-N-S-x(2)-Q(SEQ ID NO:8)模體。在進一步的實施方案中,連接具有木寡糖轉運活性的MFS糖轉運蛋白的跨膜螺旋4和跨膜螺旋5的環可以包含L-L-x(1,30)-H-P-Q-H-R(SEQ ID NO:9)模體。在一些實施方案中,具有木寡糖轉運活性的MFS糖轉運蛋白的跨膜螺旋6和跨膜螺旋7之間的序列可以包含E-[FY]-x-E-I-[RK]-[DE]-T(SEQ ID NO:10)模體。在其它的實施方案中,具有木寡糖轉運活性的MFS糖轉運蛋白的跨膜螺旋10可以包含W-S-G-L(SEQ ID NO:11)模體。在進一步的實施方案中,具有木寡糖轉運活性的MFS糖轉運蛋白的胞內區域可以包含G-P-T-L-E-E(SEQ ID NO:12)模體。
因此,在某些實施方案中,本公開的木寡糖轉運蛋白可以是具有木寡糖轉運活性的MFS糖轉運蛋白。MFS糖轉運蛋白含有12個跨膜的α-螺旋(如α-螺旋1、α-螺旋2、α-螺旋3、α-螺旋4、α-螺旋5、α-螺旋6、α-螺旋7、α-螺旋8、α-螺旋9、α-螺旋10、α-螺旋11、α-螺旋12),並且至少含有一種、二種、三種、四種、五種或六種下列的模體:R-x-L-Y-T-G-Y-D-G(SEQ ID NO:7),G-F-G-N-S-x(2)-Q(SEQ ID NO:8),L-L-x(1,30)-H-P-Q-H-R(SEQ ID NO:9),E-[FY]-x-E-I-[RK]-[DE]-T(SEQ ID NO:10),W-S-G-L(SEQ ID NO:11)和G-P-T-L-E-E(SEQ ID NO:12)。此外,至少一種、二種、三種、四種、五種或六種的模體序列可以與其它任何數目的模體組合。例如,在某些實施方案中,本公開的重組的木寡糖轉運蛋白可以含有α-螺旋1、α-螺旋2、α-螺旋3、α-螺旋4、α-螺旋5、α-螺旋6、α-螺旋7、α-螺旋8、α-螺旋9、α-螺旋10、α-螺旋11、α-螺旋12,可以含有一種或多種下列的模體:R-x-L-Y-T-G-Y-D-G(SEQ ID NO:7),G-F-G-N-S-x(2)-Q(SEQ ID NO:8),L-L-x(1,30)-H-P-Q-H-R(SEQ ID NO:9),E-[FY]-x-E-I-[RK]-[DE]-T(SEQ ID NO:10),W-S-G-L(SEQ ID NO:11)和G-P-T-L-E-E(SEQ ID NO:12)。
示例性的木寡糖轉運蛋白可以包括,如:GI336463171,GI85111305,GI336265400,GI317144741,GI115492463,GI367019682,GI169613751,GI116180882,GI396476342,GI238485660,GI330924560,GI83768202,GI189198948,GI389624607,GI340924204,GI378727300,GI310790351,GI310800345,GI156057085,GI171687197,GI380474010,GI169851388,GI429858279,GI472245111,GI317451470,GI477537114,GI159123739,GI347840412,GI70983456,GI380480795,GI451851885,GI345565206,GI451995308,GI409045374,GI389739875,GI255954533,GI393212245,GI392561917,GI389747805,GI449542817,GI317431879,GI392589230,GI393212288,GI392594130,GI402080963,GI392589229,GI477517948,GI477532537,GI471566562,GI392570497,GI336375423,GI342887383,GI302675837,GI403412898,GI346979623,GI393243817,GI50980922,GI429856489,GI302885243,GI50980920,GI402220822,GI119484188,GI336384853,GI50980814,GI395327133,GI407921652,GI403417250,GI395333241,GI50980916,GI157674373,GI336372105,GI389743154,GI390598972,GI170099628,GI46126507,GI50980918,GI409076933,GI475675010,GI429850133,GI426195279,GI408391526,GI380481283,GI50980914,GI449544581,GI346970758,GI451847000,GI361124441,GI409048565,GI395329450,GI452002698,GI477527980,GI115386538,GI449542872,GI390598040,GI302403881,GI398395223,GI449295152,GI361129867,GI389628216,GI46121949,GI408391130,GI409045849,GI342872438,GI406859506,GI402079797,GI452980716,GI393212779,GI403420153,GI310795966,GI299748721,GI367039407,GI390598898,GI189192086,GI408392461,GI46139961,GI353237496,GI406867787,GI121700448,GI330920776,GI396501117,GI393212304,GI471897438,GI159130218,GI70992963,GI477517573,GI330944461,GI119473893,GI477593444,GI451856188,GI471572208,GI169600747,GI119473383,GI342877339,GI302887372,GI389643896,GI302890289,GI471879149,GI429848762,GI169784774,GI406701640,GI115397337,GI121712210,GI367023388,GI401881295,GI238508000,GI171682982,GI367040823,GI402079610,GI336372104,GI67515463,GI402219043,GI378733150,GI477532665,GI353237498,GI302881468,GI477521642,GI408398452,GI380482112,GI380491182,GI393241491,GI46114604,GI83768524,GI340946132,GI392594043,GI46139085,GI391864453,GI398388786,GI408398213,GI238490288,GI353234628,GI475673276,GI46126477,GI408391512,GI477523847,GI342889863,GI302679092,GI429848658,GI475666583,GI477531560,GI449540330,GI358386965,GI342876695,GI255954603,GI302880307,GI342879157,GI477511570,GI402221884,GI477509075,GI452003196,GI310797035,GI393244761,GI477517292,GI170098821,GI392594044,GI154297060,GI70985968,GI242772225,GI426199525,GI409078516,GI429856851,GI402224495,GI440471626,GI477528319,GI391865969,GI336370919,GI310794698,GI302410075,GI212529706,GI409048830,GI408398456,GI302684805,GI393213085,GI346980084,GI346974165,GI358398653,GI392568136,GI302416575,GI367039713,GI242820800,GI336383675,GI402224782,GI320589783,GI302900235,GI317431855,GI353237497,GI395332594,GI408393532,GI443921814,GI189209525,GI46126625,GI212541650,GI342873777,GI477520190,GI342882753,GI395329777,GI302886316,GI46115532,GI475674542,GI353234629,GI169615919,GI477513409,GI408395147,GI449549369,GI475673984,GI409050432,GI336373956,GI255941274,GI342873441,GI402222263,GI443917241,GI302418580,GI393241388,GI242787981,GI353242496,GI320584092,GI409079438,GI169865238,GI426192620,GI389749836,GI475675183,GI86196491,GI392586908,GI46139335,GI50426457,GI440472215,GI449302102,GI212534032,GI440639149,GI393233992,GI380477434,GI392594946,GI452987659,GI402222514,GI146422137,GI238494754,GI302917301,GI336262574,GI475675239,GI429853891,GI169777579,GI347829750,GI429855681,GI407919583,GI302888323,GI477511581,GI398411145,GI344233577,GI402221284,GI429859607,GI389646653,GI302887434,GI440482625,GI190348766,GI146412796,GI353239284,GI389647635,GI86196013,GI67902250,GI169859598,GI380489737,GI429849376,GI477532141,GI134119066,GI408392325,GI380492851,GI380485843,GI302881155,GI336465735,GI350287441,GI429858924,GI115491233,GI164424491,GI471564797,GI378725745,GI346978042,GI345566254,GI429856885,GI302415056,GI402219282,GI145248423,GI350639100,GI452002162,GI342882290,GI344304410,GI358370507,GI317034943,GI169594826,GI302901784,GI350632927,GI452001921,GI67524313,GI407916978,GI477533791,GI294659451,GI477523640,GI429847594,GI389624925,GI350630030,GI46103327,GI425767943,GI429863729,GI405123292,GI358374365,GI429852368,GI459366747,GI340519452,GI350639301,GI407923780,GI317451460,GI380488960,GI260951447,GI477535671,GI358393072,GI389637768,GI58260536,GI134117103,GI358385446,GI255730163,GI145235529,GI402220490,GI342890350,GI440470256,GI477511506,GI308198145,GI310791878,GI126273966,GI391873356,GI46114596,GI171691520,GI380486599,GI260951445,GI402076217,GI429862052,GI310795192,GI146421205,GI169785253,GI190346119,GI302883799,GI475674623,GI477533270,GI302882471,GI402080455,GI317031224,GI406861400,GI322697407,GI85094247,GI336467806,GI406607550,GI238506229,GI126132458,GI367033975,GI126273939,GI302884874,GI396464906,GI475674549,GI322711180,GI134077570,GI477512227,GI477515015,GI429851103,GI336471923,GI358383783,GI342878508,GI342876702,GI119494457,GI321265766,GI380095555,GI477511576,GI396475175,GI408396504,GI302898747,GI475670215,GI402076475,GI150865436,GI344229190,GI342883283,GI58262550,GI346976696,GI255940738,GI475675360,GI477513860,GI119473356,GI477523296,GI302883821,GI336270802,GI396493052,GI310800862,GI317451430,GI477516994,GI380493642,GI85085012,GI367039241,GI116200915,GI336266077,GI46138341,GI302913423,GI471562806,GI477526206,GI358376032,GI212538607,GI403418185,GI119473409,GI46125945,GI367026193,GI406701892,GI402216469,GI342873809,GI475672478,GI134081460,GI169774135,GI475677330,GI121700434,GI452979822,GI347828193,GI406859968,GI340939620,GI342889050,GI477509642,GI255931303,GI451854957,GI238497377,GI452001121,GI477514839,GI126138322,GI121700751,GI83771606,GI171677314,GI406607553,GI475674291,GI402219269,GI70996500,GI408388106,GI477527586,GI159130224,GI342883062,GI70992951,GI115391487,GI46102882,GI46114928,GI408389965,GI342875112,GI459367863,GI385301207,GI302415575,GI119494209,GI119482834,GI344229911,GI346977093,GI429860850,GI406607552,GI342876303,GI358394391,GI242792392,GI342872176,GI242799333,GI330907139,GI302886675,GI429857088,GI346321540,GI449299447,它們的同源蛋白,和直系同源蛋白。
在一些實施方案中,木寡糖轉運蛋白多肽所包含的胺基酸序列與脈孢黴CDT-2的胺基酸序列(NCU08114)(SEQ ID NO:1)具有至少有10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。
本公開的木寡糖轉運蛋白多肽可以是內源存在細胞中,或者可以是重組表達於本公開的細胞中。在某些實施例中,本公開的重組木寡糖轉運蛋白多肽包括,例如,含有突變的木寡糖轉運蛋白多肽。這些突變的木寡糖轉運蛋白多肽含有一種或多種增加特異性、功能和/或木寡糖轉運活性的突變。在一些實施方案中,本公開的重組木寡糖轉運蛋白多肽可以具有一種或多種額外的轉運蛋白活性,如葡萄糖、纖維素或纖維糊精轉運活性。因此,在某些實施方案中,本公開的突變木寡糖轉運蛋白多肽優先轉運木寡糖。也就是說,本公開的突變木寡糖轉運蛋白多肽,與缺少一個或多個突變的相應的木寡糖轉運蛋白相比,對木寡糖有更高的特異性。含有一個或多個突變的重組木寡糖轉運蛋白可通過突變編碼本公開的木寡糖轉運蛋白的多核苷酸來產生。在一些實施方案中,本公開的一種突變的木寡糖轉運蛋白可以含有一個或多個的突變,其包括,例如,點突變、錯義突變、取代突變、移碼突變、插入突變、重複突變、擴增突變、易位突變或倒置突變。與相應的不含一個或多個突變的木寡糖轉運蛋白相比這些突變導致木寡糖轉運蛋白對木寡糖的特異性增強和/或木寡糖轉運活性增加。
在一些實施方案中,木寡糖轉運蛋白是保持將一種或多種木寡糖分子到細胞內和/或從細胞內轉運到細胞外的能力的功能片段。木寡糖轉運蛋白多肽的功能片段,可以包括,例如具有至少10個、12個、14個、16個、18個或20個連續的胺基酸的木寡糖轉運蛋白多肽。
木糖還原酶多肽
本公開的宿主細胞含有一種木糖還原酶多肽。木糖還原酶多肽通常理解為催化以下反應的酶:木糖+NAD(P)H+H+=木糖醇+NAD(P)+(E.C.1.1.1.21)。然而,申請人已表明,木糖還原酶多肽可以同樣也作用於木寡糖底物上,催化下列的一般反應:木寡糖+NAD(P)H+H+=木糖甙-木糖醇寡聚物+NAD(P)+。例如,當底物是木二糖時,本公開的一種木糖還原酶多肽可以催化下列反應:木二糖+NAD(P)H+H+=木糖甙-木糖醇+NAD(P)+。可以作用於木寡糖底物,產生木糖甙-木糖醇寡聚物的木糖還原酶多肽,具有木寡糖還原酶活性。同樣地,本公開方法所使用的木糖還原酶多肽具有木寡糖還原酶活性。
本公開的木糖還原酶多肽,所具有的木糖還原酶活性和木寡糖還原酶活性,並不一定是相互排斥的。例如本公開的木糖還原酶多肽可以同時具有木糖還原酶活性和木寡糖還原酶活性。
各種木糖還原酶多肽是本領域已知的,並且可以用於本公開的方法中。此外,還可以用本領域熟知的任何合適的方法,例如,在此公開的那些方法,篩選具有木糖還原酶活性和/或木寡糖還原酶活性的假定的木寡糖轉運蛋白多肽。
適宜的木糖還原酶可以從任何能夠代謝木糖和/或木寡糖的微生物中獲得。這些微生物包括,例如,畢赤酵母、假絲酵母、麴黴和粗糙脈孢黴。這些適宜的木糖還原酶可以包括,例如,來自樹幹畢赤酵母的木糖還原酶XYL1(GenBank:ADQ89193.1)、來自粗糙脈孢黴的木糖還原酶XYR-1(NCU08384)。其它的木糖還原酶可以包括,例如,AAF86345.1、AAO91803.1、AEY80024.1、AAC25601.1和AAW34373.1。與上述登錄號相關的每個序列通過引用併入本文。其它的木糖還原酶為本領域的技術人員公知的,並且可以用於本公開的宿主細胞。
在一些實施方案中,木糖還原酶多肽所包含的胺基酸序列與樹幹酵母XYL1的胺基酸序列(GenBank:ADQ89193.1)(SEQ ID NO:2)具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。在一些實施方案中,木糖還原酶多肽所包含的胺基酸序列與粗糙脈孢黴XYR-1的胺基酸序列(NCU08384)(SEQ ID NO:3)具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。
本公開的木糖還原酶多肽可以是內源存在細胞中,或者可以是重組表達於本公開的細胞中。在某些實施例中,本公開的重組木糖還原酶多肽包括,例如,含有突變的木糖還原酶多肽。這些突變的木糖還原酶多肽含有一個或多個增加特異性、功能和/或木糖還原酶活性的突變。例如,在一些實施方案中,本公開的突變或內源性的木糖還原酶多肽優先作用於低聚木糖底物。也就是說,本公開的突變木糖還原酶多肽,與缺少一個或多個突變的相應木糖還原酶多肽相比,對木寡糖有更高的特異性。重組的木糖還原酶多肽含有一個或多個突變,可以通過突變編碼本公開的木糖還原酶的多核苷酸來產生。在一些實施方案中,本公開的一種突變的木糖還原酶多肽可以含有一個或多個的突變,這些突變包括,例如,點突變、錯義突變、取代突變、移碼突變、插入突變、重複突變、擴增突變、易位突變或倒置突變。。與相應的不含一個或多個突變的木糖還原酶多肽相比這些突變導致一種木糖還原酶多肽對木寡糖(而不是木糖)的特異性增強。
在一些實施方案中,木糖還原酶多肽是維持催化活性(例如,轉化木寡糖底物到木糖甙-木糖醇寡聚物的能力)的功能片段。木糖還原酶多肽的功能片段,可以包括,例如具有至少10個、12個、14個、16個、18個或20個連續的胺基酸的木糖還原酶多肽。
β-木糖苷酶多肽
在一些方面,本公開的宿主細胞與相應的野生型細胞相比,一種或多種β-木糖苷酶多肽的活性降低。β-木糖苷酶多肽通常被理解為β-1,4-D-木聚糖木糖苷水解酶(E.C.3.2.1.37),它可以催化水解木寡糖中D-木糖殘基的非還原末端,釋放出D-木糖。然而,申請人還已顯示β-木糖苷酶可以具有作用於木糖甙-木糖醇寡聚物底物的活性。可以催化水解木糖甙-木糖醇寡聚物的β-木糖苷酶多肽具有木糖甙-木糖醇水解酶活性。因此,本公開方法使用的β-木糖苷酶多肽具有木糖甙-木糖醇水解酶活性。
本公開的β-木糖苷酶多肽,所具有的β-木糖苷酶活性和木糖甙-木糖醇水解酶活性,並不一定是相互排斥的。例如本公開的β-木糖苷酶多肽可以同時具有β-木糖苷酶活性和木糖甙-木糖醇水解酶活性。
各種β-木糖苷酶多肽是本領域已知的。用本公開的方法可以把這些β-木糖苷酶多肽作為降低活性的靶標。本公開所用的具有活性降低的β-木糖苷酶,可以包括,例如,糖苷水解酶GH3家族的成員、糖苷水解酶GH39家族的成員、糖苷水解酶GH43家族的成員、糖苷水解酶GH52家族的成員、糖苷水解酶GH54家族的成員。
可以通過本領域已知的任何合適的方法(包括例如本文公開的那些)篩選蛋白質,例如GH3、GH39GH43、GH52或GH54糖苷水解酶的木糖甙-木糖醇水解酶活性。在一些實施方案中,具有木糖甙-木糖醇水解酶活性的β-木糖苷酶多肽作為降低活性的靶標。
在一些實施方案中,降低活性的β-木糖苷酶所包含的胺基酸序列與粗糙脈孢黴GH43-7的胺基酸序列(NCU09652)(SEQ ID NO:4)具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。
在一些實施方案中,降低活性的β-木糖苷酶所包含的胺基酸序列與枯草芽孢桿菌β-木糖苷酶的胺基酸序列(AAB41091.1)(SEQ ID NO:5)具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。
在一些實施方案中,降低活性的β-木糖苷酶所包含的胺基酸序列與大腸桿菌β-木糖苷酶的胺基酸序列(WP_000406872.1)(SEQ ID NO:6)具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。
木糖醇脫氫酶多肽
在一些方面,本公開的宿主細胞與野生細胞相比,一種或多種木糖醇脫氫酶(XDH)多肽的活性降低。木糖醇脫氫酶通常是指催化以下反應的酶(E.C.1.1.1.9):木糖醇+NAD+=D-木酮糖+NADH+H+。木糖醇脫氫酶其它名稱包括,例如,「D-木酮糖還原酶」、「NAD-依賴的木糖醇脫氫酶」、「赤藻糖醇脫氫酶」、「2,3-順式多元醇(DPN)脫氫酶(C3-5)」、「戊五醇-DPN脫氫酶」、「木糖醇-2-脫氫酶」和「木糖醇:NAD+2-氧化還原酶(D-木酮糖形成)」。
各種木糖醇脫氫酶(XDH)多肽是本領域已知,並且用本公開的方法可以把這些木糖醇脫氫酶多肽作為降低活性的靶標。本公開所用的具有活性降低的木糖醇脫氫酶,可以包括,例如,來自畢赤酵母、假絲酵母、麴黴和粗糙脈孢黴的木糖醇脫氫酶。在一些實施方案中,木糖醇脫氫酶是來自樹幹畢赤酵母的木糖醇脫氫酶XYL2(登錄號P22144)。在一些實施方案中,木糖醇脫氫酶包括,例如,NCBI登錄號為ACI01079.1、XP_456938.2和ABA39795.1的多肽。與上述登錄號相關的每個序列通過引用併入本文。其它的木糖醇脫氫酶是本領域的技術人員眾所周知的。
在一些實施方案中,降低活性的木糖醇脫氫酶所包含的胺基酸序列與木糖醇脫氫酶P22144的胺基酸序列(WP_000406872.1)(SEQ ID NO:6)具有至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或100%的一致性。
編碼多肽的多核苷酸
本公開進一步涉及到編碼本公開多肽的多核苷酸。編碼多肽的多核苷酸在本文中也稱為「基因」。例如,提供了編碼如本文所述的任何已知或推定的木寡糖轉運蛋白、木糖還原酶、β-木糖苷酶或木糖醇脫氫酶的多核苷酸。用於判斷多肽與編碼多肽的多核苷酸之間的關係的方法是本領域技術人員眾所周知的。類似地,確定由多核苷酸序列編碼的多肽序列的方法是本領域技術人員眾所周知的。。
如本文所用,術語「多核苷酸」、「核酸序列」、「核酸」及其變體應屬於多脫氧核糖核苷酸(含有2-脫氧-D-核糖)、多核糖核苷酸(含有D-核糖)、N-糖苷的嘌呤或嘧啶鹼基的任何其它類型的多核苷酸,以及含有非核苷酸主鏈的其它聚合物。只要是所述聚合物含有允許鹼基配對和鹼基堆積的構型,如在DNA和RNA所發現的。因此,這些術語包括了已知類型的核酸序列修飾,例如,用類似物取代一個或多個天然存在的核苷酸,以及核苷酸間的修飾。如本文所用,核苷酸和多核苷酸的符號是由IUPAC-IUB生物化學命名委員會推薦的那些符號。
本公開的多核苷酸序列可以用本領域已知的各種方法製備,包括例如直接化學合成或克隆。對於直接化學合成,核酸聚合物的形成通常涉及將3'-封閉的和5'-封閉的核苷酸單體依次加入到延伸的核苷酸鏈的末端5'-羥基,其中每次加入通過親核作用在所添加的單體的3'-位上的延伸鏈的末端5'-羥基,其通常是磷衍生物,例如磷酸三酯,亞磷醯胺等。這種方法是本領域普通技術人員已知的,並且描述在相關的文本和文獻中(如Matteucci et al.,(1980)Tetrahedron Lett 21:719-722;U.S.Pat.Nos.4,500,707;5,436,327;和5,700,637)。此外,可通過使用適當的內切酶剪切DNA,用凝膠電泳分離,之後用本領域普通技術人員已知的方法,從凝膠裡回收所需的多核苷酸序列,從天然來源分離所需的序列,例如利用聚合酶鏈反應(PCR,如U.S.Pat.No.4,683,195)。
序列相似性的鑑定方法
本領域的技術人員已知用於鑑定多肽和/或多核苷酸序列相似性(如同源物,直系同源物,旁系同源物)的各種方法,包括系統發生方法,序列相似性分析和雜交方法。
可以通過使用諸如CLUSTAL(Thompson et al.,Nucleic Acids Res.22:4673-4680(1994);Higgins et al.,Methods Enzymol 266:383-402(1996))或MEGA(Tamura et al.,Mol.Biol.&Evo.24:1596-1599(2007))程序構建基因家族的系統發生樹。來自物種的基因的初始樹一旦建立構建,可以將潛在的直系同源序列置於系統發生樹中,並且可以確定它們與來自目的物種的基因的關係。進化關係也可以通過鄰位-相接法(Saitou and Nei,Mol.Biol.&Evo.4:406-425(1987))來推斷。同源的系列也可以通過交互式的BLAST策略來鑑定。進化距離可以使用泊松校正方法(Zuckerkandl and Pauling,pp.97-166in Evolving Genes and Proteins,edited by V.Bryson and H.J.Vogel.Academic Press,New York(1965))來計算。
此外,進化信息可以用來預測基因的功能。通過關注基因如何在序列上變得相似(即通過進化過程)而不是序列本身相似性(Eisen,Genome Res.8:163-167(1998)),可以極大地改善基因的功能預測。存在許多具體實例,其中已經顯示基因功能與基因系統發生良好相關(Eisen,Genome Res.8:163-167(1998))。通過使用系統發生分析,本領域技術人員將認識到推斷密切相關的多肽賦予的相似功能的能力是可預測的。
當使用系統發育程序如CLUSTAL分析一組相關序列時,緊密相關的序列通常聚集在一起或在相同的進化枝(一組相似的基因)中。多組相似的基因也可以通過成對的BLAST分析來鑑定(Feng and Doolittle,J.Mol.Evol.25:351-360(1987))。分析落在同一個分枝上的多組具有相似功能的相似基因,可以得到這個分枝特有的子序列。這些子序列,被稱為保守序列,不僅可以用來定義每個分枝內的序列,還可以定義這些基因的功能。位於同一個分枝內的基因可能含有旁系同源序列或具有相同功能的直系同源序列(見Mount,Bioinformatics:Sequence and Genome Analysis Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,page 543(2001))。
為了找到與參考序列同源的序列,可以使用BLASTN程序(得分設為100,字長為12),以獲得編碼本公開的蛋白的核苷酸序列同源的核苷酸序列。可以用BLASTX程序(得分設為50,字長為3)進行BLAST蛋白質搜索,以獲得與本公開的蛋白質或多肽同源的胺基酸序列。可以用Altschul et al.,(1997)Nucleic Acids Res.25:3389所描述的Gapped BLAST(在BLAST 2.0中)獲得序列比較所需要的帶空位的比對。或者可以用PSI-Blast對距離較遠的分子進行迭代搜索(見上面的Altschul et al.,(1997))。使用BLAST、Gapped BLAST或PSI-BLAST時,可以使用各自程序(如核酸序列用的BLASTN,蛋白序列用的BLASTX)的默認參數。
用於序列比對和用於分析多肽和多核苷酸序列的相似性和一致性的方法是本領域眾所周知的。
本文所用的「序列一致性」是指所分析的序列在相同位置相同鹼基的百分比。如本文所用的「序列相似性」是指所分析的序列在相同位置具有相似的生理/生化特性(如電荷、大小、疏水性)的殘基的百分比。
用於比較的序列比對方法是本領域公知的,包括手動比對和計算機輔助的序列比對和分析。由於計算機輔助比對方法能夠大量地處理數據,後一種方法是本公開中的優選方法。如下所述,有許多可以用來進行序列比對的電腦程式,也可以由技術人員自己研發。
兩條任意序列間的一致性和/或相似性百分比的計算,可以使用數學的算法完成。例如,這些數學的算法有:Myers and Miller算法(CABIOS 4:11-17(1988))、Smith局部相似性算法(Smith et al.,Adv.Appl.Math.2:482(1981))、Needleman和Wunsch的同源比對算法(Needleman and Wunsch,J.Mol.Biol.48:443-453(1970)1970)、Pearson和Lipman的搜索相似性算法(Pearson and Lipman,Proc.Natl.Acad.Sci.85:2444-2448(1988)、Karlin和Altschul算法(Karlin and Altschul,Proc.Natl.Acad.Sci.USA 87:2264-2268(1990))、修改的Karlin和Altschul算法(Karlin and Altschul,Proc.Natl.Acad.Sci.USA 90:5873-5877(1993)。
由計算機執行的這些數學算法可以用來比較序列,確定序列的一致性和/或相似性。這些執行的程序可以包括:PC/Gene程序中的CLUSTAL(可從Intelligenetics,Mountain View,Calif.獲得)、AlignX程序,版本10.3.0(Invitrogen,Carlsbad,CA)和Wisconsin Genetics軟體包中的GAP、BESTFIT、BLAST、FASTA和TFASTA,版本 8(可從Genetics Computer Group(GCG),575Science Drive,Madison,Wis.,USA獲得)。使用這些程序進行比對時,可以使用默認的參數。CLUSTAL程序在以下的文獻中充分描述(Higgins et al.,Gene 73:237-244(1988);Higgins et al.,CABIOS 5:151-153(1989);Corpet et al.,Nucleic Acids Res.16:10881-90(1988);Huang et al.,CABIOS 8:155-65(1992);and Pearson et al.,Meth.Mol.Biol.24:307-331(1994))。BLAST程序(Altschul et al.,J.Mol.Biol.215:403-410(1990))是基於上文的Karlin和Altschul算法(Karlin and Altschul(1990))。
與參考序列同源的多核苷酸可以在嚴緊條件或高度嚴緊條件下的雜交來鑑定。在各種良好表徵的物理-化學力,如氫鍵、溶劑排除力、鹼基堆積力和相類似的力的作用下,單鏈多核苷酸發生雜交。雜交的嚴緊度反應了反涉及的核酸序列的一致性的程度。嚴緊度越高,兩條多核苷酸鏈越相似。嚴緊度受雜交和洗滌溶液和溫育(及其次數)中存在的多種因素的影響,包括溫度、鹽濃度和組成、有機和非有機添加劑、溶劑等,如在下文引用的參考文獻中詳細描述(如,Sambrook et al.,Molecular Cloning:A Laboratory Manual,2nd Ed.,Vol.1-3,Cold Spring Harbor Laboratory,Cold Spring Harbor,N.Y.("Sambrook")(1989);Berger and Kimmel,Guide to Molecular Cloning Techniques,Methods in Enzymology,vol.152Academic Press,Inc.,San Diego,Calif.("Berger and Kimmel")(1987);and Anderson and Young,"Quantitative Filter Hybridisation."In:Hames and Higgins,ed.,Nucleic Acid Hybridisation,A Practical Approach.Oxford,TRL Press,73-111(1985))。
本公開涵蓋能夠在各種嚴格條件下與所公開的多核苷酸序列及其片段雜交的多核苷酸序列(見Wahl and Berger,Methods Enzymol.152:399-407(1987);and Kimmel,Methods Enzymo.152:507-511,(1987))。可以使用公知的多核苷酸雜交方法鑑定和分離本公開的多核苷酸的全長cDNA、同源物、直系同源物和旁系同源物。
此外,本公開可以使用的基因和蛋白包括這裡所描述基因和蛋白的保守性修飾的變體。這本文所用的「保守性修飾的變體」包括對多肽序列單個的替換、缺失或添加,結果導致胺基酸被化學性質相似的胺基酸替換。提供功能相似的胺基酸的保守性替換表是本領域熟知的。此類保守性修飾的變體是本公開的多態變體、種間同源物、等位基因和各種替代,且不具有排它性。以下8組包含彼此保守取代的胺基酸:1)丙氨酸(A),甘氨酸(G);2)天冬氨酸(D),穀氨酸(E);3)天冬醯胺(N),穀氨醯胺(Q);4)精氨酸(R),賴氨酸(K);5)異亮氨酸(I),亮氨酸(L),甲硫氨酸(M),纈氨酸(V);6)苯丙氨酸(F),酪氨酸(Y),色氨酸(W);7)絲氨酸(S),蘇氨酸(T);和8)半胱氨酸(C),甲硫氨酸(M)(見Creighton,Proteins(1984)).
用於表達多核苷酸的載體
本公開的每條多核苷酸可以克隆到表達質粒。「表達載體」或「載體」是指一種混合物或組合物可以轉導、轉化或感染宿主細胞,除該細胞天然的多核苷酸和/或蛋白質以外的多核苷酸和/或蛋白質,或以非原有的方式表達。「表達載體」含有可在宿主中表達的多核苷酸序列(通常是RNA或DNA)。可選的,表達載體還包括一些有助於多核苷酸成功進入宿主的材料,如病毒、脂質體、蛋白外衣等。考慮用於本公開內容的表達載體包括可以插入多核苷酸序列的表達載體,以及任何優選的或需要的操作元件。此外,表達載體必須是可以被轉移到宿主細胞內,並在其中複製的載體。優先的表達載體是質粒,特別是那些已經已經被充分證明的限制性位點和具有轉錄多核苷酸序列的優選或必需的操作元件的質粒。這些質粒,以及其他的表達載體,是本領域熟知的。
單個多核苷酸的克隆可以通過已知的方法完成,包括可以使用限制酶性內切酶(例如BamHI,EcoRI,HhaI,XhoI,XmaI等)切割表達載體,如質粒,的特定位點。限制性內切酶產生的單鏈末端,可以與表達載體的粘性末端退火,這種末端可以是自帶的或合成的。使用適當的酶,例如DNA連接酶進行退火。如本領域的普通技術人員將理解的,表達載體和所需的多核苷酸通常用相同的限制內切酶切割,從而確保表達載體的末端和多核苷酸的末端彼此互補。此外,DNA接頭可用於輔助多核苷酸序列連接到表達載體中。
一系列單個多核苷酸也可以通過利用本領域已知的方法(例如,U.S.Pat.No.4,683,195)進行組合。例如,每個所需的多核苷酸可以在單獨的PCR中產生。此後,設計特異性引物,使得PCR產物的末端含有互補序列。當PCR產物混合、變性和重新退火時,在3'端具有匹配序列的鏈會重疊,並且可以充當彼此的引物。通過DNA聚合酶對該重疊進行延伸,產生把原始序列「剪接」在一起的分子。以這種方式,一系列單個多核苷酸可以「剪接」在一起,並隨後同時轉導到宿主細胞中。因此,多個多核苷酸中的每一個都能表達。
單個多核苷酸或「剪接的」多核苷酸接著克隆到表達載體中。本公開不限於將多核苷酸克隆到表達載體的過程。本領域普通技術人員熟悉將多核苷酸克隆到表達載體的必要步驟。一個典型的表達載體包含:在所需的多核苷酸前有一個或多個調節區,以及一個核糖體結合位點,例如長度為3-9個核苷酸並位於大腸桿菌起始密碼子上遊3-11個核苷酸的核苷酸序列。見Shine和Dalgarno(1975)Nature 254(5495):34-38和Steitz(1979)Biological Regulation and Development(Goldberger,R.F.),1:349-399(Plenum,New York)。
本文所用的術語「可操作地連接」是指這樣的構型:將控制序列置於相對於DNA序列或多核苷酸的編碼序列的適當位置,使得控制序列能夠指導多肽的表達。
調節區域包括,例如含有啟動子和操縱子的那些區域。啟動子與所需的多核苷酸可操作地連接,從而通過RNA聚合酶啟動多核苷酸的轉錄。操縱子是與啟動子相鄰的多核苷酸序列,它包含可以與阻遏蛋白結合的蛋白結構域。在不存在阻遏蛋白的情況下,轉錄通過啟動子啟動。當存在阻遏蛋白時,阻遏蛋白與蛋白結合結構域特異性地結合,從而抑制轉錄。以這種方式,使用特定的調控區域和相應的阻遏蛋白的存在或不存在來完成轉錄的控制。實例包括乳糖啟動子(當與乳糖接觸時,Lad阻遏蛋白構象發生變化,從而阻止Lad阻遏蛋白與操縱子結合)和色氨酸啟動子(當與色氨酸結合時,TrpR阻遏蛋白具有與操縱基因結合的構象;在不存在色氨酸時,TrpR阻抑蛋白不具有結合操縱基因的構象)。另一個實例是tac啟動子(見de Boer et al.,(1983)Proc Natl Acad Sci USA 80(1):21-25)。
構建本公開的宿主細胞的方法可以包括將含有本公開的重組核酸的表達載體導入或轉移到宿主細胞中。這些將表達載體轉移到宿主細胞中的方法是本領域普通技術人員熟知的。例如,用表達載體轉化細胞的一種方法包括氯化鈣處理,通過鈣沉澱物轉化入表達載體。也可以按類似的方法使用其它鹽,如磷酸鈣。此外,電穿孔(即,使用電流以增加細胞對核酸序列的滲透性)可用於轉化宿主細胞。細胞也可以通過使用原生質球轉化(Schweizer,M,Proc.Natl.Acad.Sci.,78:5086-5090(1981))。此外,顯微注射的核酸序列也具有轉染宿主細胞的能力。也可以使用脂質複合物,脂質體和樹狀聚合物。本領域普通技術人員可以使用這些或其它方法將所需的序列轉染宿主細胞。
在一些情況下,在轉化前將細胞製備為原生質體或原生質球。可以通過用酶處理具有細胞壁的細胞以降解細胞壁來製備原生質體或原生質球。真菌細胞可以用幾丁質酶處理。
載體可以是自主複製的載體,即作為染色體外存在的載體,其複製獨立於染色體的複製,例如質粒、染色體外元件、微染色體或人工染色體。載體可以包含用於確保自我複製的任何元件。或者,載體可以是導入宿主時整合到基因組中並與染色體一起複製的載體。此外,可以使用單個載體或質粒或兩個或多個載體或質粒,一起含有待導入宿主基因組的總DNA。也可以使用轉座子。
載體優選含有一個或多個選擇標記,這些標記能夠可方便地選擇轉化的宿主細胞。選擇標記是一種基因,其產物能夠提供抗生素或病毒抗性、對重金屬的抗性、營養缺陷型的原養性等。細菌細胞可以通過由諸如amp、gpt、neo和hyg基因賦予的抗生素抗性進行選擇。
用於真菌宿主細胞的選擇標記可以包括amdS(乙醯胺酶)、argB(鳥氨酸氨甲醯基轉移酶)、bar(草胺膦乙醯轉移酶)、hph(潮黴素磷酸轉移酶)、niaD(硝酸還原酶)、pyrG(乳清酸核苷-5′-磷酸脫羧酶)、sC(硫酸腺苷醯轉移酶)和trpC(鄰氨基苯甲酸合成酶),及其等同物。
載體可以含有允許載體整合到宿主基因組中的元件,允許載體在細胞中獨立於基因組的自主複製的元件。
為了整合到宿主基因組中,載體可以通過基因的序列或載體的任何其它元件進行同源或非同源重組,將載體整合到基因組中。或者,載體可含有額外的核苷酸序列,用於指導同源重組整合到宿主的基因組中。額外的核苷酸序列使得載體能夠精確定位到染色體中的位置,整合到宿主基因組中。為了增加精確定位整合的可能性,整合元件應當包含足夠數量的核酸,例如100至10,000個鹼基對、400至10,000個鹼基對或800至10,000個鹼基對,以增強與相應的靶序列同源重組的概率。整合元件可以是與宿主基因組中的靶序列同源的任何序列。此外,整合元件可以是非編碼或編碼核苷酸序列。另一方面,載體可以通過非同源重組整合到宿主的基因組中。
對於自主複製,載體可以進一步包含一個複製起點位點,使得載體能夠在所討論的宿主中自主複製。複製起點可以是在細胞中倡導自主複製的任何質粒複製子。術語「複製起點」或「質粒複製子」在本文中定義為使質粒或載體能夠在體內複製的序列。
用於調節載體中本公開的重組核酸的表達的各種啟動子是本領域熟知的,可以有組成型啟動子和誘導型啟動子。啟動子在Sambrook,et al.,Molecular Cloning:A Laboratory Manual,第3版,Cold Spring Harbor Laboratory Press,(2001)等中有描述。啟動子可以是病毒,細菌,真菌,哺乳動物或植物啟動子。另外,啟動子可以是組成型啟動子、誘導型啟動子、環境調節型啟動子或發育調節型啟動子。用於調節本公開的重組核酸的合適啟動子的實例可以是:粗糙脈孢黴ccg-1組成型啟動子,其對粗糙脈孢黴晝夜節律和營養條件有響應;粗糙脈孢黴gpd-1(甘油醛-3-磷酸脫氫酶-1)強組成型啟動子;粗糙脈孢黴vvd(光)誘導型啟動子;粗糙脈孢黴qa-2(奎尼酸)誘導型啟動子;構巢麴黴gpdA啟動子;構巢麴黴trpC組成型啟動子;粗糙脈孢黴tef-1(轉錄延長因子)高度組成型啟動子;和粗糙脈孢黴xlr-1(XlnR同源物)啟動子(經常用於麴黴菌屬)。在一些實施方案中,本公開的重組多肽的表達處於異源啟動子的控制下。
可以將不止一個拷貝的基因插入宿主中以增加基因產物的生產。可以通過將基因的至少一個額外拷貝整合到宿主基因組中,或通過包含具有核苷酸序列的可擴增選擇性標記基因來獲得基因拷貝數的增加。含有擴增拷貝選擇標記基因的細胞,可通過在適當的選擇劑存在的條件,篩選獲得基因的額外拷貝。
用於連接上述元件以構建本公開的重組表達載體的步驟是本領域技術人員熟知的(可見Sambrook et al.,1989,同上)。當僅使用單個表達載體(不添加中間體)時,載體將包含所有必需的核酸序列。
本公開的宿主細胞
本公開的宿主細胞能夠從木寡糖底物產生木糖甙-木糖醇寡聚物。「宿主細胞」和「宿主微生物」在本文中可互換使用,並且是指可以用於本公開方法中的活的生物細胞。在一些實施方案中,可以通過插入一個或多個重組核酸(例如DNA或RNA)轉化宿主細胞。這樣的重組核酸可以在一個或多個表達載體中。因此,本文所述的宿主微生物或細胞可以是原核生物(例如,真細菌界的生物)或真核細胞。如本領域的普通技術人員將理解的,原核細胞缺乏被膜包圍的細胞核,而真核細胞具有被膜包圍的細胞核。
各種原核或真核宿主細胞可以用於本公開,只要其在轉化核酸序列後保持存活即可。優選地,宿主細胞不受必要的核酸序列的轉導、隨之的蛋白表達或所得中間體的不利影響。合適的真核細胞包括例如真菌、植物、昆蟲和哺乳動物細胞。
在一些實施方案中,宿主是真菌菌株。本文所用的「真菌」包括例如子囊菌門,擔子菌門(Ascomycota),壺菌門(Basidiomycota)和接合菌門(Zygomycota)(如Hawksworth,et al.,In,Ainsworth and Bisby's Dictionary of The Fungi,第8版,1995,CAB International,University Press,劍橋,英國)以及卵菌門(Oomycota)(如Hawksworth,et al.,1995,同上,第171頁中所述)和所有有絲分裂孢子真菌(Hawksworth,et al.,1995,同上)。
在某些實施方案中,真菌細胞是酵母細胞。本文所用的「酵母」包括產子囊酵母(內孢黴目)、產擔孢子酵母(basidiosporogenous yeast)和屬於半知菌的酵母(Blastomycetes)。由於酵母的分類在將來可能改變,為了本公開的目的,酵母應按照Biology and Activities of Yeast定義(Skinner,F.A.,Passmore,S.M.和Davenport,R.R.,eds,Soc.App.Bacteriol.Symposium Series No.9,1980)。
在一些實施方案中,酵母宿主是假絲酵母屬(Candida)、漢遜酵母屬(Hansenula)、伊薩酵母屬(Issatchenkia)、克魯維酵母屬(Kluyveromyces)、畢赤酵母屬(Pichia)、酵母屬(Saccharomyces)、裂殖酵母屬(Schizosaccharomyces)或耶氏酵母屬(Yarrowia)菌株。在其他實施方案中,酵母宿主是卡氏酵母(Saccharomyces carlsbergensis)(Todka,2010)、釀酒酵母(Saccharomyces cerevisiae)(Duarte et al.,2009)、糖化酵母(Saccharomyces diastaticus)、道格拉斯酵母(Saccharomyces douglasii)、克魯弗酵母(Saccharomyces kluyveri)、諾地酵母(Saccharomyces norbensis)、摩納酵母(Saccharomyces monacensis)(GB-Analysts Reports,2008)、貝酵母(Saccharomyces bayanus)(Kristen Publicover,2010)、巴氏酵母(Saccharomyces pastorianus)(Nakao et al.,2007)、粟酒酵母(Saccharomyces pombe)(Mousdale,2008)或卵形酵母(Saccharomyces oviformis)菌株。在其他實施方案中,酵母宿主是乳酸克魯維酵母(Kluyveromyces lactis)(O.W.Merten,2001)、脆壁克魯維酵母(Kluyveromyces fragilis)(Pestal et al.,2006;Siso,1996)、馬克斯克魯維酵母(Kluyveromyces marxiamus)(K.Kourkoutas et al.,2008)、樹幹畢赤酵母(Pichia stipitis)(Almeida et al.,2008)、休哈塔假絲酵母(Candida shehatae)(Ayhan Demirbas,2003)或熱帶假絲酵母(Candida tropicalis)(Jamai et al.,2006)。在其他實施方案中,酵母宿主可以是解脂耶氏酵母(Yarrowia lipolytica)(Biryukova E.N.,2009)、卡斯酒香酵母(Brettanomyces custersii)(Spindler D.D.et al.,1992)或魯氏接合酵母(Zygosaccharomyces roux)(Chabane et al.,2006)。在一些實施方案中,酵母細胞是釀酒酵母(Saccharomyces cerevisiae)。
在其它實施方案中,真菌宿主是絲狀真菌菌株。「絲狀真菌」包括真菌門(Eumycota)和卵菌門(Oomycota)的所有絲狀形式(如Hawksworth et al.,1995,同上所定義)。絲狀真菌通常特徵在於由幾丁質、纖維素、葡聚糖、殼聚糖、甘露聚糖和其它複合多糖組成的菌絲壁。營養生長是通過菌絲伸長,碳分解代謝是專性好氧的。相比之下,酵母如釀酒酵母的營養生長是通過單細胞菌體的出芽,並且碳分解代謝可以是發酵的。
在一些實施方案中,絲狀真菌宿主可以是支頂孢屬(Acremonium)、麴黴屬(Aspergillus)、鐮孢屬(Fusarium)、腐質黴屬(Humicola)、毛黴屬(Mucor)、毀絲黴屬(Myceliophthora)、脈孢黴屬(Neurospora)、青黴屬(Penicillium)、節格孢屬(Scytalidium)、梭孢殼屬(Thielavia)、彎頸黴屬(Tolypocladium)或木黴屬(Trichoderma)的菌株。在一些實施方案中,宿主細胞是粗糙脈孢黴(Neurospora crassa)。
在一些實施方案中,絲狀真菌宿主是泡盛麴黴(Aspergillus awamori)、臭麴黴(Aspergillus foetidus)、日本麴黴(Aspergillus japonicus),構巢麴黴(Aspergillus nidulans)、黑麴黴(Aspergillus niger)或米麴黴(Aspergillus oryzae)菌株。在另一些實施方案中,絲狀真菌宿主是杆抱狀鐮孢菌(Fusarium bactridioides)、禾穀穀類鐮孢菌(Fusarium cerealis)、克魯克威爾鐮孢菌(Fusarium crookwellense)、黃色鐮孢菌(Fusarium culmorum)、正禾穀鐮孢菌(Fusarium graminearum)、禾赤鐮孢菌(Fusarium graminum)、異孢鐮孢菌(Fusarium heterosporum)、合歡鐮孢菌(Fusarium negundi)、尖鐮孢菌(Fusarium oxysporum)、多枝鐮孢菌(Fusarium reticulatum)、粉紅鐮孢菌(Fusarium roseum)、接骨木鐮孢菌(Fusarium sambucinum)、膚色鐮孢菌(Fusarium sarcochroum)、擬枝孢鐮孢菌(Fusarium sporotrichioides)、硫色鐮孢菌(Fusarium sulphureum)、簇鐮孢菌(Fusarium torulosum)、擬絲孢鐮刀菌(Fusarium trichothecioides)或鑲片鐮孢菌(Fusarium venenatum)菌株。在一些實施方案中,絲狀真菌宿主是特異腐質黴(Humicola insolens)、高溫毛殼黴(Humicola lanuginosa)、(Mucor miehei)、嗜熱毀絲黴(Myceliophthora thermophila)、產紫青黴(Penicillium purpurogenum)、嗜熱柱黴(Scytalidium thermophilum)、嗜熱側孢黴(Sporotrichum thermophile)(Topakas et al.,2003)、或太瑞斯梭孢殼黴(Thielavia terrestris)菌株。在一些實施方案中,絲狀真菌宿主是哈茨木黴(Trichoderma harzianum)、康寧木黴(Trichoderma koningii)、長梗木黴(Trichoderma longibrachiatum)、裡氏木黴(Trichoderma reesei)或綠色木黴菌株(Trichoderma viride)。
在一些實施方案中,宿主細胞是原核的,並且在某些實施方案中,原核生物是大腸桿菌(E.coli)(Dien,B.S.et al.,2003;Yomano,L.P.et al.,1998;Moniruzzaman et al.,1996)、枯草芽孢桿菌(Bacillus subtilis)(Susana Romero et al.,2007)、運動發酵單胞菌(Zymomonas mobilis)(B.S.Dien et al.,2003;Weuster Botz,1993;Alterthum and Ingram,1989)、解熱厭氧桿菌(Thermoanaerobacterium saccharolyticum)(Marietta Smith,2009)或產酸克雷伯式菌(Klebsiella oxytoca)(Dien B.S.et al.,2003;Zhou et al.,2001;Brooks and Ingram,1995)。在其他實施方案中,原核宿主細胞是互營單孢菌(Carboxydocella sp.)、穀氨酸棒桿菌(Corynebacterium glutamicum)(Masayuki Inui et al.,2004)、腸桿菌(Enterobacteriaceae)(Ingram et al.,1995)、菊歐文菌(Erwinia chrysanthemi)(Zhou和Ingram,2000;Zhou et al.,2001)、乳桿菌(Lactobacillus sp.)(McCaskey,T.A.et al.,1994)、嗜酸小球菌(Pediococcus acidilactici)(Zhou,S.et al.,2003)、莢膜紅假單胞菌(Rhodopseudomonas capsulata)(X.Y.Shi et al.,2004)、乳酸鏈球菌(Streptococcus lactis)(J.C.Tang et al.,1988)、弗尼斯弧菌(Vibrio furnissii)(L.P.Wackett,2010)、弗尼斯弧菌M1(Vibrio furnissii M1)(Park et al.,2001)、解糖熱纖維素菌(Caldicellulosiruptor saccharolyticus)(Z.Kadar et al.,2004)或野油菜黃單胞菌(Xanthomonas campestris)(S.T.Yang et al.,1987)。在其他實施方案中,宿主細胞是藍細菌(cyanobacteria)。其它細菌宿主細胞的實例包括例如分類到大腸桿菌屬(Escherichia)、腸桿菌屬(Enterobacter)、固氮菌屬(Azotobacter)、歐文氏菌屬(Erwinia)、桿菌屬(Bacillus)、假單胞菌屬(Pseudomonas)、克雷伯菌屬(Klebsiella)、變形桿菌屬(Proteus)、沙門氏菌屬(Salmonella)、沙雷氏菌屬(Serratia)、志賀氏菌屬(Shigella)、根瘤菌屬(Rhizobia)、透明顫菌屬(Vitreoscilla)、集胞藻屬(Synechococcus)、集胞藻屬(Synechocystis)和副球菌屬(Paracoccus)的細菌。
本公開的宿主細胞可以是遺傳修飾的,因為重組核酸已經被導入宿主細胞,因此自然界沒有這種經遺傳修飾的宿主細胞。本公開的適宜的宿主細胞是能夠表達編碼一種或多種不同功能的蛋白的一種或多種核酸組件的宿主細胞。
如本文所用的「重組核酸」或「異源核酸」或「重組多核苷酸」是指核酸的聚合物,其中至少下列之一是真的:(a)對於給定的宿主細胞,核酸序列是外來的(即,不是天然存在於宿主細胞內);(b)該序列可以在給定的宿主細胞中天然存在,但是它的量是非天然的(例如大於預期);或(c)核酸序列含有兩個或多個在自然界中彼此不具有相同關係的子序列。例如,關於實例(c),重組核酸序列將來自無關基因的兩條或更多條序列,重排在一起,開成具有新功能的核酸。具體地,本公開描述了將表達載體引入宿主細胞中,其中表達載體含有編碼通常不在宿主細胞中存在的蛋白的核酸序列,或雖含有編碼通常存在宿主細胞中的蛋白的核酸序列,但處於不同調控序列的控制之下。然後,與參考宿主細胞的基因組相比,編碼蛋白的核酸序列是重組的。被稱為重組的蛋白通常意味著其由宿主細胞中的重組核酸序列編碼。
本公開的「重組」多肽、蛋白或酶是由「重組核酸」或「異源核酸」或「重組多核苷酸」編碼的多肽,蛋白或酶。
在一些實施方案中,宿主細胞中編碼所需蛋白的基因對於宿主細胞來說可以是異源的,或者這些基因對於宿主細胞來說可以是內源性的,但可操作地連接到異源啟動子和/或控制區,導致其在宿主細胞中基因表達更高。在某些實施方案中,宿主細胞不會自然地產生期望的蛋白,並且含有能夠表達一種或多種產生這些分子所必需的基因的異源核酸組件。
如本文所用的關於核酸分子或多肽和特定細胞或微生物「內源的」,是指存在細胞中並且不使用重組工程技術引入細胞中的核酸序列或多肽;例如當細胞最初從自然界分離時就存在於細胞中的基因。在一些實施方案中,本公開的某些多肽內源地存在於產生木糖甙-木糖醇寡聚物方法的宿主細胞中。
「經遺傳工程改造的」或「遺傳修飾的」是指用於構建能夠表達蛋白的原核或真核宿主細胞的任何重組DNA或RNA方法,該蛋白表達可以是上升的形式、下降的形式或非內源性(例如突變的)形式。換句話說,已經用重組多核苷酸分子轉染、轉化或轉導宿主細胞,從而改變宿主細胞以使細胞改變所需蛋白的表達。用於遺傳工程改造宿主細胞的方法和載體是本領域公知的;例如各種技術在Ausubel等人編輯的Current Protocols in Molecular Biology上有闡述(Wiley&Sons,New York,1988,每季度更新)。遺傳工程技術包括例如表達載體,和定點同源重組和基因激活(例如見U.S.Pat.No.5,272,071)。
改變多肽活性的方法
與相應的對照細胞,例如相應的野生型細胞相比,本公開的宿主細胞可具有修飾的多肽活性,以促進和/或增加木糖甙-木糖醇寡聚物的生產。可以修飾多肽活性,使得本公開的一種或多種多肽具有增加的活性或降低的活性。在一些實施方案中,宿主細胞可以具有一種或多種具有增加的活性的多肽以及一種或多種具有降低的活性的多肽。修飾(例如增加和/或降低)本公開的一種或多種多肽的活性的方法是本領域熟知的並且在本文中描述。
降低多肽的活性
本公開的宿主細胞可以含有與相應的對照細胞例如野生型細胞相比具有降低的/降低的活性的一種或多種多肽。例如,與相應的對照細胞相比,一種或多種β-木糖苷酶蛋白(例如具有木糖甙-木糖醇水解酶活性的那些)或一種或多種木糖醇脫氫酶可以在宿主細胞中具有降低的活性。降低多肽的表達,豐度和/或活性的方法是本領域熟知的並且在本文中描述。
在一些實施方案中,降低多肽的活性涉及過表達作為多肽抑制蛋白的多肽。宿主細胞可以過表達抑制一種或多種蛋白的表達和/或活性的抑制蛋白,所述蛋白用於防止木糖甙-木糖醇寡聚物的產生和/或積累,例如β-木糖苷酶具有木糖甙-木糖醇水解酶的活性。
在一些實施方案中,降低多肽(例如一種或多種β-木糖苷酶和/或一種或多種木糖醇脫氫酶)的活性涉及降低編碼多肽的核酸的表達。降低核酸的表達可以通過將遺傳突變引入靶核酸中來實現。突變方法可以用於通過產生突變來破壞或「敲除」靶基因的表達。在一些實施方案中,突變導致靶基因的部分缺失。在其他實施方案中,突變導致靶基因的完全缺失。微生物突變的方法是本領域熟知的,包括例如隨機突變和定點突變以引入突變。隨機突變的方法的實例包括例如化學誘變(例如使用乙磺酸甲酯),插入突變和輻射。在一些實施方案中,本公開的宿主細胞具有一種或多種β-木糖苷酶多肽和/或一種或多種木糖醇脫氫酶多肽的突變。
用於減少或抑制靶基因表達的一種方法是通過遺傳修飾靶基因並通過同源重組引入宿主細胞的基因組中以替換野生型版本的基因(例如,描述在U.S.Pat.No.6,924,146中)。
用於減少或抑制靶基因表達的另一種方法是通過使用根癌農桿菌(Agrobacterium tumefaciens)的T-DNA或轉座子的插入突變(參見Winkler et al.,Methods Mol.Biol.82:129-136,1989,和Martienssen,Proc.Natl.Acad.Sci.95:2021-2026,1998)。在產生插入突變體後,突變體可以經過篩選以鑑定在靶基因中含有插入的突變體。通過插入突變來破壞靶基因的方法描述於例如U.S.Pat.No.5,792,633。通過轉座子突變來破壞靶基因的方法描述於例如U.S.Pat.No.6,207,384。
破壞靶基因的另一種方法是通過使用cre-lox系統(例如,如U.S.Pat.No.4,959,317中所述)。
破壞靶基因的另一種方法是通過使用PCR突變(例如,如U.S.Pat.No.7,501,275中所述)。
內源基因表達還可以通過RNA幹擾(RNAi)來減少或抑制,其使用具有與靶基因序列相同或相似的序列的雙鏈RNA。RNAi可以包括使用microRNA(例如人工miRNA)抑制基因的表達。
RNAi是當將具有與靶基因的序列相同或相似的序列的雙鏈RNA導入細胞中時,插入的外源基因和靶內源基因兩者的表達被抑制的現象。雙鏈RNA可以由兩條分開的互補RNA形成,或者可以是具有形成雙鏈RNA的內部互補序列的單條RNA。
因此,在一些實施方案中,使用RNAi技術實現基因表達的降低或抑制。例如,為了使用RNAi實現編碼蛋白的DNA的表達的降低或抑制,使用具有編碼蛋白的DNA序列或與其基本上相似的序列的雙鏈RNA(包括那些工程改造的不翻譯蛋白的序列)或其片段,引入到感興趣的宿主細胞中。如本文所用,RNAi和dsRNA均指通過引入雙鏈RNA分子誘導的基因特異性沉默,參見例如U.S.Pat.Nos.6,506,559和6,573,099,並且包括具有雙鏈區域的分子,例如短髮夾RNA分子。然後可以對所得細胞篩選與靶基因表達降低相關的表型,例如降低的纖維素酶表達,和/或通過監測靶基因轉錄的RNA穩定水平。儘管用於RNAi的序列不需要與靶基因完全相同,但它們可以是至少70%、80%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更多與與靶基因相同。參見例如美國專利申請公開號2004/0029283。構建編碼具有與靶基因無關的莖-環結構的RNA分子的組件,並且其位於所感興趣的基因特異性的序列的遠端,也可以用於抑制靶基因表達。參見例如美國專利申請公開號2003/0221211。
RNAi核酸可以包括全長靶RNA或對應於靶RNA的片段。在一些情況下,所述片段將比對應的靶序列少100、200、300、400或500個核苷酸。另外,在一些方面,這些片段的長度至少50、100、150、200或更多個核苷酸。幹擾RNA可基於短雙鏈體(即,雙鏈序列的短區)設計。通常,短雙鏈體的長度為至少約15、20或25-50個核苷酸(例如,雙鏈RNA的每個互補序列的長度為15-50個核苷酸),通常約20-30個核苷酸,例如20、21、22、23、24、25、26、27、28、29或30個核苷酸。在一些情況下,用於RNAi的片段所對應的靶蛋白的區域,不存在於生物體中的其它蛋白中或與生物體中的其他轉錄物幾乎沒有相似性的。例如通過分析與比較公開可用的序列資料庫進行選擇。類似地,可以通過與感興趣的基因家族(例如本文所述的那些)的保守序列的相似性或一致性來選擇RNAi片段,使得RNAi可以針對含有保守序列的多種不同基因轉錄物。
RNAi可以作為較大DNA組件的一部分引入宿主細胞。通常,這樣的組件允許RNAi在引入後在細胞中穩定表達,例如通過將組件整合到宿主基因組中。因此,轉染細胞後能連續表達RNAi的表達載體可用於本公開。例如,可以使用表達小髮夾或莖-環結構的RNA或microRNA前體的載體。microRNA在體內可加工成能夠進行基因特異性沉默的小RNAi分子(Brummelkamp et al.,Science 296:550-553,(2002);和Paddison,et al.,Genes&Dev.16:948-958,(2002))。用雙鏈RNA進行轉錄後基因沉默的更詳細的討論見Hammond et al.,Nature Rev Gen 2:110-119,(2001);Fire et al.,Nature 391:806-811,(1998);和Timmons and Fire,Nature 395:854,(1998)。
用於選擇和設計產生RNAi的序列的方法是本領域眾所周知的(例如U.S.Pat.Nos.6,506,559;6,511,824;和 6,489,127)。
降低或抑制靶基因在宿主細胞中的表達,還可以通過將基於靶基因核酸序列的反義元件引入宿主細胞中來實現。對於反義抑制,靶序列相對於表達載體中的啟動子序列反向方向排列。引入的序列不需要是全長cDNA或基因,並且不需要與靶cDNA或待轉化細胞中的基因相同。然而,一般地,當引入的序列具有較短的長度時,使用與天然靶序列同源性更高的序列可實現有效的反義抑制。在一些方面,載體中引入的反義序列的長度為至少30個核苷酸,並且通常在反義序列的長度增加時,反義抑制效果提高。在一些方面,載體中反義序列的長度將大於100個核苷酸。所述的反義元件的轉錄導致RNA分子的產生,該RNA分子與內源靶基因轉錄的mRNA分子反向互補。靶基因表達的抑制也可以使用核酶實現。核酶的製備和使用公開於U.S.Pat.Nos.4,987,071和5,543,508。
可以使用本領域熟知的方法構建含有編碼靶基因表達的抑制劑,例如反義或siRNA的核酸表達框。元件包括調節元件,包括啟動子和用於表達和篩選表達元件的細胞的其它序列。通常,真菌和/或細菌轉化載體包括一個或多個克隆的編碼序列(基因組或cDNA)和顯性選擇標記,編碼序列序列受5'和3'調節序列。這樣的轉化載體通常還包含啟動子(例如,控制誘導型或組成型、環境或發育調節的表達的調節區)、轉錄起始起始位點、RNA加工信號(例如內含子剪接位點)、轉錄終止位點,和/或polyA信號。
在某些實施方案中,可以修飾靶核酸的一部分,例如編碼催化結構域的區域、編碼區或編碼區表達所需的控制序列。基因的這種控制序列可以是啟動子序列或其部分功能,即足以影響基因表達的部分。例如,啟動子序列可以是失活的,導致沒有表達,或者可以用較弱的啟動子替代天然啟動子序列以降低編碼序列的表達。可供改造的其它控制序列可包括例如前導序列、前肽序列、信號序列、轉錄終止子和轉錄激活子。
提高多肽的活性
本公開的宿主細胞可以含有與相應的對照細胞(例如相應的野生型細胞)相比具有增加的表達水平和/或活性的一種或多種多肽。在一些實施方案中,本公開的宿主細胞含有編碼重組多肽的重組核酸。在某些實施方案中,重組核酸在宿主細胞中異常地表達(例如,組成型表達,可誘導表達等),使得與相應的對照細胞相比,異常表達導致多肽活性的增加。在一些實施方案中,含有編碼重組多肽的重組核酸的宿主細胞,其多肽的量比不含相應重組核酸的對照細胞更多。當宿主細胞中蛋白或核酸以大於正常量的量產生或維持時,蛋白或核酸被「過表達」。在一些實施方案中,本公開的宿主細胞過表達多肽,例如,木寡糖轉運蛋白或木糖還原酶多肽。宿主細胞可以過表達一種或多種多肽,使得與相應的對照細胞相比,宿主細胞中一種或多種這些蛋白的活性增加。相應的對照細胞可以是,例如沒有過表達宿主細胞中過表達的一種或多種多肽的細胞,例如野生型細胞。各種對照細胞對於本領域技術人員是顯而易見的。
增加多肽表達的各種方法是本領域已知的。例如,可以改造涉及控制編碼多肽的核酸表達的其他遺傳區域,例如增強子序列,從而增加核酸的表達。核酸的表達水平可以通過檢測該基因編碼的mRNA的水平和/或通過檢測該核酸編碼的多肽的水平或活性來評估。
在一些實施方案中,宿主細胞過表達是一種或多種多肽(例如木糖寡糖轉運蛋白和/或木糖還原酶)的活化蛋白的多肽。激活蛋白多肽的過表達可以導致多肽的豐度和活性增加。激活蛋白可以增加靶多肽的表達。活化蛋白可以增加靶多肽的活性。
增加本公開多肽(例如木寡糖轉運蛋白和/或木糖還原酶)的豐度以增加多肽活性可以通過過表達多肽來實現。增加多肽豐度的其他方法是本領域已知的。例如,通過細胞降解機制(例如蛋白酶體)降低多肽的降解可增加多肽的穩定性和豐度。多肽可以被遺傳改造,增強它們對細胞蛋白水解的抗性,但它們在分子活性上沒有變化。可以將作為參與一種或多種多肽降解的細胞因子的抑制蛋白多肽引入宿主細胞中以增加一種或多種多肽的豐度,所述多肽是定向增加活性的。此外,宿主細胞可以用蛋白酶體的化學抑制劑如放線菌酮處理,以增加本公開的一種或多種多肽的豐度。
生產木糖甙-木糖醇寡聚物的方法
本公開涉及生產木糖甙-木糖醇寡聚物的方法。本公開用於生產木糖甙-木糖醇寡聚物的宿主細胞具有木糖葡聚糖轉運蛋白和木糖還原酶。可以使用各種木寡糖轉運蛋白,只要它們能夠將一種或多種木寡糖運輸到宿主細胞中即可。可以使用各種木糖還原酶多肽,只要它們能夠作用於木寡糖底物以將木寡糖轉化成木糖甙-木糖醇寡聚物。另外,細胞中,一種或多種β-木糖苷酶蛋白的活性可以降低,只要特定的β-木糖苷酶具有木糖甙-木糖醇水解酶活性。具有木糖甙-木糖醇水解酶活性的蛋白將水解木糖甙-木糖醇寡聚物並阻止它們在宿主細胞中積累,因此細胞中的木糖甙-木糖醇水解酶活性應該降低或去除。此外,可以在細胞中降低一種或多種木糖醇脫氫酶的活性。
為了產生木糖甙-木糖醇寡聚物,本公開的宿主細胞應在含有木寡糖或木寡糖源的生長培養基中培養。可以使用各種木寡糖,包括例如木二糖(2個木糖單體),木三糖(3個木糖單體),木四糖(4個木糖單體),木五糖(5個木糖單體)和木六糖(6個木糖單體)。如本領域技術人員將理解的,可以針對宿主細胞中特定的木寡糖轉運蛋白選擇特定的木寡糖,因為不同的木寡糖轉運蛋白可以具有對不同類型和長度的木寡糖的不同親和力和/或不同的轉運能力。木寡糖可以商業購買,或者它們可以衍生自其它木寡糖。
木寡糖的來源是本領域公知的並且在本文中描述。例如,木寡糖的來源可以是含有木寡糖或其分解釋放木寡糖的材料。如本文所用,「含木寡糖的材料」是含有或能夠產生木寡糖的任何材料,包括生物質,例如含有植物材料的生物質。適合在目前公開的方法中使用的生物質包括各種含木寡糖的材料,例如芒草、柳枝稷、禾草、黑麥草、蘆葦草、甜象草、普通蘆葦、麥稈、大麥秸稈、油菜秸稈、燕麥秸稈、玉米秸稈、大豆秸稈、燕麥殼、高粱、稻殼、黑麥殼、小麥殼、甘蔗渣、椰肉粉、椰肉顆粒、棕櫚仁粉、玉米纖維、具有可溶物的幹酒糟(DDGS)、藍莖、玉米芯、松木、樺木、柳木、白楊木、楊木、能源甘蔗、廢紙、鋸屑、林業廢物、城市固體廢物、作物殘渣、其他草和其他木材。木寡糖的來源材料可能需要預處理以產生和/或釋放木寡糖,例如用高溫或高壓處理。這樣的處理是本領域技術人員公知的。在宿主細胞在某些木寡糖源例如木質纖維素生物質上生長的實施方案中,應當使用能夠從生物質中釋放木寡糖的宿主細胞。示例性細胞對於本領域技術人員是顯而易見的。
本公開的宿主細胞應在合適的條件下培養,使得宿主細胞能從木寡糖底物產生木糖甙-木糖醇寡聚物。在本公開的方法中用於培養宿主細胞的生長培養基應當包含合適的碳源。「碳源」通常是指適合用作細胞生長的碳源的底物或化合物。碳源可以是各種形式,例如聚合物、碳水化合物、酸、醇、醛、酮、胺基酸、肽等。這些包括例如各種單糖、寡糖、多糖、生物質聚合物(如纖維素或半纖維素)、木糖、阿拉伯糖、二糖(如蔗糖)、飽和或不飽和脂肪酸、琥珀酸鹽、乳酸鹽、乙酸鹽、乙醇等,或其混合物。除了合適的碳源之外,培養基可以包含本領域技術人員已知的、適合培養物生長和促進參與木糖甙-木糖醇寡聚物生產途徑的合適的礦物質、鹽、輔因子、緩衝液和其他組分。用於宿主細胞例如微生物的標準培養環境是本領域公知的並且在本文中描述。在一些實施方案中,本發明的宿主細胞好氧培養或微好氧培養。
本公開的方法可以導致木糖甙-木糖醇寡聚物(木糖甙n-木糖醇)在宿主細胞中的產生和積累。宿主細胞可以生產各種木糖甙-木糖醇寡聚物,包括例如木糖甙-木糖醇、木二糖甙-木糖醇(木糖甙2-木糖醇)、木三糖甙-木糖醇(木糖甙3-木糖醇)、木四糖甙-木糖醇(木糖甙4-木糖醇)、木五糖甙-木糖醇(木糖甙5-木糖醇)和木六糖甙-木糖醇(木糖甙6-木糖醇)。本領域技術人員很容易理解,所生產的特定木糖甙-木糖醇寡聚物取決於多種因素,例如當作用於木寡糖底物時,特定的木寡糖底物和特定的木糖還原酶的活性。
在一些實施方案中,本公開的方法涉及的宿主細胞與相應的對照細胞相比,具有增加的木糖甙-木糖醇寡聚物生產速率。具有增加的木糖甙-木糖醇寡聚物生產速率的宿主細胞可以是具有降低的一種或多種β-木糖苷酶和/或一種或多種木糖醇脫氫酶的活性和/或一種或多種木糖醇轉運蛋白和/或木糖還原酶的表達或活性增加。本公開的宿主細胞,木糖甙-木糖醇寡聚物產生的速率比野生型細胞或不具有改造的多肽活性的細胞可以高至少0.1倍、至少0.2倍、至少0.3倍、至少0.4倍、至少0.5倍、至少0.6倍至少1.0倍、至少0.7倍、至少0.8倍、至少0.9倍、至少1倍、至少1.25倍、至少1.5倍、至少1.75倍、至少2倍、至少2.25倍、至少2.5倍、至少2.75倍、至少3倍、至少3.25倍、至少3.5倍、至少3.75倍、至少4倍、至少4.25倍、至少4.5倍、至少4.75倍、至少5倍、至少5.25倍、至少5.5倍、至少5.75倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍或至少30倍或更多。在一些實施方案中,相應的對照細胞不積累任何木糖甙-木糖醇寡聚物。對照細胞可能不能產生木糖甙-木糖醇寡聚物,因為例如對照細胞不含有產生木糖甙-木糖醇寡聚物所需的分子機制。不能產生木糖甙-木糖醇寡聚物的示例性細胞可以包括例如不具有木寡糖轉運蛋白和/或木糖還原酶多肽的細胞。對照細胞可能不能積累木糖甙-木糖醇寡聚物,因為例如對照細胞具有水解木糖甙-木糖醇寡聚物的分子機制,例如具有木糖甙-木糖醇水解酶活性的β-木糖苷酶。
在一些實施方案中,本公開的方法涉及的宿主細胞,與相應的對照細胞相比木糖甙-木糖醇寡聚物消耗速率降低。木糖甙-木糖醇寡聚物消耗速率降低的宿主細胞可以是降低木糖甙-木糖醇水解酶活性的一種或多種β-木糖苷酶和/或一種或多種木糖醇脫氫酶的活性。本公開的宿主細胞,與對應的對照細胞例如野生型細胞或未改造的多肽活性的細胞相雙,對木糖甙-木糖醇寡聚物的水解可以降低約5%、約10%、約15%、約20%、約25%、約30%、約35%、約40%、50%、約45%、約50%、約55%、約60%、約65%、約70%、約75%、約80%、約85%、約90%、約95%或約100%。在一些實施方案中,與相應的對照細胞相比,本公開的宿主細胞消耗木糖甙-木糖醇寡聚物減少約100%。
測量宿主細胞或細胞群木糖甙-木糖醇寡聚物的積累、產生和/或消耗/降解/水解速率的方法是本領域熟知的並且在本文中描述。例如,測定培養物中細胞或細胞群的木糖甙-木糖醇寡聚物消耗/降解速率可以通過允許細胞在含有木寡糖的培養基中生長,並且在指定的時間點測量生長培養基中的木寡糖隨時間的消耗,測定所繪曲線的斜率以確定木寡糖消耗/降解速率(例如木二糖/L/h)。類似地,測定木糖甙-木糖醇寡聚物積聚或產生可以通過在含有木寡糖的培養基中培養細胞或細胞群,並且在指定的時間點測量從木寡糖中產生的木糖甙-木糖醇寡聚物。
在一些實施方案中,在本公開的宿主細胞產生木糖甙-木糖醇寡聚物之後,木糖甙-木糖醇寡聚物可以從培養基中沉澱、移出或初步純化。從培養基中初步純化木糖甙-木糖醇寡聚物的方法對於本領域技術人員是顯而易見的並且在本文中描述。例如,各種柱層析技術可用於從培養基中純化木糖甙-木糖醇寡聚物。
含有木糖甙-木糖醇寡聚物的組合物
本發明還提供了含有木糖甙-木糖醇寡聚物的組合物。根據本公開的方法產生的包括木糖甙-木糖醇寡聚物在內的各種組合物在本文中描述並且對於本領域技術人員是顯而易見的。例如,在從培養基中純化木糖甙-木糖醇寡聚物的一些實施方案中,木糖甙-木糖醇寡聚物可以包含在組合物中,產生含有木糖甙-木糖醇的組合物。在其它實施方案中,含有木糖甙-木糖醇寡聚物的組合物可以含有未從培養基中初步純化出來的寡聚物。例如,可以製備含有由本公開的宿主細胞產生的含有木糖甙-木糖醇寡聚物的培養基的組合物。可以從培養基中除去宿主細胞,使得組合物含有由宿主細胞產生的無細胞生長的培養基和木糖甙-木糖醇寡聚物。
實施例
提供以下實施例用於說明並幫助本領域技術人員更好地理解本公開的各種實施例。以下實施例不以任何方式限制本公開的範圍。
實施例1:木糖甙-木糖醇寡聚物及其微生物和酶製備
本實施例展示木糖甙-木糖醇寡聚物是由含有木寡糖轉運和利用途徑的釀酒酵母工程菌株產生。異源表達木寡糖轉運蛋白和木糖還原酶的工程菌株,能將木寡糖運到體內並轉化成主要產物木糖甙-木糖醇和木二糖甙-木糖醇。因此,該工作展示了建立木糖甙-木糖醇寡聚物生物法生產的生物平臺。從木寡糖底物生產木糖甙-木糖醇寡聚物的生物途徑的概述見圖13A。
材料與方法
粗糙脈孢黴菌株
粗糙脈孢黴菌株來自真菌遺傳學庫存中心(FGSC)(McCluskey et al.,2003),包括WT(FGSC 2489)和兩種寡糖轉運蛋白的缺失菌株:NCU00801(FGSC 16575)和NCU08114(FGSC 17868)。
異源表達的質粒和酵母菌株
按(http://www.fgsc.net/fgn35/lee35.pdf)和Harju等人所述提取粗糙脈孢黴WT菌株(FGSC 2489)和釀酒酵母S288C菌株的模板基因組DNA(gDNA)。從粗糙脈孢黴gDNA模板擴增β-木糖苷酶基因NCU01900和NCU09652(分別為GH43-2和GH43-7)的開放閱讀框(ORF)。NCBI上粗糙脈孢黴CDT-2的登錄號為XP_963873.1。GenBank上的樹幹畢赤酵母木糖還原酶的登錄號為ADQ89193.1。為方便生化分析,每個ORF的C末端與6個組氨酸標籤融合,並與2μ酵母質粒pRS423骨架中的釀酒酵母PTEF1啟動子和CYC1轉錄終止子側接。質粒pRS426_NCU08114先前已有描述(Galazka et al.,2010)。含有樹幹畢赤酵母木糖利用途徑(木糖還原酶、木糖醇脫氫酶和木酮糖激酶)的質粒pLNL78來自John Dueber的實驗室(Latimer et al.,提交)。通過使用In-Fusion克隆試劑盒(Clontech)將NCU08114和NCU01900表達框整合到pLNL78中構建質粒pXD2,即單一質粒形式的木寡糖途徑。質粒pXD8.4,衍生自質粒pRS316(Sikorski et al.,1989)用於表達帶有PCCW12啟動子的CDT-2和GH43-2。質粒pXD8.6,衍生自pXD8.4,用GH43-7的ORF替代GH43-2的ORF。pXD8.7包含使用各自的PCCW12啟動子的所有三種表達框(CDT-2,GH43-2和GH43-7)。釀酒酵母菌株D452-2(MATa leu2 his3 ura3 can1)(Kurtzman et al.,1994)和SR8U(進化的木糖快速利用菌株SR8的尿嘧啶自養型)(Kim et al.,2013)用於酵母實驗的受體菌株。從粗糙脈孢黴gDNA擴增粗糙脈孢黴木糖還原酶(XYR-1,NcXR)的ORF,通過重疊PCR除去內含子。從pLNL78擴增樹幹畢赤酵母木糖還原酶(SsXR)的ORF。將每個木糖還原酶ORF的C-末端與6個組氨酸標籤融合,並與釀酒酵母PCCW12啟動子和CYC1轉錄終止子側接,並插入質粒pRS316中。
基於酵母細胞的木寡糖攝取測定
釀酒酵母在缺乏尿嘧啶的優化基礎培養基(oMM)中生長至對數期後期。oMM含有1.7g/L YNB(Sigma,Y1251),2倍適當的CSM無氮源混合物,10g/L(NH4)2SO4,1g/L MgSO4.7H2O,6g/L KH2PO4,100mg/L,100mg/L腺嘌呤半硫酸鹽,10mg/L肌醇,100mg/L穀氨酸,20mg/L賴氨酸,375mg/L絲氨酸和100mM 4-嗎啉乙磺酸(MES),pH 6.0(Lin et al.,提交)。然後收穫細胞並用測定緩衝液(5mM MES,100mM NaCl,pH 6.0)洗滌三次,並重懸至最終OD600為40。用相同測定緩衝液製備濃度為200μM的底物母液。通過混合等體積的細胞懸浮液和底物母液開始轉運的測定。反應在30℃下連續振蕩孵育30分鐘。將樣品在4℃以14,000rpm離心5分鐘除去酵母細胞。將各樣品上清液400μL轉移到含有100μL 0.5M NaOH的HPLC小瓶中,如下所述通過HPAEC測定剩餘底物的濃度。
酶的純化
將轉化酶表達質粒的釀酒酵母菌株在缺少組氨酸的oMM中生長到對數後期,離心收集菌體。將酵母細胞沉澱重懸於含有50mM Tris-HCl、100mM NaCl、0.5mM DTT(pH 7.4)和蛋白酶抑制劑混合物(Pierce)的緩衝液中。將細胞用Avestin勻漿機裂解,將澄清的上清液加載到HisTrap柱(GE Healthcare)上。組氨酸標記的酶用咪唑梯度純化,將緩衝液置換為20mM Tris-HCl、100mM NaCl(pH 7.4),並濃縮至5mg/mL。
酶的測定
對於木寡糖底物的GH43-2β-木糖苷酶的測定:將0.5μM純化的酶與0.1%自製的木寡糖或1mM木二糖(Megazyme)在30℃,1×PBS中孵育。在30分鐘時取樣,並加入5倍體積的0.1mM NaOH滅活。如下所述通過HPAEC分析產物。對於pH分析,加入0.1M的濃度pH 4.0、4.5、5.0、5.5、6.0的醋酸鹽緩衝液和6.5、7.0、7.5、8的磷酸鹽緩衝液。對於木糖甙-木糖醇底物的GH43-2和GH43β-木糖苷酶的測定:將10μM純化的酶與4.5mM木糖甙-木糖醇和0.5mM木二糖在20mM MES緩衝液(pH 7.0)和1mM CaCl2在30℃孵育。在3小時取樣,並通過在99℃加熱10分鐘滅活。如下所述通過離子排阻HPLC分析產物。
對於樹幹畢赤酵母木糖還原酶XR和粗糙脈孢黴木糖還原酶XR的測定:在30℃下將1μM純化的酶與0.06%木寡糖和2mM NADPH(在1×PBS中)一起孵育。在30分鐘時取樣,並通過在99℃下加熱10分鐘滅活。如下所述通過LC-QToF分析產物。
寡糖製備
木寡糖購自Cascade Analytical Reagents and Biochemicals公司,或根據公開的流程(Akpinar et al.,2009),稍作修改製備。簡言之,將20g櫸木木聚糖(Sigma-Aldrich)完全懸浮在1000mL水中,向其中加入13.6mL 18.4M H2SO4。將混合物在150℃油浴中連續攪拌孵育。30分鐘後,將反應物倒入冰上的2L塑料容器中,同時攪拌以使其冷卻。此後,緩慢加入0.25mol CaCO3以中和pH並沉澱硫酸鹽。將上清液過濾並在旋轉蒸發器上50℃濃縮至幹。自製的木寡糖含有約30%的木糖單體和70%的低聚物。為了獲得較大部分的短鏈木寡糖,將商業木寡糖按20%質量體積比(重量/體積)溶解,並與2mg/mL木聚糖酶在37℃下孵育48小時。使用前進行熱失活和過濾。
(木糖甙)n-木糖醇純化
從含有質粒pXD8.4的菌株SR8的木寡糖培養液中純化木糖甙-木糖醇和寡聚體。將50mL培養物上清液在50℃的旋轉蒸發器上濃縮至約5mL。將過濾的樣品加載到填充有SupelcleanTM ENVI-CarbTM填料(Sigma-Aldrich)的XK 16/70柱子上(GE Healthcare),用Purifier(GE Healthcare)進行純化。在室溫下用乙腈梯度以3.0mL/min的流速洗脫柱。將通過LC-MS驗證的純化組分合併並濃縮。最終的產品,含有90%木糖甙-木糖醇和10%木二糖用於酶活測定的底物和HPLC標準品。
酵母在木寡糖上培養
好氧條件下,將酵母菌株在含有2%葡萄糖的oMM培養基中預培養過夜,用水洗滌3次,並重懸於oMM培養基中。對於好氧生長,菌株按起始OD600為1.0或20接種到50mL含4%w/v(重量/體積)木寡糖的oMM培養基的250mL錐形瓶中,並用4層miracl布覆蓋,220rpm振蕩培養。對於微好氧生長,菌株按起始OD600 80接種到50mL含4%w/v(重量/體積)木寡糖的oMM培養基的125mL錐形瓶中,並用4層miracl布覆蓋,100rpm振蕩培養。在指定的時間點,取出0.8mL樣品並離心。取20μL上清液通過離子排阻HPLC分析測定木糖、木糖醇、甘油和乙醇濃度。25μL 1:200稀釋或2μL 1:100稀釋的上清液分別通過HPAEC或LC-QToF分析以測定木寡糖濃度。
圖13B中,具體地,將工程化的酵母菌株在含有2%葡萄糖的oMM培養基中好氧預培養過夜,用水洗滌3次,並重懸於oMM培養基中。不含碳源的oMM培養基每升含有1.7g YNB(不含硫酸銨,Sigma,Y1251)、2倍適當的CSM無氮混合物(MP Biomedicals)、10g(NH4)2SO4,1g MgSO4.7H2O、6g KH2PO4、100mg腺嘌呤半硫酸鹽、10mg肌醇,以及另外的100mg穀氨酸、20mg賴氨酸和375mg絲氨酸。然後將細胞按起始OD600為80接種到50mL含有4%w/v(重量/體積)木寡糖的oMM培養基的125mL錐形瓶中,4層miracl布覆蓋,100rpm振蕩培養。在指定的時間點,取出0.8mL樣品並離心。通過LC-QToF質譜鑑定和測量XOS消耗和(木糖甙)n-木糖醇生產。在第5天結束時,消耗了93%的木二糖和71%的木三糖。木糖甙-木糖醇和木二糖甙-木糖醇的產率分別為90%和54%。
離子排阻HPLC分析
在裝有示差檢測器的Shimadzu Prominence HPLC儀上進行離子排阻HPLC。樣品在離子排阻柱(Aminex HPX-87H柱,300×7.8mm,Bio-Rad)上使用流動相為0.01N H2SO4,在50℃條件下,以0.6mL/min的流速分離。
HPACE分析
在30℃下使用CarboPac PA200分析柱(150×3mm)和CarboPac PA200保護柱(3×30mm)在ICS-3000HPLC儀(Thermo Fisher)上進行HPAEC分析。在注射25μL稀釋的樣品後,用0.1M NaOH在乙酸鈉梯度的流動相中以0.4mL/min進行洗脫。對於木寡糖和木糖甙-木糖醇分離,乙酸鹽梯度為:0mM 1分鐘,在8分鐘內增加至80mM,在1分鐘內增加至300mM,保持30mM 2分鐘,然後在0mM下重新平衡3分鐘。使用脈衝電流檢測器(PAD)檢測碳水化合物,並使用Chromeleon軟體包分析和定量峰。
質譜分析
所有質譜分析在Agilent 1200 LC-Agilent 6520 Accurate-Mass Q-TOF上進行,使用的柱子是100×7.8mm Rezex RFQ-Fast Fruit H+8%柱(Phenomenex),以0.5%甲酸為流動相,在55℃條件下,以0.3mL/min的流速分離樣品。
為了確定未知代謝物的精確質量,取2μL 1:100稀釋的酵母培養物上清液進行LC-QTOF分析。使用氮氣為載氣。在負離子模式下,源電壓(Vcap)為3,000V,碰撞電壓為100V。乾燥氣溫度為300℃;乾燥氣流量為7L/min;霧化器壓力為45psi。ESI離子源使用單獨的霧化器持續、低量地引入參考質量化合物(112.985587,1033.988109)以維持質量軸的校準。以1Hz採集速率收集數據,掃描範圍m/z 50至1100,以棒狀圖形式存儲。
以LC-MS/MS確認木糖甙-木糖醇和木二糖甙-木糖醇。保留時間(RT)為5.8分鐘且m/z比為283.103的化合物和RT為4.7分鐘且m/z比為415.15的化合物用10、20和40eV的碰撞量碎片化。獲得MS/MS譜圖,產物離子與ChemBioDraw Ultra v13中的碎裂工具產生的計算碎片離子進行比較和匹配。
為了定量培養物中的碳水化合物和碳水化合物衍生物,將培養物上清液用水中稀釋100倍,取2μL通過LC-QToF分析。將譜圖導入到Agilent MassHunter Workstation軟體的定性分析模塊中,使用從校準樣品獲得的m/z和保留時間值來搜索數據中的目標離子。這些搜索基於目標化合物列表生成提取離子色譜圖(EIC)。將峰進行積分並與標準曲線比較以計算濃度。從oMM培養基中製備的校準樣品(與所有樣品一樣)計算出校準曲線,並且對於每個化合物的曲線擬合R2為0.999。以4-嗎啉乙磺酸(MES)為內標(IS)進行濃度校準,MES化合物在oMM培養基中具有恆定濃度且不會被酵母利用。
系統發育分析
使用BLAST(Altschul et al.,1997)將各自的序列與NCBI蛋白數據進行查詢,找到GH43-2和GH43-7的同源物。選擇來自多樣化分類的、具有代表性的序列用MUSCLE(Edgar et al.,2004)算法進行比對。使用MEGA v6.05(Tamura et al.,2013)軟體,根據Jones-Taylor-Thornton比對模型構建了最大可能性進化樹。使用Phyre2伺服器對GH43-2和GH43-7進行同源建模。
結果
申請人對探索木寡糖代謝的生物學方法感興趣。利用生物法從植物生物質生產生物燃料和可再生化學品,需要經濟的方式將來自植物細胞壁的複雜碳水化合物聚合物轉化為可被微生物發酵的單糖(Carroll et al.,2009;Chundawat et al.,2011)。在目前的工業方法中,植物細胞壁中的兩種主要多糖,纖維素和半纖維素(Somerville et al.,2004)通常分別加工成葡萄糖和木糖的單體(Chundawat et al.,2011)。然而,除了對生物質的苛刻的預處理之外,還需要大量的纖維素酶和半纖維素酶混合物以從植物細胞壁中釋放單糖,導致許多未解決的經濟和後勤的挑戰(Chundawat et al.,2011;Himmel et al.,2007;Jarboe et al.,2010;Lynd et al.,2002)。生物乙醇工業目前使用酵母釀酒酵母將來自玉米澱粉或蔗糖發酵成乙醇(Hong et al.,2012),但是釀酒酵母需要大量的改造才能發酵來源於植物細胞壁的糖,例如纖維二糖和木糖(Hong et al.,2012;Ha et al.,2011;Kuyper et al.,2005;Young et al.,2014;Jeffries et al.,2006)。
與釀酒酵母相反,許多纖維素分解真菌包括粗糙脈孢黴(Tian et al.,2009)在植物細胞壁的纖維素和半纖維素組分上生長良好。如圖12所示,多種分子組分參與纖維素和半纖維素作為碳源的轉運和利用,包括用於將纖維糊精和/或木寡糖運輸到細胞中的轉運蛋白、細胞內β-葡糖苷酶和β-木糖苷酶分別水解纖維糊精和木寡糖、以及促進這些水解產物作為碳源的利用的各種組分。對於木糖,它是木寡糖水解的產物,木糖還原酶(XR),木糖醇脫氫酶(XDH)和木酮糖激酶(XK)可以利用木糖。
如上所述,來自植物細胞壁的纖維糊精和木寡糖不能被野生型釀酒酵母分解代謝(Galazka et al.,2010;Young et al.,2010;Matsushika et al.,2009)。之前發現,在釀酒酵母中重構來自粗糙脈孢黴的纖維糊精轉運和消耗途徑,使得該酵母能夠發酵纖維二糖(Galazka et al.,2010)。此外,釀酒酵母之前被工程化改造,通過引入木糖異構酶(XI)或木糖還原酶(XR)和木糖醇脫氫酶(XDH)消耗木糖(Jeffries et al.,2006;Matsushika et al.,2009)。申請人推斷表達來自粗糙脈孢黴的、具有功能的木寡糖轉運和消耗系統,可以進一步擴大釀酒酵母利用植物來源的木寡糖作為碳源的能力。
木寡糖運輸和利用菌株的構建
申請人感興趣於在釀酒酵母中構建功能性木寡糖轉運和消耗系統,並且開始研究粗糙脈孢黴中木寡糖轉運的可能機制。申請人分析了粗糙脈孢黴的轉錄分析數據(Tian et al.,2009)和敲除菌株生長表型,鑑定了粗糙脈孢黴消耗由其分泌酶釋放的纖維糊精和木寡糖的單獨途徑(Galazka et al.,2010)。缺失了先前鑑定的纖維糊精轉運蛋白(CDT-2,NCU08114)的菌株(Galazka et al.,2010)不能在木聚糖上生長,並且木寡糖留在培養物上清液中,表明CDT-2可能是木糖轉運蛋白。作為CDT-2的轉運功能的直接測試,表達cdt-2的釀酒酵母菌株能夠導入木二糖、木三糖和木四糖(圖1)。與CDT-1一樣,CDT-2的直系同源物廣泛分布在真菌界(Galazka et al.,2010),這表明許多真菌消耗來自植物細胞壁的木寡糖。
在運輸進入細胞後,木寡糖的水解將允許它們進一步用作碳源。值得注意的是,當在木聚糖上生長時,粗糙脈孢黴能表達假定的細胞內β-木糖苷酶GH43-2(NCU01900)(Sun et al.,2012)。申請人發現純化的GH43-2對於具有2至8的聚合度(DP)和最適pH 7附近的木寡糖顯示出很強的水解酶活性。此外,如同細胞內β-glucosidases(Galazka et al.,2010)一樣,細胞內β-木糖苷酶也廣泛存在於真菌中(Sun et al.,2012)。
申請人因此鑑定了可將木寡糖轉運到細胞中的蛋白(CDT-2)和可水解木寡糖的蛋白(GH43-2)。為了測試釀酒酵母是否可以利用木寡糖,釀酒酵母菌株工程改造了源自樹幹畢赤酵母的XR/XDH途徑進行工程改造,該途徑類似於粗糙脈孢黴中使用的途徑(Sun et al.,2012),還對釀酒酵母菌株工程改造了源自粗糙脈孢黴的木寡糖轉運和消耗途徑。表達來自粗糙脈孢黴的CDT-2、來自粗糙脈孢黴的胞內β-木糖苷酶GH43-2和來自樹幹畢赤酵母的XR和XDH的木糖利用酵母,能夠直接利用具有2或3個DP(聚合度)的木寡糖(圖2A)。對照野生型釀酒酵母菌株不能直接利用木寡糖(圖3A和3C)。類似地,工程改造了木糖利用途徑而不是木寡糖轉運途徑的釀酒酵母菌株不能代謝木寡糖(圖3B和3D)。
工程菌株生產木糖甙-木糖醇寡聚物
進行與圖2A相似的實驗,除了使用更高的細胞密度培養物(OD600=20)(見圖2B)。值得注意的是,工程化酵母的高細胞密度培養物能夠消耗高達DP 5的木寡糖,但是木糖水平保持很高(圖2B),這表明在工程化酵母中存在未知的瓶頸。這些結果與之前嘗試工程化釀酒酵母用於木寡糖消耗的那些結果類似,那些都報導了木糖在培養基中積累(Fujii et al.,2011)。申請人關注為什麼在該培養物中木寡糖濃度降低,但木糖濃度隨時間保持相對穩定(不降低)。不希望受理論束縛,認為來自樹幹畢赤酵母的木糖還原酶會將木糖(由來自粗糙脈孢黴的β-木糖苷酶GH43-2水解木寡糖產生的)轉化為木糖醇,然後木糖醇將進一步代謝。在這點上,認為木糖將被消耗,而不是如所觀察到的在該培養物中積累。申請人試圖探索這個未知的瓶頸並分析培養物上清液的內容物。對來自具有木寡糖的培養物的上清液的分析意外地揭示,通過工程化酵母將木寡糖轉化成木糖甙-木糖醇寡聚物,一組以前未知的代謝中間體,而不是水解成木糖並消耗(圖4A和4B)。所得木糖甙-木糖醇寡聚物是有效的末端產物,不能被該工程酵母菌株進一步代謝。
申請人發現XR/XDH/CDT-2/GH43-2釀酒酵母菌株能產生木糖甙-木糖醇寡聚物是令人驚訝的,因為之前認為該菌株將有效地將木寡糖代謝成木糖用於消耗。此外,這個令人驚訝的發現可能是非常有益的。不希望受理論束縛,認為木糖甙-木糖醇寡聚物可用於各種目的,例如用作甜味劑,用作益生元或作為抗感染藥物。因此,申請人希望更好地理解工程化的酵母菌株中木糖甙-木糖醇寡聚物的產生。
木糖醇寡聚體生產的研究機制
為了測試木糖甙-木糖醇寡聚物產生是否由木寡糖與釀酒酵母內源酶的副反應導致,將兩種單獨的酵母菌株在組合培養物中孵育:一種菌株含有由CDT-2和GH43-2組成的木寡糖水解途徑,另一種菌株用XR/XDH木糖消耗途徑工程改造。表達CDT-2和GH43-2的菌株能夠將木寡糖切割成木糖,然後被分泌並用作表達木糖消耗途徑(XR和XDH)的菌株的碳源。相比之下,表達XR和XDH但不是木寡糖轉運和水解途徑(CD-2和GH43-2)的工程酵母將僅能夠消耗木糖。當這些菌株共培養時,發現木寡糖被消耗而不產生木糖甙-木糖醇副產物(圖5)。X2和X3減少,並且產生木糖醇單體,但是值得注意的是,未檢測到木糖甙-木糖醇寡聚物。這些結果表明酵母內源性的酶和GH43-2的轉糖酵解活性不負責產生木糖甙-木糖醇副產物,表明它們必須由木糖還原酶(XR)產生。在這種情況下該酶來自樹幹畢赤酵母。
純化的木糖還原酶催化由木寡糖底物製備木糖甙-木糖醇寡聚物
不希望受理論束縛,認為如果木糖甙-木糖醇副產物由來自樹幹畢赤酵母的XR產生,則類似的副產物可能由粗糙脈孢黴中的XR產生。為了直接測試木糖還原酶從木寡糖底物產生木糖甙-木糖醇寡聚物的能力,用來自粗糙脈孢黴的木糖還原酶XYR-1進行體外分析。如圖6A和6B所示,當與聚合度2至4的木寡糖底物一起孵育時,XYR-1能夠直接產生具有聚合度達3(xlt3)的木糖甙-木糖醇寡聚物。
β-木糖苷酶GH43-7水解木糖甙-木糖醇寡聚物
從上面在圖6中描述的實驗,發現來自粗糙脈孢黴的木糖還原酶XYR-1(NCU08384)可以在體外由木寡糖產生木糖甙-木糖醇產物。然而,當在培養物中生長時,在粗糙脈孢黴培養基中沒有木糖甙-木糖醇副產物積聚(圖7),表明在粗糙脈孢黴中存在能夠代謝木糖甙-木糖醇寡聚物的內源途徑。發現在木聚糖上生長的粗糙脈孢黴,其假定的第二個β-木糖苷酶表達上調。第二個β-木糖苷酶GH43-7(NCU09625)(Sun et al.,2012)具有很弱的β-木糖苷酶活性,但卻能快速水解木糖甙-木糖醇轉化成木糖和木糖醇(圖8A和8B)。儘管該酶的活性從木糖消耗的觀點來看是有益的,但是該蛋白的活性不允許木糖甙-木糖醇寡聚物的積累。然而,不希望受理論束縛,因為該蛋白(GH43-7)已顯示具有直接木糖甙-木糖醇水解酶活性,申請人相信,降低該蛋白或其它具有相似功能的蛋白的活性或敲除該蛋白或其它具有相似功能的蛋白將導致木糖甙-木糖醇寡聚物的重新的積累。
進一步的實驗
為了進一步研究由各種工程化酵母菌株產生的各種產物,進行了一系列發酵實驗。圖9A顯示野生型釀酒酵母SR8酵母、轉化了CDT-2和GH43-2(pXD8.4)的SR8酵母、轉化了CDT-2和GH43-7(pXD8.6)的SR8酵母或轉化CDT-2、GH43-2和GH43-7(pXD8.7)的SR8酵母在以木寡糖作為唯一碳源生長時的生長速度。發現工程化的酵母菌株與野生型相比生長具有一些改善。具有pXD8.4的菌株最類似於野生型,推測是因為該菌株積累木糖甙-木糖醇寡聚物而不是利用來自木寡糖水解的木糖。圖9B、9C和9D顯示了在微好氧條件下,指定的酵母菌株在木寡糖上生長,起始培養物OD600=20時,木寡糖和木糖甙-木糖醇寡聚物水平。僅在具有質粒pXD8.4的SR8菌株中觀察到木糖甙-木糖醇積累。圖9E、9F和9G顯示了在微好氧條件下,指定的酵母菌株在木寡糖上生長,起始培養物OD600=80時,木寡糖和木糖甙-木糖醇寡聚物水平。同樣,只有具有pXD8.4的菌株可以積累木糖甙-木糖醇寡聚物。類似的結果在圖10中給出,但分析了不同的木寡糖及其衍生物。如圖9H所示,具有pXD8.7的菌株是最有效的乙醇生產菌株,該菌株不能積累木糖甙-木糖醇寡聚物。結果進一步證實,木糖還原酶能夠從木寡糖底物中產生木糖甙-木糖醇寡聚物,並且粗糙脈孢黴酶GH43-7具有木糖甙-木糖醇水解酶活性並且能夠代謝木糖甙-木糖醇寡聚物。
為了進一步研究工程化的酵母產生木糖甙-木糖醇寡聚物的能力,進行了另外的實驗。其中一個實驗,類似於圖9和圖10,稍有不同,例如更長的孵育時間和對不同的木糖甙-木糖醇產物分析。實驗中,使用具有XR/CDT-2/GH43-2的釀酒酵母菌株的,起始培養物OD600為80。如圖13B所示,在第5天結束時,消耗了93%的木二糖和71%的木三糖。木糖甙-木糖醇和木二糖甙-木糖醇的產率分別為90%和54%。圖13A顯示了由木寡糖底物產生木糖甙-木糖醇寡聚物的可能機制。
還進行具有XR/CDT-2/GH43-2的釀酒酵母菌株的發酵延長到第10天的實驗。這與先前的發酵相反,之前第6天或更早終止。如圖14所示,在培養物中生長10天後,具有木寡糖轉運蛋白和木糖還原酶的工程化酵母能夠產生聚合度高達6的木糖甙-木糖醇寡聚物,雖然速率較低,並且最終產率低於觀察到的較短的寡聚體,例如木二糖甙-木糖醇。
還進行實驗以進一步研究其它β-木糖苷酶的潛在木糖甙-木糖醇水解酶活性。如圖11所示,發現枯草芽孢桿菌和大腸桿菌都具有與GH43-7同源的蛋白。為了觀察這些蛋白是否實際上具有木糖甙-木糖醇水解酶活性,將純化的枯草芽孢桿菌GH43-7和純化的大腸桿菌GH43-7與木二糖(X2)或木糖甙-木糖醇(xlt2)一起孵育,並分析它們對這些底物的活性。如圖15所示,枯草芽孢桿菌GH43-7和大腸桿菌GH43-7都對木糖甙-木糖醇底物表現出木糖甙-木糖醇水解酶活性。這兩種蛋白還表現出對木二糖底物的β-木糖苷酶活性。因此,這些蛋白是表現出β-木糖苷酶活性(在木寡糖底物上)和木糖甙-木糖醇水解酶活性(在木糖甙-木糖醇寡聚物底物上)的β-木糖苷酶的實例。這與粗糙脈孢黴GH43-7的β-木糖苷酶相反,其表現出弱的β-木糖苷酶活性(在木寡糖底物上),但具有強的木糖甙-木糖醇活性(在木糖甙-木糖醇寡聚物底物上)。總之,測試了來自細菌枯草芽孢桿菌(AAB41091.1)和大腸桿菌(WP_000406872.1)的兩種GH43酶並確認它們能切割木糖甙-木糖醇。
討論
申請人發現廣泛用於工業微生物木糖醇生產的真菌木糖還原酶同樣會減少低聚木糖(XOS)。產物是木糖甙-木糖醇寡聚物((木糖甙)n-木糖醇),這是一組以前不知道是木寡糖代謝中間體的化合物。木糖、XOS,木糖醇和(木糖甙)n-木糖醇的結構描述於圖16中。結果表明能夠作用於木寡糖(XOS)的木糖還原酶可以用於木糖甙-木糖醇寡聚物的生產。
此外,新鑑定的木糖甙-木糖醇-特異性β-木糖苷酶GH43-7廣泛分布在真菌和細菌中(圖11)。這些結果揭示了廣泛使用的XR/XDH途徑天然具有對木寡糖的寬底物特異性,並且真菌和細菌可以使用平行的細胞內β-木糖苷酶水解木寡糖和木糖甙-木糖醇以產生單體木糖和木糖醇。在該實施例中描述的木寡糖轉運和代謝途徑的總結提供在圖12中。為了改善從具有木糖還原酶活性的細胞中用木寡糖底物生產木糖甙-木糖醇寡聚物,應當降低具有木糖甙-木糖醇水解酶活性的蛋白的活性,或完全從細胞中除去,以允許木糖甙-木糖醇寡聚物的積累。
實施例2:具有木寡糖還原酶活性的木糖還原酶的建模
本實施例描述了模擬作用於木寡糖底物的木糖還原酶的建模實驗。
結果
從實施例1,申請人發現並提供了顯示具有木寡糖還原酶活性的木糖還原酶的實例。傳統上認為木糖還原酶催化木糖轉化為木糖醇,但申請人已經表明,這些酶還可以具有木寡糖還原酶活性,可以催化低聚木糖(木寡糖)轉化成木糖甙-木糖醇寡聚物。
為了進一步探索木糖還原酶的木糖還原酶催化活性,申請人進行了建模實驗。在該研究中,分析了假絲酵母木糖還原酶(CtXR,AAC25601.1)(Kavanagh et al.,2002)的結構,CtXR是木幹畢赤酵母蛋白XYL1(SsXR)的高度同源物。回想實施例1,SsXR是發現具有木寡糖還原酶活性的木糖還原酶。
CtXR含有開放的活性位點空腔,可與木糖結合,位於NADH輔因子的結合位點附近(Kavanagh et al.,2002;Kratzer et al.,2006)。申請人發現,特別地,活性位點的開放形狀可以很容易地適應較長的木寡糖底物的結合(圖17)。使用計算對接算法(Trott et al.,2010),發現木二糖在口袋中很好地適應。此外,在蛋白中似乎沒有阻止更長的木寡糖寡聚物結合的任何阻礙物。
總之,申請人已經使用計算對接分析來顯示木糖還原酶(XR)通常具有開放的活性位點,可以容易地適應作為底物的木寡糖。不希望受理論束縛,認為具有可容納作為底物木寡糖的活性位點的木糖還原酶將表現出木寡糖還原酶活性。此外,並且不希望受理論束縛,認為這有助於解釋實施例1中木糖甙-木糖醇寡聚物積累的令人驚奇的發現,因為所分析的木糖還原酶可能能夠適應木寡糖作為底物,通過木寡糖還原酶活性產生木糖甙-木糖醇寡聚物。
實施例3:在酵母中擴展木糖代謝用於植物細胞壁轉化為生物燃料
本實施例詳述了實施例1和2中提供的實驗、數據和信息。用可再生生物質生產可持續生物燃料,將需要有效和完全利用植物細胞壁中的所有豐富的糖。使用纖維素分解真菌粗糙脈孢黴作為模型,申請人已經鑑定了其在半纖維素上生長所需的木寡糖運輸和消耗途徑。在釀酒酵母中重建這種木寡糖利用途徑揭示了真菌木糖還原酶作為木寡糖還原酶,能產生木糖甙-木糖醇寡聚物作為代謝中間體。然後通過兩種水解酶將木寡糖和木糖甙-木糖醇寡聚物水解以產生細胞內木糖和木糖醇。在蔗糖和葡萄糖的共發酵中使用木寡糖轉運蛋白、木寡糖還原酶和串聯的胞內水解酶的木寡糖消耗極大地擴展了酵母使用植物細胞壁衍生的糖的能力,並且具有提高第一代和第二代生物燃料生產效率的潛力。
材料和方法
粗糙脈孢黴菌株
粗糙脈孢黴菌株來自真菌遺傳學庫存中心(FGSC)(McCluskey,Wiest,and Plamann 2010),包括WT(FGSC 2489)和兩種寡糖轉運蛋白的缺失菌株:NCU00801(FGSC 16575)和NCU08114(FGSC 17868)(Colot et al.,2006)。
粗糙脈孢黴生長測定
將分生孢子以106個/mL濃度接種到24深孔板中,每個孔有3mL含有2%w/v(重量/體積)奇崗草粉(Energy Bioscience Institute,UC-Berkeley)、Avicel PH 101(Sigma)、櫸木木聚糖(Sigma)或果膠(Sigma)的Vogel培養基(Vogel,1956)。將板用Corning TM透氣密封帶密封,並在恆定光照、25℃條件下振動(200rpm)培養。在48小時時拍攝圖像。如下所述,在Dionex高效陰離子交換色譜(HPAEC)分析之前,將培養物上清液用0.1M NaOH稀釋200倍。
質粒和酵母菌株
按(http://www.fgsc.net/fgn35/lee35.pdf)和Harju等人所述提取粗糙脈孢黴WT菌株(FGSC 2489)和釀酒酵母S288C菌株的模板基因組DNA(gDNA)(McCluskey and Plamann,2010)。從粗糙脈孢黴gDNA模板擴增β-木糖苷酶基因NCU01900和NCU09652(分別為GH43-2和GH43-7)的開放閱讀框(ORF)。為方便生化分析,每個ORF的C末端與6個組氨酸標籤融合,並與2μ酵母質粒pRS423骨架中的釀酒酵母PTEF1啟動子和CYC1轉錄終止子側接。質粒pRS426_NCU08114先前已有描述(Galazka et al.,2010)。含有樹幹畢赤酵母木糖利用途徑(木糖還原酶、木糖醇脫氫酶和木酮糖激酶)的質粒pLNL78來自John Dueber的實驗室(Latimer et al.,2014)。通過使用In-Fusion克隆試劑盒(Clontech)將NCU08114(CDT-2)和NCU01900(GH43-2)表達框整合到pLNL78中構建質粒pXD2,即單一質粒形式的木寡糖途徑。質粒pXD8.4,衍生自質粒pRS316(Sikorski and Hieter,1989)用於表達帶有PCCW12啟動子的CDT-2和GH43-2。質粒pXD8.6,衍生自pXD8.4,用GH43-7的ORF替代GH43-2的ORF。pXD8.7包含使用各自的PCCW12啟動子的所有三種表達框(CDT-2,GH43-2和GH43-7)。釀酒酵母菌株D452-2(MATa leu2his3ura3can1)(Kurtzman et al.,1994)和SR8U(進化的木糖快速利用菌株SR8的尿嘧啶自養型)(Kim et al.,2013)用於酵母實驗的受體菌株。從粗糙脈孢黴gDNA擴增粗糙脈孢黴木糖還原酶(xyr-1,NcXR)的ORF,通過重疊PCR除去內含子。XR ORF C-末端與6個組氨酸標籤融合,並與釀酒酵母PCCW12啟動子和CYC1轉錄終止子側接,插入質粒pRS313中。表1列出了本研究中使用的質粒。
表1:質粒列表
基於酵母細胞的木寡糖攝取測定
釀酒酵母在缺乏尿嘧啶的優化基礎培養基(oMM)中生長至對數期後期。oMM含有1.7g/L YNB(Sigma,Y1251),2倍適當的CSM無氮源混合物,10g/L(NH4)2SO4,1g/L MgSO4.7H2O,6g/L KH2PO4,100mg/L,100mg/L腺嘌呤半硫酸鹽,10mg/L肌醇,100mg/L穀氨酸,20mg/L賴氨酸,375mg/L絲氨酸和100mM 4-嗎啉乙磺酸(MES),pH 6.0(Lin et al.,提交)。然後收穫細胞並用測定緩衝液(5mM MES,100mM NaCl,pH 6.0)洗滌三次,並重懸至最終OD600為40。用相同測定緩衝液製備濃度為200μM的底物母液。通過混合等體積的細胞懸浮液和底物母液開始轉運的測定。反應在30℃下連續振蕩孵育30分鐘。將樣品在4℃以14,000rpm離心5分鐘除去酵母細胞。將各樣品上清液400μL轉移到含有100μL 0.5M NaOH的HPLC小瓶中,如下所述通過HPAEC測定剩餘底物的濃度。
酶的純化
將轉化酶表達質粒的釀酒酵母菌株在缺少組氨酸的oMM中生長到對數後期,離心收集菌體。將酵母細胞沉澱重懸於含有50mM Tris-HCl、100mM NaCl、0.5mM DTT(pH 7.4)和蛋白酶抑制劑混合物(Pierce)的緩衝液中。將細胞用Avestin勻漿機裂解,將澄清的上清液加載到HisTrap柱(GE Healthcare)上。組氨酸標記的酶用咪唑梯度純化,將緩衝液置換為20mM Tris-HCl、100mM NaCl(pH 7.4),並濃縮至5mg/mL。
酶的測定
對於木寡糖底物的GH43-2β-木糖苷酶的測定:將0.5μM純化的酶與0.1%自製的木寡糖或1mM木二糖(Megazyme)在30℃,1×PBS中孵育。在30分鐘時取樣,並加入5倍體積的0.1mM NaOH滅活。如下所述通過HPAEC分析產物。對於pH分析,加入0.1M的濃度pH 4.0、4.5、5.0、5.5、6.0的醋酸鹽緩衝液和6.5、7.0、7.5、8的磷酸鹽緩衝液。對於木糖甙-木糖醇底物的GH43-2和GH43β-木糖苷酶的測定:將10μM純化的酶與4.5mM木糖甙-木糖醇和0.5mM木二糖在20mM MES緩衝液(pH 7.0)和1mM CaCl2在30℃孵育。在3小時取樣,並通過在99℃加熱10分鐘滅活。如下所述通過離子排阻HPLC分析產物。
對於樹幹畢赤酵母木糖還原酶XR和粗糙脈孢黴木糖還原酶XR的測定:在30℃下將1μM純化的酶與0.06%木寡糖和2mM NADPH(在1×PBS中)一起孵育。在30分鐘時取樣,並通過在99℃下加熱10分鐘滅活。如下所述通過LC-QToF分析產物。
寡糖製備
木寡糖購自Cascade Analytical Reagents and Biochemicals公司,或根據公開的流程(Akpinar et al.,2009),稍作修改製備。簡言之,將20g櫸木木聚糖(Sigma-Aldrich)完全懸浮在1000mL水中,向其中加入13.6mL 18.4M H2SO4。將混合物在150℃油浴中連續攪拌孵育。30分鐘後,將反應物倒入冰上的2L塑料容器中,同時攪拌以使其冷卻。此後,緩慢加入0.25mol CaCO3以中和pH並沉澱硫酸鹽。將上清液過濾並在旋轉蒸發器上50℃濃縮至幹。自製的木寡糖含有約30%的木糖單體和70%的低聚物。為了獲得較大部分的短鏈木寡糖,將商業木寡糖按20%質量體積比(重量/體積)溶解,並與2mg/mL木聚糖酶在37℃下孵育48小時。使用前進行熱失活和過濾。
從含有質粒pXD8.4的菌株SR8的木寡糖培養液中純化木糖甙-木糖醇和寡聚體。將50mL培養物上清液在50℃的旋轉蒸發器上濃縮至約5mL。將過濾的樣品加載到填充有SupelcleanTM ENVI-CarbTM填料(Sigma-Aldrich)的XK 16/70柱子上(GE Healthcare),用Purifier(GE Healthcare)進行純化。在室溫下用乙腈梯度以3.0mL/min的流速洗脫柱。將通過LC-MS驗證的純化組分合併並濃縮。最終的產品,含有90%木糖甙-木糖醇和10%木二糖用於酶活測定的底物和HPLC標準品。
真菌和枯草芽孢桿菌木糖甙-木糖醇生產的測量
粗糙脈孢黴菌株(FGSC 2489)和構巢麴黴儲存並分生在含2%葡萄糖的Volgel培養基(Vogel,1956)的瓊脂斜面上。裡氏木黴(菌株QM6a)在馬鈴薯葡萄糖瓊脂(PDA)平板上分生孢子。通過重懸浮於水中收集每種真菌的分生孢子,並以10 6個/mL細胞的濃度接種。粗糙脈孢黴和構巢麴黴接種到含有2%木寡糖的Volgel培養基中。裡氏木黴接種到含有2%木寡糖的木黴基本培養基(et al.,1987)中。粗糙脈孢黴、構巢麴黴和裡氏木黴分別在25℃、37℃和30℃下在搖瓶中生長。40小時後,收集2mL培養物的菌絲體,並在玻璃纖維過濾器上用水洗滌,並轉移至預冷的具有螺旋蓋的2mL試管中。試管中含有0.5mL Zirconia氧化鋯珠(0.5mm)和1.2mL酸性乙腈提取溶液(80%乙腈,20%H2O和0.1M甲酸)(Rabinowitz和Kimball 2007),然後將試管插入液氮中。收集過程控制在30秒內,將樣品保持在-80℃直至如下所述提取。
枯草芽孢桿菌儲存在0.5×LB(1%胰蛋白腖,0.5%酵母提取物和0.5%NaCl)瓊脂平板上。將單個菌落接種到含有1%葡萄糖的0.5×LB液體培養基中,37℃過夜振蕩培養。將過夜培養物接種到具有1%木聚糖的新鮮0.5×LB液體培養基中,初始OD600為0.2。40小時後,取2mL培養物離心並用冷PBS溶液洗滌。向細胞沉澱中加入Zirconia氧化鋯珠和酸性乙腈提取溶液。試管立即快速冷凍管並保持在-80℃直至提取。
為了提取,使所有樣品在4℃解凍10分鐘,珠磨(bead beat)2分鐘,並在4℃渦旋20分鐘。取每個樣品的50μL上清液通過LC-MS/MS(參見質譜分析部分)分析。
酵母在木寡糖上好氧培養
酵母菌株在含有2%葡萄糖的oMM培養基中好氧預培養過夜,用水洗滌3次,並重懸於oMM培養基中。對於好氧生長,將細胞按起始OD600為1.0接種到50mL含有3%w/v(重量/體積)木寡糖的oMM培養基的250mL錐形瓶中,4層miracl布覆蓋,220rpm振蕩培養。在指定的時間點,取出0.8mL樣品並離心。取20μL上清液通過離子排阻HPLC分析測定木糖、木糖醇、甘油和乙醇濃度。25μL 1:200稀釋或2μL 1:100稀釋的上清液分別通過HPAEC或LC-QToF分析以測定木寡糖濃度。
補料分批厭氧發酵
在1L攪拌罐生物反應器(DASGIP生物反應器系統,DGCS4型,Eppendorf AG)中進行厭氧發酵實驗,培養基為含有3%w/v(重量/體積)木寡糖的oMM培養基,接種的初始細胞濃度OD600=20。在30℃溫度,發酵時間107小時,培養物攪拌轉速200rpm下,並用6L/h的氮氣恆定地吹掃。對於木糖和木寡糖共發酵,以0.8mL/h連續流加25%木糖母液。在發酵期間,每4小時用自動進樣器通過陶瓷取樣針(Seg-Flow Sampling System,Flownamics)取3mL無細胞樣品。取20μL上清液通過離子排阻HPLC分析測定木糖、木糖醇、甘油和乙醇濃度。2μL 1:100稀釋的上清液通過LC-QToF分析以測定木寡糖濃度。對於葡萄糖和木寡糖共發酵,以2mL/h連續流加10%葡萄糖母液。如木糖和木寡糖共發酵所述檢測分析物,增加培養基中葡萄糖濃度的測定。
木糖發酵比較
為了對菌株SR8(XR/XDH)和SXA-R2P-E(XI)之間的木糖發酵進行比較,首先建立YPD上生長的每個菌株每OD600的克細胞乾重,發現兩株菌相當,對於菌株SR8為0.433±0.01g/OD,對於菌株SXA-R2P-E為0.423±0.01g/OD。將酵母菌株SR8或SXA-R2P-E在含有2%葡萄糖的oMM或YSC培養基中好氧預培養至對數中期或後期,用水洗滌3次,根據分批發酵情況,重懸於oMM或YSC培養基中。用如圖所示的一系列起始OD值接種到含有4%w/v(重量/體積)木糖的培養基中,然後用N2吹掃。在裝有50mL的oMM或YSC培養基的125mL血清瓶中進行發酵,在30℃搖床中以220rpm振蕩培養。在指定的時間點,用注射器取出1mL樣品並離心。取5μL上清液通過離子排阻HPLC分析測定木糖、木糖醇、甘油和乙醇濃度。
蔗糖與木寡糖的共發酵
將含有質粒pXD8.7的酵母菌株SR8U在缺乏尿嘧啶並含有2%葡萄糖的oMM培養基中好氧預培養至對數後期,用水洗滌,並重懸於oMM培養基中。用20OD洗滌的酵母種子培養物接種到含有75g/L蔗糖加或減15g/L木寡糖的培養基中,並用N2吹掃。在裝有50mL的oMM或YSC培養基的125mL血清瓶中進行發酵,在30℃搖床中以220rpm振蕩培養。在指定的時間點,用注射器取出1mL樣品並離心。取5μL上清液通過離子排阻HPLC分析測定木糖、木糖醇、甘油和乙醇濃度。如下所述,取2μL 1:100稀釋的上清液通過LC-QToF分析以測定木寡糖濃度。
離子排阻HPLC分析
在裝有示差檢測器的Shimadzu Prominence HPLC儀上進行離子排阻
HPLC。樣品通過Rezex RFQ-Fast Fruit H+8%柱(100×7.8mm Phenomenex),在50℃條件下,以1mL/min的流速分離。木寡糖發酵樣品在Aminex HPX-87H柱(300×7.8mm,Bio-Rad)上使用流動相為0.01N H2SO4,在50℃條件下,以0.6mL/min的流速分離。
HPACE分析
在30℃下使用CarboPac PA200分析柱(150×3mm)和CarboPac PA200保護柱(3×30mm)在ICS-3000HPLC儀(Thermo Fisher)上進行HPAEC分析。在注射25μL稀釋的樣品後,用0.1M NaOH在乙酸鈉梯度的流動相中以0.4mL/min進行洗脫。對於木寡糖和木糖甙-木糖醇分離,乙酸鹽梯度為:0mM 1分鐘,在8分鐘內增加至80mM,在1分鐘內增加至300mM,保持30mM 2分鐘,然後在0mM下重新平衡3分鐘。使用脈衝電流檢測器(PAD)檢測碳水化合物,並使用Chromeleon軟體包分析和定量峰。
質譜分析
所有質譜分析在Agilent 1200 LC-Agilent 6520 Accurate-Mass Q-TOF上進行,使用的柱子是100×7.8mm Rezex RFQ-Fast Fruit H+8%柱(Phenomenex),以0.5%甲酸為流動相,在55℃條件下,以0.3mL/min的流速分離樣品。
為了確定未知代謝物的精確質量,取2μL 1:100稀釋的酵母培養物上清液進行LC-QTOF分析。使用氮氣為載氣。在負離子模式下,源電壓(Vcap)為3,000V,碰撞電壓為100V。乾燥氣溫度為300℃;乾燥氣流量為7L/min;霧化器壓力為45psi。ESI離子源使用單獨的霧化器持續、低量地引入參考質量化合物(112.985587,1033.988109)以維持質量軸的校準。以1Hz採集速率收集數據,掃描範圍m/z 50至1100,以棒狀圖形式存儲。
以LC-MS/MS確認木糖甙-木糖醇和木二糖甙-木糖醇。保留時間(RT)為5.8分鐘且m/z比為283.103的化合物和RT為4.7分鐘且m/z比為415.15的化合物用10、20和40eV的碰撞量碎片化。獲得MS/MS譜圖,產物離子與ChemBioDraw Ultra v13中的碎裂工具產生的計算碎片離子進行比較和匹配。
為了定量培養物中的碳水化合物和碳水化合物衍生物,將培養物上清液用水中稀釋100倍,取2μL通過LC-QToF分析。將譜圖導入到Agilent MassHunter Workstation軟體的定性分析模塊中,使用從校準樣品獲得的m/z和保留時間值來搜索數據中的目標離子。這些搜索基於目標化合物列表生成提取離子色譜圖(EIC)。將峰進行積分並與標準曲線比較以計算濃度。從oMM培養基中製備的校準樣品(與所有樣品一樣)計算出校準曲線,並且對於每個化合物的曲線擬合R2為0.999。以4-嗎啉乙磺酸(MES)為內標(IS)進行濃度校準,MES化合物在oMM培養基中具有恆定濃度且不會被酵母利用。
結果
利用生物法從植物生物質生產生物燃料和可再生化學品,需要經濟的方式將來自植物細胞壁的複雜碳水化合物聚合物轉化為可被微生物發酵的單糖(Carroll et al.,2009;Chundawat et al.,2011)。在目前的工業方法中,植物細胞壁中的兩種主要多糖,纖維素和半纖維素(Somerville et al.,2004)通常分別加工成葡萄糖和木糖的單體(Chundawat et al.,2011)。然而,除了對生物質的苛刻的預處理之外,還需要大量的纖維素酶和半纖維素酶混合物以從植物細胞壁中釋放單糖,導致許多未解決的經濟和後勤的挑戰(Chundawat et al.,2011;Himmel et al.,2007;Jarboe et al.,2010;Lynd et al.,2002)。生物乙醇工業目前使用酵母釀酒酵母將來自玉米澱粉或蔗糖發酵成乙醇(Hong et al.,2012),但是釀酒酵母需要大量的改造才能發酵來源於植物細胞壁的糖,例如纖維二糖和木糖(Kuyper et al.,2005;Jeffries,2006;van Maris et al.,2007;Ha et al.,2011;Hong and Nielsen,2012;Young et al.,2014)。
與釀酒酵母相反,許多纖維素分解真菌包括粗糙脈孢黴(Tian et al.,2009)在植物細胞壁的纖維素和半纖維素組分上自然生長良好。通過分析粗糙脈孢黴的轉錄分析數據(Tian et al.,2009)和敲除菌株生長表型,申請人鑑定了粗糙脈孢黴消耗由其分泌酶釋放的纖維糊精(Galazka et al.,2010)和木寡糖的單獨途徑(圖18A和18B)。缺失了先前鑑定的纖維糊精轉運蛋白(CDT-2,NCU08114)的菌株(Galazka et al.,2010)不能在木聚糖上生長(圖19),並且木寡糖留在培養物上清液中(見圖17)。作為CDT-2的轉運功能的直接測試,表達cdt-2的釀酒酵母菌株能夠導入木二糖、木三糖和木四糖(圖1)。值得注意的是,當在木聚糖上生長時,粗糙脈孢黴能表達假定的細胞內β-木糖苷酶GH43-2(NCU01900)(Sun et al.,2012)。純化的GH43-2對於具有2至8的聚合度(DP)和最適pH 7附近的木寡糖顯示出很強的水解酶活性(圖20A、20B)。在(Cai et al.,2014)中獨立獲得CDT-2和GH43-2的結果。與cdt-1一樣,cdt-2的直系同源物廣泛分布在真菌界(Galazka et al.,2010),這表明許多真菌消耗來自植物細胞壁的木寡糖。此外,如同細胞內β-glucosidases(Galazka et al.,2010)一樣,細胞內β-木糖苷酶也廣泛存在於真菌中(Sun et al.,2012)(圖21)。
來自植物細胞壁的纖維糊精和木寡糖不能被野生型釀酒酵母分解代謝(Matsushika et al.,2009;Galazka et al.,2010;Young and Alper,2010)。在釀酒酵母中重建來自粗糙脈孢黴的纖維糊精運輸和消耗途徑使得該酵母能夠發酵纖維二糖(Galazka et al.,2010)。因此,申請人推斷,表達來自粗糙脈孢黴的、具有功能的木寡糖轉運和消耗系統,可以進一步擴大釀酒酵母利用植物來源的木寡糖作為碳源的能力。之前,釀酒酵母通過工程改造引入木糖異構酶(XI)或木糖還原酶(XR)和木糖醇脫氫酶(XDH)消耗木糖(Jeffries,2006;van Maris et al.,2007;Matsushika et al.,2009)。為了測試釀酒酵母是否可以利用木寡糖,釀酒酵母菌株工程改造了源自樹幹畢赤酵母的XR/XDH途徑進行工程改造,該途徑類似於粗糙脈孢黴中使用的途徑(Sun et al.,2012),還對釀酒酵母菌株工程改造了源自粗糙脈孢黴的木寡糖轉運(CDT-2)和消耗途徑(GH43-2)。表達來自粗糙脈孢黴的CDT-2、來自粗糙脈孢黴的胞內β-木糖苷酶GH43-2和來自樹幹畢赤酵母的XR和XDH的木糖利用酵母,能夠直接利用具有2或3個DP(聚合度)的木寡糖(見圖2A、圖3A-3D)。
值得注意的是,儘管工程化酵母的高細胞密度培養物能夠消耗高達DP 5的木寡糖,但是木糖水平保持很高(見圖2B),這表明在工程化酵母中存在許多未知的瓶頸。這些結果與之前嘗試工程化釀酒酵母用於木寡糖消耗的那些結果類似,那些都報導了木糖在培養基中積累(Fujii et al.,2011)。對表達CDT-2,GH43-2和樹幹畢赤酵母XR/XDH途徑的酵母菌株的培養物的上清液的分析令人驚訝地揭示,木寡糖被轉化成木糖甙-木糖醇寡聚物,一組以前未知的代謝中間體,而不是水解成木糖並消耗(見圖16、圖4A-4B、圖22)。所得木糖甙-木糖醇寡聚物是有效的末端產物,不能被進一步代謝。
由於之前沒有報導作為中間代謝物木糖甙-木糖醇寡聚物產生,需要檢測木糖甙-木糖醇寡聚物生成中涉及的分子成分。為了測試木糖甙-木糖醇寡聚物產生是否由木寡糖與釀酒酵母內源酶的副反應導致,申請人將兩種單獨的酵母菌株在組合培養物中孵育:一種菌株含有由CDT-2和GH43-2組成的木寡糖水解途徑,另一種菌株用XR/XDH木糖消耗途徑工程改造。表達CDT-2和GH43-2的菌株能夠將木寡糖切割成木糖,然後木糖可以通過內源性轉運蛋白分泌(Hamacher et al.,2002),並作為表達木糖消耗途徑(XR和XDH)的菌株的碳源。表達XR和XDH的工程化酵母能夠消耗木糖(見圖2A)。當共培養時,這些菌株消耗木寡糖而不產生木糖甙-木糖醇副產物(見圖5)。這些結果表明內源性酵母酶和GH43-2的轉糖酵解活性不負責產生木糖甙-木糖醇副產物,意味著它們一定由來自樹幹畢赤酵母(SsXR)的XR產生的。
真菌木糖還原酶如SsXR已經在工業上廣泛用於木糖發酵。然而,尚未建立XR活性位點與底物結合的結構細節。為了探索低聚木寡糖的XR還原的分子基礎,分析了與SsXR高度同源的假絲酵母木糖還原酶(CtXR)(Kavanagh et al.,2002)的結構。CtXR含有開放的活性位點空腔,位於NADH輔因子的結合位點附近,可與木糖結合,(Kavanagh et al.,2002;Kratzer et al.,2006)。值得注意的是,活性位點的開放形狀可以容易地適應較長的木寡糖底物的結合(圖17)。使用計算對接算法(Trott and Olson,2010),發現木二糖在口袋中很好地適應。此外,在蛋白中沒有阻止更長的木寡糖低聚物結合的阻礙(圖17)。
申請人推斷,如果木糖甙-木糖醇副產物是由類似於來自樹幹畢赤酵母的真菌XR產生的,則應在粗糙脈孢黴中產生類似的副產物,從而需要額外的途徑來消耗它們。與該假設一致,來自粗糙脈孢黴的木糖還原酶XYR-1(NCU08384)也能從木寡糖產生木糖甙-木糖醇產物(見圖6A-6B)。然而,當粗糙脈孢黴在木聚糖上生長時,培養基中並沒有木糖甙-木糖醇副產物積聚(圖7)。因此,粗糙脈孢黴中想必存在能消耗木糖甙-木糖醇寡聚物的額外酶活性。與該假說一致,發現在木聚糖上生長的粗糙脈孢黴,其假定的第二個β-木糖苷酶表達上調。第二個β-木糖苷酶GH43-7(NCU09625)(Sun et al.,2012)具有很弱的β-木糖苷酶活性,但卻能快速水解木糖甙-木糖醇轉化成木糖和木糖醇(圖8A和8B)。新鑑定的β-木糖苷酶GH43-7,能夠代謝木糖甙-木糖醇,廣泛分布在真菌和細菌中(見圖11、圖23),表明其被各種微生物用於消耗木寡糖。實際上,來自細菌枯草芽孢桿菌和大腸桿菌的GH43-7能切割木寡糖和木糖甙-木糖醇(見圖15)。
為了測試木糖甙-木糖醇是否通常是微生物在半纖維素上生長產生的中間代謝物,申請人提取並分析了許多在木寡糖上生長的子囊菌物和枯草芽孢桿菌的代謝物。值得注意的是,當在木寡糖上生長時,這些廣泛分歧的真菌和枯草芽孢桿菌都能產生木糖甙-木糖醇(圖24A和圖25)。這些生物跨越了10億年的進化(圖24B),表明使用木寡糖還原酶消耗植物半纖維素是廣泛的。
接下來測試完整的木寡糖消耗途徑的整合是否將克服釀酒酵母很差的木寡糖利用能力(見圖2A-2B)(Fujii et al.,2011)。當與原始的木寡糖途徑(CDT-2加GH43-2)組合時,GH43-7使得釀酒酵母在木寡糖上更快地生長(見圖9A),並消除木糖甙-木糖醇中間體的積累(見圖9B-9D、圖10和圖26)。木糖和葡萄糖的存在極大地改善了木寡糖的厭氧發酵(圖27A-27B、圖28和圖29A-29B),表明具有完全木寡糖途徑的釀酒酵母中的代謝途徑可能還需要進行附加的調節(Youk and van Oudenaarden,2009)才能用於最優的木寡糖發酵。總之,這些結果揭示了廣泛用於工程化釀酒酵母中的XR/XDH途徑天然具有對木寡糖的寬底物特異性,並且完全重構天然存在的木寡糖途徑使得釀酒酵母能有效地消耗木寡糖。
已經有人提出將木糖發酵為生物燃料的最佳方法是使用XI而不是XR/XDH途徑(van Maris et al.,2007;Zhou et al.,2012;Lee and Alper,2014)。儘管XI可以原則上替代用於產生細胞內木酮糖的木寡糖消耗途徑中的XR/XDH部分,但是未見發表工程改造使用XI或XR/XDH的最佳酵母菌株的明確比較(Karhumaa et al.,2007)。因此,申請人在厭氧木糖發酵實驗中,比較了在公共領域中表現最佳的兩種工程酵母菌株:使用XR/XDH的菌株SR8(Kim et al.,2013)和使用XI的菌株SXA-R2P-E(Lee and Alper,2014)。與表達XI的菌株SXA-R2P-E相比(圖30、表2),在一系列細胞起始接種濃度(OD600 2.5-20)下,表達XR/XDH的菌株SR8顯示出更高的乙醇生產速率。無論對於從對數中期或後期培養物製備的種子以及在兩種不同的已知成分的培養基中結果都是一樣的(Lin et al.,2014;Lee and Alper,2014)(圖31)。相比之下,菌株SXA-R2P-E具有略微更高的乙醇產率,並且產生更少的木糖醇副產物(圖30、表2和圖31)。值得注意的是,當木寡糖用於發酵時,XR/XDH途徑比木糖產生少得多的木糖醇(圖27A-27B和圖29B)。因此,通過XR/XDH途徑的木寡糖消耗可以導致酵母菌株乙醇生產率和產率都很高,而沒有木糖醇形成。
表2:兩種利用木糖的釀酒酵母菌株的發酵性能比較
1在分批條件下使用三角瓶和40g/L木糖進行厭氧發酵。
2木糖或乙醇的克數/g細胞乾重/小時的最大值。
3g乙醇產量/g木糖。
葡萄糖能促進木葡聚糖發酵,這個觀察結果(圖27B)表明,木寡糖途徑可以更普遍地用於共發酵以增強生物燃料生產。因此,測試木寡糖發酵是否可以與蔗糖發酵同時進行,作為增加甘蔗乙醇產量的手段。在這種情況下,通過熱水處理釋放的木寡糖(Hendriks and Zeeman,2009;Agbor et al.,2011;Evangelina et al.,2012)可以加入到經過木寡糖消耗途徑工程改造的酵母的蔗糖發酵中。為了測試這一點,申請人蔗糖和木寡糖的組合發酵中使用了含有木寡糖途徑(CDT-2、GH43-2和GH43-7)工程改造的菌株SR8。申請人觀察到蔗糖和木寡糖的同時發酵,且乙醇產量增加(圖33)。值得注意的是,如同在葡萄糖的共發酵中觀察到的現象(圖27B),蔗糖共發酵也同樣發現木糖醇產生水平低(圖33)。
使用酵母作為示例性平臺,申請人鑑定了粗糙脈孢黴(圖12)中的木寡糖消耗途徑,令人驚訝地,涉及到一種由許多真菌和細菌廣泛產生的新的代謝中間體。在細菌如枯草芽孢桿菌中,木糖甙-木糖醇可以通過已知具有寬底物特異性的醛-酮還原酶產生(Barski et al.,2008)。在纖維素分解真菌中發現的木寡糖消耗途徑和纖維消耗途徑(Galazka et al.,2010),可以降解植物細胞壁的兩種主要的糖組分,為工程改造酵母發酵植物生物質來源的糖,提供了許多模式(圖12)。XR/XDH途徑還可為來自半纖維素的糖的發酵提供顯著的優點。乙醯化的半纖維素的分解(Sun et al.,2012)釋放高毒性乙酸鹽,降低釀酒酵母發酵的性能(Bellissimi et al.,2009;Sun et al.,2012)。由XR/XDH途徑產生的額外還原力(最初被認為是一個問題)可用於驅動乙酸鹽的還原,從而使發酵培養基解毒並增加乙醇產量(Wei et al.,2013)。
通過優化,新鑑定的木寡糖消耗途徑提供了將玉米澱粉或甘蔗為原料的第一代生物乙醇生產擴展為包括來自植物細胞壁的半纖維素的新機會。例如,如本文所述的實驗,申請人提出通過使用壓縮熱水處理從甘蔗渣中的半纖維素釋放的木寡糖(Hendriks and Zeeman,2009;Agbor et al.,2011;Evangelina et al.,2012),可以被經工程改造、消耗木寡糖的酵母直接發酵(圖33)。結合葡萄糖或纖維糊精消耗的木寡糖消耗(圖12)還可以改進木質纖維素原料生產二代生物燃料遇到的需要許多預處理的問題(Hendriks and Zeeman,2009;Evangelina et al.,2012)。這些途徑可以廣泛用於克服使用可持續和經濟來源的木質纖維素原料發酵生產生物燃料和可再生化學品的所剩餘的瓶頸。
參考文獻
D.C.Savage,Microbial ecology of the gastrointestinal tract.Annu Rev Microbiol 31,107(1977).
M.J.Vazquez,J.L.Alonso,H.Dominguez,J.C.Parajo,Xylooligosaccharides:manufacture and applications.Trends Food Sci Tech 11,387(Nov,2000).
A.A.Aachary,S.G.Prapulla,Xylooligosaccharides(XOS)as an Emerging Prebiotic:
Microbial Synthesis,Utilization,Structural Characterization,Bioactive Properties,and Applications.Compr Rev Food Sci F 10,2(Jan,2011).
J.Schrezenmeir,M.de Vrese,Probiotics,prebiotics,and synbiotics‐approaching a definition.American Journal of Clinical Nutrition 73,361s(Feb,2001).
G.R.Gibson,M.B.Roberfroid,Dietary modulation of the human colonic microbiota:introducing the concept of prebiotics.J Nutr 125,1401(Jun,1995).
M.Okazaki,S.Fujikawa,N.Matsumoto,Effects of xylooligosaccharide on growth of bifidobacteria.Nippon Eiyo Shokuryo Gakkaishi=Journal of the Japanese Society of Nutrition and Food Science 43,395(1990).
C.K.Hsu,J.W.Liao,Y.C.Chung,C.P.Hsieh,Y.C.Chan,Xylooligosaccharides and fructooligosaccharides affect the intestinal microbiota and precancerous colonic lesion development in rats.J Nutr 134,1523(Jun,2004).
A.Azarpazhooh,H.Limeback,H.P.Lawrence,P.S.Shah,Xylitol for preventing acute otitis media in children up to 12 years of age.Cochrane Database Syst Rev,CD007095(2011).
A.Maguire,A.J.Rugg‐Gunn,Xylitol and caries prevention‐‐is it a magic bullet?Br Dent J 194,429(Apr 26,2003).
K.Dietary prevention of dental caries by xylitol‐clinical effectiveness and safety.J Appl Nutr 44,16(1992).
L.Hyvonen,P.Koivistoinen,F.Voirol,Food Technological Evaluation of Xylitol.Adv Food Res 28,373(1982).
T.B.K.Izumori,M.Leisola,A rare sugar xylitol.Part II:biotechnological production and future applications of xylitol.Applied microbiology and biotechnology 74,273(2007).
A.Carroll,C.Somerville,Cellulosic biofuels.Annual Review of Plant Biology 60,165(2009).
S.P.Chundawat,G.T.Beckham,M.E.Himmel,B.E.Dale,Deconstruction of lignocellulosic biomass to fuels and chemicals.Annual Review of Chemical and Biomolecular Engineering 2,121(2011).
C.Somerville et al.,Toward a systems approach to understanding plant cell walls.Science306,2206(2004).
M.E.Himmel et al.,Biomass recalcitrance:engineering plants and enzymes for biofuels production.Science 315,804(2007).
L.R.Jarboe et al.,Metabolic engineering for production of biorenewable fuels and chemicals:contributions of synthetic biology.Journal of Biomedicine&Biotechnology 2010,761042(2010).
L.R.Lynd,P.J.Weimer,W.H.van Zyl,I.S.Pretorius,Microbial cellulose utilization:fundamentals and biotechnology.Microbiology and Molecular Biology Reviews 66,506(2002).
K.K.Hong,J.Nielsen,Metabolic engineering of Saccharomyces cerevisiae:a key cell factory platform for future biorefineries.Cellular and Molecular Life Sciences 69,2671(2012).
S.J.Ha et al.,Engineered Saccharomyces cerevisiae capable of simultaneous cellobiose and xylose fermentation.Proceedings of the National Academy of Sciences of the United States of America 108,504(2011).
M.Kuyper et al.,Metabolic engineering of a xylose-isomerase-expressing Saccharomyces cerevisiae strain for rapid anaerobic xylose fermentation.FEMS Yeast Research 5,399(2005).
E.M.Young,A.Tong,H.Bui,C.Spofford,H.S.Alper,Rewiring yeast sugar transporter preference through modifying a conserved protein motif.Proceedings of the National Academy of Sciences of the United States of America 111,131(2014).
T.W.Jeffries,Engineering yeasts for xylose metabolism.Current Opinion in Biotechnology 17,320(2006).
C.Tian et al.,Systems analysis of plant cell wall degradation by the model filamentous fungus Neurospora crassa.Proceedings of the National Academy of Sciences of the United States of America 106,22157(2009).
J.M.Galazka et al.,Cellodextrin transport in yeast for improved biofuel production.Science330,84(2010).
J.Sun,C.Tian,S.Diamond,N.L.Glass,Deciphering transcriptional regulatory mechanisms associated with hemicellulose degradation in Neurospora crassa.Eukaryotic Cell 11,482(2012).
E.Young,S.M.Lee,H.Alper,Optimizing pentose utilization in yeast:the need for novel tools and approaches.Biotechnology for Biofuels 3,24(2010).
A.Matsushika,H.Inoue,T.Kodaki,S.Sawayama,Ethanol production from xylose in engineered Saccharomyces cerevisiae strains:current state and perspectives.Applied Microbiology and Biotechnology 84,37(2009).
T.Fujii et al.,Ethanol production from xylo-oligosaccharides by xylose-fermenting Saccharomyces cerevisiae expressing beta-xylosidase.Bioscience,Biotechnology,and Biochemistry 75,1140(2011).
K.McCluskey,The Fungal Genetics Stock Center:from molds to molecules.Advances in Applied Microbiology 52,245(2003).
S.Harju,H.Fedosyuk,K.R.Peterson,Rapid isolation of yeast genomic DNA:Bust n'Grab.BMC Biotechnol 4,8(2004).
Latimer,Luke N,Michael E Lee,Daniel Medina-Cleghorn,Rebecca A Kohnz,Daniel K Nomura,and John E Dueber.2014.「Employing a Combinatorial Expression Approach to Characterize Xylose Utilization in Saccharomyces cerevisiae.」Metabolic Engineering 25(September):20–29.doi:10.1016/j.ymben.2014.06.002.
R.S.Sikorski,P.Hieter,A system of shuttle vectors and yeast host strains designed for efficient manipulation of DNA in Saccharomyces cerevisiae.Genetics 122,19(1989).
C.P.Kurtzman,Molecular taxonomy of the yeasts.Yeast 10,1727(1994).
Kim et al.,Rational and evolutionary engineering approaches uncover a small set of genetic changes efficient for rapid xylose fermentation in Saccharomyces cerevisiae.PloS One 8,e57048(2013).
Lin,Yuping,Kulika Chomvong,Ligia Acosta-Sampson,Raíssa Estrela,Jonathan M Galazka,Soo Rin Kim,Yong-Su Jin,and Jamie HD Cate.2014.「Leveraging Transcription Factors to Speed Cellobiose Fermentation by Saccharomyces cerevisiae.」Biotechnol Biofuels 7(1):126.doi:10.1186/s13068-014-0126-6.
O.Akpinar,K.Erdogan,S.Bostanci,Production of xylooligosaccharides by controlled acid hydrolysis of lignocellulosic materials.Carbohydr Res 344,660(2009).
S.F.Altschul et al.,Gapped BLAST and PSI-BLAST:a new generation of protein database search programs.Nucleic Acids Research 25,3389(1997).
R.C.Edgar,MUSCLE:multiple sequence alignment with high accuracy and high throughput.Nucleic Acids Research 32,1792(2004).
K.Tamura,G.Stecher,D.Peterson,A.Filipski,S.Kumar,MEGA6:Molecular Evolutionary Genetics Analysis version 6.0.Molecular Biology and Evolution 30,2725(2013).
L.A.Kelley,M.J.Sternberg,Protein structure prediction on the Web:a case study using the Phyre server.Nature Protocols 4,363(2009).
K.L.Kavanagh,M.Klimacek,B.Nidetzky,D.K.Wilson,The structure of apo and holo forms of xylose reductase,a dimeric aldo-keto reductase from Candida tenuis.Biochemistry 41,8785-8795(2002).
R.Kratzer,S.Leitgeb,D.K.Wilson,B.Nidetzky,Probing the substrate binding site of Candida tenuis xylose reductase(AKR2B5)with site-directed mutagenesis.The Biochemical journal 393,51-58(2006).
O.Trott,A.J.Olson,AutoDock Vina:improving the speed and accuracy of docking with a new scoring function,efficient optimization,and multithreading.Journal of computational chemistry 31,455-461(2010).
Agbor,V B,N Cicek,R Sparling,A Berlin,and D B Levin.2011.「Biomass Pretreatment:Fundamentals Toward Application.」Biotechnol Adv 29(6):675–85.doi:10.1016/j.biotechadv.2011.05.005.
Barski,Oleg A,Srinivas M Tipparaju,and Aruni Bhatnagar.2008.「The Aldo-Keto Reductase Superfamily and Its Role in Drug Metabolism and Detoxification.」Drug Metabolism Reviews 40(4):553–624.doi:10.1080/03602530802431439.
Bellissimi,Eleonora,Johannes P van Dijken,Jack T Pronk,and Antonius J A van Maris.2009.「Effects of Acetic Acid on the Kinetics of Xylose Fermentation by an Engineered,Xylose-Isomerase-Based Saccharomyces cerevisiae Strain.」FEMS Yeast Research 9(3):358–64.doi:10.1111/j.1567-1364.2009.00487.x.
Cai,Pengli,Ruimeng Gu,Bang Wang,Jingen Li,Li Wan,Chaoguang Tian,and Yanhe Ma.2014.「Evidence of a Critical Role for Cellodextrin Transporte 2(CDT-2)in Both Cellulose and Hemicellulose Degradation and Utilization in Neurospora crassa.」Edited by Michael Freitag.PloS One 9(2):e89330.doi:10.1371/journal.pone.0089330.
Colot,Hildur V,Gyungsoon Park,Gloria E Turner,Carol Ringelberg,Christopher M Crew,Liubov Litvinkova,Richard L Weiss,Katherine A Borkovich,and Jay C Dunlap.2006.「A High-Throughput Gene Knockout Procedure for Neurospora Reveals Functions for Multiple Transcription Factors.」Proceedings of the National Academy of Sciences of the United States of America 103(27):10352–57.doi:10.1073/pnas.0601456103.
Coradetti,Samuel T,James P Craig,Yi Xiong,Teresa Shock,Chaoguang Tian,and N Louise Glass.2012.「Conserved and Essential Transcription Factors for Cellulase Gene Expression in Ascomycete Fungi.」Proceedings of the National Academy of Sciences of the United States of America 109(19):7397–7402.doi:10.1073/pnas.1200785109.
Evangelina Vallejos,Maria,Marcia Dib Zambon,Maria Cristina Area,and Antonio Aprigio da Silva Curvelo.2012.「Low Liquid-Solid Ratio(LSR)Hot Water Pretreatment of Sugarcane Bagasse.」Green Chemistry 14(7):1982–89.doi:10.1039/c2gc35397k.
Galagan,James E,Matthew R Henn,Li-Jun Ma,Christina A Cuomo,and Bruce Birren.2005.「Genomics of the Fungal Kingdom:Insights Into Eukaryotic Biology..」Genome Research 15(12):1620–31.doi:10.1101/gr.3767105.
Hamacher,Tanja,Jessica Becker,Márk Gárdonyi,and Eckhard Boles.2002.「Characterization of the Xylose-Transporting Properties of Yeast Hexose Transporters and Their Influence on Xylose Utilization.」Microbiology(Reading,England)148(Pt 9):2783–88.
Hedges,S Blair,Joel Dudley,and Sudhir Kumar.2006.「TimeTree:a Public Knowledge-Base of Divergence Times Among Organisms.」Bioinformatics(Oxford,England)22(23):2971–72.doi:10.1093/bioinformatics/btl505.
Hendriks,A T,and G Zeeman.2009.「Pretreatments to Enhance the Digestibility of Lignocellulosic Biomass.」Bioresour Technol 100(1):10–18.doi:10.1016/j.biortech.2008.05.027.
Karhumaa,Kaisa,Rosa Garcia Sanchez,and Marie-F Gorwa-Grauslund.2007.「Comparison of the Xylose Reductase-Xylitol Dehydrogenase and the Xylose Isomerase Pathways for Xylose Fermentation by Recombinant Saccharomyces cerevisiae.」Microbial Cell Factories 6(1):5.doi:10.1186/1475-2859-6-5.
Lee,Sun-Mi,Taylor Jellison,and Hal S Alper.2014.「Systematic and Evolutionary Engineering of a Xylose Isomerase-Based Pathway in Saccharomyces cerevisiae for Efficient Conversion Yields.」Biotechnol Biofuels 7(1):122.doi:10.1186/s13068-014-0122-x.
McCluskey,K,A Wiest,and M Plamann.2010.「The Fungal Genetics Stock Center:a Repository for 50 Years of Fungal Genetics Research.」Journal of Biosciences 35(1):119–26.
M,H Nevalainen,ME Salminen,and J Knowles.1987.「A Versatile Transformation System for the Cellulolytic Filamentous Fungus Trichoderma reesei.」Gene 61(2):155–64.
Rabinowitz,Joshua D,and Elizabeth Kimball.2007.「Acidic Acetonitrile for Cellular Metabolome Extraction From Escherichia coli.」Analytical Chemistry 79(16):6167–73.doi:10.1021/ac070470c.
van Maris,Antonius J A,Aaron A Winkler,Marko Kuyper,Wim T A M de Laat,Johannes P van Dijken,and Jack T Pronk.2007.「Development of Efficient Xylose Fermentation in Saccharomyces cerevisiae:Xylose Isomerase as a Key Component.」Advances in Biochemical Engineering/Biotechnology 108(Chapter 57).Berlin,Heidelberg:Springer Berlin Heidelberg:179–204.doi:10.1007/10_2007_057.
Vogel,Henry J.1956.「A Convenient Growth Medium for Neurospora(Medium N).」Microbial Genetics Bulletin 13:42–43.
Wei,Na,Josh Quarterman,Soo Rin Kim,Jamie H D Cate,and Yong-Su Jin.2013.「Enhanced Biofuel Production Through Coupled Acetic Acid and Xylose Consumption by Engineered Yeast.」Nature Communications 4(October).doi:10.1038/ncomms3580.
Wellman,Charles H,Peter L Osterloff,and Uzma Mohiuddin.2003.「Fragments of the Earliest Land Plants.」Nature 425(6955):282–85.doi:10.1038/nature01884.
Xiong,Yi,Samuel T Coradetti,Xin Li,Marina A Gritsenko,Therese Clauss,Vlad Petyuk,David Camp,et al.2014.「The Proteome and Phosphoproteome of Neurospora crassa in Response to Cellulose,Sucrose and Carbon Starvation.」Fungal Genetics and Biology:FG&B 72(November):21–33.doi:10.1016/j.fgb.2014.05.005.
Youk,Hyun,and Alexander van Oudenaarden.2009.「Growth Landscape Formed by Perception and Import of Glucose in Yeast.」Nature 462(7275):875–79.doi:10.1038/nature08653.
Zhou,Hang,Jing-Sheng Cheng,Benjamin L Wang,Gerald R Fink,and Gregory Stephanopoulos.2012.「Xylose Isomerase Overexpression Along with Engineering of the Pentose Phosphate Pathway and Evolutionary Engineering Enable Rapid Xylose Utilization and Ethanol Production by Saccharomyces cerevisiae.」Metabolic Engineering 14(6):611–22.doi:10.1016/j.ymben.2012.07.011.
序列表
詹姆斯·H·杜德納·凱特
李欣
木糖甙木糖醇寡聚物的生產方法
PN1651687PZC
PCT/US2015/037115
2015-06-23
62/016,555
2014-06-24
12
FastSEQ for Windows Version 4.0
1
525
PRT
粗糙脈孢黴(N. crassa)
1
Met Gly Ile Phe Asn Lys Lys Pro Val Ala Gln Ala Val Asp Leu Asn
1 5 10 15
Gln Ile Gln Glu Glu Ala Pro Gln Phe Glu Arg Val Asp Trp Lys Lys
20 25 30
Asp Pro Gly Leu Arg Lys Leu Tyr Phe Tyr Ala Phe Ile Leu Cys Ile
35 40 45
Ala Ser Ala Thr Thr Gly Tyr Asp Gly Met Phe Phe Asn Ser Val Gln
50 55 60
Asn Phe Glu Thr Trp Ile Lys Tyr Phe Gly Asp Pro Arg Gly Ser Glu
65 70 75 80
Leu Gly Leu Leu Gly Ala Leu Tyr Gln Ile Gly Ser Ile Gly Ser Ile
85 90 95
Pro Phe Val Pro Leu Leu Thr Asp Asn Phe Gly Arg Lys Thr Pro Ile
100 105 110
Ile Ile Gly Cys Val Ile Met Ile Val Gly Ala Val Leu Gln Ala Thr
115 120 125
Ala Lys Asn Leu Asp Thr Phe Met Gly Gly Arg Thr Met Leu Gly Phe
130 135 140
Gly Asn Ser Leu Ala Gln Ile Ala Ser Pro Met Leu Leu Thr Glu Leu
145 150 155 160
Ala His Pro Gln His Arg Ala Arg Leu Thr Thr Ile Tyr Asn Cys Leu
165 170 175
Trp Asn Val Gly Ala Leu Val Val Ser Trp Leu Ala Phe Gly Thr Asn
180 185 190
Tyr Ile Asn Asn Asp Trp Ser Trp Arg Ile Pro Ala Leu Leu Gln Ala
195 200 205
Phe Pro Ser Ile Ile Gln Leu Leu Gly Ile Trp Trp Val Pro Glu Ser
210 215 220
Pro Arg Phe Leu Ile Ala Lys Asp Lys His Asp Glu Ala Leu His Ile
225 230 235 240
Leu Ala Lys Tyr His Ala Asn Gly Asp Pro Asn His Pro Thr Val Gln
245 250 255
Phe Glu Phe Arg Glu Ile Lys Glu Thr Ile Arg Leu Glu Met Glu Ser
260 265 270
Thr Lys Asn Ser Ser Tyr Leu Asp Phe Phe Lys Ser Arg Gly Asn Arg
275 280 285
Tyr Arg Leu Ala Ile Leu Leu Ser Leu Gly Phe Phe Ser Gln Trp Ser
290 295 300
Gly Asn Ala Ile Ile Ser Asn Tyr Ser Ser Lys Leu Tyr Glu Thr Ala
305 310 315 320
Gly Val Thr Asp Ser Thr Ala Lys Leu Gly Leu Ser Ala Gly Gln Thr
325 330 335
Gly Leu Ala Leu Ile Val Ser Val Thr Met Ala Leu Leu Val Asp Lys
340 345 350
Leu Gly Arg Arg Leu Ala Phe Leu Ala Ser Thr Gly Gly Met Cys Gly
355 360 365
Thr Phe Val Ile Trp Thr Leu Thr Ala Gly Leu Tyr Gly Glu His Arg
370 375 380
Leu Lys Gly Ala Asp Lys Ala Met Ile Phe Phe Ile Trp Val Phe Gly
385 390 395 400
Ile Phe Tyr Ser Leu Ala Trp Ser Gly Leu Leu Val Gly Tyr Ala Ile
405 410 415
Glu Ile Leu Pro Tyr Arg Leu Arg Gly Lys Gly Leu Met Val Met Asn
420 425 430
Met Ser Val Gln Cys Ala Leu Thr Leu Asn Thr Tyr Ala Asn Pro Val
435 440 445
Ala Phe Asp Tyr Phe Gly Pro Asp His Ser Trp Lys Leu Tyr Leu Ile
450 455 460
Tyr Thr Cys Trp Ile Ala Ala Glu Phe Val Phe Val Phe Phe Met Tyr
465 470 475 480
Val Glu Thr Lys Gly Pro Thr Leu Glu Glu Leu Ala Lys Val Ile Asp
485 490 495
Gly Asp Glu Ala Asp Val Ala His Ile Asp Ile His Gln Val Glu Lys
500 505 510
Glu Val Glu Ile His Glu His Glu Gly Lys Ser Val Ala
515 520 525
2
318
PRT
樹幹畢赤酵母(Scheffersomyces stipitis)
2
Met Pro Ser Ile Lys Leu Asn Ser Gly Tyr Asp Met Pro Ala Val Gly
1 5 10 15
Phe Gly Cys Trp Lys Val Asp Val Asp Thr Cys Ser Glu Gln Ile Tyr
20 25 30
Arg Ala Ile Lys Thr Gly Tyr Arg Leu Phe Asp Gly Ala Glu Asp Tyr
35 40 45
Ala Asn Glu Lys Leu Val Gly Ala Gly Val Lys Lys Ala Ile Asp Glu
50 55 60
Gly Ile Val Lys Arg Glu Asp Leu Phe Leu Thr Ser Lys Leu Trp Asn
65 70 75 80
Asn Tyr His His Pro Asp Asn Val Glu Lys Ala Leu Asn Arg Thr Leu
85 90 95
Ser Asp Leu Gln Val Asp Tyr Val Asp Leu Phe Leu Ile His Phe Pro
100 105 110
Val Thr Phe Lys Phe Val Pro Leu Glu Glu Lys Tyr Pro Pro Gly Phe
115 120 125
Tyr Cys Gly Lys Gly Asp Asn Phe Asp Tyr Glu Asp Val Pro Ile Leu
130 135 140
Glu Thr Trp Lys Ala Leu Glu Lys Leu Val Lys Ala Gly Lys Ile Arg
145 150 155 160
Ser Ile Gly Val Ser Asn Phe Pro Gly Ala Leu Leu Leu Asp Leu Leu
165 170 175
Arg Gly Ala Thr Ile Lys Pro Ser Val Leu Gln Val Glu His His Pro
180 185 190
Tyr Leu Gln Gln Pro Arg Leu Ile Glu Phe Ala Gln Ser Arg Gly Ile
195 200 205
Ala Val Thr Ala Tyr Ser Ser Phe Gly Pro Gln Ser Phe Val Glu Leu
210 215 220
Asn Gln Gly Arg Ala Leu Asn Thr Ser Pro Leu Phe Glu Asn Glu Thr
225 230 235 240
Ile Lys Ala Ile Ala Ala Lys His Gly Lys Ser Pro Ala Gln Val Leu
245 250 255
Leu Arg Trp Ser Ser Gln Arg Gly Ile Ala Ile Ile Pro Lys Ser Asn
260 265 270
Thr Val Pro Arg Leu Leu Glu Asn Lys Asp Val Asn Ser Phe Asp Leu
275 280 285
Asp Glu Gln Asp Phe Ala Asp Ile Ala Lys Leu Asp Ile Asn Leu Arg
290 295 300
Phe Asn Asp Pro Trp Asp Trp Asp Lys Ile Pro Ile Phe Val
305 310 315
3
322
PRT
粗糙脈孢黴(N. crassa)
3
Met Val Pro Ala Ile Lys Leu Asn Ser Gly Phe Asp Met Pro Gln Val
1 5 10 15
Gly Phe Gly Leu Trp Lys Val Asp Gly Ser Ile Ala Ser Asp Val Val
20 25 30
Tyr Asn Ala Ile Lys Ala Gly Tyr Arg Leu Phe Asp Gly Ala Cys Asp
35 40 45
Tyr Gly Asn Glu Val Glu Cys Gly Gln Gly Val Ala Arg Ala Ile Lys
50 55 60
Glu Gly Ile Val Lys Arg Glu Glu Leu Phe Ile Val Ser Lys Leu Trp
65 70 75 80
Asn Thr Phe His Asp Gly Asp Arg Val Glu Pro Ile Val Arg Lys Gln
85 90 95
Leu Ala Asp Trp Gly Leu Glu Tyr Phe Asp Leu Tyr Leu Ile His Phe
100 105 110
Pro Val Ala Leu Glu Tyr Val Asp Pro Ser Val Arg Tyr Pro Pro Gly
115 120 125
Trp His Phe Asp Gly Lys Ser Glu Ile Arg Pro Ser Lys Ala Thr Ile
130 135 140
Gln Glu Thr Trp Thr Ala Met Glu Ser Leu Val Glu Lys Gly Leu Ser
145 150 155 160
Lys Ser Ile Gly Val Ser Asn Phe Gln Ala Gln Leu Leu Tyr Asp Leu
165 170 175
Leu Arg Tyr Ala Lys Val Arg Pro Ala Thr Leu Gln Ile Glu His His
180 185 190
Pro Tyr Leu Val Gln Gln Asn Leu Leu Asn Leu Ala Lys Ala Glu Gly
195 200 205
Ile Ala Val Thr Ala Tyr Ser Ser Phe Gly Pro Ala Ser Phe Arg Glu
210 215 220
Phe Asn Met Glu His Ala Gln Lys Leu Gln Pro Leu Leu Glu Asp Pro
225 230 235 240
Thr Ile Lys Ala Ile Gly Asp Lys Tyr Asn Lys Asp Pro Ala Gln Val
245 250 255
Leu Leu Arg Trp Ala Thr Gln Arg Gly Leu Ala Ile Ile Pro Lys Ser
260 265 270
Ser Arg Glu Ala Thr Met Lys Ser Asn Leu Asn Ser Leu Asp Phe Asp
275 280 285
Leu Ser Glu Glu Asp Ile Lys Thr Ile Ser Gly Phe Asp Arg Gly Ile
290 295 300
Arg Phe Asn Gln Pro Thr Asn Tyr Phe Ser Ala Glu Asn Leu Trp Ile
305 310 315 320
Phe Gly
4
543
PRT
粗糙脈孢黴(N. crassa)
4
Met Pro Leu Val Lys Asn Pro Ile Leu Pro Gly Phe Asn Pro Asp Pro
1 5 10 15
Ser Val Leu Arg Val Gly Gln Asp Tyr Tyr Ile Ala Thr Ser Thr Phe
20 25 30
Glu Trp Tyr Pro Gly Val Gln Ile His His Ser Thr Asp Leu Ala Asn
35 40 45
Trp Thr Leu Leu Thr Arg Pro Leu Asn Arg Lys Ser Gln Leu Asp Met
50 55 60
Arg Gly Asp Pro Asp Ser Cys Gly Val Trp Ala Pro Cys Leu Ser His
65 70 75 80
Asp Gly Asp Lys Phe Trp Leu Val Tyr Thr Asp Val Lys Arg Lys Asp
85 90 95
Gly Ser Phe Lys Asp Ala His Asn Phe Ile Val Trp Ala Asp Lys Ile
100 105 110
Asp Gly Glu Trp Ser Asp Pro Val Tyr Val Asn Ser Ser Gly Phe Asp
115 120 125
Pro Ser Leu Phe His Asp Pro Asp Ser Gly Lys Lys Tyr Phe Val Asn
130 135 140
Met Leu Trp Asp His Arg Arg Arg Pro Leu Leu Phe Ala Gly Ile Ala
145 150 155 160
Val Gln Glu Trp Asp Ala Lys Thr Lys Lys Leu Val Gly Glu Arg Lys
165 170 175
Asn Val Tyr Gln Gly Thr Glu Leu Ala Leu Ala Glu Ala Pro His Val
180 185 190
Tyr Lys Arg Asn Gly Trp Tyr Tyr Leu Leu Ile Ala Glu Gly Gly Thr
195 200 205
Gly Tyr Glu His Ala Cys Thr Leu Ala Arg Ser Lys Asp Ile Trp Gly
210 215 220
Pro Tyr Lys Thr His Pro Glu Lys His Val Leu Thr Ser Lys Asp His
225 230 235 240
Pro Arg Ala Ala Leu Gln Arg Ala Gly His Gly Asp Ile Val Glu Ile
245 250 255
Glu Asp Gly Arg Thr Tyr Leu Val His Leu Thr Gly Arg Pro Thr Thr
260 265 270
Gln Leu Arg Arg Cys Val Leu Gly Arg Glu Thr Ala Ile Gln Glu Cys
275 280 285
Tyr Trp Lys Asp Asp Trp Leu Tyr Val Lys Asn Gly Pro Val Pro Ser
290 295 300
Leu Trp Val Asp Leu Leu Gly Glu Arg Asp Glu Ser Lys Tyr Trp Glu
305 310 315 320
Glu Lys Arg Tyr Thr Phe Lys Asp Gly Leu His Lys Asp Phe Gln Trp
325 330 335
Leu Arg Thr Pro Glu Thr Glu Arg Ile Phe Asn Val Lys Asp Gly Lys
340 345 350
Leu Thr Leu Ile Gly Arg Glu Ala Ile Gly Ser Trp Phe Glu Gln Ala
355 360 365
Leu Val Ala Arg Arg Gln Glu His Phe Ser Tyr Asp Ala Glu Thr Val
370 375 380
Ile Asp Phe Ser Pro Thr Asp Glu Arg Gln Phe Ala Gly Leu Thr Ala
385 390 395 400
Tyr Tyr Cys Arg Tyr Asn Phe Phe Tyr Leu Thr Val Thr Ala His Ser
405 410 415
Asp Gly Gln Arg Glu Leu Leu Ile Met Ser Ser Glu Ala Ser Trp Pro
420 425 430
Ile Gly Asn Leu Asn Thr Pro Tyr Val Pro Tyr Val Gln Ile Pro Asn
435 440 445
Glu Gly Lys Val Lys Leu Ala Leu Thr Ile Arg Gly Asn Gln Leu Gln
450 455 460
Phe Tyr Tyr Ala Val Leu Asp Ser Gly Asp Glu Glu Leu Lys Lys Ile
465 470 475 480
Gly Pro Val Phe Asp Ala Ser Ile Val Ser Asp Glu Cys Gly Gly His
485 490 495
Gln Gln His Gly Ser Phe Thr Gly Ala Phe Val Gly Val Ala Ala Ser
500 505 510
Asp Leu Asn Gly Leu Ala Ala Glu Ala Lys Phe Asp Tyr Leu Leu Tyr
515 520 525
Lys Pro Val Lys Asn Gln Gln Asp Ala Tyr Val Arg Asp Asn Glu
530 535 540
5
533
PRT
枯草芽孢桿菌(Bacillus subtilis)
5
Met Lys Ile Thr Asn Pro Val Leu Lys Gly Phe Asn Pro Asp Pro Ser
1 5 10 15
Ile Cys Arg Ala Gly Glu Asp Tyr Tyr Ile Ala Val Ser Thr Phe Glu
20 25 30
Trp Phe Pro Gly Val Gln Ile His His Ser Lys Asp Leu Val Asn Trp
35 40 45
His Leu Val Ala His Pro Leu Gln Arg Val Ser Gln Leu Asp Met Lys
50 55 60
Gly Asn Pro Asn Ser Gly Gly Val Trp Ala Pro Cys Leu Ser Tyr Ser
65 70 75 80
Asp Gly Lys Phe Trp Leu Ile Tyr Thr Asp Val Lys Val Val Asp Gly
85 90 95
Ala Trp Lys Asp Cys His Asn Tyr Leu Val Thr Cys Glu Thr Ile Asn
100 105 110
Gly Asp Trp Ser Glu Pro Ile Lys Leu Asn Ser Ser Gly Phe Asp Ala
115 120 125
Ser Leu Phe His Asp Thr Asp Gly Lys Lys Tyr Leu Leu Asn Met Leu
130 135 140
Trp Asp His Arg Ile Asp Arg His Ser Phe Gly Gly Ile Val Ile Gln
145 150 155 160
Glu Tyr Ser Asp Lys Glu Gln Lys Leu Ile Gly Lys Pro Lys Val Ile
165 170 175
Phe Glu Gly Thr Asp Arg Lys Leu Thr Glu Ala Pro His Leu Tyr His
180 185 190
Ile Gly Asn Tyr Tyr Tyr Leu Leu Thr Ala Glu Gly Gly Thr Arg Tyr
195 200 205
Glu His Ala Ala Thr Ile Ala Arg Ser Ala Asn Ile Glu Gly Pro Tyr
210 215 220
Glu Val His Pro Asp Asn Pro Ile Leu Thr Ser Trp His Asp Pro Gly
225 230 235 240
Asn Pro Leu Gln Lys Cys Gly His Ala Ser Ile Val Gln Thr His Thr
245 250 255
Asp Glu Trp Tyr Leu Ala His Leu Thr Gly Arg Pro Ile His Pro Asp
260 265 270
Asp Asp Ser Ile Phe Gln Gln Arg Gly Tyr Cys Pro Leu Gly Arg Glu
275 280 285
Thr Ala Ile Gln Lys Leu Tyr Trp Lys Asp Glu Trp Pro Tyr Val Val
290 295 300
Gly Gly Lys Glu Gly Ser Leu Glu Val Asp Ala Pro Ser Ile Pro Glu
305 310 315 320
Thr Ile Phe Glu Ala Thr Tyr Pro Glu Val Asp Glu Phe Glu Asp Ser
325 330 335
Thr Leu Asn Ile Asn Phe Gln Thr Leu Arg Ile Pro Phe Thr Asn Glu
340 345 350
Leu Gly Ser Leu Thr Gln Ala Pro Asn His Leu Arg Leu Phe Gly His
355 360 365
Glu Ser Leu Thr Ser Thr Phe Thr Gln Ala Phe Val Ala Arg Arg Trp
370 375 380
Gln Ser Leu His Phe Glu Ala Glu Thr Ala Val Glu Phe Tyr Pro Glu
385 390 395 400
Asn Phe Gln Gln Ala Ala Gly Leu Val Asn Tyr Tyr Asn Thr Glu Asn
405 410 415
Trp Thr Ala Leu Gln Val Thr His Asp Glu Glu Leu Gly Arg Ile Leu
420 425 430
Glu Leu Thr Ile Cys Asp Asn Phe Ser Phe Ser Gln Pro Leu Asn Asn
435 440 445
Lys Ile Val Ile Pro Arg Glu Val Lys Tyr Val Tyr Leu Arg Val Asn
450 455 460
Ile Glu Lys Asp Lys Tyr Tyr Tyr Phe Tyr Ser Phe Asn Lys Glu Asp
465 470 475 480
Trp His Lys Ile Asp Ile Ala Leu Glu Ser Lys Lys Leu Ser Asp Asp
485 490 495
Tyr Ile Arg Gly Gly Gly Phe Phe Thr Gly Ala Phe Val Gly Met Gln
500 505 510
Cys Gln Asp Thr Gly Gly Asn His Ile Pro Ala Asp Phe Arg Tyr Phe
515 520 525
Arg Tyr Lys Glu Lys
530
6
536
PRT
大腸桿菌(Escherichia coli)
6
Met Glu Ile Thr Asn Pro Ile Leu Thr Gly Phe Asn Pro Asp Pro Ser
1 5 10 15
Leu Cys Arg Gln Gly Glu Asp Tyr Tyr Ile Ala Thr Ser Thr Phe Glu
20 25 30
Trp Phe Pro Gly Val Arg Ile Tyr His Ser Arg Asp Leu Lys Asn Trp
35 40 45
Ser Leu Val Ser Thr Pro Leu Asp Arg Val Ser Met Leu Asp Met Lys
50 55 60
Gly Asn Pro Asp Ser Gly Gly Ile Trp Ala Pro Cys Leu Ser Tyr Ala
65 70 75 80
Asp Gly Lys Phe Trp Leu Leu Tyr Thr Asp Val Lys Ile Val Asp Ser
85 90 95
Pro Trp Lys Asn Gly Arg Asn Phe Leu Val Thr Ala Pro Ser Ile Glu
100 105 110
Gly Pro Trp Ser Glu Pro Ile Pro Met Gly Asn Gly Gly Phe Asp Pro
115 120 125
Ser Leu Phe His Asp Asp Asp Gly Arg Lys Tyr Tyr Ile Tyr Arg Pro
130 135 140
Trp Gly Pro Arg His His Ser Asn Pro His Asn Thr Ile Val Leu Gln
145 150 155 160
Ala Phe Asp Pro Gln Thr Gly Thr Leu Ser Pro Glu Arg Lys Thr Leu
165 170 175
Phe Thr Gly Thr Pro Leu Cys Tyr Thr Glu Gly Ala His Leu Tyr Arg
180 185 190
His Ala Gly Trp Tyr Tyr Leu Met Val Ala Glu Gly Gly Thr Ser Tyr
195 200 205
Glu His Ala Val Val Val Leu Arg Ser Lys Asn Ile Asp Gly Pro Tyr
210 215 220
Glu Leu His Pro Asp Val Thr Met Met Thr Ser Trp His Leu Pro Glu
225 230 235 240
Asn Pro Leu Gln Lys Ser Gly His Gly Ser Leu Leu Gln Thr His Thr
245 250 255
Gly Glu Trp Tyr Met Ala Tyr Leu Thr Ser Arg Pro Leu Arg Leu Pro
260 265 270
Gly Val Pro Leu Leu Ala Ser Gly Gly Arg Gly Tyr Cys Pro Leu Gly
275 280 285
Arg Glu Thr Gly Ile Ala Arg Ile Glu Trp Arg Asp Gly Trp Pro Tyr
290 295 300
Val Glu Gly Gly Lys His Ala Gln Leu Thr Val Lys Gly Pro Gln Val
305 310 315 320
Ala Glu Gln Pro Ala Ala Val Pro Gly Asn Trp Arg Asp Asp Phe Asp
325 330 335
Ala Ser Ser Leu Asp Pro Glu Leu Gln Thr Leu Arg Ile Pro Phe Asp
340 345 350
Asp Thr Leu Gly Ser Leu Thr Ala Arg Pro Gly Phe Leu Arg Leu Tyr
355 360 365
Gly Asn Asp Ser Leu Asn Ser Thr Phe Thr Gln Ser Thr Val Ala Arg
370 375 380
Arg Trp Gln His Phe Ala Phe Arg Ala Glu Thr Arg Met Glu Phe Ser
385 390 395 400
Pro Val His Phe Gln Gln Ser Ala Gly Leu Thr Cys Tyr Tyr Asn Ser
405 410 415
Lys Asn Trp Ser Tyr Cys Phe Val Asp Tyr Glu Glu Gly Gln Gly Arg
420 425 430
Thr Ile Lys Val Ile Gln Leu Asp His Asn Val Pro Ser Trp Pro Leu
435 440 445
His Glu Gln Pro Ile Pro Val Pro Glu His Ala Glu Ser Val Trp Leu
450 455 460
Arg Val Asp Val Asp Thr Leu Val Tyr Arg Tyr Ser Tyr Ser Phe Asp
465 470 475 480
Gly Glu Thr Trp His Thr Val Pro Val Thr Tyr Glu Ala Trp Lys Leu
485 490 495
Ser Asp Asp Tyr Ile Gly Gly Arg Gly Phe Phe Thr Gly Ala Phe Val
500 505 510
Gly Leu His Cys Glu Asp Ile Ser Gly Asp Gly Cys Tyr Ala Asp Phe
515 520 525
Asp Tyr Phe Thr Tyr Glu Pro Val
530 535
7
9
PRT
人工序列
合成構建體
變體
2
Xaa = 任何胺基酸
7
Arg Xaa Leu Tyr Thr Gly Tyr Asp Gly
1 5
8
8
PRT
人工序列
合成構建體
變體
6, 7
Xaa = 任何胺基酸
8
Gly Phe Gly Asn Ser Xaa Xaa Gln
1 5
9
8
PRT
人工序列
合成構建體
變體
3
Xaa = 任何胺基酸
9
Leu Leu Xaa His Pro Gln His Arg
1 5
10
8
PRT
人工序列
合成構建體
變體
2
Xaa = Phe或Tyr
變體
3
Xaa = 任何胺基酸
變體
6
Xaa = Arg或Lys
變體
7
Xaa = Asp或Glu
10
Glu Xaa Xaa Glu Ile Xaa Xaa Thr
1 5
11
4
PRT
人工序列
合成構建體
11
Trp Ser Gly Leu
1
12
6
PRT
人工序列
合成構建體
12
Gly Pro Thr Leu Glu Glu
1 5
