一種新的三萜化合物及其製備方法和醫藥用途與流程
2023-09-16 08:10:35
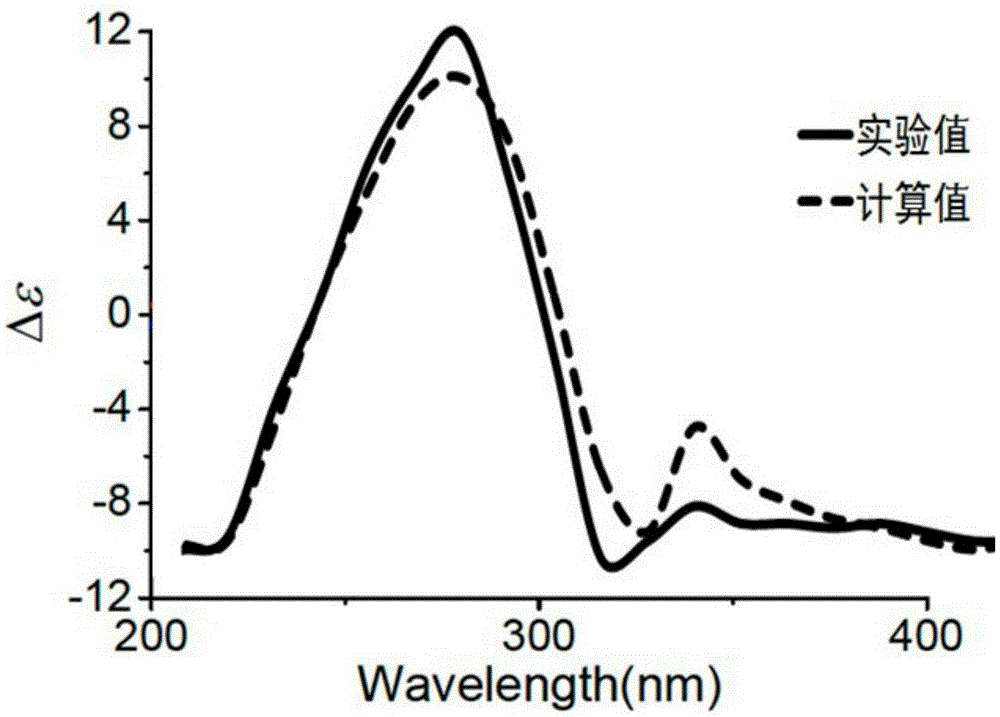
本發明屬於藥物
技術領域:
,具體涉及從補骨脂乾燥成熟果實中分離得到的一種具有肝臟保護作用的三萜化合物及其製備方法。
背景技術:
:補骨脂為豆科植物補骨脂PsoraleacorylifoliaL.的乾燥成熟果實,始載於《雷公炮灸論》,具有補腎助陽、納氣、止瀉的功效。歷代中醫用於腎虛、冷瀉、遺滑精、小便頻數、腰膝冷痛;外治用於皮膚病、白癜風等。補骨脂臨床應用廣泛,2010年版《中華人民共和國藥典》收錄含補骨脂的中成藥有20餘種。補骨脂化學化成分的研究最早見於1910年。自1933年從補骨脂中分離得到第一個純品補骨脂(Psoralen),至今已分離鑑定了四十餘種成分。近年來,又從中分得許多新的香豆素、黃酮及其他成分。目前,國內外學者對其化學成分研究較多,主要成分為香豆素類,黃酮類和三萜類化合物。(1)香豆素類:有呋喃香豆素如補骨脂素(Psoralen)和異補骨脂素(Isopsoralen)。擬雌內酯類如補骨脂定(Psoralidin)和雙輕異補骨脂定(Eorylidin)。(2)黃酮類化合物,如查爾酮類:補骨脂甲素(Ocrylioflni)和補骨脂乙素(Eorylioflinin)。二氫黃酮類:補骨脂二氫黃酮(Bavaehin)、補骨脂二氫甲醚(Bavaehinin)和異補骨脂二氫黃酮(Isobavaehin)。異黃酮類:補骨脂異黃酮(Eorylin)和補骨脂醇黃酮體化合物。(3)單萜酚類:補骨脂酚(Bakuehiol)。(4)三萜類。(5)其它類成分有豆甾醇、β-谷甾醇葡萄糖苷、三十烷、葡萄糖、棉子糖、對輕基苯甲酸、樹酯、結構未定的補骨脂醛、兩種葡萄糖苷等三十餘種物質。技術實現要素:本發明的目的是提供一種從補骨脂乾燥成熟果實中分離得到的一種具有肝臟保護作用的三萜化合物及其製備方法。本發明的上述目的是通過下面的技術方案得以實現的:具有下述結構式的化合物(Ⅰ),所述的化合物(Ⅰ)的製備方法,包含以下操作步驟:(a)補骨脂乾燥的成熟果實粉碎,用85%乙醇熱回流提取,合併提取液,濃縮至無醇味,依次用石油醚、乙酸乙酯和水飽和的正丁醇萃取,分別得到石油醚萃取物、乙酸乙酯萃取物和正丁醇萃取物;(b)步驟(a)中乙酸乙酯萃取物用大孔樹脂除雜,依次用15%乙醇和75%乙醇洗脫,收集75%乙醇洗脫液,減壓濃縮得75%乙醇洗脫物浸膏;(c)步驟(b)中75%乙醇洗脫浸膏用正相矽膠分離,依次用體積比為80:1、50:1、30:1、15:1和1:1的二氯甲烷-甲醇梯度洗脫得到5個組分;(d)步驟(c)中組分4用正相矽膠進一步分離,依次用體積比為20:1、12:1和5:1的二氯甲烷-甲醇梯度洗脫得到3個組分;(e)步驟(d)中組分2用十八烷基矽烷鍵合的反相矽膠分離,用體積百分濃度為70%的甲醇水溶液等度洗脫,收集8-10個柱體積洗脫液,洗脫液減壓濃縮得到純的化合物(Ⅰ)。進一步地,所述大孔樹脂為AB-8型大孔吸附樹脂。藥物組合物,其中含有治療有效量的所述的化合物(Ⅰ)和藥學上可接受的載體。所述的化合物(Ⅰ)在製備肝臟保護的藥物中的應用。所述的藥物組合物在製備肝臟保護的藥物中的應用。本發明化合物用作藥物時,可以直接使用,或者以藥物組合物的形式使用。該藥物組合物含有治療有效量的本發明化合物(Ⅰ),其餘為藥物學上可接受的、對人和動物無毒和惰性的可藥用載體和/或賦形劑。所述的可藥用載體或賦形劑是一種或多種選自固體、半固體和液體稀釋劑、填料以及藥物製品輔劑。將本發明的藥物組合物以單位體重服用量的形式使用。本發明藥物可通過口服或注射的形式施用於需要治療的患者。用於口服時,可將其製成片劑、緩釋片、控釋片、膠囊、滴丸、微丸、混懸劑、乳劑、散劑或顆粒劑、口服液等;用於注射時,可製成滅菌的水 性或油性溶液、無菌粉針、脂質體或乳劑等。說明書附圖圖1為化合物(Ⅰ)結構式;圖2為化合物(Ⅰ)理論ECD值與實驗ECD值比較;圖3為化合物(Ⅰ)NOESY譜圖。具體實施方式下面結合實施例進一步說明本發明的實質性內容,但並不以此限定本發明保護範圍。儘管參照較佳實施例對本發明作了詳細說明,本領域的普通技術人員應當理解,可以對本發明的技術方案進行修改或者等同替換,而不脫離本發明技術方案的實質和範圍。實施例1:化合物(Ⅰ)分離製備及結構確證試劑來源:乙醇、石油醚、乙酸乙酯、正丁醇、二氯甲烷為分析純,購自上海凌峰化學試劑有限公司,甲醇,分析純,購自江蘇漢邦化學試劑有限公司。製備方法:(a)補骨脂乾燥的成熟果實(8kg)粉碎,用85%乙醇熱回流提取(25L×3次),合併提取液,濃縮至無醇味(6L),依次用石油醚(6L×3次)、乙酸乙酯(6L×3次)和水飽和的正丁醇(6L×3次)萃取,分別得到石油醚萃取物、乙酸乙酯萃取物(355g)和正丁醇萃取物;(b)步驟(a)中乙酸乙酯萃取物用AB-8型大孔樹脂除雜,依次用15%乙醇(8L)和75%(12L)乙醇洗脫,收集75%乙醇洗脫液,減壓濃縮得75%乙醇洗脫物浸膏(136g);(c)步驟(b)中75%乙醇洗脫浸膏用正相矽膠分離,依次用體積比為80:1(8個柱體積)、50:1(8個柱體積)、30:1(6個柱體積)、15:1(8個柱體積)和1:1(5個柱體積)的二氯甲烷-甲醇梯度洗脫得到5個組分;(d)步驟(c)中組分4(31g)用正相矽膠進一步分離,依次用體積比為20:1(8個柱體積)、12:1(10個柱體積)和5:1(6個柱體積)的二氯甲烷-甲醇梯度洗脫得到3個組分;(e)步驟(d)中組分2(11g)用十八烷基矽烷鍵合的反相矽膠分離,用體積百分濃度為70%的甲醇水溶液等度洗脫,收集8-10個柱體積洗脫液,洗脫液減壓濃縮得到純的化合物(Ⅰ)(23mg)。結構確證:白色粉末,易溶於氯仿、乙酸乙酯、丙酮和甲醇;HR-ESIMS顯示[M+Na]+為m/z495.3512,結合核磁特徵可得分子式為C30H48O4,不飽和度為7。核磁共振氫譜數據δH(ppm,DMSO-d6,400MHz):H-1(1.55,m),H-1(1.86,m),H-2(2.32,ddd,J=1.7,6.4,14.0),H-2(2.74,dt,J=6.4,14.0),H-3(3.93,m),H-5(1.73,m),H-6(1.17,m),H-6(2.07,m),H-7(0.95,m),H-7(1.58,m),H-8(1.60,m),H-11(1.38,m),H-11(1.60,m),H-12(1.35,m),H-12(1.40,m),H-15(1.61,m),H-15(1.75,m),H-16(1.35,m),H-16(1.97,m),H-17(2.23,m),H-18(0.96,s),H-19(0.78,d, J=4.0),H-19(0.58,d,J=4.0),H-20(1.76,m),H-21(3.41,dd,J=11.6,2.4),H-21(3.96,d,J=11.6),H-22(1.52,m),H-22(2.07,m),H-24(2.91,s),H-26(1.31,s),H-27(1.28,s),H-28(1.09,s),H-29(0.91,s),H-30(1.04,s);核磁共振碳譜數據δC(ppm,DMSO-d6,400Hz):33.6(CH2,1-C),37.7(CH2,2-C),64.7(CH,3-C),50.4(C,4-C),48.6(CH,5-C),26.8(CH2,6-C),21.7(CH2,7-C),49.1(CH,8-C),21.1(C,9-C),26.1(C,10-C),26.1(CH2,11-C),35.6(CH2,12-C),45.3(C,13-C),48.2(C,14-C),32.4(CH2,15-C),27.6(CH2,16-C),44.1(CH,17-C),18.8(CH3,18-C),29.8(CH2,19-C),37.7(CH,20-C),70.2(CH2,21-C),36.7(CH2,22-C),219.1(C,23-C),86.5(CH,24-C),74.3(C,25-C),28.7(CH3,26-C),24.0(CH3,27-C),21.0(CH3,28-C),19.6(CH3,29-C),22.4(CH3,30-C);碳原子標記參見圖1。13CNMR譜顯示有30個碳原子,包括6個甲基,11個亞甲基,6個次甲基,5個季碳,1個含氧叔碳和1個羰基碳。1HNMR譜表明有6個共振甲基信號(δH0.91,s;0.96,s;1.04,s;1.09,s;1.28,s;1.31,s),1個含氧亞甲基(δH3.96,d,J=11.6Hz;3.41,dd,J=11.6,2.4Hz),和2個含氧次甲基(δH3.93,m;2.91,d,J=9.2Hz)。C-21(δH3.41,3.96;δC70.2)和C-24(δH2.91;δC86.5)的核磁共振化學位移表明21,24位碳連有環氧結構,HMBC譜中H-21與C-24的相關峰進一步確定了此結構。綜合1H-1HCOSY相關譜、HMBC譜和NOESY譜(圖3),以及文獻關於相關類型核磁數據,可基本確定該化合物如圖1所示,立體構型進一步通過ECD試驗確定,理論值與實驗值基本一致(圖2)。因此,最終確定該化合物結構如圖1所示。實施例2:化合物(Ⅰ)藥理作用試驗一、材料和儀器HL7702肝細胞株由中國科學院上海生命科學研究所提供。化合物(Ⅰ)為自製(純度大於98%)。高糖DMEM培養基、高糖DMEM/F12=1:1培養基、胎牛血清均購於HycLone。EDTA購於上海試劑一廠。臺盼藍購於北京化工廠。無糖DMEM培養基購於Gibco。胰酶、MTT、DMSO均購於Amresco。LDH釋放法檢測試劑盒購於GENMDE。ALT生化檢測試劑盒、AST生化檢測試劑盒、LDH生化檢測試劑盒均購於美國貝克曼試劑有限公司。Western及IP細胞裂解液、PMSF、BCA蛋白濃度測定試劑盒、MDA檢測試劑盒均購於碧雲天生物研究所。CO2培養箱,SheL-Lab2300;電熱恆溫孵育箱,上海躍進醫療器械廠;缺氧培養盒,長沙長錦科技有限公司;酶標儀,美國BioTekEpoch;全自動生化儀,BeckmanLX20;離心機,德國Eppendorfcentrifμge5415D。二、試驗方法1、細胞分組將細胞分為6組,每組6個復孔:(1)正常培養組(N組):完全培養基,正常條件下培養;(2)缺血再灌注組(IR組):完全培養基正常條件下培養1h後,模擬缺氧8h,再灌注4h;(3)化合物(Ⅰ)組:RE1組:化合物(Ⅰ)0.5ng/mL預處理1h;RE2組:化合物(Ⅰ)5ng/mL預處理1h;RE3組:化合物(Ⅰ)50ng/mL預處理1h;模擬缺氧8h,再灌注4h;(4)生理鹽水組(NS組):以與化合物(Ⅰ)同等體積的生理鹽水預處理1h,模擬缺氧8h,再灌注4h。2、化合物(Ⅰ)的預處理(1)化合物(Ⅰ)的配製:將1mg化合物(Ⅰ)溶解於500mL生理鹽水中。移液槍吸取2.5mL於第一支離心管中,用生理鹽水稀釋至10mL配製成濃度為500ng/mL的化合物(Ⅰ)溶液。從第一支離心管中吸取1mL至第二支離心管中,用生理鹽水稀釋至10mL配製成濃度為50ng/mL的化合物(Ⅰ)溶液。從第二支離心管中吸取1mL至第三支離心管中,用生理鹽水稀釋至10mL配製成濃度為5ng/mL的化合物(Ⅰ)溶液。作好標記。(2)化合物(Ⅰ)預處理:正常培養組和缺血再灌注組以每孔100μL新鮮的完全培養基更換。RE1組每孔加入5ng/mL的化合物(Ⅰ)溶液10μL和新鮮的完全培養基90μL,RE2組每孔加入50ng/mL的化合物(Ⅰ)溶液10μL和新鮮的完全培養基90μL,RE3組每孔加入500ng/mL的化合物(Ⅰ)溶液10μL和新鮮的完全培養基90μL。生理鹽水組每孔加入生理鹽水10μL和新鮮的完全培養基90μL。輕輕搖動96孔板,使藥液充分混混勻,放入CO2培養箱中孵育1h。3、肝細胞體外模擬缺血再灌注損傷模型的建立:(1)體外模擬缺血過程:預處理時間結束後,從細胞培養箱中取出第一塊96孔板,正常培養組每孔用100μL完全培養基更換,放入CO2培養箱中繼續培養8h。從CO2培養箱中取出第二塊96孔板,缺血再灌注組、化合物(Ⅰ)預處理組和生理鹽水組每孔用100μL無糖DMEM培養基置換完全培養基,放入缺氧培養盒中,培養盒中放入盛有50mL滅菌水的無菌小瓶保持飽和溼度。將缺氧培養盒放入37℃恆溫孵育箱中,進氣口連接94%N2-5%CO2-1%O2混合氣體,出氣口連接氧氣檢測儀。以2L/min的氣體流量通入混合氣體,當氧氣檢測儀顯示出氣口氧氣濃度<1%時,調節混合氣體流量300mL/min維持出氣口氧氣濃度<1%。以此模擬缺血過程8h。(2)體外模擬再灌注過程:從CO2培養箱中取出第一塊96孔板,正常培養組每孔更換100μL新鮮的完全培養基,放入CO2培養箱中繼續培養4h。從缺氧培養盒中取出第二塊96 孔板,缺血再灌注組、化合物(Ⅰ)預處理組和生理鹽水組每孔用100μL新鮮的完全培養基置換無糖DMEM培養基,放入CO2培養箱中正常條件下(37℃、5%CO2、95%空氣、飽和溼度)培養4h,模擬再灌注過程。3、指標檢測3.1MTT法檢測肝細胞活力(1)MTT溶液配製:用電子微量天平稱取250mgMTT,放入小燒杯中,加入50mLPBS攪拌30min,使之充分溶解,即為濃度為5mg/mL的MTT溶液。在超淨工作檯中用0.22μm微孔濾器除菌,分裝為每支1mL,4℃避光保存備用。(2)細胞準備:按上述方法進行細胞分組,並另設調零孔。並按上述方法進行化合物(Ⅰ)預處理和體外模擬缺血再灌注過程。(3)呈色:終末時間點每孔加入5mg/mL的MTT溶液20μL,放入37℃、5%CO2、95%空氣、飽和溼度的CO2培養箱中繼續培養4h。終止培養,小心吸棄孔內上清液,每孔加入100μLDMSO溶液,微量振蕩器上振蕩10min,使結晶物充分溶解。(4)比色:選擇570nm波長,在酶標儀上測定各孔吸收度(A),記錄結果。實驗重複2次。3.2乳酸脫氫酶釋放法細胞繁殖與毒性檢測按GENMED乳酸脫氫酶釋放法細胞繁殖與毒性定量檢測試劑盒說明書操作,實驗重複2次。(1)按上述方法準備待測細胞,並另設無細胞的培養液(背景空對照孔)和未處理的後續裂解的細胞(樣品最大酶活性對照孔),作好標記。(2)到規定的檢測時間點前1小時,從CO2培養箱中取出待測的96孔細胞培養板,加入10μLGENMED裂解液到未處理的後續裂解的細胞孔裡,同時加入10μLGENMED補充液到其餘所有檢測孔裡。放回CO2培養箱中繼續培養1小時即規定檢測時間。(3)從CO2培養箱中取出待測的96孔細胞培養板,放入孔板離心機離心10min,速度為250g。(4)分別小心移取50μL上清液到新的96孔板的相應孔裡,同時作好標記。(5)混勻GENMED反應液,每孔分別加入50μLGENMED反應液,再分別每孔加入10μLGENMED顯色液,搖動96孔板混勻。(6)在室溫下孵育30min,避免光照。(7)每孔分別加入10μLGENMED終止液。(8)即刻放進酶標儀裡測定光吸收度(A),選擇波長570nm。(9)根據以下公式計算細胞死亡率:處理樣品實際吸光讀數=處理樣品孔吸光讀數-樣品對照孔吸光讀數-背景空對照孔吸光讀數樣品細胞最大酶活性的實際吸光讀數=樣品最大酶活性對照孔吸光讀數-樣品對照孔吸光讀數-背景空對照孔吸光讀數細胞死亡率=(處理樣品實際吸光讀數÷樣品細胞最大酶活性的實際吸光讀數)×100%3.3肝細胞功能指標的測定:按上述方法進行細胞分組、預處理和模擬缺血再灌注損傷。到終末時間點分別將各孔細胞培養上清液100μL收集於Ep管中,每管分別加入100μL完全培養基稀釋至200μL,室溫下離心5min,速度為1200r/min。取上清液在全自動生化儀下檢測ASL、ALT和LDH水平。實驗重複2次。三、結果及結論1、化合物(Ⅰ)預處理對缺血再灌注損傷肝細胞活力的影響IR組肝細胞活力比N組明顯下降(P<0.05),表明體外模擬缺血再灌注過程成功地造成了肝細胞缺血再灌注損傷。給予5ng/ml化合物(Ⅰ)預處理1小時,缺血再灌注損傷肝細胞的活力較缺血再灌注組和生理鹽水組增強(P<0.05),但未能恢復到正常組肝細胞活力水平(P0.05)。而0.5ng/ml和50ng/ml濃度的化合物(Ⅰ)預處理1小時,均未能增強缺血再灌注損傷肝細胞的活力(P>0.05),其肝細胞活力與生理鹽水組之間差異也無統計學意義(P>0.05)。結果見表1(▲表示與N組比較,P<0.05,差異有統計學意義;★表示與IR組和NS組比較,P90%。給予5ng/ml化合物(Ⅰ)預處理1小時,肝細胞死亡率下降約35%,差異有統計學意義(P<0.05),但其細胞死亡率仍比正常組高約50%,差異有統計學意義(P0.05);而與生理鹽水組的肝細胞死亡率相近(P>0.05)。結果見表2(▲表示與N組比較,P<0.05,差異有統計學意義;★表示與IR組和NS組比較,P0.05);而AST、LDH水平以及AST/ALT比值顯著升高,差異有統計學意義(P<0.05)。給予5ng/ml化合物(Ⅰ)預處理1小時,肝細胞培養上清液中的AST、LDH水平以及AST/ALT比值較缺血再灌注組和生理鹽水組降低,但仍較正常組高(P0.05)。生理鹽水組細胞培養上清液中的ALT、AST、LDH水平以及AST/ALT比值與缺血再灌注組之間差異無統計學意義(P>0.05)。0.5ng/ml和50ng/ml化合物(Ⅰ)預處理1小時,均未能使肝細胞培養上清液中的AST、LDH水平降低(P>0.05)。結果見表3(▲表示與N組比較,P<0.05,差異有統計學意義;★表示與IR組和NS組比較,P<0.05,差異有統計學意義)。本研究顯示,化合物(Ⅰ)(RE2組)使肝細胞對之後經歷的缺血再灌注損傷的耐受力增強,表現為肝細胞活力增強,細胞死亡率降低。以上結果提示,化合物(Ⅰ)預處理能夠減輕人肝細胞缺血再灌注損傷,起到肝細胞保護作用。表1MTT法檢測化合物(Ⅰ)預處理對缺血再灌注損傷肝細胞活力的影響組別樣本數nA值N組62.222±0.135IR組61.585±0.113▲RE1組61.509±0.073▲RE2組62.076±0.144▲★RE3組61.569±0.118▲NS組61.484±0.085▲表2LDH釋放法肝細胞繁殖與毒性定量檢測細胞死亡率組別樣本數n細胞死亡率N組50.000±0.145IR組50.915±0.076▲RE1組50.851±0.157▲RE2組50.531±0.058▲★RE3組50.791±0.065▲NS組50.834±0.107▲表3肝細胞培養上清液中ALT、AST、LDH水平的變化(n=5)組別ALTASTAST/ALTLDHN組14.0±1.5821.1±0.841.53±0.13100.8±9.52IR組12.8±0.8433.0±2.24▲2.58±0.07▲247.2±13.76▲RE1組14.0±1.5833.0±1.58▲2.37±0.16▲260.0±11.77▲RE2組14.0±1.5827.2±0.84▲★1.96±0.24▲★204.0±8.60▲★RE3組13.8±0.8432.8±2.17▲2.38±0.17▲239.6±6.54▲NS組12.8±0.8431.2±0.84▲2.45±0.22▲249.2±8.87▲實施例3片劑的製備:按實施例1方法先製得化合物(Ⅰ),以及利用有機酸如酒石酸、或檸檬酸或甲酸或乙二酸等、無機酸如鹽酸或硫酸或磷酸製成的鹽,按其與賦形劑重量比為1:9的比例加入賦形劑,制粒壓片。實施例4口服液的製備:按實施例1方法先製得化合物(Ⅰ),以及利用有機酸如酒石酸、或檸檬酸或甲酸或乙二酸等、無機酸如鹽酸或硫酸或磷酸製成的鹽,按常規口服液製法製成口服液。實施例5膠囊劑或顆粒劑的製備:按實施例1方法先製得化合物(Ⅰ),以及利用有機酸如酒石酸、或檸檬酸或甲酸或乙二酸等、無機酸如鹽酸或硫酸或磷酸製成的鹽,按其與賦形劑重量比為1:9的比例加入賦形劑,製成膠囊或顆粒劑。實施例6注射液的製備:按實施例1方法先製得化合物(Ⅰ),以及利用有機酸如酒石酸、或檸檬酸或甲酸或乙二酸等、無機酸如鹽酸或硫酸或磷酸製成的鹽,按常規加注射用水,精濾,灌封滅菌製成注射液。實施例7無菌粉針的製備:按實施例1方法先製得化合物(Ⅰ),以及利用有機酸如酒石酸、或檸檬酸或甲酸或乙二酸等、無機酸如鹽酸或硫酸或磷酸製成的鹽,將其溶於無菌注射用水中,攪拌使溶,用無菌抽濾漏鬥過濾,再無菌精濾,分裝於安瓿中,低溫冷凍乾燥後無菌熔封得粉針劑。當前第1頁1 2 3 
