一種具有超長持續時間的超聲造影劑及其製備方法與流程
2023-10-11 18:57:09 6
本發明涉及醫藥領域,具體涉及一種具有超長持續時間的超聲造影劑及其製備方法。
背景技術:
超聲造影劑通常是脂質、聚合物或蛋白質包裹的直徑在10微米以下的氣體微泡,能夠在超聲成像中用來增強檢測部位的回聲信號。超聲造影劑在人體微小血管和組織血流灌注檢測與成像方面具有很大優勢。另外,近些年的研究表明超聲造影劑在腫瘤或炎症部位的靶向成像和藥物遞送等方面表現出了廣闊的應用前景,因此可以預見超聲造影劑在不久的將來將會成為臨床上超聲診斷或治療中的不可或缺的試劑。
目前超聲造影劑已經有很多產品進入臨床應用,國際市場上如definity、optison、sonazoid、sonovue等,國內市場上現在有sonovue、雪瑞欣可以使用。儘管超聲造影劑在超聲診斷中有著諸多應用優勢,但是目前國內臨床診斷中超聲造影劑卻很少被普通民眾所使用,一般只有在三甲以上的醫院才會有較多的使用。這其中一個很重要的原因就是造影劑的價格非常昂貴,如每瓶sonovue的價格在700人民幣左右,雪瑞欣的價格更是高達每瓶900多人民幣,普通老百姓難以負擔得起,極大地限制了超聲造影劑的普及。另外目前已有的超聲造影劑的成像時間都比較短(sonovue的有效時間為4-8分鐘,雪瑞欣不足2分鐘),難以滿足一個完整的超聲檢查的需求。尤其是隨著介入超聲等技術的發展,對具有長持續時間的造影劑的需求就更加迫切。
另外,隨著超聲分子影像和介入治療的發展,亞微米的微泡(即含有一定比例的納米泡的超聲微泡)開始顯現出巨大的應用潛力。納米泡在高頻超聲下穩定性更好,具有更好的穿透血管的能力,而微米級微泡的超聲造影增強效果更好,亞微米的微泡結合了兩者的優勢表現出更好的應用價值。例如研究發現definity由於含有一定比例的納米泡具有更好的超聲溶栓效果,而同等條件下的 白蛋白微泡由於均是微米級尺寸則沒有這種效果。
技術實現要素:
基於以上需求和問題,本發明提供一種具有超長持續時間的超聲造影劑的製備方法,該方法操作簡單,微泡包膜材料可以在很溫和的條件下分散得到均一穩定的溶液,可以進行過濾除菌,容易進行產業化生產。本發明所述超聲造影劑為凍幹製劑,為了製備凍幹製劑,需要先製備超聲微泡包膜材料的混懸液,混懸液中的成分是雙親性包膜材料、凍幹保護劑和溶劑。
本發明技術方案如下:
一種具有超長持續時間的超聲造影劑的製備方法,包括以下步驟:
1)製備微泡包膜材料混懸液,其中所述混懸液的溶劑為叔丁醇和水混合液;
2)冷凍乾燥所述混懸液,製得微泡凍乾粉;
3)將所述微泡凍乾粉充入填充氣體,所述填充氣體為混合氣體。
本發明所述包膜材料為雙親性包膜材料,其主要組分是帶有負電荷的磷脂,疏水鏈的長度以18個碳為宜,適合的磷脂包括二硬脂醯基-磷脂醯甘油、二硬脂醯基-磷脂醯絲氨酸、二硬脂醯基-磷脂酸等中的一種。研究發現,由於這些磷脂在生理條件下淨電荷為負,保證了微泡帶有較強的負電荷,從而使得穩定性大大提高。且較長的疏水鏈能夠保證能夠形成穩定的膜結構以防止微泡內部氣體的溢出。另外這些磷脂的親水性頭部中的磷酸、甘油、絲氨酸等結構能夠通過氫鍵或靜電相互作用形成穩定的親水層,大大提高微泡的穩定性。
本發明所述雙親性包膜材料中除了前面提到的帶有負電荷的磷脂外,也可以摻入一些其他的雙親性成膜材料,但是為了保證微泡的穩定性,前面提到的帶有負電荷的磷脂(即二硬脂醯基-磷脂醯甘油、二硬脂醯基-磷脂醯絲氨酸以及二硬脂醯基-磷脂酸)的重量比例應該在70%以上,優選90%以上,更優選為100%。其他雙親性材料包括各種天然、半合成的的磷脂化合物,如卵磷脂、卵磷脂醯甘油、氫化大豆磷脂、氫化蛋黃磷脂、氫化磷脂醯絲氨酸,氫化磷脂醯甘油等。也包括各種合成磷脂如帶有各種脂肪酸鏈的磷脂醯膽鹼、磷脂醯乙醇胺、磷脂醯甘油、磷脂酸、磷脂醯絲氨酸等。也包括改性的磷脂,例如聚乙二醇化的磷脂。也包括各種合成的陽離子脂質,如羥乙基乙二胺基化的磷脂、乙 基磷脂醯膽鹼的衍生物(如1,2-二硬脂酸-sn-甘油基-3-乙基膽鹼磷酸)、帶有烷基鏈的銨鹽(如硬脂醯氯化銨、十二烷基溴化胺等)等。也包括各種表面活性劑,如司盤類、吐溫類、聚乙二醇化的脂肪酸、單硬脂酸甘油酯、蔗糖單硬脂酸酯、氫化蓖麻油、棕櫚酸抗壞血酸脂等。也包括類固醇類化合物(如膽固醇、羊毛固醇、谷甾醇、豆固醇、麥角固醇)及其衍生物、維生素e及其衍生物、脂肪酸(如硬脂酸、棕櫚酸、花生酸、月桂酸、肉豆蔻酸、油酸等)。
研究發現,本發明所述雙親性包膜材料以單一一種磷脂為最佳,即選擇二硬脂醯基-磷脂醯甘油、二硬脂醯基-磷脂醯絲氨酸以及二硬脂醯基-磷脂酸中的一種作為微泡包膜材料。一方面單一一種磷脂避免了由於多種磷脂混合不均導致的微泡均一性和可重複性差的問題。另一方面,採用單一一種磷脂有利於磷脂形成均一的微泡包膜結構,穩定性大大提高。
本發明製備微泡包膜材料混懸液的過程中還需加入凍幹保護劑。
本發明優選採用的凍幹保護劑是聚乙二醇,平均分子量應該在1000-10000之間為宜,優選的是平均分子量為4000左右的聚乙二醇。聚乙二醇的主要作用是在混懸液冷凍乾燥時能夠對支撐起成膜材料,使其保持在溶液中的穩定分散狀態而不至於塌陷聚集,使得凍乾粉在水化時能夠很容易分散得到均一穩定的溶液。另外,聚乙二醇在水中能夠與微泡膜表面的磷脂通過氫鍵作用大量附著,聚合物的附著可以極大地提高微泡的穩定性,也能夠降低微泡在體內被識別的機率從而延長微泡的循環時間。
為了獲得均一穩定的微泡包膜材料混懸液,需要一種溶劑能夠將微泡包膜材料(和凍幹保護劑)均勻混合分散。另外,為了獲得微泡凍乾粉,這種溶劑還需要具有合適的熔點和飽和蒸汽壓。
水是冷凍乾燥工藝中最常用的溶劑,但是雙親性材料在水中很容易自組裝成膠束或脂質體等結構,直接將多種雙親性材料分散在水中很難實現分子水平上的均勻混合。
目前能夠用於冷凍乾燥的最優選的非水溶劑是叔丁醇,由於其具有較高的熔點(25.7℃)和飽和蒸汽壓(26.8mmhg,20℃),用普通的冷凍乾燥設備實現冷凍乾燥,極大的節約成本。另外,較低的毒性也使得叔丁醇較適合用於 藥物製劑的冷凍乾燥。儘管純的叔丁醇可以溶解大多數雙親性材料和不同分子量的聚乙二醇,但是卻無法溶解大多數的凍幹保護劑。另外,微泡製備時通常需要加入一定比例的帶有負電荷的磷脂如磷脂醯絲氨酸、磷脂醯甘油或磷脂酸等,而這類磷脂在叔丁醇中的溶解度較差。
本發明中用來製備微泡包膜材料混懸液的溶劑是叔丁醇和水的混合液。優選地,所述叔丁醇和水混合液中叔丁醇的質量含量為1%~99%,進一步優選為30%~70%。
本發明中所採用的成膜材料主要是帶有負電荷的磷脂,這類磷脂在水中難以分散,在氯仿、甲醇、正己烷、叔丁醇、乙醇等大多數有機溶劑中的溶解性都不好。而且除了要保證磷脂能夠充分分散,還要保證混懸液能夠在一般的冷凍乾燥設備中被凍幹。我們經過大量實驗發現只有叔丁醇和水的混合液能夠滿足需求,帶負電荷的磷脂在這種溶劑中能夠被很容易地溶解,混懸液中的溶劑能夠很容易地通過冷凍乾燥除去,而且這種溶劑的生物毒性很低,痕量殘留的溶劑毒性可以被忽略。
另外,本發明研究發現,以叔丁醇和水混合液為溶劑能夠同時溶解絕大多數雙親性包膜材料和凍幹保護劑,而且溶解過程不需要太高的溫度,40℃左右甚至更低的溫度就可以溶解,且溶解後冷卻到室溫後不會析出。最後獲得的所述混懸液澄清、均一、穩定,並且很容易利用過濾進行除菌。另外,使用叔丁醇和水混合液為溶劑進行冷凍乾燥時,叔丁醇能夠在水中形成針狀結晶,大大縮短冷凍乾燥的周期。
本發明所述微泡包膜材料混懸液製備好後通常還需要進行過濾,比較優選的是用220nm的濾膜進行過濾。使用叔丁醇和水作為溶劑能夠很容易將包膜材料溶解得到澄清透明的溶液,很容易進行過濾。過濾的目的一方面能夠除去可能存在的微量雜質,另一方面能夠起到對混懸液過濾除菌的目的。
本發明中微泡包膜材料混懸液製備好後(例如分裝入藥物製劑用的西林瓶),通過冷凍乾燥的方法除去溶劑(即叔丁醇和水混合液)得到微泡凍乾粉,凍乾粉能夠穩定存在,常溫條件下即可以保存很長時間。所述冷凍乾燥可採用本領域常用方法。
本發明方法還包括將製備好的微泡凍乾粉進行充入填充氣體的步驟。例如冷凍乾燥結束後向西林瓶中充入填充氣體。填充氣體是超聲微泡內核的成分,為了提高超聲微泡的穩定性,填充氣體應該在水中具有較低的溶解度,還要對生物體安全無毒。常用的超聲造影劑的填充氣體是氟化碳類氣體,但是我們的研究發現當使用氟化碳類氣體如八氟丙烷作為填充氣體時,最後製備的超聲微泡的尺寸較大,較多的微泡尺寸在10微米以上,由於人體中肺部最細的血管的內徑在10微米左右,這種微泡難以被安全用到生物體中。另一方面,在水中溶解度較高的氣體,如空氣、氮氣等氣體用作填充氣體所製備的微泡儘管尺寸較小但是穩定性極差。
本發明中所使用的填充氣體是混合氣體,其含有兩類氣體:氣體a和氣體b。氣體a的特點是分子量比較小(100),並且含有氟元素,可以利用的氣體包括八氟丙烷、十氟丁烷、八氟環丁烷、全氟戊烷、全氟己烷、全氟辛烷等氟化碳類氣體以及六氟化硫等氟化硫類氣體中的一種或幾種的混合氣。
本發明中填充氣體(即混合氣體)中氣體a的體積比例為1%~99%,優選的比例為95%~99%。混合氣體的使用,一方面能夠保證微泡具有很好的穩定性,另一方面能夠顯著降低微泡的尺寸使得絕大多數的微泡尺寸都在7微米以下,並且有很多納米泡。
本發明中氣體填充過程可以是在凍幹機外用特定的充氣裝置進行。工業化生產時更優選的方法是氣體填充、密封的過程都是在凍幹設備中進行。本發明中混懸液分裝入西林瓶中後,在經過凍幹、氣體填充、密封、無菌處理後即可得到最終的超聲造影劑(微泡凍乾粉)成品。
本發明上述製備方法中,
步驟1)包括將所述包膜材料和凍幹保護劑加入叔丁醇和水混合液中,加熱溶解,製得微泡包膜材料混懸液;然後過濾除菌;
所述包膜材料和凍幹保護劑的重量比例為1:200~1:5;優選為1:50~1:10。
所述包膜材料和凍幹保護劑的總重量佔所述溶劑(即叔丁醇和水混合液) 重量的1%~50%;優選為5%~20%;
所述叔丁醇和水混合液中叔丁醇的質量含量為1%~99%,優選為30%~70%。
所述加熱溶解溫度為25℃~70℃;優選為35℃~50℃。
所述過濾除菌優選採用220nm的濾膜。
具體地,本發明所述具有超長持續時間的超聲造影劑的製備方法,包括以下步驟:
1)將所述包膜材料和凍幹保護劑加入叔丁醇和水混合液中,加熱溶解,製得微泡包膜材料混懸液;然後採用220nm的濾膜過濾除菌;
2)將步驟1)過濾除菌的微泡包膜材料混懸液冷凍乾燥,得到微泡凍乾粉;
3)將步驟2)製備好的微泡凍乾粉充入混合填充氣體;
上述製備方法中,
所述包膜材料為二硬脂醯基-磷脂醯甘油、二硬脂醯基-磷脂醯絲氨酸或二硬脂醯基-磷脂酸;
所述凍幹保護劑為平均分子量4000的聚乙二醇;
所述包膜材料和凍幹保護劑的重量比例為1:50~1:10;
所述包膜材料和凍幹保護劑的總重量佔所述溶劑重量的5%~20%;
所述加熱溶解溫度為35℃~50℃;
所述混合氣體含有兩類氣體:氣體a和氣體b;其中氣體a的分子量100,並且含有氟元素;
所述氣體a包括空氣、氧氣、氮氣、二氧化碳、氦氣、氖氣、氬氣中的一種或幾種的混合氣;
所述氣體b包括氟化碳類氣體、氟化硫類氣體中的一種或幾種的混合氣;其中,氟化碳類氣體包括八氟丙烷、十氟丁烷、八氟環丁烷、全氟戊烷、全氟己烷、全氟辛烷;氟化硫類氣體包括六氟化硫。
本發明還包括上述方法製得的超聲造影劑。
本發明所述超聲造影劑(微泡凍乾粉)在使用時需要向所述超聲造影劑中注入水化液,經震蕩製得超聲造影劑懸浮液。
具體地,本發明所述超聲造影劑(微泡凍乾粉)在使用時需要向包裝容器 (如西林瓶)中注入水化液,水化液的量優選佔包裝容器(如西林瓶)容積的10%~80%。水化液的選擇應該是完全無毒、可以進行靜脈注射的。純水和大多數臨床上使用的注射液都可以被用做水化液,如生理鹽水,磷酸鹽緩衝液,甘油注射液,葡萄糖注射液,胺基酸注射液等。也可以是加入了一定量的甘油和/或丙二醇的生理鹽水或磷酸鹽緩衝液,甘油的加入能夠提高微泡的粘彈性和穩定性,丙二醇可以促進雙親性包膜材料的分散。
本發明所述超聲造影劑(微泡凍乾粉)水化後優選通過機械振蕩器來激活微泡以獲取可以用於超聲成像造影的微泡混懸液。這裡所採用機械振蕩器與目前臨床上牙科所用的銀汞調和器的結構原理基本一致。優選地,震蕩方式是往復式,震蕩頻率為2000~7000rpm,震蕩幅度為0.5~3cm,震蕩時間為30~180s。
本發明製備方法簡單,微泡各組分之間能夠在很溫和的條件下分散得到均一穩定的溶液,達到分子水平的均勻混合,各組分在製備過程中不易發生降解,樣品凍幹效率高,樣品均一穩定,可以進行過濾除菌,可重複性高、容易規模化生產,表現出廣闊的臨床應用前景。本發明解決了傳統方法中因磷脂在高溫條件下或水溶液中長期存在時容易發生降解產生溶血性磷脂,影響產品的穩定性和安全性的技術問題。本發明中優選的方法採用單一一種帶負電的磷脂作為成膜材料,提高了產品的均一性和可重複性。產品高效安全、方法可重複性高。
本發明中造影劑體內(例如肝臟、腎臟和脾臟等臟器)造影持續時間達到了2-6小時以上,是目前已報導的微氣泡類超聲造影劑中超聲造影持續時間最長的一類造影劑。打破了傳統的對氣體微泡超聲造影劑穩定性差的認知。這種造影劑除了含有較多的微米級氣泡之外,還含有很多納米級的氣泡。另外,這種造影劑的成分簡單、價格低廉,主要原料均為fda已經批准的可注射藥用輔料,製備工藝簡單、可重複性高、易於進行規模化生產,預計工業化生產後每瓶生產成本僅為2人民幣左右。良好的超聲造影效果、低廉的價格使得這種超聲造影劑具有良好的應用價值,預計將有助於超聲造影劑的普及應用,具有很廣闊的臨床應用前景。
附圖說明
圖1為實施例1和對比例1製得的微泡包膜材料混懸液照片。
圖2為實施例1製得的微泡懸液的微泡顯微鏡照片。
圖3為對比例2得的微泡懸液的微泡顯微鏡照片。
圖4為實施例1製得的微泡懸液的微泡的粒徑分布圖。
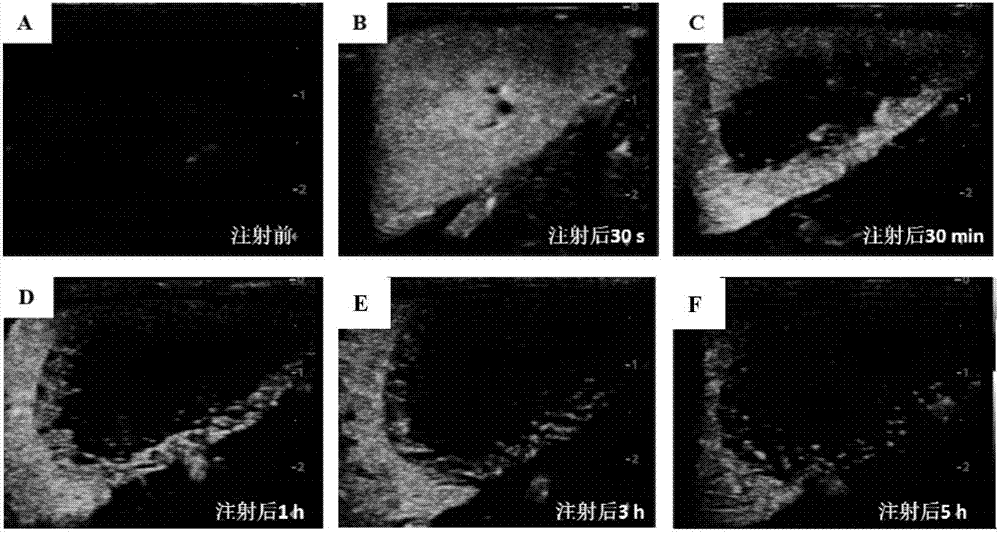
圖5為實施例1製得的超聲造影劑(微泡混懸液)對紐西蘭大白兔的腎臟和肝臟實質在不同時間點的造影效果圖。a,微泡注射前;b,微泡注射後30秒;c微泡注射後30分鐘;d,微泡注射後1小時;e,微泡注射後3小時;f,微泡注射後5小時。
具體實施方式
以下實施例用於說明本發明,但不用來限制本發明的範圍。實施例中未註明具體技術或條件者,按照本領域內的文獻所描述的技術或條件,或者按照產品說明書進行。所用試劑或儀器未註明生產廠商者,均為可通過正規渠道商購買得到的常規產品。
實施例1
準確稱取128mg二硬脂醯基-磷脂醯甘油,1872mgpeg4000,加入溶劑(即9g去離子水和9g叔丁醇的混合液),加熱到45℃溶解得到微泡包膜材料混懸液,為澄清的溶液(見圖1),然後冷卻到室溫。將溶解後的溶液用220nm的濾膜過濾後分裝入2ml的西林瓶(實際容積約為3.5ml),每瓶分裝入250mg。將分裝好的西林瓶放於凍幹機隔板上,迅速冷卻到-40℃,冷凍乾燥過夜。冷凍乾燥結束後,保持凍幹機的真空狀態,充填入氮氣體積比例為98%的氮氣和八氟丙烷混合氣體,待真空度恢復到常壓後,壓下西林瓶上的橡膠塞,密封西林瓶,製得超聲造影劑。
該超聲造影劑(凍乾粉製劑)使用之前,向西林瓶中注入1ml的生理鹽水,放於醫用銀汞調和機的夾頭上,振蕩頻率為4000rpm,振蕩45s後得到微泡懸浮液。
實施例2
一種超聲造影劑,其製備方法與實施例1的區別僅在於將二硬脂醯基-磷脂醯甘油成分更換為:128mg二硬脂醯基-磷脂醯絲氨酸。
實施例3
一種超聲造影劑,其製備方法與實施例1的區別僅在於將二硬脂醯基-磷脂醯甘油成分更換為:128mg二硬脂醯基-磷脂酸。
實施例4
一種超聲造影劑,其製備方法與實施例1的區別僅在於溶劑為12.6g去離子水和5.4g叔丁醇的混合液。
實施例5
一種超聲造影劑,其製備方法與實施例1的區別僅在於溶劑為5.4g去離子水和12.6g叔丁醇的混合液。
實施例6
一種超聲造影劑,其製備方法與實施例1的區別僅在於充填的混合氣體為氮氣體積含量為95%的全氟丙烷和氮氣的混合氣體。
實施例7
一種超聲造影劑,其製備方法與實施例1的區別僅在於充填的混合氣體為空氣體積含量為98%的全氟丙烷和空氣的混合氣體。
實施例8
一種超聲造影劑,其製備方法與實施例1的區別僅在於充填的混合氣體為空氣體積含量為98%的全氟丁烷和空氣的混合氣體。
實施例9
一種超聲造影劑,其製備方法與實施例1的區別僅在於充填的混合氣體為氮氣體積含量為98%的全氟丁烷和氮氣的混合氣體。
實施例10
一種超聲造影劑,其製備方法與實施例1的區別僅在於充填的混合氣體為氧氣體積含量為98%的全氟丙烷和氧氣的混合氣體。
對比例1
一種超聲造影劑,其製備方法與實施例1的區別僅在於以水為溶劑製備微泡包膜材料混懸液。
製備過程中發現,在製備微泡包膜材料混懸液的時候,實施例1中只需在45℃加熱溶解5分鐘左右就可以得到澄清透明的混懸液,而對比例1中在45℃ 加熱溶解30分鐘後仍然可以看到很多顆粒狀不溶物,而且混懸液渾濁不透明(圖1)。在使用傳統的220nmpvdf膜針頭濾器(直徑25mm)對混懸液進行過濾時,實施例1中混懸液在過濾100ml後沒有遇到明顯的阻力,而對比例1中的混懸液過濾時過濾的阻力非常明顯,僅過濾了2ml後濾器就基本完全被堵塞無法繼續進行了。
對比例2
一種超聲造影劑,其製備方法與實施例2的區別僅在於充填的氣體為全氟丙烷單一氣體。
對比例3
一種超聲造影劑,其製備方法與實施例2的區別僅在於充填的氣體為空氣單一氣體。
對比例4
一種超聲造影劑,其製備方法與實施例2的區別僅在於充填的氣體為氮氣單一氣體。
實驗例1
為獲取微泡在光學顯微鏡下的圖像;具體操作步驟如下:用等體積的生理鹽水分別稀釋實施例1和對比例2~4中製得的微泡懸液,用移液器吸取10μl微泡懸液滴在乾淨的載玻片上,小心蓋上蓋玻片,使用顯微鏡在不同物鏡倍數下觀察微泡的大小、形態及分散情況並拍照。圖2是實施例1中得到的微泡的顯微照片,可以看到微泡的尺寸大都在2μm以下,並且能夠明顯看到很多納米泡。圖3是對比例2中得到的微泡的顯微照片,可以看到很多尺寸都位於10μm以上,較多的大尺寸微泡在體內使用的時候容易堵塞血管,安全性沒有保證,無法被用於體內超聲實驗。而對比例3和對比例4中的微泡在顯微鏡可以看到微泡大多都是2μm以下,尺寸很小,但是這種微泡非常不穩定,常溫放置約30分鐘後就完全消失了。
實驗例2
採用採用庫爾特顆粒計數儀測試新型微泡的尺寸分布及濃度。操作步驟如下:取實施例1新製備的微泡懸液20μl加入到20ml生理鹽水中中,輕微搖 晃混合均勻。設定分析體積為20μl,測試微泡的粒徑分布及濃度。樣品測試重複三次,取平均值。圖4是其中一次代表性的結果,可以看到微泡的尺寸分布範圍很窄,大部分都在2μm以下,與顯微鏡照片吻合。
實驗例3
以紐西蘭大白兔為實驗對象,於兔左耳經耳緣靜脈建立外周靜脈通道,在導管的末端連接三通管,其中一個通道用於注射超聲造影劑,一個通道尾隨生理鹽水。紐西蘭大白兔用3%的戊巴比妥鈉靜脈注射麻醉(30mg/kg),並輔以0.2%肝素鈉抗凝血。待兔完全麻醉後,以背臥的姿勢固定在兔床上。右腹部毛髮用脫毛膏小心脫除,對兔肝臟和腎臟進行未注射造影劑的超聲檢查,記錄基礎狀態下的圖像。待圖像滿意後分別將實施例1以及對比例3和對比例4中的超聲造影劑微泡混懸液按20μl/kg的劑量經兔耳緣靜脈團注,即刻尾隨2.0ml生理鹽水衝洗管道,實時動態觀察並記錄兔肝臟和腎臟回聲強度增強情況以及腎臟能量都卜勒血流信號增強情況。
圖5是實施例1中的微泡在兔肝臟和腎臟的造影結果,可以看到造影信號在肝臟和腎臟有顯著的造影增強效果,並且能夠持續很長時間,注射後5小時仍能看到較強的信號。在注射後7小時,儘管腎臟的信號已經基本完全消失,但在在肝臟部位仍然能夠看到顯著的增強信號。
而對比例3和對比例4中的造影劑在注射入動物體內後基本看不到造影增強的信號。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬於本發明要求保護的範圍。
