一種複合催化體系和一種反應體系及其使用方法與流程
2023-10-26 03:20:57 3
本申請涉及但不限於一種複合催化體系和一種反應體系及其使用方法。
背景技術:
在油氣田開採過程中,經常遇到由於地層溫度不高,導致地層及井筒結蠟、原油無法流動的現象,造成開採成本提高,開採效果差。為解決此問題曾採用注蒸汽、熱洗、電加熱等來解決這方面的問題,這些方法相比化學熱存在諸多不足。化學自生熱體系利用一到兩種化學劑注入地層,反應生成大量熱量,使地層溫度升高,將蠟溶解,同時生成的氣體又可以起到一定的解堵、驅油作用,在油田開採中應用最為廣泛。
目前油田生產中應用最廣泛的自生熱體系為亞硝酸鈉/氯化銨配方。亞硝酸納/氯化銨自生熱體系的反應產物有氮氣、高溫熱水和氯化鈉鹽水。其中鹽水對大多數地層無損害,大量的氮氣可以提高局部地層壓力,並在較大壓力衝擊作用下衝洗儲層,把堵塞物和溶解垢一起舉升到地面。從產物看體系的危害性較小。
亞硝酸鈉/氯化銨作為化學生熱體系,在實際應用時,為降低單井成本,常將兩種液體在地面混合後注入井內,而不採用將兩種液體分別注入井下混合。許多油井地層溫度都在60℃以上,此溫度下,達到峰值溫度的時間只有4分鐘左右。若使用劑量大,體系在井筒會發生劇烈反應,放出大量氣體和熱量,熱量在井筒散失很多而不能全部作用在地層,大量的氣體使井筒壓力升高,注入壓力難以控制。
技術實現要素:
目前應用於海上油田熱解堵作業的化學生熱體系,在傳統的工藝過程中,多採用段塞式交替注入方式。這種方式不能充分混合生熱體系,導致藥劑浪費並降低生熱效率。比較理想的注入工藝要滿足「地面混合地下反應」的目的。因此,為合理控制反應時間,充分利用反應放出的熱能,使兩液體注入井下的過程中儘量不反應,抵達油層反應,找到一種延緩反應的方法非常有必要。
本申請的發明人在實踐經驗的基礎上經過大量研究分析後研發出能夠控制放熱反應進程的抑制劑,並以溫度作為控制手段。由此可實現在地面溫度條件下將摻複合催化體系的生熱體系混合後使其不發生或極其緩慢發生反應,而在井底溫度條件下抑制劑失效而使放熱反應迅速發生以達到作業目的。以此可以實現地面合注工藝,有效利用生熱體系,提高生熱效率,增強工藝效果。
本申請提供了一種複合催化體系,所述複合催化體系包括酸性引發劑和鹼性抑制劑;其中,所述酸性引發劑選自甲酸、苯甲酸、乙酸、草酸、鄰苯二甲酸和檸檬酸中的一種或多種,所述鹼性抑制劑選自甲胺、三乙醇胺、二甲胺、二乙胺和乙二胺中的一種或多種,所述酸性引發劑與所述鹼性抑制劑的摩爾比為1:1-4。
在一個實施方案中,所述酸性引發劑可以為檸檬酸,所述鹼性抑制劑可以為三乙醇胺。
在一個實施方案中,所述酸性引發劑與所述鹼性抑制劑的摩爾比可以為1:2。
本申請還提供了一種能夠控制放熱反應進程的反應體系,所述反應體系包括亞硝酸鈉/氯化銨化學生熱體系,以及如上所述的複合催化體系,所述複合催化體系中所述酸性引發劑的含量為使得與所述化學生熱體系等體積的水的pH為1.7-3.5。
在一個實施方案中,所述酸性引發劑的含量可以為使得與所述化學生熱體系等體積的水的pH約為2.5。
在一個實施方案中,亞硝酸鈉與氯化銨的摩爾比可以為1:1。
本申請還提供了一種使用如上所述的能夠控制放熱反應進程的反應體系控制放熱反應進程的方法,其中,所述複合催化體系的組分和所述化學生熱體系的組分在低於50℃的溫度下混合抑制放熱反應進行;所述複合催化體系的組分和所述化學生熱體系的組分混合後在50℃-60℃的溫度下促進放熱反應進行。
本申請還提供了一種如上所述的能夠控制放熱反應進程的反應體系用於油水井解堵、驅油的方法,該方法包括在0℃-50℃(可選地,在0℃-45℃)下將所述複合催化體系的所述酸性引發劑與所述化學生熱體系的氯化銨的水溶液混合,將所述複合催化體系的所述鹼性抑制劑與所述化學生熱體系的亞硝酸鈉的水溶液混合,將兩種混合後的混合物間隔或同時注入油田井筒及地層中。
本申請提供的複合催化體系,弱酸中加入弱鹼後,封閉了H+的自由電離,H+濃度減小,體現在溶液pH值升高;當溶液溫度升高時,弱鹼的封閉效果減弱,弱酸解離增多,pH值會相應降低,此時H+濃度促使反應進行。在應用於生熱體系時,注入油井的同時加入適當的弱酸弱鹼,抑制弱酸電離,使放熱反應不能順利進行。當到達油層後,由於周圍溫度的上升,體系溫度上升,弱酸電離度變大,溶液pH值降低,變為利於反應引發的酸性環境,促進放熱反應進行,從而實現控制放熱反應進程的目的。
附圖說明
附圖用來提供對本申請技術方案的進一步理解,並且構成說明書的一部分,與本申請的實施例一起用於解釋本申請的技術方案,並不構成對本申請技術方案的限制。
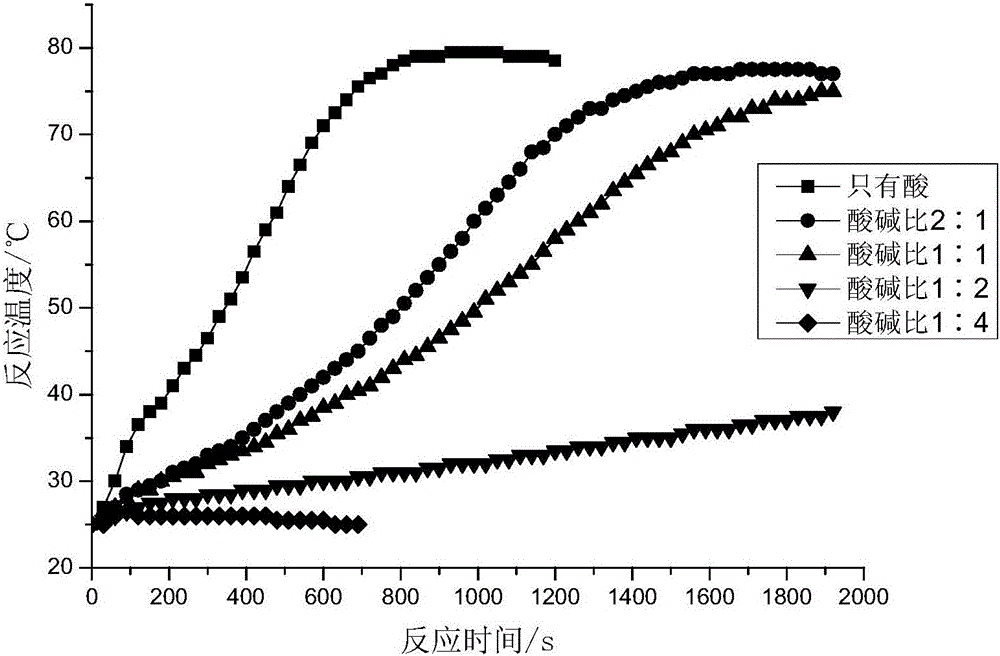
圖1為實施例1和對比例1的反應液的溫度隨時間的變化曲線。
圖2為實施例2和對比例2的反應液的溫度隨時間的變化曲線。
圖3為實施例3和對比例3的反應液的溫度隨時間的變化曲線。
圖4為實施例4和對比例4的反應液的溫度隨時間的變化曲線。
圖5為實施例5和對比例5的反應液的溫度隨時間的變化曲線。
圖6為實施例6和對比例6的反應液的溫度隨時間的變化曲線。
圖7為對比例7的反應液的溫度隨時間的變化曲線。
圖8為對比例8的反應液的溫度隨時間的變化曲線。
圖9為對比例9的反應液的溫度隨時間的變化曲線。
具體實施方式
下面通過實施例來描述本申請的實施方式,本領域的技術人員應當認識到,這些具體的實施例僅表明為了達到本申請的目的而選擇的實施技術方案,並不是對技術方案的限制。根據本申請的教導,結合現有技術對本申請技術方案的改進是顯然的,均屬於本申請保護的範圍。
本申請提供了一種複合催化體系,所述複合催化體系包括酸性引發劑和鹼性抑制劑;其中,所述酸性引發劑選自甲酸、苯甲酸、乙酸、草酸、鄰苯二甲酸和檸檬酸中的一種或多種,所述鹼性抑制劑選自甲胺、三乙醇胺、二甲胺、二乙胺和乙二胺中的一種或多種,所述鹼性抑制劑與所述酸性引發劑的摩爾比為1:1-4。
所述酸性引發劑與所述鹼性抑制劑的摩爾比在上述範圍內可以較好的實現放熱反應的抑制效果。在本申請實施方式中,所述鹼性抑制劑與所述酸性引發劑的摩爾比可以為1:2。
在本申請實施方式中,所述酸性引發劑可以為檸檬酸,所述鹼性抑制劑可以為三乙醇胺。
本申請還提供了一種能夠控制放熱反應進程的反應體系,所述反應體系包括亞硝酸鈉/氯化銨化學生熱體系,以及如上所述的複合催化體系,所述複合催化體系中所述酸性引發劑的含量為使得與所述化學生熱體系等體積的水的pH為1.7-3.5。需要說明的是,測量與所述化學生熱體系等體積的水的pH是在與所述化學生熱體系相同的溫度下進行的。
在本申請實施方式中,可以通過將上述複合催化體系用於自生熱的反應體系來控制放熱反應進程。影響放熱反應進程的因素有很多,例如反應物濃度、催化劑濃度、反應溫度、反應物pH值等。在本申請實施方式中,所述複合催化體系利用控制反應物pH值來控制放熱反應進程。
本申請的發明人經過大量實驗後發現,在用所述複合催化體系控制所述化學生熱體系的放熱反應進程時,當所述複合催化體系中酸性引發劑的含量為使得與所述化學生熱體系等體積的水的pH為1.7-3.5時,能夠有效控制放熱反應進程。
在本申請實施方式中,所述酸性引發劑的含量為使得與所述化學生熱體系等體積的水的pH約為2.5。
在本申請中,亞硝酸鈉與氯化銨的摩爾比可以為本領域技術人員已知的範圍。在本申請實施方式中,亞硝酸鈉與氯化銨的摩爾比可以為1:1。
在本申請實施方式中,所述亞硝酸鈉和所述氯化銨的化學生熱體系在使用時通常為亞硝酸鈉水溶液和氯化銨水溶液的混合體系。亞硝酸鈉水溶液和氯化銨水溶液的濃度可以根據實際需要進行選擇。可選地,亞硝酸鈉水溶液和氯化銨水溶液的濃度分別可以為3mol/L。
在本申請中,由於化學生熱體系發生化學反應需要一定的條件,通常溫度對化學反應的影響較大。在亞硝酸鈉/氯化銨化學生熱體系,在較低溫度下,亞硝酸鈉和氯化銨接觸反應較慢,但是升高溫度,將會促進亞硝酸鈉和氯化銨的反應。因此,要控制放熱反應的反應進程,需要抑制或者增強溫度對放熱反應的影響。
本申請還提供了一種使用如上所述的能夠控制放熱反應進程的反應體系控制放熱反應進程的方法,其中,所述複合催化體系的組分和所述化學生熱體系的組分在低於50℃的溫度下混合抑制放熱反應進行;所述複合催化體系的組分和所述化學生熱體系的組分混合後在50℃-60℃的溫度下促進放熱反應進行。
在上述溫度範圍內,所述複合催化體系能夠有效抑制或者增強溫度對放熱反應的影響。
本申請還提供了一種將如上所述的能夠控制放熱反應進程的反應體系用於油水井解堵、驅油的方法,該方法包括在0℃-50℃下將所述複合催化體系的所述酸性引發劑與所述化學生熱體系的氯化銨的水溶液混合,將所述複合催化體系的所述鹼性抑制劑與所述化學生熱體系的亞硝酸鈉的水溶液混合,將兩種混合後的混合物間隔或同時注入油田井筒及地層中。
本申請提供的複合催化體系,在應用於生熱體系時,注入油井的同時加入適當的弱酸弱鹼,抑制弱酸電離,使放熱反應不能順利進行。當到達油層後,由於周圍溫度的上升,體系溫度上升,弱酸電離度變大,溶液pH值降低,變為利於反應引發的酸性環境,促進放熱反應進行,從而實現控制放熱反應進程的目的。
本申請通過加入抑制劑的方式,以溫度作為控制手段,與引發劑混合製備反應引發溫度可控的複合型催化體系,控制化學生熱體系反應的最佳發生溫度和時機,有效利用放熱量、降低熱損失、提高工藝效果。通過複合催化體系使得放熱反應任意可控,可根據不同的油田井筒及地層條件設計化學生熱體系的用量;實現了化學生熱體系的「同時注入」的工藝,提高反應效率及藥劑的利用率。
以下實施例中所用試劑均來自國藥集團化學試劑有限公司,相同的試劑來源相同。
反應液的溫度通過熱電偶溫度傳感器測量。
實施例1
在25℃下,將8.025g氯化銨溶於50mL水中,向氯化銨水溶液中加入0.105g檸檬酸形成混合液;將10.35g亞硝酸鈉溶於50mL水中,向亞硝酸鈉水溶液中加入與檸檬酸的摩爾比分別為1:1、1:2、1:4的三乙醇胺形成混合液;將兩種混合液混合形成反應液。
其中,檸檬酸的添加量使得100mL水的pH值為2.64。通過觀察,反應液的溫度隨時間的變化如圖1所示。
從圖1可以看出:當酸鹼比例為1:1時,可有效推遲溫度峰值達到的時間,約4000s左右。而當酸鹼比例為1:2和1:4時,能夠明顯抑制反應的進行。
對比例1
採用實施例1的方法,不同的是,檸檬酸與三乙醇胺的摩爾比為2:1;或者不加入三乙醇胺,即,只有酸存在。反應液的溫度隨時間的變化如圖1所示。
從圖1可以看出,檸檬酸與三乙醇胺的摩爾比為2:1時,從1000s開始,溫度與檸檬酸與三乙醇胺的摩爾比為1:1時相比,具有明顯上升的趨勢。說明酸含量較高的體系,不利於控制反應的進程。
實施例2
採用實施例1的方法,不同的是,檸檬酸的添加量使得100mL水的pH值為2.34。通過觀察,反應液的溫度隨時間的變化如圖2所示。
從圖2可以看出:當酸鹼比例為1:1時,可有效推遲溫度峰值達到的時間,約2000s左右。而當酸鹼比例為1:2時,能夠明顯推遲溫度峰值達到的時間超過2000s;而當酸鹼比例為1:4時,明顯抑制反應的進行。
對比例2
採用實施例2的方法,不同的是,檸檬酸與三乙醇胺的摩爾比為2:1;或者不加入三乙醇胺。通過觀察,反應液的溫度隨時間的變化如圖2所示。
從圖2可以看出,相比於只含有酸的體系,反應溫度出現峰值的時間接近900s。而檸檬酸與三乙醇胺的摩爾比為2:1時,從400s開始,溫度與檸檬酸與三乙醇胺的摩爾比為1:1時相比,具有明顯上升的趨勢。說明酸的濃度的升高,不利於控制反應的進程。
實施例3
採用實施例1的方法,不同的是,檸檬酸的添加量使得100mL水的pH值為2.22。通過觀察,反應液的溫度隨時間的變化如圖3所示。
從圖3可以看出:當酸鹼比例為1:1時,溫度峰值達到的時間,約1800s左右,而當酸鹼比例為1:2時,能夠明顯推遲溫度峰值達到的時間超過1800s;當酸鹼比例為1:4時,明顯抑制反應的進行。
對比例3
採用實施例3的方法,不同的是,檸檬酸與三乙醇胺的摩爾比為2:1;或者不加入三乙醇胺。通過觀察,反應液的溫度隨時間的變化如圖3所示。
從圖3可以看出,只含有酸的體系,反應溫度出現峰值的時間接近600s。而檸檬酸與三乙醇胺的摩爾比為2:1時,從100s開始,溫度與檸檬酸與三乙醇胺的摩爾比為1:1時相比,具有明顯上升的趨勢。與圖2相比,說明酸的濃度的升高,不利於有效控制反應的進程。同時也說明,本申請的複合催化體系,能夠有效的控制放熱反應的進程。
實施例4
採用實施例1的方法,不同的是,初始溫度為45℃。通過觀察,反應液的溫度隨時間的變化如圖4所示。
從圖4可以看出,當酸鹼比例為1:2時,在保證峰值溫度的情況下可推遲峰值達到時間約1400s。當酸鹼比例為1:1時,可有效推遲溫度峰值達到的時間,約1000s左右。而當酸鹼比例為1:4時,能夠明顯抑制反應的進行。
對比例4
採用實施例4的方法,不同的是,不加入三乙醇胺;或者檸檬酸與三乙醇胺的摩爾比為2:1。通過觀察,反應液的溫度隨時間的變化如圖4所示。
從圖4可以看出,只含有酸的體系,和酸鹼比為2:1的體系反應溫度出現峰值的時間接近,在600s左右,說明酸含量較多不利於有效控制反應的進程。
實施例5
採用實施例4的方法,不同的是,檸檬酸的添加量使得100mL水的pH值為1.94。通過觀察,反應液的溫度隨時間的變化如圖5所示。
從圖5可以看出,酸鹼比例為1:1時,溫度出現峰值的時間降低到500s左右,而當酸鹼比例為1:2時,仍然能夠有效起到延遲反應進行的效果。而酸鹼為1:4時,仍然能夠有效抑制反應的進行。
對比例5
採用實施例5的方法,不同的是,不加入三乙醇胺;或者檸檬酸與三乙醇胺的摩爾比為2:1。通過觀察,反應液的溫度隨時間的變化如圖5所示。
從圖5可以看出,在較高的初始反應溫度下,採用檸檬酸的質量濃度為0.3%時,酸鹼比為2:1時,反應溫度出現峰值的時間接近只含有酸的體系。說明較高的溫度和較高的酸含量,不利於控制反應的進程。
實施例6
採用實施例5的方法,不同的是,檸檬酸的添加量使得100mL水的pH值為1.78。通過觀察,反應液的溫度隨時間的變化如圖6所示。
從圖6可以看出:當酸鹼比例為1:1時,仍然能夠有效起到延遲反應進行的效果,峰值達到時間約700s;當酸鹼比例為1:2時,峰值達到時間約1400s。而酸鹼為1:4時,仍然能夠有效抑制反應的進行。
對比例6
採用實施例6的方法,不同的是,不加入三乙醇胺;或者檸檬酸與三乙醇胺的摩爾比為2:1。通過觀察,反應液的溫度隨時間的變化如圖6所示。
從圖6可以看出,只含有酸的體系,和酸鹼比為2:1的體系反應溫度出現峰值的時間接近,在200s左右,說明酸含量較多不利於控制反應的進程。
對比例7
採用實施例1的方法,不同的是,初始溫度分別為25℃、45℃、60℃和75℃,不加入三乙醇胺。通過觀察,反應液的溫度隨時間的變化如圖7所示。
從圖7可以看出,與45℃初始溫度距離發生劇烈反應的600s相比,初始溫度分別為60℃和75℃發生反應的時間幾乎在100s內,說明,初始溫度大於60℃,不利於控制反應進程。
對比例8
採用對比例7的方法,不同的是,檸檬酸的添加量使得100mL水的pH值分別為2.34、1.94、1.67、1.56。通過觀察,反應液的溫度隨時間的變化如圖8所示。
從圖8可以看出,初始溫度分別為60℃和75℃時,反應溫度出現峰值的時間在100s內。並且與圖7相比,反應溫度出現峰值的時間明顯延長。說明,隨著酸性引發劑的濃度升高,不利於控制反應進程。
對比例9
採用對比例7的方法,不同的是,檸檬酸的添加量使得100mL水的pH值分別為2.22、1.78、1.54、1.33。通過觀察,反應液的溫度隨時間的變化如圖9所示。
從圖9可以看出,初始溫度分別為60℃和75℃時,反應溫度出現峰值的時間在100s內。並且與圖2相比,反應溫度出現峰值的時間接近。說明,與酸性引發劑的濃度相比,初始溫度對反應進程的影響更明顯。
應用實施例1
將實施例1的反應體系用於渤海油田B5井。採用地面合注方式,在地面井口連接具有兩條管線的三通管件,其中一條管線輸送混配有檸檬酸和氯化銨水溶液的混合液,另一條管線輸送混配有三乙醇胺和亞硝酸鈉水溶液的混合液,兩條管線輸送的物料在三通管件處混合後注入井筒。地面溫度18℃,地層溫度62℃,氯化銨水溶液和亞硝酸鈉水溶液的濃度分別為3mol/L;亞硝酸鈉與氯化銨的摩爾比為1:1;檸檬酸與三乙醇胺摩爾配比為1:2。檸檬酸的用量為使得與氯化銨和亞硝酸鈉體系等體積的水的pH為3.5。井筒內體積7m3,注入速度20m3/h(從地面至地層需20min),注入過程中井筒段內注入壓力沒有升高,說明抑制劑的存在延緩了反應的引發;在注入後期(大概260min)時出現了升壓的現象,說明體系液進入地層後在地層溫度下抑制劑失效引發了放熱反應,伴生氣量增加導致注入壓力升高。
從以上實施例可以看出,本申請提供的複合催化體系,能夠有效控制放熱反應的進程,實現了在地面溫度條件下摻複合催化體系的生熱體系混合後使其不發生或極其緩慢發生反應,而在井底溫度條件下抑制劑失效而使放熱反應迅速發生以達到作業目的。從而實現地面合注工藝,有效利用生熱體系,提高生熱效率,增強工藝效果。
雖然本申請所揭露的實施方式如上,但所述的內容僅為便於理解本申請而採用的實施方式,並非用以限定本申請。任何本申請所屬領域內的技術人員,在不脫離本申請所揭露的精神和範圍的前提下,可以在實施的形式及細節上進行任何的修改與變化,但本申請的專利保護範圍,仍須以所附的權利要求書所界定的範圍為準。
