用於神經調節的設備、系統和方法與流程
2023-10-05 22:25:34 1
本申請是發明名稱為「用於神經調節的設備、系統和方法」、申請號為「201280069253.3」、申請日為2012年12月7日的申請的分案申請。
本申請要求2011年12月9日提交的美國申請號61/568,843的優先權,其整體通過在此引用被併入本文。公開內容一般涉及治療性神經調節,更具體而言,涉及用於經治療實現例如肝系統的靶向神經纖維的神經調節以治療代謝疾病或狀況諸如糖尿病的設備、系統和方法的實施方式。
背景
慢性高血糖是糖尿病的界定特徵之一。高血糖是其中存在血糖濃度升高的狀況。由於來自胰腺的受損的胰島素分泌,以及還有或者可選地,由於細胞不能正常響應胰島素,可導致血糖濃度升高。來自腎和肝的過多的葡萄糖釋放是空腹高血糖的重要促進因素。肝是造成大約90%的過多葡萄糖產量的原因。
1型糖尿病是由導致不足的胰島素產量的胰島β細胞的自體免疫破壞造成的。2型糖尿病是更複雜的慢性代謝病症,其由於不足的胰島素產量結合對胰島素作用的細胞抵抗而發展的。胰島素促進葡萄糖攝入到各種組織中而且還減少通過肝和腎產生的葡萄糖;胰島素抗性導致外周葡萄糖攝入減少和內源葡萄糖輸出增多,兩種均驅使血糖濃度高於正常水平。
當前的估計是,在美國大約2600萬人(超過人口的8%)患有一些形式的糖尿病。治療,諸如藥物、飲食和鍛鍊,尋求控制血糖水平,其要求患者密切監測他或她的血糖水平。另外,患有1型糖尿病的患者和許多患有2型糖尿病的患者被要求每日服用胰島素。然而,胰島素不能以小丸的形式被利用,而是必需被皮下注射。由於對糖尿病的治療是由患者日日自我管理的,所以順從或堅持治療可能是個問題。
概述
本文所述若干實施方式一般涉及用於經治療實現靶向神經纖維的神經調節以治療各種醫學狀況、病症和疾病的設備、系統和方法。在一些實施方式中,靶向神經纖維的神經調節被用於治療各種代謝疾病,或降低與各種代謝疾病有關的症狀發生的風險。例如,靶向神經纖維的神經調節可治療糖尿病(diabetes)(例如,糖尿病(diabetesmellitus))或其它糖尿病相關疾病或降低與糖尿病(例如,糖尿病)或其它糖尿病相關疾病有關症狀發生的風險。本文所述方法可有利地治療糖尿病而不需要每日胰島素注射或持續監測血糖水平。通過本文所述設備、系統和方法提供的治療可以是永久的或至少是半永久的(例如,持續若干周、月或年),從而減少繼續或定期治療的需要。本文所述設備的實施方式可以是臨時性的或可植入的。
在一些實施方式中,本文所述靶向神經纖維的神經調節可用於治療胰島素抗性、遺傳代謝症候群、室性心動過速、心房顫動或撲動、心律失常、炎性疾病、高血壓、肥胖、高血糖、高血脂症、進食障礙疾患和/或內分泌疾病。在一些實施方式中,靶向神經纖維的神經調節治療糖尿病、胰島素抗性或其它代謝疾病的任意組合。在一些實施方式中,臨時性或可植入神經調節物可用於調節飽食和食慾。在若干實施方式中,使肝受神經支配(傳入地或傳出地)的神經組織的調節被用於治療血色素沉著、威爾遜病、非酒精脂肪肝炎(nash)、非酒精脂肪肝疾病(nafld)和/或影響肝和/或肝代謝的其它狀況。
在一些實施方式中,與肝有關的交感神經纖維被選擇性地破壞(例如,被消融、被去神經支配、被失去能力、被切斷、被阻斷、被脫敏、被移除),以降低肝葡萄糖產量和/或提高肝葡萄糖攝入,從而有助於治療糖尿病和/或相關疾病或病症,或減小糖尿病和/或相關疾病或病症的風險。破壞可以是永久性或臨時性的(例如,約若干天、周或月)。在一些實施方式中,肝叢中的交感神經纖維被選擇性地破壞。在一些實施方式中,圍繞接近肝固有動脈的肝總動脈的交感神經纖維、圍繞肝固有動脈的交感神經纖維、鄰近腹腔動脈的腹腔神經節中的交感神經纖維、使肝受神經支配或圍繞肝的其它交感神經纖維、使胰腺受神經支配的交感神經纖維、使脂肪組織(例如,內臟脂肪)受神經支配的交感神經纖維、使腎上腺受神經支配的交感神經纖維、使小腸(例如,十二指腸)受神經支配的交感神經纖維、使胃受神經支配的交感神經纖維、使褐色脂肪組織受神經支配的交感神經纖維、使骨骼肌受神經支配的交感神經纖維和/或使腎受神經支配的交感神經纖維被選擇性地破壞或調節,以促進治療或減少與糖尿病有關症狀(例如,糖尿病)或其它代謝疾病或病症。在一些實施方式中,本文所述方法、設備和系統被用於經治療調節與任何糖尿病相關器官或組織有關的自主神經。
根據若干實施方式,含自主纖維的任意神經均被調節,包括、但不限於隱神經、股神經、腰神經、正中神經、尺神經、迷走神經和橈神經。圍繞除肝動脈以外的動脈或靜脈的神經可被調節,諸如、但不限於圍繞腸繫膜上動脈、腸繫膜下動脈、股動脈、盆腔動脈、門靜脈、肺動脈、肺靜脈、腹部主動脈、腔靜脈、脾動脈、胃動脈、頸內動脈、頸內靜脈、椎動脈、腎動脈和腎靜脈的神經。
根據若干實施方式,治療性神經調節系統被用於選擇性地破壞交感神經纖維。神經調節系統可包括消融導管系統和/或遞送導管系統。消融導管系統可利用射頻(rf)能量,以消融交感神經纖維,從而引起交感交流的神經調節或破壞。在一些實施方式中,消融導管系統利用超聲能量,以消融交感神經纖維。在一些實施方式中,消融導管系統利用超聲(例如,高強度聚焦超聲或低強度聚焦超聲)能量選擇性地消融交感神經纖維。在其它實施方式中,消融導管系統利用電穿孔法調節交感神經纖維。如本文中所使用的,消融導管不應限於引起消融,而且還包括有助於神經調節(例如,部分或可逆的消融、阻斷而不消融、刺激)的設備。在一些實施方式中,遞送導管系統遞送藥物或化學劑至神經纖維,以調節神經纖維(例如,經化學消融)。用於化學消融(或一些其它形式的經化學介導的神經調節)的化學劑可,例如包括苯酚、醇或使神經纖維化學消融的任意其它化學劑。在一些實施方式中,冷凍療法被使用。例如,提供利用冷凍消融選擇性地調節(例如,消融)交感神經纖維的消融導管系統。在其它實施方式中,遞送導管系統被用於近距離放射療法,以調節神經纖維。導管系統可進一步利用rf能量、超聲能量、聚焦超聲(例如,hifu、lifu)能量、離子化能量(諸如x-射線、質子束、γ射線、電子束和α射線)、電穿孔法、藥物遞送、化學消融、冷凍消融、近距離放射療法或任意其它形式的任意組合,從而引起自主(例如,交感的或副交感的)神經纖維的破壞或神經調節(例如,消融、去神經支配、刺激)。
在一些實施方式中,微創手術技術被用於遞送治療性神經調節系統。例如,用於交感神經纖維的破壞或神經調節的導管系統可經動脈內(例如,經股動脈、臂動脈、橈動脈)被遞送。在一些實施方式中,消融導管系統被推進至肝固有動脈,以消融(完全地或部分地)肝叢中的交感神經纖維。在其它實施方式中,消融導管系統被推進至肝總動脈,以消融圍繞肝總動脈的交感神經纖維。在一些實施方式中,消融導管系統被推進至腹腔動脈,以消融腹腔神經節或腹腔叢中的交感神經纖維。消融或遞送導管系統可被推進到其它動脈(例如,肝左動脈、肝右動脈、胃十二指腸動脈、胃動脈、脾動脈、腎動脈等)中,以破壞與肝或其它器官或組織(諸如胰腺、脂肪組織(例如,肝的內臟脂肪)、腎上腺、胃、小腸、膽管、褐色脂肪組織、骨骼肌)有關的靶向交感神經纖維,其中至少一些可能與糖尿病臨床相關。
在一些實施方式中,治療性神經調節或破壞系統經血管內被遞送經過靜脈系統。例如,治療性神經調節系統可被遞送或者經過門靜脈或者經過下腔靜脈。在一些實施方式中,神經調節系統經皮膚被遞送至膽管樹,以調節或破壞(幹擾,disrupt)交感神經纖維。
在其它實施方式中,神經調節系統經腔或經腹腔鏡被遞送,以調節或破壞交感神經纖維。例如,神經調節系統可經腔被遞送或者經過胃或者經過十二指腸。
在一些實施方式中,微創手術遞送神經調節系統是結合圖像引導技術完成的。例如,可視化設備,諸如纖維光學鏡可用於在微創手術遞送神經調節系統中提供圖像引導。在一些實施方式中,螢光透視、計算機化x線體層照相術(ct)、放射照相、光學相干x線體層照相術(oct)、血管內超聲(ivus)、都卜勒、熱相圖和/或磁共振(mr)成像被用於結合微創手術遞送神經調節系統。在一些實施方式中,射線不透標記被定位於神經調節系統的遠端,以幫助神經調節系統的遞送和對齊。
在一些實施方式中,開放式外科手術被用於進入待被調節的神經纖維。在一些實施方式中,本文所述的任意形式,包括、但不限於rf能量、超聲能量、hifu、熱能量、光能量、除rf能量以外的電能量、藥物遞送、化學消融、冷凍消融、蒸汽或熱水、離子化能量(諸如x-射線、質子束、γ射線、電子束和α射線)或任意其它形式結合開放式外科手術被用於調節或破壞交感神經纖維。在其它實施方式中,神經纖維經手術被切割(例如,橫切),以破壞神經信號的傳導。
在一些實施方式中,非創(例如,經皮的)程序被用於調節或破壞交感神經纖維。在一些實施方式中,本文所述的任意形式,包括、但不限於rf能量、超聲能量、hifu能量、放射治療、光能量、紅外線能量、熱能量、蒸汽、熱水、磁場、離子化能量、其它形式的電或電磁能量或任意其它形式結合非創程序被用於調節或破壞交感神經纖維。
根據一些實施方式,神經調節系統被用於調節或破壞一個或多個位置或目標位點處的交感神經纖維。例如,消融導管系統可以圓周或半徑式樣進行消融和/或消融導管系統可在沿血管長度線性間隔開的多個點處進行消融。在其它實施方式中,消融導管系統在一個或多個位置處以能夠在交感神經纖維的交流通道中導致破壞的任意其它式樣(例如,螺旋形式樣、z字形式樣、多線性式樣等)進行消融。式樣可以是連續的或非連續的(例如,間歇的)。消融可靶向血管周圍的某部分(例如,周圍的一半或小於一半的部分)。
根據本文公開的本發明實施方式,治療各種醫學病症和疾病的治療性神經調節包括靶向神經纖維的神經刺激。例如,自主神經纖維(例如,交感神經纖維、副交感神經纖維)可被刺激,以治療糖尿病(例如,糖尿病)或其它狀況、疾病和病症或降低糖尿病(例如,糖尿病)或其它狀況、疾病和病症發生的風險。
在一些實施方式中,使肝受神經支配的副交感神經纖維被刺激。在一些實施方式中,使胰腺、脂肪組織(例如,肝的內臟脂肪)、腎上腺、胃、腎、褐色脂肪組織、骨骼肌和/或小腸(例如,十二指腸)受神經支配的副交感神經纖維被刺激。根據一些實施方式,使肝、胰腺、脂肪組織、腎上腺、胃、腎、褐色脂肪組織、骨骼肌和小腸受神經支配的副交感神經纖維的任意組合被刺激以治療或減輕糖尿病(例如,糖尿病)或其它狀況、疾病或病症或降低與糖尿病(例如,糖尿病)或其它狀況、疾病或病症有關症狀發生的風險。在一些實施方式中,器官或組織被從內部或從外部直接刺激。
在一些實施方式中,神經刺激物被用於刺激交感或副交感神經纖維。在一些實施方式中,神經刺激物是可植入的。根據一些實施方式,可植入神經刺激物電刺激副交感神經纖維。在一些實施方式中,可植入神經刺激物化學刺激副交感神經纖維。在再其它實施方式中,可植入神經刺激物利用電刺激、化學刺激或能夠刺激副交感神經纖維的任意其它方法的任意組合。
在其它實施方式中,非創神經刺激被用於實現副交感神經纖維的刺激。例如,經皮電刺激可用於刺激副交感神經纖維。其它能量形式也可用於實現副交感神經纖維的非創神經刺激(例如,光能量、超聲能量)。
在一些實施方式中,靶向自主神經纖維的神經調節通過降低系統性葡萄糖治療糖尿病(例如,糖尿病)和相關狀況。例如,靶向神經纖維的治療性神經調節可通過降低肝葡萄糖產量降低系統性葡萄糖。在一些實施方式中,通過破壞(例如,消融)交感神經纖維而降低肝葡萄糖產量。在其它實施方式中,通過刺激副交感神經纖維而降低肝葡萄糖產量。
在一些實施方式中,靶向神經纖維的治療性神經調節通過提高肝葡萄糖攝入來降低系統性葡萄糖。在一些實施方式中,通過破壞(例如,消融)交感神經纖維而提高肝葡萄糖攝入。在其它實施方式中,通過刺激副交感神經纖維而提高肝葡萄糖攝入。在一些實施方式中,通過治療性神經調節降低甘油三酯或膽固醇水平。
在一些實施方式中,肝叢的交感神經纖維的破壞或調節對圍繞肝的副交感神經纖維沒有影響。在一些實施方式中,肝叢的交感神經纖維的破壞或調節(例如,消融或去神經支配)導致極低密度脂蛋白(vldl)水平降低,從而導致對脂質分布的有益作用。在若干實施方式中,本發明包括神經調節治療,以影響交感神經激動和/或甘油三酯或膽固醇水平,包括高密度脂蛋白(hdl)水平、低密度脂蛋白(ldl)水平和/或極低密度脂蛋白(vldl)水平。在一些實施方式中,交感神經的去神經支配或消融降低甘油三酯水平、膽固醇水平和/或中樞交感神經激動。
在其它實施方式中,靶向神經纖維的治療性神經調節(例如,肝去神經支配)通過提高胰島素分泌降低系統性葡萄糖。在一些實施方式中,通過破壞(例如,消融)交感神經纖維(例如,肝動脈的周圍分支)而提高胰島素分泌。在其它實施方式中,通過刺激副交感神經纖維而提高胰島素分泌。在一些實施方式中,圍繞胰腺的交感神經纖維可被調節,以降低胰高血糖素水平和提高胰島素水平。在一些實施方式中,圍繞腎上腺的交感神經纖維被調節,以影響腎上腺素或去甲腎上腺素水平。肝的脂肪組織(例如,內臟脂肪)可被靶向,以影響甘油或游離脂肪酸水平。
根據本發明若干實施方式,降低對象中血糖水平的方法被提供。方法包括在對象腹股溝中形成切口以進入股動脈和插入神經調節導管到切口中。在一些實施方式中,方法包括從股動脈推進神經調節導管經過動脈系統至肝固有動脈和使待通過消融導管經血管內遞送到肝固有動脈的內壁的治療有效量的能量熱抑制沿圍繞肝固有動脈的肝叢內交感神經的神經交流,從而降低對象內的血糖水平。其它切口或進入點可在期望或需要時使用。
在一些實施方式中,神經調節導管是包括一個或多個電極的射頻(rf)消融導管。在一些實施方式中,神經調節導管是高強度聚焦超聲消融導管。在一些實施方式中,神經調節導管是冷凍消融導管。方法可進一步包括刺激一個或多個與肝有關的副交感神經,以降低肝葡萄糖產量或提高葡萄糖攝入。
根據若干實施方式,治療患有糖尿病或具有與糖尿病有關症狀的對象的方法被提供。方法可包括遞送rf消融導管至對象肝叢附近和通過使rf能量從rf消融導管的一個或多個電極射出而破壞沿肝叢的交感神經的神經交流。在一些實施方式中,rf消融導管經血管內被遞送經過股動脈至肝固有動脈內的位置。在一些實施方式中,rf能量通過rf消融導管經血管外被遞送。
在一些實施方式中,破壞神經交流包括永久地使沿肝叢的交感神經的神經交流不能進行。在一些實施方式中,破壞神經交流包括臨時性抑制或減少沿肝叢的交感神經的神經交流。在一些實施方式中,破壞沿肝叢的交感神經的神經交流包括破壞沿肝叢的多個交感神經的神經交流。
該方法可進一步包括布置rf消融導管在對象的腹腔叢附近和通過使rf能量從rf消融導管的一個或多個電極射出而破壞沿腹腔叢的交感神經的神經交流。在一些實施方式中,方法包括布置rf消融導管在使胰腺受神經支配的交感神經纖維附近和通過使rf能量從rf消融導管的一個或多個電極射出而破壞沿所述交感神經纖維的神經交流、布置rf消融導管在使胃受神經支配的交感神經纖維附近和通過使rf能量從rf消融導管的一個或多個電極射出而破壞沿所述交感神經纖維的神經交流、和/或布置rf消融導管在使十二指腸受神經支配的交感神經纖維附近和通過使rf能量從rf消融導管的一個或多個電極射出而破壞沿所述交感神經纖維的神經交流。在一些實施方式中,藥物或治療劑可被遞送至肝或周圍器官或組織。
根據若干實施方式,提供了降低對象中血糖水平的方法。方法包括插入rf消融導管到對象的血管系統中和推進rf消融導管至肝動脈分支(例如,肝固有動脈或肝總動脈)的位置。在一個實施方式中,方法包括使待通過消融導管經血管內遞送到肝固有動脈的內壁的治療有效量的rf能量熱抑制圍繞肝固有動脈的肝叢的交感神經內的神經交流,從而降低所述對象內的血糖水平。
在一個實施方式中,目標血管的血管內壁的位置處或目標神經的位置處的治療有效量的rf能量在約100j和約1kj(例如,在約100j和約500j之間、在約250j和約750j之間、在約500j和1kj之間或其重疊範圍)之間的範圍內。在一個實施方式中,治療有效量的rf能量的功率在約0.1w和約10w(例如,在約0.5w和約5w之間、在約3w和約8w之間、在約2w和約6w之間、在約5w和約10w之間或其重疊範圍)之間。
在一個實施方式中,rf消融導管包括至少一個消融電極。rf消融導管可被配置成使至少一個消融電極接觸肝動脈分支的內壁,和在遞送rf能量時以足夠接觸壓力維持與內壁的接觸。在一個實施方式中,rf消融導管包括氣囊式導管,其被配置成維持至少一個電極與肝動脈分支的內壁的足夠接觸壓力。在一個實施方式中,rf消融導管包括可操縱的遠末端,其被配置成維持至少一個電極與肝動脈分支的內壁的足夠接觸壓力。在各種實施方式中,足夠接觸壓力範圍可以是0.1g/mm2至約100g/mm2(例如,在約0.1g/mm2和約10g/mm2之間)。在一些實施方式中,rf消融導管包括至少一個錨定構件,其被配置成維持至少一個電極與肝動脈分支的內壁的接觸。
根據若干實施方式,提供了治療患有糖尿病或具有與糖尿病有關症狀的對象的方法。在一個實施方式中,方法包括遞送rf消融導管至肝動脈分支(例如,肝固有動脈、肝總動脈或兩者之間的分叉附近或之內)內的肝叢附近。在一個實施方式中,rf消融導管包括至少一個電極。方法可包括布置至少一個電極接觸肝動脈分支的內壁。在一個實施方式中,方法包括通過應用電信號至至少一個電極,因而使熱能量通過至少一個電極被遞送以加熱肝動脈分支的內壁,來破壞圍繞肝動脈分支的肝叢的交感神經的神經交流。非消融加熱、消融加熱或其組合在若干實施方式中被利用。
在一個實施方式中,破壞神經交流包括永久地使肝叢的交感神經不能進行神經交流。在一個實施方式中,破壞神經交流包括臨時性抑制或減少沿肝叢的交感神經的神經交流。在一些實施方式中,方法包括布置rf消融導管在對象的腹腔叢附近和破壞沿所述腹腔叢的交感神經的神經交流、布置rf消融導管在使胰腺受神經支配的交感神經纖維附近和破壞沿所述交感神經纖維的神經交流、布置rf消融導管在使胃受神經支配的交感神經纖維附近和破壞沿所述交感神經纖維的神經交流、和/或布置rf消融導管在使十二指腸受神經支配的交感神經纖維附近和破壞沿所述交感神經纖維的神經交流,所述破壞沿所述交感神經纖維的神經交流通過使rf能量從所述rf消融導管的所述至少一個電極射出而進行。在若干實施方式中,提供反饋機構,以有助於確認神經調節和允許實時調整治療。
根據若干實施方式,提供了治療患有糖尿病或具有與糖尿病有關症狀的對象的方法。在一個實施方式中,方法包括在肝動脈內遞送神經調節導管至對象肝叢附近和通過使rf能量從rf消融導管的一個或多個電極射出而調節肝叢的神經。在一個實施方式中,調節肝叢的神經的步驟包括使所述肝叢的交感神經去神經支配和/或刺激肝叢的副交感神經。在一個實施方式中,交感的去神經支配和副交感的刺激同時進行。在一個實施方式中,交感的去神經支配和副交感的刺激相繼進行。在一個實施方式中,交感神經被調節而無需調節圍繞相同血管或組織的副交感神經。
根據若干實施方式,提供了被配置用於肝神經調節的裝置。在一個實施方式中,裝置包括氣囊式導管,其被配置用於血管內放置到肝動脈分支中。在一個實施方式中,氣囊式導管包括至少一個可擴張氣囊和雙極電極對。在一個實施方式中,雙極電極對的至少一個被配置成在所述至少一個可擴張氣囊擴張時,被布置成擴張接觸所述肝動脈分支的內壁。在一個實施方式中,雙極電極對被配置成遞送熱能量劑量,其被配置成實現肝去神經支配。至少一個可擴張氣囊可被配置成維持所述雙極電極對的所述至少一個電極和所述肝動脈分支的內壁之間的足夠接觸壓力。在一些實施方式中,氣囊式導管包括兩個可擴張氣囊,其上各布置所述雙極電極對的一個電極。在一個實施方式中,氣囊式導管包括單一可擴張氣囊和雙極電極對被布置在可擴張氣囊上。在一個實施方式中,氣囊包括所述氣囊的腔內的冷卻流體。
根據若干實施方式,提供了被配置用於肝神經調節的裝置。在一個實施方式中,裝置包括導管,導管包括腔和開放的遠端;和可操縱杆,可操縱杆被配置成可滑動地容納在所述導管的腔內。在一個實施方式中,可操縱杆的至少遠側部分包括具有預成形狀的形狀記憶材料,其被配置成使所述可操縱杆的所述遠側部分彎曲,以在將所述可操縱杆的所述遠側部分推出所述導管的所述開放的遠端時接觸血管壁。在一個實施方式中,可操縱杆的遠端包括至少一個電極,其被配置成被激活,以遞送熱能量劑量,熱能量劑量被配置成實現使肝動脈分支或其它目標血管去神經支配。在一個實施方式中,可操縱杆的形狀記憶材料足夠有回彈性,以在肝去神經支配過程中維持至少一個電極和肝動脈分支內壁之間足夠接觸壓力。導管遠端處的外直徑可小於導管近端處的外直徑,以在具有小內徑的血管內容納插入物。在各種實施方式中,導管遠端處的外直徑在約1mm和約4mm之間。在一個實施方式中,至少一個電極包括具有一個或多個窗的塗層。
根據若干實施方式,提供了神經調節試劑盒。在一個實施方式中,試劑盒包括神經調節導管,其被配置成被插入肝系統的血管內,以調節圍繞肝動脈的神經。在一個實施方式中,試劑盒包括多個能量遞送設備,其被配置成被插入神經調節導管的腔內。在一個實施方式中,各能量遞送設備均在能量遞送設備的遠端處或其附近包括至少一個調節構件。在一個實施方式中,各能量遞送設備均包括遠側部分,其包括不同的預成形狀記憶構造。至少一個調節構件可被配置成被激活,以調節至少部分圍繞肝動脈的神經,以治療與糖尿病有關症狀。
在若干實施方式中,本發明包括調節神經系統,以治療影響胰島素和/或葡萄糖、諸如胰島素調節、葡萄糖攝入、代謝等的病症。在一些實施方式中,神經系統輸入和/或輸出被臨時或永久地調節(例如,減少)。若干實施方式被配置成執行以下作用中的一個或組合:消融神經組織、加熱神經組織、冷卻神經組織、失活神經組織、切割神經組織、細胞裂解、凋亡和壞死。在一些實施方式中,進行局部化神經調節,使周圍組織不受影響。在其它實施方式中,還治療圍繞靶向神經(一個或多個)的組織。
根據若干實施方式,與腎去神經支配程序相比,肝去神經支配的方法用較短的程序和能量應用時間進行。在若干實施方式中,進行肝去神經支配而不引起疼痛或在治療中減輕對象疼痛。根據若干實施方式,進行神經調節(例如,去神經支配或消融)而不引起目標血管(例如,肝動脈)內的狹窄或血栓形成。在涉及熱治療的實施方式中,與現有去神經支配系統和方法相比,可防止或減少在血流中損失的熱,導致較低的功率和較短的治療時間。在各種實施方式中,進行神經調節的方法而對目標血管幾乎沒有或沒有內皮損傷。在若干實施方式中,能量遞送在所有方向中基本上被等量遞送(例如,全方向遞送)。在神經調節系統(例如,本文所述基於導管的能量遞送系統)的各種實施方式中,維持與目標血管壁的足夠的電極接觸,從而降低功率水平、電壓水平和治療時間。
為了總結本公開內容的目的,在此描述本發明實施方式的某些方面、優勢和新特徵。應該理解,根據本文公開的本發明的任意具體實施方式,不一定實現所有這樣的優勢。因此,以實現或優化本文教導或暗示的一個優勢或優勢組而不一定實現本文可能教導或暗示的其它優勢的方式,本文公開的實施方式可被實施或執行。
附圖簡介
圖1圖解根據本發明實施方式的目標治療位置——包括肝和肝血供應——的解剖結構。
圖2圖解供應血至肝及其周圍器官和組織的各種動脈以及使肝及其周圍器官和組織受神經支配的神經。
圖3圖解肝總動脈和肝叢的神經的示意圖。
圖4a-4c、5a和5b、6和7圖解被配置成促進神經調節的壓縮構件的實施方式。
圖8和9圖解神經調節導管的實施方式。
圖10和11圖解電極導管的實施方式。
圖12a和12b圖解消融線圈的實施方式。
圖13a-13c、14a和14b圖解能量遞送導管的實施方式。
圖15圖解導管遠末端電極和導絲形狀的若干實施方式。
圖16a和16b圖解開窗的消融導管的實施方式。
圖17圖解基於氣囊的體積消融導管系統的實施方式。
圖18圖解基於微波的消融導管系統的實施方式。
圖19圖解基於感應的消融導管系統的實施方式。
圖20圖解蒸汽消融導管的實施方式。
圖21圖解熱水氣囊消融導管的實施方式。
圖22a-22d圖解幾何模型。
圖23是圖解通過兩個口服葡萄糖耐性測試(ogtts)報告的、針對三隻狗的平均靜脈血漿葡萄糖隨時間的圖。
圖24圖解在高血糖-高胰島素鉗夾研究期間獲得的平衡的淨肝葡萄糖。
詳細描述
i.介紹和綜述
本文所述的本發明實施方式一般涉及靶向神經纖維的治療性神經調節,以治療各種代謝疾病、狀況或病症,包括但不限於糖尿病(例如,糖尿病)或降低各種代謝疾病、狀況或病症,包括但不限於糖尿病(例如,糖尿病)發生或發展的風險。雖然說明書在各種實施方式中闡述了具體的細節,但應該理解,說明書僅是說明性的,而不應該以任何方式被解釋為限制公開內容。而且,公開的實施方式的各種應用及其修改——本領域技術人員可以想到的——通過本文所述的一般概念也被包括在內。
自主神經系統包括交感和副交感神經系統。交感神經系統是造成身體「對抗或逃走(flight)」反應——可使身體準備一定周期的高應力或劇烈的體力消耗——的自主神經系統的組分。因此,交感神經系統的功能之一是在興奮或應力周期中提高葡萄糖對快速能量代謝的可用性和降低胰島素分泌。
肝在維持正常血糖濃度中可發揮重要作用。例如,肝可通過形成糖原——大的葡萄糖聚合物——將過多葡萄糖存儲於其細胞內。然後,如果血糖濃度開始太劇烈地降低,則葡萄糖分子可從存儲的糖原中分離並返回至血液,以被其它細胞作為能量使用。肝是高度血管器官,其通過兩個獨立的血液供應——一個是門靜脈(作為肝的主要血供應)和另一個是肝動脈(是肝的次要血供應)——而被供應。
將糖原分解成葡萄糖的過程被稱為糖原分解,其是交感神經系統可提高系統性葡萄糖的一種方式。為了使糖原分解發生,酶——磷酸化酶必需首先被激活,以引起磷酸化,磷酸化允許單個的葡萄糖分子與糖原聚合物的分支分開。例如,激活磷酸化酶的一種方法是通過腎上腺髓質的交感刺激。通過刺激使腎上腺髓質受神經支配的交感神經,腎上腺素被釋放。然後,腎上腺素促進環狀amp的形成,其進而又發起激活磷酸化酶的活性反應。激活磷酸化酶的可選方法是通過胰腺的交感刺激。例如,通過由胰腺的α細胞釋放激素胰高血糖素可激活磷酸化酶。類似於腎上腺素,胰高血糖素刺激環狀amp的形成,其進而又開始化學反應以激活磷酸化酶。
其中肝起維持正常血糖濃度的作用的另外的方法是通過糖異生過程。當血糖濃度低於正常時,肝將由各種胺基酸和甘油合成葡萄糖,以維持正常血糖濃度。已經顯示,交感活性提高增加糖異生,從而導致血糖濃度提高。
副交感神經系統是自主神經系統的第二組分,其負責身體的「休息和消化」功能。這些「休息和消化」功能補足交感神經系統的「對抗或逃走」反應。副交感神經系統的刺激與降低的血糖水平有關。例如,已經顯示副交感神經系統的刺激提高胰腺β細胞的胰島素分泌。由於葡萄糖運輸經過細胞膜的速率被胰島素大大提高,所以提高由胰腺分泌的胰島素的量可幫助降低血糖濃度。在一些實施方式中,使胰腺受神經支配的副交感神經的刺激結合使肝受神經支配的交感神經的去神經支配,以治療糖尿病或與糖尿病有關症狀(例如,高血糖水平、高甘油三酯水平、高膽固醇水平)低胰島素分泌水平)。圍繞其它器官或組織的交感和/或副交感神經的刺激和/或去神經支配還可組合執行。
圖1圖解肝101和目標肝治療位置100的血管系統(脈管系統,vasculature)。血管系統包括肝總動脈105、肝固有動脈110、肝右動脈115、肝左動脈120、肝右靜脈125、肝左靜脈130、肝中靜脈135和下腔靜脈140。在肝血供應系統中,通過流經肝總動脈105、肝固有動脈110,然後流經肝左動脈120或肝右動脈115,血液進入肝。肝右動脈115和肝左動脈120(以及門靜脈,未顯示)提供血供應至肝101,並直接流入肝101的肝組織內的毛細血管床。肝101利用氧化血流提供的氧,氧化血流由肝右動脈115和肝左動脈120提供。來自肝101的去氧化血液離開肝101經過肝右靜脈125、肝左靜脈130和肝中靜脈135,其均流入下腔靜脈140。
圖2圖解圍繞肝的各種動脈和使肝及其周圍器官和組織受神經支配的各種神經系統200。動脈包括腹部主動脈205、腹腔動脈210、肝總動脈215、肝固有動脈220、胃十二指腸動脈222、肝右動脈225、肝左動脈230和脾動脈235。圖解的各種神經系統200包括腹腔叢240和肝叢245。給肝的血供應從心泵送至主動脈,然後向下經過腹部主動脈205和進入腹腔動脈210。血液從腹腔動脈210前進,經過肝總動脈215,進入肝固有動脈220,然後經過肝右動脈225和肝左動脈230進入肝。肝總動脈215從腹腔幹分支。肝總動脈215產生胃和胃十二指腸動脈。使肝受神經支配的神經包括腹腔叢240和肝叢245。腹腔叢240環繞腹腔動脈210並繼續進入肝叢245,肝叢245環繞肝固有動脈220、肝總動脈215,並可繼續進入肝右動脈225和肝左動脈230。在一些解剖結構中,腹腔叢240和肝叢245緊緊粘附於供應血液給肝的動脈的壁(並且一些神經可包埋在供應血液給肝的動脈的外膜內),從而使得內-至-外-血管神經調節特別有利於調節腹腔叢240和/或肝叢245的神經。在若干實施方式中,血管(例如,肝動脈)的中膜厚度範圍為約0.1cm至約0.25cm。在一些解剖結構中,至少大部分的肝動脈分支的神經纖維定位在離腔壁0.5mm至1mm內,以便利用血管內途徑的調節(例如,去神經支配)對降低的功率或能量劑量要求有效。在一些實施方式中,低-功率或低-能量(例如,小於10w的功率輸出和/或小於1kj的能量,其被遞送至目標血管內壁或目標神經)血管內能量遞送可被利用,因為神經緊緊粘附於供應血液給肝的動脈(例如,肝動脈分支)的外壁或其內部。
繼續參考圖1和2,肝叢245是腹腔叢240的最大分支。據認為,肝叢245主要攜帶傳入和傳出交感神經纖維,傳入和傳出交感神經纖維的刺激可通過一些機制提高血糖水平。例如,刺激肝叢245中的交感神經纖維可通過提高肝葡萄糖產量提高血糖水平。刺激肝叢245的交感神經纖維還可通過降低肝葡萄糖攝入提高血糖水平。因此,通過破壞肝叢245中的交感神經信號傳導,血糖水平可降低或減少。
在若干實施方式中,在圖1和2中鑑定的任意區域(例如,神經)均可根據本文所述實施方式被調節。可選地,在一個實施方式中,局部化治療被提供給肝叢,同時使這些其它區域中的一個或多個不受影響。在一些實施方式中,圖1和2所示(例如,器官、動脈、神經系統的)多個區域可被組合調節(同時或相繼)。
圖3是肝叢300的神經纖維的示意性圖解。部分肝總動脈305(或者可選地,肝固有動脈)被顯示,其中肝叢300環繞所述動脈。一些肝叢的神經纖維可包埋在肝總動脈305(或肝固有動脈)的外膜內或至少緊緊粘附於外血管壁或其內部。如所示,存在血管腔軸,其沿著動脈腔的中心。肝叢300由副交感神經310和交感神經315組成。在一些解剖結構中,副交感神經310趨於向下經過動脈周圍的一半,和交感神經315趨於向下經過動脈的另一半。
如示於圖3,肝總動脈305部分大致為圓柱形,其中副交感神經310使圓柱體的大約180°弧受神經支配,和肝叢315的交感神經使圓柱體的對面大約180°弧受神經支配。在一些解剖結構中,在肝叢的副交感神經310和交感神經315之間存在非常小的重疊(如果有的話)。這樣的離散在僅肝叢的交感神經315或副交感神經310待被調節的實施方式中可以是有利的。在一些實施方式中,肝叢的交感神經315的調節可以是期望的,而肝叢的副交感神經310的調節可以不是期望的(或反之亦然)。
在一些實施方式中,僅目標血管系統外膜層的選定區域被調節。在一些對象中,副交感和交感神經可明顯分布於血管外膜層上或其內。例如,利用通過血管腔產生的軸,肝叢的副交感神經可位於外膜的一個180度弧中,而交感神經可位於外膜的另一個180度弧中,諸如示於圖3。一般而言,交感神經纖維趨於沿肝動脈的前表面延伸,而副交感神經纖維朝向肝動脈的後表面被定位。在這些情況中,通過調節前區域或後區域中的神經選擇性地破壞交感或副交感神經可以是有利的。
在一些對象中,交感神經纖維可沿相當長度的肝動脈延伸,而副交感神經纖維可朝向肝動脈的遠側範圍連接。研究已經表明,迷走神經連接接近肝實質(例如,在比圍繞肝動脈樹的神經更遠側的位置中)的肝門。因為迷走神經是副交感神經,圍繞肝動脈的近側的神經可主要是交感神經。根據若干實施方式,在期望破壞肝叢中的交感神經時,可朝向其近側範圍(例如,腹腔動脈的第一分支和肝總動脈的第一分支之間的中途)進行肝固有動脈的調節(例如,消融)。肝動脈近側範圍的消融可有利地提供避免像膽管和門靜脈(其在朝向肝遠側經過時接近肝動脈)這樣的關鍵結構的伴隨利益。
在一個實施方式中,僅肝動脈的前區域被選擇性地調節(例如,消融)。在一個實施方式中,大約180度的動脈周圍被消融。在一些實施方式中,期望在約60°至約240°、約80°至約220°、約100°至約200°、約120°至約180°、約140°至約160°或其重疊範圍的範圍內消融。在一些實施方式中,與被靶向的血管壁部分相對的未被靶向的血管壁部分在調節程序中被主動冷卻。這樣的冷卻可降低對不意圖進行治療的神經纖維的間接損壞。在許多實施方式中,不利用冷卻。
在其中僅選定部分的血管壁待被治療的實施方式中,z字形、重疊半圓形、螺旋形、套索或其它式樣的消融可用於僅治療外膜中選定區域的神經組織。根據一個實施方式,螺旋形消融式樣z的實例示於圖3。在一些實施方式中,具有內在的z字形、螺旋形或其它式樣的一個或多個消融電極被利用。在一些實施方式中,單點消融電極(不考慮電極式樣)被縱向和圓周推進大約基本上180度的血管周圍,以以z字形、螺旋形或其它式樣進行消融,從而選擇性地僅消融大約180度的血管壁和伴隨神經組織。在一些實施方式中,其它式樣的電極構造被利用。在一些實施方式中,其它式樣的消融電極移動(不考慮內在的構象)被利用。
在一些實施方式中,其中僅選定區域的血管壁待被調節(例如,被消融或刺激),具有高度的導管控制、穩定性和/或精確度可以是有幫助的。為實現對高度精確度所必須的控制,引導導管可用於接合鄰近分支(例如,從腹腔動脈的肝總動脈分支)的口(ostium),以提供布置消融導管的恆定參考點。可選地,導管還可錨定在其它分支中——單獨地或同時地,以進一步提高控制。同時錨定可通過順應的、充氣式氣囊(例如,具有形狀和尺寸,其被配置成匹配特定血管的口或另外部分)——可充分堵塞血管腔(例如,口)——的手段實現,從而錨定導管和提供提高的穩定性。這樣的方法可避免需要血管造影術來表示出治療路線,包括伴隨的有害的造影劑和x-射線暴露,因為可相對於參考血管造影進行治療指導,同時神經調節導管與引導導管的距離在患者外面被測量。在一些實施方式中,充氣式氣囊可具有尺寸和形狀,其被配置成接合多個口或在多個分支中錨定。
腹腔叢遠側的血管分支的解剖結構在對象之間可高度不同,並且,交感和副交感神經途徑中的差異趨於主要與腹腔叢遠側的分支有關,而不是與沿肝動脈遠側的任意特定距離有關。在一些實施方式中,基於相對於分支解剖結構的位置而不是基於沿肝動脈的任意固定距離選定神經調節位置,以靶向交感神經纖維;例如,在肝總動脈內和離腹腔幹分支約1cm–6cm(例如,約2cm–3cm或基本上處於肝總動脈的中間點)。
副交感和交感神經纖維趨於具有相反的生理效應,因此,在一些實施方式中,僅交感神經纖維而不是副交感神經纖維被破壞(例如,去神經支配、消融),以實現減少內源葡萄糖產量和提高肝和外周葡萄糖存儲的效應。在一些實施方式中,僅副交感神經纖維而不是交感神經纖維被刺激,以實現減少內源葡萄糖產量和提高肝和外周葡萄糖存儲的效應。在一些實施方式中,交感神經纖維被去神經支配而副交感神經纖維同時被刺激,以實現減少內源葡萄糖產量和提高肝和外周葡萄糖存儲的效應。在一些實施方式中,交感神經纖維的去神經支配和副交感神經纖維的刺激相繼進行。
根據若干實施方式,用於預防或治療病症(諸如糖尿病)的治療性神經調節的方法包括調節神經纖維(例如,肝叢的交感神經纖維)。在一個實施方式中,神經調節降低肝葡萄糖產量和/或提高肝葡萄糖攝入,其進而又可導致血糖水平的降低。通過阻斷或以其它方式調節(永久地或臨時性地)神經纖維或周圍區域來消融、去神經支配、切割、破壞、移除、脫敏、使失去能力、減少、變形(crush)或壓縮、或抑制神經活性,可實現神經纖維的破壞。在一些實施方式中,利用一種或多種能量形式完成破壞。能量形式包括、但不限於微波、射頻(rf)能量、熱能量、電能量、超聲能量、聚焦超聲諸如高強度或低強度聚焦超聲、雷射能量、光療或光動力學治療(例如,結合一種或多種活化劑)、離子化能量遞送(諸如x-射線、質子束、γ射線、電子束和α射線)、冷凍消融、和化學消融、或其任意組合。在一些實施方式中,通過化學製品或治療劑(例如,經藥物遞送)——單獨的或結合能量形式——完成交感神經纖維的破壞。在一些實施方式中,離子化能量被遞送至目標區域,以防止神經再生長。
根據本文公開的若干實施方式,本發明包括調節神經纖維——而不是肝叢中的神經纖維或者除了肝叢中的神經纖維外,以治療糖尿病或其它代謝狀況、病症或其它疾病。例如,圍繞接近肝固有動脈的肝總動脈的交感神經纖維、圍繞腹腔動脈(例如,腹腔神經節或腹腔叢,其供應神經纖維至多個器官,包括胰腺、胃和小腸)的交感神經纖維、使胰腺受神經支配的交感神經纖維、使脂肪組織(例如,內臟脂肪)受神經支配的交感神經纖維、使腎上腺(例如,腎叢或腎上腺叢)受神經支配的交感神經纖維、使腸、胃或小腸(例如,十二指腸)受神經支配的交感神經纖維、使褐色脂肪組織受神經支配的交感神經纖維、使骨骼肌受神經支配的交感神經纖維、迷走神經、膈叢或膈神經節、胃叢、脾叢、內臟神經、精索叢、腸繫膜上神經節、腰神經節、腸繫膜上叢或腸繫膜下叢、主動脈叢或其交感神經纖維的任意組合可根據本文公開的實施方式被調節。在一些實施方式中,這些其它組織不被治療,而是在肝叢的局部化神經調節過程中被保護免於破壞。在一些實施方式中,一個或多個交感神經纖維(例如,神經節)可被移除(例如,胰腺交感神經切除術)。上述圍繞各種器官的神經(交感或副交感的)可在組合治療程序中被調節(同時或相繼)。
在一些實施方式中,調節使胃受神經支配的神經(例如,交感神經去神經支配)導致生長素釋放肽分泌減少和較大的飽腹感、引起動力提高和/或較快的食物轉變時間的交感緊張降低,從而影響「神經胃旁路」。在一些實施方式中,調節使幽門受神經支配的神經(例如,交感神經去神經支配)導致引起較快的轉變時間和影響「神經胃旁路」的傳出交感緊張降低。在一些實施方式中,調節使十二指腸受神經支配的神經(例如,交感神經去神經支配)導致引起各種受體和激素(例如,glp-1、gip、cck、pyy、5-ht)的信號傳導改變的傳入交感活性破壞,從而使胰島素分泌和胰島素敏感性提高;和/或引起較快的轉變時間的傳出交感緊張降低,從而影響「神經十二指腸旁路」。
在一些實施方式中,調節使胰腺受神經支配的神經(例如,交感神經去神經支配)導致傳出交感緊張降低,從而使β細胞胰島素產量和β細胞質量提高和α細胞胰高血糖素產量降低。在一些實施方式中,調節使肝受神經支配的傳入交感神經導致對胰腺、gi道和/或肌肉的交感緊張自發降低。在一些實施方式中,調節使肝受神經支配的傳入交感神經導致具有系統效應的hepatokine激素提高(例如,肝胰島素光敏處理物質。在一些實施方式中,刺激迷走神經的肝總分支會導致類似的效應。
ii.神經調節的類型
a.機械神經調節
選擇性調節或破壞神經纖維可通過機械或物理破壞、諸如但不限於切割、劈開、撕裂或變形來進行。本發明若干實施方式包括破壞神經組織的細胞膜。若干實施方式涉及選擇性壓縮神經組織和纖維。經歷機械壓力、諸如但不限於選定壓縮或變形力的神經可經歷如下的效應,諸如但不限於缺血、受阻的神經傳導速率和神經壞死。這樣的效應可能是由於多個因素,諸如血液流動降低。
在若干實施方式中,歸於選擇性壓縮或機械變形力的許多效應是可逆的。除了利用機械壓縮選擇性地和可逆地調節神經應答以外,機械壓縮還可通過對選擇的髓磷脂鞘和單個神經束的損壞用於永久地調節神經應答。在一些實施方式中,通過調節施加於神經的機械壓縮力,神經調節的水平被調諧。例如,施加至神經的大的壓縮力可完全抑制神經應答,而施加至相同神經的輕的壓縮力可僅輕微降低神經應答。在一些實施方式中,機械壓縮力或變形力可通過可移動變形設備被施加至神經,諸如肝叢中的交感神經。在一些實施方式中,可移動變形設備被移除並取代以較強或較弱的可移動變形設備,這取決於對象的個別需要(例如,使可移動變形設備的強度適應需要的神經應答水平)。這樣的可移動變形設備被微調以選擇性地調節神經應答的能力相對於許多類型神經消融的二元(例如,全部或沒有)應答是有優勢的。
在各種實施方式中,壓縮或變形神經或在肝動脈或其它血管內引起缺血所需的壓縮或變形力範圍可以是約1至約100g/mm2、約1g/mm2至約10g/mm2、約3g/mm2至約5g/mm2(例如,8g/mm2)、約5g/mm2至約20g/mm2、約10g/mm2至約50g/mm2、約20g/mm2至約80g/mm2、約50g/mm2至約100g/mm2或其重疊範圍。這些壓縮力可通過本文所述機械神經調節設備或構件的各種實施方式來實現。
圖4a-4c、5a、5b、6和7圖解機械神經調節設備或構件的各種實施方式。圖4a-4c圖解形狀記憶壓縮夾400的實施方式。在一些實施方式中,形狀記憶壓縮夾400被用於機械壓縮目標神經。在一些實施方式中,形狀記憶壓縮夾400是可移除的。圖4a圖解形狀記憶壓縮夾400的靜止構象。圖4b圖解形狀記憶壓縮夾400的應變構象,其在示例的實施方式中看起來像大寫字母「u」。通過強制將形狀記憶壓縮夾400放置於其應變構象中、將目標神經放置於形狀記憶壓縮夾400的底井中,然後允許形狀記憶壓縮夾400恢復至其靜止構象,形狀記憶壓縮夾400可被施用至神經,諸如肝叢的神經,從而通過使其變形或夾緊而施加期望的壓縮力至目標神經。圖4c圖解形狀記憶壓縮夾420的可選實施方式,其中處於靜止形狀時,底井形成尖銳彎曲而不是彎曲的(curvate)。通過去除在應變構造中偏置壓縮夾的外力(例如,利用超彈性性質的形狀記憶材料)或加熱壓縮夾高於轉變溫度,從而使得壓縮夾在高於轉變溫度的奧氏體相中呈現天然或靜止構造,可使壓縮夾400、420返回至靜止構造。
在一些實施方式中,機械壓縮力在施加後被保持處於基本上恆定的水平。在一些實施方式中,形狀記憶壓縮夾400可適於不同目標神經的解剖結構。在一些實施方式中,形狀記憶壓縮夾400的尺寸或形狀變化,以彌補解剖變化。在一些實施方式中,除了彌補解剖變化以外,形狀記憶壓縮夾的變化的尺寸或形狀還可被用於選擇性地施加不同水平的壓縮應力至目標神經(例如,較小的夾或較強的材料針對較大的力,和較大的夾或較弱的材料針對較小的力)。在一個實施方式中,形狀記憶材料是鎳鈦金屬互化物。在各種實施方式中,形狀記憶材料是形狀記憶聚合物或具有形狀記憶材料性質的任意其它合適的材料。在一些實施方式中,壓縮構件包括簡易彈性夾或能夠施加基本上恆定的力的任意其它設備。在一些實施方式中,壓縮構件被配置成夾住整個動脈和外膜層中的神經,從而施加期望的壓縮力至目標神經和目標神經圍繞其經過的動脈。
在一些實施方式中,施加壓縮力至肝動脈是唯一可行的,因為肝通過肝動脈以及門靜脈被供應以血液,本文所述許多目標神經可圍繞肝動脈經過。如果至少一個肝動脈被夾住(為了施加壓縮力至其外膜內的神經),則肝會失去來自動脈的血供應,但會通過門靜脈被充分供應,從而使肝存活和健康。
在一些實施方式中,機械壓縮力在使用後隨時間可變。在一些實施方式中,機械壓縮力根據預定工作循環而變化,從而滴定(titrating)神經調節的效應。一個或多個實施方式可包括經皮的遞送能量至連接於壓縮構件(例如,鎳鈦金屬互化物夾)——在由本質上不同於體溫的溫度引起的特定溫度下具有馬氏體和奧氏體狀態之間的轉變——的電路。在若干實施方式中,溫度變化通過、但不限於:熱連結至電路可對其應用功率的壓縮構件的熱電偶(例如,珀耳帖接頭)或熱連結至電路可對其應用電阻功率的壓縮構件的加熱元件被提供,從而改變壓縮構件的物理構象和改變(提高或降低,這取決於施加的功率)通過壓縮構件產生的壓縮力。在一個實施方式中,壓縮構件本身充當電阻元件,並且電路直接連接至壓縮構件,以施加電阻功率至壓縮構件,從而改變壓縮構件的物理構象和改變(提高或降低,這取決於施加的功率)通過壓縮構件產生的壓縮力。其它實施方式組合壓縮構件與熱電偶,以允許選擇性施加電功率,以改變通過壓縮構件產生的壓縮應力。
圖5a和5b圖解壓縮設備的另外的實施方式。圖5a圖解基於導管的血管壁壓縮系統500,其包括處於開放構象中的血管壁鉗515。基於導管的血管壁壓縮系統500包括可拆卸插入導管505、吸入孔510、血管壁鉗515的接合部分515a、錨定機構520、血管壁鉗的接收部分515b和錨定機構承受部分530。在操作中,血管壁鉗515可被插入到可拆卸插入導管505遠端上的目標血管中。在一個實施方式中,血管壁鉗515的接收部分515b位於可拆卸插入導管505的遠端,而血管壁鉗515的接合部分515a的位置稍接近接收部分515b。接收部分515b和接合部分515a之間的可拆卸插入導管505的表面可包括多個吸入孔510。
在進一步操作中,一旦血管壁鉗515被放置於期望的目標位置,則在一個實施方式中,吸入孔510產生真空或負壓,其使目標血管壁與包括多個吸入孔510的可拆卸插入導管部分的表面基本上直接並置。在維持負壓以及因此維持血管壁的位置與可拆卸插入導管505並置時,接合部分515a朝向接收部分515b(或反之亦然)移動,從而在接收部分515b和接合部分515a之間夾緊保持與可拆卸插入導管直接並置的血管壁。
連接於接合部分515a的錨定機構520接合接收部分515b的錨定構件承受部分530,從而固定接收部分515b至接合部分515a並在接收部分515b和接合部分515a之間夾住與可拆卸插入導管505直接並置的血管壁部分。一旦接收部分515b與接合部分515a充分接合,則可拆卸插入導管505可脫離血管壁鉗515並經過其被插入的相同路徑被移除。
圖5b圖解閉合構象中的血管壁鉗515。在圖5b中,連接於血管壁鉗515的接合部分515a的錨定機構520已經接合血管壁鉗515的接收部分515b的錨定構件承受部分530,從而在接收部分515b和接合部分515a之間夾住血管壁部分。圖5b顯示,可拆卸插入導管505已經被移除。
在一些實施方式中,血管壁鉗525的接合部分515a和接收部分515b均包括空中心。在這些實施方式中,當可拆卸插入導管505被移除時,血管壁鉗515的接合部分515a的中心處的孔和血管壁鉗525的接收部分515b的中心處的孔在接收部分515b和接合部分515a之間產生明顯的腔,從而允許從一側至另一側的繼續血液流動。在一些實施方式中,可拆卸插入導管505通過帶螺紋部分的手段連接於血管壁鉗515的接合部分515a或接收部分515b,所述帶螺紋部分在接收部分515b和接合部分515a已經接合和不再需要可拆卸插入導管505後可以不帶螺紋。
在一些實施方式中,血管壁鉗515利用下懸線(over-the-wire)方法被插入至目標解剖結構處。在一些實施方式中,可拆卸插入導管505是中空的,並具有吸入孔510,其與可拆卸插入導管505的內部空腔流通。吸入孔510可以是一系列小的開口、篩子或允許在血管壁鉗515的接收部分515b和接合部分515a之間產生較低壓力區域以使血管壁和血管周圍組織與可拆卸插入導管505基本上直接並置的任意其它結構。在一些實施方式中,通過在可拆卸插入導管505上近側拉動,血管壁鉗515被展開,從而使血管壁鉗525的遠側接收部分515b接合血管壁鉗515的近側接合部分515a,從而壓縮和/或切割在此捕獲的動脈和神經組織。在一些實施方式中,導管505的旋轉有效使導管505脫離血管壁鉗515。在一些實施方式中,從血管壁鉗515去除可拆卸插入導管505留下明顯的腔,允許血液流至肝。
在一些實施方式中,接合機構520包括至少一個矛形夾,和接合承受部分530包括至少一個孔,所述孔被排列以接收至少一個矛形夾和接合兩者,至少一個矛形夾接合機構520進入至少一個孔接合承受部分530並卡到合適的位置中。在一些實施方式中,接合機構520和接合承受部分530僅僅是磁體,其保持血管壁鉗515的接收部分515b和血管壁鉗515的接合部分515a在一起。在再其它的實施方式中,接合機構520和接合承受部分530是任意結構,其允許接合部分515a接合接收部分515b和保持處於該接合的構象。在一些實施方式中,血管壁鉗515包括生物學上的惰性材料,其具有降低的血栓性(thrombogenicity),諸如
圖6圖解插入血管中的血管外壓縮線圈600的實施方式。在操作中,血管外壓縮線圈600可經過血管壁610中的孔以螺旋形血管內至血管外的方式被推進到血管外膜中,從而將血管外壓縮線圈600布置在目標血管周圍。在一些實施方式中,血管外壓縮線圈600具有壓縮位於目標血管的血管壁內的神經的作用。在一些實施方式中,為防止阻塞和狹窄,血管內支架隨後被放入目標血管的腔中,從而兩者撐開血管以繼續流動和提供有回彈性的表面,針對其可壓縮目標神經。
在特別關心狹窄的實施方式中,支架在治療後被放入到目標血管中,以保持開放。在一些實施方式中,將支架放入目標血管的腔中更高程度地提供壓縮血管壁的額外益處,從而甚至更多地破壞目標神經。在一些實施方式中,由於肝動脈消融程序導致的門靜脈狹窄風險,支架被放入到門靜脈中。在一些實施方式中,為保護門靜脈免於可能的狹窄,利用肛門冷卻,因為腸靜脈流延伸到門靜脈系統(在一些實施方式中,肛門冷卻的直接結果是冷卻門靜脈和降低由於肝動脈治療導致的狹窄的可能性)。
在一些實施方式中,磁體可分別被遞送到門靜脈和肝動脈中。在放置兩個磁體後,兩個磁體的相對的磁極將彼此接觸並隨後匹配,從而導致充分壓縮布置在兩個磁體之間的神經。通過匹配兩個磁體產生的力可通過在期望或需要時提高或降低用於任意給定的患者形態學的磁體的強度而被選擇性地調節。
圖7圖解插入目標血管中的完全閉塞氣囊700的實施方式。在操作中,完全閉塞氣囊710被插入到目標血管中、被充氣並用於擴張或拉伸血管腔,以充分拉伸周圍神經至缺血點或物理破壞點。完全閉塞氣囊710可在物理破壞後或在目標神經由於缺血已經被破壞後移除。可選地,完全閉塞氣囊710可被永久地留在適當的位置中,因為——如前所述——肝也通過來自門靜脈的血液被供應,致使肝動脈至少有點多餘。在一些實施方式中,氣囊壓縮水平以非固定方式被調節,從而允許神經調節效應的滴定。
在一些實施方式中,不利用完全閉塞氣囊710,而是非閉塞氣囊或部分閉塞氣囊被插入到目標血管中、被充氣並用於擴張或拉伸血管腔,以充分拉伸周圍神經至缺血點或物理破壞點。非閉塞或部分閉塞氣囊可與完全閉塞氣囊710具有類似的結構特徵,但可包括至少一個空腔(例如,中央腔),以允許放置後的繼續血液流動。在一些實施方式中,氣囊壓縮水平可以非固定方式被調節,從而允許神經調節效應的滴定。
在一些實施方式中,與上述阻塞技術類似,氣囊式導管可被插入到目標血管中,然後被填充以流體,所述流體以特定頻率(例如,以振蕩方式被加壓)被注入和抽回,從而引起圍繞目標血管(例如,肝動脈)的神經纖維的機械破壞。在一些實施方式中,用於填充氣囊式導管的流體可以是造影劑,以幫助可視化動脈結構(和從而限制用於程序的造影劑的量)。
在一些實施方式中,流體被注入圍繞血管系統——目標神經位於其周圍——的空隙空間中,從而施加壓縮力至圍繞血管(一個或多個)的神經束。在一些實施方式中,流體是空氣。在一些實施方式中,流體是任意稀有氣體(例如,重氣),包括但不限於:氦、氖、氬、氪和氙。在一些實施方式中,流體是氮氣。在一些實施方式中,流體是能夠被注入以施加期望壓縮力的任意流體。在一些實施方式中,流體通過經腔插入到充分接近目標位點(例如,期望神經壓縮的位置)的血管中的導管被注入。在一些實施方式中,流體通過經皮插入到皮膚和目標位點的周圍組織中的針或套針被注入。任意流體注射的方法均可用於遞送需要量的流體至目標位點,以產生壓縮力,其被施加至目標神經,諸如肝叢的神經。
在一些實施方式中,目標血管被完全橫切,從而導致對外膜組織中血管壁和周圍神經的徹底和全面的物理破壞。然後,目標血管可被再接通,從而允許通過血管繼續灌注。神經組織或者不重新連接或者花費相當長的時間來重新連接。因此,圍繞橫切血管的所有神經交流均可臨時性地或永久地被破壞。在一些實施方式中,切割設備經過對象的血管系統被推進導管中直到其到達目標血管。然後,切割設備可沿目標血管的軸被扭動,以經過目標血管從內至外切割。在一些實施方式中,可擴張元件,諸如氣囊式導管,被插入血管中,以壓縮血管壁和提供受控制的血管厚度,從而允許橫切。然後,旋轉切割機可在可擴張元件周圍被圓周推進,以實現橫切血管和布置在血管外膜中的神經。在一個實施方式中,目標血管在開放手術中被橫切。
血管再接通可利用任意若干方法來實現,所述方法包括雷射、rf、微波、直接熱或超聲血管密封。在一些實施方式中,熱能量可被遞送經過可擴張元件,以在由可擴張元件提供的機械壓力下實現血管接通。壓力、時間和溫度的組合(例如,在一個實施方式中,60℃、5秒和120psi)可以是密封血管,諸如肝動脈的有效手段。
b.基於導管的神經調節
根據一些實施方式,利用微創導管系統,諸如消融導管系統進行神經調節(例如,交感神經纖維的破壞)。在一些實施方式中,用於消融神經纖維的消融導管系統利用血管內(例如,動脈內)途徑被引入。在一個實施方式中,消融導管系統被用於消融肝叢中的交感神經纖維。如上所述,肝叢圍繞肝固有動脈,在肝固有動脈處其從肝總動脈分支。在一些實施方式中,消融導管系統經腹股溝中的切口被引入,以進入股動脈。經髂動脈、腹部主動脈、腹腔動脈和肝總動脈,消融導管系統可從股動脈被推進至肝固有動脈。在其它實施方式中,任意其它合適的經皮血管內切口點或途徑均被用於將消融導管系統引入到動脈系統中(例如,經橈動脈的半徑途徑或經臂動脈的臂途徑)。
在一些實施方式中,導管可通過經皮注射被放置到充分接近目標神經的目標區域中。利用這樣的經皮放置可允許較小的破壞性、較小的侵入選擇性破壞或破壞目標神經。
在一些實施方式中,導管系統包括可視化設備,其充分接近導管遠端。可視化設備可促進神經可視化,從而在靶向神經破壞中可能允許較高水平的精確度。在一些實施方式中,導管系統包括光源,其被配置成幫助可視化。在一些實施方式中,光源和可視化設備(諸如照相機)被串聯用於促進可視性。在一些實施方式中,導管系統包括遠側開口,活動元件(諸如任意照相機、光、藥物遞送埠和/或切割設備等)被推進到遠側開口外面。在一些實施方式中,導管系統包括側開口,活動元件(諸如任意照相機、光、藥物遞送埠和/或切割設備等)可被推進到側開口外面,從而允許用戶通過曲折的曲線接近血管內的血管壁,和從而允許在導管軸與血管平行排列情況下的神經破壞。
動物研究已經顯示,電極與血管壁接觸的力可能是在一些實施方式中實現消融成功的關鍵參數。因此,有利地是,消融導管設備可以不僅足夠小以進入目標血管系統,而且還結合低-剖面特徵,以在治療期間促進足夠的電極接觸壓力。
在一些實施方式中,導管系統的導管的直徑範圍為約2-8fr、約3-7fr、約4-6fr(包括約5fr)和其重疊範圍。導管沿其長度可具有變化的直徑,以便導管末端部分足夠小,以隨導管被推進到血管系統中而安裝到越來越小的血管中。在一個實施方式中,導管的外直徑大小適於安裝到肝總動脈(其可小至約1mm)或肝固有動脈中。在一些實施方式中,導管至少為約150cm長、至少約140cm長、至少約130cm長、至少約120cm長、至少約110cm長、至少約100cm長或至少約90cm長。在一些實施方式中,導管的撓性足以使其通過曲折的肝動脈解剖結構,其彎曲半徑為約10mm、約9mm、約8mm、約7mm、約6mm、約5mm、約4mm、約3mm、約2mm、約1mm或約0.5mm。
根據若干實施方式,本文所述基於導管的系統的導管具有可操縱、預彎曲、可轉向或柔性遠末端組件或遠側區段。可轉向性或撓性可有利地針對動脈壁偏置能量發生器,以保證有效和/或安全遞送治療、允許精確布置能量發生器、維持能量遞送元件與血管壁接觸、維持與血管壁的足夠接觸壓力和/或幫助其導管通過目標解剖結構。在一些實施方式中,具有可操縱、可彎曲或可鉸接或遠側部分的導管提供引起遠末端(其可包含消融元件或能量遞送元件)鉸接、彎曲或其它展開的能力——甚至在大部分導管保留在引導導管內時。在一些實施方式中,神經調節導管提供在導絲上被遞送的能力,因為放置引導導管可能是不實用的和使其通過是花費時間的。
在各種實施方式中,施加於血管壁上的、維持足夠接觸壓力的接觸力在約1g至約500g之間、約20g至約200g、約10g至約100g、約50g至約150g、約100g至約300g、約200g至約400g、約300g至約500g或其重疊範圍。在一些實施方式中,相同範圍可被利用,但被表示為g/mm2數。上述接觸壓力可通過本文所述任意神經調節(例如,消融)設備和系統來實現。
圖8圖解具有可鉸接末端的可操縱神經調節導管800的實施方式。神經調節導管800包括導管體805、多個區段810、多個相應鉸鏈820和多個相應鉸接線830。在一些實施方式中,神經調節導管800包括少於六個區段、鉸鏈和/或鉸接線(例如,二、三、四或五)。在一些實施方式中,神經調節導管800包括多於六個區段、鉸鏈和/或鉸接線(例如,七、八、九、十、十一至二十或多於二十)。在一個實施方式中,區段810和鉸鏈820是中空的。
各區段810通過鉸鏈820之一連接鄰近區段(一個或多個)。各鉸接線連接於區段之一和從其連接的區段穿過其它區段朝嚮導管體805。在操作中,鉸接線可在期望時被伸長或縮回,從而圍繞導管800的可鉸接末端樞轉。
在一些實施方式中,所有鉸接線830均聯合伸長和縮回。在其它實施方式中,各鉸接線830是獨立可制動的。在這樣的實施方式中,各單獨的區段810可通過各相應鉸接線830而獨立制動的。例如,甚至當第三區段、第四區段、第五區段和第六區段被約束在引導導管內時,第一區段和第二區段也可通過用足夠力分別伸長或縮回第一鉸接線和/或第二鉸接線被鉸接。可操縱導管800可有利地允許可操縱導管800的遠末端和目標血管的血管壁之間的接觸壓力提高,從而提高治療功效。
圖9圖解具有可轉向遠末端的神經調節導管900的實施方式。神經調節導管900包括導絲,其被配置成促進操縱性。神經調節導管900包括消融導管末端905、導絲殼910、導絲通道915和導絲920。在操作中,導絲920可通過導絲通道915延伸到外面,所述導絲通道915待以其導向能力被用於使其通過血管系統。當不期望以其導向能力利用導絲920時,導絲920可縮回消融導管末端905,然後延伸到導絲殼910中,在此其可被存儲直到需要或期望。
在一些實施方式中,導絲920是塑性可變形的,其在遠末端具有永久性的彎曲。在這樣的實施方式中,導絲920可在神經調節導管900的主體內旋轉,以塑性變形和被推入到導絲殼910中或可旋轉180度和恢復其彎曲構造,以通過導絲通道915退出。在一些實施方式中,熱電偶溫度傳感器可結合到導絲920中。在一些實施方式中,導絲920被用於遞送消融能量(諸如rf能量)至至少一個電極。在一個實施方式中,遞送消融能量通過布置傳導性凝膠於導絲和至少一個消融電極之間而被促進。
在一些實施方式中,導管系統被配置成經血管外和選擇性地破壞目標神經。在一些實施方式中,導管被推進經過心血管系統,諸如上述心血管系統,到達目標位點。導管可經腔傳至血管外空間或可在血管中膜和血管外膜之間產生虛擬空間。在一些實施方式中,導管在被布置於期望的位置後被活化,以選擇性地調節或破壞一個或多個目標神經。選擇性破壞可通過化學破壞來完成或執行,所述化學破壞,諸如供應任意類型的神經破壞劑——包括、但不限於神經毒素或對神經存活能力有害的其它藥物。在一些實施方式中,選擇性破壞通過能量誘導的破壞來執行,所述能量誘導的破壞,諸如熱或光消融(例如,射頻消融、超聲消融或雷射消融)。在一個實施方式中,照相機或其它可視化設備(例如,纖維光學鏡)被布置於導管遠端上,以保證神經被靶向而周圍組織沒有。如果目標位置鄰近於肝總動脈和肝固有動脈之間的分支,則可要求較不尖銳的導管彎曲,這是由於在肝總動脈和肝固有動脈的分叉之間形成角。在一些實施方式中,導管包括側埠、開口或窗,從而允許遞送流體或能量,以去神經支配或消融神經,同時導管縱軸與目標血管部分平行排列或基本上平行排列。在一些實施方式中,導管或探針經皮膚被插入和推進至目標位置,用於血管外遞送能量或流體。
c.基於能量的神經調節
1.射頻
在一些實施方式中,導管系統包括消融設備,其連接至產生脈衝的設備。例如,消融設備可以是消融導管。消融導管可具有近端和遠端。在一些實施方式中,消融導管遠端包括一個或多個電極。一個或多個電極可被布置於消融導管外表面上或可延伸到消融導管遠端外。在一些實施方式中,電極包括一個或多個雙極電極對。在一些實施方式中,電極包括一個或多個有源電極和一個或多個迴路電極(returnelectrodes),其可合作以形成電極對。在一些實施方式中,一個或多個電極是單極電極。在一些實施方式中,消融導管遠端包括至少一個雙極電極對和至少一個單極電極。一個或多個導電線可連接位於消融導管遠端的一個或多個電極與產生脈衝的設備。在一些實施方式中,多個電極可從多條線上的消融導管延伸,以在血管(例如,肝動脈)內提供多個能量遞送位置或點。
在一些實施方式中,產生脈衝的設備遞送電(例如,射頻(rf))信號或脈衝至位於消融導管遠端或其附近的電極。電極可被布置,以在肝叢中的交感神經纖維的方向遞送rf能量,從而引起由於熱能量導致的消融。在一些實施方式中,電極被布置於反射層或塗層的頂部,以促進遠離消融導管的rf能量的方向性。在一些實施方式中,電極是彎曲或平直的。電極可以是乾電極或溼電極。在一些實施方式中,導管系統包括一個或多個探針,其具有一個或多個電極。例如,第一探針可包括有源電極和第二探針可包括迴路電極。在一些實施方式中,一個或多個探針的遠端是柔性的。消融導管可包括柔性遠端。可變撓性或硬度區域在一些實施方式中被提供。
在一個實施方式中,雙極電極對被布置於基本上正切於肝動脈內腔的位置,各獨立電極的弧長度為20度,其中電極間間隔為10度。兩個電極的邊緣的半徑可足以降低電流濃度。在一些實施方式中,兩個電極被塗以非傳導性材料的薄層,以降低電流濃度,以便能量經電容耦合遞送至目標組織。雙極電極的弧長度和間隔可變化,以改變能量遞送區的形狀和通過從電極遞送能量產生的熱損傷。
在一些實施方式中,外周有源或接地導體被用於定形電場。在一個實施方式中,接地針被布置於血管周圍,以引導消融電流朝向血管周圍空間內的神經。在實現相同效應的非創實施方式中,高離子含量材料被注入到門靜脈中。在另外的實施方式中,利用諸如在經頸靜脈肝內門體循環(tips)技術中使用的經皮技術,成形電極被布置於門靜脈內。在一個實施方式中,第二成形電極經內窺鏡被布置於膽管樹中。
在一些實施方式中,多個電極相對於消融導管的中央軸(例如,沿消融導管的長度)被縱向間隔開。在一些實施方式中,多個電極在消融導管遠端外圍周圍被徑向間隔開。在一些實施方式中,多個電極彼此沿消融導管縱軸縱向地和在消融導管外周周圍徑向地間隔開。在各種實施方式中,電極以各種其它式樣(例如,螺旋形式樣、交錯式樣、z字形式樣、線性式樣、隨機化式樣)被布置。
一個或多個電極可被布置,以與血管(例如,肝總動脈或肝固有動脈)內壁(例如,內膜)在鄰近待被破壞或調節的自主神經的一個或多個目標消融位點接觸,從而提供血管內能量遞送。在一些實施方式中,電極被連接至可擴張和伸縮式結構(例如,可自擴張或可機械擴張),以促進與血管內壁接觸。可擴張結構可包括線圈、彈簧、叉、尖齒、架子、線材、支架、氣囊和/或類似物。可擴張電極可從導管遠端或從導管的外圓周表面展開。導管還可包括絕緣層,其鄰近電極或有源冷卻元件。在一些實施方式中,不需要冷卻元件。在一些實施方式中,電極可以是針形電極,其被配置成穿透經過血管(例如,肝動脈)壁,以經血管外遞送能量,從而破壞交感神經纖維(例如,肝叢)。例如,利用具有刺穿元件的的可擴張針形電極,導管可應用血管內-至-血管外途徑。電極可以是一次性的或可再利用的。
在一些實施方式中,消融導管包括電極,電極的表面積為約2至約5mm2、5至約20mm2、約7.5至約17.5mm2、約10至約15mm2、其重疊範圍、小於約5mm2、大於約20mm2、4mm2或約12.5mm2。在一些實施方式中,消融導管僅依賴於直接血液冷卻。在一些實施方式中,電極表面積是可用於降低血栓形成和內皮壁損壞的冷卻的函數。在一些實施方式中,較低溫度冷卻被提供。在一些實施方式中,較高的表面積被利用,從而提高遞送至血管周圍空間的能量的量,包括表面積為約5至約120mm2、約40至約110mm2、約50至約100mm2、約60至約90mm2、約70至約80mm2、其重疊範圍、小於5mm2或大於120mm2。在一些實施方式中,電極包括不鏽鋼、銅、鉑、金、鎳、鍍鎳鋼、鎂或任意其它合適的傳導性材料。在一些實施方式中,利用正溫度係數(ptc)複合聚合物,其傳導性和溫度之間具有相反的和高度非線性的關係。在一些實施方式中,ptc電極(諸如美國專利號7,327,951中描述的ptc電極,其通過引用被併入本文)被用於控制遞送至目標組織的rf能量的溫度。例如,ptc電極可在低於60℃溫度下提供高傳導性和在高於60℃溫度下基本上較低的傳導性,從而限制在高於60℃下能量遞送至組織的效應。
圖10圖解自修復消融導管1000。自修復消融導管1000包括導管體1005、針形電極1010和血管壁塞子1015。在一個實施方式中,針形電極1010被放置於導管體1005的遠端或其附近,並用於加熱組織(其可導致神經消融)。血管壁塞子1015可被放置於針形電極1010周圍,以便當針形電極1010被推入或經過血管壁時,血管壁塞子1015也被推入或經過血管壁。在一些實施方式中,在縮回自修復消融導管1000後,針形電極1010充分縮回,留下血管壁塞子1015,從而堵住或閉塞由針形電極1010留下的孔。
在用於經血管外進行調節(例如,消融)的實施方式中,血管壁塞子1015可包括水凝膠護套或塗層,其布置於針形電極1010上。在一些實施方式中,血管壁塞子1015在其遠端被膠合或以其他方式粘附或以脆弱方式固定於針形電極1010,然而可以足夠薄,以便其不防止針形電極1010隨其被推進血管周圍空間中時平滑通過。在一些實施方式中,當血管壁塞子1015的近端經過導向腔外面後,其可不被向近端拉動。因此,在消融完成後,從血管周圍空間移除針形電極1010將水凝膠護套壓縮放置於由針形電極1010在血管壁中產生的孔中,從而形成預防血管滲漏或破裂或降低其可能性的塞子。在一些實施方式中,血管壁塞子1015由暴露於組織時擴張的水凝膠製成,諸如聚乙烯醇,或由凝血酶原材料製成,諸如在盤繞(coiloff)非目標血管的介入放射學程序中應用的那些。
圖11圖解水凝膠塗覆的電極導管1100的實施方式。水凝膠塗覆的電極導管1100包括導管體1105、消融電極1110和水凝膠塗層1115。在一個實施方式中,消融電極1110連接於導管體1105的遠端和水凝膠塗層1115包住電極1110。
在一些實施方式中,水凝膠塗層1115是預先乾燥的水凝膠。在插入目標解剖結構後,消融電極1110上的水凝膠塗層1115可從周圍組織和血液吸收水分。從血液抽入的離子(或包括水凝膠塗層1115中的先驗(priori))可賦予傳導性質給水凝膠塗層1115,從而允許遞送能量至組織。根據若干實施方式,水凝膠塗覆的電極導管1100在消融期間要求較少的冷卻,因為水凝膠塗層抵抗乾燥。隨著構造要求和組件數目可被減少,較小的導管尺寸還可被利用。在一些實施方式中,電極阻抗複製天然組織阻抗,以更好地進行阻抗匹配。在一些實施方式中,可在水凝膠塗覆的電極表面進行溫度測量。
在一些實施方式中,氣囊式導管包括導管體和遠側氣囊。導管體包括腔,其被配置成連續注入鹽水或其它流體到氣囊中。遠側氣囊包括一個或多個水凝膠部分,其在遠側氣囊周圍被間隔。在一個實施方式中,如果利用鹽水,則從遠側氣囊表面蒸發的任意水通過從氣囊腔進行擴散而得以補充,從而防止游離鹽水進入血管界面中和減少鹽水注入的任何不期望的效應。
根據若干實施方式,肝總動脈、肝固有動脈和胃十二指腸動脈之間的叉脈(fork)的分支被有利地同時或相繼靶向(例如,通過rf能量),因為供應肝和胰腺的交感神經通常緊緊粘附於這些動脈的壁或其內部。其它動脈或血管之間的叉脈可類似地被同時或相繼靶向(例如,通過rf能量)。在一些實施方式中,利用與動脈壁相對的成卷電極。
圖12a圖解單一消融線圈1200設備的實施方式。單一消融線圈設備1400可被插入到目標血管系統中和被激活,以消融血管系統中的神經或圍繞血管系統的神經。為消融血管叉脈,有必要插入單一消融線圈1200到一個叉脈分支(例如,肝固有動脈分支)中和消融該分支,然後插入單一消融線圈1200到叉脈的其它分支(例如,胃十二指腸動脈分支)中和消融該分支。
圖12b圖解分叉的消融線圈設備1250。分叉的消融線圈設備1250包括兩個消融線圈、第一消融線圈1255和第二消融線圈1260。根據若干實施方式,分叉的消融線圈設備1250允許全部血管叉脈被同時消融。在操作中,通過重疊第一消融線圈1255和第二消融線圈1260(有效地產生單一雙螺旋線圈),分叉的消融線圈設備1250可被插入至目標血管系統。一旦到達目標叉脈,第一消融線圈1255和第二消融線圈1260可被分開,和第一消融線圈1255被插入目標叉脈的第一分支中和第二消融線圈1260被插入目標叉脈的第二分支中。目標血管叉脈的分支(和叉脈分支的血管內的神經或圍繞叉脈分支的血管的神經)然後可被同時消融。
在一些實施方式中,成卷電極(例如,消融線圈設備1200或分叉的消融線圈設備1250)由記憶材料,諸如鎳鈦金屬互化物或任意其它形狀記憶材料產生。在一些實施方式中,能量可通過一個或多個成卷電極以不引起神經消融(臨時性或永久性)的方式被遞送。在一些實施方式中,遞送的熱劑量可調節神經而不引起消融。消融線圈可通過一個或多個導管被遞送。消融線圈可連接於導管,以便消融線圈可在目標位置消融後被移除或被重新布置。氣囊電極或其它消融元件可取代消融線圈被利用。在一些實施方式中,具有多個電極的單一氣囊可取代成卷電極被利用。具有電極的氣囊部分可被布置在各分支中。在其它實施方式中,各分支可用阻塞構件堵塞,並且,流體可被注入,以產生用於消融的溼電極效應。
在一些實施方式中,能量在被布置以以雙極方式橫跨血管分叉的兩個消融元件之間被遞送,從而在較高的密度的神經纖維可能存在的分叉區域中集中消融元件之間的能量遞送和去神經支配。
圖13a-13c圖解氣囊消融導管的實施方式。圖13a圖解單一氣囊消融導管1300的實施方式,圖13b圖解分叉的雙氣囊消融導管1325的實施方式,和圖13c圖解分叉的氣囊消融導管1375的實施方式。
圖13a的單一氣囊消融導管1300包括電極氣囊1305,其具有至少一個電極1310(例如,一個電極、兩個電極、三個電極、四個電極、五個至十個電極、十至二十個電極或多於二十個電極)。示於圖13a–13c的電極式樣和構造圖解各種電極式樣和構造的實施方式;然而,在期望或需要時,其它式樣和構造也可被利用。在一些實施方式中,高介電常數材料可取代至少一個電極被利用。單一氣囊消融導管1300可被插入到目標血管系統中,然後被充氣和用於消融血管系統(和從而消融血管內或血管周圍的神經)。為消融血管叉脈,有必要插入單一氣囊消融導管1300到叉脈的一個分支中和消融該分支,然後從該分支縮回單一氣囊消融導管1300和插入單一氣囊消融導管1300到叉脈其它分支中和消融該分支。
圖13b的分叉的兩個氣囊消融導管1325包括第一電極氣囊1330和第二電極氣囊1335。第一電極氣囊1330包括至少第一電極1340和第二電極氣囊1330包括至少第二電極1345。在若干實施方式中,分叉的兩個氣囊消融導管1325允許全部血管叉脈(例如,所有分支)被同時消融。在操作中,分叉的兩個氣囊消融導管1325被插入到血管系統中和推進至目標叉脈。一旦到達目標叉脈,左電極氣囊1330和右電極氣囊1335可被充氣和左電極氣囊1330被插入目標叉脈的左分支中和右電極氣囊1335被插入目標叉脈的右分支中(或反之亦然)。然後,目標叉脈可被同時消融。如上所述,第一氣囊和第二氣囊可包括多個電極,或在一些實施方式中,至少一個電極被取代以高介電常數材料。一個或多個電極可被獨立地連接至脈衝發生器。通過選擇性地和/或相繼同時激活一個或多個電極對,向周圍組織的能量遞送可被唯一地引導朝向相對於氣囊位置的目標解剖結構。例如,現在參考圖13c,能量可在電極1390a和電極1390b之間被引導,以在血管壁內產生聚焦損傷,或在電極1390c和1390d之間被引導,以集中血管分叉處的能量遞送。
圖13c的分叉的氣囊消融導管1375包括單一氣囊,其具有帶有至少一個氣囊電極1390的左叉脈1380和右叉脈1385。在一些實施方式中,分叉的氣囊消融導管1375對於各氣囊叉脈包括至少一個氣囊電極。電極可被間隔開和沿氣囊分布,以有利於在目標叉脈各分支中布置至少一個氣囊電極。分叉的氣囊消融導管1375以與分叉的雙氣囊消融導管1325相同的方式操作;然而,可有利地允許更有效消融血管叉脈的分叉處。在一些實施方式中,分叉的氣囊消融導管1375的氣囊基本上是目標叉脈的形狀,或被配置成順應目標叉脈的形狀。在一些實施方式中,分叉的氣囊消融導管1375被配置成在具有帶有三個或更多分支的叉脈(諸如肝總動脈、肝固有動脈和胃十二指腸動脈之間的叉脈)的血管中被利用。在一些實施方式中,各血管叉脈分支可被阻塞構件堵塞和流體可被注入,以形成用於消融的溼電極。
電極氣囊可用於消融(或以其他方式調節)目標血管系統。在一些實施方式中,電極氣囊經導管被插入和被充氣,以便氣囊充分接觸所有叉脈內膜壁。在一些實施方式中,電極氣囊基本上是橢圓形的。兩步驟途徑可用於消融叉脈的整個表面:第一,氣囊可被放入叉脈的一個分支(例如,肝固有動脈分支)中的合適位置、被充氣、然後用於消融;第二,氣囊可被縮回,然後被推進到其它叉脈(例如,胃十二指腸動脈分支)中、被充氣、然後用於消融。在一些實施方式中,電極氣囊包括外表面上的消融電極,其具有足夠密度,以至於同時消融接觸電極氣囊的整個內膜壁是可能的。在一些實施方式中,電極氣囊表面上的消融電極以預定式樣被排列。在一些實施方式中,電極氣囊表面上的消融電極被同時激活。在一些實施方式中,電極氣囊表面上的消融電極是獨立可尋址的(例如,可制動的),從而允許選定區域在期望時被消融。在一些實施方式中,電極氣囊上的至少一個電極是消融電極和電極氣囊上的至少一個電極是傳感電極(例如用於檢測阻抗、溫度等)。
在一些實施方式中,電極氣囊包括近側電極和遠側電極,其被配置成是獨立可制動的和被配置成以刺激模式、消融模式和/或傳感模式被利用。近側電極和遠側電極可被布置在兩個不同分支中(例如,近側電極在肝固有動脈中和遠側電極在胃十二指腸動脈中)。電極氣囊可從位於肝總動脈中的引導導管展開。在一個實施方式中,近側電極被刺激和遠側電極被檢測,並且,如果鑑定了正確的區域(例如,發散至肝固有動脈而不是胃十二指腸動脈的神經纖維),則近側電極可被激活用於消融。電極氣囊可用於勘測和選擇性地消融各種血管部分。
在一些實施方式中,圓形電極氣囊可用於選擇性地僅消融選定區域。在一些實施方式中,圓形電極氣囊具有與上述大約相同的電極性質,包括電極密度,和至少一個消融電極的存在。在一些實施方式中,圓形電極氣囊包括至少一個傳感器電極。
在一些實施方式中,電介質消融氣囊被利用。電介質消融氣囊可具有與本文所述其它電極氣囊實施方式相同的形狀特徵。在一些實施方式中,電介質消融氣囊在外表面上包括至少一片高傳導性材料。在一些實施方式中,電介質消融氣囊的使用包括通過本文所述方法推進電介質消融氣囊到目標血管中的位置中和使電介質消融氣囊充氣,以便其外表面接近於目標血管的內膜壁。在一些實施方式中,微波發生器然後被放置於對象身體表面附近,並且微波從微波發生器朝向對象內的電介質消融氣囊被引導,以便微波與至少一片高傳導性材料相互作用,以產生熱,和以便產生的熱熱消融接近至少一種高介質常數材料的區域(例如,血管壁表面)。在一些實施方式中,電介質消融氣囊的外表面上包括多(例如,二、三、四或多於四)片或部分(例如,二、三、四或多於四)的高傳導性材料。
在一些實施方式中,較低功率和較長時間的消融可被用於涉及肝動脈而不是其它動脈中的阻塞的消融程序。這樣的治療可能是唯一可能的,這是因為肝的雙源血供應(上述)。肝動脈的氣囊消融可應用完全阻塞達相當長的一段時間,這在為了安全原因(例如,為避免由於缺血導致的潛在的中風)而在其它位置中之前是不可能的或者之前未嘗試過。在一些實施方式中,氣囊可被充氣和用於消融,其範圍為約1至約10分鐘、約10分鐘至約20分鐘、約20分鐘至約60分鐘、約15分鐘至約45分鐘、約10分鐘至約40分鐘、約15分鐘、約20分鐘、約25分鐘、約30分鐘、約35分鐘、約40分鐘、約45分鐘、約50分鐘、約55分鐘、約60分鐘。較長消融時間可具有根據若干實施方式的若干優勢。首先,較長暴露時間意味著較低治療溫度可被利用,因為組織和神經死亡是溫度和時間的函數。在一些實施方式中,溫度被利用,其範圍為約30℃至約80℃、約40℃至約70℃或約50℃至約60℃。在一個實施方式中,大於45℃和小於60℃的溫度被利用。
在一些實施方式中,通過經過氣囊空腔注入低溫度冷卻劑(從而保持內膜冷卻)同時在外膜(目標神經位於其中)水平上集中rf能量和熱加熱,可同時保護動脈腔。其次,氣囊阻塞可有助於布置於氣囊外面上的電極和動脈的壁之間接觸和接觸壓力增加。第三,氣囊阻塞可壓縮動脈壁的組織,從而降低從電極(一個或多個)至目標神經的距離,這提高熱能量遞送至目標神經的效率。第四,通過利用氣囊式導管可需要較少的造影劑/顯像劑,因為閉塞設備被可靠而精確地布置(並且,一旦就位就維持該位置)和充當設備和治療布置的可靠標記。另外,在氣囊接合血管壁時,完全避免加熱血液(因為能量從電極(一個或多個)直接轉移至血管壁,而不直接接觸血液),從而減少汽泡形成或血栓形成(例如,凝塊形成)的風險。
氣囊消融導管系統對於使圍繞肝動脈分支的神經去神經支配可以是有利的,其可以是有利的,因為肝動脈可被一個或多個氣囊堵塞,然後,冷卻劑可在消融區域中流通(例如,通過氣囊的腔)。在各種實施方式中,氣囊消融導管通過較大電極表面積(例如,通過可包括在氣囊上的大的電極尺寸被實現)有利地促進較高的功率淨能量和有利地促進沉積時間提高(通過堵塞向肝動脈的流量達較長時間段的能力而被允許)。在一些實施方式中,對內皮壁損壞的風險通過冷卻劑——甚至在通過較高功率而使能量密度提高的情況下——的流動而減輕。因此,除用於使其它血管或器官去神經支配的去神經支配系統以外,較高的功率能量遞送(例如,約40至50%較高的功率)可被利用,而無需冒損壞肝動脈內皮區域的風險,這是由於從肝動脈腔上至1mm維持的小於人工發熱溫度。
在一些實施方式中,主動冷卻的氣囊式導管被用於消融目標血管系統。足以遞送高流量冷卻劑至冷卻元件的泵可用於促進主動冷卻。在若干實施方式中,遞送適當流動速率(例如,在約100和500ml/min之間)的冷卻劑至4至6fr氣囊式導管中以維持適當溫度的驅動壓力範圍在約25和約150psi之間。流動速率可基於氣囊內的實際溫度而被調節。在一些實施方式中,氣囊中期望的冷卻劑溫度在約5℃和約10℃之間。在一些實施方式中,熱電偶被包括在氣囊內,以持續監測冷卻劑溫度。根據冷卻劑的期望溫度和實際溫度之間的差異,可提高或降低泵輸出。
肝動脈解剖結構通常比其它區域中其它血管的解剖結構更曲折和可變。維持曲折的肝動脈解剖結構內電極或其它能量遞送元件的良好接觸可能是困難的,並可需要利用不同於現有導管設備的導管設備,以進行神經消融。圖14a和14b圖解可有利地促進電極或其它能量遞送元件與曲折的肝血管解剖結構的動脈內壁接觸的低-剖面消融導管1400的實施方式。低-剖面消融導管1400包括內電極構件1410和外殼1415。內電極構件1410可包括可逆地可轉向、預形成的圓柱形杆,包括回彈性(例如,形狀記憶)材料和至少一個電極1420。在一個實施方式中,外殼1415包括具有腔的引導導管。內電極構件1410可被配置成在外殼1415的腔內被遞送和相對於外殼1415可轉移,以便內電極構件1410可被推進到外殼1415的遠端外面和縮回來。在一個實施方式中,在被推進到外殼1415的遠端外面時,內電極構件1410呈現大體的偏斜(例如,離軸)構造,如示於圖14b。以這種不受約束的狀態,內電極構件1410的遠端偏離由電極近側部分限定的縱軸。當內電極構件1410縮回到外殼1415內時,內電極構件1410被回彈性地變形,以呈現基本上直的形狀,其由外殼1415的腔的基本上直的形狀限定,如示於圖14a。在一些實施方式中,當內電極構件1410被推進到外殼1415的遠端外面時,內電極構件1410的遠端部分偏斜,以接觸血管壁(例如,動脈壁)。不受約束狀態的內電極構件1410的遠端的形狀可被預形成,以確保接觸血管壁。
在一些實施方式中,外殼1415的直徑小於約4mm、小於約3mm、小於約2mm或小於約1mm。在一些實施方式中,內電極構件1410包括杆,其至少部分由記憶材料諸如鎳鈦合金材料形成。內電極構件1410的外橫截面尺寸可基本上等於外殼1415的外直徑,或其外橫截面尺寸可小於或大於外殼1415的外直徑。在一些實施方式中,當內電極構件1410滑到外殼1415外面在其遠端或遠端附近越過預成節距(step)1425時,遠端或遠端附近的節距1425將內電極構件1410的遠端表面遠離外殼1415的自然軸放置。在一些實施方式中,接近內電極構件1410的遠端的節距1425將內電極構件1410的表面放置在與外殼1415外表面大約相同的平面和從外殼1415中央至外殼1415外表面的直徑的大約兩倍之間。
在一些實施方式中,在接近遠端的節距1425中產生的離軸偏斜的量級適於滿足變化的解剖學要求(例如,針對較大血管接近遠端的較大節距,和針對較小血管接近遠端的較小節距)。在一些實施方式中,內電極構件1410是可互換的,並可被具有不同尺寸參數的不同內電極構件替換。不同尺寸的內電極構件或具有不同預成形狀的電極構件可被提供在試劑盒中,並且適當的內電極構件可在評價患者解剖結構(例如,通過ct、螢光檢查或超聲成像方法)後被選擇。在一些實施方式中,內電極構件1410在導管體內旋轉。
在一些實施方式中,內電極構件1410的至少一個電極1420包括一個或多個單極、雙極或多極電極(另外的預形成的電極的加入可使雙極和多極rf能量遞送能夠進行)。電極的任意組合可結合到內電極構件1410的設計中,以產生具有任意期望性質的導管。
在一些實施方式中,內電極構件1410的杆包括絕緣構件,以防止熱傳遞遠離內電極構件1410的部分或電絕緣內電極構件1410的部分。在一些實施方式中,絕緣構件是由聚醯胺、聚四氟乙烯、聚醚醚酮、聚乙烯或任意其它高電介質材料組成的管材、塗層或熱套(heatshrink)。絕緣構件可包括一個或多個開口,以暴露內電極構件1410的部分遠端部分。在一些實施方式中,通過以任意期望的幾何形狀選擇性移除絕緣構件,絕緣構件被用於限定特定的電極幾何形狀。在其它實施方式中,內電極構件1410包括形狀記憶聚合物或形狀偏置聚合物,其中布置有一個或多個電極導線。在一個實施方式中,低-剖面消融導管包括與形狀記憶電極殼針(spine)共擠出的導管,其中擠出的導管提供電絕緣。在一個實施方式中,至少一個電極1420包括球形電極。在一個實施方式中,內電極杆的遠端包括一系列電極。
在一些實施方式中,低-剖面消融導管1400包括在接近消融導管遠端的側面部分中的徑向窗或槽。在一個實施方式中,內電極構件1410的遠端被配置成展開到徑向窗或槽外面。在一個實施方式中,消融導管1400的腔包括向上通過徑向窗或槽的斜面,以引導內電極構件的遠端到徑向窗或槽外。
根據若干實施方式,低-剖面消融導管1400有利地提供這樣的設備:其包括低剖面(例如,小的外橫截面尺寸)和利用相同的機構,以驅使電極偏斜以及電極本身,從而減少不同組件的數目。低-剖面消融導管的內電極1410還可有利地被至少部分展開,以通過提供各種末端曲率選項促進通過,從而在導管插入期間「鉤住」血管分支或通過曲折的血管。根據若干實施方式,低-剖面消融導管1400有利地促進與血管壁進行可靠和連續的接觸,從而允許基本上恆定的電壓以維持期望的電極末端溫度。
圖15圖解遠末端電極和導絲形狀1500的各種實施方式。遠末端電極和導絲形狀1500可包括「l」形狀的末端1505、「j」形狀的末端1510、「看護鉤狀物(shepherdscrook)」-形狀的末端1515、「鉤」形狀的末端1520、「線」形狀的末端1525、「鑰匙」形狀的末端1530、「圓」形狀的末端1535、「方形鉤」形狀的末端1540或「節距」形狀的鉤1545。螺旋形-形狀的末端(諸如示於圖12a)還可被利用。在一個實施方式中,套索-形狀的末端被利用。套索-形狀的末端可具有與「圓」形狀的末端1535類似的構造,但是「圓」-或「套索」-形狀的末端部分與直線部分基本上垂直定向。圖15圖解的各種形狀可有利地被選擇和結合低-剖面消融導管1400或其它導管設備使用,以促進電極或其它能量遞送元件與曲折的肝血管解剖結構(例如,基於被治療對象的特定血管解剖結構或被治療的特定血管)的動脈內壁的接觸。圖15所示任意形狀1500可包括多個電極,其以不同的式樣被排列。
在一些實施方式中,遠端電極本身或導絲可部分地或全部從插入導管延伸,以幫助通過,從而提供各種末端曲率選項,以在導管插入期間「鉤住」血管分支。在一些實施方式中,形狀-記憶電極可由臨床醫師-用戶進行互換。例如,臨床醫師可針對患者的唯一解剖結構從不同形狀設備的試劑盒選擇最適當的形狀構象,而不是局限於單一設備構象或構造。各種形狀的末端可有利地被選擇,以最佳化一個或多個電極或能量遞送元件接觸目標血管的能力,這是由於目標血管處和/或圍繞目標血管的血管解剖結構的彎曲和可變性。電極組件還可包括傳感元件,諸如熱傳感元件(熱敏電阻器或熱電偶),以允許在治療期間測量組織溫度和能量遞送。針對神經傳導的去神經支配或阻斷的確認,傳感元件可提供反饋。
根據若干實施方式,一旦選定特定形狀,則可將力(f)施加至電極近端,以調節針對血管壁的接觸力f』。在一些實施方式中,電極末端部分的應變程度與施加至血管壁的力成比例。射線不透標記可沿內電極1410的長度被放置,並且,在兩個射線不透標記之間繪製的線之間的相對角φ可被設計,以便f』=f(φ(f))。然後,臨床醫師可調節電極近端上的力,以實現期望的接觸力。
在一些實施方式中,具有基本上匹配目標血管內徑的外直徑的導管被利用,從而最小化針對精確靶向的機械和腳印(footprint)要求。基於目標血管的測量的內徑,可從具有各種外直徑尺寸的導管的試劑盒中選擇導管。在一些實施方式中,利用程序試劑盒中提供的隔離物,導管的外直徑可被修改。導管可被推進經過患者的血管系統(其內徑可隨接近目標位置而減小)。一旦導管被推進至目標血管位置,其然後可通過圍繞其外周的基本上均一的接觸壓力有利地接合血管壁。在一些實施方式中,因為不期望將能量施加至血管的全部外圍(由於狹窄的風險),所以利用本文公開的任意設計——應用選擇性電極布置或電極「窗」,從而允許在血管壁周圍的不連續位置中遞送能量。
圖16a和16b圖解開窗的消融導管1600的實施方式。開窗的消融導管1600包括導管體1605、內套筒1610——具有第一窗1620和至少一個消融電極1630和外套筒1615——具有第二窗1625。圖16a顯示開窗的消融導管1600的遠端視圖和圖16b顯示開窗的消融導管1600的遠端的詳細剖視圖。
在一些實施方式中,消融電極1630被布置在內套筒1610的腔內。內套筒1610被旋轉接納在外套筒1615內,以便外套筒1615圍繞內套筒1610可旋轉。通過相對於外套筒1615旋轉內套筒1610而對齊外套筒1615的第二窗1625與內套筒1610的第一窗1620,或反之亦然,能量可被導管遞送。在一個實施方式中,內套筒1610包括電介質遮蓋物,以提供絕緣。
在一些實施方式中,當內套筒1610的第一窗1620和外套筒1615的第二窗1625重疊時,消融電極1630被暴露於外套筒1615(其可針對目標血管的壁被放置)外面。在一個實施方式中,當第一窗1620和第二窗1625重疊或至少部分對齊時,能量僅到達目標血管的壁。重疊程度可通過相對於外套筒1615旋轉或平移內套筒1610而受到控制。在一個實施方式中,導管由用戶插入,內套筒1610基於用戶控制而轉動和外套筒1615基於用戶控制而轉動,從而允許選擇性施加通過至少一個消融電極產生的能量至基本上任意部分的目標血管。
在一些實施方式中,內套筒1610包括多個開口,其沿內套筒1610的長度在不同的位置被間隔開。例如,內套筒1610可具有開口,其沿內套筒1610的軸被線性間隔開,和具有開口,其圍繞內套筒1610的軸旋轉。在一個實施方式中,內套筒1610的開口限定螺旋形式樣。如示於圖16b,內套筒1610的外表面和外套筒1615的內表面可以是帶螺紋的,以便通過相對於內套筒1610旋轉外套筒1615,內套筒1610相對於外套筒1615平移。在一些實施方式中,外套筒1615相對於內套筒1610的相對旋轉用於平移和旋轉外套筒1615的窗1625,通過內套筒1610的各開口相繼暴露血管組織於消融電極1635。根據若干實施方式,本文所述開窗的消融導管可促進沿血管壁長度產生螺旋形損害。通過選擇性地在內套筒1610內產生開口和相對於內套筒1610旋轉外套筒1615,可產生沿螺旋狀路徑基本上任意式樣的消融。
為提高消融導管-血管壁接觸,從而提高治療功效,一些實施方式在消融導管遠末端上包括窗或結合到一個或多個電極窗中,以提供負壓(或真空壓力)。提供至腔壁的負壓使動脈直接接觸設備,從而實現更有效和損害較小的消融。
圖17是基於氣囊的體積消融系統1700的實施方式,其可例如,用於腹腔動脈、肝總動脈和肝固有動脈中。在示例的實施方式中,基於氣囊的體積消融系統1700包括多個閉塞氣囊1725、多個氣囊導絲1730、導管1750和電極1740。圖17還圖解腹部主動脈1705、腹腔動脈1706、肝總動脈1707、脾動脈1708、肝固有動脈1709、肝右動脈1710和肝左動脈1711,作為目標治療位點的實例。在操作中,基於氣囊的體積消融系統1700可經過腹部主動脈1705被插入至目標治療位點和進入腹腔動脈1706。獨立閉塞氣囊1725然後可被推進到隨後的血管中,諸如脾動脈1708、肝右動脈1710和肝左動脈1711。當適當的閉塞氣囊1725已被布置,以便它們限定期望體積的、待被消融的血管系統時,閉塞氣囊1725可被充氣,從而閉塞其中它們已經被布置的血管。在一個實施方式中,目標體積然後被填充以鹽水和電極1740被激活,以遞送電能量來同時加熱全部目標體積。電極1740可被配置成遞送足夠的能量至目標體積,以消融目標治療位點內所有或至少部分血管的神經。在完成後,閉塞氣囊1725可被放氣和整個基於氣囊的體積消融系統1700可被縮回。
在一些實施方式中,同時消融使從腹腔動脈產生的所有動脈(諸如左胃動脈、脾動脈、右胃動脈、胃十二指腸動脈和肝動脈)的部分或其子集受神經支配的神經的區域可以是有利的。在一些實施方式中,消融通過如下方式實現:利用氣囊式導管或從在腹腔動脈或腹部主動脈內的引導導管展開的其它阻塞構件以阻斷或堵塞部分待不被去除的血管(目標體積可通過使氣囊充氣或將阻塞構件放置於期望的體積的上遊和下遊而被調節,從而產生不連續的體積),通過引導導管以鹽水溶液填充目標體積,和施加rf或其它能量至鹽水從而消融圍繞目標體積的組織——以通過液壓維持血管開放同時還通過冷藏鹽水的循環提供血管內皮表面的直接冷卻的方式。在一些實施方式中,所描述的「鹽水電極」系統被用於以鹽水加壓目標動脈。通過根據血管造影術測量動脈直徑和利用動脈直徑和流體壓力之間預限定的關係或通過利用一個或多個壓力傳感器——在一個實施方式中,其被包括作為鹽水電極系統的組件,鹽水電極與動脈壁的接觸壓力可被評估。鹽水電極系統可有利地促進全方向遞送能量。
在一些實施方式中,高滲(例如,高滲性(hyperosmolar))鹽水被用於消融目標體積。利用高滲鹽水可導致內皮細胞「負載」離子,有效地提高其傳導性。使內皮細胞負載離子可具有一個或多個如下效應:降低內皮襯細胞(和沿滲透梯度影響的其它細胞,諸如中膜中的細胞)內的離子摩擦;減少沉積在內皮細胞位置中的熱;預防對內皮細胞的明顯熱損壞;和由於接近電極的區域中傳導性提高而提高電流密度,這可有利地提高目標神經可能位於其中的血管壁中的更深加熱的效率。
在各種實施方式中,電容耦合或電阻加熱導管設備被用於遞送熱能量。在一個實施方式中,電容耦合導管設備包括氣囊,其包括雙極電極對,該雙極電極對以電容耦合構造排列,其中絕緣層在兩個電極之間。在一個實施方式中,絕緣層包住兩個電極。在一個實施方式中,氣囊包括以鹽水填充的非傳導性氣囊,其通過由基本上非傳導性氣囊膜形成的電介質層電容連接至目標組織。電容耦合導管設備可有利地不要求與目標組織的直接電極接觸,從而減少其它設備所要求的電流密度水平和邊緣效應。可利用類似於美國專利號5,295,038中描述的電容耦合設備或方法的電容耦合設備或方法,該專利通過引用被併入本文。迴路電極路徑還可被提供.
在一個實施方式中,電阻加熱能量遞送導管包括氣囊式導管,其上布置電阻加熱元件。例如,氣囊式導管可包括環繞氣囊的螺旋形電阻加熱器。替代在血管組織中引起rf電流,dc或ac/rf電流可用於在氣囊式導管本身中產生熱並且熱可通過傳導傳輸至周圍血管組織(例如,肝動脈組織)。
在一些實施方式中,rf能量遞送系統遞送具有不同持續時間的rf能量波。在一些實施方式中,rf能量遞送系統改變rf能量的幅度。在其它實施方式中,rf能量遞送系統遞送多個rf波脈衝。例如,rf能量遞送系統可遞送一系列rf脈衝。在一些實施方式中,rf能量遞送系統改變rf能量的頻率。在其它實施方式中,rf能量遞送系統改變rf能量的任意一個或多個參數,包括、但不限於持續時間、幅度、頻率和脈衝總數或脈寬總數。例如,rf能量遞送系統可遞送rf能量,其被選來最有效地調節(例如,消融或以其他方式破壞)肝叢中的交感神經纖維。在一些實施方式中,rf能量的頻率被維持在恆定或基本上恆定的水平。
在一些實施方式中,rf能量的頻率在約50khz和約20mhz之間、在約100khz和約2.5mhz之間、在約400khz和約1mhz之間、在約50khz和約5mhz之間、在約100khz和約10mhz之間、在約500khz和約15mhz之間、小於50khz、大於20mhz、在約3khz和約300ghz之間或其重疊範圍。非-rf頻率還可被利用。例如,頻率範圍可從約100hz至約3khz。在一些實施方式中,施加的電壓的幅度在約1伏特和1000伏特之間、在約5伏特和約500伏特之間、在約10伏特和約200伏特之間、在約20伏特和約100伏特之間、在約1伏特和約10伏特之間、在約5伏特和約20伏特之間、在約1伏特和約50伏特之間、在約15伏特和25伏特之間、在約20伏特和約75伏特之間、在約50伏特和約100伏特之間、在約100伏特和約500伏特之間、在約200伏特和約750伏特之間、在約500伏特和約1000伏特之間、小於1伏特、大於1000伏特或其重疊範圍。
在一些實施方式中,rf能量的電流範圍為約0.5ma至約500ma、約1ma至約100ma、約10ma至約50ma、約50ma至約150ma、約100ma至約300ma、約250ma至約400ma、約300至約500ma或其重疊範圍。施加的rf能量的電流密度可具有在約0.01ma/cm2和約100ma/cm2之間、在約0.1ma/cm2和約50ma/cm2之間、在約0.2ma/cm2和約10ma/cm2之間、在約0.3ma/cm2和約5ma/cm2之間、小於約0.01ma/cm2、大於約100ma/cm2或其重疊範圍的電流密度。在一些實施方式中,rf發生器的功率輸出範圍在約0.1mw和約100w之間、在約1mw和100mw之間、在約1w和10w之間、在約10w和50w之間、在約25w和約75w之間、在約50w和約90w之間、在約75w和約100w之間或其重疊範圍。在一些實施方式中,在目標位置(例如,在血管內壁、至血管中膜、至血管外膜或至血管壁內的目標神經或粘附於血管壁的目標神經)遞送的總rf能量劑量在約100j和約2000j之間、在約150j和約500j之間、在約300j和約800j之間、在約500j和約1000j之間、在約800j和約1200j之間、在約1000j和約1500j之間和其重疊範圍。在一些實施方式中,阻抗範圍為約10歐姆至約600歐姆、約100歐姆至約300歐姆、約50歐姆至約200歐姆、約200歐姆至約500歐姆、約300歐姆至約600歐姆和其重疊範圍。
rf能量可以是脈衝的或連續的。根據連續的還是脈衝的信號被利用,電壓、電流密度、頻率、治療持續時間、功率和/或其它治療參數均可變化。例如,對於脈衝的rf能量,電壓或電流幅度可明顯被提高。脈衝的信號的工作循環的範圍可從約0.0001%至約100%、從約0.001%至約100%、從約0.01%至約100%、從約0.1%至約100%、從約1%至約10%、從約5%至約15%、從約10%至約50%、從約20%至約60%從約25%至約75%、從約50%至約80%、從約75%至約100%或其重疊範圍。脈衝持續時間或脈寬可變化。例如,在一些實施方式中,脈衝持續時間範圍可從約10微秒至約1毫秒;然而,小於10微秒或大於1毫秒的脈衝持續時間可在期望和/或需要時被利用。根據一些實施方式,脈衝的能量的利用可促進溫度降低、治療時間減少、冷卻要求降低和/或功率水平提高,而沒有由於加熱而提高溫度或導致內皮損傷的風險。
治療時間持續時間範圍可從1秒至1小時、從5秒至30分鐘、從10秒至10分鐘、從30秒至30分鐘、從1分鐘至20分鐘、從1分鐘至3分鐘、從2至4分鐘、從5分鐘至10分鐘、從10分鐘至40分鐘、從30秒至90秒、從5秒至50秒、從60秒至120秒、其重疊範圍、小於1秒、大於1小時、約120秒或其重疊範圍。持續時間可根據各種治療參數(例如,幅度、電流密度、鄰近、連續的或脈衝的、神經的類型、神經的尺寸)而變化。在一些實施方式中,rf或其它電能量被控制,以便能量的遞送在約50至約90攝氏度(例如,60至75度、50至80度、70至90度或其重疊範圍)的範圍內加熱目標神經或周圍組織。在一些實施方式中,溫度可小於50或大於90攝氏度。電極末端能量範圍可為37至100攝氏度。在一些實施方式中,rf消融熱損傷尺寸範圍為約0至約3cm(例如,在1和5mm之間、在2和4mm之間、在5和10mm之間、在15和20mm之間、在20和30mm之間、其重疊範圍、約2mm、約3mm)或距血管腔一至十(例如,一至三,二至四,三至五,四至八,五至十)個中膜厚度差異(例如,研究已經表明,圍繞肝總動脈和肝動脈其它分支的神經通常在該範圍內)。在若干實施方式中,血管(例如,肝動脈)的中膜厚度的範圍為約0.1cm至約0.25cm。在一些解剖結構中,至少大部分肝動脈分支的神經纖維定位在距腔壁0.5mm至1mm處,以便利用血管內途徑的調節(例如,去神經支配)有效降低功率或能量劑量要求。
在一些實施方式中,rf消融導管被用於在肝叢中的一個或多個位置執行交感神經纖維的rf消融。例如,rf消融導管可以圓周或半徑式樣進行消融,以消融肝叢中一個或多個位置(例如,一個、兩個、三個、四個、五個、六個、七個、八個、九個、十個、六至八個、四至八個、多於十個位置)處的交感神經纖維。在其它實施方式中,通過在沿血管長度線性間隔的多個點進行rf消融,在一個或多個點消融肝叢中的交感神經纖維。例如,rf消融可在沿固有動脈長度線性間隔的一個或多個點處執行,以消融肝叢中的交感神經纖維。在一些實施方式中,rf消融以任意式樣在一個或多個位置執行,從而在期望和/或需要時引起肝叢中的交感神經纖維的消融(例如,可能或可能不相交的螺旋形式樣或一系列線性式樣)。消融式樣可包括連續式樣或間歇式樣。根據各種實施方式,rf消融不引起對血管壁的任何永久性損壞,因為壁處的熱通過流動血液、通過提供在體外的冷卻或通過由鄰近器官和組織結構提供的提高的冷卻(例如,門靜脈冷卻和/或注入)而消散,從而通過跨過內膜和中膜層到達神經經過的外膜不斷提高的溫度產生梯度。外膜是動脈壁的外層,其中中膜是中間層和內膜是內層。內膜包括內皮細胞層,其由結締組織層支撐。中膜是三個血管層中最厚的,包括平滑肌和彈性組織。外膜包括纖維結締組織。
在一些實施方式中,從rf能量源的能量輸出可利用恆定溫度模式被調節。當達到溫度下限時,恆定溫度模式打開能量源,和當達到溫度上限時,關閉能量源(類似於恆溫器)。在一些實施方式中,利用恆定溫度模式的消融導管系統需要反饋,在一個實施方式中,反饋通過溫度傳感器提供。在一些實施方式中,消融導管系統包括溫度傳感器,其與能量源(例如,rf發生器)交流。在這些實施方式的一些中,當溫度傳感器記錄溫度已經降到某下限水平以下時,能量源開始遞送能量(例如,打開),和當溫度傳感器記錄溫度已經超過預定的上限水平時,能量源終止能量遞送(例如,關閉)。
在一些實施方式中,從能量遞送系統的能量輸出可被利用除溫度以外的參數,諸如組織阻抗進行調節。組織阻抗可隨組織溫度提高而提高。阻抗模式可被配置成在達到阻抗下限時打開能量源和在達到阻抗上限時關閉能量源(以與恆定溫度模式響應溫度提高和降低相同的方式)。利用恆定阻抗模式的能量遞送系統可包括一些形式的反饋機構,在一個實施方式中,反饋機構由阻抗傳感器提供。在一些實施方式中,通過測量電壓和電流和由電流除電壓計算阻抗。
在一些實施方式中,基於導管的能量遞送系統包括第一導管,其具有第一電極,和第二導管,其具有第二電極。第一導管被插入目標血管(例如,肝總動脈)內和用於遞送能量,以調節目標血管內的神經。第二導管可被插入鄰近血管內和阻抗可在兩個電極之間進行測量。例如,如果第一導管被插入肝動脈內,則第二導管可被插入膽管或門靜脈內。在一些實施方式中,第二電極被布置於對象皮膚上,並且在第二電極和基於導管的能量遞送系統的電極之間測量阻抗。在一些實施方式中,第二電極可被布置在其它位置中,所述其它位置被配置成提供對目標組織阻抗的基本上精確的測量。
在一些實施方式中,阻抗測量結果傳達至能量源(例如,脈衝發生器)。在一些實施方式中,當阻抗記錄阻抗已經降到某下限水平以下時,能量源開始產生脈衝(即,打開),和當阻抗記錄阻抗已經超過預定的上限水平時,能量源終止脈衝(即,關閉)。
在一些實施方式中,能量遞送系統的能量輸出由時間調節。在這樣的實施方式中,能量遞送系統的能量源遞送能量達預定的時間量,然後終止能量遞送達預定的時間量。循環可重複達期望的治療總持續時間。在一些實施方式中,能量被遞送的預定時間量和能量遞送被終止的預定時間量是經經驗優化的時間長度。根據若干實施方式,根據阻抗控制能量遞送和在阻抗接近臨界水平時減少能量遞送(或可選地,及時調節能量而不考慮阻抗水平)有利地提供在血管腔外圍位置處被聚焦的熱能量。例如,當能量脈衝結束時,血管腔由於向血液的對流熱損失可快速冷卻,從而保護內皮細胞免於熱損壞。在一些實施方式中,外圍組織(例如,其中布置靶向神經)中的熱通過熱傳導更緩慢的消散。在一些實施方式中,連續脈衝趨於引起外周(例如,神經)組織的優先加熱。根據若干實施方式,當組織的阻抗由於汽化而升高時,導電性陡降,從而有效地防止進一步遞送能量至目標組織。在一些實施方式中,通過在組織阻抗升至該水平以前終止能量脈衝(例如,通過阻抗監測或時間調節),可避免該有害作用。根據若干實施方式,碳形成是組織汽化和碳化的結果,其是由阻抗快速提高、電弧擊穿和血栓形成造成的。通過預防阻抗提高,可避免組織碳化。
在一些實施方式中,通過計算功率輸出的時間積分(其之前可與消融特徵相關),監測總能量遞送,以跟蹤治療進程。在一些實施方式中,溫度、時間和電場之間的關係被監測,以獲得利用arrhenius關係對圍繞消融電極的組織內的溫度場的評估。在一些實施方式中,已知的熱輸入根據需要被提供至消融電極,以提供已知的初始狀況,用於評價周圍組織響應。在一些實施方式中,部分消融區域被臨時冷卻,並且,所得溫度被降低。例如,對於已經進行一定時間段的血管內消融,可預期在組織內存在某種高溫分布。如果臨床醫師希望評估給定時間(例如,t0)時的治療進程,則可中斷能量遞送,並且冷卻的鹽水或氣體可被快速循環通過電極,以在短時間段(例如,約1秒)內實現預定的電極溫度。在一些實施方式中,在電極表面測量的所得的溫度提高(例如,在約5秒內)則代表周圍組織的總能量。該過程可通過該程序被重複,以追蹤進程。
在一些實施方式中,可監測參數、諸如溫度、紅外線輻射或微波輻射,以評估遞送至組織的能量的量級,因而評估引起的神經調節的程度。熱輻射(溫度)、紅外線輻射和/或微波輻射的量級均可指示在身體組織內包括的能量的量。在一些實施方式中,在完成消融後期望量級隨組織冷卻向體溫退回而降低,並且,該降低的速率——在特定點(例如,在血管腔表面)被測量——可用於評估消融尺寸(例如,較慢降低可對應於較大消融尺寸)。本文所述任意實施方式均可被單獨或組合利用,以表明組織損傷區的實際尺寸。
在各種實施方式中,各種治療參數(例如,阻抗、電極溫度、組織溫度、功率、電流、電壓、時間、和/或能量的速率變化基本上被實時監測並展示在用戶界面上。治療參數數據可存儲在數據存儲上,用於稍後報告和/或分析。在一些實施方式中,能量遞送系統接收輸入,其由生理學信號,諸如血糖水平、去甲腎上腺素水平或指示治療進程狀態的其它生理學參數轉換來。
觀察組織消融區和周圍解剖結構的其它方法可包括通過如下形式的在先、伴隨或隨後血管內成像,所述形式包括、但不限於:血管內超聲、光學相干x線體層照相術、共聚焦顯微鏡方法、紅外光譜學、紫外光譜學、拉曼光譜學和微波計溫學。所有這樣的成像形式均可有利地適應於肝動脈,這是因為其對低流量的獨特耐性。在一些實施方式中,超聲彈性成像(elastography)被有利地用於成像。超聲彈性成像可顯示在熱消融期間膠原蛋白質變性造成的局部化組織僵硬的區域(相對於天然組織,消融的區域趨於變硬);例如,僵硬區域可對應於消融的區域。血管內超聲可被用於,例如檢測或監測消融損傷的存在和深度。例如,如果損傷範圍為距離腔壁2至6mm,則臨床醫師可確信目標神經由於熱血凝而被破壞。血管外超聲成像還可被利用。
2.超聲
在一些實施方式中,能量遞送系統遞送超聲能量,以調節(例如,消融、刺激)肝叢中的交感神經纖維。例如,能量遞送系統可應用聚焦超聲能量,諸如高強度聚焦超聲(hifu)能量或低強度聚焦超聲(lifu)能量,以消融交感神經纖維。在一些實施方式中,能量遞送系統包括消融導管,其連接至一個或多個超聲轉導器。例如,超聲轉導器(一個或多個)可遞送超聲能量至一個或多個消融位點,以消融肝叢中的交感神經纖維。超聲能量可通過投藥、脈衝或頻率選擇而被控制。在一些實施方式中,hifu能量可有利地在遠點被聚焦,以降低血管組織(例如,內膜和中膜層)或周圍組織的潛在幹擾。hifu能量可有利地降低布置消融導管所要求的精確度。一個或多個超聲轉導器可在治療期間被重聚焦,以增加治療位點數目或調解治療深度。在一些實施方式中,hifu能量的利用可導致在較短的持續時間內熱濃度的提高,並可在多個焦點同時聚焦能量,從而減少執行神經調節程序所需的總時間。
在一些實施方式中,能量遞送系統包括聚焦超聲(例如,hifu)消融導管和聲頻發生器。消融導管可以利用遠程機構從對象外面可操縱。消融導管遠端可以是柔性的,以允許偏斜或圍繞導管杆的軸的旋轉自由度,以促進在肝動脈或其它動脈中進行布置。例如,一個或多個超聲轉導器——可以是單一元件或多個元件轉導器——倚靠動脈內膜或以距離內膜層一定的距離被間隔。在一些實施方式中,消融導管包括聚焦(例如,拋物面)鏡或其它反射器、氣體填充的或液體填充的氣囊和/或其它結構聚焦元件,以促進超聲能量的遞送。一個或多個轉導器可以是圓柱形、矩形、橢圓形或任意其它形狀。消融導管可包括傳感器和控制電路,以監測溫度和防止過度加熱,或以獲得對應於一個或多個超聲轉導器、血管壁和/或跨超聲轉導器流動的血液的其它數據。在一些實施方式中,傳感器提供反饋,以控制超聲能量的遞送。在一些實施方式中,超聲能量被控制,以便超聲能量的遞送在約40至約90℃(例如,40℃至60℃、60℃至75℃、65℃至80℃、60℃至90℃或其重疊範圍的範圍內加熱動脈組織。在一些實施方式中,溫度可小於40℃或大於90℃。
用於消融交感神經的頻率可基於預期的衰減、橫向和軸向同時對光束的限制、治療深度、神經的類型和/或其它參數而變化。在一些實施方式中,使用的頻率範圍為從約20khz至約20mhz、從約500khz至約10mhz、從約1mhz至約5mhz、從約2mhz至約6mhz、從約3mhz至約8mhz、小於20khz、大於20mhz或其重疊範圍。然而,可使用其它頻率而無需限制本公開內容的範圍。在一些實施方式中,hifu導管還可傳輸頻率,其可用於成像目的或用於確認成功消融或去神經支配目的。在一些實施方式中,hifu導管遞送具有參數的能量,以便不發生成穴。用於消融肝叢、腹腔叢中的交感神經纖維或其它交感神經纖維的平均超聲強度範圍可從約1w/cm2至約10kw/cm2、從約500w/cm2至約5kw/cm2、從約2w/cm2至約8kw/cm2、從約1kw/cm2至約10kw/cm2、從約25w/cm2至約200w/cm2、從約200w/cm2至約1mw/cm2、小於1w/cm2、大於10kw/cm2或其重疊範圍。功率水平範圍可以是約25w/cm2至約1mw/cm2(取決於超聲能量的強度和/或其它參數)。超聲能量可以是連續的或脈衝的。用於脈衝的超聲能量的功率水平或能量密度水平可高於用於連續的超聲能量的功率水平。
各目標消融位點的治療時間範圍可從約5秒至約120秒、從約10秒至約60秒、從約20秒至約80秒、從約30秒至約90秒、小於10秒、大於120秒、一分鐘至十五分鐘、十分鐘至一小時或其重疊範圍。根據若干實施方式,使用的參數被選擇,以使肝叢的交感神經不能傳導、阻斷、停止或以其他方式破壞肝叢的交感神經的傳導至少若干月,同時對動脈壁或周圍組織或器官產生最小損壞。
3.雷射
在若干實施方式中,雷射可用於調節(例如,消融)肝叢的交感神經或使肝受神經支配的其它神經的活性。儘管雷射在其它動脈中通常不用於動脈神經消融,但肝動脈的壁厚度基本上小於其它動脈結構的厚度,從而使得雷射能量遞送成為可能。在一些實施方式中,一個或多個雷射被用於消融位於肝動脈內膜表面約2mm內、內膜表面約1.5mm內、內膜表面約1mm內或內膜表面約0.5mm內的神經。在一些實施方式中,執行交感纖維的生色團染色,以選擇性地增強交感神經對雷射能量的吸收。在一些實施方式中,氣囊被用於拉伸肝動脈,從而使動脈壁變薄和降低從內膜表面至交感神經纖維的深度,和從而提高雷射能量的遞送。
還可利用其它形式的光學或光能量。光源可包括led光源、電致發光光源、白熾光源、螢光光源、氣體雷射、化學雷射、染料雷射、金屬蒸氣雷射、固態雷射、半導體雷射、垂直空腔表面發射雷射或其它光源。光學或雷射能量的波長範圍可以是約300nm至約2000nm、從約500nm至約1100nm、從約600nm至約1000nm、從約800nm至約1200nm、從約1000nm至約1600nm或其重疊範圍。
4.外部發起的
根據各種實施方式,從對象外面的源(例如,身體外激活)發起能量遞送。圖18圖解基於微波的能量遞送系統1800的實施方式。基於微波的能量遞送系統1800包括消融導管1805和微波發生設備1820。在一些實施方式中,其它能量源還可被外部遞送。
在一些實施方式中,消融導管1805包括布置在其遠端的高傳導性探針1810。在操作中,消融導管1805可被插入到目標血管中,並被布置,以便高傳導性探針1810接近被靶向以進行消融的位點。微波發生設備1820位於對象身體外面,並被布置,以便聚焦微波1825朝向目標血管和高傳導性探針1810被遞送。在若干實施方式中,當遞送的聚焦微波1825接觸高傳導性探針1810時,它們在高傳導性探針1810內引起渦電流,從而加熱高傳導性探針1810。通過加熱高傳導性探針產生的熱能量1815可通過傳導性熱轉移而加熱目標組織。在一些實施方式中,產生的熱能量1815足以消融目標組織(例如,血管壁)內或其上布置的神經。在各種實施方式中,高傳導性探針1810的傳導性大於10^3西門子/米。
圖19圖解基於感應的能量遞送導管系統1900的實施方式。在示例的實施方式中,基於感應的能量遞送系統1900包括導管1905、感應線圈1910、外部感應器電源電路1950、感應器1960、電阻器1970和電容器1980。在一個實施方式中,感應線圈1910布置在導管1905遠端處。在操作中,感應線圈1910可充當感應器,以從外部感應電源電路1950接收能量。在一些實施方式中,外部感應電源電路1950被布置,以便感應器1960在足夠感應範圍內臨近感應線圈1910。在一些實施方式中,電流經過外部感應電源電路1950被遞送,從而引起電流在感應線圈1910內流動和遞送隨後的消融能量至周圍組織。在一個實施方式中,感應線圈組合本文所述任意開窗的導管設備(諸如,關於圖16a和16b描述的開窗的導管設備)被使用。例如,感應線圈可被放置於具有一個或多個窗的導管或套筒的腔內,所述窗被配置成允許選擇性遞送能量至目標組織。
在一些實施方式中,一個或多個合成栓可被插入目標血管內和被植入或埋入其中(至少臨時地)。合成栓可有利地大小適於至匹配目標血管的解剖結構(例如,基於目標位置的血管造影術和血管直徑)。合成栓可基於測量的或估計的目標血管的尺寸被選擇。在一個實施方式中,能量遞送導管連接至插入目標血管內的一個或多個合成栓,以遞送能量。在一些實施方式中,利用結合圖21描述的電感耦合,能量經皮被遞送至合成栓,從而取消對能量遞送導管的需要。合成栓可包括感應線圈和嵌入到絕緣支持結構中的多個電極,所述絕緣支持結構由高電介質材料組成。在適當的能量已經被遞送以調節與目標血管有關的神經之後,一個或多個栓可被移除。
在本發明若干實施方式中,基於能量的遞送系統包括冷卻系統,其被用於,例如降低對圍繞目標區域的區域的熱損壞。例如,冷卻可降低(或維持)組織溫度低於特定臨界溫度(例如,處於或在40至50攝氏度之間),從而預防或減少細胞壞死。冷卻氣囊或其它可擴張冷卻構件在一些實施方式中被利用。在一個實施方式中,消融電極被布置於氣囊上,所述氣囊利用冷卻流體被擴張。在一些實施方式中,冷卻流體通過遞送系統(例如,導管系統)循環。在一些實施方式中,冷卻流體(諸如預冷卻的鹽水)可從治療區域中的導管設備被遞送(例如,噴射)。在進一步的實施方式中,冷卻流體在導管設備內連續或間歇地內部循環,以在沒有足夠血液流量的情況下冷卻內皮細胞壁。
d.蒸汽/熱水神經調節
圖20圖解蒸汽消融導管2000的實施方式。在示例的實施方式中,蒸汽消融導管2000包括水通道2005、蒸汽生成頭2010和蒸汽出口2015。在操作中,水可被迫經過水通道2005和被導致進入蒸汽生成頭2010。在一個實施方式中,蒸汽生成頭2010將水轉換成蒸汽,蒸汽通過蒸汽出口2015離開蒸汽消融導管2000。
在一些實施方式中,蒸汽被用於消融目標解剖結構(例如,肝動脈和與其有關的神經)或使其去神經支配。根據若干實施方式,水被迫經過消融導管2000和出來經過蒸汽生成頭2010(其將水轉換成蒸汽),並且蒸汽被引導至消融目標。蒸汽消融導管2000可包括一個或多個沿導管體長度的窗。
圖21圖解熱流體氣囊消融導管2100的實施方式。在示例的實施方式中,熱流體氣囊消融導管2100包括充氣式氣囊2105。在一些實施方式中,充氣式氣囊2105被填充以溫度可變流體2110。根據若干實施方式,熱水是溫度可變流體2110,其被用於填充充氣式氣囊2105。在充氣式氣囊內由熱流體產生的熱可足以消融目標解剖結構(例如,肝動脈和與其有關的神經)或使其去神經支配。在一些實施方式中,充氣式氣囊2105被插入至消融位點和被充以滾燙或沸騰的流體(例如,水),從而加熱圍繞充氣式氣囊2105的組織足以消融該組織或使其去神經支配。在一些實施方式中,氣囊2105內的熱流體在如下溫度範圍內:約120℉至約212℉、約140℉至約212℉、約160℉至約212℉、約180℉至約212℉、約200℉至約212℉或其重疊範圍。在一些實施方式中,氣囊消融導管2100包括溫度傳感器和不同溫度的流體(例如,水)可按照治療指示被添加和抽回。在一些實施方式中,充氣式氣囊2105由聚氨基甲酸酯或任意其它抗熱充氣式材料製成。
e.化學神經調節
在一些實施方式中,藥物被單獨或組合另外的形式用於引起神經調節。藥物包括、但不限於毒蕈鹼受體激動劑、抗膽鹼酯酶劑、煙酸受體激動劑和鹽鹼受體拮抗劑。直接影響神經傳遞合成、退化或再吸收的藥物在一些實施方式中被利用。
在一些實施方式中,藥物(單獨或組合能量形式)可用於神經調節。例如,遞送導管可具有一個或多個內腔。在一些實施方式中,一個或多個內腔與遞送導管的近側開口和遠側開口流體交流。在一些實施方式中,至少一個遠側開口位於遞送導管的遠端。在一些實施方式中,至少一個近側開口位於遞送導管的近端。在一些實施方式中,至少一個近側開口與至少一個儲器流體交流。
在一些實施方式中,至少一個儲器是藥物儲器,其容納能夠調節肝叢中的交感神經纖維的藥物或治療劑。在一些實施方式中,針對用於遞送導管系統的各藥物,提供單獨的藥物儲器。在其它實施方式中,至少一個藥物儲器可容納多種藥物或治療劑的組合。能夠調節神經信號的任意藥物均可根據本文公開的實施方式被利用。在一些實施方式中,神經毒素(例如,肉毒桿菌毒素)被遞送至肝、胰腺或與其有關的其它周圍器官或神經。在一些實施方式中,神經毒素(例如,肉毒桿菌毒素)不被遞送至肝、胰腺或與其有關的其它周圍器官或神經。
在一些實施方式中,遞送導管系統包括遞送設備,其遞送一種或多種藥物至一個或多個目標位點。例如,遞送設備可以是泵。任意泵、閥門或能夠通過導管遞送藥物的其它流量調節構件均可被利用。在一些實施方式中,泵從至少一個藥物儲器通過導管遞送系統的至少一個內腔遞送至少一種藥物至一個或多個目標位點。
在一些實施方式中,泵選擇待從儲器被遞送至目標位點(一個或多個)的藥物劑量。例如,如神經調節所需要的,泵可選擇性地改變被遞送的一種或多種藥物的總量。在一些實施方式中,多種藥物被基本上同時遞送至目標位點。在其它實施方式中,多種藥物被連續遞送。在其它實施方式中,多種藥物被基本上同時遞送和至少一種其它藥物在多種藥物被遞送至目標位點(一個或多個)之前或之後被遞送。在一些實施方式中,藥物或其它劑可被利用而無需遞送導管。根據若干實施方式,藥物可具有抑制或刺激效應。
在一些實施方式中,消融導管系統利用化學消融,以消融神經纖維(例如,肝叢中的交感神經纖維)。例如,消融導管可具有一個或多個內腔。在一些實施方式中,一個或多個內腔與近側開口和遠側開口流體交流。在一些實施方式中,至少一個遠側開口位於消融導管遠端。在一些實施方式中,至少一個近側開口位於消融導管近端。在一些實施方式中,至少一個近端側開口與至少一個儲器流體交流。
在一些實施方式中,至少一個儲器容納和/或存儲能夠破壞(例如,消融、脫敏、破壞)神經纖維(例如,肝叢中的交感神經纖維)的一種或多種化學製品。在一些實施方式中,針對用於消融導管系統的各種化學製品,提供單獨的儲器。在其它實施方式中,至少一個儲器可容納化學製品的任意組合。根據本文公開的實施方式,能夠破壞神經信號的任意化學製品均可被利用。例如,使用的一種或多種化學製品或乾燥劑可包括苯酚或醇、胍乙啶、硫酸鋅、納米顆粒、近距離放射療法的輻射源、神經刺激物(例如,甲基苯丙胺)和/或氧自由基(例如,過氧化物)。然而,根據本文公開的實施方式,能夠消融肝叢中的交感神經纖維的任意化學製品均可被利用。在一些實施方式中,利用經皮膚、經腹腔鏡或經血管內途徑遞送的流體遞送針進行化學消融。
f.低溫調節
在一些實施方式中,本發明包括冷凍療法或低溫調節。在一個實施方式中,消融導管系統利用冷凍消融技術進行神經調節。在一個實施方式中,冷凍消融被用於消融肝叢中的交感神經纖維。例如,消融導管可具有一個或多個內腔。在一些實施方式中,一個或多個內腔與近側開口流體交流。在一些實施方式中,至少一個近側開口位於消融導管近端。在一些實施方式中,至少一個近側開口與至少一個儲器(例如,低溫室)流體交流。在一些實施方式中,至少一個儲器容納一種或多種冷卻劑,包括但不限於液氮。消融導管可包括供料管線,用於遞送冷卻劑至消融導管遠末端,和返回管線,用於使用過的冷卻劑返回至至少一個儲器。冷卻劑可達到足夠低的溫度,以冷凍和消融肝叢中的交感神經纖維。在一些實施方式中,冷卻劑可達到如下溫度:小於零下75攝氏度、小於零下80攝氏度、小於零下90攝氏度或小於零下100攝氏度。
在一些實施方式中,消融導管系統包括遞送設備,其控制通過一個或多個內腔遞送一種或多種冷卻劑至目標位點(一個或多個)。例如,遞送設備可以是泵。任意泵、閥門或能夠通過導管遞送冷卻劑的其它流量調節構件均可被利用。在一些實施方式中,泵從至少一個儲器遞送至少一種冷卻劑經過至少一個導管體的近側開口、經過至少一個導管體的內腔和達到消融導管遠端(例如,經供料管線或冷卻劑管線)。
在一些實施方式中,目標神經可利用可植入珀耳帖冷卻設備而被不可逆地冷卻。在一些實施方式中,可植入冷卻設備被配置成被再次填充以惰性氣體,其在壓力下被注入可植入設備中的儲器中,然後在目標神經附近被選擇性地釋放、以隔熱方式使其冷卻,從而減緩或終止神經傳導(臨時性地或永久地)。在一些實施方式中,局部注射或注入氯化銨被用於引起冷卻反應,其足以改變或抑制神經傳導。在一些實施方式中,遞送冷卻劑至消融導管遠端——可包括一個或多個消融電極或金屬包裹的圓柱形末端——導致肝叢中的交感神經纖維去神經支配。例如,當消融導管被布置於肝固有動脈或肝總動脈中或其附近時,冷卻劑溫度可導致周圍區域的溫度充分降低,以使肝叢中的交感神經纖維去神經支配。在一些實施方式中,利用低溫導管進行冷凍消融。可選地,可利用一個或多個探針——單獨的或組合低溫導管進行冷凍消融。
各目標消融位點的治療時間的範圍可從約5秒至約100秒、5分鐘至約30分鐘、從約10分鐘至約20分鐘、從約5分鐘至約15分鐘、從約10分鐘至約30分鐘、小於5秒、大於30分鐘或其重疊範圍。根據若干實施方式,使用的參數被選擇,以使例如肝叢的交感神經不能傳導、阻斷、停止或以其他方式破壞例如肝叢的交感神經的傳導。對神經傳導的作用可以是永久性的或臨時性的。一、二、三或更多個冷卻循環可被利用。
在一些實施方式中,藥物遞送、化學消融和/或冷凍消融的任意組合均被用於神經調節並可組合能量形式被利用。在若干實施方式中,結合能量遞送提供冷卻系統,以例如,保護臨近神經纖維的組織。
iii.圖像引導、勘測和選擇性布置
根據本文公開的若干實施方式,可利用圖像引導技術。例如,可視化元件(例如,光纖鏡(fiberopticscope))可組合基於導管的能量或流體遞送系統被提供,以幫助神經調節導管的遞送和對齊。在其它實施方式中,螢光透視、超聲、都卜勒或其它成像被用於幫助神經調節導管的遞送和對齊。在一些實施方式中,射線不透標記被定位於神經調節導管遠端或沿神經調節導管長度的一個或多個位置。例如,對於具有電極的導管,至少一個電極可包括輻射不透性材料。計算機化的x線體層照相術(ct)、螢光、放射照相、熱相圖、都卜勒、光學相干x線體層照相術(oct)、血管內超聲(ivus)和/或磁共振(mr)成像系統在具有或不具有造影劑或分子成像劑的情況下也可用於提供神經調節導管系統的圖像引導。在一些實施方式中,神經調節導管包括一個或多個腔,用於插入成像、可視化、光遞送、吸入或其它設備。
根據一些實施方式,圖像或可視化技術和系統被用於提供對被靶向神經纖維的破壞(例如,消融、破壞、切斷、去神經支配)的確認。在一些實施方式中,神經調節導管包括一個或多個傳感器(例如,傳感器電極),其被用於提供對被靶向神經纖維交流的破壞(例如,消融、破壞、切斷、去神經支配)的確認。
在一些實施方式中,交感神經和副交感神經在調節之前被勘測。在一些實施方式中,傳感器導管被插入目標調節區域附近的血管腔內。傳感器導管可包括一個傳感器構件或沿導管體長度分布的多個傳感器。在傳感器導管就位以後,交感神經或副交感神經可被刺激。在一些實施方式中,傳感器導管被配置成檢測電活性。在一些實施方式中,當交感神經被人工刺激和副交感神經不變時,傳感器導管檢測提高的電活性和從傳感器導管獲得的數據被用於繪製交感神經幾何形狀。在一些實施方式中,當副交感神經被人工刺激和交感神經不變時,傳感器導管檢測提高的電活性和從傳感器導管獲得的數據被用於繪製副交感神經幾何形狀。在一些實施方式中,利用神經刺激和傳感器導管繪製神經幾何形狀有利地促進提高的或更知情地選擇待調節的目標區域,使選定神經能存活,同時選擇性地消融和破壞其它神經。作為一個實施方式的實例,為選擇性地消融交感神經,交感神經可被人工刺激同時已經插入的傳感器導管檢測和勘測電活性提高的區域。為破壞交感神經,僅記錄電活性提高的區域可需要被消融。
在一個實施方式中,靶向交感神經纖維的方法包括利用電生理學勘測工具。雖然應用中央或外周神經信號趨於提高交感活性(例如,通過施用去甲腎上腺素或電刺激),但傳感導管可用於繪製目標血管(例如,肝動脈)的幾何形狀和突出電活性提高的區域。然後,消融導管可被引入和激活,以消融繪製的電活性提高的區域,因為電活性提高的區域有可能主要通過交感神經纖維受神經支配。在一些實施方式中,神經損傷監測(nim)方法和設備被用於提供關於接近位於血管周圍的交感神經的設備的反饋。在一個實施方式中,nim電極經腹腔鏡或胸腔鏡連接至交感神經節。
在一些實施方式中,為選擇性地靶向交感神經,可在肝動脈周圍監測局部傳導性。相應於最大阻抗的位置有可能對應於交感神經纖維的位置,因為它們最遠離膽管和門靜脈,其經過肝動脈後面和與圍繞門脈三徵的其它組織相比是高度傳導性的。在一些方法中,為選擇性地破壞交感神經,具有提高的阻抗的位置被選擇性地調節(例如,消融)。在一些實施方式中,一個或多個迴路電極被放置在門靜脈和/或膽管中,以增強在交感神經組織中觀察的阻抗效應。在一些實施方式中,迴路電極被放置在充滿大的靜脈和具有減少的脂肪和/或非-血管組織(諸如頸或腕等)的皮膚區域上。門靜脈和其它靜脈之間的電阻可非常低,因為相對於其它組織血液的導電性提高。因此,阻抗效應可被增強,因為肝動脈和門靜脈上各位置之間電阻的相當小的變化對記錄的整體電阻有可能具有相對大的影響。
在一些實施方式中,交感神經被定位靶向。在一些對象中可觀察到交感神經纖維趨於沿肝固有動脈的相當長度伸展,而副交感神經纖維趨於朝向肝固有動脈的遠側範圍聯結。在一些實施方式中,通過朝向其近端範圍(例如,通常是腹腔動脈的第一分支和肝總動脈的第一分支之間的中間或超過肝固有動脈分支約一釐米、約兩釐米、約三釐米、約四釐米或約五釐米)消融肝固有動脈,可靶向交感神經。定位靶向可以是有利的,因為可避免損壞重要結構,諸如膽管和門靜脈,其在朝向肝遠側經過時通常接近肝動脈。
在一些實施方式中,通過與血管系統的已知分支結構(例如,直接在給定分支之後)關聯選擇神經調節位置。在一些實施方式中,通過測量(例如,插入到目標血管中的釐米數)選擇神經調節位置。因為相關神經和血管解剖結構在人中是高度可變的,所以基於相對於分支解剖結構的位置而不是基於沿肝動脈的距離選擇神經調節位置在一些情況中更有效。在一些對象中,神經纖維密度在分支位置有質的提高。
在一些實施方式中,靶向交感神經纖維的方法包括利用血管造影術評估腹腔幹遠側的動脈結構的幾何形狀。在一個實施方式中,方法包括將幾何形狀表徵成任意數目的普通變量,然後基於針對給定的動脈變化的預期副交感神經纖維的路線選擇神經調節(例如,消融)位置。因為動脈長度測量結果可因對象而異,所以在一些實施方式中,該用於靶向交感神經纖維的方法獨立於動脈長度測量結果而執行。例如,當期望去神經支配或消融臨近和最接近肝總動脈向胃十二指腸和肝固有動脈的分叉的區域時可利用該方法。
在直接觀察下缺乏神經鑑別的情況下,可基於其生理學功能鑑別神經。在一些實施方式中,利用葡萄糖和去甲腎上腺素(「ne」)水平進行勘測和隨後的調節。在一些實施方式中,葡萄糖和ne水平隨禁食時間常數做出響應。因此,臨床醫師可刺激目標動脈或其它血管中的特定區域(例如,在不同方向中或圓周鍾位置或縱向位置)、監測生理學應答、然後僅在顯示不期望生理學應答的位置中進行調節(例如,消融)。交感神經趨於朝向肝動脈的前部分伸展,而副交感神經趨於朝向肝動脈的後部分伸展。因此,可選擇不僅位於前部的位置,而且可以選擇(利用上述葡萄糖和ne水平測量)在前部顯示對刺激最強生理學應答(例如,由於交感刺激而葡萄糖水平提高)的具體位置。在一些實施方式中,通過0.1s-開,4.9s-關,14hz,0.3ms,4ma脈衝的rf能量的刺激是交感活化劑,和通過2s-開,3s-關,40hz,0.3ms,4ma脈衝的rf能量的刺激是副交感活化劑。然而,rf能量的其它參數或其它能量類型可被利用。
在一些實施方式中,利用電和/或位置選擇性,臨床醫師可應用刺激脈衝或信號和監測生理學應答。可指示治療功效的一些生理學應答包括、但不限於以下:血糖水平、血液和/或組織ne水平、血管肌張力、血液胰島素水平、血液胰高血糖素水平、血液c肽水平、血壓(收縮壓、舒張壓、平均血壓)和心率。在一些情況下,血糖和組織ne水平可以是最精確和容易測量的參數。生理學應答可通過動脈或靜脈血液抽取、神經傳導研究、口腔或直腸溫度讀數或經皮膚的或手術活體解剖被監測或評估。在一些實施方式中,在各增加的消融之後進行經頸靜脈肝活體解剖,以測量因此產生的組織ne水平降低,和治療可基於測量的水平被滴定或調節。例如,為了測量肝中的組織ne水平,活體解剖導管可通過tips途徑或其它頸靜脈入口被插入,以獲取肝實質樣品。在一些實施方式中,門靜脈的靜脈壁可被安全地侵犯,以獲得活體解剖,因為靜脈被肝實質環繞,從而預防血液損失。
在一些實施方式中,利用具有能夠在利用螢光透視成像觀看時指示正確位置的輻射不透性指示劑的消融導管進行消融。由於螢光透視成像的二維性質,設備位置可僅沿單一平面被確定,提供目標血管系統的矩形橫截面視圖。為了克服沿血管周圍確定設備位置而無需重新布置螢光透視成像系統的困難,利用螢光透視成像可視的旋轉布置指示劑可有利地被結合在血管內消融設備上,以指示消融組件(例如,電極)相對於血管解剖結構的圓周位置。
在一個實施方式中,具有消融電極的消融導管包括三種輻射不透性指示劑,其沿消融導管的縱軸布置。在一個實施方式中,第一輻射不透性指示劑基本上臨近於設備軸上的電極被布置;第二輻射不透性指示劑被布置於設備軸上的電極近側;和第三輻射不透性指示劑離開設備軸被布置。在一個實施方式中,第三輻射不透性指示劑被布置於第一和第二輻射不透性指示劑之間。在具有三種輻射不透性指示劑的實施方式中,消融電極被配置成通過從導管的中央軸偏斜接觸血管壁。在一個實施方式中,第一和第二輻射不透性指示劑的對齊意味著消融電極位於這樣的位置:與成像平面間隔開並直接垂直於成像平面(例如,假定冠狀成像平面,前面或後面)。在一個實施方式中,第三輻射不透性指示劑的位置指示前-後方向。例如,高於、位於或低於第一和第二輻射不透性指示劑之間形成的線的第三輻射不透性指示劑的位置可提供餘下的信息,其對於允許用戶推斷消融導管的位置是必要的。
iv.可選導管遞送方法
除了經血管內被遞送經過動脈以外,本文所述神經調節系統(例如,消融導管系統)可經血管內遞送經過靜脈系統。例如,消融導管系統可被遞送經過門靜脈。在其它實施方式中,消融導管系統經血管內被遞送經過下腔靜脈。任意其它血管內遞送方法或途徑均可用於遞送神經調節系統,例如,用於調節肝叢中的交感神經纖維。
在一些實施方式中,神經調節系統(例如,導管系統)經腔被遞送,以調節神經纖維。例如,導管系統可經腔被遞送經過胃。在其它實施方式中,導管系統經腔被遞送經過十二指腸或通過內窺鏡逆行胰膽管造影術(ercp)經腔經過膽管樹。根據本文所述實施方式,任意其它經腔或腹腔鏡遞送方法可用於遞送導管系統。
在一些實施方式中,導管系統經皮膚被遞送至膽管樹,以消融肝叢中的交感神經纖維。任意其它微創遞送方法均可用於遞送神經調節系統,用於在期望和/或需要時調節或破壞肝叢中的交感神經纖維。
在一些實施方式中,開放式外科手術被用於調節肝叢中的交感神經纖維。任意開放式外科手術均可用於接近肝叢。結合開放式外科手術,本文所述的用於神經調節的任意形式均可被利用。例如,rf消融、超聲消融、hifu消融、通過藥物遞送的消融、化學消融、冷凍消融、離子化能量遞送(諸如x-射線、質子束、γ射線、電子束和α射線)或其任意組合均可被用於開放式外科手術。在一個實施方式中,神經纖維(例如,在肝叢中或其周圍)經手術結合開放式外科手術被切割,以破壞,例如肝叢中的交感信號傳導。
在一些實施方式中,非創程序或方法被用於消融肝叢中的交感神經纖維和/或其它神經纖維。在一些實施方式中,本文所述的任意形式,包括、但不限於超聲能量、hifu能量、電能量、磁能量、光/輻射能量或可影響神經纖維非創消融的任意其它形式,結合非創(例如,經皮)程序被用於消融肝叢中的交感神經纖維和/或其它神經纖維。
v.刺激
根據一些實施方式,神經調節通過刺激神經和/或提高神經傳遞而完成。在一個實施方式中,刺激可導致神經阻斷。在其它實施方式中,刺激增強神經活性(例如,信號傳導)。
根據一些實施方式,神經纖維的治療性調節通過自主(例如,交感或副交感)神經纖維的神經刺激執行。神經刺激可通過上述任意設備或系統(例如,消融導管或遞送導管系統)和利用上述任意方法(例如,血管內、腹腔鏡、經皮、非創、開放式手術)被提供。在一些實施方式中,利用臨時性導管或探針,提供神經刺激。在其它實施方式中,利用可植入設備提供神經刺激。例如,電神經刺激物可被植入,以刺激使肝受神經支配的副交感神經纖維,這通過抵消交感神經的作用可有利地導致血糖水平降低。
在一些實施方式中,可植入神經刺激物包括可植入脈衝發生器。在一些實施方式中,可植入脈衝發生器包括內部電源。例如,內部電源可包括一個或多個電池。在一個實施方式中,內部電源放置在與可植入脈衝發生器分開的皮下位置處(例如,為了容易接近,以進行電池更換)。在其它實施方式中,可植入脈衝發生器包括外部電源。例如,可植入脈衝發生器可通過rf連接被提供功率。在其它實施方式中,可植入脈衝發生器通過直接電連接被提供功率。根據本文公開的實施方式,任意其它內部或外部電源均可用於為可植入脈衝發生器提供功率。
在一些實施方式中,可植入脈衝發生器被電連接至一個或多個電線或導線。一個或多個電線或導線可被電連接至一個或多個電極。在一些實施方式中,一個或多個電極是雙極的。在其它實施方式中,一個或多個電極是單極的。在一些實施方式中,存在至少一個雙極電極對和至少一個單極電極。在一些實施方式中,一個或多個電極是神經袖套電極。在其它實施方式中,一個或多個電極是傳導性錨狀物。
在一些實施方式中,一個或多個電極被放置在使肝受神經支配的副交感神經纖維上或其附近。在一些實施方式中,可植入脈衝發生器遞送電信號至一個或多個電極。在一些實施方式中,可植入脈衝發生器遞送電信號至一個或多個電極,其產生足夠電場,以刺激使肝受神經支配的副交感神經纖維。例如,產生的電場可通過改變這些神經纖維的膜電位而刺激使肝受神經支配的副交感神經纖維,以產生動作電位。
在一些實施方式中,可植入脈衝發生器通過改變遞送至電極的電信號徵用增加數目的使肝受神經支配的副交感神經纖維。例如,可植入脈衝發生器可遞送不同持續時間的脈衝。在一些實施方式中,可植入脈衝發生器改變脈衝的幅度。在其它實施方式中,可植入脈衝發生器遞送多個脈衝。例如,可植入脈衝發生器可遞送一系列脈衝。在一些實施方式中,可植入脈衝發生器改變脈衝的頻率。在其它實施方式中,可植入脈衝發生器改變脈衝的任意一個或多個參數,包括、但不限於持續時間、幅度、頻率和脈衝總數。
在一些實施方式中,可植入神經刺激物化學刺激使肝受神經支配的副交感神經纖維。例如,化學神經刺激物可以是可植入泵。在一些實施方式中,可植入泵從植入的儲器遞送化學製品。例如,可植入泵可遞送化學製品、藥物或治療劑,以刺激使肝受神經支配的副交感神經纖維。
在一些實施方式中,可植入神經刺激物利用電刺激、化學刺激或任意其它方法的任意組合來刺激使肝受神經支配的副交感神經纖維。
在一些實施方式中,非創神經刺激被用於刺激使肝受神經支配的副交感神經纖維。例如,經皮電刺激可用於刺激使肝受神經支配的副交感神經纖維。在其它實施方式中,任意非創神經刺激的方法均被用於刺激使肝受神經支配的副交感神經纖維。
根據本文公開的實施方式,除了使肝受神經支配的副交感神經纖維以外的副交感神經纖維被刺激,以治療糖尿病和/或與代謝狀況相關的其它狀況、疾病、病症或症狀。例如,使胰腺受神經支配的副交感神經纖維、使腎上腺受神經支配的副交感神經纖維、使小腸受神經支配的副交感神經纖維、使胃受神經支配的副交感神經、使腎受神經支配的副交感神經纖維(例如,腎叢)或其副交感神經纖維的任意組合均可根據本文公開的實施方式被刺激。任意自主神經纖維均可利用本文所述設備、系統和方法經治療被調節(例如,被破壞或刺激),以治療本文所述任意狀況、疾病、病症或症狀(例如,糖尿病或糖尿病相關狀況)。在一些實施方式中,肝內臟脂肪組織或其它周圍器官被刺激。在一些實施方式中,提供肝內刺激或對肝外表面的刺激。在一些實施方式中,刺激(例如,電刺激)不被提供至肝外表面或肝內(例如,至肝實質)、不被提供至迷走(vagal)或迷走(vagus)神經、不被提供至肝門靜脈和/或不被提供至膽管。
可經血管內或血管外進行刺激。在一個實施方式中,刺激導線經血管內被布置於臨近副交感神經的肝動脈樹中。通過靶向接近肝固有動脈或追蹤肝左和肝右動脈分支和亞分支的多個肝分支的位置,副交感神經的主要肝分支可被刺激。在一個實施方式中,刺激導線被布置於部分肝食道(hepatoesophageal)動脈中,並被激活,以刺激圍繞肝食道動脈的副交感神經,因為兩個迷走分支均沿肝食道動脈經過。
在一個實施方式中,刺激導線被布置於門靜脈中,並被激活,以刺激圍繞門靜脈的神經纖維,所述門靜脈可具有傳入副交感性質。在一個實施方式中,刺激導線從中央靜脈途徑跨肝實質被布置(例如,經tips-樣的程序)或通過動脈入口被布置經過肝動脈,然後進入門靜脈。在一個實施方式中,門靜脈通過經皮途徑經血管外被進入。刺激導線可被縱向放置於門靜脈內或像袖套一樣環繞門靜脈。通過在附著於外部血管壁或外部血管壁內的副交感纖維上直接放置刺激導線,可進行對門靜脈的血管外刺激。在各種實施方式中,通過跨過動脈壁或通過接近膽管樹,經門靜脈壁利用tips-樣途徑,在螢光檢查指導下經皮放置刺激導線。
在一些實施方式中,刺激導線被連續或長期地刺激,以影響靜止的肝葡萄糖產物和葡萄糖攝入。在各種實施方式中,當對象處於空腹或餵食狀態時進行刺激,這取決於對象的葡萄糖移動分布。在一些實施方式中,刺激可被編程,以在不同的時間(例如,定期或基於反饋)自動發生。例如,傳感導線可被布置胃中或其它位置,以檢測食物攝取和在檢測後觸發刺激。在一些實施方式中,刺激由對象控制或編程或在線由臨床醫師遠程控制或編程。
在一些實施方式中,通過0.1s-開,4.9s-關,14hz,0.3ms,4ma脈衝的rf能量的刺激被用於交感神經刺激和通過2s-開,3s-關,40hz,0.3ms,4ma脈衝的rf能量的刺激被用於副交感神經激活。然而,rf能量的其它參數或其它能量類型均可被利用。
除了導致肝葡萄糖產量和攝取變化的對肝的傳出效應以外,副交感刺激還可引起沿迷走神經的傳入效應。傳入效應可引起代謝狀態的其它傳出神經介導的變化,包括、但不限於以下一個或多個:胰腺中β細胞功能的提高、提高的肌肉葡萄糖攝入、胃或十二指腸動力變化、分泌或重要的胃和十二指腸激素變化(例如,胃中生長素釋放肽的提高,以發出飽腹感信號和/或來自十二指腸的胰高血糖素-樣肽-1(glp-1)的提高,以提高胰島素敏感性)。
vi.實施例
下面提供的實施例意圖是本發明的非限制性實施方式。
a.實施例1
三隻狗進行高脂肪、高果糖飲食達四周,從而使狗具有胰島素抗性。作為對照,在開始高-脂肪、高果糖飲食後第四周在過夜禁食後給予0.9g/kg口服管飼葡萄糖聚合物製劑劑量,並且,在各種時間間隔進行口服葡萄糖耐性測試,以追蹤葡萄糖水平。然後,經手術使三隻狗的肝總動脈去神經支配。另外的0.9g/kg口服給予葡萄糖聚合物製劑劑量在肝去神經支配後約二至三周在過夜禁食後被給予。給予葡萄糖聚合物製劑後,在各種時間間隔進行口服葡萄糖耐性測試。圖23圖解通過兩個口服葡萄糖耐性測試(ogtts)報告的、針對三隻狗的平均靜脈血漿葡萄糖隨時間的圖。由黑圈表示的具有數據點的曲線表示來自在肝去神經支配前四周的高脂肪、高果糖飲食後三隻狗的ogtt測試的葡萄糖測量結果的平均值。口服管飼葡萄糖聚合物製劑劑量在圖23所示時間零給予。白圈表示的具有數據點的曲線表示來自在肝去神經支配後二至三周相同三隻狗的ogtt測試的葡萄糖測量結果的平均值。如圖23可見,與肝去神經支配前的葡萄糖值相比,在肝去神經支配後葡萄糖值在較低葡萄糖濃度達到峰值,並且更快速地下降。根據若干實施方式,研究結果提供肝去神經支配對控制血糖水平的功效的有力證據。
b.實施例2
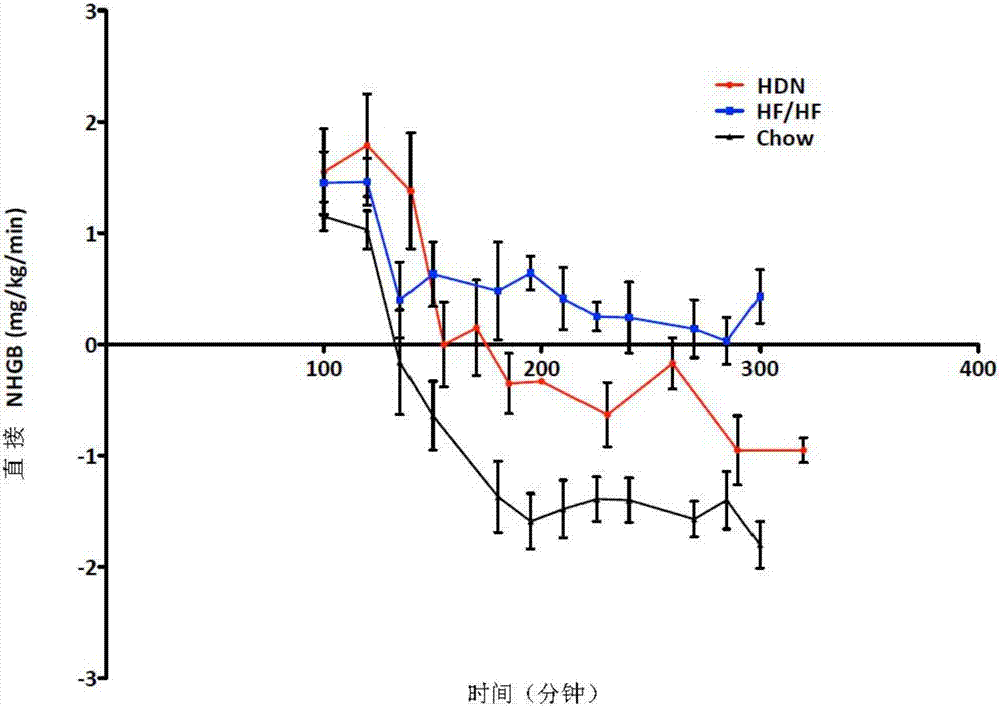
圖24圖解在高血糖-高胰島素鉗夾研究期間獲得的平衡的淨肝葡萄糖。以圓形指示物(hdn)表示的數據表示去神經支配後四周與實施例1相同的3隻狗的平均淨肝葡萄糖水平。以方形指示物(hf/hf)表示的數據表示被餵以高脂肪、高果糖飲食的5隻狗的平均淨肝葡萄糖水平。以三角形指示物(chow)表示的數據表示被餵以正常飲食的5隻狗的平均淨肝葡萄糖水平。數據顯示,在曲線即將結束時,肝去神經支配將淨肝葡萄糖平衡恢復回基線的約60%,這表明hf/hf狗模型中肝的胰島素抗性通過肝去神經支配被大大矯正,這還表明肝去神經支配對肝葡萄糖攝入和/或肝葡萄糖產量有影響。
c.實施例3
從豬肝近至肝總動脈和遠至肝左動脈和肝右動脈的分叉獲取肝動脈。動脈叢夾在兩個部分的肝實質(「床」和「屋頂」)之間,並被放置於不鏽鋼盤中,以用作迴路電極。利用radionicsrfg-3crf發生器利用niti/擴張器鞘消融總計3條動脈,使暴露表面長度為大約1/16」至3/32」。在各種情況下施用rf能量117秒,其中發生器功率設置為4(通常遞送2-3w到55-270ω中)。對於前兩個樣品動脈,k-型熱電偶被用於監測血管外溫度,其達到50-63℃。在肝左動脈中進行第一消融,在肝右動脈中進行第二消融和在肝固有動脈中進行第三消融。對於肝左動脈——腔直徑為1.15mm——中的第一消融,獲得兩個消融區測量結果(0.57mm和0.14mm)。測量大致3mm血凝區。電極暴露距離為3/32」。對於肝右動脈中的第二消融,利用電極暴露距離1/16」。由於高電流密度,發生器阻礙出來,並且沒有觀察到消融損傷。對於肝固有動脈——腔直徑為2mm和利用電極暴露距離3/32」——的第三消融,測量的三個消融區的寬度為0.52mm、0.38mm和0.43mm。測量的消融區寬度支持這樣的事實:即,圍繞肝固有動脈的神經(其可緊緊粘附於動脈壁或在動脈壁內)可利用血管內途徑被去神經支配。對豬肝動脈區段的組織學測量結果已經表明,肝動脈神經離腔表面在1-10個中膜厚度(大約1-3mm)內,從而提供對利用低-功率rf能量(例如,小於10w和/或小於1kj)或其它能量形式經血管內調節(例如,去神經支配、消融、阻斷其傳導或破壞)使肝動脈分支受神經支配的神經的支持。使腎動脈受神經支配的神經離腎動脈腔通常在4-6mm範圍內。
d.實施例4
對豬模型的肝總動脈和肝固有動脈進行急性動物實驗。肝總動脈被消融7次和肝固有動脈被消融3次。根據本發明一個實施方式,溫度-控制算法(例如,手工調節功率,以實現期望的溫度)在範圍從50℃至80℃的溫度下實施和達總消融時間範圍從2至4分鐘。根據本發明一個實施方式,對於所有消融,電極暴露距離為3/32」。根據本發明各種實施方式,在所有消融中,消融參數通常範圍如下:電阻範圍從約0.1歐姆至約869歐姆(通常約100歐姆至約300歐姆)、功率輸出範圍從約0.1w至約100w(通常約1瓦特至約10瓦特)、發生器電壓通常範圍從約0.1v至約50v、電流通常範圍從約0.01a至約0.5a和電極末端溫度通常範圍從約37℃至約99℃(通常為各消融的目標溫度+/-5℃)。基於溫度和時間,在許多消融中能量被滴定上至大約1kj或者更多。在對應於完成的消融的位置中在螢光檢查下觀察到缺口,這可能是消融成功的陽性指示物,因為熱損壞引起動脈痙攣。
觀察到,儘管試圖將消融區域分開1cm,但消融導管在消融程序中遠端跳躍,這據信是由於在消融程序中隔膜的運動而發生的,從而引起解剖結構和圍繞肝的肝動脈血管系統的運動(其可以是肝解剖學的唯一挑戰)。
與之前血管內消融目標(例如,腎動脈,其通常直接朝向腎經過)不同,肝動脈血管系統是高度可變和曲折的。在研究中觀察到,具有單一鉸接形狀的導管可能不能提供足夠和連續的電極接觸力來實現消融成功。例如,在利用現有商售rf消融導管的若干消融嘗試——其中,能量根據手動實施的恆定-溫度算法被遞送——中,功率水平相對高,同時需要電壓輸出的低可變性,以維持目標溫度。該數據通常指示差的血管壁接觸,因為電極被暴露於較高的水平的血液冷卻(從而要求較高的功率輸出,以維持特定目標溫度)。另外,組織電阻率是溫度的函數。儘管血管壁內的組織在空間上被固定,但存在與電極在生理學溫度下接觸的「恢復的」血液組織的恆定質量流量。因此,在一個實施方式中,當電極在生理學溫度下充分接觸「恢復的」血液時,電極「看到」基本上恆定的阻抗。由於阻抗和電壓之間的相關性(例如,p=v2/r),基本上恆定的阻抗以需要來維持目標電極末端溫度的基本上恆定的(較少變化)電壓輸入被反映。因此,特定實施方式(諸如,在例如圖14和15中描述的實施方式有利地使以可在臨床上遇到的任意程度的肝動脈彎曲能夠進行充分的電極接觸。
e.實施例5
代表肝動脈和周圍結構的數字模型利用解剖、熱和電組織性質在comsolmultiphysics4.3中構建。熱和電性質是溫度的函數。導電性(sigma或σ)通常根據如下方程式而變化:其中σ0是在生理學溫度(t0)下測量的導電性和t是溫度。參考圖22a-22d,模型幾何形狀被評估並包括代表肝動脈腔、膽管2205和門靜脈2210的區域。膽管2205和門靜脈2210被模擬為接地結構,突出這些結構對電流流動的作用。通過計算肝血液流量和肝動脈和門靜脈2210的相對貢獻,確定肝動脈中的流量明顯低於其它動脈(例如,腎動脈)中的流動速率。在一個實施方式中,對於肝動脈估計的流動速率是139.5ml/min。利用上述模型,首先獲得針對單極和雙極電極構造的獨立解決方案。產生對應於肝總動脈的幾何模型,並且,利用如下生物熱方程在comsol中計算時間依賴性解決方案:其在一個實施方式中,關聯作為組織中溫度梯度函數的模型中任意點的溫度、血液灌注、進入感興趣幾何區域的血液溫度和作為rf能量沉積函數的產生的熱(qm)。
圖22a和22b圖解利用單一電極的肝總動脈中rf能量沉積的幾何模型,其中膽管2205和門靜脈2210的導電性被接地(圖22a)和計算在內(圖22b)。如示於圖22b,在單一電極2215被利用時,膽管和門靜脈傳導性可影響消融能量經過的地方。圖22c和22d圖解雙極電極構造2215的肝總動脈中rf能量沉積的幾何模型,其中膽管2205和門靜脈2210的導電性被接地(圖22c)和計算在內(圖22d)。
電場形狀和產生的熱消融2220在單極消融模型中明顯受影響,這是由於膽管和門靜脈傳導性(如示於圖22a和22b)造成的。對於雙極消融模型,由於膽管和門靜脈傳導性造成的最小效應(例如,成形效應)在電場形狀和產生的熱消融2220中被觀察到(示於圖22c和22d)。當雙極電極對根據一個實施方式隨著被布置在基本上正切於動脈內腔的位置——其中各獨立電極的弧長度為20度和其中電極間間隔為10度——而被模擬時,獲得圖22a和22b。在一個實施方式中,電極邊緣的半徑足以降低電流濃度(小於0.001」)。在若干實施方式中,雙極構造有利地提供有效的消融(例如,肝動脈的熱消融),而不明顯影響消融區成形,儘管由於膽管和門靜脈接近肝總動脈而產生的膽管和門靜脈傳導性的作用。
f.實施例6
利用上述實施例5中的相同雙極構造模型,獲得針對利用對流冷卻(例如,僅通過血液流動提供)的消融和針對結合主動冷卻(例如,7℃冷卻劑)的消融的獨立模擬解決方案。模型顯示在對應於腔(內皮細胞)界面的位置明顯降低的溫度。較高功率(45%較高功率)被遞送至主動冷卻模型。即使利用遞送至主動冷卻模型的較高功率(例如,45%較高功率),肝總動脈的內皮區域仍保持冷卻(例如,離腔上至1mm小於人工發熱溫度)。熱消融區的有效成形也被引導到在主動冷卻模型中被徑向引導的更線性的形狀中。根據若干實施方式,觀察到,隨著冷卻功率被提高和rf功率被提高,線性成形作用被放大,從而使消融區能夠被引導或「程序化」(例如,朝向更目標的位置)。
在一些實施方式中,本文所述神經調節導管(例如,消融導管)設計(例如,圖13a-13c的氣囊式導管)有利地提供對使肝動脈分支受神經支配的神經的有效調節,而不引起或至少最小化內皮損傷——如果期望。例如,本文所述導管可堵塞肝動脈(例如,利用氣囊),然後在消融區域(例如,在氣囊的腔內)內循環冷卻劑。在一些實施方式中,導管提供如下獨特優勢:通過較大電極表面積(通過可在氣囊上製造的較大電極尺寸可實現)提供的較高功率淨能量和提高的沉積時間(可通過堵塞向肝動脈的流量達較長時間段的能力而被允許)。根據若干實施方式,通過較高功率的能量密度提高通過冷卻劑在氣囊內的流動而減輕損壞內皮細胞壁的風險。
雖然本文所述設備、系統和方法已經主要解決對糖尿病(例如,糖尿病)的治療,但其它狀況、疾病、病症或症狀均可利用本文所述設備、系統和方法被治療,包括但不限於室性心動過速、心房顫動或心房撲動、炎性疾病、內分泌疾病、肝炎、胰腺炎、胃潰瘍、胃動力病症、過敏性腸症候群、自身免疫性病症(諸如克羅恩病)、肥胖、泰-薩二氏病、威爾遜病、nash、nafld、白質病變、多囊卵巢症候群、妊娠糖尿病、尿崩症、甲狀腺疾病和其它代謝病症、疾病或狀況。
儘管本文公開了若干實施方式和實施例,但本申請超過具體公開的實施方式而延伸到本發明的其它可選實施方式和/或用途及其修飾和等同物。還考慮可進行實施方式的具體特徵和方面的各種組合或亞組合,其仍屬於本發明的範圍。因此,應該理解,公開的實施方式的各種特徵和方面可彼此組合或替代,以形成公開的發明的不同方式。因此,意圖本文公開的本發明的範圍不應該被上述具體公開的實施方式所限制。
