用於分析體細胞可動因子的方法及其用途與流程
2023-07-27 10:41:51 7
本申請要求於2014年2月27日提交的美國臨時申請序列號61/945,791的權益,該申請通過引用全文併入本文。
援引併入
本說明書中提到的所有出版物、專利和專利申請均通過引用而併入本文,其程度猶如特別地且單獨地指出每個單獨的出版物、專利或專利申請通過引用而全文併入。
技術實現要素:
一些實施方案涉及鑑定可動因子插入(MEI)標記的細胞增殖的方法,該方法包括以下步驟:定量測量第一核酸樣品中第一MEI插入位點處的MEI水平,定量測量第二核酸樣品中第一MEI插入位點處的MEI水平,以及如果第一核酸樣品中第一MEI插入位點處的MEI水平與第二核酸樣品中第一MEI插入位點處的MEI水平顯著(substantially)不同,則將所述第一MEI插入位點鑑定為標記MEI標記的細胞增殖。在所述方法的一些方面,所述第一核酸樣品和所述第二核酸樣品包含基本相似量的核酸。在所述方法的一些方面,所述第一核酸樣品和所述第二核酸樣品中存在基本相似量的對照核酸。所述方法的一些方面包括鑑定與所述第一MEI插入位點相鄰的序列。所述方法的一些方面包括選擇與應對與所述第一MEI插入位點相鄰的序列中的缺陷的功效相關的治療。在所述方法的一些方面,所述第一核酸樣品和所述第二核酸樣品在第一時間點和第二時間點從相同(common)個體獲得。在所述方法的一些方面,所述第一時間點和第二時間點被施用於所述個體的治療隔開。在所述方法的一些方面,所述治療包括癌症療法。在所述方法的一些方面,所述第一時間點和第二時間點相隔至少6個月。在所述方法的一些方面,所述第一時間點和第二時間點相隔至少1年。在所述方法的一些方面,所述第一時間點和第二時間點相隔至少2年。在所述方法的一些方面,所述第一時間點和第二時間點相隔至少5年。在所述方法的一些方面,所述第一核酸樣品和所述第二核酸樣品從血液中提取。在所述方法的一些方面,所述第一核酸樣品和所述第二核酸樣品包含循環遊離核酸。在所述方法的一些方面,所述第一核酸樣品和所述第二核酸樣品包含循環遊離基因組DNA。在所述方法的一些方面,所述第一核酸樣品從個體的第一位置獲得,而所述第二核酸樣品從該個體的第二位置獲得。在所述方法的一些方面,所述第一位置包含第一癌性組織。在所述方法的一些方面,所述第二位置包含健康組織。在所述方法的一些方面,所述第二位置包含第二癌性組織。在所述方法的一些方面,所述第二癌性組織和所述第一癌性組織來源於相同的癌。所述方法的一些方面包括生成報告,該報告披露第一核酸樣品中第一MEI插入位點處的MEI水平和第二核酸樣品中第一MEI插入位點處的MEI水平。在所述方法的一些方面,所述報告提供給所述個體。在所述方法的一些方面,所述報告提供給醫療保健專業人員。在所述方法的一些方面,所述報告是保密的。
一些實施方案涉及可動因子插入(MEI)監測方案,其包括以下步驟:從個體獲得包含多個MEI插入邊界的基因組序列信息,考察所述多個MEI插入邊界以鑑定與癌基因相鄰的邊界,以及隨時間監測與所述癌基因相鄰的MEI邊界的定量豐度。在所述方法的一些方面,所述隨時間監測與所述癌基因相鄰的MEI邊界的定量豐度包括在第一時間點獲得第一血液樣品,確定在所述第一時間點所述第一血液樣品中所述MEI邊界的定量豐度,在第二時間點獲得第二血液樣品,以及確定所述在第二時間點所述第二血液樣品中所述MEI邊界的定量豐度。在所述方法的一些方面,所述隨時間監測與所述癌基因相鄰的MEI邊界的定量豐度包括在第一時間點獲得第一組織樣品,確定在所述第一時間點所述第一組織樣品中所述MEI邊界的定量豐度,在第二時間點獲得第二組織樣品,以及確定在所述第二時間點所述第二組織樣品中所述MEI邊界的定量豐度。在所述方法的一些方面,所述第一組織樣品和所述第二組織樣品包含腫瘤組織。所述方法的一些方面包括選擇應對與所述癌基因中的缺陷有關的癌症的治療。所述方法的一些方面包括如果從所述第一時間點到所述第二時間點,樣品中MEI插入位點的定量豐度增加高於閾值,則施用所述應對與所述癌基因中的缺陷有關的癌症的治療。在所述方法的一些方面,所述閾值為10%的增加。在所述方法的一些方面,所述閾值為20%的增加。在所述方法的一些方面,所述閾值為30%的增加。在所述方法的一些方面,所述閾值為50%的增加。所述方法的一些方面包括在第一時間點前施用第一劑量的所述應對與所述癌基因中的缺陷有關的癌症的治療,並且如果從所述第一時間點到所述第二時間點,樣品中MEI插入位點的定量豐度未能降低至閾值以下,則增加劑量。在所述方法的一些方面,所述閾值為所述第一時間點的量的90%。在所述方法的一些方面,所述閾值為所述第一時間點的量的80%。在所述方法的一些方面,所述閾值為所述第一時間點的量的70%。在所述方法的一些方面,所述閾值為所述第一時間點的量的60%。在所述方法的一些方面,所述閾值為所述第一時間點的量的50%。在所述方法的一些方面,所述閾值為所述第一時間點的量的10%。在所述方法的一些方面,所述治療包括化療。在所述方法的一些方面,所述治療包括放療。在所述方法的一些方面,所述治療包括針對與MEI插入相鄰的序列中的缺陷的藥物。在所述方法的一些方面,所述治療包括針對由與MEI插入位點相鄰的序列編碼的蛋白質參與的途徑的誤調節的藥物。在所述方法的一些方面,所述治療包括特異性結合MEI插入接合點(junction)的核酸。在所述方法的一些方面,所述核酸包括piRNA。在所述方法的一些方面,所述核酸包括siRNA。在所述方法的一些方面,所述核酸包括CRISPR核酸。在所述方法的一些方面,所述核酸引導MEI插入邊界的甲基化。
一些實施方案涉及用於癌組織的體內可視化的組合物,該組合物包含與檢測元件偶聯的、跨越與癌基因相鄰的MEI邊界的核酸探針。在所述組合物的一些方面,所述檢測元件包含螢光團。在所述組合物的一些方面,所述檢測元件包含光可激發的部分。在所述組合物的一些方面,所述探針穿過細胞膜。在所述組合物的一些方面,所述探針穿過細胞核膜。在所述組合物的一些方面,探針螢光依賴於探針與包含與癌基因相鄰的MEI邊界的靶核酸序列的結合。在所述組合物的一些方面,所述探針通過手持螢光團激發裝置可視化。
一些實施方案涉及用於監測基因組老化的方法,該方法包括以下步驟:在第一時間段定量測量第一核酸樣品中MEI插入位點的數目,在第一時間段定量測量第一核酸樣品中MEI插入位點的數目,以及將MEI插入邊界的增加與基因組老化的增加相關聯。在所述方法的一些方面,MEI插入位點數目的10%的增加表明基因組老化。在所述方法的一些方面,MEI插入位點數目的20%的增加表明基因組老化。在所述方法的一些方面,MEI插入位點數目的30%的增加表明基因組老化。在所述方法的一些方面,MEI插入位點數目的50%的增加表明基因組老化。所述方法的一些方面包括如果表明基因組老化,則推薦抗老化方案。在所述方法的一些方面,該抗老化方案包括卡路裡限制。在所述方法的一些方面,該抗老化方案包括NTHE的施用。在所述方法的一些方面,該抗老化方案包括DNA甲基化酶的施用。在所述方法的一些方面,該抗老化方案包括小調節eRNA的施用。在所述方法的一些方面,該抗老化方案包括逆轉錄酶抑制劑的施用。在所述方法的一些方面,該抗老化方案包括逆轉錄病毒抑制劑的施用。在所述方法的一些方面,該抗老化方案包括HIV抑制劑的施用。在所述方法的一些方面,該抗老化方案包括AZT的施用。在所述方法的一些方面,該抗老化方案包括HBV抑制劑的施用。在所述方法的一些方面,該抗老化方案包括三氮唑核苷(ribavirin)的施用。在所述方法的一些方面,該抗老化方案包括轉座酶抑制劑的施用。
一些實施方案涉及比較第一核酸樣品與第二核酸樣品的方法,該方法包括以下步驟:獲得所述第一核酸樣品的多個MEI邊界的可動因子插入(MEI)邊界序列,分析所述第二核酸樣品中是否存在所述多個MEI邊界,以及如果所述第二核酸樣品缺少在所述第一核酸樣品中存在的MEI邊界序列,則將所述第二核酸樣品鑑定為與所述第一核酸樣品不同。所述方法的一些方面包括如果所述第二核酸樣品包含在所述第一核酸樣品中不存在的MEI邊界序列,則將所述第二核酸樣品鑑定為與所述第一核酸樣品不同。在所述方法的一些方面,獲得所述第一核酸樣品的多個MEI邊界的可動因子插入(MEI)邊界序列包括進行所述第一核酸樣品的全基因組測序。在所述方法的一些方面,獲得所述第一核酸樣品的多個MEI邊界的可動因子插入(MEI)邊界序列包括對所述第一核酸樣品的多個MEI邊界進行靶向測序。在所述方法的一些方面,分析所述第二核酸樣品中是否存在所述多個MEI邊界包括進行所述第二核酸樣品的全基因組測序。在所述方法的一些方面,分析所述第二核酸樣品中是否存在所述多個MEI邊界包括進行對所述第二核酸樣品的多個MEI邊界進行靶向測序。在所述方法的一些方面,對所述第二核酸樣品的多個MEI邊界進行靶向測序包括使所述第二核酸樣品與引物組接觸,該引物組包含特異性擴增所述第一核酸樣品的每個MEI插入位點的引物。在所述方法的一些方面,對所述第二核酸樣品的多個MEI邊界進行靶向測序包括使所述第二核酸樣品與探針組接觸,該探針組包含與所述第一核酸樣品的每個MEI插入位點特異性退火的探針。在所述方法的一些方面,所述探針組包含至少一種與螢光團結合的探針,使得與底物結合的探針相對於未與底物結合的探針可被差異性地可視化。在所述方法的一些方面,所述第二樣品包括法醫樣品。在所述方法的一些方面,所述第二樣品包括植物樣品。在所述方法的一些方面,所述植物樣品是植物作物樣品。在所述方法的一些方面,所述第二樣品包含生物危害性物質。
一些實施方案涉及用於在延緩年齡相關的基因組退化中使用的組合物,該組合物包含可動因子插入抑制藥物。在所述組合物的一些方面,所述組合物包含逆轉錄酶抑制劑。在所述組合物的一些方面,所述組合物包含逆轉錄病毒抑制劑。
附圖說明
本發明的新穎特徵在所附的權利要求書中具體闡述。通過參考以下對利用本發明原理的說明性實施方案加以闡述的詳細描述以及附圖,將會獲得對本發明的特徵和優點的更好的理解,在這些附圖中:
圖1示出了使用靶向測序來探測和/或檢測複雜變體。
圖2顯示了使用冗餘度和標籤來確認和/或定量插入事件。
具體實施方式
可動因子插入(MEI)也被稱為轉座因子,其佔人類基因組的三分之二。存在數百種由於古老MEI活性而進化的人類基因。一些MEI在人類基因組中仍具有活性,包括現代Alu序列。神經元細胞具有高MEI活性,並且病毒MEI的效應在全基因組範圍內在癌症中發揮作用。MEI隨機無偏倚地出現在基因組的蛋白質編碼區和非編碼區二者中。MEI影響人類宿主轉錄和細胞活性,因此在破壞宿主基因的功能時是非常有害的。針對這些有害事件的種系傳遞會發生強陰性選擇。MEI與癌症及其他遺傳病症有關,但體細胞MEI的規模和範圍尚未得到很好的研究或證明。新的DNA測序技術正在難以解釋該作用,因為,例如,樣品製備和分析方法缺乏對活性MEI在疾病中的作用進行定量的必要靈敏度。由於有偏倚的擴增,許多這樣的方法錯報了MEI的活性。用於準確檢測MEI的方法需要能夠確定被體細胞MEI影響的關鍵基因並定量其隨疾病進展的活性。用於檢測和定量關鍵基因功能破壞的一種非侵入性試驗是細胞健康的通用試驗,並且已經涉及成年發作疾病的幾乎所有領域。
可動DNA因子是進化和遺傳病的主要驅動力。可動因子佔人類基因組的近三分之二。MEI的主要類型包括但不限於Alu、LINE、SVA、I型逆轉錄轉座子、ERV(內源性逆轉錄病毒),並且它們被統稱為Mobilome。
下一代測序技術增加了我們對MEI在人類基因組中的普遍性的了解。Alu、SINE和SVA因子現今在人類基因組中具有活性。MEI的特定家族在其插入位點處具有共同的序列特徵,由此允許產生合成寡核苷酸來探詢這些插入事件的診斷性序列。對遺傳的MEI的分析及其在1000個基因組計劃的可公開獲得的數據內的群體頻率表明,在研究群體中發現的幾乎所有MEI都被認為是罕見的並且以小於10%的頻率出現。大多數遺傳的MEI都不編碼蛋白質編碼,表明MEI對基因功能具有高度破壞性,因此通過自然選擇而被去除。特別地,體細胞MEI是組織特異性的。例如,Alu和SVA MEI是常見的腫瘤特異性事件,特別是在上皮癌中,但不太可能在血液或腦癌中發現。這表明對MEI活性的環境效應。應激誘導的MEI活性的進一步證據來自於許多轉座因子具有與熱休克TF結合位點相似的啟動子序列這一事實。ME的激活與甲基化的減少之間存在相關性,已經提出這是MEI活性的控制機理。體細胞MEI活性在胚胎發生、腫瘤細胞系和神經元祖細胞中是豐富的,但關於MEI在正常體細胞組織中的活性是鮮為人知的。
數十年來癌症研究的一種主要材料(staple)——HeLa細胞系,具有在c-Myc基因上遊的HPV插入位點,這可能是無限細胞分裂的原因。
MEI可以通過破壞開放閱讀框或通過在人類基因中提供選擇性剪接位點、備選的啟動子位點或備選的polyA信號來改變人的轉錄。根據2001年的人類基因組草圖,許多人驚訝於人類基因組僅編碼約20,000個基因,特別是相比於>100,000種翻譯的蛋白質。現在認為MEI通過引入新的剪接位點(例如,L1、Alu)而與此現象關聯。大多數Alu衍生的基因被選擇性地剪接,並且許多選擇性剪接是組織特異性的。大多數人類基因利用選擇性剪接位點,受到基因的備選末端的MEI加工的影響。例如,ATRN基因在內含子中具有L1因子。選擇性剪接的基因編碼可溶形式的引蛋白(Attractin),這是炎症應答的一部分。該備選形式充當色素沉著和能量代謝的受體。超過120種逆轉錄轉座子序列已進化成功能性的人類基因。對於Alu、L1和SVA因子,估計的從頭種系MEI突變的比例分別為20個初生兒中1例到100個中1例到1000個中1例。DNA甲基化被證明是宿主防禦機制,缺少甲基轉移酶的小鼠表現出高的染色體不穩定性,最終變為災難性的。小RNA也是MEI活性和作用的調節機制。這些小RNA(包括piRNA和siRNA的類別)也是MEI衍生的。MEI對轉錄的影響可以通過選擇性剪接、備選的啟動子或備選的polyA位點而在單個基因座處。在整體水平上,轉錄網絡由MEI啟動子活性控制。胚胎幹細胞顯示出基因網絡的連接。ES細胞顯示出內源性逆轉錄病毒長串聯重複序列的網絡,該內源性逆轉錄病毒長串聯重複序列引發通過甲基化控制的基因表達的網絡。在多能性狀態下,ERV被甲基化阻抑。哺乳動物妊娠途徑通過MEI活性進化。該基因網絡在孕酮應答中被MER20因子激活。例如,催乳素啟動子來源於MER39可動因子。用於胎兒-母體交換的合胞素(Synctin)基因也來源於ERV基因。ERV的側翼為約300至約1200個核苷酸的LTR。對於更常見的因子,許多MEI的大小可以在例如約200bp至約10kb的範圍內。
ME掃描可從人類基因組中最具活性的常見MEI——AluYb8/9因子中鑑定遺傳的MEI。然而該方法在本質上不是定量的。當研究比較非洲與歐洲人群時,這些Alu因子模擬SNP的多樣性特徵。Alu拷貝在數量上遠超過人類基因組中的編碼基因,並且據估計,由於在腫瘤和衰老細胞中發生MEI活性的脫阻抑,體細胞MEI事件在數量上遠超過種系事件。這些因子的豐度和重複性質對此時的全基因組研究造成了問題。測序深度越大,檢測MEI的靈敏度越高,但在文庫製備步驟期間,可能由於嵌合分子的產生而引起假陽性,並且由於在諸如PCR等過程中的偏倚,某些因子可能被過度表示。
儘管上述實例示出了遺傳的MEI的作用、其破壞性作用和陰性選擇,但對體細胞MEI的普遍性也有了更多的了解。MEI的鑲嵌性在神經元細胞中是豐富的。神經元具有水平升高的非整倍性和逆轉錄轉座,這可能有助於人腦中的功能多樣性。
有證據暗示,體細胞組織中MEI的活化對老化有影響。在正常老化過程中,體細胞MEI轉錄開始變得活化。這些因子的活化逆轉錄轉座在小鼠的晚期衰老中發生,這對應於隨細胞年齡升高的基因組不穩定性。MEI位置和豐度調節衰老的速率,並且缺乏維持複雜DNA結構的能力導致組織的功能紊亂以及生物體的最終死亡。這些轉座事件可以被多種應激相關因素如炎症加速。在一些情況下,逆轉錄轉座通過逆轉錄酶的抑制如用於B肝病毒(HBV)和人類免疫缺陷病毒(HIV)感染的藥物來介導。小鼠中自然發生的癌症具有增加的MEI活性。
由於癌症被認為是基因組的疾病,因此癌症是並且將很可能繼續是最流行的體細胞MEI研究領域。可採用高覆蓋度全基因組測序(WGS)分析HBV整合事件的影響及其在肝細胞癌(HCC)中的作用。從技術角度來看,由於插入事件的數目與測序的深度成正比,因此測序深度增加會導致許多更加確定的體細胞插入事件。與來自相同個體的正常樣品相比,肝細胞癌(HCC)腫瘤中的克隆擴充導致更高頻率的相同事件。平均來說,在腫瘤來源的DNA中,對於宿主人類基因組的每個拷貝均可發現病毒基因組的兩個拷貝。在插入位點附近發現了破壞性事件,包括直接的基因破壞、病毒啟動子驅動的人類基因轉錄、病毒-人類轉錄物融合以及DNA拷貝數變化。有證據支持插入事件的隨機模型,提示插入大多數是隨機的,其中可能僅有的影響是未束縛在染色質中的DNA的可接近性。由於擴增的偏倚,先前基於PCR的方法通常過高地估計了某些插入事件的普遍性。整合廣泛存在於整個腫瘤和正常肝組織中,但由於功能性影響限於腫瘤細胞的腫瘤抑制基因和癌基因在腫瘤中的插入事件存在不同模式,並且豐度是這些細胞的克隆擴充的結果。插入「端」映射(map)至HBV基因組的不同區域,這可用於插入位點的檢測目的。例如,DR1和DR2位點是在HBV線性病毒的HBx基因的末端處發現的直接重複元件。隨機模型顯示,來自轉錄物的融合產物可映射至基因組中的任何位置,因此在插入點存在來自病毒的共同位點和來自人類基因組的無偏倚位點。
大多數HBV插入位點不是頻繁發生的,但經歷克隆擴充的腫瘤中的主要插入位點的豐度顯著升高。腫瘤中的大多數事件出現在蛋白質編碼基因附近,提示未在染色質中的暴露的DNA使其易於插入。腫瘤中的插入事件存在對於啟動子和外顯子的陽性選擇。在癌基因普查資料庫中,大多數插入可能似乎是中性的,不插入基因中。腫瘤中整合位點的數目可能與結果或其他醫療指標如存活率對應。例如,具有>3個插入事件的腫瘤可能對存活具有更大的負面影響。
可以使用來自各種癌症類型的腫瘤的RNA-Seq數據來研究宿主/病毒融合,特別是已知的致癌病毒。例如,可將NGS RNA-Seq讀序映射至HPV、HBV、HCV、EBV和HHV的常見病毒株以觀察其對宮頸癌、肝癌和伯基特淋巴瘤的影響。使用從頭組裝,可以重新診斷具有新型HPV株的陰性宮頸癌腫瘤。PCR測定可能錯報HPV整合的豐度。不論涉及的腫瘤類型或組織如何,HPV陽性整合均可顯示出腫瘤聚類(clustering)。病毒MEI可通過病毒癌基因的表達或通過整合從而改變癌基因或腫瘤抑制基因的活性來引起細胞轉化。
為了MEI檢測的臨床應用及其診斷意義,必須採用靶向策略。MEI是鑲嵌性的,由某種形式的環境因素如應激誘導的MEI活性或病毒誘導的MEI活性引起。已證明,MEI對進化有顯著的影響,並且當其在基因組的功能區中被發現時具有非常有害的影響。SNP的遺傳模式模型以及對體細胞MEI的影響是一個剛剛開始被解開的謎。觀察插入位點以及定量其在所有組織類型(可能使用血液或血液中的無細胞DNA作為替代品)中的豐度的能力是用於確定細胞健康的有用工具。這些活躍可動的或侵入性的基因組因子的靶標可用於診斷目的,以及通過小RNA、甲基化或甚至對逆轉錄酶抑制對特定個體的合理治療幹預。了解這些因子對個體以及特別是個體疾病的影響將能夠提供新的治療和診斷選擇。例如,引起癌症的MEI事件擾亂癌基因或腫瘤抑制基因。使用在活組織內通過各種手段激活的螢光探針來靶向用於在手術中提取的那些細胞。跨越可動因子與其擾亂的人類宿主基因序列的接合點、僅對特定接合事件具有結合效率的探針將為手術中的提取提供標誌物或信標。
MEI的起源可能是非人類的,其隨時間進化或通過病毒感染而引入。從病毒的角度來看,其主要目的是存活。由感染、炎症、毒素如酒精、物理壓力、潰瘍等誘導的細胞應激全都影響細胞的存活,因此使MEI活性增加。活性MEI的失調(Deregulation)可能只是偶然地發生。然後活性MEI使染色體重排或改變細胞轉錄。這些影響可能是溫和的或災難性的。一個細胞變得脫阻抑,並最終克隆擴充。被活性MEI破壞的基因決定擴充的速率。如果細胞生長基因或調節基因被破壞,則其分裂速率上升,導致腫瘤生長。相反,非癌症相關基因也可被擾亂,並且激活/滅活關鍵的細胞機制(例如,凋亡、壞死、增殖、細胞分裂)。例如,如果凋亡途徑被滅活,則細胞可能繼續分裂,增加在器官中的普遍性,並開始負面地影響器官功能。最終,這可導致功能喪失。被擾亂的基因以及插入事件的數目均可充當細胞健康或疾病進展的診斷性指標。在一些情況下,這些細胞中的一些可能死亡,並且來自這些細胞的DNA將會以無細胞DNA的形式在血液中被發現。採用具有足以檢測這些罕見事件的靈敏度以及足以定量這些罕見事件的精確度的技術監測這些無細胞分子的增加將是分子醫學的主要研究內容。從早期基線開始的事件的數目以及其擾亂的基因都可以將全部人類器官的細胞功能分類並監測個體在其一生中的細胞健康。這些診斷試驗可能導致受MEI擾亂影響的幾乎所有成人發作疾病和病症的早期檢測和預防。大腦中體細胞活性的增加可導致癌症、神經變性病症如阿爾茨海默病或帕金森病,或其他病症如孤獨症。MEI既含有遺傳的組分也含有體細胞活性。它們之間的關係可以解釋這些病症中的許多病症的遺傳力缺失以及應激或環境誘導的這些因子的激活。這可能是這些複雜病症的合理解釋。
MEI代表了我們DNA中僅有的真正個體基因組標誌物。對於攜帶幾乎相同DNA的雙胞胎,由於錯誤率,使用目前的測序儀無法檢測出絕對差異。相反,尋找MEI譜可以確定在兩個幾乎相同的基因組(例如,雙胞胎)之間的致病的基因組差異。此外,MEI的真正獨特的遺傳組成構成僅有的真正獨特的法醫鑑定標誌物。最簡單的實例是密切相關的個體或雙胞胎的MEI。MEI與傳統SNP檢測或微衛星標誌物相結合能夠確定地排除甚至最接近的基因組序列。
隨著產生的關於個人基因組的序列信息的量增加以及公開共享該信息的意願增加,偽造基因組身份的能力必定成為現實。在一些情況下,對用於PCR分析的引物具有更好結合親和力的合成DNA序列從通過公共領域、研究領域或者甚至通過基因檢測公司的網絡安全性缺乏而獲得的個體序列數據生成。個體的血液中摻有這些高度有效的DNA序列不大可能對個體的健康造成影響,或者如果造成了影響,那些個體也可能願意接受這種風險。當抽取血液用於DNA檢測時,這些更加有效的分子可能混淆或徹底掩蓋個體的身份或甚至將該樣品表示為另一個個體。MEI,特別是最近作為體細胞MEI有活性的那些MEI,將呈現一種完全獨特的鑑定策略,由於這些體細胞事件在基因組中的位置以及這樣的事件在複雜背景中的量,在一些情況下使用該策略作為基因組鑑定。
這些法醫目的還可在農業中用於檢測GMO作物。來自GMO農場的種子可輕易地傳播至相鄰的農場。許多農業公司檢測在相鄰農場中的這些轉座的因子,以確定其不希望的智慧財產權轉移的程度。以極高靈敏度定量這些診斷標誌物的方法將允許檢測和定量已被其產物汙染的生物體的百分比的能力。PCR方法以及其他偏倚策略不提供這一水平的靈敏度。
MEI也可對化妝品工業具有重大的影響。由於MEI激活與細胞老化有關,因此其代表了一種用於研究和確定皺紋或脫髮的原因的獨特方法。MEI可以是遺傳的、體細胞激活的或病毒誘導的。全都導致基因組及其功能的破壞。確定被擾亂的基因代表了用於降低或消除其活性的治療和美容幹預的新目標。監測MEI活性的速率和水平可以是通過自然手段如卡路裡限制或通過增加藥理幹預劑量進行幹預的信號。
如本文公開的,從早期MEI活性基線開始的監測細胞健康的試驗是針對所有個體的常見檢測選擇。
在本文的整個說明書中,為了便於理解,本公開內容被分成多個部分。應理解,這些劃分是為了方便理解,而並不一定限制說明書的一些部分相對於彼此的適用性。因此,說明書的任何一個部分中的公開內容在一些情況下不僅與該部分有關,而且與其他部分有關,並且在一些情況下與作為整體的公開內容有關。
用於體細胞MEI檢測和定量的方法
當前用於MEI檢測的全基因組方法包括全基因組測序和生物信息學分析。MEI事件導致「分離讀序(split-reads)」,其中序列的一部分映射至人類參考基因組而另一部分未恰當地映射。配雙或配對端讀序提供了使用一個讀序的全部或一部分來錨定DNA分子的未映射或連接部分的位置的能力。大規模平行測序通過更多的採樣允許冗餘的探詢和置信水平增加。然而,該增加的採樣導致成本急劇增加。更深的測序深度與MEI檢測的靈敏度成比例。全基因組測序(WGS)方法造成了成本增加以及不想要的數據和倫理考慮方面的問題,但在一些情況下具有無偏倚檢測整個樣品中的MEI插入位點的優勢。在一些情況下,這些方法引入序列特異性擴增偏倚,這將抑制定量一些MEI事件的能力,該能力對確定中性MEI與致病MEI之間的差異是關鍵的。
針對MEI的一些先前的靶向方法通常涉及半特異性PCR的變化形式。如先前討論的,由於序列特異性偏倚,這些方法在一些情況下不是定量的,由於序列擴增效率而極大地過度呈現一些MEI位置相對於其他位置的量。無法確定體細胞MEI事件是否為中性的,因此無法確定該事件是否是隨機呈現的,或者無法確定其是否已在諸如癌症中克隆擴充。此外,對於MEI的插入端,基因座特異性引物的設計的靈活性有限。如果序列發生突變或差異足以導致不發生擴增或導致不那麼有效的擴增,則對該特異性事件的量進行定量是不可能的。因此在使用這些方法時必須小心,以確保序列結果定量地反映原始核酸樣品中的模板量。
由於MEI的插入端通常是重複或改變的,因此一些適當的靶向體細胞MEI檢測方法能夠提供冗餘度。活性體細胞MEI是現代的,與古老的無活性MEI相比不大可能被截短,但就診斷性序列而言,活性體細胞MEI可以是突變或最小化的。因此,針對MEI的插入端,如TSR或在HBV的情況下在Hbx基因附近的DR 1/2診斷區域,設計了多個冗餘的基因座特異性引物。這些多個不同的起始點還允許MEI的確認,因為MEI事件的多次獨立採樣允許事件的內部確認以及更高的靈敏度和特異性。此外,應該對NGS文庫分子產生天然標籤或替代的3'端。由於NGS文庫分子的替代3'端引起的冗餘引物位點與天然標籤的組合顯示了DNA模板的獨立採樣,從而保證了任何局部性的插入事件均可通過在擴增步驟期間去除克隆矯作物(artifact)而得到確認和定量。此外,這樣的方法需要在製備過程中避免片段化和連接,因為嵌合分子可在這些製備步驟中產生並導致假陽性。
本文設想了其他定量方法,並且本文公開的與MEI位點有關的方法不受任一種定量方法的限制。各種方法在本文中均作為替代方案呈現,突出了其各自呈現的挑戰和優勢,以及為了使每種方法均適用於本文公開的方法而將要採取的防範措施。
本文公開內容的各個實施方案包括一個或多個MEI事件相對於其插入相鄰的基因組序列的定量。定量通過多種方法實現。MEI,有時被稱為MEI及其插入相鄰的基因組序列,最初通過非靶向方法中的全基因組測序,或通過特異性或半特異性PCR或本領域已知的其他方法來鑑定。在一些實施方案中,使用了TAIL-PCR或本領域中已知用於確定插入相鄰序列的其他方法。在許多實施方案中,對於映射至插入相鄰邊界的初始MEI,全基因組測序或其他非靶向方法是優選的。在後續測定中,在一些實施方案中使用了全基因組方法,而針對特異性MEI和插入相鄰序列的靶向測定在備選的後續測定中使用或與全基因組測定組合使用。
核酸樣品中MEI插入相鄰序列接合點的豐度的定量通過多種備選或協調的方法實現。通過將跨越給定MEI及其插入相鄰序列的讀序的數目或獨特讀序的數目或獨立衍生的讀序的數目與以下任一項或多項進行比較來定量特異性MEI插入邊界:樣品中核酸的量;映射至核酸樣品中的已知單拷貝序列的讀序的數目或獨特讀序的數目或獨立衍生的讀序的數目,映射至單獨MEI及其插入相鄰序列的讀序的數目或獨特讀序的數目或獨立衍生的讀序的數目;或在不同時間點映射至相同MEI及其插入相鄰序列的讀序的數目或獨特讀序的數目或獨立衍生的讀序的數目。在一些情況下,通過相對於輸入核酸的總量測量跨越其插入位點的獨立讀序的數目來定量特異性MEI插入位點。在一些情況下,通過相對於映射至核酸樣品的已知獨特基因座的獨立讀序的數目測量跨越其插入位點的獨立讀序的數目來定量特異性MEI插入位點。在一些情況下,通過相對於映射至已知拷貝數的多拷貝基因座的獨立讀序的數目測量跨越其插入位點的獨立讀序的數目來定量特異性MEI插入位點。在一些情況下,通過相對於來自第二時間點的樣品的跨越其插入位點的獨立讀序的數目測量來自第一時間點的樣品的跨越其插入位點的獨立讀序的數目來定量特異性MEI插入位點。組合地或作為替代方案考慮備選的定量方法,如通過與具有可定量的螢光水平的螢光探針雜交而定量。
圖2呈現了用於MEI插入位點定量的多個獨立讀序的實例。每個讀序均包含MEI和插入相鄰序列,並且每個讀序均具有5』端、3』端和插入長度的獨特組合。因此,每個讀序均可被鑑定,並且是MEI和插入相鄰序列而不是克隆擴增的PCR產物的獨立表示。
設計
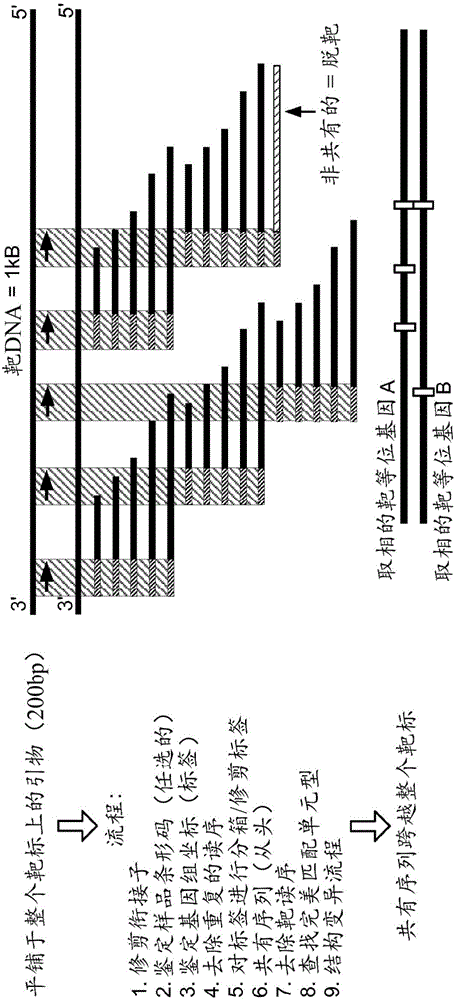
每個MEI家族均在MEI的插入端具有相似的序列。例如,在Alus中,重複序列的側翼可以有7bp診斷性序列。末端的長度可以變化,並且/或者可具有一些重複序列。在Alu序列中,還可以有polyA序列的延伸。可以部分地靶向polyA序列。還可以靶向具有序列同源性的直接重複區,如DR1和DR2。使用更長的讀取長度(例如,MiSeq 2x350讀序)、用於配對末端測序的更長插入片段(例如,500bp插入片段)以及由於ddNTP摻入引起的可控的片段長度,可為可動因子的DR1和DR2區的每條鏈設計多種引物。例如,為了靶向可動因子(例如,Alus、LINE、SVA、病毒MEI等)的每個末端處的1kb區域,可設計多個非重疊引物,以從最末端(接近末端重複序列)跨越通過更加複雜的序列,從而提供更高的特異性。在一些情況下,對於MEI的每個側翼元件,可以使用至少約三種引物。與PCR不同,由於使用鏈置換聚合酶的線性引物延伸,多個引發位點將不會互相干擾。因子的每個家族均可具有足夠的序列差異,以通過生成的合成序列經由測序立即鑑定因子類型。可鑑定每個因子家族內的多種引物,並將其分箱(bin)在一起以供自組裝。在一些情況下,讀序可以以足夠的確定性進行映射,以確定是否存在關鍵基因的中斷。然後可通過簡單地比較從嵌合分子產生的非MEI序列,使用相同MEI的多種引物作為相同MEI破壞事件的獨立確認。隨著多個引發事件(例如,每個MEI約3個至約10個),每一種引物將從基因組的多個拷貝產生相同事件的多個拷貝。天然標籤和3'合成標籤可用來確定模板的獨立採樣,並進一步確認該事件。有趣的是,相同的方法可用來確定事件的相對年齡。更加古老的MEI事件傾向於在MEI序列自身內具有截短的末端或突變,並且這些事件因為缺乏剪切和粘貼或拷貝和粘貼活性所需的插入序列而通常被顯示為無活性的。
本公開內容還提供了用於檢測遺傳疾病中的MEI的方法。在全長MEI的存在下,可使用其他的數據來源進一步確定MEI是否是體細胞的或是否仍然具有活性。通常,截短事件可以表明無活性的MEI,該MEI可能是遺傳的並且可能在大部分分子中找到。另一方面,在較小百分比的分子中發現新的體細胞MEI活性(可以是細胞老化的指示),這是需要極深的序列深度的原因。通過反算,體細胞活性的比率為25次細胞分裂中接近約一次。在雜合的群體中,這相當於來自給定組織或活檢物的50個DNA分子中約一個。對於50分之一的事件,在每個個體事件三個讀序的情況下,需要150x的測序深度。鑑於潛在的高異質性和其中許多是單例(singleton)事件的事實,可能需要提供平均至少1000倍的覆蓋來分析腫瘤,並且相比於分析古老MEI如Alus的內源活性的覆蓋或許甚至更高(例如,約1百萬倍的覆蓋)。
其他的數據來源來自其擾亂的一個或多個基因,並且如果事件是克隆擴增的,其還來自事件的數目。例如,病毒如HPV或HBV將會自身隨機地插入到基因組的許多區域。這是導致每個個體事件中同等水平的標準化覆蓋的隨機事件。如果該事件命中細胞生長基因(例如,癌基因或腫瘤抑制基因),則可以觀察到那些細胞類型的克隆擴充。因此與背景單例(singleton)或雙例(doubleton)體細胞事件的數目相比,特定MEI事件的數目充當疾病診斷的指示。對於單細胞工作,如已經在腫瘤中顯示的,相同細胞中的多個事件可以是結果的指示。由於每個腫瘤可具有受感染的但非腫瘤的細胞的集合,因此甚至觀察異質腫瘤也可以提供另一水平的數據。背景事件與引起腫瘤的事件的比例可通過對每個事件中的測序深度覆蓋取平均值來計算。例如,3倍或更大的增加將是引起腫瘤的事件相對於良性事件的截止值。這可用作治療期間血液中特定腫瘤的監測目標,或用於確定疾病進展,或作為探針(跨越該事件)用於在手術期間提取以保證腫瘤的去除是完全的。例如,在肝細胞中HBV感染的情況下,可利用針對HBV序列的特異性引物,使用靶向接近線性病毒中Hbx基因的DR1或DR2區的插入末端的3種不同引物來鑑定所有讀序。通過計算來自三種引物(其從基因組中的給定位置產生數據)中的每一種的平均覆蓋深度,並將給定事件的平均深度與其他隨機插入事件的平均深度進行比較,可將更高平均覆蓋的事件突出顯示為可導致克隆擴充的主要插入位點。在一些實例中,給定事件的平均深度可以是其他隨機插入事件的平均深度的超過約1.2倍、約1.4倍、約1.6倍、約1.8倍、約2倍、約3倍、約4倍、約5倍、約10倍、約20倍、約50倍或約100倍。可使用三種不同引物從更加有效的序列(例如,較低GC含量的區域)中去除擴增矯作物。可使用天然和隨機合成的標籤去除任一事件的克隆擴增。總的來說,可以存在多種用於確認和定量每個事件的信息來源。
本公開內容可提供一種包含分子文庫的組合物,其中每個分子均代表MEI事件。該文庫可以為多重(multiplex)的形式。
本公開內容可進一步提供一種用於測試所有已知致癌病毒和/或在種系中傳代的所有已知活性ALU及MEI的方法。該方法可用於諸如癌基因破壞、細胞老化、每個組織特異性MEI事件中關鍵基因的破壞(例如,老化大腦中的阿爾茨海默症)和/或針對細胞健康和老化的測試等應用。
本公開內容提供了一種從已知插入位點序列生成基因組中的未知序列的方法。可使用該未知序列確定基因的破壞。可使用來自讀序的合成引物序列確定經測序的MEI類型,可使用基因組序列鑑定被破壞的基因,並且可使用天然和合成的標籤確定每個事件的定量數量。因此,事件的位置和豐度以及總活性(事件的總數)均可在成年發作的疾病和細胞健康中具有診斷或預後意義。
針對插入區域的引物設計出現在MEI的5'或3'插入位點處的已知診斷性序列中。通過分解成20、50、100個鹼基對的窗口,考慮TM、簡併位置和重複位置,設計了獨特或有些獨特的引物序列。由於設計了從插入端開始的多種引物,因此引物設計是冗餘的。開發、合成並以等摩爾比合併了針對所有已知MEI病毒性和內源性MEI序列設計的單引物文庫。
引物在與所使用的測序平臺的銜接子互補物(compliment)對應的5'端包含分子「尾」。在一些情況下,為了樣品多重化在合成步驟中包含任選的分子條形碼。
引物延伸通過在均勻溫度下使用鏈置換聚合酶或通過使用熱穩定聚合酶以及使引物延伸反應循環而發生。該聚合酶必須具有在摻入修飾的鹼基或具有缺少羥基的末端3'端的鹼基的同時進行延伸的能力。
在反應混合物中使用天然dNTP和生物素化的ddNTP的組合。ddNTP與天然dNTP之比決定了延伸分子的片段長度。例如,使用1%比例的ddNTP將產生1/100的在任何給定鹼基處摻入終止分子的機率。通常的結果顯示,1%的ddNTP比例產生約500bp的片段峰。這可能是因為天然NTP相對於改變的NTP的摻入效率差異。
所得到的分子是嵌合體,其由在5'端的合成序列和在3'端的來源於患者的序列組成。該分子以終止的、生物素化的核苷酸結束。
通過使用親和反應,從基因組背景中純化所述分子。該步驟使用鏈黴親和素塗覆的磁珠。珠子上的每個鏈黴親和素分子結合四個生物素化的分子,而剩餘的ddNTP、dNTP和未使用的引物被去除。
使用隨機引物進行第二引物延伸反應,該隨機引物由在3'端的8個核苷酸和與測序儀平臺對應的B-銜接子互補物組成。隨機引發在整個分子上發生,但通過使用鏈置換聚合酶,只有最遠端的隨機引物及其延伸產物將保持與鏈黴親和素珠子氫鍵結合。來自B反應的拷貝分子將一直運行通過前一條鏈上的A引物,並產生具有5'B銜接子、8bp合成隨機序列、MEI插入的人類宿主基因組序列位點、MEI基因座特異性引物的合成序列以及在3端的A銜接子互補物的單鏈分子。如果需要樣品多重化,則使這些分子從鏈黴親和素結合的分子上變性並PCR擴增以摻入全長測序儀銜接子和任選的外部條形碼。
這種嵌合讀序結構及其特徵在數據分析中具有許多優勢。使用引物的合成基因座特異性序列來確定在讀序中靶向哪個MEI。對於相同MEI種類導致不同延伸起始點的冗餘引物位點可用作插入事件的內部確認。這也避免了因基因座特異性引物不太有效或設計不當而退出(drop out)。該基因座特異性引物可用於所有已知的MEI,包括Alus、LINE以及病毒MEI。將在單個文庫中設計已知病毒的全譜,多種病毒在相同樣品中的可能性較低。有可能許多病毒引物在任何給定的樣品中將不產生數據。
3'片段化和改變的3'序列充當內部分子標籤或天然條形碼。如果兩個讀序具有不同的天然標籤(3'序列),則它們肯定是模板DNA的獨立讀出,而非克隆錯誤。
來自B銜接子反應的合成序列的隨機8bp也可充當隨機標籤。可以組合使用隨機3'序列與來自隨機8-mer的隨機標籤的組合,以進一步保證讀序是獨立的而非克隆擴增的。
在數據分析過程中,首先對來自給定MEI的讀序修剪去(trim of)銜接子序列。如果測序儀運行含有多重化的條形碼化樣品,則鑑定分子條形碼。鑑定與合成基因座特異性引物對應的前5-25個鹼基以確定被靶向的MEI事件。然後從讀序中修剪這些鹼基以供映射和組裝。將剩餘的序列相對於人類參考基因組映射並跨越重疊讀序進行組裝,以提供人類基因組中的插入位置的證據。重複讀序基於其3'端和隨機標籤而被去除。對於配對端讀序,如果未單獨地映射,則使用減小的插入大小募集第二個讀序,以針對插入位點提供重疊讀序。通過使用MiSeq系統,採用300bp的插入大小(優先於ILMN聚類產生),生成了約400-500bp的累積序列以供位置映射。在去除全部克隆讀序後,對每個位置定量事件的位置和數目。
因此,本文公開了與可動因子插入(MEI)插入位點序列和可動因子活性有關的方法、組合物及使用方法,例如其涉及人類健康。可將人類可動因子分類為DNA轉座子或逆轉錄轉座子。DNA轉座子通過剪切-粘貼機制移動。逆轉錄轉座子通過經由RNA中間體的拷貝-粘貼機制(被稱為逆轉錄轉座的過程)調動。
與人類疾病有關的可動因子是本領域已知的。示例性的可動因子包括但不限於L1、Alu、SINE-R/VNTR/Alu(SVA)、經加工的假基因和人類內源性逆轉錄病毒(HERV)。位於蛋白質編碼基因座的5』側的逆轉錄轉座子常常充當備選啟動子。例如,如通過帽分析基因表達和焦磷酸測序所評價的,位於基因的3』UTR(非翻譯區)中的逆轉錄轉座子顯示出降低相應基因表達的有力證據。已知逆轉錄轉座子的低甲基化影響該逆轉錄轉座子自身或附近基因的轉錄。例如,已知與MET(肝細胞生長因子受體)癌基因相關的L1中啟動子的增加的甲基化誘導攜帶腫瘤的膀胱的尿路上皮內的備選MEI轉錄物。
類似地,由於其對人類基因組序列的影響,本文設想多種構成『可動因子』的人類逆轉錄病毒。多種人類逆轉錄病毒是本領域已知的。已知逆轉錄病毒以兩種形式存在:作為其染色體DNA中的正常遺傳元件(內源性逆轉錄病毒)和作為從人到人傳播的水平傳播傳染性含RNA病毒(外源性逆轉錄病毒,例如HIV和人T細胞白血病病毒HTLV)。已知由於人類逆轉錄病毒插入導致的DNA異常變化與疾病的發作有關。插入到人DNA中的示例性人類逆轉錄病毒包括但不限於HIV1、HIV2、HTLV1、HTLV2和HSRV。
本文公開了鑑定可動因子插入(MEI)標記的細胞增殖的方法。在一些情況下,這些方法包括以下步驟:定量測量第一核酸樣品中第一MEI插入位點處的MEI水平;定量測量第二核酸樣品中第一MEI插入位點處的MEI水平;以及如果第一核酸樣品中第一MEI插入位點處的MEI水平與第二核酸樣品中第一MEI插入位點處的MEI水平顯著不同,則將所述第一MEI插入位點鑑定為標記MEI標記的細胞增殖。
在一些情況下對樣品的核酸量進行歸一化,而在備選的情況下,通過例如測量已知在健康個體中將在每個單倍體基因組以單拷貝存在的一種或多種核酸的水平來對核酸量進行歸一化。在一些情況下,當樣品的核酸豐度或核酸相對豐度或歸一化的核酸豐度相差5%、10%、15%、20%、25%、30%、35%、40%、45%、50%或大於50%時發生『顯著不同』。在一些情況下,『顯著不同』是指相差5%。在一些情況下,『顯著不同』是指相差10%。在一些情況下,『顯著不同』是指相差15%。在一些情況下,『顯著不同』是指相差20%。在一些情況下,『顯著不同』是指相差25%。在一些情況下,『顯著不同』是指相差30%。在一些情況下,『顯著不同』是指相差35%。在一些情況下,『顯著不同』是指相差40%。在一些情況下,『顯著不同』是指相差45%。在一些情況下,『顯著不同』是指相差50%。在一些情況下,『顯著不同』是指相差大於50%。
在一些情況下確定了與MEI插入位點相鄰的序列。在一些情況下使用與MEI插入位點相鄰的序列來選擇治療,例如,如果相對於其他MEI或在一個時間點相對於之前的時間點,該MEI插入與過度增殖有關。
例如,如果MEI相鄰序列與已知癌基因對應,則選擇與應對與該癌基因相關的癌症相關的治療,施用於在時間上或空間上表現出該MEI的過度增殖的個體。
多種與癌症發作有關的基因是本領域已知的。這些基因有不同名稱,包括但不限於,癌症驅動基因(driver)、癌基因、腫瘤抑制基因和腫瘤易感基因。已知這些基因的異常DNA變化有助於癌症進展。變化時與驅動癌症有關的示例性基因包括但不限於abl1、acvr1b、af4/hrx、akt1、akt-2、alk、alk/npm、aml1、aml1/mtg8、apc、ar、arid1a、arid1b、arid2、asxl1、atm、atrx、axin1、axl、b2m、bap1、bcl2、blc-3、bcl-6、bcor、bcr/abl、braf、brca1、brca2、card11、casp8、c-myc、cbl、cdc73、cdh1、cdkn2a、cebpa、cic、crebbp、crlf2、csf1r、ctnnb1、cyld、daxx、dbl、del/can、dnmt1、dnmt3a、e2a/pbx1、egfr、enl/hrx、ep300、erbB、erbB-2、erg/TLS、ets-1、ews/fli-、ezh2、fam123b、fbxw7、fgfr2、fgfr3、flt3、fms、fos、foxl2、fps、fubp1、gata1、gata2、gata3、gli、gna11、gnaq、gnas、gsp、her2/neu、h3f3a、hist1h3b、hnf1a、hras、hox11、hst、idh1、idh2、il-2、int-2、jak1、jak2、jak3、jun、kit、ks3、K-sam、kdm5c、kdm6a、kit、klf4、kras、lbc、lck、lmo1、lmo2、l-myc、lyl-1、lyt-10C alpha-1、mas、mdm-2、mos、map2k1、map3k1、med12、men1、met、mlh1、mll2、mll3、mpl、msh2、msh6、myd88、myb、myh11/cbfb、ncor1、neu、n-myc、nf1、nf2、nfe2l2、notch1、notch2、npm1、nras、ost、pax5、pbx1/e2a、pbrm1、pdgfra、phf6、pik3ca、pik3r1、pim-1、prad-1、ppp2r1a、prdm1、ptch1、pten、ptpn11、raf、rar/pml、rasH、rasN、rb1、rel/nrg、ret、rhom1、rehom2、ros、rnf43、runx1、ski、sis、set/can、srcret、setd2、setbp1、sf3b1、smad2、smad4、smarca4、smarcb1、smo、socs1、sox9、spop、srsf2、stag2、stk11、tal1、tal2、tan-1、tiam1、tsc2、trk、tet2、tnfaip3、traf7、tp53、tsc1、tshr、u2af1、vhl和wt1。例如,映射至該列表中的基因的MEI插入相鄰序列在一些情況下提示,將選擇與所述基因或與所述基因的基因產物參與的信號途徑有關的治療以併入治療方案中。
類似地,多種基因組重排被鑑定為與癌症有關。本領域已知,癌症中的基因重排主要由DNA雙鏈斷裂(DSB)引起。導致基因重排的示例性機制包括但不限於合成依賴性末端連接(SDEJ)、通過斷裂-融合-橋循環的姐妹染色單體融合導致的基因擴增、V(D)J重組活化(RAG)蛋白介導的易位以及活化誘導的胞苷脫氨酶(AID)類別轉換重組。
示例性的基因重排包括但不限於ACSL3/ETV1、ACTB/GLI1、AFF3/BCL2、AGTRAP/BRAF、AHRR/NCOA2、AKAP9/BRAF、ALK/PTPN3、ANKRD28/NUP98、ARHGAP6/PRCC、ASPSCR1/TFE3、ATIC/ALK、BACH2/BCL2L1、BCL11B/TCR、BCL2/Ig、BCOR/RARA、BCR/ABL1、BCR/FGFR1、BCR/JAK2、BCR/PDGFRA、BIRC3/MALT1、BRD3/C15orf55、BRWD3/ARHGAP2、BRWD3/ARHGAP20、C11orf95/MKL2、C15orf21/ETV1、C15orf55/BRD4、C6orf204/PDGFRB、CACNA2D4/WDR43、CANT1/ETV4、CAPRIN1/PDGFRB、CARS/ALK、CBFB/MYH11、CCDC6/PDGFRB、CCDC6/RET、CCDC88C/PDGFRB、CCND1/FSTL3、CD44/SLC1A2、CD74/ROS1、CDH11/USP6、CDK5RAP2/PDGFRA、CDK6/MLL、CEP110/FGFR1、CHCHD7/PLAG1、CHIC2/ETV6、CIC/DUX4、CLTC/ALK、CLTC/TFE3、CNBP/USP6、CNTRL/KIT、COL1A1/PDGFB、COL1A1/USP6、COL1A2/PLAG1、COL6A3/CSF1、CREB3L2/PPARG、CRTC1/MAML2、DGKB/MIPOL1、EML1/ABL1、EML4/ALK、EPC1/PHF1、ERC1/PDGFRB、ESRP1/RAF1、ETV6/ABL1、ETV6/ABL2、ETV6/ACSL6、ETV6/ARNT、ETV6/BAZ2A、ETV6/CDX2、ETV6/FGFR3、ETV6/FLT3、ETV6/GOT1、ETV6/ITPR2、ETV6/JAK2、ETV6/LYN、ETV6/MDS2、ETV6/MECOM、ETV6/NKAIN2、ETV6/NTRK3、ETV6/PDGFRA、ETV6/PDGFRB、ETV6/PER1、ETV6/PRDM16、ETV6/RUNX1、ETV6/SYK,EWSR1/ATF1、EWSR1/CREB1、EWSR1/DDIT3、EWSR1/ERG、EWSR1/ETV1、EWSR1/ETV4、EWSR1/FEV、EWSR1/FLI1、EWSR1/NFATC2、EWSR1/NR4A3、EWSR1/PATZ1、EWSR1/PBX1、EWSR1/POU5F1、EWSR1/SMARCA5、EWSR1/SP3、EWSR1/WT1、EWSR1/ZNF444、EXOC2/IGH、FCHSD1/BRAF、FGFR1OP/FGFR1、FGFR1OP/FGFR1、FGFR1OP2/FGFR1、FIP1L1/PDGFRA、FIP1L1/RARA、FOXO1/PAX3、FOXP1/ABL1、FUS/ATF1、FUS/CREB3L1、FUS/CREB3L2、FUS/DDIT3、FUS/ERG、FUS/FEV、FZD6/SDC2、GAPDH/BCL6、GIT2/PDGFRB、GOLGA4/PDGFRB、GOLGA5/RET、GOPC/ROS1、HAS2/PLAG1、HELIOS/BCL11B、ERVK-17/ETV1、HIP1/PDGFRB、HIST1H4I/BCL6、HMGA1/LAMA4、HMGA2/CCNB1IP1、HMGA2/COG5、HMGA2/COX6C、HMGA2/FHIT、HMGA2/LPP、HMGA2/NFIB、HMGA2/RAD51L1、HMGA2/WIF1、HMGN2P46/ETV1、HNRNPA2B1/ETV1、HOOK3/RET、HPR/MRPS10、HSP90AA1/BCL6、HSP90AB1/BCL6、IKZF1/BCL6、IL2/DEXI、IL2/TNFRSF17、IL21R/BCL6、INPP5D/ABL1、ITK/SYK、Ig/BCL11B、Ig/BCL3、Ig/BCL6、Ig/BCL7A、Ig/CCND1、Ig/CCND3、Ig/CDKN2A、Ig/FCGR2B、Ig/FCRL4、Ig/FOXP1、Ig/IL3、Ig/KDSR、Ig/LHX4、Ig/LHX4、Ig/MUC1、Ig/MYC、Ig/PAFAH1B2、Ig/WHSC1、Ig/WWOX、JAZF1/PHF1、JAZF1/SUZ12、KIAA1549/BRAF、KIF5B/ALK、KIF5B/PDGFRA、KIF5B/RET、KLK2/ETV4、KTN1/RET、LCK/TCR、LCP1/BCL6、LEO1/SLC12A1、LIFR/PLAG1、LRRFIP1/FGFR1、LYL1/TCR、MALAT1/ACAT2、MALAT1/TFEB、MALT1/MAP4、MEF2D/DAZAP1、MIR142/MYC、MLL/ABI1、MLL/ABI2、MLL/ACACA、MLL/AFF1、MLL/AFF3、MLL/AFF4、MLL/ARHGAP26、MLL/ARHGEF12、MLL/CASC5、MLL/CASP8AP2、MLL/CBL、MLL/CREBBP、MLL/DAB2IP、MLL/EEFSEC、MLL/ELL、MLL/EP300、MLL/EPS15、MLL/FLNA、MLL/FOXO3、MLL/GAS7、MLL/GMPS、MLL/GPHN、MLL/KIAA0284、MLL/KIAA1524、MLL/LASP1、MLL/LPP、MLL/MAML2、MLL/MAPRE1、MLL/MLLT1、MLL/MLLT10、MLL/MLLT11、MLL/MLLT3、MLL/MLLT4、MLL/MLLT6、MLL/MYO1F、MLL/NCKIPSD、MLL/NEBL、MLL/PICALM、MLL/PDS5A、MLL/SACM1L、MLL/SEPT11、MLL/SEPT2、MLL/SEPT5、MLL/SEPT6、MLL/SEPT9、MLL/SH3GL1、MLL/SORBS2、MLL/TET1、MLL/ZFYVE19、MN1/ETV6、MSI2/HOXA9、MSN/ALK、MYB/GATA1、MYB/NFIB、MYC/Ig、MYC/ZBTB5、MYH9/ALK、MYO18A/FGFR1、MYST3/ASXL2、MYST3/CREBBP、MYST3/NCOA2、MYST3/NCOA3、MYST4/CREBBP、NAV2/TCF7L1、NCOA4/RET、NDE1/PDGFRB、NDRG1/ERG、NDRG1/ERG、NFKB2/INA、NFKB2/TBXAS1、NIN/PDGFRB、NONO/TFE3、NOTCH1/TCR、NPM1/ALK、NPM1/MLF1、NPM1/RARA、NSD1/ANKRD28、NUMA1/RARA、NUP214/ABL1、NUP214/DEK、NUP98/ADD3、NUP98/CCDC28A、NUP98/DDX10、NUP98/HHEX、NUP98/HMGB3、NUP98/HOXA11、NUP98/HOXA13、NUP98/HOXA9、NUP98/HOXC11、NUP98/HOXC13、NUP98/HOXD11、NUP98/HOXD13、NUP98/IQCG、NUP98/KDM5A、NUP98/LNP1、NUP98/MLL、NUP98/NSD1、NUP98/PRRX1、NUP98/PRRX2、NUP98/PSIP1、NUP98/RAP1GDS1、NUP98/SETBP1、NUP98/TOP1、NUP98/WHSC1L1、OMD/USP6、P2RY8/CRLF2、PAX3/NCOA1、PAX3/NCOA2、PAX5/AUTS2、PAX5/BRD1、PAX5/C20orf112、PAX5/DACH1、PAX5/ELN、PAX5/ETV6、PAX5/FOXP1、PAX5/HIPK1、PAX5/JAK2、PAX5/PML、PAX5/POM121、PAX5/SLCO1B3、PAX5/ZNF521、PAX8/PPARG、PCM1/JAK2、PCM1/RET、PDE4DIP/PDGFRB、PEX5/LPL、PICALM/MLLT10、PIM1/BCL6、PML/RARA、POU2AF1/BCL6、PPP2R2A/CHEK2、PRKAR1A/RARA、PRKAR1A/RET、PRKG2/PDGFRB、PVRL2/TCR、RABEP1/PDGFRB、RANBP17/TCR、RANBP2/ALK、RBM15/MKL1、RBM6/CSF1R、RCSD1/ABL1、RNF213/ALK、RPN1/MECOM、RUNX1/AFF3、RUNX1/CBFA2T3、RUNX1/CLCA2、RUNX1/LPXN、RUNX1/MACROD1、RUNX1/RUNX1T1、RUNX1/SH3D19、RUNX1/TRPS1、RUNX1/USP42、RUNX1/YTHDF2、RUNX1/ZNF687、RYK/ATP5O、SEC31A/ALK、SEC31A/JAK2、SENP6/NKAIN2、SET/NUP214、SFPQ/ABL1、SFPQ/TFE3、SFRS3/BCL6、SLC34A2/ROS1、SLC45A3/BRAF、SLC45A3/ELK4、SLC45A3/ERG、SLC45A3/ETV1、SLC45A3/FLI1、SNX2/ABL1、SPECC1/PDGFRB、SPTBN1/FLT3、SQSTM1/ALK、SRGAP3/RAF1、SS18/SSX1、SS18/SSX2、SS18/SSX4、SS18L1/SSX1、SSBP2/JAK2、STAT5B/RARA、STRN/PDGFRA、TAF15/NR4A3、TAF15/ZNF384、TAL1/RHOA、TAL1/TCR、TCEA1/PLAG1、TCF12/NR4A3、TCF3/HLF、TCF3/NOP2、TCF3/PBX1、TCF3/TFPT、TCF3/ZNF384、TCR/LMO1、TCR/LMO2、TCR/MTCP1NB、TFG/ALK、TFG/NR4A3、TFG/NTRK1、TFRC/BCL6、THRAP3/USP6、TLX1/TCR、TMPRSS2/ERG、TMPRSS2/ERG、TMPRSS2/ETV1、TMPRSS2/ETV4、TMPRSS2/ETV5、TP53BP1/PDGFRB、TPM3/PDGFRB、TPM4/ALK、TPR/NTRK1、TRIM24/FGFR1、TRIM27/RET、TRIM33/RET、TRIP11/PDGFRB、VTI1A/TCF7L2、WDR48/PDGFRB、WWTR1/CAMTA1、ZBTB16/RARA、ZMIZ1/ABL1、ZMYM2/FGFR1、RUNX1/KIAA1549L、YAP1/TFE3、GTF2I/NCOA2、EWS/FLI1、SLC44A1/PRKCA、NAB2/STAT6、CUX1/AGR3、FGFR3/BAIAP2L1、FGFR3/TACC3、FGFR3/TACC3和NABP1/RARA。因此,對應於與癌基因重排有關的基因的MEI插入相鄰序列提示,與該重排相關的治療在針對該個體的治療方案中將是有效的。
在一些情況下,根據從基因組分析獲得的信息施用抗癌劑。化療抗癌劑的實例包括:氮芥類(Nitrogen Mustards),如苯達莫司汀、苯丁酸氮芥、氮芥(chlormethine)、環磷醯胺、異環磷醯胺、美法侖、潑尼氮芥、氯乙環磷醯胺;烷基磺酸鹽,如白消安、甘露舒凡、蘇消安;乙烯亞胺,如卡波醌、塞替派、三亞胺醌;亞硝基脲,如卡莫司汀、福莫司汀、洛莫司汀、尼莫司汀、雷莫司汀、司莫司汀、鏈脲菌素;環氧化物,如依託格魯;其他烷化劑,如達卡巴嗪、二溴甘露醇、哌泊溴烷、替莫唑胺;葉酸類似物,如甲氨蝶呤、培美曲塞、普拉曲沙、雷替曲塞;嘌呤類似物,如克拉屈濱、氯法拉濱、氟達拉濱、巰嘌呤、奈拉濱、硫鳥嘌呤;嘧啶類似物,如阿扎胞苷、卡培他濱、卡莫氟、阿糖胞苷、地西他濱、氟尿嘧啶、吉西他濱、替加氟;長春花生物鹼,如長春鹼、長春新鹼、長春地辛、長春氟寧、長春瑞濱;鬼臼毒素衍生物,如依託泊苷、替尼泊苷;秋水仙素衍生物,如脫羰秋水仙鹼;紫杉烷,如多西他賽、紫杉醇、聚穀氨酸紫杉醇;其他植物生物鹼和天然產物,如曲貝替定;放線菌素,如更生黴素;蒽環黴素,如阿柔比星、柔紅黴素、阿黴素、表阿黴素、伊達比星、米託蒽醌、吡柔比星、戊柔比星、佐柔比星;其他細胞毒性抗生素,如博來黴素、伊沙匹隆、絲裂黴素、普卡黴素;鉑化合物,如卡鉑、順鉑、奧沙利鉑、賽特鉑;甲基肼,如甲基苄肼;致敏劑,如氨基酮戊酸、乙丙昔羅、氨基酮戊酸甲酯、卟吩姆鈉、替莫卟吩;蛋白激酶抑制劑,如達沙替尼、厄洛替尼、依維莫司、吉非替尼、伊馬替尼、拉帕替尼、尼洛替尼、pazonanib、索拉非尼、舒尼替尼、西羅莫司;其他抗腫瘤劑,如阿利維甲酸、六甲蜜胺、安吖啶、阿那格雷、三氧化二砷、天冬醯胺酶、貝沙羅汀、硼替佐米、塞來考昔、地尼白介素(denileukin diftitox)、雌氮芥、羥基脲、伊立替康、氯尼達明、馬索羅酚、米替福新、米託胍腙、米託坦、奧利默森(oblimersen)、培門冬酶、噴司他丁、羅米地辛、塞西馬集(sitimagene ceradenovec)、噻唑呋林、拓撲替康、維甲酸、伏立諾他;雌激素,如二乙基二苯乙烯醇、炔雌醇、磷雌酚、磷酸聚雌醇;孕激素,如孕諾酮、甲羥孕酮、甲地孕酮;促性腺激素釋放激素類似物,如布舍瑞林、戈舍瑞林、亮丙瑞林、曲普瑞林;抗雌激素,如氟維司群、他莫昔芬、託瑞米芬;抗雄激素,如比卡魯胺、氟他胺、尼魯米特;酶抑制劑,如氨魯米特、阿那曲唑、依西美坦、福美坦、來曲唑、伏氯唑;其他激素拮抗劑,如阿巴瑞克、地加瑞克;免疫刺激劑,如組胺二鹽酸鹽、米伐木肽、匹多莫德、普樂沙福、羅喹美克、胸腺五肽;免疫抑制劑,如依維莫司、胍立莫司、來氟米特、黴酚酸、西羅莫司;鈣調磷酸酶抑制劑,如環孢素、他克莫司;其他免疫抑制劑,如硫唑嘌呤、來那度胺、甲氨蝶呤、沙利度胺;以及放射性藥物,如碘苄胍。
在一些實施方案中,抗癌劑是毒素,例如白喉毒素。在某些實施方案中,使生物相容性水凝膠聚合物負載有治療有效量的一種或多種毒素以形成生物相容性水凝膠聚合物。毒素的實例包括外毒素,如白喉毒素、肉毒桿菌毒素、溶細胞素、溶血素(例如,金黃色葡萄球菌(Staphyllococcus aureus)的α毒素或α溶血素)、霍亂毒素、百日咳毒素、志賀毒素;來自大腸桿菌(E.coli)的熱穩定腸毒素;箭毒;α-眼鏡蛇毒素;維羅毒素-1(Verotoxin-1);以及來自百日咳博德特氏菌(Bordetella pertussis)的腺苷酸環化酶(AC)毒素。
在一些情況下,治療包括施用特異性地以包含MEI插入相鄰連續序列的核酸序列的降解為目標的組合物。
除了使用MEI邊界來選擇與與被上述MEI插入相鄰序列標記的基因產物相關的途徑或基因產物或基因有關的治療之外,在一些情況下還使用MEI插入邊界序列來開發直接靶向跨越MEI和插入相鄰序列的序列的核酸靶向藥物。本文設想包含跨越MEI和插入相鄰邊界序列的核酸序列的多種組合物。在一些情況下,這樣的組合物的一個共同方面是,它們包含對跨越MEI邊緣序列和插入相鄰基因組序列二者的序列具有特異性並且長度不足以靶向單獨的MEI序列或插入相鄰序列的核酸組分。
也就是說,本文在許多情況下設想和公開的組合物在不存在插入相鄰序列的情況下不與MEI結合,並且在不存在相鄰MEI的情況下不與插入相鄰序列結合;確切地說,本文公開的組合物包含與含有MEI和相鄰基因組序列兩者的序列進行特異性結合的核酸組分。因此,在用這樣的組合物治療後,只有與MEI插入相鄰序列對應的核酸,例如本文公開的已經在時間或空間測定(例如,如上文公開的)中被鑑定為明顯過度表示的核酸,才會被該組合物所靶向,而其他MEI和包含插入相鄰序列但不含MEI序列的未插入的等位基因不被該組合物結合。在一些情況下,該組合物的核酸組分包含MEI序列的3、4、5、6、7、8、9、10個或超過10個鹼基,以及插入相鄰序列的3、4、5、6、7、8、9、10個或超過10個鹼基,使得該組合物與單獨的MEI之間或者該組合物與單獨的插入相鄰序列之間的結合能不足以保證結合。
例如,如本文公開的組合物包含與指導包含MEI和插入相鄰序列的靶序列的內切核苷酸切割的部分組合的、具有如上所述的特徵的引導核酸。
在一些實施方案中,所述引導核酸分子為引導RNA分子。在一些情況下,例如通過募集具有內切核酸酶活性的蛋白質如Cas9蛋白,該引導RNA分子或其他引導核酸分子指導與其結合的DNA分子的內切核苷酸切割。鋅指核酸酶(ZFN)、轉錄激活物樣效應物核酸酶和基於成簇規律間隔短回文重複序列/Cas的RNA指導的DNA核酸酶(CRISPR/Cas9)等與本公開內容的一些實施方案相匹配。
引導RNA分子或其他引導核酸分子包含與將從測序中去除的靶序列發生鹼基配對的序列(靶序列區內的非靶序列)。在一些實施方案中,該鹼基配對是完全的,而在一些實施方案中,該鹼基配對是部分的,或包含未配對的鹼基以及與非靶序列配對的鹼基。
引導RNA分子或其他引導核酸分子可包含一個或多個形成『髮夾』結構的區域。這樣的一個或多個區域包含部分或完全回文的序列,使得該區域的5』和3』端可彼此雜交形成雙鏈『莖'結構,在一些實施方案中該結構被非回文環加帽,從而將雙鏈環中的每條單鏈彼此拴住。
在一些實施方案中,引導RNA分子或其他引導核酸分子包含莖環,如tracrRNA莖環。莖環如tracrRNA莖環可與核酸內切核酸酶如Cas9DNA內切核酸酶複合或結合。或者,莖環可與除Cas9之外的內切核酸酶複合,或與除內切核酸酶之外的核酸修飾酶如鹼基切除酶、甲基轉移酶或具有幹擾一種或多種DNA聚合酶的其他核酸修飾活性的酶複合。
tracrRNA/CRISPR/內切核酸酶系統被鑑定為真細菌和古細菌原核生物中的適應性免疫系統,細胞藉由該系統獲得對具有已知序列的病毒的反覆感染的抗性。參見,例如,Deltcheva E,Chylinski K,Sharma CM,Gonzales K,Chao Y,Pirzada ZA等人(2011)"CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III"Nature 471(7340):602–7.doi:10.1038/nature09886.PMC 3070239.PMID 21455174;Terns MP,Terns RM(2011)"CRISPR-based adaptive immune systems"Curr Opin Microbiol 14(3):321–7.doi:10.1016/j.mib.2011.03.005.PMC 3119747.PMID 21531607;Jinek M,Chylinski K,Fonfara I,Hauer M,Doudna JA,Charpentier E(2012)"A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity"Science 337(6096):816–21.doi:10.1126/science.1225829.PMID 22745249;以及Brouns SJ(2012)"A Swiss army knife of immunity"Science 337(6096):808–9.doi:10.1126/science.1227253.PMID 22904002。該系統已被調適用於在真核細胞中引導靶向誘變。參見,例如,Wenzhi Jiang,Huanbin Zhou,Honghao Bi,Michael Fromm,Bing Yang和Donald P.Weeks(2013)"Demonstration of CRISPR/Cas9/sgRNA-mediated targeted gene modification in Arabidopsis,tobacco,sorghum and rice"Nucleic Acids Res.Nov 2013;41(20):e188,2013年8月31日在線發表.doi:10.1093/nar/gkt780,以及其中的參考文獻。
如本文所設想的,在一些實施方案中使用引導RNA分子或其他引導核酸分子來提供對DNA內切核酸酶如Cas9內切核酸酶的序列特異性。在這些實施方案中,引導RNA分子或其他引導核酸分子包含與內切核酸酶如Cas9結合或被內切核酸酶如Cas9結合的髮夾結構(在一些實施方案中設想其他內切核酸酶作為替代物或添加物),並且引導RNA分子或其他引導核酸分子進一步包含與將從測序文庫或測序反應中去除的序列結合或特異性結合或排他性地結合的識別序列。引導RNA分子或其他引導核酸分子中的識別序列的長度可根據序列消除過程中期望的特異性程度而變化。如上文所討論的,核酸特異性在許多情況下被解釋為以下情況:RNA分子或其他引導核酸分子與MEI-插入相鄰序列接合點特異性結合,但不與單獨的MEI也不與單獨的插入相鄰序列結合。包含在樣品中頻繁出現的序列或包含差異豐富序列(富含AT的基因組樣品中的AT豐度或富含GC的基因組樣品中的GC豐度)的短識別序列有可能鑑定相對大量的位點,並因此引導頻繁的核酸修飾,如內切核酸酶活性、鹼基切除、甲基化或幹擾至少一種DNA聚合酶活性的其他活性。包含在樣品中不頻繁出現的序列或包含表示不足的鹼基組合(富含AT的基因組樣品中的GC豐度或富含GC的基因組樣品中的AT豐度)的長識別序列有可能鑑定相對少量的位點,並因此引導不頻繁的核酸修飾,如內切核酸酶活性、鹼基切除、甲基化或幹擾至少一種DNA聚合酶活性的其他活性。因此,如本文公開的,在一些實施方案中,通過對識別序列長度的修飾,可以調節從測序反應中去除序列的頻率,以便特異性地靶向單個MEI-插入相鄰序列。
引導RNA分子或其他引導核酸分子可通過多種符合本公開內容的方法合成。可使用標準合成技術來產生大量的引導RNA分子或其他引導核酸分子。雙鏈DNA分子可包含RNA分子或其他引導核酸分子位點特異性結合序列、引導RNA分子或針對Cas9蛋白和T7啟動子位點的其他引導核酸分子序列。在一些情況下,該雙鏈DNA分子的長度可小於約100bp。可使用T7聚合酶來創建單鏈RNA分子,該單鏈RNA分子可包含靶RNA序列和針對Cas9蛋白的引導RNA序列。
例如,本文公開的組合物包含具有如上所述的MEI插入相鄰序列結合特徵的引導核酸,該引導核酸引導插入相鄰序列中的基因的沉默,使得基因產物如癌基因產物、導致例如細胞周期調節、細胞生長調節或細胞分裂調節缺陷的基因產物的截短或以其他方式突變的等位基因在插入相鄰序列處在被引導核酸結合時得以沉默。在一些情況下,引導核酸包含siRNA部分、piRNA部分或參與基因沉默、基因產物的轉錄調節或轉錄後調節的其他核酸部分。
siRNA和piRNA是與基因沉默有關的小RNA分子。向生物體中引入dsRNA可導致基因表達的特異性幹擾。該現象被稱為RNA幹擾(RNAi),由特異性靶向mRNA以便被植物、無脊椎動物和哺乳動物細胞中的細胞機制降解而導致。本領域已知的示例性RNAi技術包括但不限於siRNA、shRNA和piRNA。RNAi機制的組分包括靶向靶基因的dsRNA(siRNA或shRNA)、Dicer、Argonaute蛋白家族(特別是Ago-2)、Drosha、RISC、TRBP和PACT。小幹擾RNA(siRNA)通常被認為是具有2nt 3』端突出端的dsRNA,其激活RNAi,導致mRNA以依賴於靶mRNA的互補結合的序列特異性方式降解。shRNA通常被認為是含有環結構的短髮夾RNA(shRNA),其被加工成siRNA並且也導致mRNA以依賴於靶mRNA的互補結合的序列特異性方式降解。Drosha通常被認為是在細胞核中加工pri-miRNA和shRNA的RNA酶III酶。Dicer通常被認為是將dsRNA加工成20-25bp的siRNA,而在3'端留下2nt突出端的核糖核酸酶(RNA酶)III酶。果蠅(Drosophila)Dicer-2切割長dsRNA,而Dicer-1對miRNA加工是重要的。RISC通常被認為是由Argonaute蛋白質和締合的siRNA組成的最小RNA誘導的沉默複合物(RISC)。其還可含有PACT、TRBP和Dicer。應注意,RISC的確切組成尚未得到描述。TRBP通常被認為是Dicer對dsRNA的切割以及隨後向RISC的傳遞所需的。蛋白R(PKR)活化蛋白(PACT)通常被認為與用於dsRNA切割的Dicer和TRBP相關。與單鏈siRNA一起,argonaute蛋白家族組裝形成RISC,結合21–35nt RNA(包括miRNA和siRNA)以及其關聯的靶mRNA,隨後通過其核酸內切功能將它們切割。
小幹擾RNA(siRNA)——有時被稱為短幹擾RNA或沉默RNA,是一類雙鏈RNA分子,通常為20-25個鹼基對的長度。siRNA是RNA幹擾(RNAi)途徑中最值得注意的,其中其幹擾具有互補核苷酸序列的特定基因的表達。siRNA通過使mRNA在轉錄後分解來起作用,導致不發生翻譯。siRNA還在RNAi相關途徑中起作用,例如,充當抗病毒機制,或在塑造基因組的染色質結構中起作用。
當在siRNA或shRNA之間進行選擇時,要考慮的重要因素是治療的長度。siRNA在細胞中瞬時表達,而shRNA可通過病毒介導的轉導而被穩定地整合。siRNA設計的指導方針包括:(1)通常推薦19–29nt的siRNA序列以避免非特異性沉默,(2)包含AA二核苷酸的靶向位點,和(3)具有3』dUdU或dTdT二核苷酸突出端的siRNA使有效性增強。通常,siRNA序列應該具有35–55%的G/C含量。
由於不同的細胞類型對核酸的引入具有不同的敏感性,因此用於遞送RNAi的方案將取決於細胞類型。轉染、電穿孔和某些病毒遞送方法是瞬時的。
最常見的核酸遞送方法包括轉染和電穿孔。轉染包括核酸與載體分子的複合物的形成,這允許它們穿過細胞膜。轉染方法包括脂質轉染,在脂質轉染中,具有帶有帶正電荷的頭部基團的長疏水鏈的陽離子脂質與帶負電荷的siRNA相互作用,從而將其包圍在脂雙層中,該脂雙層隨後被細胞內吞;基於陽離子聚合物的納米顆粒,其允許降低的毒性和增加的效率,並且允許遞送修飾的siRNA;以及脂質或細胞穿透肽(CPP)綴合,其包括siRNA與疏水部分(例如,膽固醇)或陽離子CCP(例如,轉運蛋白或pentatratin)的綴合,這促進了向靶細胞內的遞送。
在電穿孔方法中,向由具有帶負電荷的頭部基團的磷脂分子組成的細胞膜施加電場。電脈衝導致磷脂重新定向,在膜中產生孔,從而允許siRNA進入。電穿孔常用於難以轉染的細胞。然而,必須針對每種細胞或組織類型來優化具體的設置(電壓、脈衝數和脈衝的長度)。
已知RNAi幹預對癌症、神經疾病、病毒感染、黃斑變性、糖尿病性視網膜病和C型肝炎以及其他病症具有治療價值。
轉座子沉默是以轉座子為目標的轉錄基因沉默的一種形式。轉錄基因沉默是防止DNA的該區域轉錄的組蛋白修飾的結果。轉座子的轉錄沉默對基因組的維持至關重要。轉座子的「跳躍(jumping)」產生基因組不穩定性並且可以導致非常有害的突變。轉座因子插入與包括血友病、重症聯合免疫缺陷和癌症傾向在內的多種疾病有關。因此,為阻止轉座子突變發展並傳遞到下一代,轉座子的沉默在種系中是非常重要的。
最大的一類小RNA——Piwi相互作用RNA(piRNA)的長度在26到31個核苷酸之間,並且其通過與來自Argonaute蛋白家族的piwi蛋白(基因沉默蛋白質)相互作用而起作用。本領域已知與PIWI蛋白結合的piRNA採用轉錄後轉錄物破壞來使轉座子沉默。大多數piRNA相對於從沉默的轉座子轉錄的mRNA是反義的,其通常與Piwi和Aubergine(Aub)蛋白相締合,而相反,有義鏈piRNA傾向於與Argonaute 3(Ago3)締合。被稱為「桌球」擴增的循環在有義和反義piRNA之間進行,其包括大量的修剪和加工以產生成熟的piRNA。該過程導致種系中大多數piRNA的產生,並且還可以解釋piRNA在種系發育中的起源。Piwi-piRNA複合物通過增加轉座子區之內或上遊的CpG甲基化,和/或轉座子區周圍的染色質修飾,或通過直接降解轉座子的轉錄物來抑制轉座子表達。
可替代地或組合地,在一些情況下,選擇與應對癌症有關的治療,該癌症與細胞生長、細胞周期或細胞增殖途徑(與MEI有關的基因為其編碼參與成員)的誤調節有關。例如,TOR(雷帕黴素信號傳導的靶標)的負調節物如TSC2基因座中的MEI提示採用生長調節抑制劑的治療,而編碼視網膜母細胞瘤抑制基因Rb的基因座中的MEI提示與細胞周期進展有關的治療。
在一些情況下,在個體中的位置之間或在來自個體的相同樣品來源的時間之間比較MEI水平。
在一些情況下,使用血液作為待測定核酸如游離循環核酸的來源,以單獨地或與替代監測方法組合地用於MEI水平的持續時間監測。可替代地或組合地,在一些實施方案中使用來自其他來源的循環遊離DNA或其他DNA。
提取循環遊離核酸的方法是本領域已知的。當核酸在細胞內時,提取程序通常包括細胞裂解(通常通過對樣品進行化學和物理法混合、研磨或超聲處理而實現),通過添加去汙劑或表面活性劑(也用於細胞裂解)去除膜脂質,任選地通過添加蛋白酶去除蛋白質,任選地通過添加RNA酶去除RNA(當DNA為所需靶標時進行)。DNA純化方法是本領域已知的。示例性的DNA純化方法包括但不限於乙醇沉澱、酚-氯仿提取和微型柱純化。可使用冰冷的乙醇或異丙醇完成乙醇沉澱。由於DNA在這些醇中是不可溶的,因此其將聚集在一起,在離心後得到沉澱物。通過增加離子強度(通常通過添加乙酸鈉)來改善DNA的沉澱。酚-氯仿提取使樣品中的蛋白質變性。在樣品離心後,變性的蛋白質留在有機相中,而含有核酸的水相與氯仿混合,從而將酚殘留物從溶液中去除。對於微型柱純化,根據緩衝液的pH和鹽含量,核酸與固相(二氧化矽或其他)結合,隨後洗脫。
供提取的循環核酸的示例性形式包括但不限於DNA、RNA、mRNA寡聚核小體的、線粒體的、表觀遺傳學修飾的、單鏈的、雙鏈的、環狀的,質粒、粘粒、酵母人工染色體人工或人造DNA(如包括獨特DNA序列)、以及從RNA樣品逆轉錄的DNA如cDNA,及其組合。用於核酸提取的示例性生物來源包括但不限於全血、血清、血漿、臍帶血、絨膜絨毛、羊水、腦脊液、脊髓液、灌洗液(例如,支氣管肺泡的、胃的、腹膜的、導管的、耳的、關節鏡的(athroscopic))活檢樣品、尿液、糞便、痰液、唾液、鼻黏膜、前列腺液、精液、淋巴液、膽汁、淚液、汗液、乳汁、乳房流體、胚胎細胞和胎兒細胞。該生物樣品可以是含有核酸的任何組織或流體。示例性的生物樣品包括但不限於石蠟包埋的組織、冷凍的組織、手術細針抽吸物,以下的細胞:皮膚、肌肉、肺、頭和頸、食管、腎、胰腺、口、咽喉、咽、喉、食道、筋膜(facia)、腦、前列腺、乳腺、子宮內膜、小腸、血細胞、肝、睪丸、卵巢、子宮、子宮頸、結腸、胃、脾、淋巴結、骨髓或腎。流體樣品可包括支氣管刷出物、支氣管洗液、支氣管破壞物、外周血淋巴細胞、淋巴液、腹水、漿液、胸腔積液、痰液、腦脊液、淚液、食道洗液以及糞便或尿液標本如膀胱洗液和尿。
如上文討論或本領域已知的核酸樣品來源以一個或多個時間間隔獲得,並且獲得核酸以用於MEI插入邊界豐度的定量評價。時間點可相隔數日、數周、數月或數年,如1個月、2個月、3個月、4個月、5個月、6個月、1年、2年、3年、4年、5年、10年或超過10年。
在一些情況下,時間點被部分或完全執行治療方案如腫瘤或其他癌性組織切除而隔開,或被施用以消除腫瘤或癌性組織為目標的治療如化療或放療而隔開。在一些情況下,如上文公開的治療方案和組合物預期用於治療方案的時間分析。
因此,使用針對與過度增殖細胞有關的MEI的MEI水平定量,例如,以便監測幹預的效力,其中MEI水平的降低表明有效力,或者MEI相對水平的升高速率的降低表明有效力,或者MEI插入邊界的相對量穩定在穩定水平表明有效力。
除樣品的時間分隔之外,本文還涉及樣品的空間分隔。因此,在一些情況下,從第一區域或組織取得與腫瘤或癌活性在表型上不相關的樣品,並從疑似具有癌活性或癌前活性或者觀察為腫瘤或癌的第二區域或組織取得第二樣品。
在一些情況下,從癌或腫瘤內的多個區域如靜止區域和有絲分裂活躍或增殖活躍區域取得樣品,使得與腫瘤增生、生長、細胞分裂或轉移有關的細胞與良性、靜止或衰老腫瘤組織相關細胞分開。
在一些情況下,將腫瘤組織在空間上區分,使得例如內部和邊緣的細胞群體分開提取。可替代地或組合地,通過表面特徵或生物標誌物對腫瘤細胞進行分選。
若干細胞分選方法是本領域已知的。示例性的細胞分選的類型包括但不限於螢光激活細胞分選(FACS)、磁性細胞選擇和單細胞分選。單細胞分選提供了根據細胞內和細胞外性質分選細胞的不均勻混合物的方法。FACS利用流式細胞術提供細胞內和細胞外性質(不包括形態學)的定量測量,以供分選細胞的不均勻混合物。磁性細胞分選提供了根據細胞外性質(通常是細胞表面蛋白質(即,抗原))富集細胞的不均勻混合物的方法。磁性激活細胞分選(MACS)是基於柱子的分離技術,其中使標記的細胞通過磁柱。SEP系統提供了不使用柱子的細胞分離技術,其中將含有標記的細胞的管放置在磁場內。陽性選擇的細胞保留在管中,而陰性選擇的細胞存在於液體懸浮液中。細胞分選方法包括特異性結合癌症生物標誌物以分選細胞的分選劑(例如,抗體)。
示例性的癌症生物標誌物包括但不限於CCR10、CD9、CD13、CD15、CD24、CD26、CD29、CD32、CD46、CD49a、CD49b、CD49c、CD49f、CD51、CD54、CD55、CD56、CD58、CD63、CD66a、CD66c、CD66e、CD71、CD73、CD81、CD82、CD91、CD98、CD99、CD102、CD104、CD105、CD108、CD111、CD117、CD118、CD130、CD131、CD133、CD136、CD141、CD146、CD147、CD148、CD151、CD155、CD157、CD164、CD166、CD167a、CD172a、CD177、CD186、CD196、CD221、CD230、CD234、CD244、CD245、CD262、CD265、CD273、CD275、CD295、CD298、CD299、CD317、CD318、CD324、CD340、BMPR-1B、鈣粘蛋白-11、c-Met、密蛋白-3(Claudin-3)、DLL-1、DLL-3、Eph-B2、Eph-B4、FOLR1、Frizzled-3、Glut-1、Glut-2、磷脂醯肌醇聚糖5、HLA-A/B/C、HLA-A2、HER3、IL-15R、IL-20Ra、jagged-2、整聯蛋白-a8、整聯蛋白a9b1、整聯蛋白b5、LAG-3、白三烯-B4R、Lox-1、LDL-R、MCSP、mer、柄蛋白-4(nectin-4)、notch2、NPC、PD-L2、叢蛋白-B1、腦信號蛋白4B、促生長素抑制素-R2(somatostatin-R2)、TROP-2、ULBP2、整聯蛋白aVb9和VEGFR2。在單細胞分選和FACS的情況下,生物標誌物可以是細胞內或細胞外的。
比較樣品之間的MEI水平,以鑑定在第二樣品中差異性過度豐富的MEI插入接合點。如本文所述,在一些情況下,一個樣品中差異豐富的MEI插入接合點比另一樣品豐富10%、20%、30%、40%、50%、70%、100%、2倍、2.5倍、3倍、3.5倍、4倍、5倍或超過5倍。
使用被鑑定為在假定不健康的組織中差異性存在的MEI插入邊界來指導如上所述的治療選擇。使用被鑑定為在假定不健康的組織中差異性存在的MEI插入邊界來監測疾病進展或治療效力,使得相對水平的降低,或相對水平的穩定化,或相對水平增加速率的降低表明有治療效力。
在一些情況下,使用與過度增殖細胞活性有關的MEI-插入相鄰序列來監測在鑑定的腫瘤或癌症部位之外的腫瘤或癌症或癌前細胞擴充,使得來源於假定健康組織的樣品中MEI插入位點的相對豐度的增加指示該樣品所源自的組織為潛在癌前或癌性的風險。
在一些實施方案中,提供詳述MEI定量測序分析的結果的報告。例如,該報告包含關於經時程相對於治療方案的或在一個組織或區域中相對於另一個的MEI相對豐度水平的信息。在一些情況下,該報告隨附有治療推薦,該治療推薦關聯於與MEI插入位點或與過度增殖細胞有關的位點相鄰的序列的身份或由該身份獲知。在各個實施方案中,這樣的治療推薦包括化療、放療、組織切除或其組合。在一些情況下,該治療針對與MEI插入位點有關的破壞基因的產物,而在一些實施方案中,該治療針對破壞基因的產物所參與的途徑的成員的誤調節。例如,如果負調節物被破壞(如通過MEI插入表明的),則治療可針對由於MEI插入破壞而預期將會上調的下遊信號組分。
在一些情況下,將報告提供給個體,而在一些情況下,將報告提供給醫療保健專業人員。在一些情況下,報告以保密形式提供,使得其不被提供給公眾,而是僅直接提供給提供樣品的個體或該個體及相關的醫療保健專業人員,或保密地提供給醫療保健專業人員。
多種方法可用於MEI-插入相鄰序列定量。重複元件如MEI序列如何通過全基因組測序進行定量分析的概念性實例如下。
在一些情況下,此處獲得的序列信息用於樣品中的核酸序列豐度。如本文公開或如本領域已知的那樣生成文庫並對文庫進行測序。排除重複讀序,使得僅包括獨特標記的讀序。將獨特讀序映射至基因組序列。對映射至靶區域的獨特文庫序列讀序的數目進行計數並用於表示該序列在樣品中的豐度。在一些實施方案中,獨特標記的序列讀序均映射至樣品序列中的單個位點。在一些情況下,獨特標記的序列讀序映射至整個基因組中的多個位點,如轉座子插入位點或重複元件位點。因此,在一些情況下,映射至轉錄物組『基因座』或轉錄物的文庫分子的數目與該轉錄物在產生文庫的樣品中的累積水平相對應。相對於映射至基因組的給定獨特區域的文庫分子的數目,映射至重複元件的文庫分子的數目指示該重複元件在樣品中的相對豐度。映射至給定MEI插入接合點的序列讀序用來定量給定樣品中的該插入接合點。因此,通過比較跨越MEI插入邊界的讀序的數目,相對於例如樣品中的其他序列,如已知在樣品的健康單倍體基因組中為單拷貝的序列,定量了該插入邊界。
因此,定量樣品中核酸分子序列的相對豐度通過生成包含獨特標記的文庫片段的序列文庫並將該核酸分子序列映射至該文庫上而實現,例如該核酸分子序列在該文庫中的出現頻率與該核酸分子序列在產生該文庫的樣品中的豐度相對應。在一些情況下,相對於第二核酸分子序列在該文庫中的出現頻率評價核酸分子序列在該文庫中的出現頻率,所述第二核酸序列與在轉錄物組中具有已知豐度或對於基因組樣品的每個基因組具有已知拷貝數的基因座或轉錄物相對應。
下文提供了用於核酸樣品中核酸序列定量的更加詳細的方案。然而,需要強調的是,本文公開的方法不限於任何一種在核酸樣品中的核酸序列定量方法。
從基因組中每個可能的位置生成下一代測序(NGS)文庫需要無偏倚的方法,以將基因組DNA(gDNA)模板轉化成適當大小的、平臺特異性測序銜接子在gDNA側翼的文庫分子。這可以採用如下式所示的具有測序銜接子尾部的隨機引物來進行:5』-銜接子序列-NNNNNNNN-3』。
為了使給定基因組的偏倚最小化,可以以半隨機方式合成引物的「隨機」部分,以應對感興趣的基因組中的可變內含物。可將給定基因組(例如,人類基因組)分解成具有不同GC含量的100bp窗口。理想地,合成包含代表性「隨機性」的引物,該「隨機性」針對基因組中1%至100%GC的GC含量的窗口而排列,並且以相對於每個GC%下的基因組含量的比例合成並合併這些引物。
隨機引發可允許基因組的每個鹼基被表示為測序儀讀序的起始位置。為了在基因組中每個可能的鹼基處結束每個文庫分子,需要用來終止從隨機引物開始的聚合的隨機/無偏倚方法。要做到這一點,可以使用含有固定比例的四種天然核苷酸中的每一種的ddNTP與固定比例的缺少3』-OH基團的雙脫氧核苷酸的混合物。ddNTP與dNTP的比例可以決定在任意給定鹼基位置終止的可能性。例如,1%ddNTP混合物(99%dNTP)將給出這樣的可能性,即99%的從隨機引物延伸的分子將越過第一鹼基聚合。該相同的實例將給出50bp的N50(50%的分子將長於N個鹼基)。隨著相對ddNTP比例降低,N50插入大小增加。因此,在某些條件下,0.8的ddNTP%導致中值插入大小(N50)為62.5,並且包含銜接子和隨機引物的全長文庫分子的相應N50為198.5,0.4的ddNTP%導致中值插入大小(N50)為125,並且包含銜接子和隨機引物的全長文庫分子的相應N50為261,0.2的ddNTP%導致中值插入大小(N50)為250,並且包含銜接子和隨機引物的全長文庫分子的相應N50為386,0.1的ddNTP%導致中值插入大小為500,並且包含銜接子和隨機引物的全長文庫分子的相應N50為636,而0.05的ddNTP%導致中值插入大小為1000,並且包含銜接子和隨機引物的全長文庫分子的相應N50為1136。對於低複雜度的區域,如一段AT或GC,該基因組位置中ddNTP的有效濃度將減半,導致在1%ddNTP混合物下,對於在這樣的低複雜度基因組基因座中發生的引物延伸反應,N50為100個核苷酸。(未考慮全部8種核苷酸之間的聚合酶摻入效率差異)。
調節反應中的ddNTP%可調節聚合的分子的範圍和多樣性。ddNTP濃度對片段長度和腺嘌呤-酪氨酸偏倚的影響在圖11中示出。ddNTP濃度對產率的影響在圖12中示出。在0.4%ddNTP下,300-1000bp(摩爾)的摩爾濃度為27.5;在0.2%ddNTP下,300-1000bp(摩爾)的摩爾濃度為16.1;在0.1%ddNTP下,300-1000bp(摩爾)的摩爾濃度為5.8;而在0.05%ddNTP下,300-1000bp(摩爾)的摩爾濃度為4.9。圖13示出了按照大小選擇的分子的讀取位置。
另一個步驟可以是將銜接子標記的分子與gDNA模板以及任何過量的反應物如引物和過量的NTP分離。這可以通過使用生物素化的ddNTP完成。可使用鏈黴親和素塗覆的磁珠來實現該分離。
聚合酶的選擇可限於具有鏈置換以及ddNTP/生物素摻入能力的酶。SEQUENASE和THERMOSEQUENASE(Affymetrix,Santa Clara,CA)是兩種這樣的酶。如果由於缺少樣品資源或強制稀釋而需要低輸入量,則可通過使用酶混合物如SEQUENASE和Phi29(一種缺乏摻入ddNTP能力的高度持續性聚合酶)優化反應以改善產率。phi 29酶將增加用於在反應中被SEQUENASE加工的模板量。還可以通過優化反應持續時間來提高模板的產率和多樣性。
這樣的測序反應的產物由下式表示:5』-銜接子-NNNNNNNN-基因組插入片段-ddNTP/生物素。
目前的商用測序儀需要gDNA插入片段的側翼為2個銜接子序列。可通過第二隨機引發反應添加第二銜接子。從磁珠上分離的產物可用作使用隨機引物與第二銜接子的第二隨機引發反應的模板,如下式所示:5』-銜接子2-NNNNNNNN-3』。置換的產物也可用作使用隨機引物與第二銜接子的第二隨機引發反應的模板。
用於第二銜接子添加的酶可以不需要摻入ddNTP的能力。鏈置換可能是必需的。可接受的酶包括SEQUENASE、THERMOSEQUENASE、Phi29、Bst DNA聚合酶和Taq DNA聚合酶。引物的隨機部分可以與珠子結合的模板結合併通過該模板分子的末端延伸。在最靠近模板的3'端處結合的引物可以置換在下遊結合的引物,使得將產生單拷貝的具有第一和第二銜接子兩者的與珠子結合的模板。該拷貝可與磁珠保持氫鍵鍵合。可通過珠子洗滌去除過量的引物、NTP、酶和置換產物。可對所得的產物進行熱變性(將其從珠子上釋放),並測序或通過採用與銜接子互補的引物的PCR進行擴增。由此產生的產物由下式表示(以3』至5』方向示出):3』-銜接子1-NNNNNNNN-gDNA插入片段-NNNNNNNN-銜接子2-5』。
NGS測序中的關鍵錯誤模式是文庫製備中的錯誤的克隆擴增。對於無PCR方案,這可能很少受到關注,但任何低輸入方案都需要擴增來獲得足夠的文庫以加載到測序儀上。擴增過程中引入的錯誤可在測序儀中顯露出來。這些錯誤的標準減少是從分析中去除重複。然而,如果給予樣品足夠的測序能力,則重複讀序(具有相同起始和終止位置的讀序)可自然發生。因此,去除這些讀序將降低該試驗的覆蓋度和準確性。在分析中使用合成隨機引物可允許相對於低頻突變準確確定克隆矯作物。PCR重複可在兩端上具有相同的隨機引物序列,而由於深度測序覆蓋導致的重複可具有不同的隨機引物序列。由於合成序列總是在每個讀序的相同位置處,因此該信息可以很容易地在分析中獲得。
非終止性合成測序化學法(如Qiagen和ION Torrent)在對均聚物的長段進行測序時遇到困難。這可以通過複雜文庫生成來減輕,這種複雜文庫生成通過在本文所述的均聚物的每個鹼基處的終止來實現。
因此,與以上公開內容一致,生成了第一鏈寡核苷酸文庫。為了生成隨機文庫,合成了第一輪合成寡核苷酸的群體。第一鏈寡核苷酸均包含位於隨機寡聚物序列(如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30聚物或更大的寡聚物)的5』側的序列銜接子,該序列銜接子之後為發生模板引導的延伸的3』OH。在一些情況下,該序列銜接子被配置為包含可變標識符序列。在替代情況下,該序列銜接子是不變的。在一些情況下,使用序列銜接子作為引物結合位點進行測序銜接子如A銜接子的後續添加,例如通過經由擴增的標準引物引導的序列添加。
在一些情況下,合成了寡核苷酸群體,使得給定隨機寡聚物鹼基序列(如隨機5、6、7、8、9或10聚物)的所有可能的組合都在第一鏈寡核苷酸群體中呈現。在其他情況下,特別是當選擇長隨機寡聚物時,但偶爾也在較小寡聚物的情況下,存在給定隨機寡聚物鹼基序列的部分可能的組合。
在一些情況下,隨機寡聚物的鹼基以相等的比例呈現核酸鹼基的無偏倚的隨機分布。在一些情況下,每個鹼基在給定位置出現或在隨機寡聚物群體中總計出現的可能性相同。然而,在其他情況下,為了增加退火和隨後第一鏈合成的效率,合成了群體,使其包含具有某些鹼基或鹼基對的偏倚呈現的隨機寡聚物(如隨機8聚物)的偏倚。例如,據觀察,人類基因組具有約40%的GC百分比,而不是從真正隨機鹼基豐度預期的50%GC組成。參見例如圖10。在一些情況下,隨機寡聚物分布是偏倚的,使得第一鏈合成文庫中隨機寡聚物序列(如8聚物序列)的總體分布反映出偏斜的靶標平均值如靶基因組、靶基因座、靶基因家族、靶基因組元件(例如外顯子、內含子或啟動子序列)的平均值的總體分布,或在一些實施方案中,匹配作為整體的人類基因組。
使第一鏈寡核苷酸文庫或代表第一鏈寡核苷酸文庫的90%、80%、70%、60%、50%、40%、30%、20%、10%或少於10%的寡核苷酸文庫子集與包含核酸如脫氧核糖核酸或核糖核酸的樣品接觸。核酸如DNA或RNA可以以寬範圍的量提供。在一些情況下,基因組DNA樣品以等於或約為諸如1ng、2ng、3ng、4ng、5ng、6ng、7ng、8ng、9ng、10ng、11ng、12ng、13ng、14ng、15ng、16ng、17ng、18ng、19ng、20ng、21ng、22ng、23ng、24ng、25ng、26ng、27ng、28ng、29ng、30ng、31ng、32ng、33ng、34ng、35ng、36ng、37ng、38ng、39ng、40ng、41ng、42ng、43ng、44ng、45ng、46ng、47ng、48ng、49ng、50ng、51ng、52ng、53ng、54ng、55ng、56ng、57ng、58ng、59ng、60ng、61ng、62ng、63ng、64ng、65ng、66ng、67ng、68ng、69ng、70ng、71ng、72ng、73ng、74ng、75ng、76ng、77ng、78ng、79ng、80ng、81ng、82ng、83ng、84ng、85ng、86ng、87ng、88ng、89ng、90ng、91ng、92ng、93ng、94ng、95ng、96ng、97ng、98ng、99ng或100ng的量,或在由上述列表限定的範圍之外的數值的量提供。從下文可以看出,下遊熱循環的數目將隨著起始模板量的增加而減少。在一些情況下,RNA樣品由從少至1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100個細胞或多於100個細胞的細胞群體提取的RNA提供。
還向混合物中添加包含與DNA聚合酶活性一致的試劑的聚合酶緩衝液。多種聚合酶符合本公開內容。在一些情況下,示例性的聚合酶具有鏈置換活性、ddNTP摻入活性,並且能夠摻入生物素標記的核苷酸如生物素標記的ddNTP。示例性的聚合酶是測序酶(Sequenase),而示例性的逆轉錄酶是HIV逆轉錄酶。
還向混合物中添加核苷酸群體,如包含dATP、dTTP、dCTP和dGTP的群體,以及在一些情況下還包含ddNTP如ddATP、ddTTP、ddCTP和ddGTP的群體。在一些情況下,僅向dNTP群體中添加單種ddNTP,如單獨的ddATP、單獨的ddTTP、單獨的ddCTP和單獨的ddGTP。在一些情況下,添加了ddNTP對,如ddATP和ddTTP,或ddCTP和ddGTP。
在一些情況下,添加至組合物的ddNTP群體如ddATP、ddTTP、ddCTP和ddGTP包含至少一種生物素標記的ddNTP,如生物素標記的ddATP、生物素標記的ddTTP、生物素標記的ddCTP和生物素標記的ddGTP。
dNTP/ddNTP比例的範圍符合本公開內容。99.9%/0.1%、99.5%/0.5%、99%/1%、98%/2%的比例和替代的比例符合本公開內容。在一些情況下,選擇了99%脫氧NTP與1%雙脫氧NTP的相對比例。
在一些情況下通過加熱至解鏈溫度以上,如95℃、96℃、97℃、98℃或99℃或更高的溫度,使混合物變性。在許多情況下,低於100℃的變性溫度是示例性的。
然後將混合物例如在冰上冷卻30秒、1分鐘、2分鐘或多於2分鐘,或在4℃下冷卻30秒、1分鐘、2分鐘或多於2分鐘,或在足以允許第一鏈合成寡核苷酸與核酸樣品如基因組DNA樣品或RNA樣品之間反向互補鹼基配對的備選冷卻溫度下冷卻。在一些情況下,第一鏈合成寡核苷酸中的一些或全部在其隨機寡核苷酸(如隨機8聚物)與其各自結合的核酸樣品序列如基因組DNA序列、cDNA序列或RNA序列之間顯示出完全的反向互補性。在一些情況下,一些寡核苷酸結合與寡核苷酸的隨機寡聚物(如隨機8聚物)不完全反向互補的基因組區。在一些情況下,不具有完全反向互補性的鹼基配對對隨機文庫製備過程中的後續步驟無害。
在備選的實施方案中,在任選的變性步驟之前或之後添加聚合酶。將混合物加熱至與聚合酶活性如最佳聚合酶活性一致的溫度(例如,20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃、40℃、41℃、42℃,或在一些情況下,比該範圍中的數值更高或更低的數值),並溫育足以合成第一鏈文庫的一段時間,如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45分鐘或超過45分鐘。在一些情況下,在該溫育期間的時間點如每10分鐘對反應進行攪拌。
延伸從第一鏈合成寡核苷酸的3』OH進行,導致在每個退火寡核苷酸的退火位點處與模板反向互補的序列被摻入每個退火寡核苷酸的3』端。延伸持續直到摻入生物素標記的ddNTP分子,在該時間點延伸終止。如果dNTP和生物素-ddNTP以99%/1%的比例提供,則發生延伸的第一鏈寡核苷酸的50%在摻入生物素-ddNTP分子之前顯示出超過50個鹼基的延伸。在其他參數未同時改變的一些情況下,ddNTP比例降低,代表至少50%延伸產物的長度的N50增加。
在溫育期完成時,例如通過在98℃下熱滅活五分鐘來終止反應。或者,可在另一個溫度下,或通過添加螯合劑或dNTP酶來實現滅活。
如上文提到的,在一些情況下,摻入的ddNTP例如被生物素標籤標記。在一些情況下,考慮了生物素的替代物,如二硝基苯基。可與ddNTP結合併通過至少一種核酸聚合酶摻入至新生核酸分子中的任何親和標籤都符合本公開內容。類似地,可經由例如ddNTP結合部分遞送至核酸分子的ddNTP端的任何親和標籤也都符合本公開內容。在一些情況下,該親和標籤是生物素-ddNTP。
在一些情況下,提供了與本文提供的標記的第一鏈核酸分子結合的標籤結合劑,如在標籤生物素的情況下的親和素或鏈黴親和素。在特定情況下,將鏈黴親和素與磁珠結合,使得可通過放置在磁場中(如在磁性支架(stand)上)來分離鏈黴親和素和任何結合配偶體。
使用標籤結合劑例如針對生物素標記的ddNTP核酸末端的鏈黴親和素來分離標記的第一鏈文庫。在一些情況下,將珠子/樣品混合物在22C下溫育並以10分鐘的間隔攪拌30分鐘。然後將混合物放置在磁性支架上,在珠子沉降後去除上清液。對該管進行攪拌並使其在磁性支架上靜置。用200uL TE緩衝液洗滌珠子三次。替代的標籤結合劑組合和替代的方案符合本文公開內容。
在一些情況下,在不依賴於標記的情況下,例如通過大小選擇如凝膠電泳以及隨後對所需大小的核酸的純化來純化第一鏈分子。在一些情況下,分離了大小範圍為10-100、10-150、10-200、1-300、10-350、10-400、10-500、10-600、10-700、10-800、10-900或10-1000個鹼基的片段。
將如上純化的第一鏈文庫模板重新引入至反應緩衝液中。例如,在一些情況下,將模板與其純化標籤分離,從鏈黴親和素標籤上洗脫,並重懸於包含dNTP的核酸合成緩衝液中。在一些情況下,模板保持與其純化標籤附接,洗滌所述模板,並將其重懸於反應緩衝液中。在一些情況下,包括在第一鏈文庫生成後的NaOH洗滌,以去除遺留序列並減少第一鏈文庫產物的自摺疊。
如下合成文庫第二鏈分子。添加包含第二鏈引物群體的第二探針文庫。在一些情況下,每個第二鏈引物包含在隨機寡聚物序列如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30聚物或更大寡聚物(例如8聚物)的5』側的B-銜接子序列,該B-銜接子序列之後為發生模板引導的延伸的3』OH。在一些情況下,該序列銜接子被配置為包含可變標識符序列。在替代情況下,該序列銜接子是不變的。在一些情況下,使用序列銜接子作為引物結合位點進行測序銜接子如B銜接子的後續添加,例如通過經由擴增的標準引物引導的序列添加。
在一些情況下,隨後合成了寡核苷酸群體,使得給定隨機寡聚物鹼基序列(如隨機8聚物)的所有可能的組合都在第二鏈寡核苷酸群體中呈現。在其他情況下,特別是當選擇長隨機寡聚物時,但偶爾也在較小寡聚物的情況下,存在給定隨機寡聚物鹼基序列的部分可能的組合。
在一些情況下,隨機寡聚物的鹼基以相等的比例呈現核酸鹼基的無偏倚的隨機分布。在一些情況下,每個鹼基在給定位置出現或在隨機寡聚物群體中總計出現的可能性相同。然而,在其他情況下,為了增加退火和隨後第二鏈合成的效率,合成了群體,使其包含具有某些鹼基或鹼基對的偏倚呈現的隨機寡聚物(如隨機8聚物)的偏倚。例如,據觀察,人類基因組具有約40%的GC百分比,而不是從真正隨機鹼基豐度預期的50%GC組成。參見例如圖10。在一些情況下,隨機寡聚物分布是偏倚的,使得第二鏈合成文庫中隨機寡聚物序列(如8聚物序列)的總體分布反映出偏斜的靶標平均如靶基因組、靶基因座、靶基因家族、靶基因組元件(例如外顯子、內含子或啟動子序列)的平均的總體分布,或在一些實施方案中,匹配作為整體的人類基因組。
將混合物加熱至98℃持續3分鐘。該混合物在冰上冷卻2分鐘,以允許第二鏈合成寡核苷酸與第一鏈文庫之間的反向互補鹼基配對。觀察到一些寡核苷酸在其隨機8聚物與各自結合的第一鏈序列之間顯示出完全的反向互補性。還觀察到一些寡核苷酸結合與寡核苷酸的隨機8聚物不完全反向互補的基因組區。不具有完全反向互補性的鹼基配對對隨機文庫製備過程中的後續步驟無害。
將組合物加熱至室溫並使之持續30分鐘。對於輸入DNA量更低的樣品,可以延長該時間段。
觀察到從第一鏈合成寡核苷酸的3』OH的延伸,導致在每個退火寡核苷酸的退火位點處與模板反向互補的序列被摻入每個退火寡核苷酸的3』端。延伸持續直到到達第一鏈模板的5』端。觀察到遠離第一鏈模板的3』端退火的第二鏈寡核苷酸經歷從其3』端的延伸,但通過由進一步向第一鏈模板的3』端退火的寡核苷酸引發的延伸反應從第一鏈被置換。
因此,合成了雙鏈文庫分子,其包含兩條不同的鏈:1)第一鏈,其從5』端開始,具有A銜接子、隨機8聚物序列和1-100個核苷酸數量級的靶序列,在生物素標記的ddNTP處終止;和2)第二鏈,其從5』端開始,具有B銜接子、第二隨機8聚物序列、來源於樣品的靶序列、與第一鏈的隨機8聚物反向互補的第一隨機8聚物序列以及與第一A銜接子反向互補的序列。
在一些情況下,使用磁性鏈黴親和素珠子分離生物素標記的雙鏈文庫分子。例如,在結合緩衝液中提供磁性鏈黴親和素珠子,混合,並使其在磁性支架上靜置。然後可將結合緩衝液替換成25uL、50uL、75uL、100uL、125uL、150uL、175uL、200uL、225uL、250uL、275uL、300uL、350uL、400uL、450uL或500uL體積並重複該過程。然後吸出上清液,並可將珠子重懸在5uL、10uL、12uL、14uL、16uL、18uL、20uL、22uL、24uL、26uL、28uL、30uL、31uL、32uL、33uL、34uL、35uL、36uL、37uL、38uL、39uL、40uL、41uL、42uL、43uL、44uL、45uL、46uL、47uL、48uL、49uL 50uL、52uL、54uL、56uL、58uL或60uL的結合緩衝液中。
在一些情況下,然後將生物素標記的雙鏈文庫分子添加至重懸的珠子。在一些情況下,將珠子/樣品混合物在22℃下溫育並以10分鐘的間隔攪拌30分鐘。然後將混合物放置在磁性支架上,並在珠子沉降後去除上清液。對該管進行攪拌並使其在磁性支架上靜置。用200uL TE緩衝液洗滌珠子三次。在一些情況下,這產生鏈黴親和素純化的雙鏈文庫分子的群體,該雙鏈文庫分子包含兩條不同的鏈:1)第一鏈,其從5』端開始,具有A銜接子、隨機寡聚物(如8聚物)序列和1-100個核苷酸數量級的靶序列、在生物素標記的ddNTP處終止;和2)第二鏈,其從5』端開始,具有B銜接子、第二隨機寡聚物(如8聚物)序列、來源於樣品的靶序列、與第一鏈的隨機寡聚物(如8聚物)反向互補的第一隨機寡聚物(如8聚物)序列以及與第一A銜接子反向互補的序列。替代的標籤結合劑組合和替代的方案符合本文公開內容。
然後,例如,將與雙鏈文庫分子群體結合的磁性鏈黴親和素珠子重懸在一定量的無核酸酶的水中。該量可以是10uL、12uL、14uL、16uL、18uL、20uL、22uL、24uL、26uL、28uL、30uL、32uL、34uL、36uL、37uL、38uL、39uL、40uL、41uL、42uL、43uL、44uL、45uL、46uL、47uL、48uL、50uL、52uL、54uL、56uL、58uL或60uL無核酸酶的水。向重懸的珠子中添加一定量的銜接子A引物和一定量的銜接子B引物。銜接子A引物的量與銜接子B引物的量可以是相同或不同的。銜接子A引物的量和銜接子B引物的量可獨立地為1uL、2uL、3uL、4uL、5uL、6uL、7uL、8uL、9uL或10uL。在一些情況下,銜接子A引物在引物的3』端包含與雙鏈模板的第一銜接子相同的序列,並進一步包含如本文所述的合成測序反應所必需的序列。在其他情況下,銜接子A引物在引物的3』端具有與雙鏈模板的第一銜接子的序列的一個鹼基對錯配、兩個鹼基對錯配、三個鹼基對錯配、四個鹼基對錯配、五個鹼基對錯配、六個鹼基對錯配、七個鹼基對錯配、八個鹼基對錯配、九個鹼基對錯配或十個鹼基對錯配。在一些情況下,銜接子B引物在引物的3』端包含與雙鏈模板的第二鏈的第二銜接子相同的序列,並進一步包含如本文所述的合成測序反應所必需的序列。在其他情況下,銜接子B引物在引物的3』端具有與雙鏈模板的第二鏈的第二銜接子的序列的一個鹼基對錯配、兩個鹼基對錯配、三個鹼基對錯配、四個鹼基對錯配、五個鹼基對錯配、六個鹼基對錯配、七個鹼基對錯配、八個鹼基對錯配、九個鹼基對錯配或十個鹼基對錯配。
將2x PCR主混合物以10uL、15uL、20uL、25uL、30uL、35uL、40uL、45uL、50uL、55uL、60uL、65uL、70uL、75uL、80uL、85uL、90uL、95uL或100uL的量添加至珠子和引物的混合物中。在一些情況下,然後使該混合物經歷如下的熱循環:約98℃持續約2分鐘;接著為約98℃持續約20秒、約60℃持續約30秒以及約72℃持續約30秒的約6個循環;在所述約6個循環後,將反應保持在約72℃持續約5分鐘,隨後在約4℃下儲存。本公開內容設想熱循環條件的優化,如對於具有較低模板輸入的樣品增加PCR循環的次數。在一些情況下,在沒有PCR的情況下進行擴增。在一個實例中,模板核酸與含有全長測序銜接子的引物一起使用,並且採用隨後的大小選擇進行第一鏈合成和第二鏈合成。這可能需要或不需要使用髮夾來避免二聚化。
在一些情況下,觀察到由此生成的測序文庫具有以下特徵。每個雙鏈分子按順序包含足以進行合成測序的銜接子A序列、第一隨機寡聚物序列(如8聚物)、未知長度但可能在1-100個鹼基內的靶區域、第二隨機寡聚物(如8聚物)序列以及足以進行如本文公開的合成測序的B銜接子序列。
在一些情況下,觀察到文庫成分具有以下特徵。每個分子均包含與文庫中其他分子的第一分子標籤(如8聚物)相獨立的第一分子標籤(如8聚物)。每個分子均包含與原始樣品的序列對應的靶序列。每個給定分子的靶序列的起點、靶序列的長度和靶序列的終點均與文庫中每個其他分子的起點、長度和終點相獨立。每個分子均包含與文庫中其他分子的第二分子標籤(如8聚物)相獨立的第二分子標籤(如8聚物)。
在一些情況下,觀察到文庫總體上具有以下特徵。基本上所有的樣品序列在文庫中由多個重疊分子表示。基本上所有的文庫分子(罕見事件除外)在通過熱循環最終添加A和B銜接子之前都是獨特的,就其第一分子標籤(如8聚物)序列、靶序列起點、靶序列、靶序列長度、靶序列終點和第二分子標籤(如8聚物)序列而言彼此不同。
使此處生成的序列文庫經歷與其A銜接和B銜接子相容的合成測序,並評價測序結果。獨立地,準備第二份原始樣品,以便採用標準的基於PCR的文庫標記進行測序,其包括對未標記的模板的基於PCR的大量擴增。對文庫進行測序並將結果進行比較。
觀察到,在傳統序列文庫測序結果中鑑定了與MEI對應的序列。觀察發現MEI單體單元與多個插入相鄰邊界序列相鄰,提示其以多個拷貝存在於樣品中。
由於序列讀序在每個文庫成員中被5』標籤、3』標籤以及樣品序列的獨特起點、終點和長度獨特地標記,因此序列讀序可容易地被分成與獨特文庫分子對應的組。通過對序列讀序群體中呈現的獨特文庫分子的數目(而不是序列讀序的數目)進行計數,可以獲得具有經歷測序的核酸樣品中的給定MEI插入相鄰序列的分子的絕對或相對數目的定量量度。
可使用備選的定量方法,並且本文公開的方法不限於單一的定量方法。例如,在一些情況下使用定量PCR來確定一個或多個樣品中的MEI插入相鄰序列的水平。
通常,在具有用指定波長的光束照射每個樣品並檢測由激發的螢光團發射的螢光的能力的熱循環儀中進行定量PCR。該熱循環儀還能夠快速加熱和冷卻樣品,由此利用核酸和DNA聚合酶的物理化學性質。PCR過程通常由重複25-40次的一系列溫度變化組成。這些循環通常由三個階段組成:第一階段,在約95℃下,使雙鏈核酸解鏈;第二階段,在約50-60℃的溫度下,使引物與DNA模板結合;第三階段,在68-72℃之間,促進由DNA聚合酶進行的聚合。由於片段大小較小,在這一類型的PCR中通常省略最後一步,這是因為該酶能夠在對齊(alignment)階段與變性階段之間的變化期間增加其數目。此外,一些熱循環儀向每個循環增加僅持續數秒、溫度為例如80℃的另一個短的溫度階段,以便降低在使用非特異性染料時由引物二聚體的存在而導致的噪聲。每個循環所採用的溫度和時間安排依賴於很多參數,如:用於合成DNA的酶、反應中二價離子和dNTP的濃度以及引物的鍵合溫度。
在定量PCR(qPCR)的情況下,DNA結合染料與雙鏈(ds)DNA在PCR中結合,導致該染料的螢光。PCR期間DNA產物的增加導致螢光強度的增加,並在每個循環進行測量,從而允許DNA濃度被定量。定量PCR還可包含螢光報告探針,以僅檢測含有該探針序列的DNA,這增加了特異性並使得能夠甚至在非特異性DNA擴增的存在下進行定量。
使用qPCR的定量方法包括相對定量和絕對定量。絕對定量通過使用校準曲線與DNA標準比較而給出靶DNA分子的確切數目。相對定量基於內部參考基因來確定靶基因表達的倍數差異。將定量表示為被解釋為互補DNA(cDNA,由mRNA的逆轉錄生成)的mRNA的表達水平變化。
與終點PCR(常規PCR)不同,實時PCR允許通過測量螢光在擴增過程中的任何時間點定量所需產物。常採用的通過定量PCR的DNA定量方法依賴於在對數尺度上將螢光對循環數作圖。將基於DNA的螢光的檢測閾值設置為稍高於背景。螢光超過該閾值的循環數被稱為閾值循環(Ct)或定量循環(Cq)。
商業定量PCR組合物、試劑盒和方法是可獲得的,並且其使用符合本文公開的、涉及MEI插入相鄰序列定量的一些方法。
本文公開的一些實施方案涉及隨時間監測總體體細胞基因組健康。如本文公開的,總體基因組健康涉及由獨立MEI事件的豐度反映的體細胞基因組『健康』狀態,在一些情況下與插入位點無關。因此,在一些情況下,方法涉及MEI事件的總數的時間或空間測定。在一些情況下,由於每個插入事件傳達了對相關插入位點基因有害的風險,因此MEI事件數目的增加表明『總基因組健康』的降低。在一些情況下,MEI事件的總數與癌症、衰老、細胞活性喪失或細胞活性降低的風險相關。
例如使用如本文或其他地方公開的定量全基因組測序確定總MEI事件。可替代地或組合地,使用例如本領域已知的Q-PCR或螢光原位雜交法,使用對單個可動因子具有特異性的引物、探針或引物和探針,或使用引物組、探針組或引物組和探針組來測定單獨的可動因子,使得多個可動因子(至多且包括已知可動因子的10%、20%、30%、40%、50%、60%、70%、80%、90%、95%,或約100%,或100%)就其在第一時間點或第一組織中的豐度得到定量。
在一些情況下,使用該定量作為基因組健康的基線,尤其當樣品取自基因組健康預期較高(如在青年或成年早期)時的組織或第一時間段時。
第二樣品在第二時間點,如在第一時間點後不到1年、1年、2年、3年、4年、5年、10年或超過10年的時間點取得。測量總MEI水平,並將其與初始時間點的水平或客觀上與患者的基因組健康總體相關的水平進行比較。
如果相比於第一樣品或之前的樣品,第二樣品中的MEI事件總數在豐度上升高10%、20%、30%、40%、50%、70%、100%、2倍、2.5倍、3倍、3.5倍、4倍、5倍或大於5倍,則將該樣品中的核酸確定為『衰老的』或基因組健康不佳。多個治療選擇可用於被確定為體細胞核酸樣品的基因組健康不佳的個體。在一些情況下,選擇卡路裡限制。在一些情況下,推薦NSAID作為治療方案的一部分。NSAID的部分列表包括以下藥物:阿司匹林、塞來昔布(Celebrex)、雙氯芬酸(Cambia、Cataflam、Voltaren-XR、Zipsor、Zorvolex)、二氟尼柳、依託度酸、布洛芬(Motrin,Advil)、吲哚美辛(Indocin)、酮洛芬、酮咯酸、萘丁美酮、萘普生(Aleve、Anaprox、Naprelan、Naprosyn)、奧沙普秦(Daypro)、吡羅昔康(Feldene)、雙水楊酸酯、舒林酸和妥美汀。其他NSAID也予以考慮並且符合本文公開內容。
可動因子活性與逆轉錄轉座酶(retrotransposase)活性有關,並且在一些情況下與抑制性基因組甲基化的缺陷有關。因此,在一些情況下,治療方案包括施用逆轉錄酶抑制劑。在一些情況下,治療包括施用逆轉錄轉座酶抑制劑。在一些情況下,治療包括施用逆轉錄病毒抑制劑。可基於從基因組分析獲得的信息施用治療方法。針對遺傳異常的治療方案是本領域已知的。為了治療逆轉錄病毒病症而施用的示例性抑制劑包括但不限於核苷類似物、蛋白酶抑制劑、非核苷反轉錄酶抑制劑(NNRTI)、核苷酸慢轉錄酶抑制劑(NtRTI)、混合抑制劑或進入抑制劑以及整合酶抑制劑。示例性的NRTI包括齊多夫定(Retrovir)、拉米夫定(Epivir)、地達諾新(Videx)、扎西他濱(Hivid)、司他夫定(Zerit)和阿巴卡韋(Ziagen)。示例性的蛋白酶抑制劑包括沙奎那韋(Invirase)、利託那韋(Norvir)、茚地那韋(Crixivan)、奈非那韋(Viracept)、安普那韋(Agenerase)、洛匹那韋、阿扎那韋(Reyataz)和替拉那韋(Aptivus)。示例性的非核苷反轉錄酶抑制劑(NNRTI)包括奈韋拉平(Viramune)、地拉韋啶(Rescriptor)、依非韋倫(Sustiva)和依曲韋林(Intelence)。示例性的NtRTI包括替諾福韋(Viread)。示例性的混合抑制劑或進入抑制劑包括馬拉威若(Maraviroc)和恩夫韋地。示例性的整合酶抑制劑包括雷特格韋(Isentress)。可替代地或與以上列出的治療的任意組合聯合地,向個體施用甲基轉移酶或促進DNA甲基化的組合物。用於治療HBV的示例性抑制劑包括但不限於幹擾素α(IFN-α)、PEG-IFN-α、恩替卡韋和替諾福韋。
在一些情況下,隨時間監測治療對MEI豐度增加的影響。例如,在治療方案如本文公開的治療方案開始後的時間點(如第一時間點後的1個月、2個月、3個月、4個月、5個月、6個月、7個月、8個月、9個月、10個月、11個月、不到1年、1年、2年、3年、4年、5年、10年或超過10年的時間點)取得第三樣品。測量總MEI水平,並將其與初始時間點的水平、或客觀上與患者基因組健康總體相關的水平、或在治療方案開始前確定的水平進行比較,或者與之前的MEI豐度測量值進行比較。繼續進行導致MEI豐度增加的速率降低(直到並且包括使MEI總量穩定在插入前水平)的治療方案,在一些情況下伴隨著對總MEI水平的持續監測。替換、補充不影響總MEI水平增加的治療方案,或修改或增加劑量方案,使得MEI水平增加可能受到積極影響。
在一些情況下,該測定與顯示出隨時間特定增加的特定MEI插入相鄰位點的監測,或與MEI相鄰邊界的監測組合進行,以鑑定涉及已知或疑似癌基因(如本文列出的癌基因)或與癌基因活性有關的基因組重排(如本文列出的基因組重排)或這二者的事件,使得特別被懷疑與目前或未來癌症或腫瘤活性有關的MEI插入事件得到早期鑑定,並且例如使用本文公開的組合物和方法來應對。
為了細胞健康,一個或多個試驗在早期進行並監測血液中無細胞DNA的插入事件。相同插入事件的增加代表該事件的克隆擴充,並且可將其定量並與疾病進展相關聯。該試驗可與針對MEI插入的組織特異性試驗、種系變體分析(包括外顯子組或全基因組測序)或甲基化或定量RNA分析組合使用,以確定細胞健康或疾病進展。
此外,本公開內容的一些實施方案涉及具有MEI插入邊界的組織的可視化,該MEI插入邊界例如是與過度增殖(如癌症或腫瘤細胞群體中的過度增殖)有關的MEI插入相關邊界。在一些情況下,使用具有與包含MEI插入相鄰連續序列的核酸序列特異性退火的核苷酸序列的寡核苷酸探針,使得在退火後,該探針對於例如分析癌性或腫瘤組織的成功切除的醫師而言是可檢測的。
在一些情況下,使用MEI插入邊界序列來開發直接將跨越MEI和插入相鄰序列的序列可視化的核酸靶向探針。本文設想了包含跨越MEI和插入相鄰邊界序列的核酸序列的多種組合物。在一些情況下,這樣的組合物的一個共同方面是,它們包含對跨越MEI邊緣序列和插入相鄰基因組序列二者的序列具有特異性並且長度不足以單獨靶向MEI序列或插入相鄰序列的核酸組分。
也就是說,本文在許多情況下設想和公開的組合物在不存在插入相鄰序列的情況下不與MEI結合,並且在不存在相鄰MEI的情況下不與插入相鄰序列結合;確切地說,本文公開的組合物包含與包含MEI和相鄰基因組序列兩者的序列進行特異性結合的核酸組分。因此,在用這樣的組合物治療後,只有與MEI插入相鄰序列對應的核酸,例如本文公開的已經在時間或空間測定(例如,如上文公開的)中被鑑定為明顯過度表示的核酸,才會被該組合物所可視化,而其他MEI和包含插入相鄰序列但不含MEI序列的未插入的等位基因不被該組合物結合。在一些情況下,該組合物的核酸組分包含MEI序列的3、4、5、6、7、8、9、10個或超過10個鹼基,和插入相鄰序列的3、4、5、6、7、8、9、10個或超過10個鹼基,使得該組合物與單獨的MEI之間或者該組合物與單獨的插入相鄰序列之間的結合能不足以保證結合。
在一些實施方案中,與核酸結合的還有螢光團或其他可視化部分。在一些情況下,只有在核酸與底物結合時該部分才被可視化。例如,在一些情況下,探針包含螢光團和猝滅劑,使得在不存在與靶MEI插入相鄰位點的結合時,該猝滅部分阻止螢光,而在存在與靶MEI插入相鄰位點的結合時,該猝滅劑在空間上從螢光團上去除,使得該螢光團能夠在被激發劑激發時發射。
在一些情況下,使用探針來分析癌性組織的完全切除。將組織切除並與探針接觸。通過例如在經受具有與螢光團的激發譜匹配的電磁能的波長時在切除的組織中存在螢光來確認癌性組織。通過在經受具有與螢光團的激發譜匹配的電磁能的波長時不存在螢光來鑑定非癌性組織。多種激發裝置是本領域已知的,如在手術室環境中容易實用的手持激發裝置。
本領域已知,螢光團和其他染料的化學反應性衍生物可用作標記分子的報告分子。示例性的DNA結合報告分子包括但不限於:SeTau-380-NHS、羥基香豆素、氨基香豆素、甲氧基香豆素、瀑布藍(Cascade Blue)、太平洋藍(Pacific Blue)、太平洋橙(Pacific Orange)、SeTau-405-NHS、SeTau-405-馬來醯亞胺、螢光黃、SeTau-425-NHS、NBD、R-藻紅蛋白(PE)、Seta-PerCP-680、PE-Cy5綴合物、PE-Cy7綴合物、Red 613、PerCP、TruRed、FluorX、螢光素、BODIPY-FL、Cy2、Cy3、Seta-555-NHS、Seta-555-疊氮化物、Seta-555-DBCO、Seta-R-PE-670、Cy3B、Seta-580-NHS、Cy3.5、SeTau-647-NHS、Cy5、Seta-APC-780、Cy5.5、Seta-680-NHS、Cy7、TRITC、X-羅丹明、麗絲胺羅丹明B、德克薩斯紅(Texas Red)、別藻藍蛋白(APC)、APC-Cy7綴合物、Seta-780-NHS。
螢光團和其他報告分子可用來與結合DNA的探針結合。本領域已知,這樣的探針被設計用於增加定量PCR的特異性。例如,TaqMan探針原理依賴於Taq聚合酶的5′至3′核酸外切酶活性,以在與互補靶序列雜交和基於螢光團的檢測過程中切割雙標記的探針。所得到的螢光信號允許在PCR的指數階段定量測量產物的積累。
TaqMan探針由與寡核苷酸探針的5』-端共價附接的螢光團和在3』-端的猝滅劑組成。具有不同化學性質的其他探針是本領域已知的,並且包括但不限於6-羧基螢光素或四氯螢光素,和猝滅劑(例如,四甲基羅丹明)。經由FRET(螢光共振能量轉移),猝滅劑分子猝滅螢光團在被熱循環儀的光源激發時發射的螢光。只要螢光團和猝滅劑是接近的,猝滅就會抑制螢光信號。
在一些情況下,所述探針包含引導探針跨細胞膜、跨核膜或跨細胞膜和核膜二者易位的部分,使得便於接近組織核DNA。
此外,本文公開的一些實施方案涉及通過將樣品的MEI插入相鄰序列的譜與第二樣品的譜或已知參考譜進行比較來鑑定生物樣品如人類樣品、其他動物樣品、植物樣品或生物危害性樣品。使待確定其譜的樣品經歷例如通過全基因組測序或其他合適方法的MEI插入相鄰序列確定過程,並確定其單個MEI插入相鄰譜。在一些情況下,開發了引物組、探針組或引物組及探針組,使得在其他樣品中檢測樣品的MEI插入相鄰序列譜而無需依賴於全基因組測序。
獲得了與已開發出MEI插入相鄰譜的樣品具有相同物種和表型的未知來源的樣品。在一些情況下,該樣品是作物植物如轉基因作物植物的樣品,並且存在關於該作物植物種系的來源的某一問題。獲得了相同物種並且具有相同轉基因抗性的市售轉基因植物的譜,並將該譜與未知來源的樣品的MEI插入相鄰譜進行比較。通過將樣品的MEI插入相鄰序列與參考進行比較,確定樣品和參考是否來自最近共同的原種(stock)。
在備選的實施方案中,使用MEI插入相鄰譜來確定例如法醫樣品或者生物危害性材料如炭疽、鼠疫耶爾森氏菌(Yersinia pestris)、耐甲氧西林金黃色葡萄球菌(MRSA)或其他可武器化的生物材料的來源。
在一些實施方案中,將第二核酸樣品鑑定為不同於第一或參考核酸樣品包括確定所述第二核酸樣品是否缺少該第一核酸樣品中存在的MEI邊界序列。
在一些實施方案中,將所述第二核酸樣品鑑定為不同於所述第一核酸樣品包括確定所述第二核酸樣品是否包含在所述第一核酸樣品中不存在的MEI邊界序列。
在備選的實施方案中,通過靶向測序或通過全基因組測序或二者確定邊界序列。在一些情況下,使樣品接觸探針如上文討論的探針,或探針組,並且在一些情況下通過在與探針分子接觸後,單獨地、連續地或組合地評價探針激發時樣品的螢光來實現樣品鑑定。
儘管本文中已經示出並描述了本發明的優選實施方案,但對於本領域技術人員顯而易見的是,這些實施方案僅以示例的方式提供。本領域技術人員在不脫離本發明的情況下現將想到多種變化、改變和替代。應當理解,本文中所述的本發明實施方案的各種替代方案可用於實施本發明。目的在於以下述權利要求限定本發明的範圍,並由此涵蓋這些權利要求範圍內的方法和結構及其等同項。
實施例
實施例1.時間MEI監測。對來自個體的核酸樣品進行全基因組定量測序。鑑定到以每兩個單倍體基因組拷貝出現一次的頻率出現的MEI插入位點,表明產生MEI插入的事件很可能發生在個體的先祖種系中而不是個體的體細胞中。
鑑定到以每兩個單倍體基因組拷貝出現少於一次的頻率出現的MEI插入位點,表明該事件已在個體的一些但並非全部的體細胞中發生。檢查MEI插入位點,並確定一些MEI插入位點很可能已經破壞了其功能喪失與細胞周期調節、細胞生長調節或細胞分裂調節缺陷有關的基因。
隨時間監測MEI插入位點豐度。兩年後,來自實施例1的個體的核酸樣品從該個體的血液中取出。分析來自該個體的血液的核酸。
鑑定了MEI插入位點。觀察到第一MEI插入位點以與先前全基因組測序工作中觀察到的頻率相當的頻率出現。得出以下結論:MEI插入邊界本身與細胞周期調節、細胞生長調節或細胞分裂調節缺陷不相關。
觀察到第二MEI插入位點出現的頻率是先前全基因組測序工作中觀察到的頻率的10倍。得出以下結論:MEI插入邊界與細胞周期調節、細胞生長調節或細胞分裂調節缺陷相關。對該個體進行進一步的觀察,以尋找癌症或其他欠調節的細胞增殖缺陷,從中可以獲得DNA以確定腫瘤或其他細胞缺陷是否與MEI插入邊界對應。
鑑定了假定癌性組織。對來自假定癌性組織的核酸樣品進行全基因組定量測序。發現第二MEI插入位點出現的頻率是原始全基因組MEI調查中的頻率的100倍。
實施例2.時間MEI監測。來自實施例1的個體的核酸樣品從該個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。
將假定癌性腫瘤組織從該個體切除。按照該程序,來自實施例1的個體的第二核酸樣品從該個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率已回到原始全基因組MEI調查中的頻率。
實施例3.時間MEI監測。在切除假定癌性腫瘤組織後兩年,從個體的血液中取出來自實施例1和2的個體的核酸樣品。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率保持在原始全基因組MEI調查中的頻率。
在切除假定癌性腫瘤組織後四年,來自實施例1和2的個體的核酸樣品從個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率是原始全基因組MEI調查中的頻率的5倍。
對該個體進行進一步的觀察,以尋找癌症或其他欠調節的細胞增殖缺陷,從中可以獲得DNA以確定腫瘤或其他細胞缺陷是否與MEI插入邊界對應。
鑑定了假定癌性組織。對來自假定癌性組織的核酸樣品進行全基因組定量測序。發現第二MEI插入位點出現的頻率是原始全基因組MEI調查中的頻率的100倍。
將假定癌性腫瘤組織從該個體切除。按照該程序,從該個體的血液中取出核酸樣品。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率已回到原始全基因組MEI調查中的頻率。
實施例4.空間MEI監測。對來自患有腫瘤的個體的表型健康組織的第一核酸樣品進行全基因組定量測序。鑑定到以每兩個單倍體基因組拷貝出現少於一次的頻率出現的MEI插入位點,表明該事件已在個體的一些但並非全部的體細胞中發生。檢查了MEI插入位點,並確定一些MEI插入位點很可能已經破壞了其功能喪失與細胞周期調節、細胞生長調節或細胞分裂調節缺陷有關的基因。
對來自患有腫瘤的個體的腫瘤組織的第二核酸樣品進行全基因組定量測序。鑑定到以每兩個單倍體基因組拷貝出現少於一次的頻率出現的MEI插入位點,表明該事件已在個體的一些但並非全部的腫瘤細胞中發生。檢查了MEI插入位點,並確定一些MEI插入位點很可能已經破壞了其功能喪失與細胞周期調節、細胞生長調節或細胞分裂調節缺陷有關的基因。
檢查了插入位點的相對和絕對豐度。觀察到一些MEI插入位點以與在來源於個體的表型健康組織的核酸樣品中發現的頻率相當的相對和絕對頻率出現。得出以下結論:這些位點與細胞周期調節、細胞生長調節或細胞分裂調節缺陷不相關。
鑑定了對腫瘤組織核酸樣品獨特的MEI位點。一些腫瘤特異性MEI插入位點以低豐度出現在腫瘤組織核酸樣品中。得出以下結論:這些MEI插入與腫瘤活性不相關。
在整個腫瘤組織核酸樣品中發現一些MEI插入位點。得出以下結論:這些MEI插入位點對於細胞周期調節、細胞生長調節或細胞分裂調節缺陷的顯現是必需的。然而,它們在非腫瘤核酸樣品中的相對豐富的存在表明,其本身不表明與腫瘤活性相關的細胞周期調節、細胞生長調節或細胞分裂調節缺陷的存在。
一些MEI插入位點在整個腫瘤組織核酸樣品中以非常高的頻率被發現,而在非腫瘤核酸樣品中以非常低的頻率被發現。得出以下結論:這些MEI插入位點指示與腫瘤活性相關的細胞周期調節、細胞生長調節或細胞分裂調節缺陷的顯現。
實施例5.特異性MEI插入邊界靶向。將來自實施例2-3的MEI插入邊界用作藥物幹預的源頭。開發了包含MEI插入序列和插入相鄰基因組序列的核酸分子。將該分子封裝到CRISPR核酸靶向複合物中,該複合物特異性地引導內切核酸酶切割與MEI插入序列和插入相鄰基因組序列相鄰的核酸,而不切割其他MEI插入位點。
實施例6.排除具有與假定癌性組織相關的MEI插入邊界的細胞的治療幹預。在切除假定癌性腫瘤組織後兩年,來自實施例1和2的個體的核酸樣品從個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率保持在原始全基因組MEI調查中的頻率。
在切除假定癌性腫瘤組織後四年,來自實施例1和2的個體的核酸樣品從個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率是原始全基因組MEI調查中的頻率的5倍。
對該個體進行進一步的觀察,以尋找癌症或其他欠調節的細胞增殖缺陷,從中可以獲得DNA以確定腫瘤或其他細胞缺陷是否與MEI插入邊界對應。
鑑定了假定癌性組織。對來自假定癌性組織的核酸樣品進行全基因組定量測序。發現第二MEI插入位點出現的頻率是原始全基因組MEI調查中的頻率的100倍。
用包含實施例5的靶向MEI插入邊界的藥物的治療方案治療該個體。觀察到假定癌性組織經歷特異性細胞死亡。
按照該程序,從該個體的血液中取出核酸樣品。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率已回到原始全基因組MEI調查中的頻率。
實施例7.排除具有與假定癌性組織相關的MEI插入邊界的細胞的治療幹預。在切除假定癌性腫瘤組織後兩年,來自實施例1和2的個體的核酸樣品從個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率保持在原始全基因組MEI調查中的頻率。
在切除假定癌性腫瘤組織後四年,來自實施例1和2的個體的核酸樣品從個體的血液中取出。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率是原始全基因組MEI調查中的頻率的5倍。
對該個體進行進一步的觀察,以尋找癌症或其他欠調節的細胞增殖缺陷,從中可以獲得DNA以確定腫瘤或其他細胞缺陷是否與MEI插入邊界對應。
沒有鑑定出假定癌性組織。
用包含實施例5的靶向MEI插入邊界的藥物的治療方案治療該個體。
按照該程序,從該個體的血液中取出核酸樣品。分析了來自該個體的血液的核酸,並確定了相對和絕對的MEI插入位點頻率。觀察到第二MEI插入位點的頻率已回到原始全基因組MEI調查中的頻率。
實施例8.年齡特異性基因組衰老的監測。對來自個體的核酸樣品進行全基因組定量測序。鑑定到以每兩個單倍體基因組拷貝出現一次的頻率出現的MEI插入位點,表明產生MEI插入的事件很可能發生在個體的先祖種系中而不是個體的體細胞中。
鑑定到以每兩個單倍體基因組拷貝出現少於一次的頻率出現的MEI插入位點,表明該事件已在個體的一些但並非全部的體細胞中發生。檢查了MEI插入位點,並確定一些MEI插入位點很可能已經破壞了其功能喪失與細胞周期調節、細胞生長調節或細胞分裂調節缺陷有關的基因。
隨時間監測MEI插入位點豐度。五年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與在初始全基因組定量測序後觀察到的相當的相對頻率和相對豐度出現。
十年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與在初始全基因組定量測序後觀察到的豐度相當的相對豐度出現。然而,觀察到已發生新的MEI插入事件,使插入位點的總數上升至2倍。
推薦包含卡路裡限制的抗老化方案。
15年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與十年時觀察到的豐度相當的相對豐度出現,表明MEI插入位點頻率的增加沒有持續。
實施例9.年齡特異性基因組衰老的監測。對來自個體的核酸樣品進行全基因組定量測序。鑑定到以每兩個單倍體基因組拷貝出現一次的頻率出現的MEI插入位點,表明產生MEI插入的事件很可能發生在個體的先祖種系中而不是個體的體細胞中。
鑑定到以每兩個單倍體基因組拷貝出現少於一次的頻率出現的MEI插入位點,表明該事件已在個體的一些但並非全部的體細胞中發生。檢查了MEI插入位點,並確定一些MEI插入位點很可能已經破壞了其功能喪失與細胞周期調節、細胞生長調節或細胞分裂調節缺陷有關的基因。
隨時間監測MEI插入位點豐度。五年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與在初始全基因組定量測序後觀察到的相當的相對頻率和相對豐度出現。
十年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與在初始全基因組定量測序後觀察到的豐度相當的相對豐度出現。然而,觀察到已發生新的MEI插入事件,使插入位點的總數上升至2倍。
隨後是包含逆轉錄酶抑制劑治療的抗老化方案。
15年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與十年時觀察到的豐度相當的相對豐度出現,表明MEI插入位點頻率的增加沒有持續。
實施例10.年齡特異性基因組衰老的監測。對來自個體的核酸樣品進行全基因組定量測序。鑑定到以每兩個單倍體基因組拷貝出現一次的頻率出現的MEI插入位點,表明產生MEI插入的事件很可能發生在個體的先祖種系中而不是個體的體細胞中。
鑑定到以每兩個單倍體基因組拷貝出現少於一次的頻率出現的MEI插入位點,表明該事件已在個體的一些但並非全部的體細胞中發生。檢查了MEI插入位點,並確定一些MEI插入位點很可能已經破壞了其功能喪失與細胞周期調節、細胞生長調節或細胞分裂調節缺陷有關的基因。
隨時間監測MEI插入位點豐度。五年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與在初始全基因組定量測序後觀察到的相當的相對頻率和相對豐度出現。
十年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與在初始全基因組定量測序後觀察到的豐度相當的相對豐度出現。然而,觀察到已發生新的MEI插入事件,使插入位點的總數上升至2倍。
隨後是包含逆轉錄病毒抑制劑治療的抗老化方案。
15年後,從個體的血液中取出該個體的核酸樣品。分析來自該個體的血液的核酸。
觀察到MEI插入位點以與十年時觀察到的豐度相當的相對豐度出現,表明MEI插入位點頻率的增加沒有持續。
