擬肽大環化合物的製作方法
2023-10-11 20:26:50
本申請是2013年02月14日提交的發明名稱為「擬肽大環化合物」的第201380009782.9號(國際申請號pct/us2013/026238)中國專利申請的分案申請。
序列表
本申請包含序列表,該序列表已經由efs-web以ascii格式提交。於2013年3月20日創建的所述ascii拷貝被命名為35224-766.601_sl.txt,大小為1,201,625位元組。
背景技術:
人轉錄因子蛋白質p53響應於dna損傷和細胞應激而誘導細胞周期停滯和凋亡,從而在保護細胞免於惡性轉化方面發揮關鍵作用。e3遍在蛋白連接酶mdm2(也稱為hdm2)通過中和p53反式激活活性的直接結合相互作用而負調節p53的功能,導致p53蛋白質從核輸出,並經由遍在蛋白化-蛋白酶體途徑使p53降解。由缺失、突變或mdm2過表達而引起的p53活性喪失是人類癌症的最常見缺陷。表達野生型p53的腫瘤易受到穩定或提高活性p53濃度的藥劑的攻擊。在此背景下,已出現了對mdm2活性的抑制,作為經過驗證的、用於在體外和體內恢復p53活性並使癌細胞再次對凋亡敏感的方法。mdmx(mdm4)最近已被鑑定為p53的相似的負調節劑,並且研究顯示在mdm2和mdmx的p53結合界面之間具有顯著的結構同源性。p53-mdm2和p53-mdmx的蛋白質-蛋白質相互作用由p53的同一個15個殘基的α螺旋反式激活域介導,所述α螺旋反式激活域插入mdm2和mdmx的表面上的疏水性裂隙內。p53的這個域內的三個殘基(f19、w23和l26)對與mdm2和mdmx的結合至關重要。
對於能夠與p53、mdm2和/或mdmx結合併調節其活性的化合物存在相當大的需求。本文提供了能調節p53活性的基於p53的擬肽大環化合物。本文還提供了能抑制p53、mdm2和/或mdmx蛋白之間相互作用的基於p53的擬肽大環化合物。此外,本文提供了能夠用於治療包括但不限於癌症和其它高增生性疾病的疾病的基於p53的擬肽大環化合物。
技術實現要素:
本文描述了與人p53的一部分相關的穩定交聯的肽(「p53擬肽大環化合物」)。這些交聯的肽含有至少兩個經修飾的胺基酸,這些胺基酸一起形成分子內交聯,該分子內交聯可幫助穩定被認為對於p53與mdm2的結合和p53與mdmx的結合至關重要的p53一部分的α螺旋二級結構。因此,本文描述的交聯多肽可具有相對於對應的非交聯多肽改善的生物活性。據認為,p53擬肽大環化合物幹擾p53與mdm2和/或p53與mdmx的結合,從而釋放功能性p53並抑制其破壞。本文描述的p53擬肽大環化合物可治療性地使用,例如用來治療以不希望的低p53水平或低p53活性為特徵的癌症和其它病症,以及/或者用來治療以不希望的高水平mdm2或mdmx活性為特徵的癌症和其它病症。p53擬肽大環化合物也可用於治療與遭到破壞的p53轉錄途徑的調節相關的任何病症(這種遭到破壞的調節導致過量細胞存活和增殖的病狀,如癌症和自身免疫病),以及不適當的細胞周期停滯和凋亡的病狀,如神經變性和免疫缺陷。在一些實施方案中,p53擬肽大環化合物與mdm2(例如,登錄號:228952;gi:228952)和/或mdmx(也被稱為mdm4;登錄號:88702791;gi:88702791)結合。
在一個方面,本文提供一種擬肽大環化合物,其包含的胺基酸序列與選自表1、表1a、表1b或表1c中胺基酸序列的胺基酸序列至少約60%、80%、90%或95%相同。或者,所述擬肽大環化合物的胺基酸序列選自表4中的胺基酸序列。在一些實施方案中,該擬肽大環化合物不是如表2a或2b所示的肽。在其它情況下,該擬肽大環化合物不包含如表2a或2b所示的結構。在一些實施方案中,該擬肽大環化合物具有選自表1的胺基酸序列。在一些實施方案中,該擬肽大環化合物具有選自表1a的胺基酸序列。在一些實施方案中,該擬肽大環化合物具有選自表1b的胺基酸序列。在一些實施方案中,該擬肽大環化合物具有選自表1c的胺基酸序列。
或者,所述擬肽大環化合物的胺基酸序列如上所述進行選擇,並且進一步其中該大環化合物不包括硫醚或三唑。在一些實施方案中,擬肽大環化合物包含螺旋,如α-螺旋。在其它實施方案中,擬肽大環化合物包含α,α-二取代的胺基酸。擬肽大環化合物可包含連接至少兩個胺基酸的α-位的交聯體(crosslinker)。所述兩個胺基酸中的至少一個可以是α,α-二取代的胺基酸。
在一些實施方案中,提供了下式的擬肽大環化合物:
其中:
各個a、c、d和e獨立地為胺基酸;
b為胺基酸、[-nh-l3-co-]、[-nh-l3-so2-]或[-nh-l3-];
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2和l3獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v和w獨立地為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
u為1-10的整數,例如1-5、1-3或1-2;
x、y和z獨立地為0-10的整數,例如x+y+z之和為2、3或6;且
n為1-5的整數。
在一些實施方案中,w>2並且由e表示的前兩個胺基酸中的每一個包含不帶電荷的側鏈或帶負電荷的側鏈。
在一些實施方案中,由e代表的第一c-末端胺基酸和/或第二c-末端胺基酸包含疏水性側鏈。例如,由e代表的第一c-末端胺基酸和/或第二c-末端胺基酸包含疏水性側鏈,例如大的疏水性側鏈。
在一些實施方案中,w為3-1000。例如,由e代表的第三胺基酸包含大的疏水性側鏈。
在其它實施方案中,請求保護的擬肽大環化合物不包括以下序列:
ac-rtqatf$r8nqwaibanle$tnaibtr-nh2(seqidno:1),
ac-rtqatf$r8nqwaibanle$tnaibtr-nh2(seqidno:2),
ac-$r8sqqtfs$lwrllaibqn-nh2(seqidno:3),
ac-qsq$r8tfsnlw$llaibqn-nh2(seqidno:4),
ac-qs$r5qtfstnlw$llaibqn-nh2(seqidno:5),或
ac-qsqq$r8fsnlwr$laibqn-nh2(seqidno:6)。
在其它實施方案中,請求保護的擬肽大環化合物不包括以下序列:
ac-q$r8qqtfsn$wrllaibqn-nh2(seqidno:7)。
還提供了下式的擬肽大環化合物:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的至少三個是與序列phe3-x4-his5-tyr6-trp7-ala8-gln9-leu10-x11-ser12(seqidno:8)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成接連體;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
w為3-1000的整數,例如3-500、3-200、3-100、3-50、3-30、3-20或3-10;且
n為1-5的整數。
在一些實施方案中,擬肽大環化合物具有下式:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的至少三個是與序列phe3-x4-glu5-tyr6-trp7-ala8-gln9-leu10/cba10-x11-ala12(seqidno:9)的相應位置處的胺基酸相同的胺基酸,其中每個x為胺基酸;
各個d獨立地為胺基酸;
各個e獨立地為胺基酸,例如選自ala(丙氨酸)、d-ala(d-丙氨酸)、aib(α-氨基異丁酸)、sar(n-甲基甘氨酸)和ser(絲氨酸)的胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
w為3-1000的整數,例如3-500、3-200、3-100、3-50、3-30、3-20或3-10;且
n為1-5的整數。
在一些實施方案中,擬肽大環化合物具有下式:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa8、xaa9和xaa10中的至少兩個是與序列phe3-x4-glu5-tyr6-trp7-ala8-gln9-leu10/cba10-x11-ala12(seqidno:9)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體,其中l在e構型中包含至少一個雙鍵;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數;
w為3-1000的整數;
n為1-5的整數;且
xaa7為boc-保護的色氨酸。
在本文所述的任何通式的一些實施方案中,[d]v為–leu1-thr2。在本文所述的通式的其它實施方案中,除由e表示的第三胺基酸以外的各個e為選自ala(丙氨酸)、d-ala(d-丙氨酸)、aib(α-氨基異丁酸)、sar(n-甲基甘氨酸)和ser(絲氨酸)的胺基酸。
在一些實施方案中,w為3-10的整數,例如3-6、3-8、6-8或6-10。在一些實施方案中,w為3。在其它實施方案中,w為6。在一些實施方案中,v為1-10的整數,例如2-5。在一些實施方案中,v為2。
在一些實施方案中,本文公開的肽結合至少部分由mdmx胺基酸側鏈所限定的結合位點l17、v46、m50、y96(形成口袋的邊緣)和l99。不受理論的束縛,與這樣的結合位點的結合改善了一種或多種性質,如結合親和力、凋亡的誘導、體內或體外抗腫瘤效力,或降低的mdmx結合親和力與mdm2結合親和力之比。
在一些實施方案中,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的對mdm2或mdmx的結合親和力。在其它情況下,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有降低的mdmx結合親和力與mdm2結合親和力之比。在另外其它的情況下,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的針對p53陽性腫瘤細胞系的體外抗腫瘤效力。在一些實施方案中,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物在p53陽性腫瘤細胞系中顯示出改善的體外凋亡誘導。在其它情況下,權利要求1的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的針對p53陽性腫瘤細胞系與針對p53陰性或突變腫瘤細胞系的體外抗腫瘤效力比。在一些情況下,該改善的體外效力比為1-29、≥30-49或≥50。在另外其它的情況下,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的針對p53陽性腫瘤的體內抗腫瘤效力。在一些情況下,該改善的體內效力比為-29、≥30-49或≥50。在另外其它的情況下,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物在p53陽性腫瘤中具有改善的體內凋亡誘導。在一些實施方案中,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的細胞透性。在其它情況下,該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的溶解度。
在一些實施方案中,xaa5為glu或其胺基酸類似物。在一些實施方案中,xaa5為glu或其胺基酸類似物,並且其中該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有改善的性質,如改善的結合親和力、改善的溶解度、改善的細胞效力、改善的細胞透性、改善的體內或體外抗腫瘤效力,或改善的凋亡誘導。
在一些實施方案中,該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有改善的對mdm2或mdmx的結合親和力。在其它實施方案中,該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有降低的mdmx結合親和力與mdm2結合親和力之比。在一些實施方案中,該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有改善的溶解度,或者該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有改善的細胞效力。
在一些實施方案中,xaa5為glu或其胺基酸類似物,並且其中該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有改善的生物活性,如改善的結合親和力、改善的溶解度、改善的細胞效力、改善的螺旋度、改善的細胞透性、改善的體內或體外抗腫瘤效力,或改善的凋亡誘導。
在一些實施方案中,該擬肽大環化合物具有針對p53+/+細胞系的活性,該活性為針對p53-/-細胞系的結合親和力的至少2倍、3倍、5倍、10倍、20倍、30倍、50倍、70倍或100倍。在一些實施方案中,該擬肽大環化合物具有針對p53+/+細胞系的活性,該活性為針對p53-/-細胞系的結合親和力的1-29倍、30-49倍或≥50倍。例如,活性可以作為ic50值進行測定。例如,該p53+/+細胞係為sjsa-1、rko、hct-116或mcf-7,且該p53-/-細胞係為rko-e6或sw-480。在一些實施方案中,該肽具有小於1μm的針對p53+/+細胞系的ic50。
在一些實施方案中,xaa5為glu或其胺基酸類似物,並且該擬肽大環化合物具有的針對p53+/+細胞系的活性至少為其針對p53-/-細胞系的結合親和力的10倍。
另外,提供了一種治療受試者的癌症的方法,包括向該受試者施用擬肽大環化合物。在一些實施方案中,該癌症為頭頸癌、黑素瘤、肺癌、乳腺癌或神經膠質瘤。
還提供了一種調節受試者中的p53或mdm2或mdmx的活性的方法,包括向該受試者施用擬肽大環化合物,或者一種拮抗受試者中的p53與mdm2和/或mdmx蛋白質之間的相互作用的方法,包括向該受試者施用這樣的擬肽大環化合物。
本文提供了一種製備包含式(i)的擬肽大環化合物的組合物的方法:
該擬肽大環化合物包含與選自表1、表1a、表1b或表1c中的胺基酸序列的胺基酸序列約60%至約100%相同的胺基酸序列,該方法包括用催化劑處理式(ii)的化合物:
以產生式i的化合物
其中,在式(i)和(ii)的化合物中,
各個a、c、d和e獨立地為胺基酸;
各個b獨立地為胺基酸、[-nh-l3-co-]、[-nh-l3-so2-]或[-nh-l3-];
各個r1和r2獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個r3獨立地為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個l』獨立地為式–l1–l2–的大環形成連接體;
各個l1、l2和l3獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
各個r4和r4』獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k獨立地為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
各個r7獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
各個r8獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
各個v和w獨立地為1-1000的整數;
u為1-10的整數;
各個x、y和z獨立地為0-10的整數;
各個n獨立地為1-5的整數;
各個o獨立地為1-15的整數;
各個p獨立地為1-15的整數;
「(e)」表示反式雙鍵;且
式(i)和(ii)化合物中存在的胺基酸a、c和/或b(當b為胺基酸時)中的一個或多個具有攜帶保護基團的側鏈。
在一些實施方案中,該保護基團是氮原子保護基團。
在一些實施方案中,該保護基團為boc基團。
在一些實施方案中,所述攜帶保護基團的胺基酸的側鏈包含受保護的吲哚。
在一些實施方案中,在其側鏈上攜帶所述保護基團的胺基酸為在其吲哚氮上被保護基團所保護的色氨酸(w)。例如,該保護基基團為boc基團。
在一些實施方案中,在式ii的化合物與催化劑接觸的步驟後,以等於或高於為z異構體的對應化合物的量獲得式(i)的化合物。例如,在式ii的化合物與催化劑接觸的步驟後,以2、3、4、5、6、7、8、9或10倍於為z異構體的對應化合物的量獲得式(i)的化合物。
在一些實施方案中,所述催化劑為釕催化劑。
在一些實施方案中,所述方法進一步包括用還原劑或氧化劑處理式(i)的化合物的步驟。
在一些實施方案中,式(ii)的化合物附著到固體載體上。在其它實施方案中,式(ii)的化合物不附著到固體載體上。
在一些實施方案中,所述方法進一步包括從式(i)的化合物上除去保護基團。
在一些實施方案中,在約20℃至約80℃的溫度下進行閉環複分解反應。
在一些實施方案中,式(i)的擬肽大環化合物具有下式:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa8、xaa9和xaa10中的至少兩個是與序列phe3-x4-his5-tyr6-trp7-ala8-gln9-leu10-x11-ser12(seqidno:8)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體,其中l在e構型中包含至少一個雙鍵;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數;
w為3-1000的整數;
n為1-5的整數;且
xaa7為boc-保護的色氨酸。
在一些實施方案中,式(i)的擬肽大環化合物包含α-螺旋。
具體而言,本發明涉及:
1.下式的擬肽大環化合物:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的至少三個是與序列phe3-x4-his5-tyr6-trp7-ala8-gln9-leu10-x11-ser12(seqidno:8)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
w為3-1000的整數,例如3-500、3-200、3-100、3-50、3-30、3-20或3-10;且
n為1-5的整數。
2.下式的擬肽大環化合物:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的至少三個是與序列phe3-x4-glu5-tyr6-trp7-ala8-gln9-leu10/cba10-x11-ala12(seqidno:9)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
w為3-1000的整數,例如3-500、3-200、3-100、3-50、3-30、3-20或3-10;且
n為1-5的整數。
3.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的對mdm2或mdmx的結合親和力。
4.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有降低的mdmx結合親和力與mdm2結合親和力之比。
5.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的針對p53陽性腫瘤細胞系的體外抗腫瘤效力。
6.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物在p53陽性腫瘤細胞系中顯示出改善的體外凋亡誘導。
7.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的針對p53陽性腫瘤細胞系與針對p53陰性或突變腫瘤細胞系的體外抗腫瘤效力比。
8.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的針對p53陽性腫瘤的體內抗腫瘤效力。
9.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物在p53陽性腫瘤中具有改善的體內凋亡誘導。
10.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的細胞透性。
11.如段1或2所述的擬肽大環化合物,其中該擬肽大環化合物相對於其中w為0、1或2的對應擬肽大環化合物具有改善的溶解度。
12.如段1-11中任一段所述的擬肽大環化合物,其中xaa5為glu或其胺基酸類似物。
13.如段12所述的擬肽大環化合物,其中xaa5為glu或其胺基酸類似物,並且其中該擬肽大環化合物相對於其中xaa5為ala的對應擬肽大環化合物具有改善的性質,如改善的結合親和力、改善的溶解度、改善的細胞效力、改善的螺旋度、改善的細胞透性、改善的體內或體外抗腫瘤效力,或改善的凋亡誘導。
14.如段1或2所述的擬肽大環化合物,其中各個e獨立地為選自ala(丙氨酸)、d-ala(d-丙氨酸)、aib(α-氨基異丁酸)、sar(n-甲基甘氨酸)和ser(絲氨酸)的胺基酸。
15.如段1或2所述的擬肽大環化合物,其中[d]v為–leu1-thr2。
16.如前述段中任一段所述的擬肽大環化合物,其中w為3-10。
17.如段16所述的擬肽大環化合物,其中w為3-6。
18.如段16所述的擬肽大環化合物,其中w為6-10。
19.如段16所述的擬肽大環化合物,其中w為6。
20.如前述段中任一段所述的擬肽大環化合物,其中v為1-10。
21.如段20所述的擬肽大環化合物,其中v為2-10。
22.如段20所述的擬肽大環化合物,其中v為2-5。
23.如段20所述的擬肽大環化合物,其中v為2。
24.一種擬肽大環化合物,其包含與選自表1、表1a、表1b或表1c中的胺基酸序列的胺基酸序列至少約60%相同的胺基酸序列,其中該擬肽大環化合物具有下式:
其中:
各個a、c、d和e獨立地為胺基酸;
b為胺基酸、[-nh-l3-co-]、[-nh-l3-so2-]或[-nh-l3-];
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2和l3獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v和w獨立地為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
u為1-10的整數,例如1-5、1-3或1-2;
x、y和z獨立地為0-10的整數,例如x+y+z之和為2、3或6;
n為1-5的整數;並且
其中該擬肽大環化合物不是表2a或2b的擬肽大環化合物。
25.如段24所述的擬肽大環化合物,其中各個e獨立地為選自ala(丙氨酸)、d-ala(d-丙氨酸)、aib(α-氨基異丁酸)、sar(n-甲基甘氨酸)和ser(絲氨酸)的胺基酸。
26.如段24所述的擬肽大環化合物,其中[d]v為–leu1-thr2。
27.一種擬肽大環化合物,其包含與選自表1、表1a、表1b或表1c中的胺基酸序列的胺基酸序列至少約60%相同的胺基酸序列,其中該擬肽大環化合物具有下式:
其中:
各個a、c、d和e獨立地為胺基酸;
b為胺基酸、[-nh-l3-co-]、[-nh-l3-so2-]或[-nh-l3-];
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2和l3獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v和w獨立地為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
u為1-10的整數,例如1-5、1-3或1-2;
x、y和z獨立地為0-10的整數,例如x+y+z之和為6;
n為1-5的整數;
其中w>2並且由e表示的前兩個胺基酸中的每一個包含不帶電荷的側鏈或帶負電荷的側鏈,
條件是該擬肽大環化合物不是表2a的擬肽大環化合物並且不具有以下序列:
ac-rtqatf$r8nqwaibanle$tnaibtr-nh2(seqidno:1),
ac-$r8sqqtfs$lwrllaibqn-nh2(seqidno:3),
ac-qsq$r8tfsnlw$llaibqn-nh2(seqidno:4),
ac-qs$r5qtfstnlw$llaibqn-nh2(seqidno:5),或
ac-qsqq$r8fsnlwr$laibqn-nh2(seqidno:6),
其中aib表示2-氨基異丁酸,$表示通過包含一個雙鍵的全碳交聯體連接的α-mes5-戊烯基-丙氨酸烯烴胺基酸,$r5表示通過包含一個雙鍵的全碳交聯體連接的α-mer5-戊烯基-丙氨酸烯烴胺基酸,且$r8表示通過包含一個雙鍵的全碳交聯體連接的α-mer88-辛烯基-丙氨酸烯烴胺基酸。
28.如段27所述的擬肽大環化合物,其中各個e獨立地為選自ala(丙氨酸)、d-ala(d-丙氨酸)、aib(α-氨基異丁酸)、sar(n-甲基甘氨酸)和ser(絲氨酸)的胺基酸。
29.如段27所述的擬肽大環化合物,其中[d]v為–leu1-thr2。
30.如段27所述的擬肽大環化合物,其中由e表示的第一c-末端胺基酸和/或第二c-末端胺基酸包含疏水性側鏈。
31.如段30所述的擬肽大環化合物,其中所述疏水性鏈為大的疏水性側鏈。
32.一種擬肽大環化合物,其包含與選自表1、表1a、表1b或表1c中的胺基酸序列的胺基酸序列至少約60%相同的胺基酸序列,其中該擬肽大環化合物具有下式:
其中:
各個a、c、d和e獨立地為胺基酸;
b為胺基酸、[-nh-l3-co-]、[-nh-l3-so2-]或[-nh-l3-];
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個l或l』獨立地為式–l1–l2–的大環形成連接體;
l1和l2和l3獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v和w獨立地為1-1000的整數,例如1-500、1-200、1-100、1-50、1-30、1-20或1-10;
u為1-10的整數,例如1-5、1-3或1-2;
x、y和z獨立地為0-10的整數,例如x+y+z之和為6;
n為1-5的整數;並且
w>2,其中由e表示的第三胺基酸中的每一個包含大的疏水性側鏈,
條件是該擬肽大環化合物不是表2a的擬肽大環化合物並且不具有以下序列:
ac-q$r8qqtfsn$wrllaibqn-nh2(seqidno:7)。
33.如段32所述的擬肽大環化合物,其中除由e表示的第三胺基酸之外的各個e為選自ala(丙氨酸)、d-ala(d-丙氨酸)、aib(α-氨基異丁酸)、sar(n-甲基甘氨酸)和ser(絲氨酸)的胺基酸。
34.如段32所述的擬肽大環化合物,其中[d]v為–leu1-thr2。
35.如段32-34中任一段所述的擬肽大環化合物,其中由e表示的前兩個胺基酸中的每一個包含不帶電荷的側鏈或帶負電荷的側鏈。
36.如段32-34中任一段所述的擬肽大環化合物,其中由e表示的第三胺基酸為選自異亮氨酸(i)、亮氨酸(l)、甲硫氨酸(m)、苯丙氨酸(f)、色氨酸(w)和酪氨酸(y)的胺基酸。
37.如段1至36中任一段所述的擬肽大環化合物,其中l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基或亞雜環芳基,它們各自任選地被r5取代。
38.如段1至36中任一段所述的擬肽大環化合物,其中l1和l2獨立地為亞烷基或亞烯基。
39.如段1至36中任一段所述的擬肽大環化合物,其中l為亞烷基、亞烯基或亞炔基。
40.如段39所述的擬肽大環化合物,其中l為亞烷基。
41.如段40所述的擬肽大環化合物,其中l為c3-c16亞烷基。
42.如段41所述的擬肽大環化合物,其中l為c10-c14亞烷基。
43.如任一前述段所述的擬肽大環化合物,其中r1和r2獨立地為-h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素-取代。
44.如任一前述段所述的擬肽大環化合物,其中r1和r2為h。
45.如任一前述段所述的擬肽大環化合物,其中r1和r2獨立地為烷基。
46.如段45所述的擬肽大環化合物,其中r1和r2為甲基。
47.如任一前述段所述的擬肽大環化合物,其中x+y+z=6。
48.如任一前述段所述的擬肽大環化合物,其中u為1。
49.如任一前述段所述的擬肽大環化合物,其中該擬肽大環化合物不是表2a或表2b的擬肽大環化合物。
50.如任一前述段所述的擬肽大環化合物,其中各個e為ser或ala或其類似物。
51.如任一前述段所述的擬肽大環化合物,其包含至少一種為胺基酸類似物的胺基酸。
52.下式的擬肽大環化合物:
(seqidno:163)
或其藥學上可接受的鹽。
53.下式的擬肽大環化合物:
(seqidno:124)
或其藥學上可接受的鹽。
54.下式的擬肽大環化合物:
(seqidno:123)
或其藥學上可接受的鹽。
55.下式的擬肽大環化合物:
(seqidno:108)
或其藥學上可接受的鹽。
56.下式的擬肽大環化合物:
(seqidno:397)
或其藥學上可接受的鹽。
57.下式的擬肽大環化合物:
(seqidno:340)
或其藥學上可接受的鹽。
58.下式的擬肽大環化合物:
(seqidno:454)
或其藥學上可接受的鹽。
59.下式的擬肽大環化合物:
(seqidno:360)
或其藥學上可接受的鹽。
60.下式的擬肽大環化合物:
(seqidno:80)
或其藥學上可接受的鹽。
61.下式的擬肽大環化合物:
(seqidno:78)
或其藥學上可接受的鹽。
62.下式的擬肽大環化合物:
(seqidno:16)
或其藥學上可接受的鹽。
63.下式的擬肽大環化合物:
(seqidno:169)
或其藥學上可接受的鹽。
64.下式的擬肽大環化合物:
(seqidno:324)
或其藥學上可接受的鹽。
65.下式的擬肽大環化合物:
(seqidno:258)
或其藥學上可接受的鹽。
66.下式的擬肽大環化合物:
(seqidno:446)
或其藥學上可接受的鹽。
67.下式的擬肽大環化合物:
(seqidno:358)
或其藥學上可接受的鹽。
68.下式的擬肽大環化合物:
(seqidno:464)
或其藥學上可接受的鹽。
69.下式的擬肽大環化合物:
(seqidno:466)
或其藥學上可接受的鹽。
70.下式的擬肽大環化合物:
(seqidno:467)
或其藥學上可接受的鹽。
71.下式的擬肽大環化合物:
(seqidno:376)
或其藥學上可接受的鹽。
72.下式的擬肽大環化合物:
(seqidno:471)
或其藥學上可接受的鹽。
73.下式的擬肽大環化合物:
(seqidno:473)
或其藥學上可接受的鹽。
74.下式的擬肽大環化合物:
(seqidno:475)
或其藥學上可接受的鹽。
75.下式的擬肽大環化合物:
(seqidno:476)
或其藥學上可接受的鹽。
76.下式的擬肽大環化合物:
(seqidno:481)
或其藥學上可接受的鹽。
77.下式的擬肽大環化合物:
(seqidno:482)
或其藥學上可接受的鹽。
78.下式的擬肽大環化合物:
(seqidno:487)
或其藥學上可接受的鹽。
79.下式的擬肽大環化合物:
(seqidno:572)
或其藥學上可接受的鹽。
80.下式的擬肽大環化合物:
(seqidno:572)
或其藥學上可接受的鹽。
81.下式的擬肽大環化合物:
(seqidno:1500)
或其藥學上可接受的鹽。
82.一種治療受試者的癌症的方法,其包括向該受試者施用如任一前述段所述的擬肽大環化合物。
83.如段84所述的方法,其中所述癌症選自頭頸癌、黑素瘤、肺癌、乳腺癌和神經膠質瘤。
84.一種調節受試者中的p53和/或mdm2和/或mdmx活性的方法,其包括向該受試者施用如任一前述段所述的擬肽大環化合物。
85.一種拮抗受試者中的p53與mdm2之間和/或p53與mdmx蛋白之間的相互作用的方法,其包括向該受試者施用如任一前述段所述的擬肽大環化合物。
86.一種製備包含式(i)的擬肽大環化合物的組合物的方法:
該擬肽大環化合物包含與選自表1、表1a、表1b或表1c中的胺基酸序列的胺基酸序列約60%至約100%相同的胺基酸序列,該方法包括用催化劑處理式(ii)的化合物:
以產生式i的化合物
其中,在式(i)和(ii)的化合物中
各個a、c、d和e獨立地為胺基酸;
各個b獨立地為胺基酸、[-nh-l3-co-]、[-nh-l3-so2-]或[-nh-l3-];
各個r1和r2獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個r3獨立地為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個l』獨立地為式–l1–l2–的大環形成連接體;
各個l1、l2和l3獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
各個r4和r4』獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k獨立地為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
各個r7獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
各個r8獨立地為氫、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
各個v和w獨立地為1-1000的整數;
u為1-10的整數;
各個x、y和z獨立地為0-10的整數;
各個n獨立地為1-5的整數;
各個o獨立地為1-15的整數;
各個p獨立地為1-15的整數;
「(e)」表示反式雙鍵;且
式(i)和(ii)化合物中存在的胺基酸a、c和/或當b為胺基酸時的b中的一個或多個具有攜帶保護基團的側鏈。
87.如段86所述的方法,其中所述保護基團為氮原子保護基團。
88.如段86-87中任一段所述的方法,其中所述保護基團為boc基團。
89.如段87-88中任一段所述的方法,其中所述攜帶保護基團的胺基酸的側鏈包含受保護的吲哚。
90.如段89所述的方法,其中所述在其側鏈上攜帶所述保護基團的胺基酸為在其吲哚氮上被保護基團所保護的色氨酸(w)。
91.如段90所述的方法,其中所述在其側鏈上攜帶所述保護基團的胺基酸為在其吲哚氮上被boc基團所保護的色氨酸(w)。
92.如段86-91中任一段所述的方法,其中在式ii的化合物與催化劑接觸的步驟後,以等於或高於為z異構體的對應化合物的量獲得式(i)的化合物。
93.如段92所述的方法,其中在式ii的化合物與催化劑接觸的步驟後,以2、3、4、5、6、7、8、9或10倍於為z異構體的對應化合物的量獲得式(i)的化合物。
94.如段86-93中任一段所述的方法,其中所述催化劑為釕催化劑。
95.如段86-94中任一段所述的方法,進一步包括用還原劑或氧化劑處理式(i)的化合物的步驟。
96.如段86-95中任一段所述的方法,其中所述式(ii)的化合物附著到固體載體上。
97.如段86-95中任一段所述的方法,其中所述式(ii)的化合物不附著到固體載體上。
98.如段86-97中任一段所述的方法,進一步包括從所述式(i)的化合物上除去保護基團。
99.如段86-98中任一段所述的方法,其中在約20℃至約80℃的溫度下進行閉環複分解反應。
100.如段86-100中任一段所述的方法,其中所述式(i)的擬肽大環化合物具有下式:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa8、xaa9和xaa10中的至少兩個是與序列phe3-x4-his5-tyr6-trp7-ala8-gln9-leu10-x11-ser12(seqidno:8)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體,其中l在e構型中包含至少一個雙鍵;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數;
w為3-1000的整數;
n為1-5的整數;且
xaa7為boc-保護的色氨酸。
101.如段86-99中任一段所述的方法,其中所述式(i)的擬肽大環化合物具有下式:
其中:
xaa3、xaa5、xaa6、xaa7、xaa8、xaa9和xaa10中的每一個單獨地為胺基酸,其中xaa3、xaa5、xaa6、xaa8、xaa9和xaa10中的至少兩個是與序列phe3-x4-glu5-tyr6-trp7-ala8-gln9-leu10/cba10-x11-ala12(seqidno:9)的相應位置處的胺基酸相同的胺基酸,其中各個x為胺基酸;
各個d和e獨立地為胺基酸;
r1和r2獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基、環烷基烷基、雜烷基或雜環烷基,它們是未取代的或被滷素–取代的;或者r1和r2中的至少一個形成連接至所述d或e胺基酸之一的α位置的大環形成連接體l』;
各個l或l』獨立地為式–l1–l2–的大環形成連接體,其中l在e構型中包含至少一個雙鍵;
l1和l2獨立地為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞環芳基、亞雜環芳基或[-r4-k-r4-]n,它們各自任選地被r5取代;
r3為氫、烷基、烯基、炔基、芳基烷基、雜烷基、環烷基、雜環烷基、環烷基烷基、環芳基或雜環芳基,它們任選地被r5取代;
各個r4為亞烷基、亞烯基、亞炔基、亞雜烷基、亞環烷基、亞雜環烷基、亞芳基或亞雜芳基;
各個k為o、s、so、so2、co、co2或conr3;
各個r5獨立地為滷素、烷基、-or6、-n(r6)2、-sr6、-sor6、-so2r6、-co2r6、螢光部分、放射性同位素或治療劑;
各個r6獨立地為–h、烷基、烯基、炔基、芳基烷基、環烷基烷基、雜環烷基、螢光部分、放射性同位素或治療劑;
r7為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與d殘基形成的環狀結構的一部分;
r8為–h、烷基、烯基、炔基、芳基烷基、環烷基、雜烷基、環烷基烷基、雜環烷基、環芳基或雜環芳基,它們任選地被r5取代,或是與e殘基形成的環狀結構的一部分;
v為1-1000的整數;
w為3-1000的整數;
n為1-5的整數;且
xaa7為boc-保護的色氨酸。
102.如段86-101中任一段所述的方法,其中所述式(i)的擬肽大環化合物包含α-螺旋。
附圖說明
在所附的權利要求書中詳細地闡述了本發明的新特徵。通過參考以下對利用本發明原理的說明性實施方案加以闡述的詳細說明和附圖,將會獲得對本發明的特徵和優點的更好的理解,在這些附圖中:
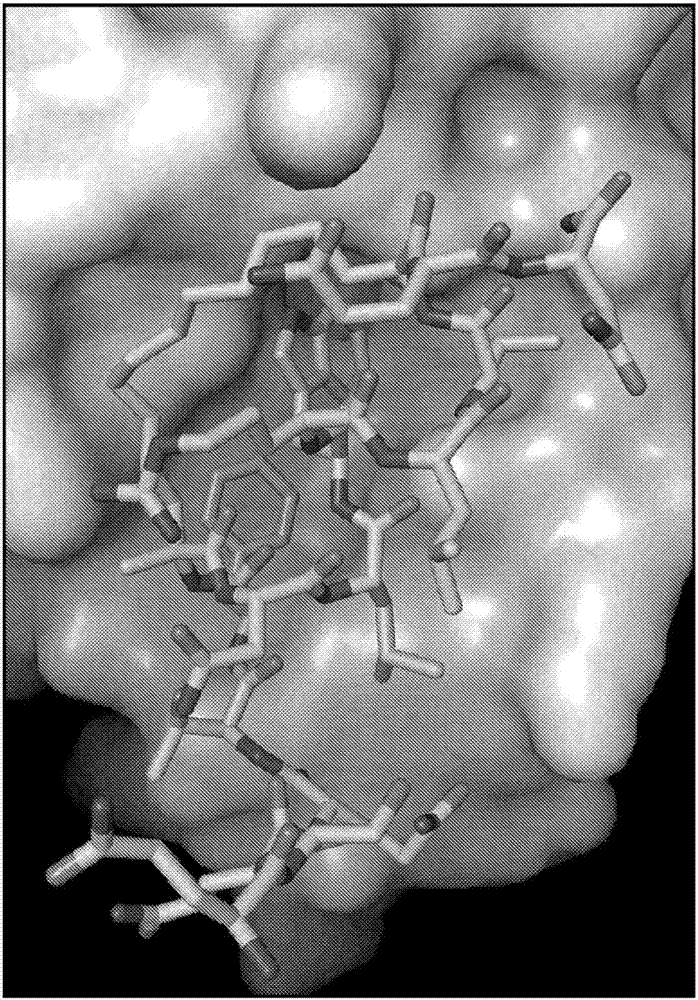
圖1示出了與mdmx(primaryswissprot資料庫登錄號q7zuw7,條目mdm4_danre)複合的擬肽大環化合物46(表2b)(一種p53擬肽大環化合物)的結構。
圖2示出了與mdmx(primaryswissprot資料庫登錄號q7zuw7,條目mdm4_danre)結合的p53擬肽大環化合物142(表2b)和sp43的疊加結構。
圖3示出了擬肽大環化合物sp154對小鼠mcf-7異種移植模型中腫瘤生長的影響。
圖4示出了擬肽大環化合物sp249對小鼠mcf-7異種移植模型中腫瘤生長的影響。
圖5示出了擬肽大環化合物sp315對小鼠mcf-7異種移植模型中腫瘤生長的影響。
圖6示出了sp154的點突變sp252對小鼠mcf-7異種移植模型中腫瘤生長的影響。
圖7示出了具有不同c-末端延伸的擬肽大環化合物的溶解度曲線圖。
發明詳述
如本文所用的,術語「大環化合物」是指這樣一種分子,該分子具有包括由至少9個共價鍵合的原子形成的環或環形的化學結構。
如本文所用的,術語「擬肽大環化合物」或「交聯的多肽」是指包含通過多個肽鍵連接的多個胺基酸殘基和至少一個大環形成連接體的化合物,所述大環形成連接體在第一天然存在的或非天然存在的胺基酸殘基(或類似物)與同一分子內的第二天然存在的或非天然存在的胺基酸殘基(或類似物)之間形成大環。擬肽大環化合物包括其中大環形成連接體將第一胺基酸殘基(或類似物)的α碳連接至第二胺基酸殘基(或類似物)的α碳的實施方案。擬肽大環化合物任選地包含處於一個或多個胺基酸殘基和/或胺基酸類似物殘基之間的一個或多個非肽鍵,且除了形成大環化合物的任意殘基外,任選地還包含一個或多個非天然存在的胺基酸殘基或胺基酸類似物殘基。當在擬肽大環化合物的背景下提及時,「相應的非交聯多肽」被理解為涉及與該大環化合物長度相同並且包含對應於該大環化合物的野生型序列的等同天然胺基酸的多肽。
如本文所用的,術語「穩定性」是指如通過圓二色性、nmr或另一種生物物理測量法測量的,擬肽大環化合物在溶液中維持確定的二級結構,或在體外或體內對蛋白水解降解作用的抗性。本文預期的二級結構的非限制性例子是α-螺旋、310螺旋、β-轉角和β-摺疊。
如本文所用的,術語「螺旋穩定性」是指如通過圓二色性或nmr測量的,擬肽大環化合物維持α-螺旋結構。例如,在一些實施方案中,與相應的非交聯的大環化合物相比,如通過圓二色性確定的,擬肽大環化合物在α-螺旋度上表現出至少1.25、1.5、1.75或2倍的增加。
術語「胺基酸」是指同時含有氨基和羧基的分子。合適的胺基酸包括但不限於天然存在的胺基酸的d-和l-異構體,以及通過有機合成或其它代謝途徑製備的非天然存在的胺基酸。本文所用的術語胺基酸包括但不限於α-胺基酸、天然胺基酸、非天然胺基酸和胺基酸類似物。
術語「α-胺基酸」是指含有的氨基和羧基都結合到被指定為α-碳的碳上的分子。
術語「β-胺基酸」是指含有均為β構型的氨基和羧基的分子。
術語「天然存在的胺基酸」是指在自然界合成的肽中通常發現的20種胺基酸中的任一種,已知其單字母縮寫為a、r、n、c、d、q、e、g、h、i、l、k、m、f、p、s、t、w、y和v。
下表示出了天然胺基酸的性質一覽:
「疏水性胺基酸」包括小疏水性胺基酸和大疏水性胺基酸。「小疏水性胺基酸」為甘氨酸、丙氨酸、脯氨酸及其類似物。「大疏水性胺基酸」為纈氨酸、亮氨酸、異亮氨酸、苯丙氨酸、甲硫氨酸、色氨酸及其類似物。「極性胺基酸」為絲氨酸、蘇氨酸、天冬醯胺、穀氨醯胺、半胱氨酸、酪氨酸及其類似物。「帶電胺基酸」為賴氨酸、精氨酸、組氨酸、天冬氨酸、穀氨酸及其類似物。
術語「胺基酸類似物」是指在結構上類似於胺基酸並且在擬肽大環化合物的形成中可代替胺基酸的分子。胺基酸類似物包括但不限於β-胺基酸和其中氨基或羧基被相似反應性的基團取代(例如,用仲胺或叔胺取代伯胺,或用酯取代羧基)的胺基酸。
術語「非天然胺基酸」是指並非在自然界合成的肽中通常發現的二十種胺基酸(已知其單字母縮寫為a、r、n、c、d、q、e、g、h、i、l、k、m、f、p、s、t、w、y和v)之一的胺基酸。非天然胺基酸或胺基酸類似物包括但不限於根據以下的結構:
胺基酸類似物包括β-胺基酸類似物。β-胺基酸類似物的實例包括但不限以下:環狀β-胺基酸類似物;β-丙氨酸;(r)-β-苯丙氨酸;(r)-1,2,3,4-四氫-異喹啉-3-乙酸;(r)-3-氨基-4-(1-萘基)-丁酸;(r)-3-氨基-4-(2,4-二氯苯基)丁酸;(r)-3-氨基-4-(2-氯苯基)-丁酸;(r)-3-氨基-4-(2-氰基苯基)-丁酸;(r)-3-氨基-4-(2-氟苯基)-丁酸;(r)-3-氨基-4-(2-呋喃基)-丁酸;(r)-3-氨基-4-(2-甲苯基)-丁酸;(r)-3-氨基-4-(2-萘基)-丁酸;(r)-3-氨基-4-(2-噻吩基)-丁酸;(r)-3-氨基-4-(2-三氟甲苯基)-丁酸;(r)-3-氨基-4-(3,4-二氯苯基)丁酸;(r)-3-氨基-4-(3,4-二氟苯基)丁酸;(r)-3-氨基-4-(3-苯並噻吩基)-丁酸;(r)-3-氨基-4-(3-氯苯基)-丁酸;(r)-3-氨基-4-(3-氰基苯基)-丁酸;(r)-3-氨基-4-(3-氟苯基)-丁酸;(r)-3-氨基-4-(3-甲苯基)-丁酸;(r)-3-氨基-4-(3-吡啶基)-丁酸;(r)-3-氨基-4-(3-噻吩基)-丁酸;(r)-3-氨基-4-(3-三氟甲苯基)-丁酸;(r)-3-氨基-4-(4-溴苯基)-丁酸;(r)-3-氨基-4-(4-氯苯基)-丁酸;(r)-3-氨基-4-(4-氰基苯基)-丁酸;(r)-3-氨基-4-(4-氟苯基)-丁酸;(r)-3-氨基-4-(4-碘苯基)-丁酸;(r)-3-氨基-4-(4-甲苯基)-丁酸;(r)-3-氨基-4-(4-硝基苯基)-丁酸;(r)-3-氨基-4-(4-吡啶基)-丁酸;(r)-3-氨基-4-(4-三氟甲苯基)-丁酸;(r)-3-氨基-4-五氟-苯基丁酸;(r)-3-氨基-5-己烯酸;(r)-3-氨基-5-己炔酸;(r)-3-氨基-5-苯基戊酸;(r)-3-氨基-6-苯基-5-己烯酸;(s)-1,2,3,4-四氫-異喹啉-3-乙酸;(s)-3-氨基-4-(1-萘基)-丁酸;(s)-3-氨基-4-(2,4-二氯苯基)丁酸;(s)-3-氨基-4-(2-氯苯基)-丁酸;(s)-3-氨基-4-(2-氰基苯基)-丁酸;(s)-3-氨基-4-(2-氟苯基)-丁酸;(s)-3-氨基-4-(2-呋喃基)-丁酸;(s)-3-氨基-4-(2-甲苯基)-丁酸;(s)-3-氨基-4-(2-萘基)-丁酸;(s)-3-氨基-4-(2-噻吩基)-丁酸;(s)-3-氨基-4-(2-三氟甲苯基)-丁酸;
(s)-3-氨基-4-(3,4-二氯苯基)丁酸;(s)-3-氨基-4-(3,4-二氟苯基)丁酸;(s)-3-氨基-4-(3-苯並噻吩基)-丁酸;(s)-3-氨基-4-(3-氯苯基)-丁酸;(s)-3-氨基-4-(3-氰基苯基)-丁酸;(s)-3-氨基-4-(3-氟苯基)-丁酸;(s)-3-氨基-4-(3-甲苯基)-丁酸;(s)-3-氨基-4-(3-吡啶基)-丁酸;(s)-3-氨基-4-(3-噻吩基)-丁酸;(s)-3-氨基-4-(3-三氟甲苯基)-丁酸;(s)-3-氨基-4-(4-溴苯基)-丁酸;(s)-3-氨基-4-(4-氯苯基)-丁酸;(s)-3-氨基-4-(4-氰基苯基)-丁酸;(s)-3-氨基-4-(4-氟苯基)-丁酸;(s)-3-氨基-4-(4-碘苯基)-丁酸;(s)-3-氨基-4-(4-甲苯基)-丁酸;(s)-3-氨基-4-(4-硝基苯基)-丁酸;(s)-3-氨基-4-(4-吡啶基)-丁酸;(s)-3-氨基-4-(4-三氟甲苯基)-丁酸;(s)-3-氨基-4-五氟-苯基丁酸;(s)-3-氨基-5-己烯酸;(s)-3-氨基-5-己炔酸;(s)-3-氨基-5-苯基戊酸;(s)-3-氨基-6-苯基-5-己烯酸;1,2,5,6-四氫吡啶-3-甲酸;1,2,5,6-四氫吡啶-4-甲酸;3-氨基-3-(2-氯苯基)-丙酸;3-氨基-3-(2-噻吩基)-丙酸;3-氨基-3-(3-溴苯基)-丙酸;3-氨基-3-(4-氯苯基)-丙酸;3-氨基-3-(4-甲氧苯基)-丙酸;3-氨基-4,4,4-三氟-丁酸;3-氨基己二酸;d-β-苯丙氨酸;β-亮氨酸;l-β-高丙氨酸;l-β-高天冬氨酸γ-苄酯;l-β-高穀氨酸δ-苄酯;l-β-高異亮氨酸;l-β-高亮氨酸;l-β-高甲硫氨酸;l-β-高苯丙氨酸;l-β-高脯氨酸;l-β-高色氨酸;l-β-高纈氨酸;l-nω-苄氧羰基-β-高賴氨酸;nω-l-β-高精氨酸;o-苄基-l-β-高羥脯氨酸;o-苄基-l-β-高絲氨酸;o-苄基-l-β-高蘇氨酸;o-苄基-l-β-高酪氨酸;γ-三苯甲基-l-β-高天冬醯胺;(r)-β-苯丙氨酸;l-β-高天冬氨酸γ-叔丁酯;l-β-高穀氨酸δ-叔丁酯;l-nω-β-高賴氨酸;nδ-三苯甲基-l-β-高穀氨醯胺;nω-2,2,4,6,7-五甲基-二氫苯並呋喃-5-磺醯基-l-β-高精氨酸;o-叔丁基-l-β-高羥基-脯氨酸;o-叔丁基-l-β-高絲氨酸;o-叔丁基-l-β-高蘇氨酸;o-叔丁基-l-β-高酪氨酸;2-氨基環戊烷羧酸;和2-氨基環己烷羧酸。
胺基酸類似物包括丙氨酸、纈氨酸、甘氨酸或亮氨酸的類似物。丙氨酸、纈氨酸、甘氨酸或亮氨酸的胺基酸類似物的實例包括但不限於以下:α-甲氧基甘氨酸;α-烯丙基-l-丙氨酸;α-氨基異丁酸;α-甲基-亮氨酸;β-(1-萘基)-d-丙氨酸;β-(1-萘基)-l-丙氨酸;β-(2-萘基)-d-丙氨酸;β-(2-萘基)-l-丙氨酸;β-(2-吡啶基)-d-丙氨酸;β-(2-吡啶基)-l-丙氨酸;β-(2-噻吩基)-d-丙氨酸;β-(2-噻吩基)-l-丙氨酸;β-(3-苯並噻吩基)-d-丙氨酸;β-(3-苯並噻吩基)-l-丙氨酸;β-(3-吡啶基)-d-丙氨酸;β-(3-吡啶基)-l-丙氨酸;β-(4-吡啶基)-d-丙氨酸;β-(4-吡啶基)-l-丙氨酸;β-氯-l-丙氨酸;β-氰基-l-丙氨酸;β-環己基-d-丙氨酸;β-環己基-l-丙氨酸;β-環戊烯-1-基-丙氨酸;β-環戊基-丙氨酸;β-環丙基-l-ala-oh·二環己基銨鹽;β-叔丁基-d-丙氨酸;β-叔丁基-l-丙氨酸;γ-氨基丁酸;l-α,β-二氨基丙酸;2,4-二硝基-苯基甘氨酸;2,5-二氫-d-苯基甘氨酸;2-氨基-4,4,4-三氟丁酸;2-氟-苯基甘氨酸;3-氨基-4,4,4-三氟-丁酸;3-氟-纈氨酸;4,4,4-三氟-纈氨酸;4,5-脫氫-l-leu-oh·二環己基銨鹽;4-氟-d-苯基甘氨酸;4-氟-l-苯基甘氨酸;4-羥基-d-苯基甘氨酸;5,5,5-三氟-亮氨酸;6-氨基己酸;環戊基-d-gly-oh·二環己基銨鹽;環戊基-gly-oh·二環己基銨鹽;d-α,β-二氨基丙酸;d-α-氨基丁酸;d-α-叔丁基甘氨酸;d-(2-噻吩基)甘氨酸;d-(3-噻吩基)甘氨酸;d-2-氨基己酸;d-2-茚滿基甘氨酸;d-烯丙基甘氨酸·二環己基銨鹽;d-環己基甘氨酸;d-正纈氨酸;d-苯基甘氨酸;β-氨基丁酸;β-氨基異丁酸;(2-溴苯基)甘氨酸;(2-甲氧基苯基)甘氨酸;(2-甲苯基)甘氨酸;(2-噻唑基)甘氨酸;(2-噻吩基)甘氨酸;2-氨基-3-(二甲氨基)-丙酸;l-α,β-二氨基丙酸;l-α-氨基丁酸;l-α-叔丁基甘氨酸;l-(3-噻吩基)甘氨酸;l-2-氨基-3-(二甲氨基)-丙酸;l-2-氨基己酸二環己基-銨鹽;l-2-茚滿基甘氨酸;l-烯丙基甘氨酸·二環己基銨鹽;l-環己基甘氨酸;l-苯基甘氨酸;l-炔丙基甘氨酸;l-正纈氨酸;n-α-氨基甲基-l-丙氨酸;d-α,γ-二氨基丁酸;l-α,γ-二氨基丁酸;β-環丙基-l-丙氨酸;(n-β-(2,4-二硝基苯基))-l-α,β-二氨基丙酸;(n-β-1-(4,4-二甲基-2,6-二氧代亞環己-1-基)乙基)-d-α,β-二氨基丙酸;(n-β-1-(4,4-二甲基-2,6-二氧環己-1-亞基)乙基)-l-α,β-二氨基丙酸;(n-β-4-甲基三苯甲基)-l-α,β-二氨基丙酸;(n-β-烯丙氧羰基)-l-α,β-二氨基丙酸;(n-γ-1-(4,4-二甲基-2,6-二氧代環己-1-亞基)乙基)-d-α,γ-二氨基丁酸;(n-γ-1-(4,4-二甲基-2,6-二氧代環己-1-亞基)乙基)-l-α,γ-二氨基丁酸;(n-γ-4-甲基三苯甲基)-d-α,γ-二氨基丁酸;(n-γ-4-甲基三苯甲基)-l-α,γ-二氨基丁酸;(n-γ-烯丙氧羰基)-l-α,γ-二氨基丁酸;d-α,γ-二氨基丁酸;4,5-脫氫-l-亮氨酸;環戊基-d-gly-oh;環戊基-gly-oh;d-烯丙基甘氨酸;d-環己基高丙氨酸;l-1-芘基丙氨酸;l-2-氨基己酸;l-烯丙基甘氨酸;l-環己基高丙氨酸;和n-(2-羥基-4-甲氧基-bzl)-gly-oh。
胺基酸類似物包括精氨酸或賴氨酸的類似物。精氨酸和賴氨酸的胺基酸類似物的實例包括但不限於以下:瓜氨酸;l-2-氨基-3-胍基丙酸;l-2-氨基-3-脲基丙酸;l-瓜氨酸;lys(me)2-oh;lys(n3)-oh;nδ-苄氧羰基-l-鳥氨酸;nω-硝基-d-精氨酸;nω-硝基-l-精氨酸;α-甲基-鳥氨酸;2,6-二氨基庚二酸;l-鳥氨酸;(nδ-1-(4,4-二甲基-2,6-二氧代-環己-1-亞基)乙基)-d-鳥氨酸;(nδ-1-(4,4-二甲基-2,6-二氧-環己-1-亞基)乙基)-l-鳥氨酸;(nδ-4-甲基三苯甲基)-d-鳥氨酸;(nδ-4-甲基三苯甲基)-l-鳥氨酸;d-鳥氨酸;l-鳥氨酸;arg(me)(pbf)-oh;arg(me)2-oh(不對稱的);arg(me)2-oh(對稱的);lys(ivdde)-oh;lys(me)2-oh·hcl;lys(me)3-oh氯化物;nω-硝基-d-精氨酸;和nω-硝基-l-精氨酸。
胺基酸類似物包括天冬氨酸或穀氨酸的類似物。天冬氨酸和穀氨酸的胺基酸類似物的實例包括但不限於以下:α-甲基-d-天冬氨酸;α-甲基-穀氨酸;α-甲基-l-天冬氨酸;γ-亞甲基-穀氨酸;(n-γ-乙基)-l-穀氨醯胺;[n-α-(4-氨基苯甲醯基)]-l-穀氨酸;2,6-二氨基庚二酸;l-α-氨基辛二酸;d-2-氨基己二酸;d-α-氨基辛二酸;α-氨基庚二酸;亞氨基二乙酸;l-2-氨基己二酸;蘇-β-甲基-天冬氨酸;γ-羧基-d-穀氨酸γ,γ-二-叔丁酯;γ-羧基-l-穀氨酸γ,γ-二-叔丁酯;glu(oall)-oh;l-asu(otbu)-oh;和焦穀氨酸。
胺基酸類似物包括半胱氨酸和甲硫氨酸的類似物。半胱氨酸和甲硫氨酸的胺基酸類似物的實例包括但不限於cys(法呢基)-oh、cys(法呢基)-ome、α-甲基-甲硫氨酸、cys(2-羥乙基)-oh、cys(3-氨丙基)-oh、2-氨基-4-(乙硫基)丁酸、丁硫氨酸、丁硫氨酸亞碸胺、乙硫氨酸、甲硫氨酸甲基鋶氯化物、硒代甲硫氨酸、磺丙氨酸、[2-(4-吡啶基)乙基]-dl-青黴胺、[2-(4-吡啶基)乙基]-l-半胱氨酸、4-甲氧苄基-d-青黴胺、4-甲氧苄基-l-青黴胺、4-甲基苄基-d-青黴胺、4-甲基苄基-l-青黴胺、苄基-d-半胱氨酸、苄基-l-半胱氨酸、苄基-dl-高半胱氨酸、氨甲醯基-l-半胱氨酸、羧乙基-l-半胱氨酸、羧甲基-l-半胱氨酸、二苯基甲基-l-半胱氨酸、乙基-l-半胱氨酸、甲基-l-半胱氨酸、叔丁基-d-半胱氨酸、三苯甲基-l-高半胱氨酸、三苯甲基-d-青黴胺、胱硫醚、高胱氨酸、l-高胱氨酸、(2-氨基乙基)-l-半胱氨酸、硒代-l-胱氨酸、胱硫醚、cys(stbu)-oh和乙醯氨甲基-d-青黴胺。
胺基酸類似物包括苯丙氨酸和酪氨酸的類似物。苯丙氨酸和酪氨酸的胺基酸類似物的實例包括β-甲基-苯丙氨酸、β-羥基苯丙氨酸、α-甲基-3-甲氧基-dl-苯丙氨酸、α-甲基-d-苯丙氨酸、α-甲基-l-苯丙氨酸、1,2,3,4-四氫異喹啉-3-甲酸、2,4-二氯-苯丙氨酸、2-(三氟甲基)-d-苯丙氨酸、2-(三氟甲基)-l-苯丙氨酸、2-溴-d-苯丙氨酸、2-溴-l-苯丙氨酸、2-氯-d-苯丙氨酸、2-氯-l-苯丙氨酸、2-氰基-d-苯丙氨酸、2-氰基-l-苯丙氨酸、2-氟-d-苯丙氨酸、2-氟-l-苯丙氨酸、2-甲基-d-苯丙氨酸、2-甲基-l-苯丙氨酸、2-硝基-d-苯丙氨酸、2-硝基-l-苯丙氨酸、2,4,5-三羥基-苯丙氨酸、3,4,5-三氟-d-苯丙氨酸、3,4,5-三氟-l-苯丙氨酸、3,4-二氯-d-苯丙氨酸、3,4-二氯-l-苯丙氨酸、3,4-二氟-d-苯丙氨酸、3,4-二氟-l-苯丙氨酸、3,4-二羥基-l-苯丙氨酸、3,4-二甲氧基-l-苯丙氨酸、3,5,3』-三碘-l-甲狀腺原氨酸、3,5-二碘-d-酪氨酸、3,5-二碘-l-酪氨酸、3,5-二碘-l-甲狀腺原氨酸、3-(三氟甲基)-d-苯丙氨酸、3-(三氟甲基)-l-苯丙氨酸、3-氨基-l-酪氨酸、3-溴-d-苯丙氨酸、3-溴-l-苯丙氨酸、3-氯-d-苯丙氨酸、3-氯-l-苯丙氨酸、3-氯-l-酪氨酸、3-氰基-d-苯丙氨酸、3-氰基-l-苯丙氨酸、3-氟-d-苯丙氨酸、3-氟-l-苯丙氨酸、3-氟-酪氨酸、3-碘-d-苯丙氨酸、3-碘-l-苯丙氨酸、3-碘-l-酪氨酸、3-甲氧基-l-酪氨酸、3-甲基-d-苯丙氨酸、3-甲基-l-苯丙氨酸、3-硝基-d-苯丙氨酸、3-硝基-l-苯丙氨酸、3-硝基-l-酪氨酸、4-(三氟甲基)-d-苯丙氨酸、4-(三氟甲基)-l-苯丙氨酸、4-氨基-d-苯丙氨酸、4-氨基-l-苯丙氨酸、4-苯甲醯基-d-苯丙氨酸、4-苯甲醯基-l-苯丙氨酸、4-雙(2-氯乙基)氨基-l-苯丙氨酸、4-溴-d-苯丙氨酸、4-溴-l-苯丙氨酸、4-氯-d-苯丙氨酸、4-氯-l-苯丙氨酸、4-氰基-d-苯丙氨酸、4-氰基-l-苯丙氨酸、4-氟-d-苯丙氨酸、4-氟-l-苯丙氨酸、4-碘-d-苯丙氨酸、4-碘-l-苯丙氨酸、高苯丙氨酸、甲狀腺氨酸、3,3-二苯丙氨酸、甲狀腺原氨酸、乙基-酪氨酸和甲基-酪氨酸。
胺基酸類似物包括脯氨酸的類似物。脯氨酸的胺基酸類似物的實例包括但不限於3,4-脫氫-脯氨酸、4-氟-脯氨酸、順-4-羥基-脯氨酸、噻唑烷-2-甲酸和反-4-氟-脯氨酸。
胺基酸類似物包括絲氨酸和蘇氨酸的類似物。絲氨酸和蘇氨酸的胺基酸類似物的實例包括但不限於3-氨基-2-羥基-5-甲基己酸、2-氨基-3-羥基-4-甲基戊酸、2-氨基-3-乙氧丁酸、2-氨基-3-甲氧丁酸、4-氨基-3-羥基-6-甲基庚酸、2-氨基-3-苄氧丙酸、2-氨基-3-苄氧丙酸、2-氨基-3-乙氧丙酸、4-氨基-3-羥基丁酸和α-甲基絲氨酸。
胺基酸類似物包括色氨酸的類似物。色氨酸的胺基酸類似物的實例包括但不限於以下:α-甲基-色氨酸;β-(3-苯並噻吩基)-d-丙氨酸;β-(3-苯並噻吩基)-l-丙氨酸;1-甲基-色氨酸;4-甲基-色氨酸;5-苄氧基-色氨酸;5-溴-色氨酸;5-氯-色氨酸;5-氟-色氨酸;5-羥基-色氨酸;5-羥基-l-色氨酸;5-甲氧基-色氨酸;5-甲氧基-l-色氨酸;5-甲基-色氨酸;6-溴-色氨酸;6-氯-d-色氨酸;6-氯-色氨酸;6-氟-色氨酸;6-甲基-色氨酸;7-苄氧基-色氨酸;7-溴-色氨酸;7-甲基-色氨酸;d-1,2,3,4-四氫-去甲哈爾滿-3-甲酸;6-甲氧基-1,2,3,4-四氫去甲哈爾滿-1-甲酸;7-氮雜色氨酸;l-1,2,3,4-四氫-去甲哈爾滿-3-甲酸;5-甲氧基-2-甲基-色氨酸;和6-氯-l-色氨酸。
在一些實施方案中,胺基酸類似物是外消旋的。在一些實施方案中,使用胺基酸類似物的d型異構體。在一些實施方案中,使用胺基酸類似物的l型異構體。在其它實施方案中,胺基酸類似物包含為r或s構型的手性中心。在又一些其它實施方案中,β-胺基酸類似物的氨基基團被諸如叔丁氧羰基(boc基團)、9-芴甲氧羰基(fmoc)、甲苯磺醯基等保護基團取代。在一些其它實施方案中,β-胺基酸類似物的羧酸官能團例如作為其酯衍生物被保護。在一些實施方案中,使用胺基酸類似物的鹽。
「非必需」胺基酸殘基是相對於多肽的野生型序列可能發生改變而不消除或基本不改變其基本生物學或生物化學活性(例如,受體結合或激活)的殘基。「必需」胺基酸殘基是當相對於多肽的野生型序列發生改變時導致多肽的基本生物學或生物化學活性消除或基本消除的殘基。
「保守胺基酸置換」是其中胺基酸殘基被具有相似側鏈的胺基酸殘基所替代的胺基酸置換。本領域中已定義了具有相似側鏈的胺基酸殘基的家族。這些家族包括具有鹼性側鏈的胺基酸(例如,k、r、h)、具有酸性側鏈的胺基酸(例如,d、e)、具有不帶電荷的極性側鏈的胺基酸(例如,g、n、q、s、t、y、c)、具有非極性側鏈的胺基酸(例如,a、v、l、i、p、f、m、w)、具有β分支的側鏈的胺基酸(例如,t、v、i)和具有芳香族側鏈的胺基酸(例如,y、f、w、h)。因此,多肽中預測的非必需胺基酸殘基例如被來自同一側鏈家族的另一種胺基酸殘基所替代。可接受的置換的其它例子是基於電子等排考慮(例如,正亮氨酸取代甲硫氨酸)或其它性質(如2-噻吩丙氨酸取代苯丙氨酸,或6-cl-色氨酸取代色氨酸)的置換。
術語「封端基團」是指出現在本發明擬肽大環化合物的多肽鏈的羧基末端或氨基末端的化學部分。羧基末端的封端基團包括未修飾的羧酸(即-cooh)或具有取代基的羧酸。例如,羧基末端可被氨基取代,從而在c末端產生羧醯胺。各種取代基包括但不限於伯胺和仲胺,仲胺包括聚乙二醇化的仲胺。用於c末端的代表性的仲胺封端基團包括:
氨基末端的封端基團包括未修飾的胺(即-nh2)或具有取代基的胺。例如,氨基末端可被醯基取代,從而在n-末端生成羧醯胺。各種取代基包括但不限於取代的醯基,包括c1-c6羰基、c7-c30羰基和聚乙二醇化的氨基甲酸酯。用於n-末端的代表性封端基團包括但不限於4-fbzl(4-氟-苄基)及以下:
在本文中與大環化合物或大環形成連接體一起使用的術語「元」是指形成或可以形成大環的原子,並且不包括取代基或側鏈原子。以此類推,環癸烷、1,2-二氟-癸烷和1,3-二甲基環癸烷都被認為是十元大環化合物,因為氫或氟取代基或甲基側鏈都沒有參與形成大環。
當用作分子結構的一部分時,符號是指單鍵或者反式或順式雙鍵。
術語「胺基酸側鏈」是指連接到胺基酸中的α-碳(或另一個骨架原子)上的部分。例如,丙氨酸的胺基酸側鏈是甲基,苯丙氨酸的胺基酸側鏈是苯甲基,半胱氨酸的胺基酸側鏈是硫甲基,天冬氨酸的胺基酸側鏈是羧甲基,酪氨酸的胺基酸側鏈是4-羥基苯甲基,等等。也包括其它非天然存在的胺基酸側鏈,例如,自然產生的胺基酸側鏈(例如,胺基酸代謝物)或合成製備的胺基酸側鏈(例如,α,α-二取代的胺基酸)。
術語「α,α-二取代的胺基酸」是指包含的氨基和羧基都結合到碳(α-碳)上而該碳(α-碳)連接到兩個天然或非天然胺基酸側鏈上的分子或部分。
術語「多肽」包括通過共價鍵(例如,醯胺鍵)連接的兩個或更多個天然或非天然存在的胺基酸。本文所述的多肽包括全長蛋白質(例如,完全加工的蛋白質)以及較短的胺基酸序列(例如,天然存在的蛋白質的片段或合成的多肽片段)。
術語「第一c-末端胺基酸」是指最靠近c-末端的胺基酸。術語「第二c-末端胺基酸」是指連接在第一c-末端胺基酸的n末端處的胺基酸。
本文所用的術語「大環化試劑」或「大環形成試劑」是指任何可以用來通過介導兩個反應性基團之間的反應而製備擬肽大環化合物的試劑。該反應性基團可以是,例如,疊氮和炔,在這種情況下,大環化試劑包括但不限於cu試劑,如提供反應性cu(i)物質的試劑,如cubr、cui或cuotf,以及通過加入諸如抗壞血酸或抗壞血酸鈉的還原劑可以原位轉化為活性cu(i)試劑的cu(ii)鹽,如cu(co2ch3)2、cuso4和cucl2。大環化試劑另外還可以包括,例如,本領域已知的ru試劑,如cp*rucl(pph3)2、[cp*rucl]4,或其它可以提供反應性ru(ii)物質的ru試劑。在其它情況下,反應性基團為末端烯烴。在這樣的實施方案中,大環化試劑或大環形成試劑為複分解催化劑,包括但不限於穩定的後過渡金屬卡賓絡合物催化劑,如viii族過渡金屬卡賓催化劑。例如,這樣的催化劑為具有+2氧化態、電子計數為16且五配位的ru和os金屬中心。在其它實例中,催化劑具有w或mo中心。各種催化劑在grubbs等人,"ringclosingmetathesisandrelatedprocessesinorganicsynthesis"acc.chem.res.1995,28,446-452,美國專利號5,811,515;美國專利號7,932,397;美國申請號2011/0065915;美國申請號2011/0245477;yu等人,"synthesisofmacrocyclicnaturalproductsbycatalyst-controlledstereoselectivering-closingmetathesis,"nature2011,479,88;和peryshkov等人,"z-selectiveolefinmetathesisreactionspromotedbytungstenoxoalkylidenecomplexes,"j.am.chem.soc.2011,133,20754中公開。在另外其它的情況下,反應性基團為巰基。在這樣的實施方案中,大環化試劑為,例如,用兩個巰基反應性基團如滷素基團官能化的連接體。
術語「滷代」或「滷素」是指氟、氯、溴或碘或其基團。
術語「烷基」是指含有指定數目的碳原子的直鏈或支鏈烴鏈。例如,c1-c10表示該基團中具有1-10(含端值)個碳原子。在沒有指定任何數值時,「烷基」是其中具有1-20(含端值)個碳原子的鏈(直鏈或支鏈)。
術語「亞烷基」是指二價烷基(即,-r-)。
術語「烯基」是指具有一個或多個碳-碳雙鍵的直鏈或支鏈烴鏈。烯基部分含有指定數目的碳原子。例如,c2-c10表示該基團中具有2-10(含端值)個碳原子。術語「低級烯基」是指c2-c6烯基鏈。在沒有指定任何數值時,「烯基」是其中具有2-20(含端值)個碳原子的鏈(直鏈或支鏈)。
術語「炔基」是指具有一個或多個碳-碳叄鍵的直鏈或支鏈烴鏈。炔基部分含有指定數目的碳原子。例如,c2-c10表示該基團中具有2-10(含端值)個碳原子。術語「低級炔基」是指c2-c6炔基鏈。在沒有指定任何數值時,「炔基」是其中具有2-20(含端值)個碳原子的鏈(直鏈或支鏈)。
術語「芳基」是指6碳單環或10碳雙環的芳香環系,其中各環的0、1、2、3或4個原子被取代基取代。芳基的例子包括苯基、萘基等。術語「芳基烷氧基」是指被芳基取代的烷氧基。
「烷基芳基(arylalkyl)」是指其中芳基的氫原子中的一個被如上定義的c1-c5烷基取代的如上定義的芳基。烷基芳基的代表性例子包括但不限於:2-甲基苯基、3-甲基苯基、4-甲基苯基、2-乙基苯基、3-乙基苯基、4-乙基苯基、2-丙基苯基、3-丙基苯基、4-丙基苯基、2-丁基苯基、3-丁基苯基、4-丁基苯基、2-戊基苯基、3-戊基苯基、4-戊基苯基、2-異丙基苯基、3-異丙基苯基、4-異丙基苯基、2-異丁基苯基、3-異丁基苯基、4-異丁基苯基、2-仲丁基苯基、3-仲丁基苯基、4-仲丁基苯基、2-叔丁基苯基、3-叔丁基苯基和4-叔丁基苯基。
「醯胺基芳基(arylamido)」是指其中芳基的氫原子中的一個被一個或多個-c(o)nh2基團取代的如上定義的芳基。醯胺基芳基的代表性例子包括:2-c(o)nh2-苯基、3-c(o)nh2-苯基、4-c(o)nh2-苯基、2-c(o)nh2-吡啶基、3-c(o)nh2-吡啶基和4-c(o)nh2-吡啶基。
「雜環基烷基(alkylheterocycle)」是指其中c1-c5烷基的氫原子中的一個被雜環取代的如上定義的c1-c5烷基。雜環基烷基的代表性例子包括但不限於:-ch2ch2-嗎啉、-ch2ch2-哌啶、-ch2ch2ch2-嗎啉和-ch2ch2ch2-咪唑。
「醯胺基烷基(alkylamido)」是指其中c1-c5烷基的氫原子中的一個被-c(o)nh2基團取代的如上定義的c1-c5烷基。醯胺基烷基的代表性例子包括但不限於:-ch2-c(o)nh2、-ch2ch2-c(o)nh2、-ch2ch2ch2c(o)nh2、-ch2ch2ch2ch2c(o)nh2、-ch2ch2ch2ch2ch2c(o)nh2、-ch2ch(c(o)nh2)ch3、-ch2ch(c(o)nh2)ch2ch3、-ch(c(o)nh2)ch2ch3、-c(ch3)2ch2c(o)nh2、-ch2-ch2-nh-c(o)-ch3、-ch2-ch2-nh-c(o)-ch3-ch3和-ch2-ch2–nh-c(o)-ch=ch2。
「羥烷基(alkanol)」是指其中c1-c5烷基的氫原子中的一個被羥基取代的如上定義的c1-c5烷基。羥烷基的代表性例子包括但不限於:-ch2oh、-ch2ch2oh、-ch2ch2ch2oh、-ch2ch2ch2ch2oh、-ch2ch2ch2ch2ch2oh、-ch2ch(oh)ch3、-ch2ch(oh)ch2ch3、-ch(oh)ch3和-c(ch3)2ch2oh。
「羧基烷基(alkylcarboxy)」是指其中c1-c5烷基的氫原子中的一個被-cooh基團取代的如上定義的c1-c5烷基。羧基烷基的代表性例子包括但不限於:-ch2cooh、-ch2ch2cooh、-ch2ch2ch2cooh、-ch2ch2ch2ch2cooh、-ch2ch(cooh)ch3、-ch2ch2ch2ch2ch2cooh、-ch2ch(cooh)ch2ch3、-ch(cooh)ch2ch3和-c(ch3)2ch2cooh。
本文使用的術語「環烷基」包括具有3-12個碳、優選3-8個碳、更優選3-6個碳的飽和的和部分不飽和的環烴基團,其中環烷基另外任選地被取代。一些環烷基包括但不限於:環丙基、環丁基、環戊基、環戊烯基、環己基、環己烯基、環庚基和環辛基。
術語「雜芳基」是指芳香族的5-8元單環、8-12元雙環或11-14元三環的環系,其如果是單環則具有1-3個雜原子,如果是雙環則具有1-6個雜原子,或者如果是三環則具有1-9個雜原子,所述雜原子選自o、n或s(例如,如果是單環、雙環或三環,分別為碳原子和1-3、1-6或1-9個o、n或s雜原子),其中各個環的0、1、2、3或4個原子被取代基取代。雜芳基的例子包括吡啶基、呋喃基(furyl或furanyl)、咪唑基、苯並咪唑基、嘧啶基、噻吩基(thiophenyl或thienyl)、喹啉基(quinolinyl)、吲哚基、噻唑基等。
術語「雜芳基烷基」或術語「雜芳烷基」是指被雜芳基取代的烷基。術語「雜芳基烷氧基」是指被雜芳基取代的烷氧基。
術語「雜芳基烷基」或術語「雜芳烷基」是指被雜芳基取代的烷基。術語「雜芳基烷氧基」是指被雜芳基取代的烷氧基。
術語「雜環基」是指非芳香族的5-8元單環、8-12元雙環或11-14元三環的環系,其如果是單環則具有1-3個雜原子,如果是雙環則具有1-6個雜原子,或者如果是三環則具有1-9個雜原子,所述雜原子選自o、n或s(例如,如果是單環、雙環或三環,分別為碳原子和1-3、1-6或1-9個o、n或s雜原子),其中各個環的0、1、2或3個原子被取代基取代。雜環基的例子包括哌嗪基、吡咯烷基、二氧雜環己基、嗎啉基、四氫呋喃基等。
術語「取代基」是指取代任何分子、化合物或部分上的第二原子或基團如氫原子的基團。合適的取代基包括但不限於滷素、羥基、巰基、氧代、硝基、滷代烷基、烷基、烷芳基、芳基、芳烷基、烷氧基、硫代烷氧基、芳氧基、氨基、烷氧羰基、醯胺基、羧基、鏈烷磺醯基、烷基羰基和氰基。
在一些實施方案中,本文公開的化合物包含一個或多個不對稱中心,因而作為外消旋體或外消旋混合物、單一對映異構體、單獨的非對映異構體和非對映體混合物存在。除非另外明確地指出,包括這些化合物的所有這樣的異構體形式。在一些實施方案中,本文公開的化合物也呈現為多種互變異構形式,在這些情況下,所述化合物包括本文所述化合物的所有互變異構形式(例如,如果環系的烷基化作用導致在多個位置發生烷基化,那麼本發明包括所有這些反應產物)。除非另外明確地指出,包括這些化合物的所有這些異構體形式。除非另外明確地指出,包括本文所述化合物的所有晶形。
如本文所用的,術語「增加」和「減少」分別意味著導致至少5%的統計學顯著的(即,p60℃的tm,表明在水溶液中高度穩定的結構。為了分析大環形成對解鏈溫度的影響,將擬肽大環化合物或未修飾的肽溶於蒸餾水中(例如,以50μm的終濃度),並且通過使用標準參數(例如,波長,222nm;步解析度,0.5nm;速度,20nm/sec;累積,10;響應,1秒;帶寬,1nm;溫度上升速度,1℃/分鐘;路徑長度,0.1cm)在分光偏振計(例如,jascoj-710)上測量橢圓度在一定溫度範圍(例如,4-95℃)內的變化來確定tm。
蛋白酶抗性試驗
肽骨架的醯胺鍵易受到蛋白酶的水解,從而致使肽化合物在體內易於快速降解。但是,肽螺旋的形成通常包埋醯胺骨架,因此可以保護其免於蛋白水解裂解。擬肽大環化合物可以經歷體外胰蛋白酶的蛋白水解,以評價與相應的非交聯多肽相比其降解速率的任何變化。例如,擬肽大環化合物和相應的非交聯多肽與胰蛋白酶瓊脂糖一起溫育,並在各個時間點通過離心猝滅反應,隨後進行hplc注入以根據280nm處的紫外吸收對殘留的底物進行定量。簡單來說,擬肽大環化合物和擬肽前體(5mcg)與胰蛋白酶瓊脂糖(pierce)(s/e~125)溫育0、10、20、90和180分鐘。通過臺式離心機高速離心猝滅反應;通過基於hplc的在280nm處的峰檢測對分離的上清液中殘餘的底物進行定量。蛋白水解反應顯示出一級動力學,且速率常數k由ln[s]相對於時間的曲線確定(k=-1x斜率)。
離體穩定性試驗
具有優化的連接體的擬肽大環化合物具有例如至少為相應的非交聯多肽的2倍的離體半衰期,且具有12小時或更長的離體半衰期。對於離體血清穩定性研究,可以使用多種試驗。例如,將擬肽大環化合物和相應的非交聯多肽(2mcg)與新鮮的小鼠、大鼠和/或人血清(2ml)一起在37℃下溫育0、1、2、4、8和24小時。為了測定完整化合物的水平,可以使用下面的程序:通過將100μl的血清轉移到2ml離心管中,接著加入10μl的50%甲酸和500μl乙腈並在4±2℃下以14,000rpm離心10分鐘來提取樣品。然後將上清液轉移到新的2ml管中,並在n2<10psi、37℃下在turbovap上蒸發。樣品在100μl的50:50乙腈:水中重建,並進行lc-ms/ms分析。
體外結合試驗
為了評價擬肽大環化合物和擬肽前體與受體蛋白質的結合和親和力,例如使用螢光偏振試驗(fpa)。fpa技術使用偏振光和螢光示蹤劑測量分子取向和分子遷移率。當用偏振光激發時,由於附著在具有高表觀分子量的分子(例如,與大蛋白質結合的fitc標記的肽)上的螢光示蹤劑(例如,fitc)與附著在較小分子(例如,在溶液中游離的fitc標記的肽)上的螢光示蹤劑相比具有較慢的旋轉速度,附著在具有高表觀分子量的分子上的螢光示蹤劑發射較高水平的偏振螢光。
例如,螢光標記的(fluoresceinated)擬肽大環化合物(25nm)與接受體蛋白質(25-1000nm)在結合緩衝液(140mmnacl、50mmtris-hcl,ph7.4)中在室溫下溫育30分鐘。例如,用發光分光光度計(例如,perkin-elmerls50b)通過螢光偏振測定結合活性。可以使用例如graphpadprism軟體(graphpadsoftware,inc.,sandiego,ca)通過非線性回歸分析來確定kd值。在一些實施方案中,擬肽大環化合物顯示出與相應的非交聯多肽類似的或更低的kd。
用於表徵肽-蛋白質相互作用的拮抗劑的體外置換試驗
為了評價拮抗肽與接受體蛋白質之間相互作用的化合物的結合和親和力,例如,使用利用來源於擬肽前體序列的螢光標記的擬肽大環化合物的螢光偏振試驗(fpa)。fpa技術使用偏振光和螢光示蹤劑測量分子取向和分子遷移率。當用偏振光激發時,由於附著在具有高表觀分子量的分子(例如,與大蛋白質結合的fitc標記的肽)上的螢光示蹤劑(例如,fitc)與附著在較小分子(例如,在溶液中游離的fitc標記的肽)上的螢光示蹤劑相比具有較低的旋轉速度,附著在具有高表觀分子量的分子上的螢光示蹤劑發射較高水平的偏振螢光。拮抗螢光標記的擬肽大環化合物與接受體蛋白質之間相互作用的化合物將在競爭性結合fpa實驗中進行檢測。
例如,推定的拮抗劑化合物(1nm至1mm)和螢光標記的擬肽大環化合物(25nm)與接受體蛋白質(50nm)一起在結合緩衝液(140mmnacl、50mmtris-hcl,ph7.4)中在室溫下溫育30分鐘。例如,用發光分光光度計(例如,perkin-elmerls50b)通過螢光偏振測定拮抗劑結合活性。可以使用例如graphpadprism軟體(graphpadsoftware,inc.,sandiego,ca)通過非線性回歸分析來確定kd值。
任一類分子,如有機小分子、肽、寡核苷酸或蛋白質,可以在該試驗中作為推定的拮抗劑進行檢測。
通過親和選擇-質譜法對蛋白質-配體結合的分析
為了評估測試化合物對蛋白質的結合和親和力,例如採用親和選擇-質譜分析試驗。按照以下對全系統對照實驗概述的代表性程序,使用1μm擬肽大環化合物加5μmhmdm2進行蛋白質-配體結合實驗。將40μm擬肽大環化合物儲備溶液的1μldmso等份溶解在19μlpbs(磷酸鹽緩衝鹽水:含有150mmnacl的50mm,ph7.5磷酸鹽緩衝液)中。得到的溶液通過反覆吸液進行混合併通過在10000g下離心10分鐘進行澄清。向4μl等份得到的上清液中加入4μl10μmhmdm2的pbs溶液。每個8.0μl實驗樣品因此含有在pbs中的濃度為5.0μm的40pmol(1.5μg)蛋白質,加1μm擬肽大環化合物和2.5%dmso。針對每個濃度點如此製備的雙份樣品在室溫下溫育60分鐘,然後冷卻至4℃,之後進行5.0μl注入液的大小排阻層析-lc-ms分析。將含有靶蛋白、蛋白質-配體複合體和未結合的化合物的樣品注入到sec柱上,通過快速sec步驟將複合體與未結合的成分在該柱上分離。採用uv檢測器監測sec柱洗脫液,以證實在sec柱的外水體積中洗脫的早期洗脫的蛋白質級分從保留在柱上的未結合的成分中良好地分離出來。在含有蛋白質和蛋白質-配體複合體的峰從主uv檢測器洗脫後,它進入樣品環路,在其中從sec階段的流上截下,並通過閥門機構直接轉移到lc-ms。通過esi-ms以預期的m/z觀察擬肽大環化合物的(m+3h)3+離子,證實檢測到蛋白質-配體複合體。
用於蛋白質-配體kd滴定實驗的分析
為了評估測試化合物對蛋白質的結合和親和力,例如,進行蛋白質-配體kd滴定實驗。蛋白質-配體kd滴定實驗如下進行:製備連續稀釋的滴定劑擬肽大環化合物儲備溶液(5,2.5,...,0.098mm)的2μldmso等份,然後溶解在38μlpbs中。得到的溶液通過反覆吸液進行混合併通過在10000g下離心10分鐘進行澄清。向4.0μl等份得到的上清液中加入4.0μl10μmhmdm2的pbs溶液。每個8.0μl實驗樣品因此含有在pbs中的濃度為5.0μm的40pmol(1.5μg)蛋白質,不同濃度(125,62.5,...,0.24μm)的滴定肽和2.5%dmso。針對每個濃度點如此製備的雙份樣品在室溫下溫育30分鐘,然後冷卻至4℃,之後進行2.0μl注入液的sec-lc-ms分析。通過esi-ms觀察(m+h)1+、(m+2h)2+、(m+3h)3+和/或(m+na)1+離子;對提取的離子色譜圖進行定量,然後與方程擬合,以推導出結合親和力kd,如以下文獻所述:「ageneraltechniquetorankprotein-ligandbindingaffinitiesanddetermineallostericvs.directbindingsitecompetitionincompoundmixtures.」annis,d.a.;nazef,n.;chuang,c.c.;scott,m.p.;nash,h.m.j.am.chem.soc.2004,126,15495-15503,以及「alis:anaffinityselection-massspectrometrysystemforthediscoveryandcharacterizationofprotein-ligandinteractions」d.a.annis,c.-c.chuang,andn.nazef.inmassspectrometryinmedicinalchemistry.wannerk,g:wiley-vch編著;2007:121-184.mannholdr,kubinyih,folkersg(系列編者):methodsandprinciplesinmedicinalchemistry。
通過親和選擇-質譜法進行競爭性結合實驗的分析
為了確定測試化合物競爭性結合蛋白質的能力,例如,進行親和選擇-質譜分析試驗。通過將三種化合物中每一種的2μl等份400μm儲備液與14μldmso混合製備每種成分40μm的配體混合物。然後,將1μl等份的該每種成分40μm的混合物與滴定劑擬肽大環化合物連續稀釋儲備溶液(10,5,2.5,...,0.078mm)的1μldmso等份混合。將這些2μl樣品溶解在38μlpbs中。得到的溶液通過反覆吸液進行混合併通過在10000g下離心10分鐘進行澄清。向4.0μl等份得到的上清液中加入4.0μl10μmhmdm2蛋白的pbs溶液。每個8.0μl實驗樣品因此含有在pbs中的濃度為5.0μm的40pmol(1.5μg)蛋白質,加0.5μm配體、2.5%dmso和不同濃度(125,62.5,...,0.98μm)的滴定劑擬肽大環化合物。針對每個濃度點如此製備的雙份樣品在室溫下溫育60分鐘,然後冷卻至4℃,之後進行2.0μl注入液的sec-lc-ms分析。這些和其它方法的另外的細節在以下文獻中提供:「ageneraltechniquetorankprotein-ligandbindingaffinitiesanddetermineallostericvs.directbindingsitecompetitionincompoundmixtures.」annis,d.a.;nazef,n.;chuang,c.c.;scott,m.p.;nash,h.m.j.am.chem.soc.2004,126,15495-15503;以及「alis:anaffinityselection-massspectrometrysystemforthediscoveryandcharacterizationofprotein-ligandinteractions」d.a.annis,c.-c.chuang,andn.nazef.inmassspectrometryinmedicinalchemistry.wannerk,g:wiley-vch編著;2007:121-184.mannholdr,kubinyih,folkersg(系列編者):methodsandprinciplesinmedicinalchemistry。
在完整細胞中的結合分析
有可能通過免疫沉澱實驗測定肽或擬肽大環化合物與其天然受體在完整細胞中的結合。例如,完整的細胞與螢光標記的(fitc-標記的)化合物在無血清的情況下溫育4小時,接著進行血清置換並進一步溫育4-18小時。然後使細胞沉澱,並在4℃下在裂解緩衝液(50mmtris[ph7.6]、150mmnacl、1%的chaps和蛋白酶抑制劑混合物)中溫育10分鐘。以14,000rpm離心提取物15分鐘,收集上清液,並與10μl山羊抗-fitc抗體一起溫育2小時,在4℃下旋轉,接著進一步在4℃下與蛋白a/gsepharose(50μl的50%微珠漿)溫育2小時。快速離心之後,將沉澱物在含有漸增的鹽濃度(例如,150、300、500mm)的裂解緩衝液中洗滌。隨後以150mmnacl再平衡微珠,之後加入含有sds的樣品緩衝液並煮沸。離心之後,任選地使用4%-12%梯度的bis-tris凝膠對上清液進行電泳,接著轉移到immobilon-p膜上。封閉後,任選地將印跡與檢測fitc的抗體一起溫育,也與一種或多種檢測與擬肽大環化合物結合的蛋白質的抗體一起溫育。
細胞透性分析
與相應的非交聯大環化合物相比,擬肽大環化合物例如具有更高的細胞透性。具有優化的連接體的擬肽大環化合物具有例如是相應的非交聯大環化合物的至少2倍的細胞透性,並且常常觀察到20%或更多的應用的擬肽大環化合物在4小時後已滲透入細胞。為了測量擬肽大環化合物和相應的非交聯大環化合物的細胞透性,將完整的細胞與螢光標記的(例如螢光化的(fluoresceinated))擬肽大環化合物或相應的非交聯大環化合物(10μm)一起在不含血清的培養基中37℃溫育4小時,用培養基洗滌2次,並與胰蛋白酶(0.25%)在37℃下溫育10分鐘。再次洗滌細胞並將其重懸浮於pbs中。例如,通過使用facscalibur流式細胞儀或cellomics』hcs讀數儀分析細胞螢光。.
細胞效力分析
例如,在基於細胞的殺傷試驗中,使用多種致瘤和非致瘤的細胞系及源自人類或小鼠細胞群體的原代細胞測定某些擬肽大環化合物的效力。例如,在與擬肽大環化合物(0.5-50μm)一起溫育的24-96小時期間監測細胞的活力,以鑑定那些以ec50<10μm殺死細胞的化合物。檢測細胞活力的幾種標準分析是可以通過商業途徑得到的,並且任選地用來評價擬肽大環化合物的效力。另外,測定膜聯蛋白v和胱天蛋白酶激活的分析任選地用來評價擬肽大環化合物是否通過激活凋亡機制殺死細胞。例如,採用celltiter-glo試驗,該試驗確定隨細胞內atp濃度變化的細胞活力。
體內穩定性分析
為了研究擬肽大環化合物的體內穩定性,例如,向小鼠和/或大鼠通過靜脈內、腹膜內、口服或吸入途徑以0.1-50mg/kg的濃度施用化合物,並在注射後0'、5'、15'、30'、1小時、4小時、8小時和24小時抽取血樣。然後如上所述通過lc-ms/ms測定25μl新鮮血清中的完整化合物的水平。
在動物模型中的體內效力
為了確定擬肽大環化合物在體內的抗致癌活性,例如,化合物單獨給予(靜脈內、腹膜內、口服、通過吸入或鼻途徑)或與亞最佳劑量的相關化療劑(例如,環磷醯胺、阿黴素、依託泊苷)聯合給予。在一個實例中,在nod-scid小鼠遭受全身輻射3小時後,通過尾靜脈注射穩定表達螢光素酶的5x106rs4;11細胞(從急性淋巴細胞白血病患者的骨髓建立)。如果不予處理,在該模型中這種形式的白血病在3周內是致命的。例如,通過對小鼠注射d-螢光素(60mg/kg)並對麻醉的動物進行成像(例如,xenogeninvivoimagingsystem,caliperlifesciences,hopkinton,ma)可容易地監測該白血病。通過livingimagesoftware(caliperlifesciences,hopkinton,ma)進行光子通量(photonicflux)(光子/秒)的積分(integration)來對全身生物發光進行定量。例如,擬肽大環化合物單獨地或與亞最佳劑量的相關化學治療劑聯合地通過尾靜脈或靜脈內途徑以0.1mg/kg-50mg/kg的劑量向白血病小鼠施用(注射後10天/實驗第1天,生物發光範圍為14-16)7-21天。任選地,在整個實驗過程中每隔一天對小鼠成像,並在實驗期間每天監測其存活。在實驗結束時任選地對死亡的小鼠進行屍體檢查。另一種動物模型是將穩定表達螢光素酶的dohh2(源自人類濾泡性淋巴瘤的細胞系)植入到nod-scid小鼠中。這些體內試驗任選地產生初步的藥代動力學、藥效學和毒理學數據。
臨床試驗
為了確定擬肽大環化合物對於人類治療的適用性,進行了臨床試驗。例如,可選擇出被診斷為患有癌症並且需要治療的患者並將他們分成治療組和一個或多個對照組,其中,對治療組施用擬肽大環化合物,而對照組接受安慰劑或已知的抗癌藥物。這樣,可以通過對患者組就諸如生存率和生活質量的因素進行比較來評價擬肽大環化合物的治療安全性和有效性。在本實施例中,相比於用安慰劑治療的患者對照組,用擬肽大環化合物治療的患者組可以顯示出提高的長期生存率。
藥物組合物和給藥途徑
本文公開的藥物組合物包含擬肽大環化合物及其藥學上可接受的衍生物或前藥。「藥學上可接受的衍生物」意指本文公開的化合物的任何藥學上可接受的鹽、酯、酯的鹽、前藥或其它衍生物,其在向接受者施用後能夠(直接或間接地)提供本文公開的化合物。尤其有利的藥學上可接受的衍生物是當向哺乳動物施用時可以提高該化合物的生物利用度(例如,通過提高口服施用的化合物進入血液的吸收),或相對於母體物質增加活性化合物向生物區室(例如,腦或淋巴系統)的遞送的那些衍生物。一些藥學上可接受的衍生物包含提高水溶性或跨過胃腸黏膜的主動轉運的化學基團。
在一些實施方案中,擬肽大環化合物通過共價或非共價地連接的合適的官能團進行修飾,以提高選擇性的生物學性質。這樣的修飾包括那些提高進入給定生物區室(例如,血液、淋巴系統、中樞神經系統)的生物學滲透性、提高口服利用度、增加溶解度以允許注射施用、改變代謝以及改變排洩率的修飾。
本文公開的化合物的藥學上可接受的鹽包括那些由藥學上可接受的無機和有機的酸和鹼衍生的鹽。合適的酸式鹽的例子包括乙酸鹽、己二酸鹽、苯甲酸鹽、苯磺酸鹽、丁酸鹽、檸檬酸鹽、二葡糖酸鹽、十二烷基硫酸鹽、甲酸鹽、延胡索酸鹽、乙醇酸鹽、半硫酸鹽、庚酸鹽、己酸鹽、鹽酸鹽、氫溴酸鹽、氫碘酸鹽、乳酸鹽、馬來酸鹽、丙二酸鹽、甲磺酸鹽、2-萘磺酸鹽、煙酸鹽、硝酸鹽、棕櫚酸鹽(palmoate)、磷酸鹽、苦味酸鹽、新戊酸鹽、丙酸鹽、水楊酸鹽、琥珀酸鹽、硫酸鹽、酒石酸鹽、甲苯磺酸鹽和十一酸鹽(undecanoate)。由合適的鹼衍生的鹽包括鹼金屬鹽(例如,鈉鹽)、鹼土金屬鹽(例如,鎂鹽)、銨鹽和n-(烷基)4+鹽。
為了由本文公開的化合物製備藥物組合物,藥學上可接受的載體包括固體或液體載體。固體形式的製劑包括粉劑、片劑、丸劑、膠囊劑、扁囊劑、栓劑和分散顆粒劑。固體載體可以是一種或多種物質,其也可以作為稀釋劑、調味劑、粘合劑、防腐劑、片劑崩解劑或包封材料發揮作用。在科學文獻和專利文獻中詳細描述了配製和給藥技術的細節,參見,例如,最新版本的remington'spharmaceuticalsciences,maackpublishingco,eastonpa。
在粉劑中,載體是細碎的固體,其與細碎的活性成分混合。在片劑中,活性成分與具有必要粘合性質的載體按照適當的比例混合,並壓製成需要的形狀和大小。
合適的固體賦形劑是碳水化合物或蛋白質填料,包括但不限於:糖,包括乳糖、蔗糖、甘露醇或山梨醇;來自玉米、小麥、水稻、馬鈴薯或其它植物的澱粉;纖維素,如甲基纖維素、羥丙基甲基纖維素或羧甲基纖維素鈉;和樹膠,包括阿拉伯樹膠和黃蓍膠;以及蛋白質,如明膠和膠原蛋白。如果需要的話,加入崩解劑或增溶劑,如交聯的聚乙烯吡咯烷酮、瓊脂、海藻酸或其鹽如海藻酸鈉。
液體形式的製劑包括溶液、懸浮液和乳液,例如,水或水/丙二醇溶液。對於腸胃外注射,液體製劑可以在聚乙二醇水溶液中配製成溶液。
藥物製劑可以為單位劑型。在這樣的形式中,製劑細分為含有適量活性成分的單位劑量。單位劑型可以是包裝製劑,該包裝包含不連續量的製劑,如包裝的片劑、膠囊和小瓶或安瓿中的粉末。另外,單位劑型也可以是膠囊、片劑、扁囊劑或錠劑本身,或者可以是包裝形式的適當數目的這些劑型中的任一種。
當一種或多種本文公開的組合物包含擬肽大環化合物和一種或多種另外的治療劑或預防劑的組合時,該化合物和另外的藥劑都應該以通常在單一治療方案中施用的劑量的大約1-100%的劑量水平,更優選大約5-95%的劑量水平存在。在一些實施方案中,另外的藥劑作為多劑量方案的一部分與一種或多種本文公開的化合物分開施用。或者,這些藥劑是單一劑型的一部分,在單一組合物中與本文公開的化合物混合在一起。
使用方法
在一個方面,本文提供了新型擬肽大環化合物,其可在競爭性結合試驗中用於鑑別可與擬肽大環化合物所模擬的蛋白質或肽的天然配體相結合的物質。例如,在p53/mdmx系統中,基於p53的標記的擬肽大環化合物可以與競爭性結合mdmx的小分子一起在mdmx結合試驗中使用。競爭結合研究允許在體外快速評價及確定對於p53/mdmx系統具有特異性的候選藥物。可以使用本文公開的任何擬肽大環化合物及其結合配偶體進行這類結合研究。
進一步提供了生成抗擬肽大環化合物的抗體的方法。在一些實施方案中,這些抗體特異性地結合擬肽大環化合物和擬肽大環化合物相關的前體肽,如p53。例如,這樣的抗體破壞天然的蛋白質-蛋白質相互作用,例如p53與mdmx之間的結合。
在其它方面,本文提供了處理處於患與分子(包括p53、mdm2或mdmx)的異常(例如,不足或過量)表達或活性有關的疾病的危險中(或易患所述疾病)或患有所述疾病的受試者的預防方法和治療方法。
在另一實施方案中,疾病至少部分地是由p53或mdm2或mdmx的異常水平(例如,過度表達或不足表達)引起的,或由顯示異常活性的p53或mdm2或mdmx的存在引起的。這樣,由源自p53的擬肽大環化合物導致的p53或mdm2或mdmx水平和/或活性的降低或者p53或mdm2或mdmx水平和/或活性的提高用來例如緩解或減輕疾病的負面症狀。
另一方面,本文提供了通過幹擾結合配偶體之間(例如,p53與mdm2或p53與mdmx之間)的相互作用或結合來治療或預防疾病(包括過度增殖性疾病和炎性病症)的方法。這些方法包括向包括人類的溫血動物施用有效量的化合物。在一些實施方案中,一種或多種本文公開的化合物的施用誘導細胞生長停滯或凋亡。
如本文所用的,術語「治療」被定義為向患者應用或施用治療劑,或者向從患者分離的組織或細胞系應用或施用治療劑,所述患者患有疾病、疾病症狀或具有患病傾向,其目的是治癒、恢復、減輕、解除、改變、矯正、緩解、改善或影響疾病、疾病症狀或患病傾向。
在一些實施方案中,擬肽大環化合物可以用來治療、預防和/或診斷癌症和腫瘤性病狀。如本文所用的,術語「癌症」、「過度增殖的」和「腫瘤性的」指具有自主生長能力的細胞,即,以快速增殖的細胞生長為特徵的異常狀態或病狀。過度增殖性的和腫瘤性的疾病狀態可以分類為病理性的,即,表現或構成疾病狀態;或者可以分類為非病理性的,即,偏離正常但與疾病狀態無關。該術語意味著包括所有類型的癌性生長或致癌過程、轉移性的組織或惡性轉化的細胞、組織或器官,而與組織病理類型或侵入階段無關。轉移性腫瘤可以由許多原發性腫瘤類型產生,包括但不限於:乳腺、肺、肝、結腸和卵巢源的腫瘤類型。「病理性過度增殖」細胞出現於以惡性腫瘤生長為特徵的疾病狀態中。非病理性過度增殖細胞的例子包括與創傷修復有關的細胞增殖。細胞增殖和/或分化疾病的例子包括癌症,例如,癌瘤、肉瘤或轉移性疾病。在一些實施方案中,擬肽大環化合物是用於控制乳腺癌、卵巢癌、結腸癌、肺癌、這些癌症的轉移等的新的治療劑。
癌症或腫瘤性疾病的例子包括但不限於:纖維肉瘤、肌肉瘤、脂肪肉瘤、軟骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、內皮肉瘤、淋巴管肉瘤、淋巴管內皮肉瘤、滑膜瘤、間皮瘤、尤因氏瘤、平滑肌肉瘤、橫紋肌肉瘤、胃癌、食道癌、直腸癌、胰腺癌、卵巢癌、前列腺癌、子宮癌、頭頸癌、皮膚癌、腦癌、鱗狀細胞癌、皮脂腺癌、乳頭狀癌、乳頭狀腺癌、囊腺癌、髓樣癌、支氣管原癌、腎細胞癌、肝細胞瘤、膽管癌、絨毛膜癌、精原細胞瘤、胚胎性癌、維爾姆斯腫瘤、子宮頸癌、睪丸癌、小細胞肺癌、非小細胞肺癌、膀胱癌、上皮癌、神經膠質瘤、星形細胞瘤、髓母細胞瘤、顱咽管瘤、室管膜瘤、松果體瘤、血管母細胞瘤、聽神經瘤、少突神經膠質瘤、腦脊膜瘤、黑素瘤、神經母細胞瘤、視網膜母細胞瘤、白血病、淋巴瘤或卡波西肉瘤。
在一些實施方案中,所述癌症是頭頸癌、黑素瘤、肺癌、乳腺癌或神經膠質瘤。
增殖性疾病的例子包括造血系統腫瘤性疾病。如本文所用,術語「造血系統腫瘤性疾病」包括涉及造血系統起源的(例如,源自骨髓、淋巴或紅細胞譜系的)增生性/腫瘤性細胞或其前體細胞的疾病。該疾病可起因於分化不良的急性白血病,例如,成紅細胞白血病和急性巨核母細胞性白血病。另外的示例性的骨髓疾病包括但不限於:急性早幼粒細胞白血病(apml)、急性髓性白血病(aml)和慢性髓性白血病(cml)(綜述見vaickus(1991),critrev.oncol./hemotol.11:267-97);淋巴樣惡性腫瘤包括但不限於急性淋巴母細胞性白血病(all),包括b-譜系all和t-譜系all、慢性淋巴細胞性白血病(cll)、幼淋巴細胞性白血病(pll)、多毛細胞白血病(hll)和瓦爾登斯特倫巨球蛋白血症(wm)。其它形式的惡性淋巴瘤包括但不限於:非何杰金淋巴瘤及其變化形式、外周t細胞淋巴瘤、成人t細胞白血病/淋巴瘤(atl)、皮膚t細胞淋巴瘤(ctcl)、巨粒淋巴細胞白血病(lgf)、何杰金病和裡德-斯特恩伯格病。
乳腺的細胞增殖和/或分化疾病的例子包括但不限於:增生性乳腺疾病,包括,例如,上皮細胞增生、硬化性腺病和小導管乳頭狀瘤;腫瘤,例如,諸如纖維腺瘤、葉狀瘤和肉瘤的間質腫瘤,和諸如大導管乳頭狀瘤的上皮腫瘤;乳腺癌,包括原位(非侵襲性)癌(包括原位導管癌(包括佩吉特病)和原位小葉癌)和侵襲性(浸潤性)癌(包括但不限於,浸潤性導管癌、浸潤性小葉癌、髓樣癌、膠體(粘液)癌、小管癌和侵襲性乳頭狀癌);和混雜性的惡性腫瘤。男性乳房疾病包括但不限於男性乳腺發育症和癌。
皮膚的細胞增殖性和/或分化性病症的實例包括但不限於增殖性皮膚病,如黑素瘤,包括黏膜黑素瘤、淺表擴散性黑素瘤、結節性黑素瘤、雀斑(例如,惡性雀斑樣痣、惡性雀斑樣黑素瘤或肢端著色斑性黑素瘤)、無黑色素黑色素瘤、結締組織增生性黑素瘤、具有斯皮茨痣特徵的黑素瘤、具有小痣樣細胞的黑素瘤、息肉狀黑素瘤和軟組織黑素瘤;基底細胞癌,包括小結基底細胞癌、表面基底細胞癌、結節性基底細胞癌(侵蝕性潰瘍)、囊性基底細胞癌、疤痕性基底細胞癌、色素性基底細胞癌、異位基底細胞癌、浸潤性基底細胞癌、痣樣基底細胞癌症候群、息肉狀基底細胞癌、孔樣基底細胞癌和平庫斯纖維上皮瘤;鱗狀細胞癌,包括棘皮瘤(巨細胞棘皮瘤)、腺樣鱗狀細胞癌、基底細胞樣鱗狀細胞癌、透明細胞鱗狀細胞癌、印戒細胞鱗狀細胞癌、梭形細胞鱗狀細胞癌、馬喬林潰瘍、凱拉增生性紅斑和bowen病;或其它皮膚或皮下腫瘤。
肺的細胞增殖和/或分化疾病的例子包括但不限於:支氣管原癌,包括類腫瘤症候群、細支氣管肺泡癌、神經內分泌腫瘤,例如,支氣管類癌瘤、混雜性腫瘤和轉移性腫瘤;胸膜的病狀,包括炎性胸腔積液、非炎性胸腔積液、氣胸和胸膜腫瘤,包括孤立性纖維瘤(胸膜纖維瘤)和惡性間皮瘤。
結腸的細胞增殖和/或分化疾病的例子包括但不限於:非腫瘤性息肉、腺瘤、家族性症候群、結直腸癌形成、結直腸癌和類癌瘤。
肝的細胞增殖和/或分化疾病的例子包括但不限於:結節性增生、腺瘤和惡性腫瘤,包括原發肝癌和轉移性腫瘤。
卵巢的細胞增殖和/或分化疾病的例子包括但不限於:卵巢腫瘤,例如,體腔上皮腫瘤、漿液性腫瘤、粘液瘤、子宮內膜樣瘤、透明細胞腺癌、囊腺纖維瘤、布倫納瘤、表面上皮腫瘤;生殖細胞瘤,例如,成熟(良性)畸胎瘤、單胚層畸胎瘤、不成熟的惡性畸胎瘤、無性細胞瘤、內胚層竇瘤、絨毛膜癌;性索-間質腫瘤(sexcord-stomaltumors),例如,粒層-卵泡膜細胞瘤、泡膜細胞瘤纖維瘤(thecomafibromas)、男性母細胞瘤、希爾細胞瘤(hillcelltumors)和性腺母細胞瘤;和諸如克魯肯貝格瘤的轉移性腫瘤。
雖然本文已顯示和描述了本發明的優選實施方案,但是對於本領域的技術人員顯而易見的是,這些實施方案只是以舉例的方式提供的。在不背離本發明的情況下,本領域技術人員將會想到許多變化、改變和替換。應當理解,在實施本發明時,可以採用本文所述的本發明的實施方案的各種替代方案。旨在用下列權利要求限定範圍,並且這些權利要求範圍內的方法和結構及其等效物也涵蓋在本發明內。
實施例
實施例1:6-氯色氨酸fmoc胺基酸的合成
6-氯-3-甲醯基-1h-吲哚-1-甲酸叔丁酯,1。在氬氣下於0℃向攪拌中的幹dmf(12ml)的溶液中逐滴加入pocl3(3.92ml,43mmol,1.3當量)。在同一溫度下攪拌該溶液20分鐘,然後逐滴加入6-氯吲哚(5.0g,33mmol,1當量)的幹dmf(30ml)溶液。使所得到的混合物升溫至室溫,並再攪拌2.5h。加水(50ml),並用4mnaoh水溶液(ph~8)中和該溶液。濾出所得到的固體,用水洗滌,並在真空下乾燥。這種材料無需額外的純化而直接用於下一步驟。在n2下於室溫向攪拌中的粗甲醯吲哚(33mmol,1當量)的thf(150ml)溶液中相繼添加boc2o(7.91g,36.3mmol,1.1當量)和dmap(0.4g,3.3mmol,0.1當量)。在室溫下攪拌所得到的混合物1.5h,減壓蒸發溶劑。將殘留物用etoac吸收,並用1nhc1洗滌,乾燥並濃縮,從而得到白色固體甲醯吲哚1(經2步,9g,98%)。1hnmr(cdcl3)δ:1.70(s,boc,9h);7.35(dd,1h);8.21(m,3h);10.07(s,1h)。
6-氯-3-(羥甲基)-1h-吲哚-1-甲酸叔丁酯,2。向化合物1(8.86g,32mmol,1當量)的乙醇(150ml)溶液中加入nabh4(2.4g,63mmol,2當量)。在室溫下攪拌反應液3h。濃縮反應混合物,並將殘留物倒入乙醚和水中。分離有機層,用硫酸鎂乾燥並濃縮,從而得到白色固體(8.7g,98%)。這種材料無需額外的純化而直接用於下一步驟。1hnmr(cdcl3)δ:1.65(s,boc,9h);4.80(s,2h,ch2);7.21(dd,1h);7.53(m,2h);8.16(bs,1h)。
3-(溴甲基)-6-氯-1h-吲哚-1-甲酸叔丁酯,3。於-40℃向氬氣下的化合物2(4.1g,14.6mmol,1當量)的二氯甲烷(50ml)溶液中加入三苯基膦(4.59g,17.5mmol,1.2當量)的二氯甲烷(50ml)溶液。在40℃下再攪拌反應溶液30分鐘。然後加入nbs(3.38g,19mmol,1.3當量)。使所得到的混合物升溫至室溫並攪拌過夜。蒸發二氯甲烷,加入四氯化碳(100ml),攪拌混合物1h並過濾。將濾液濃縮,將其裝入二氧化矽柱塞,並用25%etoac的己烷溶液快速洗脫。濃縮溶液,得到白色泡沫(3.84g,77%)。1hnmr(cdcl3)δ:1.66(s,boc,9h);4.63(s,2h,ch2);7.28(dd,1h);7.57(d,1h);7.64(bs,1h);8.18(bs,1h)。
αme-6cl-trp(boc)-ni-s-bpb,4。在氬氣下向s-ala-ni-s-bpb(2.66g,5.2mmol,1當量)和ko-tbu(0.87g,7.8mmol,1.5當量)中加入50mldmf。通過注射器加入溴化物衍生化合物3(2.68g,7.8mmol,1.5當量)在dmf(5.0ml)中的溶液。在環境溫度下攪拌反應混合物1h。然後用5%的醋酸水溶液猝滅溶液,並用水稀釋。在二氯甲烷中萃取所需產物,乾燥並濃縮。在使用etoac和己烷作為洗脫液的正相上通過快速色譜法(固體加載)純化油狀產物4,得到紅色固體(1.78g,45%產率)。αme-6cl-trp(boc)-ni-s-bpb,4:m+h計算775.21,m+h觀測775.26;1hnmr(cdc13)δ:1.23(s,3h,αme);1.56(m,11h,boc+ch2);1.82-2.20(m,4h,2ch2);3.03(m,1h,chα);3.24(m,2h,ch2);3.57和4.29(ab系統,2h,ch2(苯甲基),j=12.8hz);6.62(d,2h);6.98(d,1h);7.14(m,2h);7.23(m,1h);7.32-7.36(m,5h);7.50(m,2h);7.67(bs,1h);7.98(d,2h);8.27(m,2h)。
fmoc-αme-6cl-trp(boc)-oh,6。向50℃的3nhcl/meoh(1/3,15ml)溶液中逐滴加入化合物4(1.75g,2.3mmol,1當量)的meoh(5ml)溶液。原始材料在3-4h內消失。然後用冰浴使酸性溶液冷卻至0℃,並用na2co3(1.21g,11.5mmol,5當量)水溶液將其猝滅。除去甲醇,並向懸浮液中添加另外8當量的na2co3(1.95g,18.4mmol)。然後添加清除鎳的edta二鈉鹽二水合物(1.68g,4.5mmol,2當量),並攪拌該懸浮液2h。添加fmoc-osu(0.84g,2.5mmol,1.1當量)的丙酮(50ml)溶液並攪拌該反應液過夜。之後,用乙醚和1nhc1稀釋該反應液。然後用硫酸鎂乾燥有機層,並在真空中濃縮。在正相上使用丙酮和二氯甲烷作為洗脫液純化所需產物6,得到白色泡沫(0.9g,70%產率)。fmoc-αme-6cl-trp(boc)-oh,6:m+h計算575.19,m+h觀測575.37;lhnmr(cdc13)1.59(s,9h,boc);1.68(s,3h,me);3.48(bs,2h,ch2);4.22(m,1h,ch);4.39(bs,2h,ch2);5.47(s,1h,nh);7.10(m,1h);7.18(m,2h);7.27(m,2h);7.39(m,2h);7.50(m,2h);7.75(d,2h);8.12(bs,1h)。
6cl-trp(boc)-ni-s-bpb,5。在氬氣下向gly-ni-s-bpb(4.6g,9.2mmol,1當量)和ko-tbu(1.14g,10.1mmol,1.1當量)中加入95mldmf。通過注射器添加溴化物衍生化合物3(3.5g,4.6mmol,1.1當量)在dmf(10ml)中的溶液。在環境溫度下攪拌反應混合物1h。然後用5%的醋酸水溶液猝滅溶液,並用水稀釋。在二氯甲烷中萃取所需產物,乾燥並濃縮。在正相上使用etoac和己烷作為洗脫液通過快速色譜法(固體加載)純化油狀產物5,得到紅色固體(5g,71%產率)。6cl-trp(boc)-ni-s-bpb,5:m+h計算761.20,m+h觀測761.34;1hnmr(cdcl3)δ:1.58(m,11h,boc+ch2);1.84(m,1h);1.96(m,1h);2.24(m,2h,ch2);3.00(m,1h,chα);3.22(m,2h,ch2);3.45和4.25(ab系統,2h,ch2(苯甲基),j=12.8hz);4.27(m,1h,chα);6.65(d,2h);6.88(d,1h);7.07(m,2h);7.14(m,2h);7.28(m,3h);7.35-7.39(m,2h);7.52(m,2h);7.96(d,2h);8.28(m,2h)。
fmoc-6cl-trp(boc)-oh,7。向50℃下的3nhcl/meoh(1/3,44ml)溶液中逐滴加入化合物5(5g,6.6mmol,1當量)在meoh(10ml)中的溶液。原始材料在3-4h內消失。然後用冰浴使酸性溶液冷卻至0℃,並用na2co3(3.48g,33mmol,5當量)水溶液將其猝滅。除去甲醇,並向懸浮液中添加另外8當量的na2co3(5.57g,52mmol)。然後添加清除鎳的edta二鈉鹽二水合物(4.89g,13.1mmol,2當量),並攪拌懸浮液2h。添加fmoc-osu(2.21g,6.55mmol,1.1當量)在丙酮(100ml)中的溶液,並攪拌反應液過夜。之後,用乙醚和1nhc1稀釋該反應液。然後用硫酸鎂乾燥有機層,並在真空中濃縮。在正相上使用丙酮和二氯甲烷作為洗脫液純化所需產物7,得到白色泡沫(2.6g,69%產率)。fmoc-6cl-trp(boc)-oh,7:m+h計算561.17,m+h觀測561.37;1hnmr(cdc13)1.63(s,9h,boc);3.26(m,2h,ch2);4.19(m,1h,ch);4.39(m,2h,ch2);4.76(m,1h);5.35(d,1h,nh);7.18(m,2h);7.28(m,2h);7.39(m,3h);7.50(m,2h);7.75(d,2h);8.14(bs,1h)。
實施例2:擬肽大環化合物
如以前所述以及如下所述合成、純化和分析擬肽大環化合物(schafmeister等人,j.am.chem.soc.122:5891-5892(2000);schafmeister和verdine,j.am.chem.soc.122:5891(2005);walensky等人,science305:1466-1470(2004);和美國專利號7,192,713)。通過用相對應的合成胺基酸替代兩個或多個天然存在的胺基酸來設計擬肽大環化合物。替代發生在i和i+4以及i和i+7位。使用固相條件、rinkamideam樹脂(novabiochem)和fmoc主鏈保護基團化學方法人工地或在自動化肽合成儀(appliedbiosystems,433a型)上進行肽合成。對於天然fmoc保護的胺基酸(novabiochem)的偶聯,使用10當量的胺基酸和1:1:2摩爾比的偶聯試劑hbtu/hobt(novabiochem)/diea。非天然胺基酸(4當量)與1:1:2摩爾比的hatu(appliedbiosystems)/hobt/diea偶聯。合成肽的n末端被乙醯化,而c末端被醯胺化。
通過在反相c18柱(varian)上的高效液相色譜法(hplc)(varianprostar)來實現交聯化合物的純化,以產生純的化合物。通過lc/ms質譜法(與agilent1100hplc系統接口連接的micromasslct)和胺基酸分析(appliedbiosystems,型號420a)確認該純產物的化學組成。
在包括sp662、sp663和sp664在內的二炔烴交聯的擬肽大環化合物的合成中使用下列方案。以0.2mmol規模在peg-ps樹脂(加載0.45mmol/g)上合成完全保護的結合樹脂的肽。通過採用在dmf中的20%(v/v)的哌啶對結合樹脂的肽進行3×10min的處理來實現臨時fmoc基團的脫保護。用nmp(3×)、二氯甲烷(3×)和nmp(3x)洗滌後,通過與適當的預活化的fmoc-胺基酸衍生物進行1×60min的溫育來實現每個連續胺基酸的偶聯。在將偶聯溶液轉移至脫保護的結合樹脂的肽之前,將所有被保護的胺基酸(0.4mmol)溶解在nmp中,並用hctu(0.4mmol)和diea(0.8mmol)進行活化。偶聯反應完成後,洗滌樹脂,準備下一個脫保護/偶聯循環。在存在於nmp中的乙酸酐/diea的存在下進行氨基末端的乙醯化。對從完全組裝的結合樹脂的肽的等分試樣所獲得的已切割和脫保護的樣品進行lc-ms分析以驗證每個偶聯的完成。在典型的實例中,將四氫呋喃(4ml)和三乙胺(2ml)加入到在40ml玻璃小瓶中的肽樹脂(0.2mmol)中並搖動10分鐘。然後加入pd(pph3)2cl2(0.014g,0.02mmol)和碘化亞銅(0.008g,0.04mmol),並將所得反應混合物在大氣開放的同時機械搖動16小時。在室溫下通過用tfa/h2o/tis(95/5/5v/v)處理2.5h來將二炔環化的結合樹脂的肽脫保護並從固體載體上切下。將樹脂過濾後,使tfa溶液在冷乙醚中沉澱並進行離心,以生產呈固體的所需產物。通過製備型hplc對粗產物進行純化。
在包括sp665在內的單炔交聯的擬肽大環化合物的合成中使用下列方案。以0.1mmol規模在rinkamidembha樹脂(加載0.62mmol/g)上合成完全保護的結合樹脂的肽。通過採用在nmp中的25%(v/v)的哌啶對結合樹脂的肽進行2×20min的處理來實現臨時fmoc基團的脫保護。採用nmp和二氯甲烷進行充分的流動洗滌後,通過與適當的預活化的fmoc-胺基酸衍生物進行1×60min的溫育來實現每個連續胺基酸的偶聯。在將偶聯溶液轉移至脫保護的結合樹脂的肽之前,將所有被保護的胺基酸(1mmol)溶解在nmp中,並用hctu(1mmol)和diea(1mmol)進行活化。偶聯反應完成後,對樹脂進行充分的流動洗滌,準備下一個脫保護/偶聯循環。在存在於nmp/nmm中的乙酸酐/diea的存在下進行氨基末端的乙醯化。對從完全組裝的結合樹脂的肽的等分試樣所獲得的已切割和脫保護的樣品進行lc-ms分析以驗證每個偶聯反應的完成。在一個典型的實例中,用dcm洗滌肽樹脂(0.1mmol)。將樹脂裝入微波小瓶中。對容器進行抽真空並用氮氣進行吹掃。加入六羰基鉬(0.01當量,sigmaaldrich199959)。將無水氯苯加入到反應容器中。然後加入2-氟苯酚(1當量,sigmaaldrichf12804)。將反應物裝入微波爐,並在130℃保持10分鐘。可能需要在隨後的時間推動反應以完成反應。在室溫下通過用tfa/h2o/tis(94/3/3v/v)處理3h來對炔烴複分解的樹脂結合肽進行脫保護並將其從固體載體上切下。將樹脂過濾後,使tfa溶液在冷乙醚中沉澱並進行離心,以得到呈固體的所需產物。通過製備型hplc對粗產物進行純化。
表1示出了所製備的擬肽大環化合物的列表。
表1
表1a示出了擬肽大環化合物的選擇。
表1a
表1b示出了擬肽大環化合物的進一步選擇。
表1b
在上文和別處顯示的序列中,使用了以下縮寫:「nle」表示正亮氨酸,「aib」表示2-氨基異丁酸,「ac」表示乙醯基,並且「pr」表示丙醯基。由「$」表示的胺基酸是由全碳交聯體連接的α-mes5-戊烯基-丙氨酸烯烴胺基酸,其包含一個雙鍵。由「$r5」表示的胺基酸是由全碳交聯體連接的α-mer5-戊烯基-丙氨酸烯烴胺基酸,其包含一個雙鍵。由「$s8」表示的胺基酸是由全碳交聯體連接的α-mes8-辛烯基-丙氨酸烯烴胺基酸,其包含一個雙鍵。由「$r8」表示的胺基酸是由全碳交聯體連接的α-mer8-辛烯基-丙氨酸烯烴胺基酸,其包含一個雙鍵。「ahx」表示氨基環己基連接體。該交聯體是直鏈全碳交聯體,其在每個胺基酸的α碳之間包含8個或11個碳原子。由「$/」表示的胺基酸是並非由任何交聯體連接的α-mes5-戊烯基-丙氨酸烯烴胺基酸。由「$/r5」表示的胺基酸是未由任何交聯體連接的α-mer5-戊烯基-丙氨酸烯烴胺基酸。由「$/s8」表示的胺基酸是未由任何交聯體連接的α-mes8-辛烯基-丙氨酸烯烴胺基酸。由「$/r8」表示的胺基酸是未由任何交聯體連接的α-mer8-辛烯基-丙氨酸烯烴胺基酸。由「amw」表示的胺基酸是胺基酸α-me色氨酸。由「aml」表示的胺基酸是胺基酸α-me亮氨酸。由「amf」表示的胺基酸是胺基酸α-me苯丙氨酸。由「2ff」表示的胺基酸是胺基酸2-氟-苯丙氨酸。由「3ff」表示的胺基酸是胺基酸3-氟-苯丙氨酸。由「st」表示的胺基酸是包含兩條戊烯基丙氨酸烯烴側鏈且如所示每條側鏈與另一胺基酸交聯的胺基酸。由「st//」表示的胺基酸是包含兩條不交聯的戊烯基丙氨酸烯烴側鏈的胺基酸。由「%st」表示的胺基酸是包含兩條戊烯基丙氨酸烯烴側鏈且如所示每條側鏈通過完全飽和的烴交聯與另一胺基酸交聯的胺基酸。由「ba」表示的胺基酸是β-丙氨酸。交聯胺基酸的名稱內的小寫字母「e」或「z」(例如「$er8」或「$zr8」)表示雙鍵構型(分別為e或z)。在其它情況下,諸如「a」或「f」的小寫字母表示d胺基酸(例如,分別為d-丙氨酸或d-苯丙氨酸)。指定為「nmw」的胺基酸表示n-甲基色氨酸。指定為「nmy」的胺基酸表示n-甲基酪氨酸。指定為「nma」的胺基酸表示n-甲基丙氨酸。「kbio」表示連接至賴氨酸殘基的側鏈氨基的生物素基團。指定為「sar」的胺基酸表示肌氨酸。指定為「cha」的胺基酸表示環己基丙氨酸。指定為「cpg」的胺基酸表示環戊基甘氨酸。指定為「cba」的胺基酸表示環丁基丙氨酸。指定為「f4i」的胺基酸表示4-碘代苯丙氨酸。「7l」表示n15同位素亮氨酸。指定為「f3cl」的胺基酸表示3-氯苯丙氨酸。指定為「f4cooh」的胺基酸表示4-羧基苯丙氨酸。指定為「f34f2」的胺基酸表示3,4-二氟苯丙氨酸。指定為「6clw」的胺基酸表示6-氯色氨酸。指定為「$rda6」的胺基酸表示經由二炔鍵交聯至第二炔基胺基酸的α-mer6-己炔基-丙氨酸炔基胺基酸。指定為「$da5」的胺基酸表示α-mes5-戊炔基-丙氨酸炔基胺基酸,其中該炔烴與第二炔基胺基酸形成二炔鍵的一半。指定為「$ra9」的胺基酸表示經由炔烴複分解反應與第二炔基胺基酸交聯的α-mer9-壬炔基-丙氨酸炔基胺基酸。指定為「$a6」的胺基酸表示經由炔烴複分解反應與第二炔基胺基酸交聯的α-mes6-己炔基-丙氨酸炔基胺基酸。指定「iso1」或「iso2」指示該擬肽大環化合物是單一異構體。
指定為「cit」的胺基酸表示瓜氨酸。分別指定為「cou4」、「cou6」、「cou7」和「cou8」的胺基酸表示下列結構:
在一些實施方案中,擬肽大環化合物以超過一種異構體獲得,例如這是由於交聯體結構中雙鍵的構型(e與z)。此類異構體能夠或不能通過常規的色譜法分離。在一些實施方案中,一種異構體相對於其它異構體具有改善的生物學性質。在一個實施方案中,擬肽大環化合物的e交聯體烯烴異構體相對於其z對應物具有更好的溶解度、更好的靶標親和性、更好的體內或體外效力、更高的螺旋度或提高的細胞透性。在一個實施方案中,擬肽大環化合物的z交聯體烯烴異構體相對於其e對應物具有更好的溶解度、更好的靶標親和性、更好的體內或體外效力、更高的螺旋度或提高的細胞透性。
表1c顯示了示例性的擬肽大環化合物:
表1c
在一些實施方案中,擬肽大環化合物不包括表2a所示的擬肽大環化合物:
表2a
在表2中,x表示s或任意胺基酸。所示的肽可包含n-末端封端基團如乙醯基或另外的連接體,如在封端基團與肽序列的起點之間的β-丙氨酸。
在一些實施方案中,擬肽大環化合物不包含如表2a所示的擬肽大環化合物結構。
在其它實施方案中,擬肽大環化合物不包括表2b所示的擬肽大環化合物。
表2b
在一些實施方案中,本文公開的擬肽大環化合物不包含如表2b所示的擬肽大環化合物結構。
表2c示出了包含d-胺基酸的非交聯多肽的實例。
實施例3:與mdmx複合的擬肽大環化合物的x射線共晶學
對於與肽46(表2b)的共結晶,在開始進行結晶實驗前,將來自在dmso中的100mm儲備溶液的化學計算量的化合物加入到斑馬魚mdmx蛋白質溶液中,並在4℃下靜置過夜。該程序與popowicz等人描述的過程相似,有一些變化,如下文所述。使用pet15b載體從大腸桿菌bl21(de3)表達系統中獲得蛋白質(殘基15-129,l46v/v95l)。使細胞在37℃下生長並用1mmiptg以0.7細胞的od600進行誘導以使細胞在23℃下再生長18小時。使用ni-nt瓊脂糖隨後使用superdex75緩衝液(採用50mmnapo4、ph8.0、150mmnacl、2mmtcep進行)純化蛋白質,然後濃縮至24mg/ml。將緩衝液更換為20mm的tris(ph8.0,50mmnacl,2mmdtt)用於結晶實驗。採用nextal(qiagen)ams篩#94得到初始晶體,且最終優化的儲液為2.6mams,75mm的hepes,ph7.5。晶體在4℃下按常規作為薄片生長,並通過含有濃縮的(3.4m)丙二酸酯牽引它們進行冷沉澱保護,然後就驟冷,儲存,並在液氮中裝運。
在aps,在100°k且波長的光束線31-id(sgx-cat)下進行數據的收集。光束線配備有rayonix225-he探測器。對於數據收集,採用0.8秒的曝光時間使晶體以1°的增量在整個180°進行旋轉。使用mosflm/scala(ccp4;參見theccp4suite:programsforproteincrystallography.actacrystallogr.d50,760-763(1994);p.r.evans.jointccp4以及esf-eacbmnewsletter33,22-24(1997))以空間群c2(晶胞:a=109.2786,b=81.0836,α=90,β=89.8577,γ=90°)對數據進行處理並縮減。採用程序molrep(ccp4;參見a.vagin&a.teplyakov.j.appl.cryst.30,1022-1025(1997))的分子置換通過採用由popowicz等(2z5s;參見g.m.popowicz,a.czarna,u.rothweiler,a.szwagierczak,m.krajewski,l.weber&t.a.holak.cellcycle6,2386-2392(2007))確定的結構的mdmx分量進行,並識別了在非對稱單元中的兩個分子。採用程序refmac僅對斑馬魚mdmx的兩個分子進行初始精煉(ccp4;參見g.n.murshudov,a.a.vagin&e.j.dodson.actacrystallogr.d53,240-255(1997))產生0.3424的r-因子(rfree=0.3712)和鍵的rmsd值和角度(1.698°)。對於從gln19開始且包括所有的脂肪族釘(staple)的釘肽成分的電子密度是非常明確的。使用cnx(accelrys)及數據進一步細化為的解析度產生了被很好地精煉(rf=0.2601,rfree=0.3162,rmsd及rmsd角=0.916°)的模型(由來自mdmx的1448個原子、來自釘肽的272個原子和46個水分子組成)。
本實施例的結果示於圖1和圖2中。
實施例4:α-螺旋度的圓二色性(cd)分析
使用帶有第2版jascospectramanager系統軟體的jascoj-815分光偏振計(jascoinc.,easton,md)通過cd光譜法分析肽溶液。使用珀爾帖(peltier)溫度控制器保持對光單元的溫度控制。結果表示為從公式[θ]=θobs·mrw/10*l*c計算得到的平均摩爾橢圓度[θ](degcm2dmol-1),在該公式中,θobs為觀察到的以毫度為單位的橢圓度,mrw為肽的平均殘基重量(肽的分子量/殘基數),l為以釐米為單位的單元的光程長度,c為以mg/ml為單位的肽濃度。通過胺基酸分析確定肽濃度。在溫和cd緩衝液(20mm磷酸,ph2)中製備肽的儲備溶液。使用該儲備溶液在溫和cd緩衝液或含有50%三氟乙醇(tfe)的cd緩衝液中製備0.05mg/ml的肽溶液,以用於在10mm光程單元中的分析。在4℃下,從195至250nm,以0.2nm的增量以及每分鐘50nm的掃描速度掃描肽溶液的可變波長測量值。報告了六次掃描的平均值。
表3示出針對選定的擬肽大環化合物的圓二色性數據:
表3
實施例5:利用螢光偏振(fp)對mdm2的直接結合測定
該測定按照以下一般方案進行:
1.將mdm2(內部,41kd)稀釋到fp緩衝液(高鹽緩衝液-200mmnacl,5mmchaps,ph7.5)中,從而製備10μμ工作儲備溶液。
2.將30μl10μμ蛋白質儲備溶液添加到96孔黑色he微孔板(moleculardevices)的a1和b1孔中。
3.將30μlfp緩衝液填充到第a2至a12、b2至b12、c1至c12和d1至d12列中。
4.蛋白質儲備液從a1、b1經2或3倍系列稀釋至a2、b2;a2、b2稀釋至a3、b3;...在最後一個稀釋點達到個位數的nm濃度。
5.用dmso將1mm(在100%dmso中)fam標記的線性肽稀釋到100μμ(1:10稀釋)。然後,用水從100μμ稀釋到10μμ(1:10稀釋),然後用fp緩衝液從10μμ稀釋到40nm(1:250稀釋)。這就是工作溶液,其在孔中將是10nμ濃度(1:4稀釋)。將稀釋的fam標記的肽保持在暗處,直至使用。
6.將10μl10nμfam標記的肽添加到各孔中並溫育,在不同時間點讀數。5-fam-baltfehywaqlts-nh2(seqidno:943)的kd為約13.38nm。
實施例6:對mdm2的競爭性螢光偏振測定
該測定按照以下一般方案進行:
1.將mdm2(內部,41kd)稀釋到fp緩衝液(高鹽緩衝液-200mmnacl,5mmchaps,ph7.5.)中,從而製備84nm(2x)工作儲備溶液。
2.將20μl84nm(2x)蛋白質儲備溶液添加到96孔黑色he微孔板(moleculardevices)的各孔中。
3.用dmso將1mm(在100%dmso中)fam標記的線性肽稀釋到100μμ(1:10稀釋)。然後,用水從100μμ稀釋到10μμ(1:10稀釋),然後用fp緩衝液從10μμ稀釋到40nm(1:250稀釋)。這就是工作溶液,其在孔中將是10nμ濃度(1:4稀釋)。將稀釋的fam標記的肽保持在暗處,直至使用。
4.用fp緩衝液製備未標記的肽劑量板,從1μμ(終濃度)肽開始,並使用以下稀釋方案為6個點製備5倍系列稀釋。
用dmso將10mm(在100%dmso中)稀釋到5mm(1:2稀釋)。然後,用h2o從5mm稀釋到500μμ(1:10稀釋),然後用fp緩衝液從500μμ稀釋到20μμ(1:25稀釋)。從20μμ(4x)為6個點製備5倍系列稀釋。
5.將10μl系列稀釋的未標記的肽轉移到充填有20μl84nm蛋白質的各孔中。
6.將10μl10nμ(4x)fam標記的肽添加到各孔中並溫育3小時以讀數。
實施例7:利用螢光偏振(fp)對mdmx的直接結合測定
該測定按照以下一般方案進行:
1.將mdmx(內部,40kd)稀釋到fp緩衝液(高鹽緩衝液-200mmnacl,5mmchaps,ph7.5)中,從而製備10μμ工作儲備溶液。
2.將30μl10μμ蛋白質儲備溶液添加到96孔黑色he微孔板(moleculardevices)的a1和b1孔中。
3.將30μlfp緩衝液填充到第a2至a12、b2至b12、c1至c12和d1至d12列中。
4.蛋白質儲備液從a1、b1經2或3倍系列稀釋到a2、b2;a2、b2稀釋到a3、b3;...在最後一個稀釋點達到個位數的nm濃度。
5.用dmso將1mm(在100%dmso中)fam標記的線性肽稀釋到100μμ(1:10稀釋)。然後,用水從100μμ稀釋到10μμ(1:10稀釋),然後用fp緩衝液從10μμ稀釋到40nm(1:250稀釋)。這就是工作溶液,其在孔中將是10nμ濃度(1:4稀釋)。將稀釋的fam標記的肽保持在暗處,直至使用。
6.將10μl10nμfam標記的肽添加到各孔中並溫育,在不同時間點讀數。
5-fam-baltfehywaqlts-nh2(seqidno:943)的kd為約51nm。
實施例8:對mdmx的競爭性螢光偏振測定
該測定按照以下一般方案進行:
1.將mdmx(內部,40kd)稀釋到fp緩衝液(高鹽緩衝液-200mmnacl,5mmchaps,ph7.5)中,從而製備300nm(2x)工作儲備溶液。
2.將20μl300nm(2x)蛋白質儲備溶液添加到96孔黑色he微孔板(moleculardevices)的各孔中。
3.用dmso將1mm(在100%dmso中)fam標記的線性肽稀釋到100μμ(1:10稀釋)。然後,用水從100μμ稀釋到10μμ(1:10稀釋),然後用fp緩衝液從10μμ稀釋到40nm(1:250稀釋)。這就是工作溶液,其在孔中將是10nμ濃度(1:4稀釋)。將稀釋的fam標記的肽保持在暗處,直至使用。
4.用fp緩衝液準備未標記的肽劑量板,從5μμ(終濃度)肽開始,並使用以下稀釋方案為6個點製備5倍系列稀釋。
5.用dmso將10mm(在100%dmso中)稀釋到5mm(1:2稀釋)。然後,用h2o從5mm稀釋到500μμ(1:10稀釋),然後用fp緩衝液從500μμ稀釋到20μμ(1:25稀釋)。從4μμ(4x)為6個點製備5倍系列稀釋。
6.將10μl系列稀釋的未標記的肽轉移到填充有20μl300nm蛋白質的各孔中。
7.將10μl10nμ(4x)fam標記的肽添加到各孔中並溫育3小時以讀數。
實施例5-8的結果在表4中示出。使用下列標度:「+」表示大於1000nm的值,「++」表示大於100nm且小於或等於1000nm的值,「+++」表示大於10nm且小於或等於100nm的值,而「++++」表示小於或等於10nm的值。
表4
實施例9:競爭性結合elisa(mdm2和mdmx)
在室溫下將p53-his6蛋白質(「his6」公開為seqidno:1501)(30nm/孔)在96孔immulon板的孔中包被過夜。在實驗當天,使用自動
elisa洗板器用1xpbs-吐溫20(0.05%)洗板,在室溫下採用elisa微孔封閉將板封閉30分鐘;通過用1xpbs-吐溫20(0.05%)洗板以洗掉過量的封閉劑。在無菌水中將肽從10mmdmso儲備液稀釋至500μμ工作儲備液,在0.5%dmso中進行進一步稀釋,以在樣品中保持dmso濃度恆定。向孔中加入50μl體積的2x期望濃度的肽,隨後添加稀釋的gst-mdm2或gst-hmdx蛋白質(最終濃度:10nm)。在室溫下溫育樣品2h,用pbs-吐溫20(0.05%)洗板,之後添加100μl的在hrp穩定緩衝液中稀釋至0.5μg/ml的hrp偶聯抗gst抗體[hypromatrix,inc]。在與檢測抗體溫育30min後,洗板,並與100μl/孔的tmb-e底物溶液溫育高達30分鐘;用1mhcl停止反應,並在微孔板閱讀器上在450nm下測量吸光度。使用graphpadprism軟體分析數據。
實施例10:細胞活力分析
該分析按照以下一般方案進行:
細胞接種:在測定前一天對細胞進行胰蛋白酶化,計數,並以預定密度接種在96孔板中。對使用中的各個細胞系,使用以下細胞密度:
●sjsa-1:7500個細胞/孔
●rko:5000個細胞/孔
●rko-e6:5000個細胞/孔
●hct-116:5000個細胞/孔
●sw-480:2000個細胞/孔
●mcf-7:5000個細胞/孔
在研究當天,在室溫下將培養基替換為含有11%fbs的新鮮培養基(測定培養基)。每孔添加180μl測定培養基。不含細胞的對照孔接收200μl培養基。
肽稀釋:所有稀釋均在室溫下進行並在室溫下添加至細胞。
·在dmso中製備肽的10mm儲備液。使用dmso作為稀釋劑,利用1:3稀釋方案連續稀釋儲備液,以得到10、3.3、1.1、0.33、0.11、0.03、0.01mm的溶液。使用無菌水將連續dmso稀釋的肽稀釋33.3倍。這產生了10x工作儲備液的範圍。也為對照孔準備了dmso/無菌水(3%dmso)混合物。
·因此工作儲備濃度範圍μμ將是300、100、30、10、3、1、0.3和0μμ。使用多通道在各稀釋步驟充分混合。
·h行含有對照。h1-h3將接收20μl測定培養基。h4-h9將接收20μl3%dmso-水載體。h10-h12將含有不含細胞的單獨培養基對照。
·陽性對照:mdm2小分子抑制劑nutlin-3a(10mm)用作陽性對照。使用與肽相同的稀釋方案稀釋nutlin。
向細胞添加工作儲備液:
·向適當的孔中添加20μl10x期望濃度,以在孔中在200μl總體積中達到終濃度。(20μl300μμ肽+180μl培養基中的細胞=在孔中在200μl體積中的30μμ終濃度)。使用移液管輕柔混合數次。因此,使用的終濃度範圍將是30、10、3、1、0.3、0.1、0.03和0μμ(對於強的肽,包括進一步的稀釋)。
·對照包括未獲得肽但與包含肽的孔包含相同濃度的dmso的孔,和不含細胞的孔。
·在37℃在潮溼的5%co2氣氛下溫育72小時。
·使用來自promega的mtt試劑測定細胞的活力。sjsa-1、rko、rko-e6、hct-116細胞的活力在第3天測定,mcf-7細胞在第5天測定,而sw-480細胞在第6天測定。在指定的溫育時間結束時,使板回到室溫。從各孔中移除80μl測定培養基。向各孔添加15μl解凍的mtt試劑。
·將板在37℃在潮溼的5%co2氣氛下溫育2h,並按照生產商的方案添加100μl增溶試劑。於室溫在攪拌下溫育1h,並在synergybiotek多板閱讀器上讀取570nm處的吸光度。
·使用graphpadprism分析工具分析相對於dmso對照的細胞活力。
試劑:
·invitrogen細胞培養基
i.falcon96孔透明細胞培養處理板(nunc353072)
·dmso(sigmad2650)
·rpmi1640(invitrogen72400)
·mtt(promegag4000)
儀器:用於吸光度讀出的多板閱讀器(synergy2)。
來自細胞活力試驗的結果在表5和6中示出。使用下列標度:「+」表示大於30μm的值,「++」表示大於15μm且小於或等於30μm的值,「+++」表示大於5μm且小於或等於15μm的值,而「++++」表示小於或等於5μm的值。「ic50比」表示p53+/+細胞中的平均ic50相對於p53-/-細胞中的平均ic50的比值。
表5
表6
實施例11:p21elisa測定
該測定按照以下一般方案進行:
細胞接種:
·在測定前一天對sjsa1細胞進行胰蛋白酶化,計數,並以7500個細胞/100μl/孔的密度接種在96孔板中。
·在研究當天,將培養基替換為新鮮的rpmi-11%fbs(測定培養基)。每孔添加90μl測定培養基。不含細胞的對照孔接收100μl培養基。
肽稀釋:
·在dmso中製備肽的10mm儲備液。使用dmso作為稀釋劑,利用1:3稀釋方案連續稀釋儲備液,以得到10、3.3、1.1、0.33、0.11、0.03、0.01mm的溶液。使用無菌水將連續dmso稀釋的肽稀釋33.3倍。這產生了10x工作儲備液範圍。也為對照孔準備了dmso/無菌水(3%dmso)混合物。
·因此工作儲備液濃度範圍μμ將是300、100、30、10、3、1、0.3和0μμ。使用多通道在各稀釋步驟充分混合。
·h行含有對照。h1-h3將接收10ul測定培養基。h4-h9將接收10ul3%dmso-水載體。h10-h12將含有不含細胞的單獨培養基對照。
·陽性對照:hdm2小分子抑制劑nutlin-3a(10mm)用作陽性對照。使用與肽相同的稀釋方案稀釋nutlin。
向細胞添加工作儲備液:
·向適當的孔中添加10μl10x期望濃度,以在孔中在100μl總體積中達到終濃度。(10μl300μμ肽+90μl培養基中的細胞=在孔中在100μl體積中的30μμ終濃度)。因此,使用的終濃度範圍將是30、10、3、1、0.3和0μμ。
·對照將包括未獲得肽但與包含肽的孔包含相同濃度的dmso的孔,和不含細胞的孔。
·溫育後20h,吸出培養基;用1xpbs(不含ca++/mg++)洗滌細胞,並在冰上在60μl1x細胞裂解緩衝液(稀釋到1x並補充有蛋白酶抑制劑和磷酸酶抑制劑的cellsignalingtechnologies10x緩衝液)中裂解30min。
·將板在4℃下以5000rpm的速度離心8min;收集澄清的上清液並於-80℃冷凍直至進一步使用。
蛋白質估計:
·使用來自thermofisher的bca蛋白質檢測試劑盒和bsa標準來測定裂解物的總蛋白質含量。通常預期每孔約6-7μg蛋白質。
·每孔使用50μl裂解物來建立p21elisa。
人類總p21elisa:elisa測定方案按照生產商的說明書進行。各孔使用50μl裂解物,並且各孔一式三份建立。
試劑:
·-cell-basedassay(-)-nutlin-3(10mm):caymanchemicals,目錄號600034
·-optimem,invitrogen目錄號51985
·-cellsignaling裂解緩衝液(10x),cellsignalingtechnology,目錄號9803
·-蛋白酶抑制劑混合片(迷你),rochechemicals,目錄號04693124001
·-磷酸酶抑制劑混合片,rochechemicals,目錄號04906837001
·-人類總p21elisa試劑盒,r&dsystems,dyc1047-5
·-終止溶液(1mhcl),cellsignalingtechnologies,目錄號7002
儀器:微型離心機-eppendorf5415d和用於吸光度讀出的多板閱讀器(synergy2)。
實施例12:胱天蛋白酶3檢測試驗:
該試驗按照以下一般方案進行:
細胞接種:在測定前一天對sjsa1細胞進行胰蛋白酶化,計數,並以7500個細胞/100μl/孔的密度接種在96孔板中。在研究當天,將培養基替換為新鮮的rpmi-11%fbs(測定培養基)。每孔添加180μl測定培養基。不含細胞的對照孔接收200μl培養基。
肽稀釋:
·在dmso中製備肽的10mm儲備液。使用dmso作為稀釋劑,利用1:3稀釋方案連續稀釋儲備液,以得到10、3.3、1.1、0.33、0.11、0.03、0.01mm的溶液。使用無菌水將連續dmso稀釋的肽稀釋33.3倍。這產生了10x工作儲備液範圍。也為對照孔準備了dmso/無菌水(3%dmso)混合物。
·因此工作儲備液濃度範圍μμ將是300、100、30、10、3、1、0.3和0μμ。使用多通道在各稀釋步驟充分混合。向適當的孔中添加20ul10x工作儲備液。
·h行含有對照。h1-h3將接收20ul測定培養基。h4-h9將接收20ul3%dmso-水載體。h10-h12將含有不含細胞的單獨培養基對照。
·陽性對照:mdm2小分子抑制劑nutlin-3a(10mm)用作陽性對照。使用與肽相同的稀釋方案稀釋nutlin。
向細胞添加工作儲備液:
·向適當的孔中添加10μl10x期望濃度,以在孔中在100μl總體積中達到終濃度。(10μl300μμ肽+90μl培養基中的細胞=在孔中在100μl體積中的30μμ終濃度)。因此,使用的終濃度範圍將是30、10、3、1、0.3和0μμ。
·對照將包括未獲得肽但與包含肽的孔包含相同濃度的dmso的孔,和不含細胞的孔。
·溫育後48h,從各孔中吸出80μl培養基;每孔添加100μl胱天蛋白酶3/7glo測定試劑(promega胱天蛋白酶3/7glo測定系統,g8092),於室溫在輕柔振蕩下溫育1h。
·在synergybiotek多板閱讀器上對讀取發光。
·數據作為胱天蛋白酶3對經dmso處理的細胞的激活而進行分析。
自來實施例11和12的結果示於表7中:
表7
實施例13:由擬肽大環化合物引起的細胞裂解
提前一天以7500個細胞/孔並使用100ul/孔的生長培養基將
sjsa-1細胞鋪設在透明平底板(costar,目錄號353072)中,保留h行10-12列為空用於單獨放置培養基。在試驗當天,將培養基更換為rpmi1%fbs培養基,每孔90ul培養基。
在100%的dmso中製備擬肽大環化合物的10mm儲備溶液。然後將擬肽大環化合物在100%的dmso中進行連續稀釋,然後進一步在無菌水中稀釋20倍,以製備各擬肽大環化合物在5%dmso/水中濃度為500um至62.5um的工作儲備溶液。
將10ul的各化合物加入到90ul的sjsa-1細胞中,以在含0.5%dmso的培養基中得到50um至6.25um的終濃度。陰性對照(非裂解)樣品為單獨的0.5%dmso,而陽性對照(裂解)樣品包括10um蜂毒肽和1%tritonx-100。
將細胞板在37℃下溫育1小時。在溫育1小時後,通過顯微鏡檢查細胞的形態,然後在室溫下將該板在1200rpm下離心5分鐘。對於每個擬肽大環化合物和對照樣品,將40ul上清液轉移到透明的分析板上。使用來自caymen的目錄號#1000882的ldh細胞毒性分析試劑盒測定ldh的釋放。
結果示於表8中:
表8
實施例14:p53grip試驗
thermoscientific*bioimagep53-hdm2redistributeassay監測響應於藥物化合物或其它刺激物,蛋白質與mdm2的相互作用以及gfp-標記的p53的細胞轉位。重組cho-hir細胞穩定地表達與增強綠色螢光蛋白(egfp)的c末端融合的人p53(1-312)和pde4a4-hdm2(1-124),後者是pde4a4和hdm2(1-124)之間的融合蛋白。它們提供了用於檢測實驗條件對p53和mdm2的相互作用的影響的即用型測定系統。使用hcs平臺進行成像和分析。
將cho-hir細胞常規維持在補充有1%青黴素-鏈黴素、0.5mg/ml遺傳黴素、1mg/mlzeocin和10%fbs的hamf12培養基中。在進行測定之前18-24h,使用培養基以7000個細胞/100μl/孔的密度將細胞接種至96孔板中。第二天,更新培養基,並向細胞添加pd177至3μμ的最終濃度以激活灶形成。對照孔保持為不含pd-177溶液。用pd177刺激後24h,用opti-mem培養基洗滌細胞一次,並向細胞添加50μl補充有pd-177(6μμ)的opti-mem培養基。在無菌水中將肽從10mmdmso儲備液稀釋至500μμ工作儲備液,在0.5%dmso中進行進一步稀釋,以保持樣品中的dmso濃度恆定。最終的最高dmso濃度是0.5%,並將其用作陰性對照。使用caymanchemicalscell-basedassay(-)-nutlin-3(10mm)作為陽性對照。使用與將50μl2x期望濃度的肽添加至適當的孔中相同的稀釋方案稀釋nutlin以達到最終期望濃度。然後在溼潤的5%co2氣氛和37℃下,細胞與肽溫育6h。在溫育期之後,在室溫下通過輕輕地吸出培養基並每孔添加150μl固定溶液來固定細胞20分鐘。每次用200μlpbs/孔洗滌固定的細胞4次。在最後一次洗滌結束時,添加100μl1μμhoechst染色液。將密封的板在黑暗中溫育至少30分鐘,用pbs洗滌,以除去過量的染色劑,並向每孔中添加pbs。培養板可在4℃下於黑暗中儲存長達3天。利用位於使用針對hoechst和gfp的10x物鏡、xf-100濾光器組的cellomicsarrayscan儀器上的分子轉位模塊對p53/mdm2的轉位進行成像。輸出參數是mean-circringaveintenratio(核和細胞質的平均螢光強度的比例(孔平均值))。將用於圖像分析的每孔最小可接受細胞數設置成500個細胞。
實施例15:使用sp315、sp249和sp154進行mcf-7乳腺癌研究
進行異種移植研究以測試sp315、sp249和sp154在mcf-7乳腺癌異種移植模型中抑制裸鼠的腫瘤生長的效力。在一組中還測試了陰性對照的釘肽、sp252、sp154的點突變(第19位f到a);該肽在sjsa-1體外活力試驗中已經顯示無活性。在腫瘤細胞移植前一天(-1天),將緩釋90天的0.72mg的17β-雌二醇丸(innovativeresearch,sarasota,fl)皮下(sc)植入至頸部上的後頸上。在第0天將mcf-7腫瘤細胞皮下植入至雌性裸(crl:nu-foxn1nu)鼠的側腹。在第18天,使用卡尺測量所得到的sc腫瘤,以確定它們的長度和寬度,並對小鼠進行稱重。使用公式(長x寬2)/2計算出腫瘤的尺寸,並表示為立方毫米(mm3)。將腫瘤小於85.3mm3或大於417.4mm3的小鼠從隨後的組形成中排除。隨機形成13組小鼠,每組10隻,以使組平均腫瘤尺寸基本等同(組的平均值±組的標準偏差=180.7±17.5mm3)。
sp315、sp249、sp154和sp252的給藥溶液從在媒質中配製的肽製備,該媒質含有在ph7的10mm組氨酸緩衝鹽水中的濃度為50mg/ml的mpeg(2k)-dspe。該製劑在研究期間製備一次。該媒質用作隨後的研究中的媒質對照物。
針對各組指定不同的治療方案。第1組,作為媒質陰性對照組,在第18-39天接收到以每周三次8ml/kg體重靜脈內(iv)施用的煤質。第2和3組分別接收到以每周三次30mg/kg或一周兩次40mg/kg靜脈注射的sp154。第4組接收到以每周三次靜脈注射的6.7mg/kg的sp249。第5、6、7和8組分別接收到每周三次26.7mg/kg、每周兩次20mg/kg、每周兩次30mg/kg靜脈注射的sp315。第9組接收到以每周三次靜脈注射的30mg/kg的sp252。
在給藥期間,對小鼠進行稱重並每周1-2次測量腫瘤。關於腫瘤體積的結果示於圖3-6中,且與媒質組相比的腫瘤生長抑制率、體重變化和體重減輕值≥20%的小鼠的數目或死亡的小鼠的數目示於表9中。根據%tgi=100-[(tuvol已治療的天數-第x天–tuvol已治療的天數-第18天)/(tuvol媒質陰性對照-第x天-tuvol媒質陰性對照-第18天)*100計算腫瘤生長抑制率(tgi),其中x為正在進行治療效果評定的那一天。對於該腫瘤模型,第1組、媒質陰性對照組顯示了良好的腫瘤生長速率。
對於sp154,在以每周兩次40mg/kg給藥的組中,2隻小鼠在治療期間死亡,表明這種給藥方案是不可耐受的。每周三次30mg/kg的sp154的給藥方案耐受性良好,並取得了84%的tgi。
對於sp249,在以每周三次6.7mg/kg給藥的組中,4隻小鼠在治療期間死亡,表明這種給藥方案是不可耐受的。
用於sp315的所有給藥方案均顯示出良好的耐受性,無顯著的體重減輕或死亡。採用每周兩次40mg/kg的sp315的給藥產生了最高的tgi(92%)。每周三次26.7mg/kg、每周兩次20mg/kg、每周兩次30mg/kg的sp315的給藥方案分別產生86%、82%和85%的tgi。
對於sp252,在體外試驗中沒有顯示出明顯的活性的sp154的點突變,採用每周三次30mg/kg的給藥具有較好的耐受性,無明顯的體重減輕或死亡。而在第32天前觀察到88%的tgi,該tgi在第39天前減少至41%。
本實施例的結果示於圖3-6中並總結於表9中。
表9
*p≤0.05相比於載體對照
實施例21:擬肽大環化合物的溶解度測定
首先將擬肽大環化合物溶解於純的n,n-二甲基乙醯胺(dma,sigma-aldrich,38840-1l-f)中以製備在20-140mg/ml的濃度範圍的20x儲備溶液。將dma儲備溶液在含有2%solutol-hs-15、25mm組氨酸、45mg/ml甘露醇的水性載體中稀釋20倍,以獲得擬肽大環化合物在5%dma、2%solutol-hs-15、25mm組氨酸、45mg/ml甘露醇中的1-7mg/ml的終濃度。通過反覆移液或輕輕渦旋將終溶液輕輕地混合,然後在室溫下將終溶液在超聲波水浴中超聲處理10分鐘。然後,使用7x目視放大器在通風櫥中進行仔細的目視觀察,以確定沉澱物是否在底部上或作為懸浮物存在。根據需要檢測另外的濃度範圍,以確定每種擬肽大環化合物的最大溶解度極限。
來自實施例的結果示於圖7中。
實施例22:使用boc保護的胺基酸製備擬肽大環化合物
如實施例2所述製備包含在第「i」位的r8胺基酸和在第「i+7」位的s5胺基酸的擬肽大環化合物的前體。在第「i+3」位的胺基酸為在固相合成中被合併的boc保護的色氨酸。具體而言,在固相合成中使用如下所示的boc保護的色氨酸(市售的,例如,購自novabiochem):
在進行切割和脫保護步驟之前,使用釕催化劑進行複分解反應。通過hplc分析確定環化後得到的組合物主要含有具有包含反式烯烴(「iso2」,包含在e構型中的雙鍵)的交聯體的初級擬肽大環化合物。出乎意料的是,分別觀察到比例為90:10的反式和順式產物。
