預測轉化為糖尿病的多標記物風險參數的製作方法
2023-09-22 07:22:50 1
本專利文件的一部分公開內容包含受到版權保護的材料。版權所有者,LipoScience, Inc.,對由專利文件或專利公開的任何人的轉載不持異議(當其出現在專利商標局專利文件或記錄中時),但無論如何另外保留所有版權的權利。
相關申請
本申請要求2014年1月6日提交的美國臨時專利申請系列號61/923,855的權益和優先權,其內容通過引用結合到本文中,如同在此全面描述一樣。
發明領域
本發明一般涉及體外生物樣品的分析。
發明背景
2型糖尿病(T2DM或"糖尿病")是在美國和其它國家中最昂貴和負擔沉重的慢性疾病之一。T2DM的定義特徵是高血糖症,一種因有缺陷的或缺乏的胰島素分泌響應所致的碳水化合物(葡萄糖)利用受損的反映。T2DM是早在多年前開始的代謝紊亂的晚期表現。其原因被認為是胰島素抵抗的進行性增加,伴有β-細胞功能惡化。只要胰腺β-細胞能夠分泌足夠的胰島素以補償靶組織對胰島素的降血糖作用的進行性抵抗,患者就能夠維持正常空腹葡萄糖水平。作為進行性β-細胞功能障礙(其導致面對胰島素抵抗增加時不能維持胰島素分泌過多)的後果,出現高血糖症和轉變為T2DM。
2型糖尿病傳統上通過檢測血中升高的葡萄糖(糖)水平(高血糖症)來診斷。雖然高血糖症定義糖尿病,但它是在從胰島素抵抗導向全面爆發的糖尿病的事件鏈中很晚的發展階段。因此,在發展經典症狀,例如高血糖症之前,具有鑑定受試者是否面臨發展2型糖尿病的風險(即,易患該病症)的方法應是迫切需要的。如果不能實際的預防該病的發病,早期檢測該疾病的指標(如,在葡萄糖水平升高到足以認為是高血糖症之前檢測)可導致該疾病的更有效的治療。
最直接和準確的評估胰島素抵抗的方法是費力和費時的,因而對於臨床應用是不切實際的。在這些研究方法中的"金標準"是高胰島素血症正常血糖鉗夾試驗,其在鉗夾試驗期間量化最大葡萄糖處置率(GDR,與胰島素抵抗成反比)。另一個有些不太可能再現(CV 14-30%)的費力的研究方法是使用最小模型分析的經常取樣的靜脈內葡萄糖耐量試驗(IVGTT),其測量胰島素敏感性(Si),胰島素抵抗的反面。
進展為2型糖尿病的風險目前主要通過空腹葡萄糖評估,濃度100-125 mg/dL定義高-風險"糖尿病前期"狀況,並且對此T2DM目前被限定在具有空腹血糖水平在126 mg/dL和以上的患者中。然而,患有糖尿病前期的個體患者(面臨在最近的將來發展為T2DM的最大風險的那些患者)的實際風險變化很大。
NMR光譜已被用來同時測量低密度脂蛋白(LDL)、高密度脂蛋白(HDL),和極低密度脂蛋白(VLDL),如來自體外血漿或血清樣品的LDL、HDL和VLDL顆粒子集。見,美國專利號4,933,844和6,617,167,其內容通過引用結合到本文中,如同在此全面描述一樣。Otvos等的美國專利號6,518,069描述葡萄糖和/或某些脂蛋白值的NMR衍生的測量以評估患者發展T2DM的風險。
一般來說,為評估在血漿和/或血清樣品中的脂蛋白,NMR譜的化學位移區域內的多個NMR光譜衍生信號的振幅由複合的甲基信號包跡線的去卷積導出以產生子集濃度。子集由許多(通常超過60)離散的與NMR頻率和脂蛋白直徑相關的貢獻子集信號代表。NMR評估能夠審視NMR信號以產生不同的亞群濃度,通常為73個離散的亞群,27個為VLDL,20個為LDL和26個為HDL。這些亞群能夠被進一步表徵為與VLDL、LDL或HDL子集內的特定尺寸範圍有關。
一種先進的脂蛋白測試板,例如LIPOPROFILE® 脂蛋白試驗,從LipoScience, Raleigh, N.C.獲得,通常包括合計所有HDL子集的濃度的總高密度脂蛋白顆粒(HDL-P)測量(如,HDL-P數)和合計所有LDL子集(如,LDL-P數)的濃度的總低密度脂蛋白顆粒(LDL-P)測量。LDL-P和HDL-P數以濃度單位例如nmol/L表示那些各自顆粒的濃度。LipoScience還已發展脂蛋白-基胰島素抵抗和敏感性指數("LP-IR™"指數),如在美國專利號8,386,187中所述,其內容通過引用結合到本文中,如同在此全面描述一樣。
圖1A說明在T2DM發病前,胰島素抵抗和胰島素生產變化,以及在進展期間發生的β-細胞功能障礙的時間表。葡萄糖在進展至T2DM期間的快速增加前可保持相對穩定。參見,例如Mason等, Diabetes 2007; 56: 2054-6。圖1B說明各個葡萄糖範圍和T2DM進展的連續性,糖尿病併發症能夠在T2DM進展期間發生。具有100-110 mg/dL的範圍的葡萄糖的許多個體不發展至T2DM,而具有90-99 mg/dL的範圍的"正常"葡萄糖的其他個體,例如,可在不到5年內發展為糖尿病。目前糖尿病進展的風險主要通過葡萄糖測量來評估,所述測量是惡化葡萄糖代謝的反應,而不是其原因。存在對可更好地將發展為糖尿病的那些與將不會發展為糖尿病的那些區分開來的試驗的未滿足的診斷需求。見,AACE Prediabetes Consensus Statement, Endocr Pract. 2008; 14 (No. 7) 941。
仍然存在對能夠在疾病發病前預測或評價個人發展2型糖尿病的風險和/或鑑定那些處於早期進展的風險的個體的評估的需求,以致幹預可被用來延遲進展和/或處理心血管風險。
概述
本發明的實施方案提供以下多標記物:(i) 胰島素抵抗("IR"),(如,eLP-IR)和(ii) 能夠評價任何水平的血糖過多的糖尿病風險的空腹血漿生物樣品的短期糖尿病風險因子(SDRF)。
本發明的實施方案提供使用多參數(多變量)風險進展模型,一個對於與短期風險("STR") (如,試驗後少於3年,例如在6個月、1年、2年或3年內)相關的SDRF的模型和另一個對於可能是用於STR和長期風險 ("LTR") (如,試驗後大於3年,例如3.5年、4年、5年、或 5-10年之間)二者的重要的風險參數的IR的模型,受試者在未來發展2型糖尿病的風險評價。
SDRF可作為評分提供。SDRF評分與短期風險呈正相關,因此被認為是與β細胞功能呈負相關或與胰腺β細胞功能障礙呈正相關。
IR評分可使用"eLP-IR" (延長的脂蛋白胰島素抵抗)評分確定。
STR模型(用邏輯回歸評價)。IR模型可基於至少一個研究群體,用線性回歸模型對HOMA-IR或Si (胰島素敏感性,如通過頻繁地採樣的靜脈內葡萄糖耐量試驗所評價的)之一或者二者進行評價。
本發明的實施方案可使用多參數糖尿病風險參數作為糖尿病風險模型的輸入數據,以生成在限定的時間表,通常5年內與轉化的風險有關的糖尿病風險指數(DRI)評分。
用於風險模型的係數可由對於各自短期和長期糖尿病轉化(每個IR模型)的邏輯回歸限定,生成可合併各種標記物輸入數據的方程式。
SDRF參數(對於STR)和IR參數可作為在定義的範圍內的數值評分或值提供,較低的數表示較低的風險,而較高的值表示較高的風險。在一些實施方案中,SDRF和IR評分可合併以提供糖尿病風險指數("DRI")評分。
本發明的實施方案可提供含有來自用於通常與在試驗後3-7年之間的時間表(如約5年)相關的DRI評分或"糖尿病風險指數"的SDRF和IR兩種模型的組成成分的邏輯回歸模型。
本發明的實施方案能夠生成可被用來鑑定面臨風險患者的STR評估,所述患者可從改善或穩定β-細胞功能的療法受益和/或改善患者產生胰島素的能力。已考慮到這樣的療法的一個非限制性實例可以是再生HDL輸注療法,其已被用於心肌梗塞後患者。
本發明的實施方案可提供用於藥物療法、藥物發現和/或臨床試驗的STR評分。STR評分可用作鑑定功能障礙和/或β-細胞功能變化的標記物。
STR評分可以是關於定義的群體的相對評分或絕對評分。STR評分可對受試者採用基線STR評分和隨後的STR評分,其中變化反映了自給予的療法或藥物發現計劃的改變。
STR、IR和/或DRI評分可在給予藥物療法之前、期間和/或之後生成,以鑑定對受試者的各自評分的變化,因而從藥物療法鑑定有益的或負面的變化。
SDRF和/或STR評分可用來評估可改善或穩定β-細胞功能和/或產生胰島素的能力的療法或藥物或用來評估藥物的不需要的副作用。
風險評價可生成各自的STR、IR和DRI評分,其對超出單獨葡萄糖測量的風險進行分級並可消除葡萄糖測量。
DRI評分,當使用時,可基於使用來自SDRF和IR兩種風險預測模型的一些或全部組成成分的約5年轉化風險的風險預測模型,其可使用不同定義的加權因子進行加權,以生成DRI評分。風險評價可考慮葡萄糖測量。當使用時,葡萄糖測量可幫助建立轉化為2型糖尿病的時間表和/或用於風險的評估。可使用糖尿病風險指數評分而無需葡萄糖信息並可反映與潛在的代謝問題相關的短期和長期兩種風險。
多變量模型可用來評價用於臨床試驗的患者或在臨床試驗期間,在一種或多種療法期間評價患者,用於藥物開發、用於藥物療法選擇或受試者的適應症,和/或以鑑定或監測抗肥胖藥物或其它藥物療法候選者。
短期多變量模型可包括GlycA (一種與高密度脂蛋白(HDL)顆粒的定義的亞群濃度相關的脂蛋白組分(HMP))的NMR測量,和GlycA乘以HMP (高密度脂蛋白(HDL)顆粒的定義的亞群的濃度),HMPxGlycA的測量的相互作用參數。
雖然GlycA可以是一種優選的炎性標記物,但可使用其它炎性標記物,包括,例如,纖維蛋白原、結合珠蛋白、α-1-酸糖蛋白、CRP (C-活性蛋白)、hs)CRP (高敏感性CRP),或IL-L (白介素-6)。
HDL亞群可僅包括中等HDL顆粒子集(HMP)。中等HDL-P指HDL顆粒的亞群,其排除小和大HDL顆粒子集且精確的尺寸的範圍可在測量方法和研究群體之間變化,其使用風險模型(通常至少一個限定的研究群體的邏輯回歸模型),短期或基於IR的長期風險模型的任一個或二者使糖尿病的風險最大化。
僅僅通過舉例的方式,中等HDL-P可僅包括直徑在約8.3 nm (平均)至上限值9.4 nm (平均)或10.0 nm (平均)或10.2 nm (平均)之間的HDL顆粒。
SDRF和/或STR風險模型可包括為受損的胰島素分泌和/或胰腺β-細胞功能障礙的標記物的組成成分。
DRI風險模型可包括為胰島素抵抗的標記物以及SDRF標記物或SDRF評分的組成成分。
IR 多變量模型可包括至少一個定義的脂蛋白組分和至少一個定義的支鏈胺基酸。任選地,所述模型可包括至少一個炎性生物標記物。長期(IR)多變量模型可包括纈氨酸,和從相同NMR譜衍生的多個脂蛋白組分(如,子集)。多個脂蛋白組分可包括LP-IR和VMP (極低密度脂蛋白顆粒的定義的亞群的濃度,中等VLDL子集顆粒數量或"中等VLDL-P")。
術語"中等VLDL顆粒"或"VMP"指具有直徑/粒度在35-60 nm (平均)之間的顆粒的濃度。
DRI風險模型可包括來自SDRF和IR模型的組成成分,通常來自每種模型的3種,包括來自STR模型的HMP、GlycA、HMPxGlycA和來自IR模型的LP-IR、纈氨酸和中等-VLDL-P。
本發明的實施方案包括方法、線路、NMR分光計或NMR分析儀,和處理器,其通過使用定義的短期和長期多成分風險進展模型,評估體外血漿或血清患者樣品的NMR譜,評估發展糖尿病的未來風險和/或對具有正常葡萄糖或稍稍升高的葡萄糖的那些進行風險分級。
在一些實施方案中,STR和IR評分可以加權以生成在限定的數值範圍內的DRI評分。在一些實施方案中,IR評分可以加權以說明IR相對於SDRF對經歷5-年(或其它更長期轉化時間)的風險所作出的更大的貢獻。
本發明的實施方案涉及評估受試者發展2型糖尿病和/或具有胰腺β細胞損傷和/或功能障礙的風險的方法。所述方法包括:使用發展2型糖尿病的風險的定義數學模型,編程計算受試者的短期糖尿病風險因子(SDRF)評分。定義數學模型包括作為模型的組成部分的定義的高密度脂蛋白顆粒(HDL-P)亞群的濃度測量、至少一個炎性標記物的濃度測量和至少一個相互作用參數的濃度測量,其與各自定義的係數在數學上合併以生成計算的SDRF評分。當SDRF評分處於群體標準的第三個三分位值或更大的值時,受試者面臨在3年內轉化為2型糖尿病的風險和/或面臨β細胞功能障礙的風險。
定義的HDL-P亞群可以是中等HDL-P。
炎性標記物可以是GlycA。相互作用參數可以是GlycA乘以中等HDL-P的濃度。當中等HDL-P和Glyc A值處於群體標準的第三個三分位值時,受試者面臨β細胞功能障礙的風險。
所述方法可包括使用胰島素抵抗的定義數學模型,編程計算受試者的胰島素抵抗(IR)評分。
用於IR評分的胰島素抵抗的定義數學模型可包括多個組成成分,包括定義的HDL-P亞群的濃度測量,其可以是用來計算SDRF評分的定義的HDL-P亞群的濃度測量;炎性標記物的測量;VLDL-P (極低密度脂蛋白/乳糜微粒子集)的定義的亞群的測量;具有在0-100之間的範圍的IR指數,該範圍表示從低至高,胰島素敏感性至胰島素抗性;和從受試者的至少一個體外生物樣品獲得的支鏈胺基酸(BCAA)的測量。
IR的定義數學模型的組成成分能夠數學上合併以生成IR評分。
VLDL-P的定義的亞群的測量可以是中等VLDL-P的濃度,且其中BCAA是纈氨酸。
所述方法可包括通過合併SDRF評分和IR評分,編程計算糖尿病風險評分。
SDRF和IR評分的係數可從包括SDRF和IR的邏輯回歸模型導出,以使用至少一個定義的群體研究預測轉化為糖尿病的實際5年轉化率,從而生成具有在5年內轉化的風險的DRI評分而不考慮受試者的葡萄糖值。
所述方法可包括評估測量的受試者的葡萄糖和/或HbA1c值和電子形式提供基於葡萄糖測量和DRI評分的、轉化為2型糖尿病風險評估的5年風險的報告。
SDRF評分可使用以下方程式計算:SDRF評分= - (A) (HDL-PMED) - (B) (GlycA) + (C) (GlycA x HDL-PMED),其中A、B和C可以是來自作為發展2型糖尿病的風險的定義數學模型的用於短期轉化為糖尿病的邏輯回歸模型的定義的β係數。GlycA可以是炎性標記物,HDL-PMED是中等尺寸的HDL-P亞群,和GlycA x HDL-PMED可以是相互作用參數。
IR評分可以是eLP-IR評分並使用以下方程式計算:eLP-IR = (A) (LP-IR) + (B) (纈氨酸) – (C) (VLDL-PMED) – (D)(HDL-PMED) + (E)(GlycA)。A、B、C、D和E可以是來自用於胰島素抵抗的線性回歸模型的定義的β係數。GlycA可以是炎性標記物,HDL-PMED可以是中等HDL-P亞群的濃度,VLDL-PMED可以是中等VLDL-P亞群的濃度,纈氨酸可以是支鏈胺基酸,和LP-IR可以是使用6種確定的脂蛋白子集計算的脂蛋白胰島素抵抗指數並具有表示胰島素敏感性至胰島素抗性的在0-100範圍內的數值。
所述方法也可包括以下各項的至少一個:使用SDRF評分評估藥物療法,評估臨床試驗,或評估藥物發現的候選物。
所述方法可包括從各自的生物樣品計算隨時間推移的多個SDRF評分,從而評估SDRF評分的變化以鑑定β-細胞功能障礙的變化。
與SDRF評分有關的原始評分可以是在-6.4和-1.6之間,其中-4.1可能與研究群體的大約第25個百分位數相關和>-3.8可能與大約第75個百分位數相關。評分≥-3.8值可指示β細胞功能障礙和/或早期轉化為2型糖尿病的風險增加,這樣的風險與血糖值無關,其能夠對具有普通血糖測量的受試者用不同SDRF評分將轉化為2型糖尿病的風險分級。
SDRF評分能夠在定義的數值評分範圍內用與群體標準的第四個四分位值(4Q)、第五個五分位值(5Q)或第10個十分位值相關的評分在報告中提供,反映了相對於較低評分在2年內發展2型糖尿病和/或β細胞功能障礙和/或損傷的風險增加。
HDL-P亞群可僅包括具有8.3 nm至9.4 nm、10.0 nm或10.2 nm之一之間的直徑的中等HDL顆粒子集。
所述方法可包括使用以下方程式生成DRI評分:DRI評分= X(IR評分) + Y(SDRF)。X和Y可以是使用限定的研究群體,在具有葡萄糖<110 mg/dL的人群中,由用於5-年糖尿病轉化的邏輯回歸模型定義的係數,且其中DRI評分使用在可能的DRI原始評分範圍內的多個相等的子部分,被數學改變為DRI評分範圍。
原始DRI評分可以是在約-3.0至約1.8之間。
本發明的實施方案可涉及鑑定面臨風險的患者的方法,所述患者可從改善或穩定β-細胞功能和/或改善患者產生胰島素的能力的療法中獲益。所述方法可包括通過合併受試者的生物樣品的限定脂蛋白和代謝物組分的測量,電子上生成短期風險評分,其中組分包括高密度脂蛋白顆粒(HDL-P)亞群和使用HDL-P亞群和炎性標記物的相互作用參數。
其它實施方案涉及鑑定可能從藥物療法例如再生HDL輸注以改善胰腺β細胞功能和/或抑制2型糖尿病(T2DM)獲益的受試者的方法,所述方法可包括使用受試者的生物樣品限定的脂蛋白和代謝物組分的測量,生成定義的短期糖尿病風險因子(SDRF)評分。組分包括高密度脂蛋白顆粒(HDL-P)亞群和使用HDL-P亞群和炎性標記物的相互作用參數;和鑑定具有相對於定義的群體標準的增加的SDRF評分的受試者,其指示受試者可能從改善胰腺β細胞功能和/或抑制T2DM的療法受益。
所述方法可使用至少一個處理器進行。
用於SDRF評分的生物樣品的測量的全部或一些可以都是NMR衍生的測量。
其它實施方案涉及評估患者轉化為2型糖尿病的風險的方法,其通過以下步驟進行:
(a) 使用以下方程式編程計算SDRF評分:SDRF評分= - (A) (HDL-PMED) - (B) (GlycA) + (C) (GlycA x HDL-PMED),
其中A、B和C是來自作為發展2型糖尿病風險的定義數學模型的用於短期轉化為糖尿病的邏輯回歸模型的定義的β係數,和其中GlycA是炎性標記物,HDL-PMED是中等尺寸的HDL-P亞群,和GlycA x HDL-PMED是相互作用參數;
(b) 編程計算eLP-IR評分並使用以下方程式:eLP-IR = (A) (LP-IR) + (B)(纈氨酸) – (C) (VLDL-PMED) – (D)(HDL-PMED) + (E)(GlycA),
其中A、B、C、D和E是來自用於胰島素抵抗的線性回歸模型的定義的β係數,其中GlycA是炎性標記物,HDL-PMED是中等HDL-P亞群的濃度,VLDL-PMED是中等VLDL-P亞群的濃度,纈氨酸是支鏈胺基酸,和LP-IR是使用6種確定的脂蛋白子集計算的脂蛋白胰島素抵抗指數並具有表示胰島素敏感性至胰島素抗性的在0-100範圍內的數值,和
(c) 使用以下方程式編程生成DRI原始評分:DRI原始評分= X(eLP-IR) + Y(SDRF),
其中X和Y是使用限定的研究群體,在具有葡萄糖<110 mg/dL的人群中,由5-年糖尿病轉化的邏輯回歸模型定義的係數,且其中DRI原始評分使用在可能的DRI原始評分範圍內的多個相等的子部分,被數學上改變為在0-10或1-10之間的範圍。
本領域的普通技術人員從閱讀以下附圖和優選的實施方案的詳細描述中將理解本發明的其它特徵、優點和細節,這樣的描述僅僅是本發明的示例性說明。關於一個實施方案描述的特徵可與其它實施方案結合,儘管在下文沒有具體地討論。即是說,要注意到,本發明關於一個實施方案描述的方面,可結合到不同實施方案中,雖然沒有相對具體的討論。即是說,所有實施方案和/或任何實施方案的特徵能夠以任何方式和/或組合結合。申請人保留更改任何原始提交的權利要求或提交任何相應的新的權利要的權利,包括能夠修改任何原始提交的權利要求以依賴任何其它權利要求的任何特徵和/或結合任何其它權利要求的任何特徵的權利,儘管沒有以那種方式原始要求。本發明的前述和其它方面在以下提出的說明書中詳細地解釋。
如本領域技術人員根據本公開內容將能理解的,本發明的實施方案可包括方法、系統、裝置和/或電腦程式產品或其組合。
附圖簡述
本專利或申請文件包含至少一幅彩色繪圖。具有彩色繪圖的本專利或專利申請出版物的複製件將按要求和支付所需費用後由政府機構提供。
圖1A是說明2型糖尿病進展的病理生理學的圖。
圖1B是說明2型糖尿病進展的連續性與惡化糖尿病併發症的實例的圖。
圖2A是說明基於兩個分開的多參數風險模型的糖尿病風險預測的圖,根據本發明的實施方案,一個用於與β細胞功能障礙相關的短期風險和一個用於IR。
圖2B是說明基於具有炎性標記物的示例性特殊組分和BCAA (支鏈胺基酸)的兩個分開的多參數風險模型的糖尿病風險預測的圖,根據本發明的實施方案,一個用於短期風險和一個用於胰島素抵抗。
圖3A和3B說明具有根據本發明實施方案的示例性尺寸範圍的脂蛋白亞群。
圖4是基於根據本發明的實施方案與易發糖尿病的關係(正性和負性),用於糖尿病風險評價的示例性HDL亞群分組的圖。
圖5是顯示根據本發明的實施方案,在圖4中根據尺寸分組的不同HDL亞群的風險相關性的圖。
圖6A是基於MESA 5-年T2DM轉化(n=359/4211)的糖尿病轉化率對比葡萄糖分類(低風險、中度風險、高風險)的圖,說明了對根據本發明的實施方案的中度風險葡萄糖患者,分級或更好地鑑定面臨增加的進展為T2DM風險的患者的未滿足的需要。
圖6B基於IRAS 5-年 T2DM轉化(n=134/978)的糖尿病轉化率對比葡萄糖分類(低風險、中度風險、高風險)的圖,說明了對根據本發明的實施方案的中度風險葡萄糖患者,分級或更好地鑑定面臨增加的進展為T2DM風險的患者的未滿足的需要。
圖7是MESA研究群體(n=3450)的特徵的表。
圖8是說明根據本發明的實施方案的GlycA峰區(跨越該區的放大圖)的NMR譜。
圖9是對中等HDL-P (HDL-PMED)的3個定義的水平(高、中和低)的GlycA水平預測的短期糖尿病轉化率的圖,說明以根據本發明的實施方案的大約第80個百分位數水平的GlycA (相對於群體標準),從"好"轉變為"差"的高水平的中等HDL-P。
圖10是類似於圖2的框圖,說明可與所註明的各組成成分使用,以生成eLP-IR和SDRF評分的示例性係數,其可以單獨使用或組合使用以形成根據本發明的實施方案的DRI評分。
圖11A是在根據本發明的實施方案的動脈粥樣硬化的多種族研究(MESA)中,通過DRI評分(n=1-10)預測的糖尿病轉化率(%)對比葡萄糖分類(mg/dL單位)的圖。
圖11B是在根據本發明的實施方案的IRAS (胰島素抵抗動脈粥樣硬化研究)中,通過DRI評分(n=1-10)預測的糖尿病轉化率(%)對比葡萄糖分類(mg/dL單位)的圖。
圖12是有助於根據本發明實施方案的胰島素抵抗的eLP-IR多標記物參數的參數的圖。
圖13是有助於根據本發明實施方案的短期風險的SDRF多標記物參數的參數的圖。
圖14是說明在IRAS (n=134/976)中,在5.2年隨訪期間轉化為糖尿病的圖,其驗證使用根據本發明的實施方案的MESA開發的模型。
圖15是根據本發明的實施方案,在根據他們的GlycA和中等HDL-P (HDL-PMED)的水平(低、中或高)劃分的9個亞組的IRAS參與者(全部具有低於或等於110 mg/dL的空腹葡萄糖)中說明5-年轉化為糖尿病的實際率(%)的圖。在記錄的850位參與者中,有88位轉化為糖尿病。
圖16是假設具有高和低水平的胰島素抵抗和SDRF的患者隨時間推移的空腹葡萄糖水平(mg/dL)的示例性圖,以說明SDRF和IR (eLP-IR,例如)可被用來預測葡萄糖值是否將隨時間推移而穩定或具有在未來,例如,根據本發明的實施方案無論是短期或是長期導致糖尿病的跡線。顏色編碼區分了具有隨時間推移的穩定的葡萄糖水平(綠色)的那三個患者與可能轉化為糖尿病(紅色)的那些患者。
圖17是提供測量短期風險,例如SDRF評分的示例性報告,可監測其變化以評價隨時間推移的β-細胞功能/功能障礙。
圖18是可提供根據本發明的實施方案的DRI評分、IR評分(與胰島素抵抗有關)和STR評分(與β-細胞功能相關)的一個或多個的示例性患者報告的示意圖。
圖19是可用來評估DRI評分、IR評分或STR評分的一個或多個隨時間推移的變化的示例性圖,其可基於根據本發明的實施方案的療法的劑量或類型或與其相關。
圖20A-20C說明具有與風險種類有關的DRI評分的示例性患者報告,以根據本發明的實施方案預測在限定的時間表例如5年內對T2DM的轉化。
圖21是根據本發明的實施方案,使用STR、IR和/或DRI風險指數模塊和/或線路分析患者的風險的系統示意圖。
圖22是根據本發明的實施方案的NMR光譜裝置的示意圖。
圖23是根據本發明的實施方案的數據處理系統的示意圖。
圖24是根據本發明的實施方案,能夠用來評價在未來發展T2DM和/或患有糖尿病前期的風險的示例性操作的流程圖。
本發明的前述和其它目的和方面在以下提出的說明書中詳細地解釋。
本發明的實施方案的詳細描述
本發明現在在下文參照附圖更全面地進行描述,其中顯示了本發明的實施方案。然而,本發明可以許多不同的形式體現,而不應視為限制在此提出的實施方案;更恰當地說,提供這些實施方案以使本公開內容將變得充分和完整,並將本發明的範圍完全傳達給本領域技術人員。
同樣的數字始終指同樣的要素。在圖中,某些線的厚度、層、組分、要素或特徵為清楚起見可被誇大。在說明書和圖中,術語"圖"可與縮略形式"圖(FIG.)"和"圖(Fig.)"互換使用。
虛線說明任選的特徵或操作,除非另外指明。
本文所用的術語僅僅是為了描述特定實施方案的目的並且不打算限制本發明。如本文所用的,單數形式「一」、「一個」和「該」意欲還包括複數形式,除非文中另外清楚地指明。還應該理解,術語"包含"和/或"含有",當用於本說明書時,特指所述特徵、整數、步驟、操作、要素和/或組分的存在,但不排除一個或多個其它特徵、整數、步驟、操作、要素、組分和/或其組合的存在或添加。如本文所用的,術語"和/或"包括一個或多個相關的所列項目的任何和全部組合。如本文所用的,短語例如" X和Y之間"和"大約X和Y之間"應該被解釋為包括X和Y。如本文所用的,短語例如"大約X和Y之間"意指"在約X和約Y之間"。如本文所用的,短語例如"從約X至Y"意指"從約X至約Y"。
用於糖尿病風險指數或評分的風險進展模型的組成成分的示例性描述在2013年3月14日提交的美國專利申請系列號13/830,784和2013年6月7日提交的PCT/US2013/044679中有描述,其內容通過引用結合到本文中,如同在此全面描述一樣。
除非另外限定,本文所用的所有術語(包括科技術語)具有本發明所屬領域普通技術人員通常理解的相同意義。應該進一步理解,術語,例如在常用詞典中定義的那些術語,應該被解釋為具有與它們在該申請的上下文和相關領域的意義一致的意義,並且不應被解釋為一個理想化或過於正式的意義,除非本文有如此明確的定義。為了簡潔和/或清楚起見,眾所周知的功能或結構可能不會詳細描述。
術語"約"指特定值或數量的+/- 10% (均值或平均數)。
術語"糖尿病前期"指患者或受試者的風險狀態而不是疾病狀態。因此,術語"糖尿病前期"指尚未被診斷患有2型糖尿病的人,並且如由美國糖尿病協會(American Diabetes Association)目前所定義的,與具有在100和125 mg/dL之間的空腹血糖水平,在140-199 (mg/dL)之間的口服葡萄糖耐量試驗水平或在5.7-6.4之間的A1C %的個體有關(如在下表1中所表示的) (對於每種類型的試驗,所述水平越高,則2型糖尿病的風險越高)。
表1:糖尿病和糖尿病前期的血試驗水平
對於在糖尿病前期範圍內的所有3次試驗,試驗結果越高,糖尿病的風險越大。參見,美國糖尿病協會(American Diabetes Association)。糖尿病中的醫療保健標準—2012. Diabetes Care. 2012:35 (增刊1): S12,表2。
本發明的實施方案可特別地適合於將具有相同或類似的空腹葡萄糖水平的患者的風險分級。一般來說,可以設想STR和IR評分,單獨或結合為DRI評分,可被用來單獨或與FPG或其它葡萄糖測量例如A1C (一種使用血紅蛋白A1C的非-空腹樣品)或口服葡萄糖耐量測量一起對在未來發展2型糖尿病的風險進行分級。STR、IR或DRI糖尿病風險評分的一個或多個可被用來對具有相同葡萄糖水平,但不同基礎代謝狀況的患者的2型糖尿病風險進行分級。
SDRF與β細胞功能障礙的聯繫目前是理論上的,因為到本專利申請的申請日為止,已確定沒有SDRF與β細胞功能的客觀測量實際相關的直接證據(沒有許多證據且它們不是很好的證據)。然而,由於SDRF僅有助於短期而不是長期風險並且獨立於IR,強烈地暗示與β細胞功能障礙的聯繫,如果目前只有一個推論的話。
本發明的實施方案能夠在相對短的時幀,通常5年內提供基於IR狀態和β細胞功能的"累積的"糖尿病風險。這種風險是由胰島素抵抗(一種無論什麼時幀內的糖尿病風險的必要成分)以及也由通常為晚期表現的β-細胞功能障礙(僅僅影響相對短期的轉化,通常在2-3年內)造成的。為評價在5年內轉化為T2DM的風險,可採用IR (如,eLP-IR)和β-細胞功能障礙(SDRF)二者的評估。如果涉及的時幀更短而不是更長,總體風險的β-細胞部分的相對重要性更大,或許佔3-年轉化風險的~50%,5-年轉化風險的~30%,和10-年轉化風險(累積)的Y。例如,對於5年風險的轉化時間表,X可以是約70%和Y可以是約30%。X和Y可具有其它值。表2包括對轉化為DRI評分的5年風險的相對權重集的實例,其在一些實施方案中可具有1、10或100的最大值。顯而易見的是,隨著評估窗口/風險期增加,SDRF評分可降低與DRI風險的相關性。
表2 IR和SDRF權重
在一些實施方案中,分析可使用來自一個或多個具有5年(或其它合適的)觀察期的研究群體的糖尿病轉化數據,以運行包括以下預測變量的邏輯回歸分析:年齡、性別、種族、空腹葡萄糖、IR (如,eLP-IR或其它IR測量)和SDRF。從這個預測模型,可生成用於IR和SDRF的係數。然後DRI可以按照方程式(1)計算為定義的係數(X)乘以IR (如,eLP-IR)加定義的係數(Y)乘以SDRF。用於分析的時幀越長,IR評分相對於SDRF評分將是更主要的。即是說,β係數將提供將不需要任何其它權重的相關統計關係的數值。
本發明的實施方案提供DRI評分的臨床輸出以及能夠合併以產生DRI評分的兩個多標記物參數的一個或兩個:IR參數(如,eLP-IR評分),其可通過飲食、鍛鍊和減肥和/或胰島素增敏藥物而設定,和β-細胞功能障礙部分,SDRF,其可通過針對這種功能障礙的藥物而有效地設定。測量和報告升高的SDRF的另一個理由是要患者警惕糖尿病在其不久的未來出現的可能性,因此更迫切地做一些相關的事情(通過最小程度地減肥加藥物)。
本發明的實施方案可使用STR評分以鑑定可從改善或穩定β細胞功能的藥物療法獲益的患者。
本發明的實施方案可使用STR評分以評估藥物療法、臨床試驗和/或有利於藥物發現。
術語"患者"被廣泛使用且指提供生物樣品供試驗或分析的個體。
術語"GlycA"指可從測量來自包含N-乙醯基葡糖胺和/或N-乙醯基半乳糖胺部分的急性期反應物糖蛋白的碳水化合物部分,更特別地來自2-NAcGlc和2-NAcGal甲基的質子的複合NMR信號衍生的生物標記物。GlycA信號的中心在約47℃(+/-0.5℃)時,在血漿NMR譜的約2.00 ppm處。峰位置獨立於分光計領域,但可根據生物樣品的分析溫度而變化並且在尿生物樣品中沒有發現。因此,如果試驗樣品的溫度改變,則GlycA峰區可變化。圖8說明根據本發明的實施方案的GlycA峰區(跨越該區的放大圖)的NMR譜。
GlycA NMR信號可包括在限定的峰區的NMR信號的子集以僅僅包括臨床相關信號貢獻並可排除對在該區的信號的蛋白質貢獻,如將進一步在下文所討論的。
如本文所用的,化學位移位置(ppm)指內部參照於2.519 ppm的CaEDTA信號的NMR譜。因此,本文所討論和/或要求的註明的峰位置可根據化學位移如何生成或參照而變化,如本領域技術人員熟知的。因此,為清楚起見,某些描述和/或要求的峰位置具有在其它相應的化學位移中的等效的不同峰位置,如本領域技術人員熟知的。
術語"生物樣品"指人或動物的體外血、血漿、血清、CSF、唾液、灌洗液、痰或組織樣品。本發明的實施方案可特別地適合於評估人血漿或血清生物樣品,特別是對於GlycA (其在例如尿中未發現)。血漿或血清樣品可以是空腹或非-空腹的。當葡萄糖通過NMR測量時,生物樣品通常是空腹血漿或血清樣品。然而,葡萄糖可用任何適當的方法測量。
術語"群體標準"和"標準"指由具有足夠大的樣本以代表總體人群的一個或多個大型研究例如動脈粥樣硬化(MESA)的Framingham子代(Framingham Offspring)研究或多種族研究或其它研究限定的值。然而,本發明不限於在MESA或Framingham中的群體值,因為目前定義的正常和面臨風險的群體值或水平可隨時間的推移而變化。因此,可提供與來自風險段(如,四分位數或五分位數)限定的群體值相關的參考範圍並用來評價具有臨床疾病狀態的升高或減少的水平和/或風險。
如本文所用的,術語"NMR譜分析"意指使用質子(1H)核磁共振光譜技術,以獲得能夠測量存在於生物樣品,如血漿或血清中的各自參數的數據。
"測量"及其派生詞指測定某些脂蛋白子集的水平或濃度,可包括測量其平均粒度。
術語"NMR衍生的"意指在NMR分光計中使用來自體外生物樣品的一個或多個掃描的NMR信號/光譜計算有關的測量。
術語"脂蛋白組分"指在與脂蛋白顆粒相關的數學風險模型中的脂蛋白組分,包括脂蛋白的一個或多個子集(亞型)的尺寸和/或濃度。脂蛋白組分可包括任何脂蛋白顆粒子集、濃度、尺寸、比率和/或脂蛋白參數的數學乘積(乘)和/或定義的脂蛋白參數的或與其它參數例如GlycA合併的脂蛋白子集測量。
術語"相互作用參數"指合併(乘)為數學乘積和/或比率的至少兩個不同定義的患者參數,通常一個參數是HDL-P亞群,而另一個是炎性標記物。相互作用參數的實例包括,但不限於HDL的亞群,如中等HDL-P ("HMP")/總HDL-P、(HMP)(GlycA)、(HMP)(HZ),和/或炎性標記物與定義的脂蛋白亞群,如GlycA與HMP的比率。術語"HZ"指平均HDL-尺寸。GlycA是炎性生物標記物。其它炎性生物標記物可用於相互作用參數,如CRP (C-反應性蛋白質)、hs-CRP (高-敏感性CRP)、IL-6 (白介素-6)、纖維蛋白原、結合珠蛋白,和α-1-酸糖蛋白。
術語"數學模型"和"模型"可互換使用,並且當與STR和/或DRI ("糖尿病風險指數")一起使用時,指用來評估受試者在未來的時間段發展2型糖尿病的風險的風險統計學模型,或者當與IR一起使用時,指基於一個或多個研究群體的得自胰島素抵抗(一種糖尿病風險的良好預測指標)模型的風險。STR表示一個短於長期風險(LTR)的時間段。風險模型可以是或包括任何合適的模型包括,但不限於,邏輯模型、混合模型或分級線性模型的一個或多個。STR和DRI風險模型可提供基於在限定的時幀內(通常對於STR在0-3年內和對於LTR大於3年)轉化為2型糖尿病的概率的風險測量。STR/SDRF風險模型可在試驗後持續一段少於3年的時幀,例如6個月、1年、1.5年、2年、2.5年或3年內。對於STR和LTR 長期風險,例如,試驗後大於3年,例如3.5年、4年、5年或5-10年內,IR風險可以是重要的風險參數。
DRI時間段可以在約5-7年之間,更通常約5年。STR、IR和/或DRI風險模型能夠對發展T2DM的風險進行分級,如通過標準χ2和/或p值(後者具有充分代表性的研究群體)測量的。
表3:MESA隨訪期
表3顯示對於不同MESA訪問(隨訪檢查)的隨訪時間。STR參數能夠從回歸模型導出,以預測在訪問2診斷的糖尿病。平均隨訪時間是1.6年(最小0.9年;最大3.4年)。圖13顯示在MESA中的訪問2或3診斷的DM。IR參數可具有從STR至LTR的任何時幀,而SDRF在STR中是唯一相關的。在一些實施方案中,IR模型能夠從預測HOMA-IR的線性回歸模型導出(如圖12中所示)。
本領域技術人員應該理解,幾乎所有群體研究進行隨訪某一固定的時間段(如,5年)並在已診斷出糖尿病的時間段期間不再監測。如此回歸模型是累積的測量,包括一些較早轉化為糖尿病的人和較晚轉化為糖尿病的人。
術語"LP-IR"評分指基於脂蛋白的胰島素抵抗評分,其使用與不同定義的脂蛋白組分相關的風險評分的總和,評價受試者從胰島素敏感至胰島素抵抗的胰島素敏感性。為詳細地討論LP-IR評分,參見,例如美國專利號8,386,187和Shalaurova I等, Lipoprotein Insulin Resistance Index:A Lipoprotein Particle–Derived Measure of Insulin Resistance,Metabolic Syndrome and Related Disorders, Vol. 12, No. 8, Oct. 2014, pp. 422-429,其內容通過引用結合到本文中,如同在此全面描述一樣。一般來說,大的VLDL、VLDL尺寸,和小的LDL具有正風險相關性,而大的HDL、LDL尺寸和HDL尺寸具有負相關。這6種組分可被用來生成LP-IR評分(見,例如圖2B中底下一排指示的與LP-IR相關的組分),其通常為1-100之間的評分,其中各組分的風險評分變化,如在美國專利號8,386,187的表3中所述的。LP-IR評分可使用脂蛋白的NMR衍生的測量或其它測量方法計算。
本發明的實施方案可使用包括與糖尿病病理生理學相關聯的生物標記物的風險模型,所述生物標記物包括以下的兩種或更多種:胰島素抵抗、受損的β-細胞功能或受損的胰島素分泌、炎症和有缺陷的非-胰島素(NI)依賴性葡萄糖吸收。
HDL的作用是複雜的,而HDL-C被認為是相對粗糙的生物標記物。最近,研究者已提出HDL是在糖尿病病理生理學中的一個積極參與者而不是旁觀者。參見,Drew等,The Emerging Roles of HDL in Glucose Metabolism, Nat. Rev., Endocrinol., 8, 237-245 (2012). 2012年1月24日在線公開。
從正常到糖尿病的血糖跡線通常可以長期還算穩定的葡萄糖水平為特徵,在此期間增加的胰島素抵抗通過增加的β-細胞胰島素分泌來補償,隨後急劇增加,在β-細胞質量和功能的損失導致的糖尿病診斷前通常少於約3年。參見,例如Tabak AG等, Lancet 2009: 373: 2215-21,其內容通過引用結合到本文中,如同在此全面描述一樣。短期轉化為糖尿病可能具有胰島素抵抗和β-細胞功能障礙或損傷。與IR有關的標記物預測與轉化的時幀無關的易於發生的糖尿病。然而,提高短期轉化的預測的、獨立於IR和葡萄糖的標記物並不能獨立地提高由IR標記物提供的長期轉化的預測。
參考圖2A,本發明的實施方案使用至少兩個分開的脂蛋白的多標記物和代謝參數,提供糖尿病風險評估。兩個多標記物參數包括定義的脂蛋白和代謝參數。兩個多標記物參數如下所示:(i) 用於胰島素抵抗的IR風險因子評分,其包括多個定義的脂蛋白和代謝參數和(ii) 用於β-細胞功能障礙的STR或SDRF風險因子評分,其包括多個定義的脂蛋白和代謝參數,其中一些可與用於STR風險因子評分的參數重疊。STR風險因子評分可包括多個分開的值的組合(如,總和),其與多個或全部以下組分有關:中等HDL-P、炎性標記物和相互作用參數。相互作用參數可以是炎性標記物和定義的HDL-P亞群,通常為中等HDL-P。
IR風險因子可包括唯一的IR指數或可包括IR指數和其它定義的脂蛋白和代謝參數。例如,IR風險因子評分可使用多個或全部以下組分的分開的值或評分的組合生成:(a) 炎性標記物,(b) 中等HDL-P,(c) 中等VLDL-P,(d) 一個或多個支鏈胺基酸(BCAA)和(e) 具有限定的數值範圍的胰島素抵抗指數。BCAA可包括纈氨酸、亮氨酸和異亮氨酸中的一個或多個,其可通過NMR或其它方法測量。為討論BCAA的NMR測量,參見,例如PCT/US2013/064142,其內容通過引用結合到本文中,如同在此全面描述一樣。
IR風險因子可以是LP-IR或eLP-IR (下文進一步討論)或其它合適的胰島素抵抗指數。例如,使用在授權於Hu等 ("Hu")的US 2009/0155826中鑑定的代謝物的胰島素抵抗指數,其內容通過引用結合到本文中,如同在此全面描述一樣。Hu提出使用生物標記物,即使用表4、5、6、7、8、9A、9B、27、28和29 (段落98)的一個或多個中的生物標記物,評估胰島素抵抗。在測定一個或多個生物標記物的水平後,可將所述水平與疾病或病症參考水平比較,以確定一個或多個生物標記物各自的分級。分級可以使用任何算法集合在一起以創建一種對受試者的評分,例如,胰島素抵抗(IR)評分(段落106)。段落107繼續給出了IR評分的實例:100表示2型糖尿病,而評分少於25可表示正常葡萄糖耐受。
參考圖2B,脂蛋白和代謝物參數的兩個分開的多標記物顯示為(i) 針對IR風險因子評分的擴展的LP-IR胰島素抵抗("eLP-IR")評分和(ii) 針對STR因子評分的短期糖尿病風險因子("SDRF")評分。SDRF評分可包括至少一個相互作用參數,如GlycA x中等HDL-P所示的。多標記物參數的兩個分開的風險因子評分可評價體外生物樣品中的任何水平血糖過多的糖尿病風險。生物樣品可以是空腹血漿生物樣品。
雖然eLP-IR指數通過舉例的方式,使用LP-IR顯示,可採用具有定義的範圍的其它胰島素抵抗指數或評分。
eLP-IR評分是LP-IR評分的擴展版本,因為它包括LP-IR評分(具有由在從LP-IR框延伸的線內在圖底部上的組分指示的6種註明的脂蛋白組分)以及另外的定義的組分,包括(如所示的) GlycA、中等HDL-P、中等VLDL-P和纈氨酸。其它BCAA可被包括或用來代替纈氨酸,包括,例如,亮氨酸和異亮氨酸。GlycA是炎性生物標記物和其它炎性生物標記物可被包括或代替GlycA,例如,纖維蛋白原、hs-CRP、CRP、IL-6或結合珠蛋白。
SDRF評分可包括中等HDL-P和至少一個炎性標記物(顯示為GlycA),以及至少一個相互作用參數。相互作用參數不用於eLP-IR或LP-IR評分,因為它與長期風險無關(其在統計學上與胰島素抵抗無關,但與糖尿病風險相關)。此外,可使用不同炎性標記物或相互作用參數。顯著地,相互作用參數,例如HDL-PMED和GlycA的相互作用被認為反映這些變量與β-細胞功能障礙的關係。結果提供對於HDL在糖尿病病理生理學中的多重作用和對於炎症HDL功能性調節的最近證據的流行病學支持。圖9圖解說明了HDL功能的調節,例如,隨著炎症的水平的增加(如通過GlycA所評價的),從負性改變為正性風險因子。雖然對於MESA顯示為約第80位百分位數的GlycA,使用IRAS鑑定第65位百分位數值,二者均在約350-360 µmol/L的水平。
數學模型可使用其它臨床參數例如性別、年齡、BMI、是否使用高血壓藥、葡萄糖等。
雖然已設想STR、IR和DRI參數可作為在限定的數值範圍內的數值評分提供,其中較低的評分與較低的轉化為糖尿病的風險有關,而較高的評分與較高的風險有關,風險評分或指數能夠以不同方式在患者報告中提出。STR、IR和DRI評分可作為數字或字母數字混編表示的結果提供,通常含有關於定義的等級或在值的定義範圍內的數值評分。例如,在特定實施方案中,STR、IR和/或DRI評分可作為例如,在低端上的0和1之間至高端上的10或100的定義範圍內的評分提供或包括這樣的評分。範圍的實例包括:0-0.1、0-1、0-5、0-10、1-10、0-24、1-24、0-100、1-100、10-100、0-1000、1-1000、10-1000等。通常,最低的數與最小的風險有關,而較高的數與在未來發展T2DM的增加的風險有關。在該範圍內的較低的值可以是"0"以上例如1、2、3、4或5等,或可以甚至是負數(如,-1、-2、-3、-4、-5等)。其它指數實例包括,例如,字母與數字混合編排的指標或甚至圖標註明的風險程度,包括但不限於,"LR1" (低風險)、IR5 (中度風險)和"HR9" (高風險),術語例如"DRI正性"、"DRI高"、"DRI中性"、"DRI低"、"DRI好"、"DRI差"、"DRI警戒"等。
IR、STR或DRI評分可都在0-10或1-10之間。
IR評分和SDRF評分可具有在0-100或1-100之間的範圍和DRI評分可具有0-10或1-10的範圍,因為風險模型可將定義的小係數應用於各風險模型的不同組分,例如,少於0.001值應用於IR評分,通常約0.009 (圖10)。
如以上所註明的,STR、IR和DRI糖尿病風險指數或評分可消除葡萄糖測量。因此,例如,可對患者計算STR、IR或DRI評分中的一個或多個作為篩選試驗或將獨立於葡萄糖的風險分級。即是說,STR/IR或DRI可被用來對具有葡萄糖水平低於110 mg/dL,例如,在80-110 mg/dL之間的患者的風險分級和/或可獨立於空腹葡萄糖或其它血糖過多的測量來預測糖尿病轉化。
為幫助理解由SDRF和IR兩個不同的測量提供的信息,指導方針和/或電子程序可提供給臨床醫師,當提供兩個數據點時,會生成試驗結果。合併的數據評估可作為從實驗室或從供給公司,例如,LipoScience (Raleigh, NC)的下載來提供。指導方針可提供給臨床醫師,以致臨床醫師能夠理解由STR和/或DRI評分提供的風險分級並可通知臨床醫師是否預約對患者而言可能是更加耗時、昂貴或不方便的葡萄糖攻擊試驗。也可提供能夠生成基於STR、IR和/或DRI評分的風險信息的電子風險分析線路(如,一個通過網際網路可訪問的入口)。
STR/SDRF、IR和/或DRI評分可獨立於葡萄糖測量和/或不需要同時的葡萄糖測量來生成並可用來使臨床醫師考慮各患者可能屬於何種風險分類。
脂蛋白包括在血漿、血清、全血和淋巴中發現的廣泛種類的顆粒,含有各種類型和量的甘油三酯、膽固醇、磷脂、鞘脂和蛋白質。這些各種顆粒允許在血中的其它疏水性脂質分子的溶解並發揮與脂肪分解、脂肪生成和脂質在腸、肝、肌肉組織和脂肪組織之間的轉運有關的多種功能。在血和/或血漿中,脂蛋白已用許多方式分類,通常基於物理性質例如密度或電泳遷移率或載脂蛋白A-1 (Apo A-1),在HDL中的主要蛋白質的測量。
基於核磁共振-確定的粒徑的分類區分基於尺寸或尺寸的範圍的截然不同的脂蛋白顆粒。例如,NMR測量能夠鑑定至少15種截然不同的脂蛋白顆粒亞型,包括至少5種亞型的高密度脂蛋白(HDL),至少4亞型的低密度脂蛋白(LDL),和至少6亞型的極低密度脂蛋白(VLDL),其可指定為TRL (富含甘油三酯的脂蛋白) V1-V6。
NMR衍生的估計的脂蛋白尺寸,例如,對於H1-H26的HDL-P粒徑,不是精確的,但近似估計每個子集的尺寸範圍。其它方法可提供與NMR估算的子集尺寸相關的不同的尺寸範圍。
此外,也要注意到,雖然脂蛋白顆粒的NMR測量特別適合於本文所述的分析,考慮到現在或將來的其它技術可被用來測量這些參數,因而本發明的實施方案並不局限於這種測量方法。也應考慮到可採用使用NMR的不同方案(如,包括不同的去卷積(deconvolving)方案)以代替本文描述的去卷積方案。參見,例如,Kaess等,The lipoprotein subfraction profile: heritability and identification of quantitative trait loci, J Lipid Res. Vol. 49 pp. 715-723 (2008);和Suna等, 1H NMR metabolomics of plasma lipoprotein subclasses: elucidation of metabolic clustering by self-organizing maps, NMR Biomed. 2007;20: 658-672。採用一種基於密度的分離技術的用於評估脂蛋白顆粒和離子遷移率分析的浮選和超濾是用於測量脂蛋白子集顆粒濃度的替代技術。可有效地採用垂直自動剖析方法或其它亞組分分類方法。參見,Martin等, High-density lipoprotein subfractions: Current views and clinical practice applications, Trends Endocrinol Metab, 2014;25;329-336,其內容通過引用結合到本文中,如同在此全面描述一樣。
根據本發明的一些特定實施方案,脂蛋白子集分組可包括具有濃度的各子集,其可合計在一起以確定VLDL-P、HDL-P和LDL-P數。須注意所註明的"小、大和中"尺寸的範圍可以變化或被重新定義以擴大或縮小其上限或下限值或甚至排除在所註明的範圍內的某些範圍。註明的粒度通常指平均測量,但可採用其它分界。圖3A和3B說明不同亞群的脂蛋白的示例性尺寸的範圍。本發明的實施方案將脂蛋白顆粒分類為由基於功能/代謝相關性的尺寸範圍分組的子集,所述功能/代謝相關性通過其與脂質和代謝變量的相關性評價。因此,如以上所註明的,評估能夠測量脂蛋白顆粒的超過20種離散的亞群(尺寸),通常約30-80種之間的不同尺寸亞群(或甚至更多)。
對於GlycA測量計算,當採用時,HDL和LDL分組的離散的數可少於用來定量地測量脂蛋白子集的那些(在此NMR被用於脂蛋白測量)。不同尺寸的子集可從其光譜不同的脂質甲基NMR信號的振幅來定量。參見,Jeyarajah等, Lipoprotein particle analysis by nuclear magnetic resonance spectroscopy, Clin Lab Med. 2006;26: pp. 847-870,其內容通過引用結合到本文中,如同在此全面描述一樣。
術語"LDL-P"指合計定義的LDL子集濃度的低密度脂蛋白顆粒數(LDL-P)測量(如,LDL-P數)。總DL-P可使用合計所有LDL子集(大和小) (包括在18-23 nm之間的尺寸)的濃度(µmol/L)的總低密度脂蛋白顆粒(LDL-P)測量生成。在一些實施方案中,LDL-P測量可使用選擇的LDL子集的組合(而不是所有LDL子集亞群的全部)。如本文所用的,術語"小LDL顆粒"通常包括其尺寸範圍在從約18至少於20.5 nm之間,通常在19-20 nm之間的顆粒。術語"大LDL顆粒"包括直徑範圍在約20.5-23 nm之間的顆粒。須注意顆粒的LDL子集可被分到其它尺寸的範圍內。例如,"小"尺寸可以是在約19-20.5 nm之間,中間尺寸可以是在約20.5-21.2 nm之間,和大尺寸可以是在約21.2-23 nm之間。另外,中等-密度脂蛋白顆粒("IDL"或"IDL-P"),其直徑範圍在約23-29 nm之間,可被包括在定義為"大" LDL (或甚至是小的VLDL)的顆粒中。因此,例如,LDL子集可在19-28 nm之間。
術語"HDL-P"指定義的脂蛋白子集亞群的濃度的高密度脂蛋白顆粒數(HDL-P)測量(如,HDL-P數)。總HDL-P可使用總高密度脂蛋白顆粒(HDL-P)測量來生成,所述測量合計了所有的尺寸範圍在約7 nm-約15 nm之間,通常在7.3或7.4和13.5或14 nm之間的HDL子集(其可基於尺寸分組為不同尺寸的種類,例如大、中和小)的濃度(µmol/L)。
HDL子集顆粒通常範圍是在約7 nm-約15 nm,更通常約7.3 nm-約14 nm (如,7.4 nm-13.5 nm)之間。HDL-P濃度,至少當通過某些方法包括NMR去卷積測量時,是其HDL-子集的各自亞群的顆粒濃度的合計。HDL亞群可包括中等HDL顆粒子集(HMP)。中等HDL-P,其在本文可與縮寫詞"HMP"或"HDL-PMED"或"med-HDL-P"互換使用,指排除小和大HDL顆粒子集的HDL顆粒的定義的亞群。HMP/med-HDL-P/HDL-PMED的精確的尺寸範圍可在測量方法和研究群體之間變化。
然而,如本領域技術人員熟知的,可選擇HMP/med-HDL-P/HDL-PMED,以及用於不同IR/STR風險模型的其它脂蛋白亞群,以採用風險模型(通常地,至少一個限定的研究群體的邏輯回歸模型),短期或長期多參數STR和IR風險模型之一或二者,使轉化為糖尿病的風險的相關性最大化。
圖5圖解說明通過來自MESA的尺寸和易於發生的糖尿病風險相關性分組的HDL亞群。如本文註明的,HDL-PMED子集的HDL尺寸可以變化並可取決於研究群體中的風險相關性,該圖顯示與尺寸的不同分組(僅通過舉例的方式)的負和正相關性。該圖說明26種HDL亞群的9個不同尺寸的分組或亞群與根據本發明的實施方案選擇的HDL子集的其它分組的3個框的糖尿病風險相關性。來自邏輯回歸模型的χ2值指示如在6年的隨訪期間的MESA研究群體中,在具有411例診斷的易於發生的糖尿病病例的4968名MESA參與者(全部9種亞群包括在對年齡、性別、種族和葡萄糖調節的相同邏輯回歸模型中)中測定的風險相關性的強度和徵兆。
在一些實施方案中,HDL-P的不同亞群可通過從1-26的數目鑑定,其中"1"表示在HDL類中最小的尺寸亞群和"26"是HDL類中最大的尺寸亞群,如在圖4中所示。
HMP可包括,例如,各自亞群的具有對應於H9-H14或H9-H15,和任選的H9-H17的尺寸的HDL顆粒。圖4說明任選的、可被用來限定med-HDL-P亞群的不同示例性子集分組。可基於90 mg/dL (或甚至更低)-110 mg/dL的(空腹)葡萄糖測量選擇這些尺寸的種類,以對具有在群體標準中的中度風險的個體優化風險分級。即是說,對於特定參數,脂蛋白子集亞群或組別可基於研究群體例如MESA、IRAS和/或Framingham的統計學分析進行選擇,以確定各個亞群應如何基於與T2DM有關的,而不是LP-IR或胰島素抵抗有關的風險分組。
在一些實施方案中,中等HDL-P (HMP/HDL-PMED)可與以下範圍之一的HDL-P有關:8.3-9.2 nm、8.3-9.4 nm、8.3-9.7 nm、8.3-10 nm或8.3 nm-10.2 nm (基於NMR測量的估算尺寸)。
在IRAS研究數據集中的糖尿病預測在有點更窄的尺寸範圍內表現更好,而在MESA研究數據集(其產生8.3 nm-10.0 nm的中等HDL-P跨度)中沒有太差。然而中等HDL-P的上限範圍可以是9.4 nm、10.0 nm或10. 2 nm,或甚至例如稍高或較低。
術語"大VLDL顆粒"指在60 nm或60 nm以上例如在60-260 nm之間的顆粒。術語"中等VLDL顆粒" ("medVLDL-P"或"VLDL-Pmed")指具有尺寸在35-60 nm之間的顆粒。術語"小VLDL顆粒"指在29-35 nm之間的顆粒。術語"VLDL-P"指合計定義的VLDL子集的濃度的極低密度脂蛋白顆粒數(VLDL-P)測量(如,VLDL-P數)。總VLDL-P可通過合計所有VLDL子集(大、中和小)的濃度(nmol/L)生成。對於中和大VLDL的精確尺寸範圍可在測量方法和研究群體之間變化,但各自與可基於不同的子集分組的風險相關性定義的脂蛋白的定義亞群相關。
如以上所註明的,本發明的實施方案使用患者或受試者體外生物樣品的不同定義的脂蛋白和代謝物生物標記物或參數的風險的定義數學模型,提供 STR、IR和DRI評分,以在T2DM發病前,鑑定可從藥物、醫學、食物、鍛鍊或其它幹預受益的面臨風險的患者或受試者。
在臨床試驗和/或藥物發現期間,STR、IR和/或DRI的一個或多個評分也可或備選地用來監測代謝或細胞功能的正面或負面變化。
STR、IR和/或DRI評估可與葡萄糖測量分離並可相對容易地生成為篩選工具並能夠比用常規試驗更早的時間鑑定面臨風險的個體。
如本文所用的"未處理的生物樣品"指這樣的生物樣品,其與質譜分析的樣品製備不同,在其獲得後不經受造成生物樣品物理或化學變化的處理(但可使用緩衝劑和稀釋劑)。因此,一旦獲得生物樣品,來自生物樣品的成分沒有改變或除去。例如,一旦獲得血清生物樣品,血清並未經受從血清除去成分的處理。在一些實施方案中,未處理的生物樣品不經歷過濾和/或超濾過程。
在一些實施方案中,患者葡萄糖測量可經由生物樣品NMR譜的NMR分析,以及脂蛋白顆粒測量、GlycA和纈氨酸測量獲得。然而,葡萄糖測量(當使用時)可供選擇地以常規化學方法獲得。
在一些特定的實施方案中,已考慮可分析單一(血/血漿)體外生物樣品的GlycA、纈氨酸和脂蛋白的NMR測量,以提供重要的臨床信息和/或進一步改善預測或評估患者或受試者在未來發展2型糖尿病和/或具有糖尿病前期的風險。
圖6A是根據本發明的實施方案,基於MESA 5-年T2DM轉化(n=359/4211)的糖尿病轉化率對比葡萄糖分類(低風險、中度風險、高風險)的圖,說明對中度風險葡萄糖患者分級或更好地鑑定面臨增加的進展為T2DM患者的未滿足的需要。圖6B是根據本發明的實施方案,基於IRAS 5-年T2DM轉化(n=134/978)的糖尿病轉化率對比葡萄糖分類(低風險、中度風險、高風險)的圖,也說明對面臨增加的進展為T2DM的患者,特別是對被認為是處於低或中度風險葡萄糖區的那些患者分級或更好地鑑定他們的未滿足的需要。圖6A/6B對比基於葡萄糖水平("低" =100,如由"糖尿病前期"的名稱所暗示的在升高的範圍100-125的葡萄糖水平)指定的風險和在y軸分類(暗含)為不高(25%)所示的實際風險。在MESA中,例如,具有葡萄糖<100的39 + 87 "低風險"人群發展為糖尿病,如此他們的風險實際上是不低的。本發明的實施方案提供的DRI評分可將公認的"低風險"個體細分為具有真正的低風險的那些個體和具有高或甚至極高風險的其它個體(由各葡萄糖分類內預測的糖尿病率的寬範圍所較好顯示的)。
圖7是MESA研究群體(n=3450)的特徵的圖。
圖8是顯示GlycA、纈氨酸和脂蛋白子集峰區的NMR譜圖。
圖9是通過GlycA水平(µmol/L)對HDL-PMED (高、中和低)的3種定義的水平,預測短期糖尿病轉化率的圖,說明高HDL-PMED在大約第80位百分位數水平的GlycA從"好"轉化為"差"。高HDL-PMED線由上升到右側更高風險的最高線的左側的低線表示。低HDL-PMED線用線上的星星顯示,說明其隨著GLycA水平上升(當炎症增加時)而降低風險相關性。
HDL-PMED值可以是9、12.9和17.17,表示第25、50、和75位百分位數。對於在MESA (n=181/3450)中短期轉化為糖尿病而言,預測的轉化為糖尿病的概率可以用於預言的具有空腹血糖(FPG) =105 mg/dL和第50位百分位數的eLP-IR評分(0.90)的60歲高加索女性的邏輯回歸為基礎。
GlycA的濃度範圍通常是在約220-500 µmol/L之間,包括其端值。
圖10是類似於圖2B的框圖,說明具有示例性係數的示例性數學方程式,所述係數可與註明的各自的組分一起使用,以生成eLP-IR和SDRF評分。eLP-IR評分可與SDRF評分結合生成DRI評分。在一些實施方案中,可提供各評分或可提供不同的評分之一給用戶以供評估。
eLP-IR評分通常範圍是從約0.1至1.8並可使用群體標準例如MESA作為參照群體,以百分位數值報告給患者和/或臨床醫師。
SDRF評分通常範圍在從約-6.4至-1.6之間並且也可以百分位單位報告。
為報告目的,通常將DRI評分轉化,以使範圍在1和10之間。即是說,本文給出的示例性範圍是eLP-IR和SDRF的"原始"輸出值,即由圖10金字塔形底部的2個方程式產生的值。為報告目的,SDRF和eLP-IR值可以在數學上改變/轉化為百分位數值(例如,給出1-100評分)。
圖11A是顯示在MESA研究中,在分別為<95 mg/dL、95-99 mg/dL和100-110 mg/dL的葡萄糖分類的參與者中,DRI-預測的糖尿病轉化率(%)的範圍的垂直矩形的圖,以說明DRI評分如何能夠對在同樣窄的葡萄糖範圍內的人群風險進行分級。
圖11B是根據本發明的實施方案,顯示在IRAS研究中,在<95 mg/dL、95-99 mg/dL和100-110 mg/dL的葡萄糖分類內的參與者中的DRI-預測的糖尿病轉化率(%)範圍的類似的圖,其證實MESA導出的DRI風險模型可對在相同葡萄糖範圍內的個人風險進行分級。
圖12是顯示在MESA (n=3446)中,在預測胰島素抵抗(如通過HOMA-IR評價)的3種線性回歸模型中包括的參數的圖。各參數與胰島素抵抗的相關性強度作為在每一個標準偏差增量的ln (HOMA-IR)中的差值給出。eLP-IR可根據本發明的實施方案,由具有在方程式2A中註明的示例性β-係數的模型2參數表示,這有助於胰島素抵抗的eLP-IR多標記物參數。方程式2B是方程式2A的更普及版本,識別係數值(由A-E顯示)可不同於方程式2A中所示的那些(基於例如不同的研究群體和/或不同的炎性標記物、不同IR或不同BCAA參數)。
eLP-IR = (0.00935) (LP-IR) + (0.001687) (纈氨酸) – (0.002594) (VLDL-PMED) – (0.01096) (HDL-PMED) + (0.000848) (GlycA) 方程式2A
eLP-IR = (A) (LP-IR) + (B) (纈氨酸) – (C) (VLDL-PMED) – (D)(HDL-PMED) + (E)(GlycA) 方程式2B
圖13是根據本發明實施方案有助於短期風險的SDRF多標記物參數(來自在具有作為因變量的短期(n=181/3450)或長期(n=286/3269)糖尿病轉化的MESA中的邏輯回歸)的參數的圖。各參數在不同模型中的相關性強度由每一個標準偏差增量的優勢率(OR)給出。SDRF使用方程式3A,使用來自用於短期糖尿病轉化的模型4的β-係數導出。方程式3B是方程式3A的更普及的版本,識別係數值(由A-C顯示)可不同於方程式3A中所示的那些(例如基於不同的研究群體和/或基於不同炎性標記物,或不同的相互作用參數)。
SDRF = - (0.352) (HDL-PMED) -(0.0108) (GlycA) + (0.000969) (GlycA x HDL-PMED) 方程式3A
SDRF = - (A) (HDL-PMED) - (B) (GlycA) + (C) (GlycA x HDL-PMED) 方程式3B
為報告目的,分別得自方程式2A和3A的「原始」 eLP-IR和SDRF風險評分,可轉化為基於參考群體例如MESA內的百分位數值的範圍1-100之間的各個評分。在eLP-IR的這樣的情況下,<0.7 (1.1 (≥第75位百分位數)的值可分別表示發展2型糖尿病的低風險和高風險。在SDRF的情況下,<-4.1 (-3.8 (≥第75位百分位數)的值可分別表示在相對短的時間段內轉化為糖尿病的低風險和高風險。SDRF和eLP-IR的原始評分範圍的實例在下表4中提供。
表4 在MESA中用於eLP-IR和SDRF評分的百分位數值
對於IR (如,eLP-IR)定義的HDL-P亞群可不同於用於SDRF的HDL-P亞群,但通常是用來計算SDRF評分的相同定義的HDL-P亞群的相同濃度測量。
SDRF和eLP-IR評分或參數可被合併成一個複合或累積的DRI評分。在一些實施方案中,SDRF和IR評分(如,eLP-IR)係數(權重)可在具有葡萄糖<110 mg/dL的人群中,使用5-年糖尿病轉化的邏輯回歸模型進行選擇/限定。為此目的,可使用MESA或其它數據。選擇的權重因子可以在不同的研究中,在評價IRAS的5-年風險中證實。
生成在MESA (5-y)和IRAS (5-y)二者以及MESA長期(~10-y)中的邏輯模型,以提供SDRF和eLP-IR在那3種情況下的係數和卡方值的實例。這些僅僅作為eLP-IR和/或SDRF組分的實例,例如纈氨酸或GlycA測定可被調節或可使用例如其它IR模型/評分、其它炎性標記物或其它BCAA。如本領域技術人員熟知的,邏輯模型可用不同的組分來運行以選擇/定義係數。表5是顯示可被用來提供用於DRI評分的X和Y因子(方程式1)的示例性係數,以及在10年轉化中幾乎沒有價值的SDRF的圖表。
表5 用於DRI評分的示例性X和Y係數
在一些實施方案中,"原始" DRI值的範圍可在從約-3.0至約+1.8,但其它原始評分範圍也是可能的。DRI原始評分可任選地轉化為限定的標準化評分範圍例如1-10或0-10。
因此,例如,在一些實施方案中,使用第一套係數(MESA 5-年),DRI方程式可以是:DRI = 2.1017 (eLP-IR) + 0.5163 (SDRF)。
在一些實施方案中,不使用百分位數,DRI範圍可以被分割成一組相等的部分,例如10-50,通常20個相等的部分,以將原始值轉化為範圍從1至10 (增量為0.5)的DRI評分值(即,0.5、1.0、1.5、......10),以提供風險評價,每一個中較大的值表示與較低的值相比風險增加。
圖14是說明在IRAS中,在5.2年隨訪期間轉化為糖尿病(n=134/976)的圖表,其驗證了使用根據本發明的實施方案的MESA開發的模型。數據是以具有5-年糖尿病轉化(實際5.2年轉化)作為因變量的IRAS中的邏輯回歸為基礎的。5個回歸模型的相對預測值通過可能性比率(LR) χ2 統計學和在ROC曲線下的面積(AUC)給出。指示的變量的相關性強度由每一個標準偏差增量的優勢率(OR)給出。Si是通過經常取樣的靜脈內葡萄糖耐量試驗測量的胰島素敏感性。圖14還顯示相對於先前LP-IR,通過eLP-IR提供的改善的糖尿病風險相關性(124.2對比119.9) LRχ2。
圖15是說明根據本發明的實施方案,在9個亞組的IRAS參與者(全部具有空腹葡萄糖低於或等於110 mg/dL)中由他們的GlycA和HDL-PMED的水平(通過三分組分為低、中或高)分類的,基於觀察的(未預測的) 5-年糖尿病轉化率的相互作用參數的意義的圖。例如,當GlycA水平低(底部三分位)時,HDL-PMED水平相對於糖尿病風險呈強烈的負相關(當HDL-PMED分別呈現高對比低的關係時,則比率為2.3%對比10.1%)。然而,當GlycA水平高(上部三分位)時,具有高水平的HDL-PMED是不好的,但實際上比具有低HDL-PMED水平(12.9%率)更差(17.8%轉化率)。
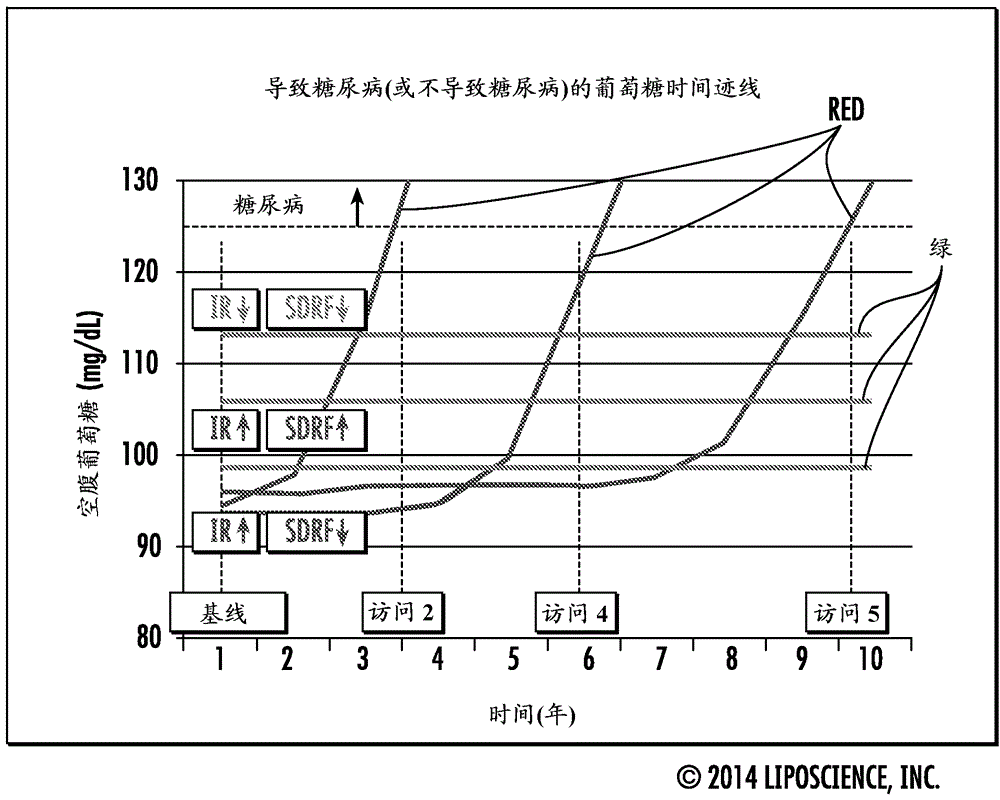
圖16是根據本發明的實施方案,對於具有高或低水平的胰島素抵抗(IR)和SDRF評分的假設患者隨時間推移(年)的空腹葡萄糖(mg/dL)的示例性圖,以說明SDRF和IR (eLP-IR,例如)評分可與中間或低葡萄糖值一起使用,以預測葡萄糖值是否隨時間推移是穩定的,或具有在未來(例如,或者短期或者長期)導致糖尿病的跡線。例如,當SDRF評分和IR評分二者表示為升高(如,超過第75位百分位數)時,則葡萄糖跡線在相對短的時幀(例如,從試驗時起的約2-3年或更短)內更可能升高。
圖17是提供短期風險測量,例如,SDRF評分的示例性報告,可監測其變化以評價隨時間推移的β-細胞功能/功能障礙並在報告中作為參考或歷史分段提供。在第三個三分位或以上的原始STR評分,如≥-3.8 (≥第75位百分位數)可指示在相對短的時間段(如試驗後2年或更短)內轉化為糖尿病的高風險。
圖20A-20C也是提供具有不同葡萄糖水平的相同DRI評分的示例性報告。所述報告也可提供對炎性標記物(如,GlycA)和BCAA,如纈氨酸的分開的評分。
DRI評分也可提供相關的5-年風險分類。5-年風險時間表被認為具有對患者的臨床意義,可能引起或促使患者採取更積極的反應,例如,相對於較長時間表的食療、鍛鍊或藥物療法。然而,可使用較長的時間表。DRI評分(如,糖尿病風險指數)可單獨或與相對於患者的FPG評分的風險圖的解釋節段一起提供。歷史報告可使STR或DRI評分與FPG評分相關。即使FPG評分保持相對水平,STR、IR或DRI評分可指示朝向糖尿病的進展,如果這些分數增加的話。
圖20A-20C說明具有相同7.5 DRI評分的患者可分別具有基於他們的FPG水平,顯示為極高、高和低的5-年風險分類的不同風險。
圖18是示例性患者報告的示意圖,其可提供根據本發明的實施方案的DRI評分、IR評分(與胰島素抵抗有關)和STR評分(與β-細胞功能相關)的一個或多個與其它脂蛋白和/或代謝物參數(如,炎性標記物)。
圖19是可被用來評估DRI評分、IR評分或STR評分中的一個或多個隨時間推移的變化的示例圖,其可基於根據本發明的實施方案的療法的劑量或類型或與其相關。
GlycA水平可經NMR以可通過乘以17.8轉化為甲基濃度單位(umol/L)的"任意單位"測量。
現在參考圖21,可以設想,在一些特定的實施方案中,STR、IR和/或DRI評分的測量的大多數(如果不是全部的話)可根據或使用與或至少部分地與如關於例如下圖22和/或美國專利號8,013,602中所述的NMR臨床分析儀22開機通信的系統10進行,所述專利的內容通過引用結合到本文中,好象在此全面敘述一樣。
系統10可包括TR、IR和/或DRI糖尿病風險指數(如,評分)模塊370,以收集適合於確定風險評分(如,HDL亞群、GlycA、纈氨酸)的一個或全部組成成分的數據。系統10可包括分析線路20,其包括至少一個能夠為分析儀22聯機或至少部分地從分析儀22遠程遙控的處理器20p。如果是後者,模塊370和/或線路20可以在伺服器150上完全或部分地駐留。伺服器150可使用包括應要求經由計算機網絡提供計算資源的雲計算來提供。資源可以體現為各種基礎設施服務(如 計算機、存儲等)以及應用程式、資料庫、文件服務、電子郵件等。在傳統的計算模式中,數據和軟體二者通常完全包含在用戶的計算機上;在雲計算中,用戶的計算機可包含極少的軟體或數據(或許是作業系統和/或網絡瀏覽器),並可起著幾乎不超過在外部計算機網絡上發生的處理過程的顯示終端的功能。雲計算服務(或多個雲資源的聚合)一般可稱為"雲"。雲存儲可包括一個網絡化的計算機數據存儲的模型,其中數據存儲在多個虛擬伺服器上,而不是被託管在一個或多個專用伺服器上。數據傳輸可被加密且可使用任何適當的防火牆以符合行業或監管標準例如HIPAA,通過網際網路進行。術語"HIPAA"指由Health Insurance Portability and Accountability Act限定的美國法律。患者數據可包括登錄號或標識符、性別、年齡和測試數據。
分析的結果可以經由計算機網絡,例如網際網路,通過電子郵件等傳輸給患者、臨床醫師網站50 (其可包括電子顯示屏50D)、傳輸給健康保障機構52或藥房51和/或患者53。結果可從分析網站直接發送或可被間接發送。結果可以列印出來並經由傳統郵件發送。這種信息也可傳輸給藥房和/或醫療保險公司,或甚至給患者,其監測可導致不利事件風險增加的處方或藥物使用或設置醫療警報以防止衝突藥物的處方。結果可經由電子郵件發送給患者的"家庭"計算機或一個普適計算設備例如智慧型手機或筆記本等。結果可作為例如總體報告的電子郵件附件或作為一個文本消息警示。
仍參考圖21,與不同的用戶,例如臨床醫師網站50、患者52D和/或試驗或實驗室網站60連接的一個或多個電子裝置50D、51D、53D、60D可被配置為訪問與各自的電子裝置的顯示屏通信的電子分析線路155。分析線路155可以在伺服器150上託管並可提供一個網際網路入口或可下載的APP或用於各種裝置的其它電腦程式。線路155可被配置為允許用戶,例如臨床醫師進入以下的一個或多個:(i) 患者的葡萄糖值,(ii) 患者的葡萄糖值和糖尿病風險指數評分,或(iii) 糖尿病風險指數評分。線路可以基於患者的標識符或其它密碼登錄(sign-in)自動填充不同的數據場或允許用戶進入對各患者的STR、IR或DRI評分的一個或多個和葡萄糖測量。分析線路可被配置為跟蹤STR、IR和/或DRI評分隨時間推移的變化並生成能夠發送給臨床醫師、患者或其它用戶的電子報告。分析線路也可發送推薦複試、後續試驗等的通知,例如,如果STR、IR或DRI風險評分升高或在低風險值以上,如在中度風險分類中,線路可通知臨床醫師,葡萄糖試驗可能是適宜的或發送通知給患者,與醫生商量,看葡萄糖檢測是否合適或後續的DRI試驗的增加的監測時間間隔是否可能是合乎需要的。
分析線路155和/或20能夠生成風險進展路徑或分析,以提供對具有相同葡萄糖值(當葡萄糖值處於中度風險範圍,當空腹血糖水平在90-110 mg/dL之間,A1C %水平在5.7-6.4之間或口服葡萄糖耐量水平在140-199 mg/dL之間)的患者在未來發展2型糖尿病的風險分級的圖形信息。電子分析線路可以是在雲中或其它可通過網際網路227訪問的聯機伺服器150或可與不同的客戶體系架構聯繫,如將為本領域技術人員理解的。因此,臨床醫師、患者或其它用戶能夠生成定製的關於風險進展的報告或另外獲得風險分級信息。
現在參考圖22,說明對各自的生物樣品採集至少一個NMR譜的系統207。系統 207包括用於獲得對樣品NMR測量的NMR數據的NMR分光計 22s和/或分析儀22。在一個實施方案中,配置分光計 22s以便在約400 MHz處對質子信號進行NMR信號採集;在其它實施方案中,測量可在約200MHz-約900 MHz之間或其它合適的頻率下進行。也可使用對應於期望的操作磁場強度的其它頻率。通常,安裝作為溫度控制器的質子流探頭,以維持樣品溫度在47 +/- 0.5攝氏度。分光計 22s可用數字計算機214或其它信號處理單元控制。計算機211應該能夠進行快速的傅立葉變換。它也可包括到另一個處理器或計算機213的數據連接 212和可連接到一個硬存儲單元215和/或遠程伺服器150的直接內存訪問存取通道214 (圖15)。
數字計算機211也可包括一組模擬數字轉換器、數字到模擬轉換器和慢設備I/O埠,所述埠通過脈衝控制和接口線路216連接至分光計的工作元件。這些元件包括RF發射機217,其產生由數字計算機211指示的RF激勵脈衝的持續時間、頻率和幅度,和RF功率放大器218,後者放大脈衝並將其耦合到圍繞樣品單元220和/或流動探針220p的RF發射線圈219。在由超導磁體 221產生的9.4 Tesla極化磁場的存在下,由激勵樣品產生的NMR信號被線圈222接收並應用到RF接收器223。放大和濾過的NMR信號在224被解調並將所得的正交信號應用於接口線路216,在那裡它們通過數字計算機211被數位化並輸入。糖尿病風險評估模塊 370或分析線路20或155 (圖21)可位於與數字計算機211連接的一個或多個處理器中和/或在可現場或遠程,通過一個全球範圍內的網絡,如網際網路227可訪問的輔助計算機213或其它計算機。
在從測量單元220中的樣品獲得NMR數據後,通過計算機211的處理產生另一個可(如果需要)存儲在存儲器 215中的文件。這種第二文件是數字表示的化學位移譜,並且它隨後被讀取到計算機213供存儲在其存儲器 225或與一個或多個伺服器連接的資料庫中。在存儲在其內存中的程序的指導下,計算機213,其可以是個人,筆記本電腦,臺式機,工作站,筆記本、平板電腦或其它計算機,按照本發明的教義處理化學位移譜以生成可輸出到印表機226或電子存儲的報告並中繼到想要的電子郵件地址或URL。本領域技術人員將認識到,也可使用其它輸出裝置,例如計算機顯示屏,筆記本,智慧型手機等,以顯示結果。
本領域技術人員應該意識到,由計算機213及其分開的存儲器 225進行的功能也可結合到由分光計的數字計算機211執行的功能中。在這樣的情況下,印表機226可直接連接至數字計算機211。其它接口和輸出設備也可以使用,如為本領域技術人員熟知的。
本發明的實施方案可採取完全的軟體實施方案或合併軟體和硬體方面的實施方案的形式,所有這些在本文通常被稱為"線路"或"模塊"。
如本領域技術人員將能理解的,本發明可體現為裝置、方法、數據或信號處理系統,或電腦程式產品。因此,本發明可採取完全的軟體實施方案,或合併軟體和硬體方面的實施方案的形式。此外,某些本發明的實施方案可採取在具有在介質中體現的計算機-可用程序代碼意義的計算機-可用存儲介質上的電腦程式產品的形式。可使用任何合適的計算機可讀介質,包括硬碟、CD-ROMs、光存儲裝置,或磁性存儲裝置。
計算機-可用或計算機-可讀介質可以是,但不限於,電子、磁性、光學、電磁、紅外,或半導體系統、設備、裝置,或傳輸介質。計算機-可讀介質的更具體的實例(非-窮舉列表)將包括以下:具有一個或多個電線的電氣連接、可攜式計算機的軟盤、隨機存取存儲器(RAM)、只讀存儲器(ROM)、可擦可編程只讀存儲器(EPROM或快閃記憶體)、光纖,和可攜式加密光碟只讀存儲器(CD-ROM)。注意到計算機-可用或計算機-可讀介質甚至可以是紙張或另一個合適的介質,該程序被列印在該介質上,因為該程序可以通過例如光學掃描紙張或其它介質被電子俘獲,然後編譯、解釋或以適當的方式另外處理(如果必要),然後存儲在計算機內存中。
進行本發明的操作的電腦程式編碼可以用一種面向對象的程式語言例如Java7、Smalltalk、Python、Labview、C++,或VisualBasic編寫。然而,用於進行本發明的操作的電腦程式編碼也可用傳統的程序程式語言,例如"C"程式語言或甚至彙編語言編寫。程序代碼可以完全在用戶的計算機上,部分在用戶的計算機上,作為單置的軟體包,部分在用戶的計算機上和部分在遠程計算機或完全在遠程計算機上執行。在後一種情況下,遠程計算機可通過區域網(LAN)或廣域網(WAN)或安全區域網絡(SAN)連接到用戶的計算機,或可連接至外部計算機(例如,通過使用網際網路服務供應商的網際網路)。
本文的某些圖的流程圖和框圖說明根據本發明的分析模型和評估系統和/或程序的體系機構、功能和可能實現的操作。在這一點上,流程圖或框圖中的每個方塊表示一個模塊、節段、操作,或部分代碼,其包含一個或多個可執行的實施指定邏輯函數的說明指令。還應該注意到,在一些備選的實施中,在方塊中註明的功能可能不以圖中註明的順序發生。例如,連續顯示的2個區塊事實上可能是同時執行的或方塊可能有時會以相反的次序執行,這取決於所涉及的功能。
圖23是數據處理系統305的示例性實施方案的框圖,其說明根據本發明的實施方案的系統、方法,和電腦程式產品。處理器 310通過地址/數據總線348與存儲器314通信。處理器 310可以是任何商業上可獲得的或自定義的微處理器。儲存器314表示內存設備的整體層次結構,其包含用來執行數據處理系統305的功能的軟體和數據。儲存器314可包括,但不限於,以下類型的裝置:cache、ROM、PROM、EPROM、EEPROM、快閃記憶體、SRAM,和DRAM。
如在圖23中所示,儲存器314可包括幾類用於數據處理系統 305的軟體和數據:作業系統 352;應用程式354;輸入/輸出(I/O)設備驅動器358;STR、IR和/或DRI風險評分模塊 370和數據 356。模塊 370可考慮定義的多標記物STR的定義的代謝物和脂蛋白參數和IR參數的水平,其可包括在限定的時間表,例如,下一個5年或具有糖尿病前期的可能性,在發展2型糖尿病的風險的多參數數學模型中,對GlycA、脂蛋白組分和纈氨酸並且還任選地對葡萄糖的測量。
數據 356可包括脂蛋白和代謝物參數362的信號(成分和/或複合光譜線形)或測量數據,其可從數據或信號採集系統 320獲得。如可被本領域技術人員理解的,作業系統 352可以是適合使用以下數據處理系統的任何作業系統:例如得自International Business Machines Corporation, Armonk, Armonk, NY的OS/2、AIX或OS/390,得自Microsoft Corporation, Redmond, WA的WindowsCE、WindowsNT、Windows95、Windows98、Windows2000或WindowsXP,得自Palm, Inc.的PalmOS,得自Apple Computer的MacOS,UNIX、FreeBSD或Linux,專有作業系統或專用作業系統,例如,嵌入式數據處理系統。
I/O設備驅動器358 通常包括通過作業系統 352經應用程式354訪問的常規軟體,以與裝置例如I/O數據埠、數據存儲 356和某些儲存器314元件和/或分析儀22通信。應用程式354是實施數據處理系統 305的各種特徵並可包括至少一種應用的示例性程序,其支持根據本發明的實施方案的操作。最後,數據 356代表由應用程式354、作業系統 352、I/O設備驅動器358和可駐存在儲存器314中的其它軟體程序使用的靜態和動態數據。
雖然,例如參考圖23中的為一種應用程式的模塊 370說明了本發明,如本領域技術人員將能理解的,其它配置也可採用,同時仍可從本發明的講述中受益。例如,模塊 370也可結合到作業系統 352、I/O設備驅動器358或數據處理系統 305的其它這樣的邏輯分割中。因此,本發明不應視為限制於圖23中的配置,其意欲涵蓋任何能夠進行本文所述操作的配置。
圖24是能夠進行本發明的實施方案的示例性操作的流程圖。在一些實施方案中,炎性標記物是NMR衍生的GlycA,其可使用與塊500、502、515、520和任選的503、412和522相關的行動。然而,根據一些實施方案,當採用其它炎性標記物時,該方法可僅包括塊423、524、525和526。
如果GlycA是炎性標記物,該方法可包括獲得(測量的)生物樣品(如,血漿或血清)的擬合區域的NMR譜的複合包跡線NMR譜(塊500)。NMR複合信號包跡線使用具有HDL、LDL和VLDL/Chylos組分和與至少GlycA峰區有關的多個曲線擬合(如,Lorentzian)函數定義的模型在電子上去卷積,所述峰區集中在與GlycA (塊502)有關的定義的化學位移位置(如,2.00 ppm)。可合計與GlycA有關的峰區的曲線擬合函數的定義的數量(塊515)。轉化因子可被應用於合計函數以生成GlycA (塊520)的計算的測量。
所述方法可包括提供STR風險因子評分以鑑定潛在的β-細胞功能障礙和/或損傷或β-細胞狀態的變化(塊523)。狀態的變化可以例如是與療法,例如藥物療法有關的改善或進一步損傷。
所述方法可包括提供與胰島素抵抗有關的IR風險評分和通常在5-7年內轉化或進展為2型糖尿病的風險(塊524)。
所述方法可包括合併IR和STR評分(塊525)和基於合併的IR和STR評分作為DRI評分鑑定患者是否面臨發展2型糖尿病的風險和/或具有糖尿病前期(塊526)。IR評分可加權以具有相對於其未-加權評分的增加的值,以提供對DRI評分相對於STR評分的更大的輸入或可在長期評估中天然具有更為優勢的評分。
STR和IR評分可使用與定義的脂蛋白和代謝物參數的定義係數有關的定義的風險模型生成,以生成STR和IR評分,所述評分生成在1-10之間的範圍的DRI評分。
任選地,DRI和/或GlycA評分可在患者和/或臨床試驗報告中提供(塊522)。
定義的GlycA去卷積模型可包括密度大於約1.21g/L的蛋白質信號組分,其可自信號複合包跡線中去卷積/分離(塊503)。
前述是本發明的示例性說明並不視為限制本發明。雖然已經描述本發明的幾個示例性實施方案,本領域技術人員將容易地理解,許多修飾在實質上不背離本發明的新的講述和優點的情況下,在示例性實施方案中是可能的。因此,所有這樣的修飾意欲包括在如在權利要求書中限定的本發明範圍內。在權利要求書中,方法-加-功能條款,當使用時,意欲覆蓋本文描述為執行所述功能的結構且不僅僅是結構等價物,而且還有等同結構。因此,要理解,前述是本發明的示例性說明,並不視為限制於公開的具體實施方案,而對公開的實施方案,以及其它實施方案的修飾意欲包括在所附權利要求書的範圍內。本發明由以下的權利要求書限定,權利要求書的等同物被包括在其中。
