多肽探針、包含該探針的試劑盒及其應用的製作方法
2023-10-09 19:48:44 2
本發明涉及生物醫療領域,具體而言,涉及一種多肽探針、包含該探針的試劑盒及其應用。
背景技術:
細胞凋亡是一種由基因控制的細胞主動死亡過程,對多細胞生物個體的發育、正常細胞更新、組織保持正常結構與功能有著積極而重要的意義,異常細胞凋亡則會導致腫瘤、神經退行性疾病等疾病的發生。細胞凋亡的實施是由一系列半胱氨酸蛋白酶所引發的級聯反應來實現的(Cold Spring Harb.Perspect.Biol.,2013,5(4):a008656),在半胱氨酸蛋白酶家族中,半胱氨酸蛋白酶-3屬於效應型凋亡酶,激活的半胱氨酸蛋白酶-3可降解一系列底物,包括凋亡抑制物、細胞外基質與骨架蛋白以及DNA修復相關因子,使細胞生化以及形態學發生改變,導致細胞凋亡(Oncogene,2008,27(48):6194-6206)。半胱氨酸蛋白酶-3是細胞凋亡執行階段的關鍵蛋白酶,因此可以通過測定半胱氨酸蛋白酶-3的活性來測定細胞凋亡過程。
雙砷染料-四半胱氨酸標籤體系是一種具有廣闊應用前景的活細胞蛋白螢光標記方法(Science,1998,281(5374):269-272)。在該系統中,四半胱氨酸標籤是一個包含四個半胱氨酸殘基的六肽或十二肽(Nat.biotechnol.,2005,23(10):1308-1314),半胱氨酸殘基兩兩結合在一起,形成半胱氨酸-半胱氨酸二聯子,這兩個二聯子被脯氨酸-甘氨酸二聯子分隔開來。四半胱氨酸標籤對雙砷染料具有較高的特異性和親和力。雙砷染料在被1,2-乙二硫醇螯合的情況下不發螢光,但是一旦與四半胱氨酸標籤結合就會發出很強的螢光。除了以線性方式存在外,四半胱氨酸標籤中的兩個半胱氨酸-半胱氨酸二聯子還可以被分離開來,但是它們在空間上必須相臨近(Nat.Chem.Biol.,2007,3(12):779-784)。在該標記系統中,四半胱氨酸標籤的空間構象會對所形成雙砷染料-四半胱氨酸標籤複合物的穩定性和量子產率產生極大的影響(J.Am.Chem.Soc.,2002,124(21):6063-6076)。
半胱氨酸蛋白酶-3通常以無活性的酶原存在細胞中,需要被上遊的激活型凋亡酶切割而得以活化。激活的半胱氨酸蛋白酶-3可以特異性切割天冬氨酸-穀氨酸-纈氨酸-天冬氨酸四肽序列,根據這一特性,一系列基於天冬氨酸-穀氨酸-纈氨酸-天冬氨酸的探針被開發出來用於測定半胱氨酸蛋白酶-3的活性,對應的方法有螢光檢測法、電化學法、比色法、表面等離子體共振法、生物發光法、電致化學發光法。隨著納米技術的發展,一些基於納米材料的多肽探針如量子點複合多肽探針、納米金複合多肽探針、石墨烯複合多肽探針也被開發出來用於測定半胱氨酸蛋白酶-3的活性(Chem.rev.,2015,115(22):12546-12629)。此外,一些基於螢光共振能量轉移反應的蛋白探針以及螢光開關(Nat.Commun.,2013;,4:2157)也被開發出來用於測定細胞內半胱氨酸蛋白酶-3的活性。在這些方法中,螢光標記會在一定程度上降低半胱氨酸蛋白酶-3對底物的切割效率,製備納米傳感器則使得檢測過程變得複雜和低效。因此迫切需要發展簡單、靈敏、高效的方法來測定細胞內半胱氨酸蛋白酶-3活性從而來檢測細胞凋亡過程。此外,本領域在檢測其它酶的活性時也或多或少的存在上述問題,且缺乏一種高效的可針對各種酶的活性進行檢測的技術。
有鑑於此,特提出本發明。
技術實現要素:
在本發明中,我們充分利用雙砷染料-四半胱氨酸標籤複合物的穩定性和量子產率極度依賴於四半胱氨酸標籤空間構象這一特性,設計了一種新型無標記多肽分子探針,進而發展了一種簡單、靈敏測定酶活性的方法。
在描述本發明的化合物、組合物、蛋白質、肽等以及方法之前,應當理解,這些實施方式不限於所描述的特定方法、方案以及試劑,這是因為它們可以變化。還應當理解,本文所使用的術語僅用於描述特定實施方式目的,並且不旨在限制本實施方式或權利要求的範圍。
為了實現本發明的上述目的,特採用以下技術方案:
一種多肽探針,所述多肽探針選自下列物質及其二聚體的組合物:
X1-Y1-CC;
其中,X1為具有二聚化能力的多肽;
Y1選自待檢測酶的酶切位點序列。
其中,X1段形成的二聚體可自發形成,也可在其它輔助蛋白或輔助條件下形成(例如X1段某些胺基酸殘基被修飾或肽段處於疏水環境中),優選的,所述二聚體為自發形成。
該探針包含有至少三個不同的功能區域,CC即兩個半胱氨酸,是與雙砷染料結合的部位,用來讀取待檢測酶的活性。在沒有被待檢測酶切割的時候,多肽探針之間的(自發)二聚化會使得兩個半胱氨酸-半胱氨酸二聯子在空間上相互接近,從而能與雙砷染料結合發出較強的螢光;相反,待檢測酶的酶解作用會將半胱氨酸-半胱氨酸二聯子從多肽中解離下來,雖然被切割的多肽依然能夠二聚,但卻缺少了錨定雙砷染料的部位,雙砷染料因而不能發光。因此,通過測定切割前後螢光的變化,可以定量測定待檢測酶的活性。
通過更改Y1段多肽的序列,理論上本發明提供的探針可對所有具有切割肽段能力的酶的活性進行檢測。
優選的,如上所述的多肽探針,所述X1的全部或部分胺基酸序列選自D構型胺基酸。
由於在生物進化過程中,胺基酸自然選擇為L型,生物體內的酶無法識別並切割D構型胺基酸。此設計可防止X1區段被其它蛋白酶非特異性切割,也能有效延長本發明提供的多肽探針的半衰期。
X1區段中D構型和L構型的胺基酸可交叉排列,例如一個D構型一個L構型交替相接,也可以起到上述作用;最優選的,X1的胺基酸序列全部選自D構型胺基酸。
優選的,如上所述的多肽探針,所述X1為亮氨酸拉鏈,或包含亮氨酸拉鏈結構的多肽。
亮氨酸拉鏈是一種作為二聚體化結構域的超二級結構,且使相互平行的α-螺旋之間產生粘附力。一個亮氨酸拉鏈包含了多個亮氨酸殘基,通常每七個胺基酸殘基就出現一次,這形成了一條兩性的α-螺旋,疏水區只在其中一側。這個疏水區提供了二聚化的區域,使得基序可以像「拉鏈」一樣拉起來。
除此之外,根據本發明提供的技術內容的啟示,X1段多肽可根據生物中常見的蛋白二聚體中負責二聚化的蛋白區段進行設計,例如受體酪氨酸激酶、某些核受體蛋白、14-3-3蛋白、驅動蛋白、Factor XI、Factor XIII、Toll樣受體、纖維原蛋白、G蛋白的βγ亞基二聚體等等,這對本領域技術人員是容易的。亮氨酸拉鏈僅作為最優選的技術方案。
優選的,X1段多肽可選自下述胺基酸序列:
QLEDKVEELLSKNYHLENEVARLKKLVG;
KLEALEGKLEAEGKGKLEAUGICLEALE;
GEIAALKQEIAALKKENAALKWEIAALKQGYY;
ASIARLEEKVKTLKAQNYELASTANMLREQVAQLGAP;
ASAAELEERVKTLKAEIYELQSEANMLREQIAQLGAP;
ASAAELEERVKTLKAEIYELQSEANMLREQGAP;
ASAAELEERVKTLKAEIYELQSEGAP;
ESKVSSLESKVSSLESKVSSLESKVSSLESKVSSLESKVSS。
更優選的,上述胺基酸序列均為D構型胺基酸。
優選的,如上所述的多肽探針,所述多肽探針的N端進行了乙醯化修飾;
和/或;
所述多肽探針的C端進行了醯胺化修飾。
多肽探針兩端的修飾可起到增加探針的穩定性的作用。
優選的,如上所述的多肽探針,所述X1與所述Y1之間還包括Linker1和/或所述Y1與所述CC之間還包括Linker2;
優選的,所述Linker1的胺基酸數目為1~30個,更優選為1~5個;
優選的,所述Linker2的胺基酸數目為1~30個,更優選為1~5個。
Linker1及Linker2的胺基酸數量可以是1,2,3,4,5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30個。
Linker1及Linker2的序列也可以選自(GGGGS)n、(GGGS)n、(GGS)n或Gn,其中n可以是1,2,3,4,5或6。
優選的,如上所述的多肽探針,所述Y1的序列為DEVD。
DEVD為半胱氨酸蛋白酶-3(Caspase3)及半胱氨酸蛋白酶-7(Caspase7)的酶切位點。
優選的,如上所述的多肽探針,所述X1的胺基酸序列為D構型的asaaeleervktlkaeiyelrskanmlreqiaqlgap。
此序列為D構型的亮氨酸拉鏈結構。
優選的,如上所述的多肽探針,所述Linker2的胺基酸序列為G。
一種多肽探針,用於檢測Caspase3或Caspase7的酶活性,其序列為asaaeleervktlkaeiyelrskanmlreqiaqlgapDEVDGCC;其中asaaeleervktlkaeiyelrskanmlreqiaqlgap為D構型的胺基酸。
優選的,asaaeleervktlkaeiyelrskanmlreqiaqlgapDEVDGCC的N端和C端分別進行了乙醯化和醯胺化修飾。
一種診斷試劑盒,其包括如上所述的多肽探針、雙砷染料、待檢測酶切割所述多肽探針得到酶切產物時所用的緩衝液1以及所述雙砷染料對所述酶切產物進行標記時所用的緩衝液2;
優選的,所述緩衝液1為含有用於避免二硫鍵出現的還原劑,更優選的,所述還原劑選自二硫蘇糖醇和/或三(2-羰基乙基)磷鹽酸鹽;
優選的,所述緩衝液2為含有用於避免單個所述CC片段與所述雙砷染料的結合的洗脫劑,更優選的,所述洗脫劑選自2,3-二巰基-1-丙醇和/或1,2-乙二硫醇。
優選的,如上所述的診斷試劑盒,所述雙砷染料選自ReAsH-EDT2、FlAsH-EDT2、F2FlAsH或F4FlAsH中的一種或多種。
優選的,如上所述的診斷試劑盒,當所述還原劑選自二硫蘇糖醇時,所述還原劑的濃度為0.5~2mM。
優選的,如上所述的診斷試劑盒,當所述洗脫劑選自2,3-二巰基-1-丙醇時,所述洗脫劑的濃度為0.03~0.10mM。
如上所述的多肽探針或如上所述的診斷試劑盒在檢測Y1所對應的酶的活性中的應用;
優選的,所述檢測在細胞裂解液中或在體細胞中進行;
更優選的,所述細胞選自HeLa細胞、NIH/3T3細胞、C6細胞、MCF7細胞、人HCE細胞、Jurkat T細胞、Huh-7細胞、DU145細胞、U-937細胞以及HepG2細胞中的任一種。
如上所述的多肽探針或如上所述診斷試劑盒在檢測單個細胞中特定酶的活性中的應用。
如上所述的多肽探針或如上所述診斷試劑盒在檢測半胱氨酸蛋白酶-3和/或半胱氨酸蛋白酶-7活性中的應用。
如上所述的多肽探針或如上所述診斷試劑盒在檢測細胞凋亡中的應用。
優選的,所述細胞凋亡可為自然發生的細胞程序性死亡、疾病造成的細胞凋亡或環境造成的細胞凋亡,例如紫外照射、雙氧水、地塞米松、腫瘤壞死因子等所誘導的細胞凋亡的測定。
如上所述的多肽探針或如上所述診斷試劑盒在製備和/或評價用於治療細胞凋亡相關疾病的藥物中的應用;
優選的,如上所述的應用,所述細胞凋亡相關疾病為腫瘤、自體免疫性疾病或神經退行性疾病;
更優選的,如上所述的應用,所述腫瘤包括:白血病、淋巴瘤、頭頸部鱗狀細胞癌、肺癌、食道癌、肝癌、結直腸癌、乳腺癌、卵巢癌、宮頸癌、腎細胞癌和黑色素瘤;
更優選的,如上所述的應用,所述自體免疫性疾病包括:系統性紅斑性狼瘡、自身免疫性淋巴細胞增生症候群、類風溼性關節炎、甲狀腺炎;
更優選的,如上所述的應用,所述神經退行性疾病包括:阿茲海默氏症、亨丁頓舞蹈症、帕金森病、中風和肌肉萎縮性側索硬化症。
一種診斷細胞凋亡相關疾病的方法,包括:
將待診斷主體的細胞裂解液或組織裂解液與如上所述的多肽探針,或如上所述診斷試劑盒中的成分進行接觸,根據反應所得信號值對所述主體進行診斷。
優選的,如上所述的診斷細胞凋亡相關疾病的方法,所述信號值為所述多肽探針與雙砷染料反應產生的螢光信號值。
優選的,如上所述的診斷細胞凋亡相關疾病的方法,所述主體為動物,更優選為哺乳動物,更優選為靈長類動物,更優選為人。
優選的,如上所述的診斷細胞凋亡相關疾病的方法,所述細胞凋亡相關疾病為腫瘤、自體免疫性疾病或神經退行性疾病;
更優選的,所述腫瘤包括:白血病、淋巴瘤、頭頸部鱗狀細胞癌、肺癌、食道癌、肝癌、結直腸癌、乳腺癌、卵巢癌、宮頸癌、腎細胞癌和黑色素瘤;
更優選的,所述自體免疫性疾病包括:系統性紅斑性狼瘡、自身免疫性淋巴細胞增生症候群、類風溼性關節炎、甲狀腺炎;
更優選的,所述神經退化性疾病包括:阿茲海默氏症、亨丁頓舞蹈症、帕金森病、中風和肌肉萎縮性側索硬化症。
與現有技術相比,本發明的有益效果為:
1)、多肽分子探針沒有任何標記,與待檢測酶之間具有較好的生物相容性,可提高切割效率;
2)、在本發明所提供試劑盒的整個檢測反應過程中,沒有分離和清洗步驟,操作簡單和方便;
3)、檢測模式具有靈活性,探針可以被具有不同激發和發射波長的雙砷染料所標記,因而有多種方式來測定細胞凋亡水平;
4)、本發明特定提供的用於測定Caspase3及Caspase7的多肽探針由胺基酸構成,將編碼多肽探針的DNA轉入細胞內,可以測定單個細胞的凋亡情況。
附圖說明
為了更清楚地說明本發明具體實施方式或現有技術中的技術方案,下面將對具體實施方式或現有技術描述中所需要使用的附圖作簡單地介紹,顯而易見地,下面描述中的附圖是本發明的一些實施方式,對於本領域普通技術人員來講,在不付出創造性勞動的前提下,還可以根據這些附圖獲得其它的附圖。
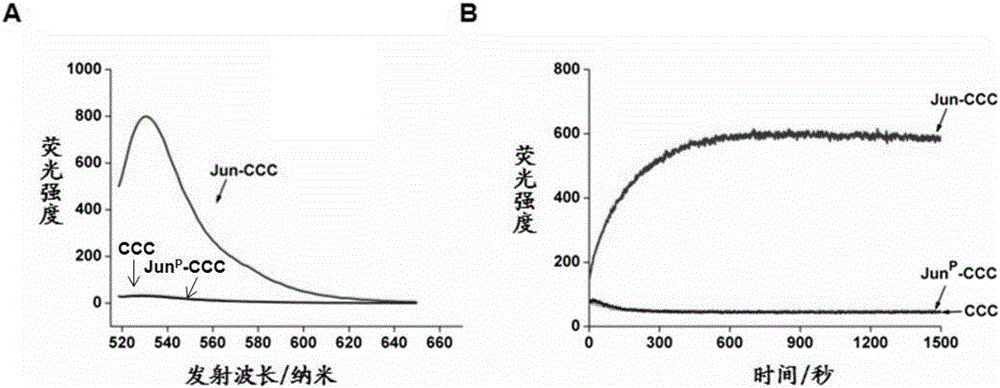
圖1為新型無標記多肽分子探針的性能測定;(A)多肽探針與雙砷染料FlAsH-EDT2結合所形成複合物的發射光譜;(B)多肽探針與雙砷染料FlAsH-EDT2的結合動力學測定;
圖2為利用新型探針定量測定體外重組半胱氨酸蛋白酶-3;(A)半胱氨酸蛋白酶-3對多肽探針的切割會降低多肽探針-雙砷染料複合物的螢光強度;位於上方的曲線代表的是Jun-CCC,位於下方的曲線代表的是Jun-CCC+半胱氨酸蛋白酶-3;(B)對圖A的定量分析;(C)多肽探針特異性測定半胱氨酸蛋白酶-3的活性;(D)半胱氨酸蛋白酶-3切割導致螢光強度的減少(ΔF)與半胱氨酸蛋白酶-3濃度之間的關係圖;
圖3為利用新型探針測定星孢菌素誘導RAW264.7細胞的凋亡;(A)星孢菌素誘導RAW264.7細胞凋亡的免疫印跡分析;(B)多肽探針測定星孢菌素誘導RAW264.7細胞的凋亡;(C)Ac-DEVD-CHO抑制細胞內半胱氨酸蛋白酶-3活性的免疫印跡分析;(D)Ac-DEVD-CHO抑制凋亡細胞內半胱氨酸蛋白酶-3活性的螢光分析。
具體實施方式
除非另有限定,本發明使用的所有技術和科學術語具有與所公開的實施方案所屬領域的普通技術人員通常理解的相同的含義。雖然與本發明所述的方法和材料類似或等同的方法和材料可用於本實施方式的實踐或測試中,但下文仍然描述了合適的方法和材料。本發明提及的所有出版物、專利申請、專利以及其他參考文獻通過引用全部內容結合於本文中。在衝突的情況下,本說明書(包括定義)將起支配作用。此外,材料、方法以及實施例僅僅是說明性的,而不旨在限制。實施方式的其它特徵和優點將從以下詳細的說明書和權利要求中變得明顯。
為了促進理解本文描述的實施方式這一目的,將參考某些實施方式,並且將使用特定語言來描述這些實施方式。本文所使用的術語僅用於描述具體實施方式目的,而不旨在限制本公開的範圍。
下面將結合實施例對本發明的實施方案進行詳細描述,但是本領域技術人員將會理解,下列實施例僅用於說明本發明,而不應視為限制本發明的範圍。實施例中未註明具體條件者,按照常規條件或製造商建議的條件進行。所用試劑或儀器未註明生產廠商者,均為可以通過市售購買獲得的常規產品。
在本發明的實施例中,以用於測定Caspase3的探針為例,來說明本發明探針的效果。該實施例的技術方案包括新型無標記多肽分子探針的設計、新型探針的性能測定、新型探針定量測定體外重組半胱氨酸蛋白酶-3、新型探針對凋亡細胞的測定四個方面。
實施例
1.新型無標記多肽分子探針的設計
所設計的多肽分子探針命名為Jun-CCC,其序列為asaaeleervktlkaeiyelrskanmlreqiaqlgapDEVDGCC,探針的N端和C端分別進行了乙醯化和醯胺化修飾來增加探針的穩定性。該探針包含有三個不同的功能區域,其中asaaeleervktlkaeiyelrskanmlreqiaqlgap是二聚化功能區,為防止多肽探針被其它蛋白酶非特異性切割,該區域全部由D-型胺基酸構成;DEVD是半胱氨酸蛋白酶-3的特異性切割序列,由L-型胺基酸構成;其後的胺基酸G為linker,用以增加CC與雙砷染料反應的靈活性;CC是與雙砷染料結合的部位,用來讀取半胱氨酸蛋白酶-3的活性。在沒有被半胱氨酸蛋白酶-3切割的時候,多肽探針之間的自二聚化會使得兩個半胱氨酸-半胱氨酸二聯子在空間上相互接近,從而能與雙砷染料結合發出較強的螢光;相反,半胱氨酸蛋白酶-3的酶解作用會將半胱氨酸-半胱氨酸二聯子從多肽中解離下來,雖然被切割的多肽依然能夠二聚,但卻缺少了錨定雙砷染料的部位,雙砷染料因而不能發光。因此,通過測定切割前後螢光的變化,可以定量測定半胱氨酸蛋白酶-3的活性,進而測定細胞凋亡過程。
2.新型探針的性能測定
為表明雙砷染料與探針的結合依賴於探針之間的二聚化作用,我們同時設計了兩條沒有二聚化能力的探針JunP-CCC和CCC,其中JunP-CCC的序列為asaaepeervktpkaeiyeprskanmpreqiaqpgapDEVDGCC,CCC的序列為GCC,JunP-CCC是將Jun-CCC中二聚化區域中的亮氨酸殘基全部突變為脯氨酸殘基來喪失其二聚化功能,CCC是通過缺失Jun-CCC中的二聚化功能區使之不能二聚化。另外,兩個多肽的N端和C端分別進行了乙醯化修飾和醯胺化修飾。我們測定了Jun-CCC、JunP-CCC以及CCC與雙砷染料之間的結合能力。如圖1A所示,Jun-CCC可以與雙砷染料結合,產生很強的螢光信號,相反,缺少二聚化能力的JunP-CCC和CCC則只能產生一些背景螢光信號,這表明是二聚化的探針而不是單個探針與雙砷染料相結合。並且,Jun-CCC探針與雙砷染料之間的結合是十分迅速的,約十分鐘左右的時間就可以達到最大螢光強度(圖1B);此外,Jun-CCC探針與雙砷染料之間的結合是比較穩定的(測定的平衡解離常數為3.17±0.39微摩爾每升)。
3.新型探針對體外重組半胱氨酸蛋白酶-3的定量測定
為了測定探針Jun-CCC能否被半胱氨酸蛋白酶-3所切割,我們添加0.1微升1毫摩爾每升的Jun-CCC以及0.2微升半胱氨酸蛋白酶-3到10微升的切割緩衝液(25mM HEPES,100mM NaCl,1mM EDTA,10%sucrose,0.1%CHAPS,1mM DTT,pH=7.4)中,並在37度孵育一小時。該混合物隨後加入到40微升包含有1微摩爾每升FlAsH-EDT2的雙砷染料標記緩衝液(100mM Tris·Cl,75mM NaCl,1mM EDTA,1mM DTT,0.05mM BAL,pH=7.4)中,並在室溫避光孵育30分鐘。我們測定了酶解前後的螢光水平(圖2A)。半胱氨酸蛋白酶-3的切割會導致Jun-CCC-雙砷染料複合物的螢光強度下降30倍(圖2B)。進一步,我們測定該探針能否特異性測定半胱氨酸蛋白酶-3的活性,我們在相同的反應體系中測定了胰蛋白酶、凝血酶、類泛素蛋白酶1對Jun-CCC的切割作用,從圖2C中我們可以看到,胰蛋白酶、凝血酶、類泛素蛋白酶1不能切割Jun-CCC,因此,探針Jun-CCC可以特異性測定半胱氨酸蛋白酶-3的活性。進一步,我們將Jun-CCC探針與不同濃度半胱氨酸蛋白酶-3相孵育,並測定每種濃度半胱氨酸蛋白酶-3所導致螢光的下降ΔF,ΔF與半胱氨酸蛋白酶-3濃度之間的關係如圖2D所示,計算出的最低檢測限為0.128納克每毫升,優於現有大部分檢測方法。
4.新型探針對凋亡細胞的測定
進一步,我們利用探針Jun-CCC來測定星孢菌素誘導的細胞凋亡。我們採用RAW264.7細胞作為研究模型,並利用1微摩爾每升的星孢菌素來誘導RAW264.7細胞的凋亡,同時將沒有經過任何處理的細胞作為對照組。細胞的凋亡同時採用免疫印跡法以及基於探針Jun-CCC的螢光法來測定。加入星孢菌素可明顯看到半胱氨酸蛋白酶-3大亞基的出現(圖3A),表明細胞內半胱氨酸蛋白酶-3被成功激活。與免疫印跡結果相一致的是,星孢菌素處理過的細胞中其螢光信號要弱於對照組(圖3B)。並且,星孢菌素誘導RAW264.7細胞的凋亡是時間依賴的,隨著誘導時間的增加,會出現更多的半胱氨酸蛋白酶-3大亞基以及更弱的螢光信號。為進一步驗證螢光較少是由於激活半胱氨酸蛋白酶-3對探針Jun-CCC的切割所導致的,我們加入了半胱氨酸蛋白酶-3特異性抑制劑Ac-DEVD-CHO來抑制細胞內半胱氨酸蛋白酶-3的活性。如圖3C和3D所示,加入Ac-DEVD-CHO並不會改變半胱氨酸蛋白酶-3的蛋白量,但是卻會導致螢光恢復,表明螢光的減少是由於半胱氨酸蛋白酶-3對探針Jun-CCC的切割引起的。因此,探針Jun-CCC是可以有效測定細胞凋亡的。
最後應說明的是:以上各實施例僅用以說明本發明的技術方案,而非對其限制;儘管參照前述各實施例對本發明進行了詳細的說明,但本領域的普通技術人員應當理解:其依然可以對前述各實施例所記載的技術方案進行修改,或者對其中部分或者全部技術特徵進行等同替換;而這些修改或者替換,並不使相應技術方案的本質脫離本發明各實施例技術方案的範圍。
