用於示蹤免疫細胞的試劑盒及方法與流程
2024-03-30 14:48:05 2
本發明屬於生物醫藥領域,具體涉及用於示蹤免疫細胞的試劑盒、以及示蹤方法。
背景技術:
基於免疫手段治療慢性疾病和腫瘤是近年來快速發展的領域,其中特異性免疫細胞的數量和功能改善能有效控制許多慢性感染和癌症的進展,為徹底治癒創造機會和條件。免疫細胞研究是醫學和生物學實驗研究領域中的重要部分;然而,已有的臨床研究提示,免疫細胞治療還沒有達到預期的療效,主要原因是免疫細胞進入體內的變化情況以及到達靶器官的數量和需要的時間尚未明確,理論上認為,足夠免疫細胞到達靶器官及其病灶是免疫細胞抗擊感染和腫瘤的關鍵,因此,在臨床研究前迫切需要進一步的基礎研究,明確修飾後的細胞回輸進入體內的走向以及靶器官的歸巢現狀,為進一步的臨床試驗提供理論依據。
大量的基礎和臨床實踐證實,活化免疫細胞進入體內的途徑有以下的方式:(1)體表淋巴結注射,免疫細胞可以通過淋巴循環進入特定組織和器官,但是淋巴結注射的細胞數量有限,同時通過淋巴結如何到達靶器官尚不能明確;(2)直接在特定靶器官的注入,該方法可以保證免疫細胞相對集中在特定的組織;但該方法複雜,一般需要手術,有創傷性;(3)向聯繫靶器官的深部血管注射,該方法也可保證足量的免疫細胞通過大血管進入特定器官的,但也有創傷,如大血管穿刺插管等複雜操作;(4)外周靜脈內注射,操作簡單,注入免疫細胞數量可控,但通過循環進入體內的免疫細胞可流至全身的各個器官,容易被某些網狀內皮系統吞噬、滯留,無法估計到達靶器官的數量。因此,需要尋找一種簡單、高效的免疫細胞示蹤技術,通過現有的成像系統可以清楚觀察外源免疫細胞注入後的路徑和走向以及到達靶器官的時間和數量,有助於優化最初外周靜脈給予的細胞數量。
技術實現要素:
本發明的目的在於針對以上要解決的技術問題,提供一種能夠清楚觀察免疫細胞在體內的走向、歸巢的試劑盒。
本發明的另一目的在於提供能夠清楚觀察免疫細胞在體內的走向、歸巢的方法。
為此,本發明提供了如下技術方案:
一種用於示蹤免疫細胞的試劑盒,其包括:klh(keyholelimpethemocyanin,鑰孔血藍蛋白)和人白蛋白。
本發明還提供了一種免疫細胞示蹤方法,其包括以下步驟:(1)用klh標記免疫細胞,klh使用劑量為5-15ug/ml;(2)將標記好的免疫細胞在37℃、5%(體積濃度)co2培養箱中孵育24-48小時;(3)洗滌後配製成細胞製劑,細胞濃度為2×106-1×107/ml,注入外周血循環;(4)利用ct影像學在48小時內,不同時間點觀察細胞的走向;(5)獲得免疫細胞最終歸巢所需的時間、定位的器官部位和數量。
作為一種優選的實施方式,所述免疫細胞可以是天然免疫的nk細胞、t細胞、b細胞、樹突狀細胞(dc細胞),可以來源於外周血、骨髓、臟器等;不同種類的免疫細胞具有特定的標記。以外周血來源的dc細胞為例,與dc細胞表面標誌性抗原的特異性抗體cd11、cd86、cd83與dc細胞孵育,進行流式細胞技術鑑定dc細胞為成熟的免疫細胞,保存在dc細胞培養液中,所述dc細胞培養液成分為:aim培養基中,含有gm-csf750-1000iu/ml和il-41000-2000iu/ml。
作為一種優選的實施方式,用klh標記免疫細胞包括:上述dc細胞溶液中加入klh至klh濃度為5-15ug/ml,最優選為10ug/ml,於37℃、5%(體積濃度)co2培養箱中孵育24-48小時。
作為一種優選的實施方式,配製細胞製劑包括:配置溶液:0.9%(質量濃度)生理鹽水中加入終濃度為0.5%(質量濃度)的人白蛋白,洗滌klh標記dc細胞兩至三次後,以上述dc細胞溶液配製注射用的dc細胞製劑,細胞濃度為2×106-1×107/ml,配製成10mldc細胞在體內走向示蹤:從外周靜脈注射步驟中獲得的10mldc細胞製劑,在以下時間點進行ct影像學觀察:0小時、4小時、24小時、48小時,根據klh在體內臟器的顯色時間和顯色大小,確定dc細胞從外周血進入體內的蹤跡。
dc細胞體內臟器歸巢包括:根據klh最終聚集在體內某臟器所需時間和顯色大小,確定dc細胞從外周血進入體內的最終歸巢的器官及器官內的部位,並確定其在歸巢部位中停留的時間。
實驗結果表明,應用本發明的試劑盒和方法,可以清楚地觀察到免疫細胞在體外和體內的走向、歸巢。
附圖說明
圖1是dc細胞成熟前後的表面特定標誌示意圖。
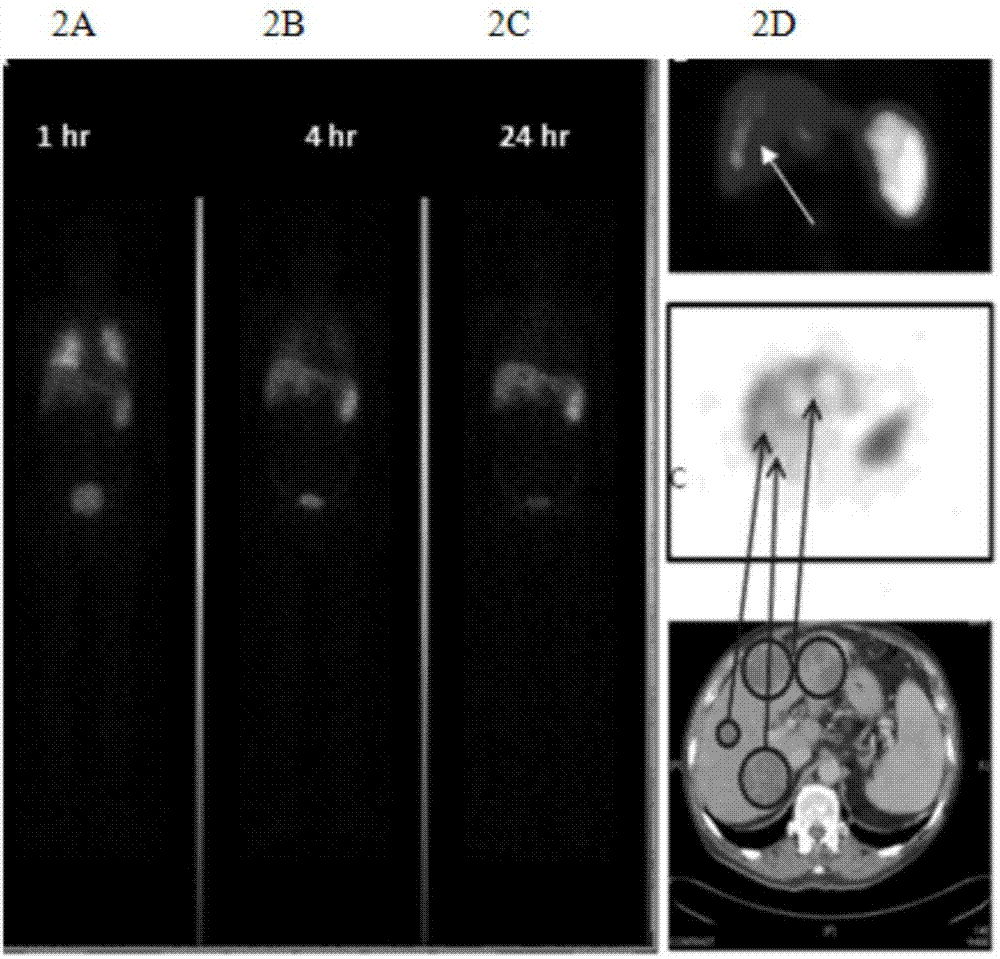
圖2示出了外周靜脈輸注dc細胞後在體內的走向、定位、富集情況。
圖3示出了外周靜脈注射的免疫細胞的數量變化情況。
圖4示出了t細胞的表型鑑定情況。
圖5示出了t細胞在動物體內的數量和功能比較。
具體實施方式
下面結合具體實施例和附圖對本發明的技術方案作進一步的詳述,但並不對本發明的保護範圍構成限制。
實例1:免疫細胞在人體內的示蹤
本實例以自體免疫細胞從外周靜脈注射後,觀察免疫細胞在體內走向和歸巢的路徑以及達到靶器官的時間和數量。實施步驟如下:
(1)獲得外周血單個核細胞(pbmc),並誘導培養成熟為dc細胞:
取10ml外周血,常規方法獲得pbmc,使用免疫磁珠(從clinmacs公司購得)富集cd14+單核細胞,在dc誘導培養液中培養(培養液成份:常規培養基aim,加入gm-csf750-1000iu/ml和il-41000-2000iu/ml)5天,終濃度為2×106-1×107細胞/ml。
(2)鑑定免疫細胞表型標記:
利用hla-dr–alexafluor700、cd11c-apc(bdbiosciences)、cd141-pe、cd86-pe、cd83-cy5.5與上述步驟(1)獲得的成熟dc孵育,並進行流式細胞儀檢測,鑑定dc的成熟度。結果如圖1和下表1所示。
圖1是dc細胞成熟前後的表面特定標誌示意圖。其中,流式細胞技術鑑定dc細胞表面帶有hla-dr、cd11c、cd83特異性標記。
表1:外周血獲得的dc表面攜帶的特異性抗原標記的數量和比率
(3)製備具有示蹤作用的注射用的dc細胞製劑:
採用臨床級別的klh對dc細胞進行示蹤標記,步驟如下:在濃度為2x106細胞/ml的dc溶液中,加入klh,使其中濃度為5-15ug/ml(10ug/ml最佳),於37℃,在5%(體積濃度)co2培養箱中孵育24-48小時,收集細胞,重懸於注射用溶液(0.9%(質量濃度)生理鹽水+0.5%(質量濃度)人血白蛋白)中,並以該溶液反覆洗滌兩至三次,最後溶於10ml注射用溶液,得到細胞濃度為2×106-1x107細胞/ml,示蹤細胞為:dc-klh。
(4)dc-klh體內示蹤:
從外周靜脈中緩慢注射上述dc-klh,5分鐘內注射完畢;利用ct成像系統進行觀察:如圖2所示,圖2a顯示,dc-klh注射後1小時,可見雙肺klh顯色,表明dc-klh細胞外周靜脈注射後1小時即到達肺部;圖2b顯示,dc-klh注射後4小時,肺部顯色消失,脾臟和肝臟顯色,提示免疫細胞已經移至脾臟和肝臟;dc-klh注射後24小時,脾臟顯色減少,肝臟顯色增強;同時免疫細胞主要積聚在肝內病灶區域,提示dc成功歸巢,其顯色是肺部顯色的80%-85%,提示,靜脈注射的免疫細胞在歸巢過程中,大約15-20%被代謝。圖2c顯示,注射後第24小時,dc-klh在脾臟顯影消失,而肝臟的顯影越來越清晰;圖2d顯示,注射後第48小時,免疫細胞在肝臟病灶區持續顯影,表明細胞仍然在病灶中高表達。提示,通過外周血進行免疫細胞輸注,非常簡便易行,並且能順利到達靶器官(圖3)。如圖3所示,為外周靜脈注射的免疫細胞的數量變化。根據klh顯色的範圍,計算注射後第0小時、1小時、4小時、24小時、48小時免疫細胞數量,與注射後1小時到達肺部的顯色範圍比較,4小時、24小時、48小時細胞數量分別為90%、85%、70%。可見,與注射前(0小時)相比,注射後1、4、24、48小時,免疫細胞數量有輕微降低,到24小時的目的靶器官,數量為注射前的85%,提示,靜脈注入的免疫細胞基本都可以達到效應器官。
實例2:t細胞的示蹤與歸巢
本實施例以肝損傷大鼠模型的肝臟作為靶器官,本實施例中的t細胞來自人體(其獲得符合倫理道德的要求),步驟如下:
(1)擴增培養人外周血t細胞:
從自願者外周血活動pbmc,使用免疫磁珠(從clinmacs公司購得)富集cd3+t細胞,在t細胞培養液中擴增培養(培養液成份:常規培養基aim,加入okt30.5-2ug/ml、抗cd280.5-2ug/ml、il-2100-300iu/ml)2天,終濃度為2x106-1x107細胞/ml。
(2)鑑定免疫細胞表型和功能標記:
利用鑑定t細胞表型和功能的抗體cd3-q605、cd4-q665、cd8-v500、ifn-r-v450、tnf-a-pe-cy7(從bdbiosciences購置)與上述步驟(1)獲得的t細胞孵育,並進行流式細胞儀檢測,鑑定t細胞表型和功能(圖4)。圖4顯示了t細胞的表型鑑定,從pbmc中成功獲得t細胞及其兩個主要亞型:cd+t細胞和cd8+t細胞。
(3)製備具有示蹤作用的注射用的t細胞製劑:
採用臨床級別的klh對t細胞進行示蹤標記,步驟如下:在濃度為2x106細胞/ml的t細胞溶液中,加入klh,使其中濃度為5-15ug/ml,在5%co2培養箱中孵育24-48小時,收集細胞,重懸於注射用溶液(0.9%生理鹽水+0.5%人血白蛋白)中,並以該溶液反覆洗滌三次,最後溶於10ml注射用溶液,細胞濃度為2x106-1x107細胞/ml,示蹤細胞為:t-klh。
(4)t-klh體內示蹤:從兩個途徑注入大鼠體內,觀察t細胞在體內的走向、歸巢和定位。
途徑一:從大鼠外周靜脈中緩慢注射上述t-klh,5分鐘內注射完畢;利用ct成像系統進行觀察:t-klh注射後10分鐘,可見雙肺klh顯色;t-klh注射後1小時,肺部顯色消失,脾臟和肝臟顯色;t-klh注射後4小時,脾臟顯色減少,肝臟顯色增強;同時免疫細胞主要積聚在肝內病灶區域,提示t細胞成功歸巢,其顯色是肺部顯色的85%-95%,提示,靜脈注射的免疫細胞在歸巢過程中,大約10-15%被代謝。提示,通過外周血進行免疫細胞輸注,非常簡便易行,並且能順利到達靶器官。
途徑二:利用介入手術,從大鼠肝動脈直接注射t細胞,可見細胞通過動脈進入病灶區域,並歸巢至肝細胞。
(5)免疫細胞歸巢後功能鑑定:
斷頸處死上述大鼠,取出肝臟,常規分離肝內淋巴細胞,獲得標記有klh的t細胞,進行t-klh細胞頻數和功能檢測,由圖5可見,其中,上圖:t細胞分泌ifn-γ功能比較,方式1(外周靜脈注射)比方式2(通過介入手術肝動脈插管注入)略有下降,但仍保持較高水平(注射前水平的>85%)。中間圖:t細胞分泌tnf-α功能比較,方式1(外周靜脈注射)比方式2(通過介入手術肝動脈插管注入)略有下降,但仍保持較高水平(注射前水平的>80%)。下圖:t細胞數量的變化:t細胞分泌ifn-γ功能比較,方式1(外周靜脈注射)比方式2(通過介入手術肝動脈插管注入)略有下降,但仍保持較高水平(注射前水平的>85%)。結果提示:(a)外源注射的t-klh細胞仍然保持良好功能,t細胞表面分泌較高的細胞因子水平,與體外檢測水平無差異;(b)外源注射的t-klh細胞在肝內定位後,細胞數量較低於注射量:經外周靜脈注入的細胞,達到肝臟病灶數量有所減少,為注射前的75-85%;經肝動脈插管直接進入肝臟病灶的細胞數量有所減少,為注射前的85-90%;(c)通過靜脈注射的t-klh細胞數量低於肝動脈插管注射的細胞數量,但功能無差異(圖5)。
