一種縮短同源臂長度的枯草芽孢桿菌基因組編輯方法與流程
2024-04-15 01:04:05 1
1.本發明涉及基因工程技術領域,尤其涉及一種縮短同源臂長度的枯草芽孢桿菌基因組編輯方法。
背景技術:
2.枯草芽孢桿菌(bacillus subtilis)是革蘭氏陽性模型微生物,具有遺傳背景清晰、遺傳操作簡單、易培養、不易汙染噬菌體、不含內毒素和分泌蛋白能力強等諸多優勢。同時,其被美國食品和藥物管理局(fda)認可為安全(gras)食品級微生物。但是,相比於大腸桿菌遺傳轉化操作所需的50bp長度的同源臂,枯草芽孢桿菌常用同源臂長度為500-1500bp,這大大增加了整合框構建的難度。若將同源臂長度降低至50bp,則可將同源臂直接使用引物引入,降低整合框構建難度。但目前並未有相關報導,因此,亟需開發針對枯草芽孢桿菌的縮短同源臂的高效同源重組方法。
技術實現要素:
3.為解決上述技術問題,本發明提供了一種縮短同源臂長度的枯草芽孢桿菌基因組編輯方法,是通過提前在基因組整合表達dna結合蛋白和dna退火蛋白,並使用iptg誘導型啟動子進行誘導,再結合枯草芽孢桿菌高效轉化方法實現。
4.本發明的第一個目的是提供一種縮短同源臂長度的枯草芽孢桿菌基因組編輯方法,包括以下步驟:
5.將單鏈dna結合蛋白和dna退火蛋白整合至枯草芽孢桿菌基因組中,所述單鏈dna結合蛋白的胺基酸序列如seq id no.1所示,所述dna退火蛋白的胺基酸序列如seq id no.2所示。
6.具體地,seq id no.1序列為:
7.masrgvnkvilvgnlgqdpevrympnggavanitlatseswrdkatgemkeqtewhrvvlfgklaevaseylrkgsqvyiegqlrtrkwtdqsgqdryttevvvnvggtmqmlggrqgggapaggnigggqpqggwgqpqqpqggnqfsggaqsrpqqsapaapsneppmdfdddipf;
8.seq id no.2序列為:
9.mnqivkftddsglavqvtpddvrryicenatekevglflqlcqtqrlnpfvkdaylvkyggapasmitsyqvfnrracrdanydgiksgvvvlrdgdvvhkrgaacykkageeliggwaevrfkdgretayaevalddystgksnwakmpgvmiekcakaaawrlafpdtfqgmyaaeemdqaqqpeqvraqaeqpvdlqpirelfkpycehfgitpaegmtavcgavgaegmhsmteqqarrarawmeeemaapaveaeyevvdegevf。
10.進一步地,所述單鏈dna結合蛋白和dna退火蛋白由異丙基-β-d-硫代半乳糖苷誘導表達。
11.本發明的第二個目的是提供一種dna結合蛋白和dna退火蛋白表達盒,所述表達盒中包括來源於大腸桿菌的單鏈dna結合蛋白以及來源於放線菌噬菌體的dna退火蛋白;其中,所述來源於大腸桿菌的單鏈dna結合蛋白的胺基酸序列如seq id no.1所示,所述來源
於放線菌噬菌體的dna退火蛋白的胺基酸序列如seq id no.2所示。
12.進一步地,所述dna結合蛋白和dna退火蛋白表達盒中還包括位於單鏈dna結合蛋白和dna退火蛋白上遊的iptg誘導表達框。
13.進一步地,所述iptg誘導表達框包括iptg誘導型啟動子和阻遏蛋白laci。該表達盒由異丙基-β-d-硫代半乳糖苷誘導表達,即由異丙基-β-d-硫代半乳糖苷誘導表達為由iptg誘導型啟動子和iptg誘導型啟動子阻遏蛋白laci調控表達。
14.進一步地,所述iptg誘導型啟動子的核苷酸序列如seq id no.3所示。
15.進一步地,所述阻遏蛋白laci的核苷酸序列如seq id no.4所示。
16.本發明的第三個目的是提供一種高效同源重組的重組枯草芽孢桿菌,所述重組枯草芽孢桿菌以枯草芽孢桿菌為出發菌,整合了上述dna結合蛋白和dna退火蛋白表達盒。
17.進一步地,所述重組枯草芽孢桿菌的構建方法包括以下步驟:將comk蛋白整合至枯草芽孢桿菌中,將該重組菌株製備成感受態細胞後,整合上述dna結合蛋白和dna退火蛋白表達盒,得到所述重組枯草芽孢桿菌。
18.進一步地,編碼所述comk蛋白的基因的核苷酸序列如seq id no.9所示。具體序列如下:
19.atgagtcagaaaacagacgcacctttagaatcgtatgaagtgaacggcgcaacaattgccgtgctgccaga
20.agaaatagacggcaaaatctgttccaaaattattgaaaaagattgcgtgttttatgtaaacatgaagccgctgcaaatt
21.gtcgacagaagctgccgattttttggatcaagctatgcgggaagaaaagcaggaacttatgaagtgacaaaaatttc
22.acacaagccgccgatcatggtggacccttcgaaccaaatctttttattccctacactttcttcgacaagaccccaatgc
23.ggctggatttcccatgtgcatgtaaaagaattcaaagcgactgaattcgacgatacggaagtgacgttttccaatggg
24.aaaacgatggagctgccgatctcttataattcgttcgagaaccaggtataccgaacagcgtggctcagaaccaaatt
25.ccaagacagaatcgaccaccgcgtgccgaaaagacaggaatttatgctgtacccgaaagaagagcggacgaaga
26.tgatttatgattttattttgcgtgagctcggggaacggtattag
27.進一步地,所述comk蛋白通過誘導型啟動子調控表達,所述誘導型啟動子可為任何適用於宿主的啟動子,如本發明中使用的是木糖誘導啟動子,通過木糖誘導型啟動子p
xyla
調控表達,所述枯草芽孢桿菌宿主基因組上使用木糖誘導型啟動子p
xyla
在基因組上過表達一個額外拷貝的comk基因。
28.進一步地,所述木糖誘導型啟動子p
xyla
的核苷酸序列如seq id no.10所示。具體序列如下:
29.tttttttactaaagcttgatctgcaatttgaataataaccactcctttgtttatccaccgaactaagttggtgttttttg
30.aagcttgaattagatatttaaaagtatcatatctaatattataactaaattttctaaaaaaaacattg
aaataaacatttatttt
31.gtatatgatgagataaagttagtttattggataaacaaactaactcaattaagatagttgatggataaacttgttcacttaa
32.atcaaagggggaaatgacaaatggtccaaactagtgatatctaaaaatcaaagggggaaatgttaaagga
33.ggaaggatcc。
34.進一步地,所述木糖誘導型啟動子表達comk蛋白的表達框序列如seq id no.5所示。
35.進一步地,製備成感受態細胞的步驟包括:將整合了comk蛋白的重組枯草芽孢桿菌活化,並接種於pab培養基中進行培養,獲得種子液,將種子液接種於新的pab培養基中進行培養,向其中加入木糖,誘導形成枯草芽孢桿菌感受態細胞。本發明中枯草芽孢桿菌dna轉化方法是一種極為簡易高效的方式,主要是採用pab豐富培養基,通過添加木糖誘導實現高效的dna轉化與基因編輯。
36.進一步地,pab培養基的組成為:蛋白腖15-25g/l,酵母粉1-10g/l,牛肉膏1-10g/l,nacl 10-20g/l,kh2po
4 10-20g/l,k2hpo
4 1-10g/l。發明人曾嘗試過lb培養基、yn培養基、tb培養基、dm3g培養基、bf培養基等培養基,發現轉化效率均遠低於pab培養基。
37.進一步地,上述轉化方法是通過在菌株對數生長期前期添加3%木糖以實現菌株感受態的誘導。
38.進一步地,所述枯草芽孢桿菌包括但不限於枯草芽孢桿菌wb 600。
39.本發明的第四個目的是提供上述重組枯草芽孢桿菌或dna結合蛋白和dna退火蛋白表達盒在食品、生物領域中的應用。
40.藉由上述方案,本發明至少具有以下優點:
41.本發明通過開發一種簡易高效且僅需短同源臂的重組枯草芽孢桿菌轉化方法,使得同源臂最小縮短至35bp,可直接使用引物引入同源臂,並可實現高效枯草芽孢桿菌基因組整合文庫的構建。
42.上述說明僅是本發明技術方案的概述,為了能夠更清楚了解本發明的技術手段,並可依照說明書的內容予以實施,以下以本發明的較佳實施例並配合詳細附圖說明如後。
附圖說明
43.為了使本發明的內容更容易被清楚的理解,下面根據本發明的具體實施例並結合附圖,對本發明作進一步詳細的說明。
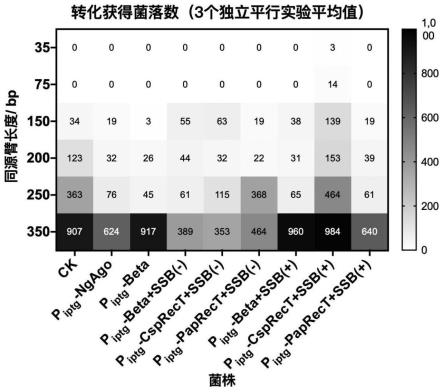
44.圖1為使用iptg誘導型啟動子表達dna結合蛋白和不同來源dna退火蛋白時平板上獲得的平均轉化子數目,其中,
「‑」
為未誘導,「+」為誘導。
具體實施方式
45.下面結合附圖和具體實施例對本發明作進一步說明,以使本領域的技術人員可以更好地理解本發明並能予以實施,但所舉實施例不作為對本發明的限定。
46.下述實施例中所涉及的材料與方法如下:
47.1、選擇的dna結合蛋白為大腸桿菌來源(核苷酸序列如seq id no.1所示);
48.2、不同來源dna退火蛋白包括:
49.(1)來源于格雷戈裡納特羅菌(natronobacterium gregoryi)的argonaute蛋白(ngago,核苷酸序列如seq id no.6所示);
50.(2)來源於大腸桿菌λ噬菌體的beta蛋白(核苷酸序列如seq id no.7所示);
51.(3)來源於銅綠假單胞菌噬菌體(pseudomonas aeruginosa phage)的paprect蛋白(核苷酸序列如seq id no.8所示);
52.(4)來源於放線菌噬菌體(collinsella stercoris phage)的csprect蛋白(核苷酸序列如seq id no.2所示)。
53.3、重組枯草芽孢桿菌的種子培養及發酵:
54.枯草芽孢桿菌為bacillus subtilis wb600。
55.pab培養基的組成(g/l):蛋白腖20,酵母粉6,牛肉膏6,nacl 14,kh2po
4 14.8,k2hpo
4 5.2。定容後ph調至6.5,115℃高壓蒸汽滅菌20min。
56.感受態細胞的製備:將於-80℃保藏的重組枯草芽孢桿菌劃線接種於lb培養基平板上,37℃,12h。挑取單菌落到每孔裝有1ml pab培養基的24孔板中,37℃、220rpm培養6~8h獲得種子液,將種子液以20%的接種量接種到新的pab培養基中,並以6%的比例向種子液中加入50g/l的木糖,同時加入終濃度為0.5mm的iptg,於37℃、220rpm條件下培養2h,誘導形成感受態細胞。向感受態細胞中加入終濃度15%的甘油凍存至-80℃。
57.轉化:取100μl感受態細胞至已加入同源重組片段的1.5ml ep管中,混勻,於37℃、220rpm條件下培養1.5h,全部塗布相應的篩選平板。
58.實施例1同源重組框
59.構建方法如下:
60.(1)合成seq id no.9所示的帶有350bp同源臂序列的卡納抗性基因整合框;
61.(2)以其為模板,
62.使用引物35-f:5
』‑
cgattgaaacagaagatcacgctgctgctgaataa-3』與引物35-r:5
』‑
gggtttccgcaaacagccaaactgaaagcatatag-3』擴增出帶有35bp同源臂的整合框1;
63.使用引物75-f:5
』‑
cataatatgacagaagaagaagtaaacgcaagac-3』與引物75-r:5
』‑
gtggtatcaaaatgggaaaaggccttcc-3』擴增出帶有75bp同源臂的整合框2;
64.使用引物150-f:5
』‑
gaaaatgagtataaatatatgcgcagctgcagc-3』與引物150-r:5
』‑
atcgcgggtgttgaccgcg-3』擴增出帶有150bp同源臂的整合框3;
65.使用引物200-f:5
』‑
atgtgaactgcgcaaatccatcttgc-3』與引物200-r:5
』‑
ttctggcgactgccaatgctgtagg-3』擴增出帶有200bp同源臂的整合框4;
66.使用引物250-f:5
』‑
gcatgtgattgtcggcaaggactac-3』與引物250-r:5
』‑
gatgaccagtaaaggcattgcagctg-3』擴增出帶有250bp同源臂的整合框5;
67.使用引物350-f:5
』‑
gctccagcttatatttatcggtttcttgtatc-3』與引物350-r:5
』‑
tcgtgacatacggaaaagatccagagg-3』擴增出帶有350bp同源臂的整合框6。
68.實施例2表達dna結合蛋白和不同來源dna退火蛋白的重組基因工程菌的構建
69.將基因組整合木糖誘導型啟動子p
xyla
表達comk蛋白(如seq id no.5所示)的重組菌株製備為感受態後,轉化含有表達dna結合蛋白和不同來源dna退火蛋白的dna片段,塗布抗性平板且測序後,獲得相應工程菌株。
70.實施例3誘導dna結合蛋白和不同來源dna退火蛋白表達後實現段同源臂高效轉化
71.將實施例2構建的重組枯草芽孢桿菌按照上述方式製備感受態後,將實施例1中獲得的同源重組框純化後,按照相同摩爾數比例添加並轉化(分別添加:35bp同源臂125ng,75bp同源臂133ng,150bp同源臂148ng,200bp同源臂158ng,250bp同源臂168ng,350bp同源臂188ng)。轉化結果如圖1所示(ck組為未轉入含有dna結合蛋白和dna退火蛋白整合框的枯草芽孢桿菌),結果顯示,當dna結合蛋白選擇大腸桿菌來源的單鏈dna結合蛋白,dna退火蛋白選擇來源于格雷戈裡納特羅菌的ngago蛋白、來源於大腸桿菌λ噬菌體的beta蛋白或來源於銅綠假單胞菌噬菌體的paprect蛋白時,在同源臂長度縮短至75bp與35bp時,未獲得任何獲得轉化子,且在所有情況下獲得的轉化子數量均低於誘導表達csprect與ssb的重組菌株。而添加iptg誘導csprect與ssb表達時,在所有同源臂長度下均可獲得最大轉化子數目,最大提升至不額外表達重組相關基因對照的4倍。同時,在同源臂長度縮短至75bp與35bp時,僅誘導表達csprect與ssb的重組菌株獲得轉化子。
72.顯然,上述實施例僅僅是為清楚地說明所作的舉例,並非對實施方式的限定。對於所屬領域的普通技術人員來說,在上述說明的基礎上還可以做出其它不同形式變化或變動。這裡無需也無法對所有的實施方式予以窮舉。而由此所引申出的顯而易見的變化或變動仍處於本發明創造的保護範圍之中。
