miR‑665‑3p抑制物在製備防治缺血再灌注損傷藥物中的應用的製作方法
2024-02-15 00:16:15
本發明涉及miR-665-3p抑制物的新用途,尤其是miR-665-3p抑制物在製備防治缺血再灌注損傷藥物中的應用。
背景技術:
缺血再灌注損傷是指組織缺血缺氧到達一定時間及程度後引起細胞發生病理變化,在恢復血液供應後,損傷的組織非但沒有恢復功能,反而出現進一步加重的病理現象。眾多文獻資料表明缺血再灌注損傷可能與以下若干因素有關:1. 氧自由基的生成;2. 鈣超載;3. 中性粒細胞(PMN)激活;4. 過度的細胞凋亡;5. 大量細胞因子和炎性介質的釋放。總之,缺血再灌注損傷是由各種機制相互影響,綜合作用的結果。
自噬是廣泛存在於真核生物中的一種溶酶體依賴的降解途徑,是細胞存活、生長和細胞內穩態平衡不可缺少的機制。自噬可以通過降解衰老、損傷細胞器和長半衰期蛋白維持細胞穩態,在應激環境下,適度激活自噬則可以通過再生代謝前體和清除亞細胞碎片維持細胞完整性,減輕細胞氧化應激損傷、細胞凋亡,減少炎症因子釋放,增強細胞抵抗外界刺激的能力。
微小RNA(microRNA, miRNA)是一類真核生物中RNA聚合酶轉錄的、具有帽子結構和多聚腺苷酸尾巴的非編碼型RNA,一般長度為22-24個核苷酸。成熟的miRNA可以和特定靶基因mRNA的3』UTR區域互補結合,從而誘導沉默複合體降解靶標mRNA或阻滯其翻譯過程,最終調控靶基因的表達。miRNA可調控生物體生長發育過程中的多個病理生理過程:細胞增殖、氧化應激、細胞凋亡等。雖然最近的研究表明miRNA在細胞自噬的多個不同階段起著精細的調控作用,但是,迄今為止還沒有關於miR-665-3p抑制物在製備預防或治療缺血再灌注損傷藥物中應用的相關報導。
技術實現要素:
本發明是發現了miR-665-3p抑制物具有預防和治療缺血再灌注損傷的作用,從而發明了miR-665-3p抑制物在製備防治缺血再灌注損傷藥物中的應用。
本發明的技術解決方案是:一種miR-665-3p抑制物在製備防治缺血再灌注損傷藥物中的應用。
所述miR-665-3p抑制物在製備防治腸道缺血再灌注損傷藥物中的應用。
所述miR-665-3p抑制物的DNA序列如SEQ ID NO:1或SEQ ID NO:3所示。
本發明證實了miR-665-3p抑制物可顯著提高腸道細胞對於缺血再灌注損傷的耐受性,減輕腸道缺血再灌注損傷的嚴重程度,表現為有效緩解了發病小鼠小腸絨毛的倒伏及脫落、毛細血管的擴張及裸露等現象; miR-665-3p抑制物可顯著抑制腸道損傷標記物腸型脂肪酸結合蛋白(I-FABP)及炎性細胞因子TNF-α和IL-6的過度釋放,同時miR-665-3p抑制物對於小鼠II/R損傷後24h生存率顯著高於對照組,可應用於製備防治缺血再灌注損傷藥物。
附圖說明
圖1是LNA-miR-665-3p治療後腸道組織病理圖。
圖2是LNA-miR-665-3p治療後血清相關細胞因子的變化。
圖3是LNA-miR-665-3p對小鼠II/R損傷後LC3蛋白表達的影響。
圖4是LNA-miR-665-3p對小鼠II/R後小腸細胞原位凋亡的影響。
圖5是LNA-miR-665-3p治療對於小鼠II/R損傷24h生存率的影響。
圖6是Antagomir-665-3p處理對於Caco-2細胞H/R損傷生存率的影響。
圖7是Antagomir-665-3p處理對於Caco-2細胞H/R損傷後自噬流的影響。
圖8是Antagomir-665-3p處理對於Caco-2細胞H/R損傷後凋亡的影響。
圖9是Antagomir-665-3p處理對於Caco-2細胞H/R損傷後炎性因子釋放的影響。
具體實施方式
下述實施例中所使用的試驗方法如無特殊說明,均為常規方法。
下述實施例中所使用的材料、試劑等,如無特殊說明,均可從商業途徑獲得。
本實驗中採用的miR-665-3p抑制物主要分為兩種:
1. 基於新型鎖核酸技術修飾的人工合成寡核苷酸序列(LNA),主要用於動物實驗。
LNA-665-3p序列如SEQ ID NO:1所示;
LNA-NC對照序列如SEQ ID NO:2所示;
LNA-miR-665-3p序列和LNA-NC對照序列均委託丹麥Exiqon生物公司合成。
2. 經過特殊標記與化學修飾的miRNA高效阻斷劑(Antagomir),主要用於細胞實驗。
Antagomir-665-3p序列如SEQ ID NO:3所示;
Antagomir-NC對照序列如SEQ ID NO:4所示:
Antagomir-665-3p序列和Antagomir-NC對照序列均委託上海吉瑪製藥技術有限公司合成。
實驗例1.LNA-miR-665-3p能夠有效治療缺血再灌注導致的小腸損傷
將24隻健康的C57BL/6J小鼠分為4組:
A.正常對照組:假手術組;
B.正常給藥組:假手術+LNA-miR-665-3p(2 mg/kg);
C.模型組:小腸缺血再灌注組(II/R組);
D.模型給藥組:II/R+LNA-miR-665-3p(2 mg/kg)。
本實驗採用Megision法構建小腸I/R動物模型,簡要步驟如下:小鼠常規麻醉,待麻醉生效後,仰臥位固定於小動物手術臺上,備皮後取上腹正中切口逐層入腹,輕柔分離腸繫膜上動脈(SMA),於SMA根部使用微型無創血管夾夾閉。此時觀察到SMA遠端搏動消失,小腸壁由粉紅色迅速轉變為蒼白色,確認SMA缺血構建成功,將小腸還納腹腔,逐層關腹。待缺血時間達到45 min,沿用原切口入腹,取下微型無創血管夾,開始進行再灌注。再灌注4 h結束後,行腹主動脈取血處死動物。正常對照組小鼠平行進行麻醉,開腹和SMA分離等步驟,但不進行SMA夾閉。各組小鼠在再灌注開始時後肢皮下注射生理鹽水12 ml/kg以補液。
使用無菌TE buffer溶解LNA-miR-665-3p,配製成10 mg/ml貯存液。術前12 h使用滅菌生理鹽水配製注射液,正常給藥組及模型給藥組通過鼠尾靜脈給藥(2 mg/kg),給藥負荷為0.1 ml。
1.1 小腸組織病理學
取小腸組織進行HE染色,於400倍光鏡下觀察。如圖1所示,正常對照組(A)及正常給藥組(B):小腸黏膜絨毛排列整齊,形態完整,上皮下間隙無擴張;模型組(C):小腸絨毛排列紊亂,頂端可見大量斷裂及脫落,上皮下間隙增寬,毛細血管淤血;模型給藥組(D):小腸絨毛脫落程度減輕,上皮與固有層輕度分離。實驗結果表明,LNA-miR-665-3p可顯著減輕缺血再灌注導致的小鼠小腸組織的損傷。
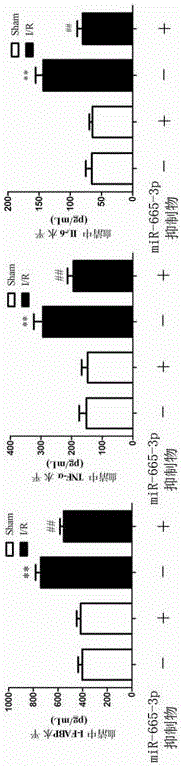
1.2 血清細胞因子的變化
採用酶聯免疫法(ELISA)分別測定血清中腸型脂肪酸結合蛋白(I-FABP)、腫瘤壞死因子(TNF-α)、白細胞介素6(IL-6)的含量,ELISA試劑盒購自上海朗頓公司,結果見圖2,** vs. Sham p<0.01,## vs. I/R p<0.01,n=6。
實驗結果表明,LNA-miR-665-3p可顯著減輕缺血再灌注導致的小腸細胞損傷及炎性因子的釋放。
1.3 小腸組織LC3蛋白表達的變化
採用Western Blot法測定小腸組織中LC3蛋白的表達水平,結果如圖3所示,** vs. Sham p<0.01,## vs. I/R p<0.01,n=6。與正常對照組相比,模型組中LC3-II/β-actin的比例顯著下調,而給予LNA-miR-665-3p後,該比例顯著上升,標誌著自噬水平的恢復。實驗結果表明,LNA-miR-665-3p可顯著上調小腸組織自噬水平。
1.4 小腸組織細胞凋亡的變化
採用TUNEL法檢測組織細胞的早期凋亡情況,結果見圖4。模型組較正常對照組TUNEL陽性細胞數顯著增多,斷裂的絨毛頂端可見顯著增強的綠色螢光信號;模型給藥組較模型組TUNEL陽性細胞數顯著減少,僅在絨毛頂端見少量綠色螢光信號。實驗結果表明LNA-miR-665-3p可顯著抑制小腸組織的細胞凋亡水平。
實驗例2. LNA-miR-665-3p顯著提高小鼠II/R損傷的生存率
將30隻健康的C57BL/6J小鼠分為2組:
A. miRNA對照組:II/R+LNA-NC(2 mg/kg);
B. LNA-miR-665-3p給藥組:II/R+LNA-miR-665-3p(2 mg/kg);
模型構建及給藥方法如例1中所述,再灌注24 h後結果見圖5,* vs. miRNA對照組 p<0.01,n=15。實驗結果表明miR-665-3p給藥組動物24小時生存率顯著高於miRNA對照組。
實驗例3.Antagomir-miR-665-3p顯著減輕缺氧復氧誘導的細胞損傷
缺氧復氧(Hypoxia/Reoxygenation,H/R)為體外常用細胞損傷模型,用於模擬體內I/R損傷。利用Caco-2細胞構建H/R損傷模型,分為4組:
A. 正常對照組:Control+Antagomir-NC(30nM);
B. 模型對照組:H/R+Antagomir-NC(30nM);
C. 正常給藥組:Control+Antagomir-665-3p(30nM);
D. 模型給藥組:H/R+Antagomir-665-3p(30nM)。
3.1 Antagomir-miR-665-3p顯著提高Caco-2細胞H/R損傷後的生存率
本實驗採用缺氧12h復氧6h構建模型,模型構建成功後,應用CCK-8法檢測各組細胞存活率,結果見圖6,** vs. Control組 p<0.01,## vs. H/R p<0.01,n=6。實驗結果表明,miR-665-3p抑制物可顯著提高細胞對H/R損傷的耐受性。
3.2 Antagomir-miR-665-3p顯著上調Caco-2細胞H/R損傷後的自噬流水平
採用mRFP-GFP-LC3自噬雙標腺病毒法檢測細胞中的自噬流水平,結果如圖7所示,與正常對照組相比,H/R組中自噬小體和自噬溶酶體的數目顯著下調,而給予Antagomir-miR-665-3p後,該數目均顯著上升,標誌著自噬流的激活。實驗結果表明,miR-665-3p抑制物可顯著激活Caco-2細胞H/R損傷後的自噬流水平。
3.3 Antagomir-miR-665-3p顯著減輕Caco-2細胞H/R損傷後的細胞凋亡
採用TUNEL法檢測細胞中的細胞凋亡水平,結果如圖8所示,與正常對照組相比,H/R組中TUNEL陽性細胞數目顯著上升,而給予Antagomir-miR-665-3p後,該數目顯著下調,標誌著細胞凋亡的減少。實驗結果表明,miR-665-3p抑制物可顯著抑制Caco-2細胞H/R損傷後的細胞凋亡水平。
3.4 Antagomir-miR-665-3p顯著減輕Caco-2細胞H/R損傷後的炎性因子釋放
採用酶聯免疫法(ELISA)分別測定細胞上清液中腫瘤壞死因子(TNF-α)、白細胞介素6(IL-6)的含量,ELISA試劑盒購自上海朗頓公司,結果見圖9。實驗結果表明,miR-665-3p抑制物可顯著減輕H/R導致的炎性因子釋放。
序列表
大連醫科大學附屬第二醫院
miR-665-3p抑制物在製備防治缺血再灌注損傷藥物中的應用
4
1
16
DNA
人工序列,LNA-665-3p
1
GACCTCAGCCTCCTGG
2
15
DNA
人工序列,LNA-NC
2
ACGTCTATACGCCCA 15
3
20
DNA
人工序列,Antagomir-665-3p
3
AGGGGCCUCAGCCUCCUGGU 20
4
21
DNA
人工序列,Antagomir-NC
4
CAGUACUUUUGUGUAGUACAA 21
