基於基因組改組的吩嗪‑1‑甲醯胺高產菌株的育種方法與流程
2024-04-05 16:13:05 3
本發明涉及生物工程技術領域,具體涉及一種基於基因組改組的吩嗪-1-甲醯胺高產菌株的育種方法。
背景技術:
吩嗪-1-甲醯胺(PCN)是一種有效的新型生物農藥,具有廣譜的抑制植物病原真菌的作用。綠針假單胞菌HT66(Pseudomonas chlororaphis HT66)CCTCCNO:M2013467是從水稻根際土壤中分離到一株產吩嗪-1-甲醯胺(PCN)的綠針假單胞菌,安全性很高,且PCN產量高達420mg/L,是國際上報導的吩嗪化合物產量最高的野生株。該菌分泌吩嗪化合物的能力很強,能夠將細胞內合成的吩嗪化合物快速運輸到胞外,在培養基中形成綠色晶體,不僅降低了代謝調控中的反饋抑制現象,具有高產PCN的巨大潛力,而且綠色晶體可以作為篩選指標,有利於PCN高產菌株的選育。
PCN具有良好的應用前景,對此開展高產菌株的選育,有利於其工業應用。目前,經過十輪的物理和化學方法誘變,PCN產量提高了很多;但是由於前期誘變引入的負突變較多,後期繼續以誘變育種的方法提高PCN產量的難度較大。
1998年Maxygen公司的Stemmer等人提出了一種新的分子育種方法——全基因組重排技術(genome shuffling),這種技術是分子定向進化在全基因組水平上的延伸,它將重組的對象從單個基因擴展到整個基因組,因此可以在更為廣泛的範圍內對菌種的目的性狀進行優化組合。
基因組重排的原理是,首先通過誘變育種得到一個含有各種不同正突變的基因組庫,然後通過原生質體的融合將這些正突變菌株的基因組進行隨機重組,並篩選目的性狀得到進一步改進的菌株來進行下一輪基因組重排,這樣可以快速、高效地選育出表型得到較大改進的雜交菌種。基因組重排技術提出後的短短幾年時間,在菌種改進方面已經取得了很突出的成果。
Zhang等[Zhang Y,Perry K,Vinci V,et al.Genome shuffling leads to rapid phenotypic improvement in bacteria,Nature,2002,415:644-646]通過基因組重排提高了弗氏鏈黴菌的泰樂菌素產量。實驗在經過一輪誘變和兩輪基因組重排篩選得到高產菌株,其生產能力與通過20輪連續誘變篩選得到的泰樂菌素高產菌株生產能力相同,這說明基因組重排在育種方面可以更加快速有效。
Hida等[Hida H,Yamada T,et al.Genome shuffling of Streptomyces sp U121for improved production of hydroxycitric acid.Applied Microbiology and Biotechnology,2007,73(6):1387-1393]利用基因組重排的方法改進了Streptomyces sp.U121生產HCA的能力,實驗中用亞硝基胍處理誘變來處理U121的孢子,得到突變株進行原生質體融合,三輪融合後篩選到高產融合子,其產量比野生型菌株提高5倍。
在國內,也有類似的通過基因組重排方法來進行菌種的育種從而提高產品產量,如梁惠儀[梁惠儀,郭勇.全基因組重排育種技術提高豆豉纖溶酶菌產酶量.中國生物工程雜誌,2007,27(10):39-43]等通過對DC-12進行紫外誘變和亞硝基胍誘變構建突變庫,以篩選到的4株誘變菌株作為融合親本,採用電融合的方法進行基因組重排,結合雙滅活的篩選方法,篩選出的菌株比親本菌株的酶活提高了4~5倍。
浙江大學朱惠等[朱惠,金志華,岑沛霖.納他黴素產生菌基因組重排育種.中國抗生素雜誌,2006,31(12):739-742]將Streptomyces gilvosporeus SG21原生質體經紫外線誘變並篩選鏈黴素抗性菌株,在高產突變株中選擇4株作為親本進行基因組重排育種,篩選得到了高產重組菌株,其產量比原始出發菌株提高1.17倍。
總之,在微生物育種方面,基因組重排有很多的應用研究,也有很大的應用潛力。基因組重排(Genome shuffling)技術是自2002年發展起來的一種新型的微生物育種方法,通過原生質體的遞歸融合使正向突變的表型快速聚集。在理論上這種方法相較於傳統誘變選育能夠更快速的改良菌株。然而,採用該技術用於吩嗪-1-甲醯胺高產菌株的育種尚未見有相關報導。此外,傳統的基因組改組方法需要預先對融合前的兩株親本進行分別標記,包括整合型標記、遺傳缺陷型標記、抗藥性標記等,然後根據標記篩選融合子,最後從融合子中篩選高產株,因此該方法的步驟繁瑣、工作難度較大,實施周期長,而且有些標記可能對染色體造成損害。本專利旨在優化融合條件,提高融合效率,以多株正突變株進行隨機融合,直接篩選高產株以縮短育種時間。
技術實現要素:
針對現有技術中的缺陷,本發明的目的在於提供一種基於基因組改組的吩嗪-1-甲醯胺高產菌株的育種方法。本發明的方法無需對誘變獲得的高產菌株進行標記,而且直接以高通量篩選的方法獲得高產PCN的融合子,大大提高了工作效率。
本發明的目的是通過以下技術方案實現的:
本發明提供了一種基於基因組改組的吩嗪-1-甲醯胺高產菌株的育種方法,包括以下步驟:
A、以綠針假單胞菌HT66為出發株,通過誘變處理獲得含有各種不同正突變的基因組庫,然後篩選出高PCN產量的若干株突變菌株;
B、將突變菌株進行原生質體製備、原生質體融合,篩選出高PCN產量的融合子。
優選地,步驟A中,所述誘變處理包括物理誘變和/或化學誘變。
優選地,步驟B中,所述原生質體製備包括以下步驟:所述原生質體製備具體採用以下步驟:將突變菌株重懸於SMM緩衝液中,添加溶菌酶、滲透壓穩定劑和螯合劑進行酶解,然後離心吸去溶液,用磷酸緩衝液清洗後重懸,得原生質體懸浮液。
優選地,所述溶菌酶的濃度為0.2mg/mL,滲透壓穩定劑為濃度0.5M甘露醇,螯合劑為濃度0.1%的EDTA;所述酶解時間為1h,突變菌株的菌齡為18h。所述EDTA的濃度為質量濃度,0.1g/100mL。
優選地,所述SMM緩衝液中含有以下濃度的各組分:蔗糖0.5mol/L,順丁烯二酸20mmol/L,六水合氯化鎂20mmol/L。
優選地,步驟B中,所述原生質體融合包括以下步驟:將突變株的原生質體懸浮液混合,離心,去上清液後,加入磷酸緩衝液,吹打原生質體沉澱重新懸浮;再加入PEG和DMSO,定溶後充分混勻,水浴中保溫靜置即可。
優選地,所述DMSO添加量為1%,所述PEG的濃度為35%,PEG分子量為8000。所述DMSO添加量為質量添加量,1g/100mL;PEG的濃度為質量濃度,35g/100mL。
優選地,所述原生質體懸浮液混合前,需將菌株分別置於70℃條件下處理15min或者750W的微波爐中低熱檔處理50s。
優選地,所述水浴溫度為32℃,所述保溫靜置時間為5分鐘。
優選地,步驟B中,所述篩選的方法包括以下步驟將經原生質體融合後獲得的融合子進行稀釋塗布培養,根據菌落上綠色晶體的產量進行篩選,即可獲得高PCN產量的融合子。
與現有技術相比,本發明具有如下的有益效果:
1、本發明採用誘變處理和基因組改組技術對綠針假單胞菌HT66的突變株進行篩選,並獲得了一種吩嗪-1-甲醯胺高產菌株,與出發株相比,其吩嗪-1-甲醯胺的產量最高提高了2.8倍。
2、本發明優化了原生質體製備與融合的相關參數,提高了基因組改組的效率。
3、本發明的方法操作簡單,無需進行標記,縮短了育種周期,大大節省勞動成本。
附圖說明
通過閱讀參照以下附圖對非限制性實施例所作的詳細描述,本發明的其它特徵、目的和優點將會變得更明顯:
圖1為本發明實施例1製備的高產融合子的PCN產量變化圖;
圖2為本發明實施例2製備的高產融合子的PCN產量變化圖。
具體實施方式
下面結合具體實施例對本發明進行詳細說明。以下實施例將有助於本領域的技術人員進一步理解本發明,但不以任何形式限制本發明。應當指出的是,對本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進。這些都屬於本發明的保護範圍。
實施例1
1.1 NTG誘變與初篩
本實施例以綠針假單胞菌HT66為出發株,採用化學誘變劑處理獲得高產的突變株。所述的誘變處理可以為NTG誘變,但不限於該方法。採用NTG誘變處理時,其步驟如下:
配製濃度為10g/L的NTG母液,使用時按比例稀釋。吸取1mL對數期菌懸液,用無菌0.01mol/L的PBS緩衝液(pH7.4)洗滌菌體兩次;加入1mL PBS緩衝液重懸菌體,加入適量的NTG母液,使NTG終濃度為50、100、200、500、1000g/L,28℃處理20min;加入0.5mL 1mol/L的NaCl溶液終止反應,使用無菌培養基洗滌菌體3次徹底去除殘留NTG,適量稀釋後塗布平板,24h後計數平板上長出的菌落個數,得到致死率。當NTG處理劑量為100ppm時,菌株HT66的致死率約為75%。因此,首次使用NTG誘變的處理濃度為100ppm,以同樣的方法進行誘變處理。
培養至平板上的菌落可以明顯看出有綠色結晶,觀察菌落的大小,以及綠色結晶出現時間的早晚和綠色結晶的多少,根據這三點直接篩選出產量較高的四個單菌落,分別為1,2,3,4。分別挑取4個菌株的單菌落接種於5mL液體培養基的小瓶中,放置於28℃,180rpm的搖床上培養48h後取樣,每個樣品中加入1mL的乙腈,並且充分振蕩混勻溶解樣品。將乙腈溶解的抽提物用0.22μm有機相濾頭過濾至進樣瓶中,進行HPLC檢測。
色譜柱採用島津WondaSil-WR C-18反相柱(5μm×250mm),檢測波長為254nm,流速為1mL/min,柱溫為30℃。檢測條件為:0-2min:乙腈8%,5mmol/L乙酸銨92%;2-20min:乙腈由8%升至60%,5mmol/L乙酸銨由92%降至40%;20-21min:乙腈8%,5mmol/L乙酸銨92%。
將篩選的四株產量較高的菌株1(HT66-N1),2(HT66-N2),3(HT66-N3),4(HT66-N4)以及出發株(HT66)分別進行搖瓶發酵,取樣以HPLC產量測定峰面積並計算出PCN的實際產量,測定結果如下表1所示。
表1 突變株的PCN產量
從圖中可以看出,篩選的四個突變株的PCN產量相對於HT66原始菌株的產量有明顯提高,其中HT66-N2的產量最高,按照48h的PCN產量來算的話,可以達到886mg/L,比原始菌株提高了100%。即使是產量最低的突變株HT66-N4在48h的產量也達到了816mg/L,相比原始菌株提高了85%。
1.2 原生質體製備
原生質體的製備主要依靠溶菌酶的作用,但是在製備體系中添加滲透壓穩定劑(甘露醇濃度分別為0.3M、0.5M和0.7M)、螯合劑(Na-EDTA的濃度分別為0.1%、0.2%和0.3%)以及選擇不同菌齡(18h,24h,30h)都是影響原生質體製備和再生效率的重要因素,利用正交試驗來探索綠針假單胞菌原生質體製備的最優條件。
將培養一定時間的菌液離心收集菌體,重新懸浮於SMM緩衝液中(含蔗糖0.5mol/L,順丁烯二酸20mmol/L,六水合氯化鎂20mmol/L)。然後添加濃度為0.2mg/mL的溶菌酶及不同濃度的滲透壓穩定劑、螯合劑,置於37℃恆溫水浴鍋中酶解一小時後取出,6000rpm離心後吸去溶液,用pH6.8磷酸緩衝液清洗兩次後重懸,稀釋一定倍數,吸取100μL分別塗布在KB培養基的平板,將平板置於28℃恆溫培養箱中培養。
定期觀察所有平板上的菌落生長情況,到所有平板上的菌落都生長到可以明確計數的時候,對每個平板上的菌落的數量進行計數。
A組平板上的菌落數代表為原始菌液中的細胞數。
B組平板上的菌落數代表經溶菌酶處理之後的菌液中沒有成為原生質體的細胞數,因為原生質體失去了細胞壁無法在基本培養基上生長。
C組平板上的菌落數代表經溶菌酶處理後沒有成為原生質體的細胞以及製備為原生質體且成功再生出來的細胞數,因為在再生培養基上,不僅完整的細胞可以生存,失去細胞壁的部分原生質體也可以再生。
按照上述的A,B,C的含義,可以知道原生質體的製備率ZB和再生率ZS的計算公式:
正交試驗結果見下表2所示。
表2 正交試驗結果
從上表2中可以看出,各因素最高平均綜合分的條件為:菌齡為18h,甘露醇濃度0.5M,EDTA濃度為0.1%。
1.3 原生質體融合
原生質體的融合過程就是基因組重排的過程,所以不僅需要選擇最佳的融合條件,而且要選擇融合的親本菌株。研究發現,融合條件如PEG分子量和濃度、促融化合物DMSO對融合效率有較大影響。本專利以NTG誘變得到的四株高產突變株為親本,分別製備為原生質體溶液後等體積混合,可以篩選到高產融合子。
分別吸取0.25mL的四株親本的原生質體懸浮液在1.5mL離心管中,四株親本分為兩組,第一組四株親本的原生質體懸浮液置於70℃條件下處理15min,第二組四株親本的原生質體懸浮液置於750W的微波爐中低熱檔處理50s。
將第一組和第二組共計8個離心管中的原生質體懸浮液等量混合,離心,去除上清液。
加入0.1mL的pH6.8磷酸緩衝液,吹打原生質體沉澱,重新懸浮。
然後加入一定量的PEG和DMSO,以pH6.8磷酸緩衝液定容到1mL,充分混勻。
放在32℃水浴中保溫靜置。
5分鐘後取出即可。
融合之後,按照一定的比例稀釋融合液,每個稀釋倍數吸取100μL塗布在高滲KB培養基的平板上。放在28℃恆溫培養箱中進行培養。
培養三天後,每天定期過來觀察平板上的菌落生長情況,等到菌落生長到可以清晰計數的時候,就可以計算融合率了。
融合率=(融合後平板菌落數X相應稀釋倍數)/(滅活前雙親等量混合平板菌落數X相應稀釋倍數)X100%
通過計算不同融合條件下原生質體的融合率,可以得到綠針假單胞菌原生質體融合的最佳條件。下表3是不同條件下的融合率。
表3 不同融合條件下的融合率
從上表可以看出,使用濃度為25%的PEG8000為融合劑,添加1%的DMSO時原生質體的融合率最高,可達82.1%。
1.4 高產PCN融合子的篩選
將融合子培養至可以看出菌落上的綠色結晶的時候,按照綠色結晶的多少來直接篩選產量較高的菌株,進行搖瓶發酵和PCN產量測定。由平板上篩選到四株綠色結晶較多的菌株,分別編號為HT66-SF1,HT66-SF2,HT66-SF3,HT66-SF4。
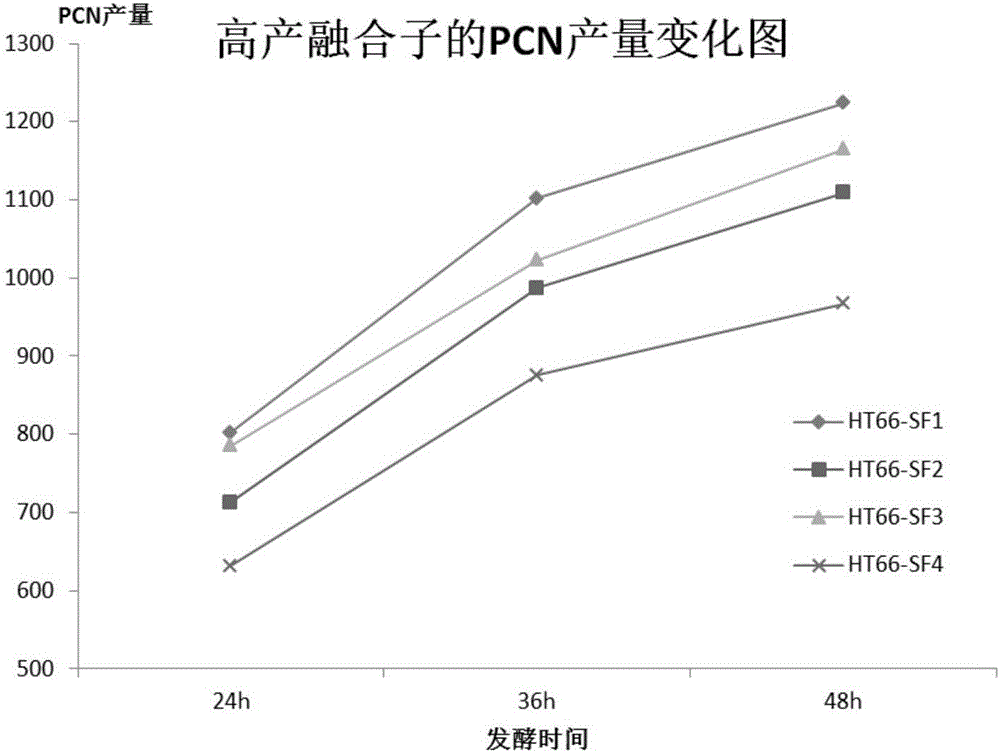
對這四個高產PCN的融合子進行發酵實驗,根據高產融合子的24h,26h,48h的PCN產量繪製產量變化圖,如圖1所示。
從圖1中可以看出,篩選到的四個融合子的產量都有所提高,產量最高是菌株HT66-SF1,48h的PCN產量達到了1224mg/L,是HT66野生型產量的2.8倍。
實施例2
2.1 鈷-60γ射線誘變與初篩
本實施例以綠針假單胞菌HT66為出發株,採用物理誘變處理獲得高產的突變株。所述的誘變處理可以為鈷-60γ射線誘變,但不限於該方法。具體方法包括以下步驟:
1.取出發菌株HT66,活化並培養為種子液。
2.取種子液離心,吸去培養基,以PBS緩衝液重懸菌體,使細胞濃度約為107至108個/mL。
3.將細胞懸浮液分裝至滅菌的玻璃進樣小瓶中,置於鈷-60γ射線放射環境中接受輻照;對照組菌液小瓶不接受輻照。
各組細胞懸浮液接受的吸收劑量分別為0.225、0.320、0.430、0.490和0.905kGy。
4.輻照完畢後,吹打混勻各組菌液,進行梯度稀釋並塗布,每組設置3個平行。待菌落長出後,挑選平板上的菌落數介於30至300個之間的計數,對各組中菌落數進行計數並計算活菌數和致死率,如表4所示。
鈷-60(60Co)半衰期為5.27a,可通過β衰變釋放出能量為315keV的高速電子成為鎳-60,並放出兩束γ射線,其能量分別為1.17及1.33MeV。其衰變反應方程式為:
考慮到對於照射量率常數為Γ的放射性同位素放射性活度為A的放射源,物體在距離點源距離為R處輻照時間為t,其接受的吸收劑量為:
其中,f為照射劑量換算為吸收劑量的常數,為照射量率,鈷-60的照射量率常數Γ為1.32Rm2/(h·Ci)。可見,對於特定的放射源,物體接受的吸收劑量與輻照時間成正比,與到點源距離的平方成反比,故R和t是可用於控制吸收劑量的變量。考慮到放射源的具體特徵及多次進出放射室的的危險性,實驗通過將菌液小瓶擺放在於點源距離不同的位置一次性輻照相同時間,以控制吸收劑量。
表4 各吸收劑量下的活菌數和致死率
5.對吸收劑量為0.225kGy的菌株進行篩選
將輻照後的菌懸液轉接至KB培養基中,隨後稀釋塗布KB平板。培養至平板上的菌落可以明顯看出有綠色結晶,觀察菌落的大小,以及綠色結晶出現時間的早晚和綠色結晶的多少,根據這三點直接篩選出產量較高的四個單菌落,分別為5,6,7,8。分別挑取4個菌株的單菌落接種於5mL液體培養基的小瓶中,放置於28℃,180rpm的搖床上培養48h後取樣,每個樣品中加入1mL的乙腈,並且充分振蕩混勻溶解樣品。將乙腈溶解的抽提物用0.22μm有機相濾頭過濾至進樣瓶中,進行HPLC檢測。
色譜柱採用島津WondaSil-WR C-18反相柱(5μm×250mm),檢測波長為254nm,流速為1mL/min,柱溫為30℃。檢測條件為:0-2min:乙腈8%,5mmol/L乙酸銨92%;2-20min:乙腈由8%升至60%,5mmol/L乙酸銨由92%降至40%;20-21min:乙腈8%,5mmol/L乙酸銨92%。
將篩選的四株產量較高的菌株5(HT66-Q5),6(HT66-Q6),7(HT66-Q7),8(HT66-Q8)以及出發株(HT66)分別進行搖瓶發酵,取樣以HPLC測得PCN的產量,結果如下表5所示。
表5 突變株的PCN產量
從上表中可以看出,四株篩選到的突變株相對於原始菌株的產量均有所提高,其中產量提高最明顯的是HT66-Q6突變株,48h的平均產量可以達到803mg/mL。這四株突變株均可以作為之後基因組重排的親本菌株,來篩選產量更高的融合子。
2.2 原生質體製備
將篩選的四株產量較高的菌株5(HT66-Q5),6(HT66-Q6),7(HT66-Q7),8(HT66-Q8)培養,當菌體培養至18h進行原生質體製備。取5mL菌液離心收集菌體,重新懸浮於相同體積的SMM緩衝液中(含蔗糖0.5mol/L,順丁烯二酸20mmol/L,六水合氯化鎂20mmol/L)。然後添加濃度為0.2mg/mL的溶菌酶及0.5M甘露醇、0.1%的EDTA,置於37℃恆溫水浴鍋中酶解一小時後取出,6000rpm離心後吸去溶液,用pH6.8磷酸緩衝液清洗兩次後重懸,稀釋一定倍數,吸取100μL分別塗布在KB培養基的平板,將平板置於28℃恆溫培養箱中培養。
定期觀察所有平板上的菌落生長情況,到所有平板上的菌落都生長到可以明確計數的時候,對每個平板上的菌落的數量進行計數。根據實施例1的方法計算原生質體的製備率ZB和再生率ZS,結果見下表6所示。
表6 正交試驗結果
2.3 原生質體融合
分別吸取0.25mL的四株親本的原生質體懸浮液在1.5mL離心管中,四株親本分為兩組,第一組四株親本的原生質體懸浮液置於70℃條件下處理15min,第二組四株親本的原生質體懸浮液置於750W的微波爐中低熱檔處理50s。
將第一組和第二組共計8個離心管中的原生質體懸浮液等量混合,離心,去除上清液。
加入0.1mL的pH6.8磷酸緩衝液,吹打原生質體沉澱,重新懸浮。
然後加入一定量的PEG和DMSO,以pH6.8磷酸緩衝液定容到1mL,充分混勻。
放在32℃水浴中保溫靜置。
5分鐘後取出即可。
融合之後,按照一定的比例稀釋融合液,每個稀釋倍數吸取100μL塗布在高滲KB培養基的平板上。放在28℃恆溫培養箱中進行培養。
2.4 高產PCN融合子的篩選
將融合子培養至可以看出菌落上的綠色結晶的時候,按照綠色結晶的多少來直接篩選產量較高的菌株,進行搖瓶發酵和PCN產量測定。由平板上篩選到五株綠色結晶較多的菌株,分別編號為HT66-QC1,HT66-QC3,HT66-QC5,HT66-QC6,HT66-QC9。
對這五個高產PCN的融合子進行發酵實驗,根據五株高產融合子的24h,26h,48h的PCN產量繪製產量變化圖,如圖2所示。
根據圖2的數據可以看出,用基因組重排的方法選育出來的五個融合子的產量有明顯的提高,產量最高的是HT66-QC6菌株,48h達到了1398mg/L,是原始出發菌株HT66的2.6倍。
綜上所述,本發明提供了一種新的吩嗪-1-甲醯胺高產菌株的育種方法,通過誘變處理和基因組改組的結合,製備出了產量提高達2.8倍的吩嗪-1-甲醯胺高產菌株。該方法可以採用任何誘變方法,只要能獲得正突變株即可,且無需對親本菌株進行標記,將多個突變的高產株製備成融合子後隨機融合,可以縮短育種周期,工作效率大幅度提高。
本發明具體應用途徑很多,以上所述僅是本發明的優選實施方式。應當指出,以上實施例僅用於說明本發明,而並不用於限制本發明的保護範圍。對於本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進,這些改進也應視為本發明的保護範圍。
