肉蓯蓉多糖製備治療缺血性腦卒中的藥物的用途的製作方法
2024-04-01 13:13:05 1
本發明涉及肉蓯蓉多糖的應用,特別涉及肉蓯蓉多糖作為治療缺血性腦卒中藥物的用途。
背景技術:
缺血性腦病(ischemicbraindisease)又稱缺血性腦卒中,目前已成為全球範圍內主要致死、致殘的疾病之一,嚴重威脅著人類的生命與健康。靜脈溶栓療法被認為是目前唯一有效而可行的卒中治療措施,但其受到治療時間窗嚴格以及顱內出血風險的限制,使得大量患者難以從項治療中獲益。因此,為腦卒中治療尋找新的預防、治療方案就顯得尤為重要。
近年大量的研究中認為腦血流中斷和再灌注導致的腦細胞損傷是一個多因素、多機制、快速的惡性級聯反應。這個級聯反應包括許多環節,如能量障礙、細胞酸中毒、興奮性胺基酸釋放增加、細胞內鈣失穩態、自由基生成、凋亡基因激活等。這些環節互為因果,彼此重疊,並相互聯繫,形成惡性循環,最終導致細胞凋亡或壞死。
細胞氧化應激損傷是導致細胞凋亡和死亡的重要因素之一。隨著對細胞抗氧化研究的進一步深入,人們逐漸認識到細胞抗氧化在繼發於缺血性腦損傷發病機制中發揮著重要作用。目前,抗氧化機制參與腦缺血損傷已成為基礎與臨床研究的熱點。
肉蓯蓉多糖為列當科植物肉蓯蓉(cistanchedeserticolay.c.ma)及管花肉蓯蓉(c.tubulosa(schenk)r.wight)提取物的主要活性成分之一。研究已經發現肉蓯蓉多糖具有免疫調節、抗衰老、改善脾虛、抗病毒抗腫瘤、促進造血等多方面的藥理作用,但其對腦缺血神經損傷的保護作用目前尚未見報導,將其開發為缺血性腦卒中治療藥物具有極高的潛在價值與社會意義。
技術實現要素:
本發明的目的是通過對肉蓯蓉多糖藥理作用的研究,提供肉蓯蓉多糖作為治療缺血性腦卒中藥物的用途。本發明中使用的肉蓯蓉多糖可以用本領域常規的提取方法從天然藥材中提取獲得或者通過商購獲得。
本發明通過以下技術方案來實現發明目的:
肉蓯蓉多糖在製備治療缺血性腦卒中藥物中的用途,
具體地,所述缺血性卒中為急性期或修復期的缺血性腦卒中。
具體地,所述肉蓯蓉多糖的單次應用量為不引起血糖上升的劑量。
具體地,所述肉蓯蓉多糖在細胞中的單次應用劑量為0.05~5μg/ml。
優選地,肉蓯蓉多糖在細胞中的單次應用劑量為0.5~5μg/ml。
優選地,肉蓯蓉多糖在細胞中的單次應用劑量為5μg/ml。
具體地,所述藥物的劑型為藥劑學上允許的口服劑型、注射劑型或粉針劑型。
本發明公開的肉蓯蓉多糖作為治療缺血性腦卒中藥物的用途,具有如下有益效果:
⑴肉蓯蓉多糖在不升高血糖的濃度情況下能夠顯著提高氧糖剝奪再灌注損傷後的細胞存活率;
⑵肉蓯蓉多糖能夠減弱氧化應激引起的細胞損傷,維持細胞內鈣離子穩態和線粒體膜電位,降低細胞凋亡率;
實驗結果表明,肉蓯蓉多糖具有氧糖剝奪再灌注損傷後的細胞保護作用,可用於製備缺血性腦卒中的治療藥物。
附圖說明
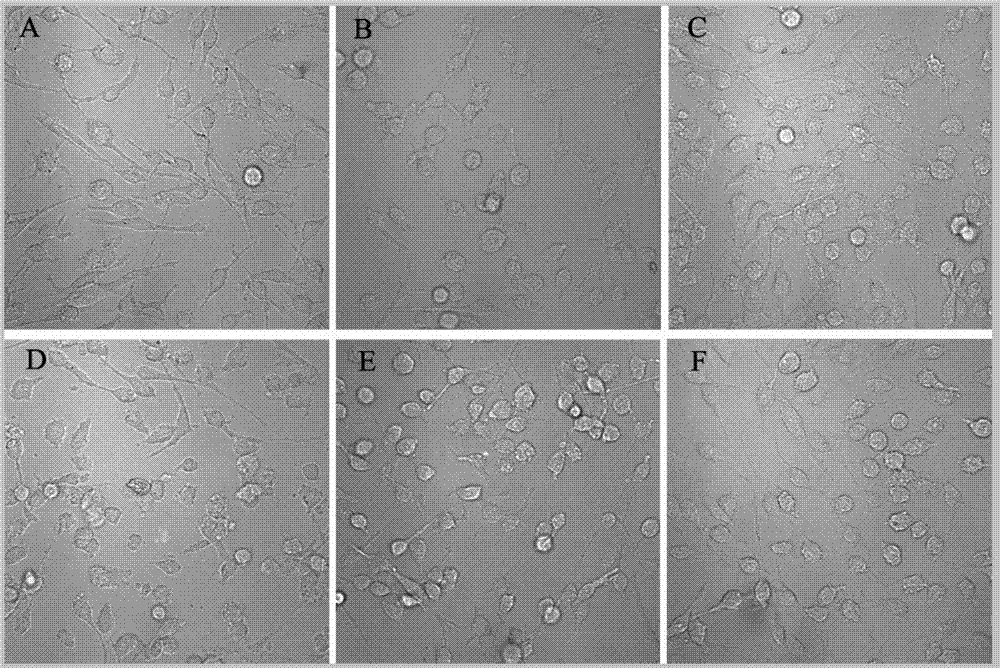
圖1:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞形態變化影響的共聚焦明場圖(×200);
圖2:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞存活率的影n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01):
圖3:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞乳酸脫氫酶漏出率的影響(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖4:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞鈣離子水平變化的影響(×100)(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖5:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞線粒體膜電位變化的影響(×200)(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖6:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞hoechst33342螢光及細胞核變化的影響(×100)(與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01(n=3));
圖7:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞凋亡率的影響(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖8:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞內ros含量的影響(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖9:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞總抗氧化能力(t-aoc)的影響(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖10:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞過氧化氫酶(cat)活性的影響(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
圖11:肉蓯蓉多糖對氧糖剝奪再灌注損傷後pc12細胞穀胱甘肽還原酶(gsh-px)活性的影響(n=3;與正常組比較:##p<0.01,與模型組比較:*p<0.05,**p<0.01);
具體實施方式
下面結合實施例對本發明作進一步詳細的說明:
實施例1
肉蓯蓉多糖作為治療缺血性腦卒中藥物的用途,缺血性卒中為急性期或修復期的缺血性腦卒中,其中肉蓯蓉多糖在細胞中單次應用量為0.05μg/ml,藥物的劑型為藥劑學上允許的粉針劑型。
實施例2
肉蓯蓉多糖作為治療缺血性腦卒中藥物的用途,缺血性卒中為急性期或修復期的缺血性腦卒中,其中肉蓯蓉多糖在細胞中單次應用量為0.5μg/ml,藥物的劑型為藥劑學上允許的粉針劑型。
實施例3
肉蓯蓉多糖作為治療缺血性腦卒中藥物的用途,缺血性卒中為急性期或修復期的缺血性腦卒中,其中肉蓯蓉多糖在細胞中單次應用量為5μg/ml,藥物的劑型為藥劑學上允許的粉針劑型。
以下細胞實驗進一步說明了上述實施例1至3的效果:
一實驗材料
1.1pc12細胞培養
實驗室凍存的pc12細胞復甦後,用含有10%胎牛血清、100u/ml青鏈黴素1640培養基,於37℃、5%co2培養箱常規培養,胰蛋白酶消化傳代,備用。
1.2實驗試劑與儀器
甲氮甲唑藍(mtt)購自廣州化學試劑廠;酶標儀購自thermo公司;ldh、ros、t-aoc、cat、gsh-px測定試劑盒:南京建成生物工程研究所產品;鈣離子,hoechst,mmp試劑盒:碧雲天試劑公司;annexinv-fitc細胞凋亡檢測試劑盒:上海貝博生物公司。雷射共聚焦顯微鏡(tcs-sp,德國leica公司)。流式分析儀(美國bdfacscalibur)。肉蓯蓉多糖購自上海源葉生物科技有限公司。
1.3實驗分組與給藥
實驗分為模型組,肉蓯蓉多糖低、中、高劑量組(0.05μg/ml、0.5μg/ml、5μg/ml),尼莫地平陽性對照組和正常組(即空白對照組)。
1.3實驗模型
pc-12細胞於培養第3d換以無糖ebss平衡鹽緩衝液充分衝洗若干次,使葡萄糖終濃度小於1mol/l,加入無糖earle’s平衡鹽溶液(ebss液),並放入缺氧盒內,持續緩慢通入含有n2的混合氣體4h,取出並吸棄平衡鹽緩衝液,換以完全培養基置入co2培養箱孵育,模擬體內缺血再灌注的過程,孵育24h;肉蓯蓉多糖低、中、高劑量組:換以無糖ebss液建立缺糖缺氧模型,在再灌注時間點前分別加入高、中、低(0.05μg/ml、0.5μg/ml、5μg/ml)三個濃度的肉蓯蓉多糖,其他處理同氧糖剝奪再灌注模型組;尼莫地平陽性對照組:換以無糖ebss液以建立氧糖剝奪模型,在再灌注時間點前加入尼莫地平,其他處理同氧糖剝奪再灌注模型組;正常組:對細胞不做任何處理。
一實驗過程
㈠檢測細胞存活率
1.1實驗方法
給予不同藥物處理的細胞經氧糖剝奪氧糖培養24h後,加入5mg/mlmtt溶液20μl,繼續孵育4h後終止培養。小心吸棄上清液,每孔加入150μl二甲基亞碸dmso混勻,選擇490nm波長測定各孔光吸收值,記錄結果。細胞活力(%)=實驗組光吸收值/對照組光吸收值×100%。
1.2實驗結果:
表1.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後存活率的影響
(與正常組比較:##p<0.01;與模型組比較:*p<0.05,**p<0.01)
由表1和圖1、圖2可以看出,單次給予肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後的細胞存活率的提高隨藥物濃度增加而增強,至5μg/ml時保護作用最強(與模型組對比**p﹤0.01),提示肉蓯蓉多糖在0.5μg/ml、5μg/ml的濃度均對pc12細胞氧糖剝奪再灌注損傷具有保護作用。
(二)檢測肉蓯蓉多糖對pc12細胞損傷後ldh漏出率的影響
2.1實驗方法
給予不同藥物處理的細胞經氧糖剝奪氧糖培養24h後收集各組細胞的培養液。使用預冷的pbs洗滌神經細胞3次,細胞刮子輕輕刮取細胞並移入離心管中。用超聲波細胞破碎儀破碎細胞,設定的儀器參數為工作時間3s,間隔時間5s,每個樣品重複5次。取少量細胞破碎液,於光鏡下確認無完整的細胞。1000rpm,4℃離心5min,取上清。參照試劑盒的說明書分別檢測培養液中和細胞勻漿中ldh的吸光度a,計算ldh漏出率(%)=(細胞培養液od440/(細胞培養液od440+細胞勻漿od440))×100
2.2實驗結果
表2.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後ldh漏出率的影響
(與正常組比較:##p<0.01;與模型組比較:**p<0.01)
由表2和圖3可以看出,單次給予肉蓯蓉多糖能夠降低pc12細胞氧糖剝奪再灌注損傷後的細胞ldh漏出率。提示肉蓯蓉多糖在0.05μg/ml、0.5μg/ml、5μg/ml的濃度均具有降低損傷後的細胞ldh漏出率的作用(與模型組對比**p﹤0.01)。
(三)檢測肉蓯蓉多糖對pc12細胞損傷後鈣離子水平的影響
3.1實驗方法
將細胞種植培養在雷射共聚焦專用皿中,氧糖剝奪再灌注後進行實驗。使用pbs輕輕衝洗3遍,每次衝洗5分鐘,然後加入試劑盒中提供的的2.5μmol/l的fluo-3/am,並將其置於培養箱中孵育30分鐘。使用pbs液衝洗3遍,每遍洗5分鐘。在每個皿中加入1mlpbs溶液。在雷射共聚焦顯微鏡下採片觀察,根據分析軟體(image-proplus)對採集的區域進行螢光強度分析。
3.2實驗結果
表3.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後鈣離子螢光強度的影響
(與正常組比較:##p<0.01;與模型組比較:**p<0.01)
由表3和圖4可以看出,單次給予肉蓯蓉多糖能夠降低pc12細胞氧糖剝奪再灌注損傷後的細胞鈣離子螢光強度。提示肉蓯蓉多糖在0.05μg/ml、0.5μg/ml、5μg/ml的濃度均具有減輕損傷後的細胞鈣離子超載的作用(與模型組對比**p﹤0.01)。
(四)檢測肉蓯蓉多糖對pc12細胞損傷後線粒體膜電位的影響
4.1實驗方法
按照說明書中的步驟首先取試劑盒中的jc-1(200×),本次試驗約需三百微升jc-1(5×),按照比例,加入480ml的超純水將jc-1稀釋。劇烈搖晃,使其充分溶解並混勻。然後再加入兩毫升的jc-1染色緩衝液,配成最後濃度為5×的緩衝液,混勻後即可。將培養皿放在37℃的培養箱中孵育20分鐘。在孵育期間,按照說明書再配製適量的jc-1染色緩衝液(1×),置於4℃。37℃孵育結束後,棄上清液,用配製好的jc-1(1×)染色緩衝液,充分衝洗細胞三次,每次5分鐘。加入2ml細胞常規培養液,在雷射共聚焦顯微鏡下採片觀察,根據分析軟體(image-proplus)對採集的區域進行螢光強度分析。使用分析軟體通過得出紅綠螢光比值繼而來衡量線粒體膜電位的水平。
4.2實驗結果
表4.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後鈣離子水平的影響
(與正常組比較:##p<0.01;與模型組比較:**p<0.01)
檢測到的線粒體膜電位(mmp)越大,紅綠螢光比值越小,細胞損傷的越嚴重。由表4和圖5可以看出,肉蓯蓉多糖在0.05μg/ml、0.5μg/ml、5μg/ml的濃度均具有減輕損傷後的細胞鈣離子超載的作用(與模型組對比**p﹤0.01)。
(五)檢測肉蓯蓉多糖對pc12細胞損傷後細胞凋亡率的影響
5.1實驗方法
5.1.1hoechst33342染色檢測細胞凋亡率
將細胞培養在雷射共聚焦專用皿中用於實驗。吸棄原培養液,用預溫的pbs洗3次,每次3min,加入細胞固定液於室溫下固定30min。用pbs洗4次/3min,加入400μl工作濃度為1μg/ml的hoechst33342於室溫下避光孵育10min,再使用pbs洗4次,每次3min。在雷射共聚焦顯微鏡下採片觀察,根據分析軟體(image-proplus)對採集的區域進行螢光強度分析。
5.1.2實驗結果
表5.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後hoechst33342螢光的影響
(與正常組比較:##p<0.01;與模型組比較:**p<0.01)
5.2.1流式檢測細胞凋亡率
消化並收集復氧後的細胞,用冷pbs洗滌兩次,儘量吸棄pbs;用400μl1╳annexinv結合液重懸細胞,加入5μlannexinv-fitc染色液,2-8℃避光孵育15分鐘,加入10μlpi染液2-8℃避光孵育5分鐘;立即用流式細胞儀進行檢測。
5.2.2實驗結果
表6.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後細胞凋亡率的影響
(與正常組比較:##p<0.01;與模型組比較:**p<0.01)
由表5、6和圖6、7可以看出,單次給予肉蓯蓉多糖能夠降低pc12細胞氧糖剝奪再灌注損傷後的細胞凋亡率。提示肉蓯蓉多糖在0.05μg/ml、0.5μg/ml、5μg/ml的濃度均具有減輕損傷後的細胞凋亡的作用(與模型組對比**p﹤0.01)。
(六)檢測肉蓯蓉多糖對pc12細胞損傷後ros、t-aoc、cat、gsh-px水平的影響
6.1實驗方法
給予不同藥物處理的細胞經氧糖剝奪氧糖培養24h後收集各組細胞的培養液。使用預冷的pbs洗滌神經細胞3次,細胞刮子輕輕刮取細胞並移入離心管中。用超聲波細胞破碎儀破碎細胞,設定的儀器參數為工作時間3s,間隔時間5s,每個樣品重複5次。取少量細胞破碎液,於光鏡下確認無完整的細胞。1000rpm,4℃離心5min,取上清。參照試劑盒的說明書分別檢測培養液中和細胞勻漿中
6.2實驗結果
表7.肉蓯蓉多糖對pc12細胞氧糖剝奪再灌注損傷後氧化應激相關指標的影響
(與正常組比較:##p<0.01;與模型組比較:*p<0.05,**p<0.01)
由表7和圖8~11的結果表示,單次給予肉蓯蓉多糖能夠顯著降低pc12細胞氧糖剝奪再灌注損傷後細胞內ros含量,提高抗氧化相關酶t-aoc、cat、gsh-px的活性;隨藥物濃度增加,抗氧化物酶(t-aoc、cat、gsh-px)活性增強,ros含量降低,至5μg/ml時細胞內的氧自由基清除劑活性最強,抗氧化物酶(t-aoc、cat、gsh-px)活性最強(與模型組對比*p﹤0.05或**p﹤0.01)。提示肉蓯蓉多糖(0.05μg/ml、0.5μg/ml、5μg/ml)均具有減輕pc12細胞氧糖剝奪再灌注後細胞氧化應激損傷的作用。
以上所述的僅是本發明的一些實施方式。對於本領域的普通技術人員來說,在不脫離本發明創造構思的前提下,還可以做出若干變形和改進,這些都屬於本發明的保護範圍。
