氮取代3‑氧代‑6‑取代四氫喹喔啉結構化合物、其製備方法及其醫藥用途與流程
2023-10-10 15:18:59 1
本發明屬於醫藥領域,具體涉及一種氮取代3-氧代-6-取代四氫喹喔啉結構化合物、其製備方法及其醫藥用途。
背景技術:
微管是由α,β微管蛋白異二聚體聚合而成的管狀聚合物,在細胞中具有諸多功能,特別是以紡錘體的形式參與細胞的有絲分裂過程。腫瘤細胞具有快速增殖能力,若抑制其紡錘體的形成,必將導致有絲分裂的阻斷,使得腫瘤細胞生長停滯於G2/M期,抑制細胞增殖。
微管以胞質微管和紡錘體微管兩種形式存在,參與細胞運動、細胞器定位、胞內物質運輸及真核細胞的有絲分裂過程等。細胞進入分裂期,其胞質微管解聚成微管蛋白後再組裝成紡錘體微管。在分裂後期,紡錘體微管牽引著姐妹染色單體從赤道面移向紡錘體兩極。在有絲分裂結束後,紡錘體微管解聚再組裝成胞質微管。因此,這種微管蛋白/微管之間的動態轉換(聚合和解聚),為細胞正常有絲分裂所必需。若破壞此循環將致使進入有絲分裂的細胞停止分裂,進而延長細胞周期或誘導細胞凋亡。
康普瑞汀(Combretastatin A4)是從風車子屬南非柳樹Combretum caffrum中分離得到的天然產物,其能夠抑制微管蛋白的聚合,具有較好的抗腫瘤活性。然而,其水溶性差及容易發生雙鍵的異構化而生成無活性的反式同分異構體限制了其臨床應用。
康普瑞汀的結構改造主要包括:(1)引入磷酸、胺基酸等結構以改善其水溶性;(2)以磺醯胺、羰基、五元芳香雜環等替代雙鍵以解決其雙鍵在體內的不穩定問題。然而,上述所有報導的康普瑞汀衍生物均不同於本發明所涉及的化合物。
技術實現要素:
本發明的目的在於提供一種氮取代3-氧代-6-取代四氫喹喔啉類新穎結構化合物;本發明的另一個目的是提供該類化合物的製備方法;本發明的第三個目的是提供該類化合物或含有該類化合物的藥物組合物在製備預防或治療抗腫瘤或除腫瘤以外的增殖性疾病藥物中的應用。
本發明的具體技術方案如下:
作為本發明的第一方面,氮取代3-氧代-6-取代四氫喹喔啉結構化合物以及其任意組合或其藥用鹽,結構通式如式(Ⅰ):
其中R1代表羥基,鏈狀C1-6的烷氧基,3-6個環成員的環烷氧基,鏈狀C1-6的烷胺基,3-6個環成員的環烷胺基,苯環或取代的苯環基,芳香環或取代的芳香環基,芳香雜環或取代的芳香雜環基,3-6個環成員的含氮和/或含氧雜環基;
R2代表氫,滷素(氟,氯,溴,碘),羥基,鏈狀C1-6的烷氧基;
R3代表氫,滷素(氟,氯,溴,碘),羥基,鏈狀C1-6的烷氧基;
R4代表氫,滷素(氟,氯,溴,碘),羥基,鏈狀C1-6的烷氧基;
W代表亞甲基,羰基,磺醯基,亞磺醯基。
優選地,R1為羥基、甲氧基、正丁胺基、環己胺基、嗎啉基或苯胺基;R2為氫或甲氧基;R3為氫、氟或甲氧基;R4為氫或甲氧基;W為亞甲基、羰基或亞甲基羰基。
本發明的化合物可按照常規方法製備為藥用鹽形式;包括其有機酸鹽及無機酸鹽:有機酸包括(但不限於)乙酸、馬來酸、富馬酸、酒石酸、琥珀酸、乳酸、對甲苯磺酸、水楊酸、草酸等,無機酸包括(但不限於)鹽酸、硫酸、磷酸、二磷酸、氫溴酸、硝酸等。含有羧酸化合物的金屬鹽:包括(但不限於)鉀鹽、鈉鹽等。
作為本發明的第二個方面,本發明的化合物可以用以下方法製備得到,其合成路線如下:
具體步驟為:
(1)製備3-硝基-4-氨基苯甲酸酯或3-硝基-4-氨基苯甲醯胺(2a-2e)
以3-硝基-4-氨基苯甲酸(即化合物1)為起始原料,在二氯亞碸作用下與甲醇脫水縮合,得到化合物2a;以3-硝基-4-氨基苯甲酸(即化合物1)為起始原料,二氯甲烷為溶劑,在1-乙基-(3-二甲基氨基丙基)碳醯二亞胺鹽酸鹽(EDCI)作用下與不同的胺類化合物縮合得到化合物2b-2e;
(2)製備3-硝基-4-((2-乙氧基-2-氧代乙基)氨基)苯甲酸酯或3-硝基-4-((2-乙氧基-2-氧代乙基)氨基)苯甲醯胺(3a-4e)
化合物2a-2e分別以碳酸銫為鹼,與溴乙酸乙酯發生親核取代反應,得到化合物3a-3e;
(3)製備3-氧代-1,2,3,4-四氫喹喔啉-6-羧酸酯或3-氧代-1,2,3,4-四氫喹喔啉-6-羧醯胺(4a-4e)
化合物3a-3e分別以甲醇為溶劑,以鈀碳為催化劑,在氫氣作用下經還原、環合一鍋法得到化合物4a-4e;
(4)製備1-取代苄基-3-氧代-1,2,3,4-四氫喹喔啉-6-羧酸酯(5a-5c)
化合物4a以乙腈為溶劑,以碳酸鉀為鹼、碘化鉀為催化劑與不同取代的氯化苄發生親核取代反應得到化合物5a-5c;
(5)製備1-(3,4,5-三甲氧苄基)-3氧代-1,2,3,4-四氫喹喔啉-6-羧酸(6)
化合物5a以四氫呋喃/水為溶劑,在氫氧化鋰作用下水解,之後用濃鹽酸酸化處理得到化合物6;
(6)製備1-(3,4,5-三甲氧苄基)-3氧代-1,2,3,4-四氫喹喔啉-6-羧醯胺(7a-7b)
化合物6以甲苯為溶劑,與草醯氯作用生成中間體,該中間體以四氫呋喃為溶劑,碳酸鉀為鹼,分別與不同的苯胺作用生成化合物7a-7b;
(7)製備取代苯甲醯氯或取代苯乙醯氯(9a-9e)
原料8a-8e分別與二氯亞碸反應生成化合物9a-9e;
(8)製備1-取代苯甲醯基-3-氧代-1,2,3,4-四氫喹喔啉-6-羧酸酯、1-取代苯甲醯基-3-氧代-1,2,3,4-四氫喹喔啉-6-羧醯胺或1-取代苯乙醯基-3-氧代-1,2,3,4-四氫喹喔啉-6-羧酸酯(10a-10l)
化合物4a-4e以四氫呋喃為溶劑、碳酸鉀為鹼分別與化合物9a-9e反應得到化合物10a-10l。
作為本發明的第三個方面,還提供了上述任一化合物以及其任意組合或其藥用鹽,在製備預防或治療抗腫瘤疾病或其它增殖性疾病藥物中的應用。
本發明還提供了一種藥物組合物,通式(Ⅰ)化合物、藥學上可接受的鹽或溶劑化物可以添加藥學上可接受的載體製成常見的藥用製劑,如片劑、膠囊、粉劑、糖漿、液劑、懸浮劑、針劑,可以加入香料、甜味劑、液體或固體填充料或稀釋劑等常用的藥物輔料。
為評價本發明合成化合物及其藥物組合物的抗腫瘤活性,對本發明的化合物進行了細胞和分子水平的藥理活性測試。
本發明化合物及其藥物組合物經體外細胞生長抑制實驗,結果顯示該類化合物普遍具有較強的細胞生長抑制作用。化合物5c、10c對細胞生長抑制作用的半數抑制濃度(IC50)達到幾微摩爾/升(μM),化合物10d達到納摩爾水平(nM)。這些化合物的細胞生長抑制活性明顯優於阿黴素。
本發明化合物及其藥物組合物經體外微管蛋白聚合抑制實驗,結果顯示化合物5c、10c及10d在20μM具有明顯的抑制微管蛋白聚合抑制作用,化合物10d對微管蛋白聚合抑制作用的半數抑制濃度(IC50)為3.9μM。
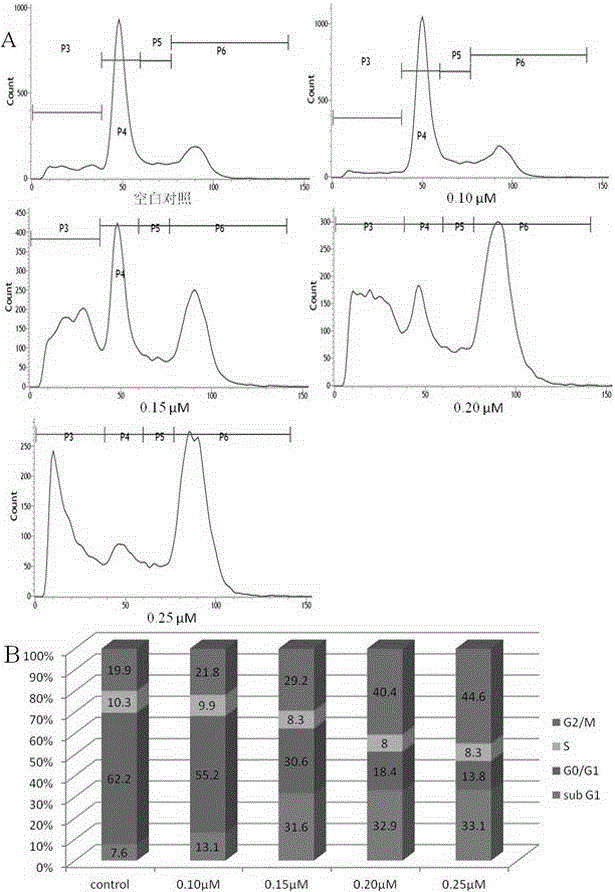
本發明化合物及其藥物組合物經體外細胞生長周期實驗,結果顯示化合物10d在0.15μM能夠明顯地將細胞阻滯在G2/M期。
本發明所述化合物和藥學上可接受的載體在臨床上可以採用口服、靜脈注射等給藥方式。在臨床上可以用於單藥治療,也可以和其他臨床上使用的化療藥物及放療等治療手段聯合用於前述癌症的治療。
附圖說明
圖1是體外微管蛋白聚合抑制作用圖。其中A為空白對照、紫杉醇(3μM)、康普瑞汀(2.5μM)、化合物5c(20μM)、10c(20μM)及10d(20μM)對微管蛋白聚合影響;B為化合物10d在1μM,5μM,10μM,50μM濃度時對微管蛋白聚合抑制作用。
圖2是化合物10d對HeLa細胞生長周期影響圖。其中A為空白對照、化合物10d在0.1μM,0.15μM,0.20μM,0.25μM濃度時對細胞生長周期影響;B為處於不同生長期細胞統計圖。
具體實施方式
以下結合具體實施例對本發明的技術方案做進一步詳細說明,但本發明的保護範圍並不局限於此。下述實施例中柱層析所用洗脫劑的比例均為體積比。
實施例1
1-(4-甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(5a)的製備
(1)3-硝基-4-氨基苯甲酸甲酯的製備(2a)
將3-硝基-4-氨基苯甲酸(即化合物1,4.50g,24.7mmol)、無水甲醇(80mL),依次投入到250mL三頸瓶中,待溫度降至0℃,用恆壓滴液漏鬥慢慢滴加氯化亞碸(5.38mL,74.1mmol,3equiv),滴加完畢,0℃繼續攪拌30分鐘,升溫至50℃反應4h,有大量的黃色固體產生,抽濾,將濾液中的甲醇蒸乾,加入30mL水與30mL乙酸乙酯,分液,用無水硫酸鈉乾燥有機層,蒸乾溶劑,得到黃色固體,與前面濾餅合併後乾燥,得到化合物2a,黃色固體4.32g,收率89.2%。熔點:181.9-182.7℃。1H NMR(300MHz,CDCl3)δ8.85(d,J=1.9Hz,1H),7.99(dd,J=8.8,1.9Hz,1H),6.83(d,J=8.8Hz,1H),6.42(brs,2H),3.90(s,3H).
(2)3-硝基-4-((2-乙氧基-2-氧代乙基)氨基)苯甲酸甲酯的製備(3a)
將2a(300mg,1.53mmol),碳酸銫(600mg,1.84mmol,1.2equiv),溴乙酸乙酯(1.70mL,15.3mmol,10equiv)依次投入到25mL圓底燒瓶中,升溫至140℃反應20h,反應完畢,減壓蒸出溴乙酸乙酯,殘留物經柱層析(石油醚:乙酸乙酯=20︰1),得252mg黃色固體3a,收率58.3%。熔點:127.6-128.8℃。1H NMR(300MHz,CDCl3)δ8.91(d,J=2.0Hz,1H),8.75(brs,1H),8.09(dd,J=8.9,1.8Hz,1H),6.72(d,J=9.0Hz,1H),4.31(q,J=7.1Hz,2H),4.14(d,J=5.2Hz,2H),3.91(s,3H),1.33(t,J=7.1Hz,3H).
(3)3-氧代-1,2,3,4-四氫喹喔啉-6-羧酸甲酯的製備(4a)
將3a(300mg,1.06mmol),無水甲醇(100mL),10%鈀碳(56mg,0.053mmol,0.05equiv,CAS號:64741-65-7,下同)依次投入到250mL圓底燒瓶中,氫氣球置換空氣三次,室溫攪拌反應10小時,反應完畢,抽濾,蒸出溶劑,柱層析(200-300目矽膠,二氯甲烷︰甲醇=80︰1),得到180mg灰白色固體4a,收率82.4%。熔點:大於280℃。1H NMR(300MHz,CDCl3)δ7.74(brs,1H),7.60(d,J=8.1Hz,1H),7.38(s,1H),6.64(d,J=8.2Hz,1H),4.09(s,2H),3.87(s,3H).MS(ESI)[M+H]+207.00.
(4)1-(4-甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯的製備(5a)
將4a(30mg,0.145mmol),乙腈(2mL),無水碳酸鉀(24mg,0.174mmol,1.2equiv),碘化鉀(12mg,0.073mmol,0.5equiv),4-甲氧基氯化苄(34mg,0.218mmol,1.5equiv)依次投入到10mL茄型瓶中,升溫至70℃反應6小時,反應完畢,蒸出溶劑,柱層析(200-300目矽膠,二氯甲烷︰甲醇=80︰1),得到20mg灰白色固體,收率42.3%。熔點:217-219℃。1H NMR(300MHz,CDCl3)δ8.48(brs,1H),7.65(d,J=8.4Hz,1H),7.44(s,1H),7.19(d,J=8.0Hz,2H),6.88(d,J=8.3Hz,2H),6.76(d,J=8.2Hz,1H),4.44(s,2H),3.92(s,2H),3.87(s,3H),3.80(s,3H).13C NMR(75MHz,CDCl3)δ166.7,165.5,159.3,138.8,128.8,127.1,126.7,125.0,119.9,116.6,114.4,110.9,55.4,52.8,51.9,51.6.HRMS(ESI):calcd for C18H19N2O4[M+H]+327.13393,found 327.13388.
實施例2
1-(3,4-二甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(5b)的製備
除第(4)步中用3,4-二甲氧基氯化苄替代4-甲氧基氯化苄外,其他步驟及提純方法同實施例1,得到29mg白色固體,收率56.1%。熔點:155.9-157.5℃。1H NMR(300MHz,CDCl3)δ9.05(s,1H),7.65(dd,J=8.5,1.8Hz,1H),7.50(d,J=1.8Hz,1H),6.82(s,2H),6.79-6.74(m,2H),4.43(s,2H),3.92(s,2H),3.87(s,6H),3.83(s,3H).13C NMR(75MHz,CDCl3)δ166.8,165.8,149.5,148.7,138.9,127.6,126.6,125.2,120.0,119.9,116.8,111.4,110.9,110.5,56.0,53.2,52.0,51.6.HRMS(ESI):calcd for C19H21N2O5[M+H]+357.14450,found 357.14450.
實施例3
1-(2,3,4-三甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(5c)的製備
除第(4)步中用3,4,5-三甲氧基氯化苄替代4-甲氧基氯化苄外,其他步驟及提純方法同實施例1,得到38mg白色固體,收率67.8%。熔點:188.9-191.0℃。1H NMR(300MHz,CDCl3)δ8.02(brs,1H),7.67(dd,J=8.5,1.9Hz,1H),7.43(d,J=1.9Hz,1H),6.78(d,J=8.6Hz,1H),6.47(s,2H),4.42(s,2H),3.93(s,2H),3.88(s,3H),3.84(s,3H),3.81(s,6H).13C NMR(75MHz,CDCl3)δ166.7,165.7,153.8,138.8,137.5,131.0,126.7,125.1,120.2,116.8,111.0,104.3,60.9,56.2,53.8,52.0,51.8.HRMS(ESI):calcd for C20H23N2O6[M+H]+387.15506,found 387.15512.
實施例4
1-(2,3,4-三甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸(6)的製備
將5c(30mg,0.0776mmol)、四氫呋喃(2mL)、蒸餾水(1mL)和氫氧化鋰(3.7mg,0.155mmol,2equiv)依次投入到10mL茄型瓶中,升溫至40℃反應10小時,反應完畢,蒸出四氫呋喃,滴加0.5mL濃鹽酸(12mol/L),析出白色固體,靜置30分鐘,抽濾得到21mg灰白色固體,收率72.6%。熔點:135.3-136.3℃。1H NMR(300MHz,CDCl3)δ11.95(brs,1H),7.73(s,1H),7.51(d,J=8.1,1H),6.67(d,J=8.4,1H),6.51(s,2H),4.46(s,2H),4.04(s,2H),3.84(s,9H).13C NMR(75MHz,CDCl3)δ170.3,167.8,153.8,138.9,137.5,131.0,127.2,124.4,119.0,118.6,109.9,104.1,60.9,56.3,53.9,51.3.HRMS(ESI):calcd for C19H21N2O6[M+H]+373.13941,found 373.13940.
實施例5
1-(2,3,4-三甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯正丁胺(7a)的製備
將化合物6(25mg,0.0671mmol),甲苯(3mL),草醯氯(57μL,0.671mmol,10euqiv)依次投入到25mL茄型瓶中,室溫攪拌至固體全部溶解,升溫至70℃反應3小時,反應完畢,蒸出甲苯及未反應的草醯氯,殘餘物即為醯氯中間體,未純化;將正丁胺(20μL,0.201mmol,3equiv),無水四氫呋喃(1.0mL),無水碳酸鉀(28mg,0.201mmol,3equiv)依次投入到10mL茄型瓶中,用無水四氫呋喃(1.0mL)將上述製備的醯氯中間體溶解,慢慢滴加到反應液中,室溫攪拌反應20分鐘,反應完畢,蒸出溶劑,柱層析(200-300目矽膠,二氯甲烷︰甲醇=80:1),得到21mg白色固體,收率73.2%。熔點:184.5-186.0℃。1H NMR(300MHz,CDCl3)δ8.72(s,1H),7.52(s,1H),7.25(d,J=8.4,1H),6.72(d,J=8.5Hz,1H),6.48(s,2H),6.06(t,J=5.4Hz,1H),4.39(s,2H),3.90(s,2H),3.84(s,3H),3.81(s,6H),3.44-3.51(m,2H),1.62-1.55(m,2H),1.47-1.37(m,2H),0.95(t,J=7.3Hz,3H).13C NMR(75MHz,CDCl3)δ166.6,165.6,153.7,137.7,137.5,131.3,126.0,124.9,122.2,115.3,111.1,104.3,60.9,56.2,53.9,52.0,39.9,31.8,20.2,13.8.HRMS(ESI):calcd for C23H30N3O5[M+H]+428.21800,found428.21802.
實施例6
1-(2,3,4-三甲氧苄基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯環己胺(7b)的製備
除用環己胺代替正丁胺外,其他步驟及提純方法同實施例5,得到19mg淡黃色固體,收率62.4%。熔點:167.1-169.0℃。1H NMR(300MHz,CDCl3)δ8.80(s,1H),7.55(d,J=1.6Hz,1H),7.24(d,J=8.1,1H),6.70(d,J=8.4Hz,1H),6.48(s,2H),5.91(d,J=7.9Hz,1H),4.39(s,2H),4.01-4.07(m,1H),3.90(s,2H),3.84(s,3H),3.81(s,6H),1.95-2.08(m,2H),1.68-1.80(m,3H),1.39-1.50(m,2H),1.15-1.23(m,3H).13C NMR(75MHz,CDCl3)δ165.7,165.6,153.7,137.6,137.5,131.3,126.1,125.1,122.1,115.5,111.0,104.3,60.9,56.2,53.9,52.1,48.7,33.4,25.6,24.9.HRMS(ESI):calcd for C25H32N3O5[M+H]+454.23365,found 454.23367.
實施例7
1-(4-氟苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(10a)的製備
(1)4-氟苯甲醯氯的製備(9a)
將對氟苯甲酸8a(110mg,0.786mmol,2equiv)、氯化亞碸(856μL,11.8mmol,30equiv)依次投入到10mL茄型瓶中,升溫至70℃反應3h,反應完畢,減壓蒸除氯化亞碸,得到淡黃色油狀物,未純化;
(2)將4a(81mg,0.393mmol),無水四氫呋喃(1.0mL),無水碳酸鉀(109mg,0.786mmol,2equiv)依次投入到10mL茄型瓶中,用無水四氫呋喃(1.0mL)將上述製備化合物9a溶解,慢慢滴加至茄型瓶中,室溫下攪拌反應2小時,減壓蒸除溶劑,用200-300目矽膠柱層析(洗脫劑DCM:MeOH=80︰1),得到77mg灰白色固體,收率59.7%。熔點:239.6-241.5℃。1H NMR(300MHz,CDCl3)δ9.31(s,1H),7.71(d,J=1.2Hz,1H),7.39-7.53(m,3H),7.02(t,J=8.5Hz,2H),6.70(d,J=8.5Hz,1H),4.60(s,2H),3.91(s,3H).13C NMR(75MHz,CDCl3)δ168.2,167.9,165.9,164.5(J=252),131.6(J=8.25),131.5,129.9,129.6(J=3.75),127.8,124.3,124.2,117.9,115.9(J=21.7),52.5,47.6.HRMS(ESI):calcd for C17H14FN2O4[M+H]+329.09321,found 329.09311.
實施例8
1-(4-甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(10b)的製備
除步驟(1)中用對甲氧基苯甲酸替代對氟苯甲酸製得化合物9b外,其他步驟及提純方法同實施例7,得到78mg灰白色固體,收率58.3%。熔點:205.5-207.2℃。1H NMR(300MHz,CDCl3)δ9.37(s,1H),7.70(d,J=1.7Hz,1H),7.46(dd,J=8.5,1.8Hz,1H),7.39(d,J=8.8Hz,2H),6.81(d,J=8.8Hz,2H),6.73(d,J=8.5Hz,1H),4.59(s,2H),3.90(s,3H),3.82(s,3H).13C NMR(75MHz,CDCl3)δ169.0,168.2,166.0,162.3,132.2,131.3,129.7,127.3,125.4,124.3,124.2,117.8,113.8,55.4,52.5,47.7.HRMS(ESI):calcd for C18H17N2O5[M+H]+341.11320,found341.11310.
實施例9
1-(3,4-二甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(10c)的製備
除步驟(1)中用3,4-二甲氧基苯甲酸替代對氟苯甲酸製得化合物9c外,其他步驟及提純方法同實施例7,得到68mg白色固體,收率46.7%。熔點:217.0-218.8℃。1H NMR(300MHz,CDCl3)δ9.39(s,1H),7.70(d,J=1.7Hz,1H),7.47(dd,J=8.5,1.8Hz,1H),7.04(d,J=1.9Hz,1H),6.95(dd,J=8.3,1.9Hz,1H),6.74(m,2H),4.59(s,2H),3.90(s,3H),3.88(s,3H),3.78(s,3H).13C NMR(75MHz,CDCl3)δ169.0,168.1,166.0,152.0,148.9,132.2,129.6,127.3,125.4,124.3,124.2,123.1,117.8,112.2,110.3,56.0,52.5,47.8.HRMS(ESI):calcd for C19H19N2O6[M+H]+371.12376,found 371.12363.
實施例10
1-(3,4,5-三甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(10d)的製備
除步驟(1)中用3,4,5-三甲氧基苯甲酸替代對氟苯甲酸製得化合物9d外,其他步驟及提純方法同實施例7,得到92mg灰白色固體,收率58.5%。熔點:92.0-94.6℃。1H NMR(300MHz,CDCl3)δ8.99(brs,1H),7.67(s,1H),7.51(d,J=8.2Hz,1H),6.83(d,J=8.2Hz,1H),6.64(s,2H),4.59(s,2H),3.91(s,3H),3.87(s,3H),3.70(s,6H).13C NMR(75MHz,CDCl3)δ168.9,167.7,165.9,153.1,141.0,131.7,129.6,128.2,127.5,124.3(2C),117.6,106.5,61.1,56.2,52.5,47.8.HRMS(ESI):calcd for C20H21N2O7[M+H]+401.13433,found 401.13437.
實施例11
1-[2-(3,4,5)-三甲氧基乙醯基]-3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯(10e)的製備
除步驟(1)中用3,4,5-三甲氧基苯乙酸替代對氟苯甲酸外,其他步驟及提純方法同實施例7,得到103mg白色固體,收率63.2%。熔點:188.0-181.9℃。1H NMR(300MHz,CDCl3)δ9.10(s,1H),7.77(dd,J=8.3,1.3Hz,1H),7.61(s,1H),7.41-7.52(m,1H),6.35(s,2H),4.51(s,2H),3.93(s,3H),3.85(d,J=4.5Hz,2H),3.80(s,3H),3.78(s,6H).13C NMR(75MHz,CDCl3)δ170.4,165.8,153.4,137.0,130.8,129.3,128.7,124.6,124.2(2C),117.9,106.4,105.6,60.9,56.1,52.6,41.4,41.1.HRMS(ESI):calcd for C21H23N2O7[M+H]+415.14998,found 415.14999.
實施例12
1-(3,4-二甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯丁胺(10f)的製備
(1)3-硝基-4-氨基苯甲醯丁胺的製備(2b)
將3-硝基-4-氨基苯甲酸(250mg,1.37mmol),二氯甲烷(30mL),EDCI(314mg,1.64mmol,1.2equiv),正丁胺(135μL,1.37mmol,1equiv)依次投入到100mL茄型瓶中,室溫攪拌反應2小時,反應完畢,蒸出溶劑,柱層析(200-300目矽膠,石油醚︰乙酸乙酯=1︰1),得到273mg黃色固體,收率84.0%。熔點:162.8-164.6℃。1H NMR(300MHz,CDCl3)δ8.47(s,1H),7.90(d,J=8.8Hz,1H),6.86(d,J=8.7Hz,1H),6.35(brs,2H),6.05(brs,1H),3.42-3.49(m,2H),1.58-1.67(m,2H),1.35-1.49(m,2H),0.97(t,J=7.3Hz,3H).MS(ESI)[M+H]+238.08。
(2)3-硝基-4-(2-乙氧基-2-氧代乙基)胺基苯甲醯丁胺的製備(3b)
將2b(200mg,0.843mmol),碳酸銫(329mg,1.01mmol,1.2equiv),溴乙酸乙酯(0.935mL,8.43mmol,10equiv)依次投入到25mL圓底燒瓶中,升溫至140℃反應20小時,反應完畢,減壓蒸出溴乙酸乙酯,殘留物經柱層析(石油醚:乙酸乙酯=20︰1),得126mg黃色固體,收率46.2%。熔點:152.8-154.0℃。1H NMR(300MHz,CDCl3)δ8.66(brs,1H),8.55(s,1H),8.01(d,J=8.6Hz,1H),6.76(d,J=9.0Hz,1H),6.05(brs,1H),4.31(q,J=7.5Hz,2H),4.13(d,J=5.1Hz,2H),3.40-3.51(m,2H),1.57-1.67(m,2H),1.37-1.49(m,2H),1.33(t,J=7.1Hz,3H),0.97(t,J=7.3Hz,3H).MS(ESI)[M-1]-322.41.
(3)3-氧代-1,2,3,4-四氫喹喔啉-6-甲酸甲酯的製備(4b)
將3b(300mg,0.928mmol),無水甲醇(100mL),10%鈀碳(49mg,0.0464mmol,0.05equiv)依次投入到250mL圓底燒瓶中,氫氣球置換空氣三次,室溫攪拌反應10小時,反應完畢,抽濾,蒸出溶劑,柱層析(200-300目矽膠,二氯甲烷︰甲醇=80:1),得到158mg灰白色固體,收率68.8%。熔點:211.9-213.3℃。1H NMR(300MHz,CD3OD)δ7.32(d,J=8.3Hz,1H),7.24(s,1H),6.67(d,J=8.3Hz,1H),3.92(s,2H),3.32-3.37(m,2H),1.54-1.63(m,2H),1.35-1.44(m,2H),0.96(t,J=7.2Hz,3H).MS(ESI)[M-1]-246.44.
(4)1-(3,4-二甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯丁胺的製備(10f)
將4b(60mg,0.243mmol)、無水四氫呋喃(1.0mL)、無水碳酸鉀(67mg,0.486mmol,2equiv)依次投入到10mL茄型瓶中,用無水四氫呋喃(1.0mL)將化合物9c(2equiv)溶解,慢慢滴加至茄型瓶中,室溫下攪拌反應2小時,減壓蒸除溶劑,用200-300目矽膠柱層析(洗脫劑DCM:MeOH=80︰1),得到55mg白色固體,收率55.1%。熔點:224.5-226.7℃。1H NMR(300MHz,CD3OD)δ7.50(s,1H),7.20(d,J=8.5Hz,1H),6.95-7.02(m,2H),6.89(d,J=8.7Hz,1H),6.79(d,J=8.5Hz,1H),4.50(s,2H),3.82(s,3H),3.69(s,3H),3.31-3.39(m,2H),1.51-1.63(m,2H),1.34-1.42(m,2H),0.95(t,J=7.2Hz,3H).13C NMR(75MHz,CD3OD)δ169.5,168.1,167.4,152.0,148.8,132.1,130.9,130.4,125.8,124.0,122.7,120.5,115.6,112.2,110.6,55.0(2C),39.4,31.2,19.8,12.8.HRMS(ESI):calcd for C22H26N3O5[M+H]+412.18670,found 412.18668.
實施例13
1-(3,4,5-三甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯丁胺(10g)的製備
除步驟(4)中用9d替代9c外,其他步驟及提純方法同實施例12,得到70mg灰白色固體,收率65.3%。熔點:230.5-232.0℃。1H NMR(300MHz,CD3OD)δ7.50(s,1H),7.23(d,J=8.5Hz,1H),6.86(d,J=8.5Hz,1H),6.70(s,2H),4.51(s,2H),3.77(s,3H),3.69(s,6H),3.32-3.37(m,2H),1.52-1.62(m,2H),1.34-1.44(m,2H),0.95(t,J=7.3Hz,3H).13C NMR(75MHz,CD3OD)δ169.4,167.9,167.4,153.1,140.5,132.3,131.0,130.1,129.0,124.1,120.5,115.5,106.3,59.8,55.2,39.4,31.2,19.8,12.7.HRMS(ESI):calcd for C23H28N3O6[M+H]+442.19726,found 442.19727.
實施例14
1-(3,4,5-三甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯環己胺(10h)的製備
除步驟(1)中用環己胺替代正丁胺、步驟(4)中用9d替代9c外,其他步驟及提純方法同實施例12,得到62mg灰白色固體,收率54.6%。熔點:263.9-264.9℃。1H NMR(300MHz,CDCl3)δ9.07(s,1H),7.84(s,1H),7.07(d,J=8.4Hz,1H),6.83(d,J=8.5Hz,1H),6.66(s,2H),5.98(d,J=8.0Hz,1H),4.56(s,2H),4.01-4.10(m,1H),3.88(s,3H),3.73(s,6H),1.99-2.08(m,2H),1.64-1.80(m,3H),1.24-1.53(m,2H),1.25-1.29(m,3H).13C NMR(75MHz,CDCl3)δ169.0,167.0,164.9,153.2,140.8,132.0,130.6,130.2,128.6,124.0,119.8,116.8,106.4,61.0,56.3,49.1,48.1,33.2,25.5,24.8.HRMS(ESI):calcd for C25H30N3O6[M+H]+468.21291,found468.21289.
實施例15
1-(3,4-二甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯苯胺(10i)的製備
除步驟(1)中用苯胺替代正丁胺,其他步驟及提純方法同實施例12,得到54mg白色固體,收率51.5%。熔點:274.7-276.5℃。1H NMR(300MHz,CDCl3)δ8.25(s,1H),7.75(s,1H),7.56-7.65(m,3H),7.38(t,J=7.5Hz,2H),7.22-7.25(m,1H),7.17(t,J=7.0Hz,1H),7.07(s,1H),6.97(d,J=8.8Hz,1H),6.85(d,J=8.4Hz,1H),6.76(d,J=8.3Hz,1H),4.58(s,2H),3.90(s,3H),3.82(s,3H).13C NMR(75MHz,CDCl3)δ167.2,164.0(2C),152.0,149.0,137.5,131.2,129.2,125.5(2C),125.0(2C),124.4,123.0,120.6,120.2,116.0,112.1,110.3,56.0,48.0.HRMS(ESI):calcd for C24H22N3O5[M+H]+432.15540,found 432.15540.
實施例16
1-(3,4-三甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯苯胺(10j)的製備
除步驟(1)中用苯胺替代正丁胺、步驟(4)中用9d替代9c外,其他步驟及提純方法同實施例12,得到62mg白色固體,收率55.3%。熔點:247.1-248.5℃。1H NMR(300MHz,CDCl3)δ9.11(s,1H),8.07(s,1H),7.61-7.66(m,3H),7.36(t,J=7.4Hz,2H),7.27-7.30(m,1H),7.15(t,J=7.0Hz,1H),6.93(d,J=8.3Hz,1H),6.67(s,2H),4.53(s,2H),3.88(s,3H),3.73(s,6H).13C NMR(75MHz,CDCl3)δ169.2,167.3,164.2,153.2,140.9,137.6,132.3,130.5,130.4,129.2,128.4,125.0,124.3,120.8,120.4,116.3,106.4,61.0,56.3,48.2.HRMS(ESI):calcd for C25H24N3O6[M+H]+462.16596,found 462.16595.
實施例17
1-(3,4-二甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯嗎啉胺(10k)的製備
除步驟(1)中用嗎啉替代正丁胺,其他步驟及提純方法同實施例12,得到54mg淡黃色固體,收率50.3%。熔點:204.0-205.1℃。1H NMR(300MHz,CDCl3)δ8.62(s,1H),7.11(d,J=13.8Hz,2H),6.94(d,J=8.6Hz,1H),6.83(s,2H),6.74(d,J=8.1Hz,1H),4.55(s,2H),3.89(s,3H),3.83(s,3H),3.69(brs,4H),3.54-3.58(m,4H).13C NMR(75MHz,CDCl3)δ169.0(2C),167.5,151.9,149.0,132.5,130.2,129.6,125.5,124.2,122.9,121.6,116.1,112.1,110.3,66.8,56.0(2C),48.1.HRMS(ESI):calcd for C22H24N3O6[M+H]+426.16596,found 426.16595.
實施例18
1-(3,4,5-三甲氧基苯甲醯基)-3-氧代-1,2,3,4-四氫喹喔啉-6-甲醯嗎啉胺(10l)的製備
除步驟(1)中用嗎啉替代正丁胺、步驟(4)中用9d替代9c外,其他步驟及提純方法同實施例12,得到59mg淡黃色固體,收率53.3%。熔點:205.5-207.0℃。1H NMR(300MHz,CDCl3)δ8.86(s,1H),7.16(s,1H),6.94(d,J=8.1Hz,1H),6.88(d,J=8.3Hz,1H),6.66(s,2H),4.54(s,2H),3.87(s,3H),3.74(s,6H),3.69(brs,4H),3.50-3.61(m,4H).13C NMR(75MHz,CDCl3)δ169.0,168.8,167.4,153.2,141.0,132.8,130.4,129.0,128.4,124.3,121.5,116.1,106.4,66.8,61.0,56.3,48.3.HRMS(ESI):calcd for C23H26N3O7[M+H]+456.17653,found 456.17651.
下面是本發明所述的部分藥理實驗及結果:
實驗例1:對腫瘤細胞的增殖抑制實驗(MTT實驗)
(1)實驗方法
測試本發明所述化合物對人類肝癌細胞株(SMMC-7721),人類子宮頸癌細胞株(HeLa),人類白血病細胞株(K562)的細胞增殖抑制活性。以上細胞株均由該實驗室凍存和傳代。方法:對於SMMC-7721和HeLa兩種腫瘤細胞,將細胞接種於96孔平底板中(每孔約有4000-6000個細胞),於37℃,5%CO2條件下孵育24小時後,每孔加入不同濃度待測化合物或陽性對照藥,再培養72小時後,各小孔中分別加入50μL MTT的PBS緩衝液(濃度為1mg/mL),與37℃孵育4小時,除去MTT和培養基,每個小孔中分別加入100μL DMSO,於570nm下檢測(Power Wave XS,Bio Tek,美國);對於K562細胞株,將細胞接種於96孔平底板中(每孔約有6000個細胞),與37℃,5%CO2條件下孵育24小時後,每孔加入不同濃度待測化合物或陽性對照藥,再培養72小時後,各小孔中分別加入50μL MTT的無血清培養基溶液(濃度為1mg/mL),與37℃孵育4小時,每小孔中加入50μL三聯溶液(10%SDS,5%異丁醇,0.01mol/L鹽酸),37℃孵育12小時,待溫度降至室溫於570nm下檢測(Power Wave XS,Bio Tek,美國)。選取康普瑞汀(CA-4)、阿黴素為陽性對照藥。對數據進行統計分析。
(2)實驗結果
實驗結果如表1所示。結果顯示該類化合物普遍具有較強的細胞生長抑制作用。化合物5c、10c對細胞生長抑制作用的半數抑制濃度(IC50)達到幾微摩爾/升(μM),化合物10d達到納摩爾水平(nM)。這些化合物的細胞生長抑制活性明顯優於阿黴素。
表1化合物MTT測試結果
說明:表格中化合物CA-4,阿黴素為陽性對照藥,不包含在專利保護範圍。
實驗例2:微管蛋白聚合抑制實驗
(1)實驗方法
測試本發明所述化合物對微管蛋白聚合抑制作用,採用cytoskeleton公司BK011P試劑盒。將96孔板置於多功能酶標儀(CLARIOstar,BMG LABTECH公司,德國)上,37℃預熱10分鐘。按照說明書上操作,配置好紫杉醇溶液(10×)、CA-4溶液(10×)、檢測化合物溶液(10×)、緩衝液1、GTP母液、微管蛋白甘油緩衝液、微管蛋白母液備用,根據實驗選擇合適的比例,將緩衝液1、GTP母液、微管蛋白甘油緩衝液、微管蛋白母液混合配製微管反應液,置於冰浴上。向96孔板中分別加入5μL對照緩衝液、紫杉醇溶液、CA-4溶液、待測化合物溶液(設1復孔),酶標儀上37℃預熱1分鐘,快速加入上面配製好的微管反應液,記錄60分鐘內螢光強度變化。
緩衝液1的配製:①每瓶緩衝液1用10mL Milli-Q超純水溶解其中的物質(共兩瓶);②混合兩瓶中的物質;③將上述緩衝液分裝到13個凍存管中,每管裝1.5mL,-70℃條件下保存。
微管蛋白甘油緩衝液,保存於4℃。
GTP母液的配製:①每管GTP母液用100μL的冰冷無菌蒸餾水溶解其中的物質(共3管);②將其置於冰上;③混合三管中物質;④將上述溶液分裝到13個凍存管中,每管20μL,-70℃條件下保存。
微管蛋白溶液的配製:①將盛裝凍幹微管蛋白的小瓶放在冰上,將液氮置於杜瓦瓶中;②標記12個凍存管並置於冰上待用;③將一個20μLGTP母液除霜;④將1.5mL冰冷的緩衝液1與15μLGTP母液混合;⑤用1.1mL上述混合液溶解微管蛋白凍乾粉末;⑥置於冰上2分鐘待粉末全部溶解懸浮;⑦將上述微管蛋白液分裝到12個細胞凍存管中,每管88μL,置於液氮中迅速冷凍;⑧-70℃條件下保存。
紫杉醇母液配製:100μL DMSO溶解紫杉醇,-70℃條件下保存。
(2)實驗結果
結果顯示化合物5c、10c及10d在20μM具有明顯的抑制微管蛋白聚合抑制作用,化合物10d對微管蛋白聚合抑制作用的半數抑制濃度(IC50)為3.9μM,如附圖1所示。
實驗例3:細胞周期實驗
(1)實驗方法
測試本發明所述化合物對癌細胞周期作用(選取人類子宮頸癌細胞株HeLa),採用PI(碘化丙啶)染色。方法:將細胞接種於6孔平底板中(每孔約有100000個細胞),於37℃,5%CO2條件下孵育24小時後,每孔加入不同濃度10d(0.10μM,0.15μM,0.20μM,0.25μM),設置空白對照組(空白對照組不加化合物10d),於37℃,5%CO2條件下孵育24小時。收集細胞,用預冷PBS(4℃,0.01mol/L)洗滌,將細胞加入到預冷(4℃)的70%(v/v)乙醇中,固定好的細胞-20℃條件下放置過夜。離心,除去乙醇,預冷PBS(4℃,0.01mol/L)洗滌,加入帶有RNase的PI染料於4℃條件下避光染色1小時,離心,除去染料,PBS洗滌,過300目濾網,在流式細胞儀(BD FACSVerse,美國)上進行測試。
(2)實驗結果
結果顯示化合物10d在0.15μM能夠明顯地將細胞阻滯在G2/M生長期。
