一種共表達核糖體蛋白提高外源蛋白表達量的方法與流程
2023-05-02 08:55:36
本發明涉及一種共表達核糖體蛋白提高外源蛋白表達量的方法,屬於酶工程技術領域。
背景技術:
畢赤酵母(komagataellaphaffii,k.phaffii,原命名為pichiapastoris)是重要的蛋白表達平臺微生物,能以甲醇或者甘油作為單一的碳源和能源,其中甲醇可作為誘導劑,誘導醇氧化酶(aox1)啟動子。畢赤酵母表達系統和其它蛋白表達系統相比較,具備如下優勢:具有強誘導性和強啟動性啟動子,利於外源基因高效表達;蛋白質加工摺疊和翻譯後修飾的作用,使外源蛋白的結構與天然蛋白相似,從而表現出一定的生物活性;上清液中內源蛋白分泌量非常少,有利於表達產物的分離純化;外源基因與畢赤酵母染色體通過基因重組的方式整合,避免了外源基因的丟失,為外源蛋白插入酵母並穩定傳代提供了可能。
提高畢赤酵母外源蛋白的表達量是當前微生物研究的重要課題之一,在工業中畢赤酵母中高效表達外源蛋白具有相當高的應用價值。畢赤酵母基因組序列的解讀,有利於根據高產蛋白的特定屬性來改良菌株品系。目前已有多種外源蛋白在畢赤酵母中取得較好的表達效果。
迄今大多數研究都集中在優化發酵條件,建立發酵條件與外源蛋白產量之間關係。但是這種簡單的對應關係,未能明確發酵菌株與蛋白產量之間聯繫的依據。
此外,利用畢赤酵母生產具有較高酶活性的蛋白還面臨一些難題,比如,雖高蛋白表達量,酶活性較低。有研究報導利用伴侶蛋白來促進外源蛋白的摺疊,從而提高蛋白的表達水平,以及比活力。如smit等通過共表達kar2的方式提高了釀酒酵母中葡萄糖苷酶的表達量;盧鑫等在畢赤酵母中共表達伴侶蛋白(pdi和ero1)提高了米根黴脂肪酶的產量;沙衝等進一步研究發現同時共表達伴侶蛋白pdi和ero1,多種伴侶蛋白通過協同作用,可較大程度提高外源蛋白的活力。另有研究報導,共表達伴侶蛋白並不能提高外源蛋白的表達水平,在有些情況下反而使得外源蛋白的表達水平降低,如當在釀酒酵母中共表達scj1時,外源蛋白人白蛋白的表達水平降低了60%(antioxidants&redoxsignaling,2014,21:414-437)。
目前僅僅局限在利用少數幾種伴侶蛋白進行共表達來提高外源蛋白的表達量,急需在研究畢赤酵母高效表達機制的基礎上開發其他新型的能夠促進外源蛋白表達的因子。
技術實現要素:
本發明提供了一種提高畢赤酵母中外源蛋白表達量的方法,所述方法是在表達外源目的蛋白的同時過表達核糖體蛋白rpl10、rpl38、rpl43中的任意一種或者多種。
在一種實施方式中,所述核糖體蛋白rpl10、rpl38、rpl43是來源於畢赤酵母的核糖體蛋白。
在一種實施方式中,所述核糖體蛋白rpl10、rpl38、rpl43的胺基酸序列分別如seqidno:1、seqidno:2、seqidno:3所示。
在一種實施方式中,所述外源目的蛋白可以是磷脂酶、脯氨醯內肽酶、脂肪酶、蛋白酶或糖化酶等。
在一種實施方式中,所述方法是在同一宿主中表達外源蛋白和所述核糖體蛋白。
在一種實施方式中,所述宿主為畢赤酵母。
本發明的第二個目的是提供一種外源蛋白表達量提高的畢赤酵母重組菌,所述畢赤酵母重組菌在表達外源目的蛋白的基礎上,還同時過表達了核糖體蛋白rpl10、rpl38、rpl43中的任意一種或者多種。
在一種實施方式中,所述表達核糖體蛋白rpl10、rpl38、rpl43的胺基酸序列分別如seqidno:1、seqidno:2、seqidno:3所示。
在一種實施方式中,所述外源目的蛋白可以是磷脂酶、脯氨醯內肽酶、脂肪酶、蛋白酶或糖化酶等。
在一種實施方式中,所述外源目的蛋白為紫紅鏈黴菌磷脂酶a2。
在一種實施方式中,所述畢赤酵母重組菌是以畢赤酵母gs115、x33、km71、km71h、smd1168、smd1163等中的任意一種為宿主菌構建得到的。
在一種實施方式中,所述畢赤酵母重組菌是以ppic9k、ppicza/b/c、ppic9k-his、ppic3.5k、ppiczalphaa/b/c、pgapzalpha、pao815、phil-s1、ppinkhc等中的任意一種為質粒載體構建得到的。
本發明的第三個目的是提供所述畢赤酵母重組菌的應用。
在一種實施方式中,所述應用是應用於食品、釀造、造紙、製革、製糖、化工等領域,更具體地,是應用於食品與釀造領域。
本發明的優點和效果:
本發明通過在表達外源目的蛋白的同時過表達核糖體蛋白rpl10、rpl38、rpl43,顯著提高了外源目的蛋白的表達量。
附圖說明
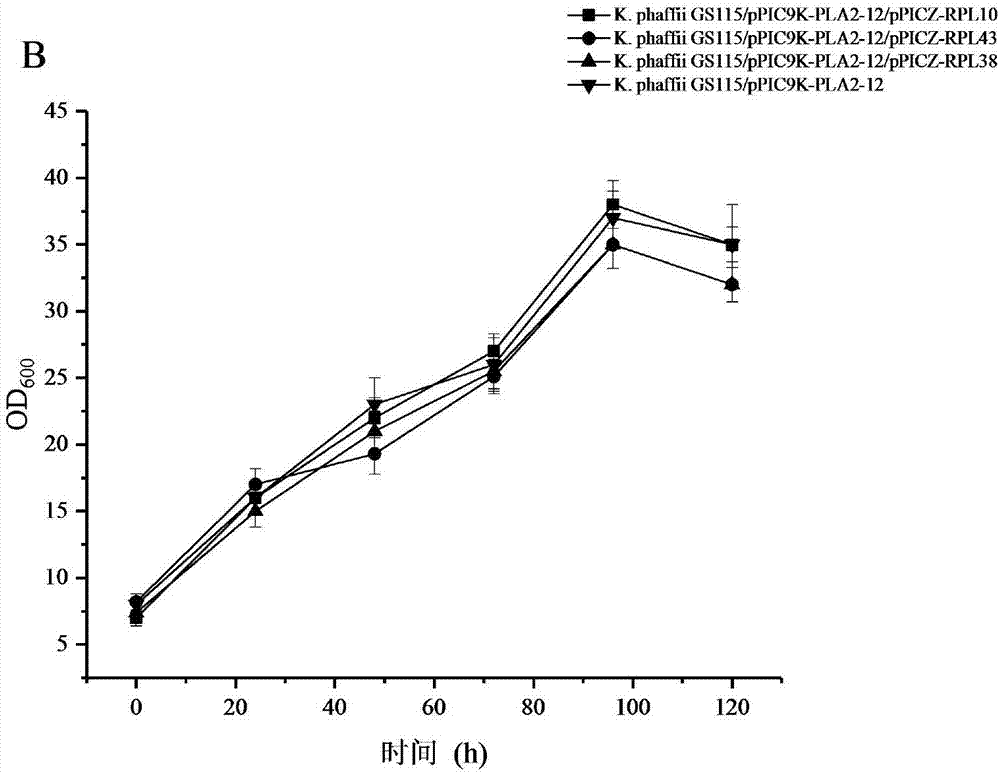
圖1為含磷脂酶菌株共表達核糖體蛋白菌體濃度搖瓶發酵曲線;
圖2為含磷脂酶菌株共表達核糖體蛋白菌體濃度搖瓶發酵曲線;
圖3為含磷脂酶菌株共表達核糖體蛋白產外源蛋白搖瓶發酵曲線;
圖4為含磷脂酶菌株共表達核糖體蛋白產外源蛋白搖瓶發酵曲線;
圖5為含磷脂酶菌株共表達核糖體蛋白產磷脂酶酶活搖瓶發酵曲線;
圖6為含磷脂酶菌株共表達核糖體蛋白產磷脂酶酶活搖瓶發酵曲線;
圖7為含脯氨醯內肽酶菌株共表達核糖體蛋白菌體濃度搖瓶發酵曲線;
圖8為含脯氨醯內肽酶菌株共表達核糖體蛋白產外源蛋白搖瓶發酵曲線;
圖9為含脯氨醯內肽酶菌株共表達核糖體蛋白產脯氨醯內肽酶酶活搖瓶發酵曲線。
具體實施方案
(1)生物量測定
採用細胞乾重(dcw)表示。取樣後置於離心機中離心(12000r·min-1,6min),將菌體保留,加生理鹽水懸浮菌體,重複離心去上清,然後放置在90℃烘箱中烘乾得細胞乾重。
(2)蛋白含量測定
利用考馬斯亮藍法測定發酵液上清中總蛋白濃度。取上述發酵上清液,測定595nm波長下測吸光度,每組設置三個平行,計算上清液中總蛋白濃度。
(3)磷脂酶活力測定
使用spla2assaykit測定磷脂酶a2酶活力,方法步驟見說明書。
(4)脯氨醯內肽酶酶活力測定方法
具體操作步驟見文獻(journalofmolecularcatalysisb:enzymatic,2016,125:81-87)。酶活計算公式為:
其中,u·ml-1:酶活力單位;δa:反應體系吸光度變化;v:總反應體系(ml);v:發酵液體積(ml);γ:摩爾消光係數(cm2·mol-1);β:比色杯光程(cm)。
下面是對本發明進行具體描述。
實施例1:共表達核糖體蛋白相關基因菌株的構建
以小分子量蛋白磷脂酶(21kd)以及大分子量蛋白脯氨醯內肽酶(66kd)兩種蛋白作為外源目的蛋白表達對象,構建共表達核糖體蛋白相關基因的重組菌株。
具體是:
(1)通過pcr方法擴增畢赤酵母核糖體蛋白(rpl10、rpl38、rpl43)的基因序列(核苷酸序列分別如seqidno:4、seqidno:5、seqidno:6所示),並在序列兩端添加酶切位點。用限制性內切酶asuii和noti分別對質粒ppicza和基因片段進行雙酶切,膠回收目的片段,利用t4dna連接酶連接目的基因和載體,轉化至dh5α感受態細胞,篩選驗證獲得重組質粒。
(2)將上述構建的重組質粒用限制性內切酶pmei酶切線性化,膠回收目的片段,分別電轉感受態細胞(畢赤酵母k.phaffiigs115/ppic9k-mlmh、gs115/ppic9k-pla2-1和gs115/ppic9k-pla2-12感受態細胞),培養並驗證陽性菌株,得到了如表1所示的畢赤酵母重組菌。
其中,表達紫紅鏈黴菌磷脂酶a2的畢赤酵母菌株k.phaffiigs115/ppic9k-pla2-1(含1拷貝磷脂酶基因)、k.phaffiigs115/ppic9k-pla2-12(含12拷貝磷脂酶基因)為本實驗室之前構建的菌株(參見:劉愛霞,碩士畢業論文,江南大學,2015年)。gs115/ppic9k-mlmh代表以k.phaffiigs115為宿主、ppic9k為載體,重組表達了脯氨醯內肽酶融合蛋白mlmh的重組菌,具體是從質粒ppicza-mlmh(journalofmolecularcatalysisb:enzymatic,2016,125:81-87)中pcr克隆得到mlmh基因,通過酶切連接構建質粒ppic9k-mlmh,然後轉化到k.phaffiigs115宿主中得到gs115/ppic9k-mlmh。
表1共表達核糖體蛋白和外源目的蛋白的畢赤酵母重組菌列表
實施例2:
以小分子量蛋白磷脂酶(21kd)以及大分子量蛋白脯氨醯內肽酶(66kd)兩種蛋白作為外源目的蛋白表達對象,分析含有核糖體蛋白相關基因的重組菌株對外源目的蛋白表達的影響。
其中畢赤酵母搖瓶發酵方法如下:
將甘油管保藏菌株用平板劃線法培養,30℃培養3–5d。挑取單克隆至bmgy培養基中,在30℃200r·min-1條件下培養16h–18h至od600達到2–6。將菌液在無菌條件下轉移至無菌的離心管中,在6000r·min-1條件下離心10min,棄掉上清收集菌體,用bmmy培養基重懸菌體,28℃250r·min-1條件下培養,每24h添加1%的甲醇誘導表達,定時取樣測定發酵液的菌體濃度和發酵上清液的蛋白濃度。
(1)產磷脂酶重組菌株共表達核糖體蛋白相關基因的搖瓶發酵結果
將構建的共表達核糖體蛋白菌株(表1)與出發菌株(gs115/ppic9k-pla-1和gs115/ppic9k-pla-12)進行搖瓶發酵。結果顯示,從圖1和圖2中可以看出,菌體生長趨勢相接近,而與對照菌株相比較,共表達核糖體蛋白能夠促進磷脂酶的表達水平,共表達核糖體蛋白促進磷脂酶表達的程度依次是rpl10,rpl43和rpl38(圖3、圖4)。其中,共表達核糖體蛋白rpl10使得總蛋白濃度最高增加了14.7%,胞外酶活力增加了16.9%(圖5、圖6)。
從圖5中可以看出,共表達rpl10、rpl43、rpl38和1拷貝磷脂酶基因的重組菌菌株在發酵84h下達到的磷脂酶酶活分別為0.47u·l-1、0.45u·l-1、0.44u·l-1,相比對照菌株gs115/ppic9k-pla-1,分別提高了1.12倍、1.08倍、1.05倍。
從圖6中可以看出,共表達rpl10、rpl43、rpl38和12拷貝磷脂酶基因的重組菌在發酵84h下達到的磷脂酶酶活分別為0.62u·l-1、0.58u·l-1、0.56u·l-1,相比對照菌株gs115/ppic9k-pla-12,分別提高了1.15倍、1.07倍、1.04倍。
(2)產脯氨醯內肽酶重組菌株共表達核糖體蛋白相關基因搖瓶發酵
以表達脯氨醯內肽酶基因的畢赤酵母作為對照菌株,分析共表達核糖體蛋白對其的影響,結果如圖7、圖8、圖9所示。
如圖7所示,共表達核糖體蛋白菌株與對照菌株(k.phaffiigs115/ppic9k-mlmh)菌體濃度(od600)生長趨勢相似。
如圖8所示,共表達核糖體蛋白促進脯氨醯內肽酶表達的程度依次是rpl10,rpl38和rpl43。脯氨醯內肽酶蛋白濃度最高的菌株是gs115/ppic9k-mlmh/ppicz-rpl10,胞外總蛋白濃度為0.25g·l-1。共表達rpl38和rpl43菌株蛋白濃度分別為0.22g·l-1、0.24g·l-1。
如圖9所示,當發酵96h時,共表達菌株rpl10,rpl38、rpl43的脯氨醯內肽酶酶活分別為190u·l-1、185u·l-1、180u·l-1,與對照菌gs115/ppic9k-mlmh的磷脂酶酶活175u·l-1相比,分別提高了1.09倍、1.06倍、1.03倍。
從本次實驗結果證明,共表達核糖體蛋白也可以提高脯氨醯內肽酶的表達量及酶活。
雖然本發明已以較佳實施例公開如上,但其並非用以限定本發明,任何熟悉此技術的人,在不脫離本發明的精神和範圍內,都可做各種的改動與修飾,因此本發明的保護範圍應該以權利要求書所界定的為準。
序列表
江南大學
一種共表達核糖體蛋白提高外源蛋白表達量的方法
6
patentinversion3.3
1
222
prt
人工序列
1
metalaargargproalaargcystyrargtyrcyslysasnlyspro
151015
pheprolysserargtyrasnargglyvalproaspprolysilearg
202530
iletyraspleuglyarglyslysalaalavalaspasppheproleu
354045
cysvalhisleuvalserasngluilegluglnleusersergluala
505560
leuglualaalaargilecysalaasnlystyrilethrthrglnser
65707580
glyargaspserphehisleuargileargvalhisprotyrhisval
859095
leuargileasnlysmetleusercysalaglyalaaspargleugln
100105110
glnglymetargglyalatrpglylysprohisglyleualaalaarg
115120125
valthrileglyglnileleumetserileargthrlysaspserasn
130135140
lysalavalvalilegluglyleuargargserargtyrlysphepro
145150155160
glyglnglnlysileileileserlyslystrpglyphethrproleu
165170175
asparggluasptyrilevallysargalaserglygluileargasp
180185190
aspglyalatyrvallyspheleuthrlyslysglyproleuglnglu
195200205
asnleugluglnpheproasptyrasntyralaglualaasn
210215220
2
132
prt
人工序列
2
metiletyrleulysthrmetleulyscysileaspasnserglyala
151015
glnmetvalglucysilelysvalleuarglysasnprolysasnphe
202530
alaserileglyasplysilevalcysvalvalglnlysalaargpro
354045
serthrserthrilethrglyalaseralaserasnargvallysarg
505560
glyaspilevalargalavalilevalargthrlyslysgluthrgln
65707580
argproaspglyservalileargpheaspaspasnalacysvalleu
859095
leuasnlysasnaspgluproilealathrargileserservalval
100105110
alalysgluleuargasplysasnpheasnlysilevalserleuala
115120125
prolysvalval
130
3
92
prt
人工序列
3
metserlysargthrlyslysvalglyilealaglylystyrglyval
151015
argtyrglyserserleuarglysglncyslyslysleugluthrgln
202530
glnhisalalystyraspcysalaphecysglylyslysthrvallys
354045
argglnalathrglyiletrpsercyslysalacyslyslysthrval
505560
alaglyglyalatyrthrvalserthralaalaalaalathrvalarg
65707580
serthrileargargleuargglumetalagluala
8590
4
669
dna
人工序列
4
atggctagaagaccagctagatgttacagatactgcaagaacaagccgttcccaaagtcc60
agatacaaccgtggtgtcccagatcctaagatcagaatttatgacttgggtagaaagaag120
gctgctgtcgatgacttcccattgtgtgttcacttggtttccaacgagattgagcaactg180
tcttccgaggctttggaagccgctcgtatctgtgctaacaagtacattaccacacaatct240
ggtagagattcattccacttgagaatcagagtccacccataccatgtcttacgtatcaac300
aagatgttgtcttgtgccggtgccgatagattgcaacaaggtatgagaggtgcttggggt360
aagccacacggtttggccgctcgtgtcaccattggtcaaattctgatgtctatcagaacc420
aaggactctaacaaggccgtcgttattgagggtctcagaagatcccgttacaagttccca480
ggtcaacaaaagatcattatctccaagaagtggggtttcactccactggaccgtgaggac540
tacattgtcaagagagctagtggtgagatcagagacgatggtgcttacgtcaagttcctg600
accaagaagggtcctttgcaagagaacttggagcaattcccagactacaactacgccgag660
gctaattag669
5
399
dna
人工序列
5
atgatataccttaagacgatgcttaaatgcatcgacaattctggtgcgcagatggttgaa60
tgcatcaaggtgttgagaaagaacccgaagaactttgcttccattggagacaagattgtc120
tgtgtggtgcagaaggccagaccttccacttccacgatcactggtgcttcggcttctaac180
agagtcaaaaggggagacatagtccgggcagttattgtgagaacaaagaaggaaactcag240
agaccagatggttcagtgatcagatttgatgataacgcatgtgttctgttgaacaagaat300
gatgaacccatagccaccagaatcagtagcgttgtagccaaggagctgcgtgacaagaac360
tttaacaaaatagtatcgttggcgcccaaggtcgtgtag399
6
279
dna
人工序列
6
atgtctaagagaactaagaaggtaggaattgccggtaaatatggtgtccgttacggttca60
tctctgagaaagcaatgtaagaagttggagactcagcaacacgccaagtacgactgtgca120
ttctgtggtaagaagactgtcaagagacaggctactggtatctggtcttgcaaggcttgc180
aagaagaccgttgctggtggtgcttacactgtttccactgctgctgccgccactgtcaga240
tccaccatcagacgtttgagagagatggctgaggcatga279
