免疫原性突變體肽篩選平臺的製作方法
2024-03-01 05:32:15 1
對相關申請的交叉引用
本申請要求2014年9月10日提交的美國臨時申請no.62/048,742的優先權,通過提及將其全部完整收入本文用於所有目的。
ascii文本文件上的序列表的提交
通過提及將ascii文本文件上的以下提交的內容整體收入本文:序列表的計算機可讀形式(crf)(文件名:146392027600seqlist.txt,記錄日期:2015年9月9日,大小:6kb)。
發明領域
本公開內容涉及鑑定可用於開發免疫治療劑的突變體肽的方法。
發明背景
牽涉細胞介導的免疫的細胞毒性t淋巴細胞(細胞毒性t細胞或cd8t細胞)通過在細胞表面上掃描肽表位或抗原監測細胞健康的變化。肽表位源自細胞蛋白,並且充當允許細胞呈現當前細胞過程的證據的顯示機制。處理天然的和非天然的蛋白質(通常分別稱為自身和非自體)進行肽表位呈遞。自天然蛋白質周轉和有缺陷的核糖體產物衍生大多數自身肽。可以自事件(諸如病毒性和細菌性感染、疾病和癌症)過程中生成的蛋白質衍生非自身肽。
人腫瘤在特徵上含有大量的體細胞突變。繼而,含有突變的肽的表達可以由適應性免疫系統識別為非自身新表位。在識別非自身抗原時,細胞毒性t細胞會觸發免疫應答,導致展示非自身新表位的細胞的凋亡。細胞毒性t細胞免疫應答是適應性免疫系統的高度特異性機制,並且是用於消除感染的、患病的和癌性的細胞的有效手段。在鑑定免疫原性表位中具有較大的治療價值,因為可以使用經由疫苗接種對免疫原性表位的暴露觸發期望的細胞毒性t細胞免疫應答。幾十年來,科學和醫學界中已經知道了免疫原性表位的作用,但是鑑定驅動有效抗腫瘤cd8t細胞應答的抗原仍然在很大程度上是未知的。牽涉表位呈現和細胞毒性t細胞活化的複雜性已經使它們的發現和治療用途陷入困境。
主要組織相容性複合體(mhc)i類分子負責肽表位呈遞給細胞毒性t細胞。在人中,人白細胞抗原(hla)系統是編碼mhci類和ii類分子的基因的基因座。hla-a、-b和-c基因編碼mhci類(mhci)蛋白質。長度通常為8-11個胺基酸的肽經由與由位於反平行β片層上方的兩個α螺旋形成的溝的相互作用結合mhci分子。肽-mhc類i(pmhci)分子的加工和呈遞牽涉一系列序貫階段,其包括:a)蛋白質酶介導的對蛋白質的消化;b)與抗原加工有關的轉運蛋白(tap)介導的將肽轉運入內質網(er)中;c)使用新合成的mhci分子形成pmhci;和d)將pmhci轉運至細胞表面。
在細胞表面上,pmhci會經由t細胞受體(tcr)與細胞毒性t細胞相互作用。在複雜的pmhci-tcr相互作用後,非自身抗原的鑑定可以經由由關聯的酶、共受體、銜接頭分子、和轉錄因子介導的一系列生物化學事件而導致細胞毒性t細胞活化。活化的細胞毒性t細胞將會增殖以生成表達對鑑定的免疫原性肽表位特異性的tcr的效應t細胞群體。對鑑定的非自身表位具有tcr特異性的t細胞的擴增導致展示活化的非自身表位的細胞的免疫介導的凋亡。
目前正在研究使用免疫原性表位激活免疫系統以用於癌症療法。雖然癌細胞源自正常組織,但是體細胞突變會驅動癌症蛋白酶體的大量變化。繼而,所得的mhci呈遞的肽表位,稱為腫瘤相關抗原(taa)或新表位,允許正常和癌組織之間的細胞毒性t細胞分化。最近的工作已經證實,突變體肽可以充當由cd4或cd8t細胞識別為非自身的表位,但是從此以後已經很少描述突變體新表位。
基於肽的免疫療法的使用取決於會刺激期望的細胞毒性t細胞應答的肽表位的選擇。具體地,腫瘤抗原可以分成兩類:腫瘤相關自身抗原(例如癌-睪丸抗原,分化抗原)和自共享的或患者特異性的突變體蛋白衍生的抗原。由於胸腺中自身抗原的呈現可以導致高親合力t細胞的消除,突變體新抗原可能更具免疫原性。此類免疫治療性表位的開發是一項有挑戰性的追求,並且可用於鑑定有效表位的有效方法尚有待開發。
在免疫原性肽表位的鑑定和驗證中牽涉的時間和成本密集性性質妨礙了有效的基於肽的癌症疫苗的開發。為了使鑑定免疫原性表位中牽涉的問題進一步複雜化,癌細胞中的突變的排列經常是患者特異性的。突變體新表位的發現需要對患者的腫瘤浸潤淋巴細胞費力篩選它們識別抗原的能力,所述抗原來自基於來自所述患者的腫瘤外顯子組序列的信息構建的文庫。或者,可以通過質譜術檢測突變體新表位。然而,突變序列已經逃避檢測,因為使用不含有患者特異性突變的公共蛋白質組資料庫不允許其鑑定。使用諸如肽-mhci結合或肽免疫原性的預測算法可以在鑑定個性化免疫原性表位中具有潛在的應用。但是,癌細胞中含有的大量體細胞突變和表達水平變化導致預測的免疫原性表位的量級對於高通量免疫原性篩選而言太大。此外,預測表位的較差的免疫原性的證據使當前方法的效用受到質疑。
本領域中需要鑑定適合於用於基於肽的免疫療法的免疫原性表位。具體地,本領域中需要鑑定用於基於肽的癌症療法中的免疫原性表位。此外,本領域中需要用於基於個性化遺傳和/或蛋白質組學分析預測免疫原性表位的高通量方法。
在此通過提及收錄本文中引用的所有參考文獻。
發明概述
在一方面,本申請提供了鑑定疾病特異性免疫原性突變體肽的方法,其包括:a)提供個體中的疾病組織的變體編碼序列組,每種變體編碼序列與參照樣品相比具有序列中的變異;並且b)自所述變體編碼序列組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由所述變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,所述方法包括a)基於個體中的疾病組織的基因組序列獲得變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中的疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列編碼的肽結合mhci類分子(mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組;並且d)自第三組選擇免疫原性變體編碼序列,包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性;由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,依照上文描述的任何方法,方法還包括i)自疾病組織獲得多個與mhci分子結合的肽;ii)使mhci結合肽受到基於質譜術的測序;iii)將mhci結合肽的質譜術衍生的序列信息與免疫原性變體編碼序列關聯。
在另一方面,本申請提供了鑑定疾病特異性免疫原性突變體肽的方法,其包括:a)自個體的患病組織獲得與mhc分子結合的多個肽;b)使mhc結合的肽經受基於質譜術的測序;並且c)將mhc結合的肽的質譜術衍生的序列信息與個體中的疾病組織的變體編碼序列組關聯,每種變體編碼序列與參照樣品相比具有序列中的變異,由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,所述方法包括a)基於個體中的疾病組織的基因組序列獲得變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中的疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列編碼的肽結合mhci類分子(mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組;d)自疾病組織獲得與mhci分子結合的多個肽;e)使mhci結合肽經受基於質譜術的測序;f)將mhci結合肽的質譜術衍生的序列信息與表位變體編碼序列的第三組關聯;由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括預測疾病特異性免疫原性突變體肽的免疫原性,其中疾病特異性免疫原性突變體肽包含變體胺基酸。
依照包括預測免疫原性的步驟的任何上文描述的方法,預測免疫原性基於下列一項或多項參數:i)肽對mhci分子的結合親和力;ii)含有肽的肽前體的蛋白質水平;iii)編碼肽前體的轉錄物的表達水平;iv)通過免疫蛋白酶體對肽前體的加工效率;v)編碼肽前體的轉錄物的表達時機;vi)肽對tcr分子的結合親和力;vii)變體胺基酸在肽內的位置;xiii)在與mhci分子結合時肽的溶劑暴露;ix)在與mhci分子結合時變體胺基酸的溶劑暴露;和x)肽中芳香族殘基的含量;xi)在與野生型殘基相比時變體胺基酸的特性;xii)肽前體的性質。在一些實施方案中,預測免疫原性進一步基於hla分型分析。
在一些實施方案中,依照包括自疾病組織獲得與mhci分子結合的多個肽的步驟的上文描述的方法之任一種,通過自疾病組織分離mhci/肽複合物並且自mhci洗脫肽獲得與mhci結合的肽。在一些實施方案中,通過免疫沉澱實施mhci/肽複合物的分離。在一些實施方案中,使用對mhci特異的抗體實施免疫沉澱。在一些實施方案中,在進行質譜術分析前通過層析進一步分開所分離的肽。
在一些實施方案中,依照包括獲得變體編碼序列的第一組的步驟的上文描述的方法之任一種,獲得變體編碼序列的第一組包括i)基於個體中的疾病組織的基因組序列獲得變體序列的第一組,每種變體序列與參照樣品相比具有序列中的變異;並且ii)自變體序列的第一組鑑定變體編碼序列。
在一些實施方案中,依照上文描述的任何方法,其中方法還包括基於鑑定的疾病特異性免疫原性突變體肽的序列合成肽。在一些實施方案中,依照上文描述的任何方法,方法還包括基於鑑定的疾病特異性免疫原性突變體肽的序列合成編碼肽的核酸。在一些實施方案中,方法還包括在體內對合成的肽測試免疫原性。
在一些實施方案中,依照上文描述的任何方法,疾病是癌症。在一些實施方案中,依照上文描述的任何方法,個體是人。
在另一方面,本申請還提供了通過本文中描述的任何方法鑑定的疾病特異性突變體肽或疾病特異性突變體肽的組合物。在一些實施方案中,組合物包含兩種或更多種本文中描述的疾病特異性免疫原性突變體肽。在一些實施方案中,組合物還包含佐劑。
在又一方面,本申請還提供了治療個體中的疾病的方法,其包括對個體施用有效量的組合物,所述組合物包含用本文中公開的用於鑑定疾病特異性免疫原性突變體肽的任何方法鑑定的疾病特異性突變體肽。在一些實施方案中,個體是鑑定疾病特異性免疫原性突變體肽的同一個體。
本申請還提供了免疫原性組合物,其包含至少一種疾病特異性肽或此類疾病特異性肽的前體,其中通過本文中描述的任何方法鑑定所述疾病特異性肽。在一些實施方案中,免疫原性組合物包含多種疾病特異性肽。
本申請還提供了包含至少一種編碼疾病特異性肽的核酸的免疫原性組合物,其中通過本文中描述的任何方法鑑定所述疾病特異性肽。在一些實施方案中,免疫原性組合物包含多種各自編碼至少一種疾病特異性肽的核酸。在一些實施方案中,免疫原性組合物包含編碼兩種或更多種(諸如3、4、5、6、7、8、9或更多種)疾病特異性肽的核酸。
在又一方面,本申請還提供了在具有疾病的個體中刺激免疫應答的方法,其包括施用本文中描述的任何免疫原性組合物。在一些實施方案中,方法還包括施用另一種藥劑。在一些實施方案中,另一種藥劑是免疫調節劑。在一些實施方案中,另一種藥劑是檢查點蛋白。在一些實施方案中,其它藥劑是pd-1的拮抗劑(諸如抗pd1抗體)。在一些實施方案中,其它藥劑是pd-l1的拮抗劑(諸如抗pd-l1抗體)。
在另一方面,本申請還提供了在具有疾病的個體中刺激免疫應答的方法,其包括:a)依照上文描述的鑑定方法之任一種自個體中的疾病組織鑑定疾病特異性免疫原性突變體肽,b)基於鑑定的疾病特異性免疫原性突變體肽的序列生成包含肽或編碼肽的核酸的組合物;c)對個體施用組合物。在一些實施方案中,方法還包括對個體施用pd-1拮抗劑(諸如抗pd1抗體)。在一些實施方案中,方法還包括對個體施用pd-l1拮抗劑(諸如抗pd-l1抗體)。
附圖簡述
圖1顯示了免疫原性肽鑑定的例示性方法。
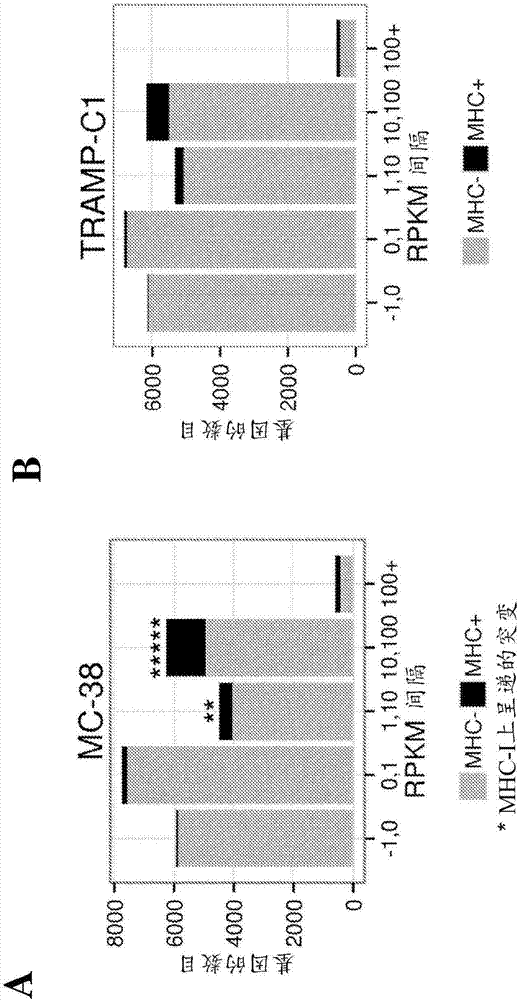
圖2a顯示了相對於測量的每百萬個定位讀段每千鹼基外顯子模型的讀段(rpkm),鑑定為mc-38細胞系的mhc分子上呈遞的表位的鑑定基因的分布。
圖2b顯示了相對於測量的rpkm,鑑定為tramp-c1細胞系的mhc分子上呈遞的表位的鑑定基因的分布。
圖3顯示了與mhc分子結合的肽的結構建模。
圖4a顯示了用選擇肽免疫的野生型c57bl/6小鼠中肽特異性cd8t細胞的百分比。
圖4b顯示了脾和腫瘤中dextramer陽性cd8t細胞的百分比。
圖4c顯示了相對於腫瘤體積的cd8t細胞和cd45t細胞的測量。
圖4d顯示了在總cd8til群體和adpgk陽性cd8til群體中共表達pd-1和tim-3的腫瘤特異性cd8til的百分比。
圖5a顯示了用mc-38腫瘤細胞的腫瘤攻擊後用對照和免疫原性疫苗處理的小鼠的腫瘤體積,和疫苗接種後adpgk陽性cd8t細胞的百分比。箭標示來自單一動物的測量。
圖5b顯示脾和腫瘤中肽特異性cd8t細胞的百分比。
圖5c顯示了以表達cd45的t細胞和表達cd8的t細胞測量的腫瘤中活細胞的百分比。
圖5d顯示了疫苗接種後總cd8t細胞群體中共表達pd-1和tim-3的adgpk特異性cd8til的百分比。
圖5e顯示了疫苗接種後pd-1和tim-3表面表達水平。
圖5f顯示了疫苗接種後腫瘤和脾臟中表達ifn-γ的cd8和cd4til的百分比。
圖5g顯示了疫苗接種後腫瘤體積的測量。
發明詳述
本申請提供了用於鑑定疾病特異性免疫原性突變體肽的高效率篩選平臺。通過將基於序列的變體鑑定方法與免疫原性預測和/或質譜術組合,本文中描述的方法允許自個體的疾病組織(諸如腫瘤細胞)有力且有效鑑定疾病特異性免疫原性突變體肽。這些肽或基於核苷酸的前體(例如dna或rna)可用於多種不同的應用,諸如疫苗的開發、突變體肽特異性治療劑(諸如抗體治療劑或基於t細胞受體(「tcr」)的治療劑)的開發、以及用於監測t細胞應答的動力學和分布的工具的開發。例如,可以利用個別的肽或肽組進行比較結合親和力測量或將個別的肽或肽組多聚化以通過mhc多聚體流式細胞術測量抗原特異性t細胞應答。本文中描述的方法在個性化醫學的背景中是特別有用的,其中可以使用自患病個體鑑定的突變體肽開發用於治療相同個體的治療劑(例如基於肽、dna、或rna的疫苗)。
如此,在一方面,本申請提供了自個體的疾病組織鑑定疾病特異性免疫原性突變體肽的方法,其通過組合基於序列的變體鑑定方法與免疫原性預測進行。
在另一方面,本申請提供了自個體的患病組織鑑定疾病特異性免疫原性突變體肽的方法,其通過將基於序列的變體鑑定方法與質譜術組合進行。
還提供了可用於本文中描述方法的試劑盒和系統。進一步包括免疫原性組合物,其包含肽、呈遞此類肽的細胞、和編碼鑑定的此類肽的核酸。
定義
如本公開內容中使用的,單數形式「一個」、「一種」和「所述/該」具體還涵蓋它們所指的術語的複數形式,除非上下文另有明確規定。本文中提及「約」數值或參數包括(並且描述)針對所述數值或參數本身的變化。例如,提及「約x」的描述包括「x」的描述。
應當理解,本文中描述的本發明的方面和實施方案包括「由方面和實施方案組成」和/或「基本上由方面和實施方案組成」。
如本文中使用的,「疾病特異性突變體肽」是指包含存在於疾病組織中但不在正常組織中的至少一種突變胺基酸的肽。「疾病特異性免疫原性突變體肽」是指能夠在個體中引發免疫應答的疾病特異性突變體肽。疾病特異性突變體肽可以源自例如:導致蛋白質中不同胺基酸的非同義突變(例如點突變);連讀突變,其中修飾或刪除終止密碼子,導致在c端具有新的腫瘤特異性序列的較長蛋白質的翻譯;剪接位點突變,其導致成熟mrna中的內含子納入,並且如此產生獨特的腫瘤特異性蛋白質序列;染色體重排,其產生在2種蛋白質的接合處具有腫瘤特異性序列的嵌合蛋白(即基因融合);和移碼突變或刪除,其導致具有新腫瘤特異性蛋白質序列的新可讀框。參見例如sensi和anichini,clincancerres,2006,v.12,5023-5032。
如本文中使用的,「變體編碼序列」是指與參照樣品中的序列相比具有變異的序列,其中序列變異導致變體編碼序列中含有的或由變體編碼序列編碼的胺基酸序列的變化。變體編碼序列可以是具有導致編碼胺基酸序列中的胺基酸變化的突變的核酸序列。或者,變體編碼序列可以是含有胺基酸突變的胺基酸序列。
「表達變體編碼序列」是指在個體的疾病組織中表達的變體編碼序列。
「編碼」肽的核酸序列是指含有肽的編碼序列的核酸。「編碼」肽的胺基酸序列是指含有肽序列的胺基酸序列。
「表位變體編碼序列」是指編碼結合或預測結合mhc分子(諸如mhci類分子或mhci)的肽的變體編碼序列。
「免疫原性變體編碼序列」是指編碼預測為免疫原性的肽的變體編碼序列。
如本文中使用的,術語「疾病組織」是指與個體中的疾病相關的組織,並且包括多個細胞。「疾病組織樣品」是指疾病組織的樣品。
本文中使用的「肽前體」是指存在於包含感興趣肽的個體的疾病組織中的多肽。例如,肽前體可以是存在於疾病組織中的多肽,其可以通過免疫蛋白酶體加工以生成感興趣的肽。
鑑定免疫原性突變體肽的方法
在一方面,本申請的方法將序列特異性變體鑑定方法與免疫原性預測方法組合。例如,在一些實施方案中,提供了自個體中的疾病組織鑑定疾病特異性免疫原性突變體肽的方法,其包括:a)提供個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;並且b)自變體編碼序列的第一組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,提供了鑑定來自個體的疾病組織的疾病特異性免疫原性突變體肽的方法,所述疾病特異性免疫原性突變體肽充當疾病組織中的新表位。在一些實施方案中,變體編碼序列組包含超過1、10、100、1000或10,000種不同變體編碼序列。在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;並且b)自變體編碼序列的第一組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,選擇步驟包括基於一項或多項(例如2、3、4、5、6、7、8、9、10或11之任一種)參數預測肽的免疫原性:i)肽對mhci分子的結合親和力;ii)含有肽的肽前體的蛋白質水平;iii)編碼肽前體的轉錄物的表達水平;iv)通過免疫蛋白酶體對肽前體的加工效率;v)編碼肽前體的轉錄物的表達時機;vi)肽對tcr分子的結合親和力;vii)變體胺基酸在肽內的位置;xiii)在與mhci分子結合時肽的溶劑暴露;ix)在與mhci分子結合時變體胺基酸的溶劑暴露;和x)肽中芳香族殘基的含量;xi)在與野生型殘基相比時變體胺基酸的特性(例如自帶電荷變化至疏水性或者反之亦然);xii)肽前體的性質。
在一些實施方案中,可以首先過濾變體編碼序列的第一組以獲得編碼預測結合mhc分子的肽的變體編碼序列(稱為「表位變體編碼序列」)的較小組,然後基於免疫原性的預測對變體編碼序列的較小組進行選擇。在此類實施方案中,方法可以包括:a)提供個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,並且c)自表位變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,並且c)自表位變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;並且b)自變體編碼序列的第一組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,通過全基因組測序獲得基因組序列。在一些實施方案中,通過全外顯子組測序獲得基因組序列。在一些實施方案中,通過靶向基因組或外顯子組測序獲得基因組序列。例如,可以首先通過探針組(例如對疾病關聯基因特異性的探針)富集疾病組織和/或參照樣品中的基因組序列,之後加工以進行變體鑑定。在一些實施方案中,可以首先過濾變體編碼序列的第一組以獲得表位變體編碼序列的較小組,然後基於免疫原性的預測對變體編碼序列的較小組進行選擇。例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,並且c)自表位變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,該疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的轉錄物組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;並且b)自變體編碼序列的第一組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,通過全轉錄物組rna-seq測序獲得轉錄物組序列。在一些實施方案中,通過靶向轉錄物組測序獲得轉錄序列。例如,可以首先通過探針組(例如對疾病關聯基因特異性的探針)富集疾病組織和/或參照樣品中的rna或cdna序列,然後加工以進行變異鑑定。在一些實施方案中,可以首先過濾變體編碼序列的第一組以獲得表位變體編碼序列的較小組,然後對變體編碼序列的較小組進行免疫原性的預測。例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的轉錄物組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由表位變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,並且c)自變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;並且c)自表達變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表達變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)基於個體中疾病組織的基因組序列獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;並且c)自表達變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表達變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,可以過濾表達變體編碼序列的第二組以獲得表位變體編碼序列的較小組,然後對變體編碼序列的較小組進行免疫原性的預測。如此,例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中疾病組織的基因組序列,提供個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列的第二組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組;並且d)自表位變體編碼序列的第三組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)基於個體中疾病組織的基因組序列獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列的第二組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組,並且d)自表位變體編碼序列的第三組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由表位變體編碼序列編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,通過將變體編碼序列信息與同mhc分子物理結合的肽的信息關聯進一步驗證通過本文中描述的方法鑑定的疾病特異性免疫原性突變體肽。例如,方法可以還包括:自疾病組織獲得多個與mhc分子結合的肽;對mhc結合的肽進行基於質譜術的測序;並將mhc結合的肽的質譜術衍生的序列信息與預測為免疫原性變體編碼序列的肽關聯。在下文部分中進一步描述質譜術和關聯方法。
另一方面,提供了將序列特異性變體鑑定方法與質譜術分析組合的方法。例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)自個體的患病組織獲得多個與mhc分子結合的肽;b)對mhc結合的肽進行基於質譜術的測序;並且c)將mhc結合的肽的質譜術衍生的序列信息與個體中疾病組織的變體編碼序列的組關聯,每種變體編碼序列與參照樣品相比具有序列中的變異,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,通過自疾病組織分離mhc/肽複合物(例如通過免疫沉澱)並且自mhc洗脫肽獲得與mhc結合的多個肽。在一些實施方案中,對肽進行串聯質譜術。在一些實施方案中,基於質譜術的測序包括對肽進行質譜術,並且將質譜術譜與參照譜(諸如由參照樣品中的序列編碼的推定蛋白質的假設的質譜術譜)比較。在一些實施方案中,在關聯步驟前通過肽長度和/或錨基序的存在過濾質譜術序列信息。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)自個體的患病組織獲得多個與mhc分子結合的肽;c)對mhc結合的肽進行基於質譜術的測序;並且d)將mhc結合的肽的質譜術衍生的序列信息與變體編碼序列的第一組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,可以過濾變體編碼序列的第一組以獲得編碼預測結合mhc分子的肽的變體編碼序列(下文稱為「表位變體編碼序列」)的較小組,然後對變體編碼序列的較小組進行關聯分析。在此類實施方案中,方法可以包括:a)提供個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第二組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第二組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列,獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)自個體的患病組織獲得多個與mhc分子結合的肽;c)對mhc結合的肽進行基於質譜術的測序;並且d)將mhc結合的肽的質譜術衍生的序列信息與變體編碼序列的第一組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,通過全基因組測序獲得基因組序列。在一些實施方案中,通過全外顯子組測序獲得基因組序列。在一些實施方案中,通過靶向基因組或外顯子組測序獲得基因組序列。例如,可以首先通過探針組(例如對疾病關聯基因特異性的探針)富集疾病組織和/或參照樣品中的基因組序列,之後加工以進行變體鑑定。
在一些實施方案中,可以過濾變體編碼序列的第一組以獲得編碼預測結合mhc分子的肽的變體編碼序列(下文稱為「表位變體編碼序列」)的較小組,然後對變體編碼序列的較小組進行免疫原性的預測。例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列,獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第二組關聯,由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的轉錄物組序列,獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)自個體的患病組織獲得多個與mhc分子結合的肽;c)對mhc結合的肽進行基於質譜術的測序;並且d)將mhc結合的肽的質譜術衍生的序列信息與變體編碼序列的第一組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,通過全轉錄物組rna-seq測序獲得轉錄物組序列。在一些實施方案中,通過靶向轉錄物組測序獲得轉錄物組序列。例如,可以首先通過探針組(例如對疾病關聯基因特異性的探針)富集疾病組織和/或參照樣品中的rna序列或cdna序列,之後加工以進行變體鑑定。在一些實施方案中,可以過濾變體編碼序列的第一組以獲得表位變體編碼序列的較小組,然後對變體編碼序列的較小組進行免疫原性的預測。例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的轉錄物組序列,獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第二組關聯,由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表達變體編碼序列的第二組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)基於個體中疾病組織的基因組序列獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表達變體編碼序列的第二組關聯,由此鑑定疾病特異性免疫原性突變體肽。
在一些實施方案中,可以過濾表達變體編碼序列的第二組以獲得表位變體編碼序列的較小組,然後對變體編碼序列的較小組進行免疫原性的預測。如此,例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中疾病組織的基因組序列,提供個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列的第二組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組,d)自個體的患病組織獲得多個與mhc分子結合的肽;e)對mhc結合的肽進行基於質譜術的測序;並且f)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第三組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)基於個體中疾病組織的基因組序列獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列的第二組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組,d)自個體的患病組織獲得多個與mhc分子結合的肽;e)對mhc結合的肽進行基於質譜術的測序;並且f)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第三組關聯,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,通過預測肽的免疫原性進一步選擇通過本文中描述的基於質譜術的方法鑑定的疾病特異性免疫原性突變體肽。在一些實施方案中,選擇步驟包括基於一項或多項(例如2、3、4、5、6、7、8、9、10或11之任一種)參數預測肽的免疫原性:i)肽對mhci分子的結合親和力;ii)含有肽的肽前體的蛋白質水平;iii)編碼肽前體的轉錄物的表達水平;iv)通過免疫蛋白酶體對肽前體的加工效率;v)編碼肽前體的轉錄物的表達時機;vi)肽對tcr分子的結合親和力;vii)變體胺基酸在肽內的位置;xiii)在與mhci分子結合時肽的溶劑暴露;ix)在與mhci分子結合時變體胺基酸的溶劑暴露;和x)肽中芳香族殘基的含量;和xi)肽前體的性質。
如此,例如,在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)自個體的患病組織獲得多個與mhc分子結合的肽;b)對mhc結合的肽進行基於質譜術的測序;並且c)將mhc結合的肽的質譜術衍生的序列信息與個體中疾病組織的變體編碼序列的組關聯,每種變體編碼序列與參照樣品相比具有序列中的變異,以獲得變體編碼序列的第二組,並且d)自變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第二組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)獲得個體中疾病組織的變體編碼序列的組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)自個體的患病組織獲得多個與mhc分子結合的肽;c)對mhc結合的肽進行基於質譜術的測序;d)將mhc結合的肽的質譜術衍生的序列信息與變體編碼序列的第一組關聯,以獲得變體編碼序列的第二組,並且e)自變體編碼序列的第二組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第二組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)提供個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第二組關聯,以獲得變體編碼序列的第三組,並且f)自變體編碼序列的第三組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第三組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)獲得個體中疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於由變體編碼序列的第一組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第一組選擇表位變體編碼序列的第二組,c)自個體的患病組織獲得多個與mhc分子結合的肽;d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的組關聯,以獲得變體編碼序列的第三組,並且f)自變體編碼序列的第三組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第三組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列提供個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)自個體的患病組織獲得多個與mhc分子結合的肽,d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第二組關聯,以獲得變體編碼序列的第三組,並且g)自變體編碼序列的第三組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第三組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)基於個體中的疾病組織的基因組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)自個體的患病組織獲得多個與mhc分子結合的肽,d)對mhc結合的肽進行基於質譜術的測序;並且e)將mhc結合的肽的質譜術衍生的序列信息與表達變體編碼序列的第二組關聯,以獲得變體編碼序列的第三組,並且g)自變體編碼序列的第三組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第三組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
在一些實施方案中,提供了鑑定來自個體中的疾病組織的疾病特異性免疫原性突變體肽的方法,其包括:a)基於個體中的疾病組織的基因組序列提供個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列的第二組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組,d)自個體的患病組織獲得多個與mhc分子結合的肽;e)對mhc結合的肽進行基於質譜術的測序;並且f)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第三組關聯,以獲得變體編碼序列的第四組,並且g)自變體編碼序列的第四組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第四組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法包括:a)基於個體中的疾病組織的基因組序列獲得個體中的疾病組織的變體編碼序列的第一組,每種變體編碼序列與參照樣品相比具有序列中的變異;b)基於個體中疾病組織的轉錄物組序列,自第一組選擇表達變體編碼序列的第二組;c)基於由表達變體編碼序列的第二組編碼的肽結合mhc分子(諸如mhci類分子或mhci)的預測能力,自第二組選擇表位變體編碼序列的第三組,d)自個體的患病組織獲得多個與mhc分子結合的肽;e)對mhc結合的肽進行基於質譜術的測序;並且f)將mhc結合的肽的質譜術衍生的序列信息與表位變體編碼序列的第三組關聯,以獲得變體編碼序列的第四組,並且g)自變體編碼序列的第四組選擇免疫原性變體編碼序列,其中選擇步驟包括預測包含由變體編碼序列的第四組編碼的變體胺基酸的肽的免疫原性,由此鑑定疾病特異性免疫原性突變體肽。在一些實施方案中,方法還包括通過功能性分析驗證疾病特異性免疫原性突變體肽。在一些實施方案中,疾病是癌症。在一些實施方案中,個體是人個體(諸如具有癌症的人個體)。
本文中還提供通過本文中描述的任一種方法獲得的疾病特異性免疫原性突變體肽。例如,可以使用疾病特異性免疫原性突變體肽生成用於治療疾病的組合物(諸如疫苗組合物)。或者,可以使用疾病特異性免疫原性突變體肽生成突變體肽特異性治療劑,諸如治療性抗體。
本文中描述的方法在個性化醫學背景下是特別有用的,其中使用通過本文中描述的任一種方法獲得的疾病特異性免疫原性突變體肽開發用於同一個體的治療劑(諸如疫苗或治療性抗體)。如此,例如,在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括:a)鑑定個體中疾病特異性免疫原性突變體肽;並且b)合成肽;並且c)對個體施用肽。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括:a)自個體獲得疾病組織樣品;b)鑑定個體中的疾病特異性免疫原性突變體肽;並且c)合成肽;並且d)對個體施用肽。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括:a)鑑定個體中的疾病特異性免疫原性突變體肽;b)生成特異性識別突變體肽的抗體(或tcr類似物,諸如可溶性tcr);並且c)對個體施用肽。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括:a)自個體獲得疾病組織樣品;b)鑑定個體中的疾病特異性免疫原性突變體肽;c)生成特異性識別突變體肽的抗體(或tcr類似物,諸如可溶性tcr);並且d)對個體施用肽。在一些實施方案中,鑑定步驟將序列特異性變體鑑定方法與免疫原性預測方法組合。在一些實施方案中,鑑定步驟將序列特異性變體鑑定方法與質譜術組合。可以將本文中描述的鑑定疾病特異性免疫原性突變體肽的任何方法用於本文中描述的治療方法。
獲得變體編碼序列
本文中在各種實施方案中描述的方法包括提供和/或獲得變體編碼序列。一般可以例如通過對個體的疾病組織樣品中的基因組或rna序列測序,並將序列與自參照樣品獲得的序列進行比較來獲得變體編碼序列。
在一些實施方案中,疾病組織是血液。在一些實施方案中,疾病組織是固體組織(諸如實體瘤)。在一些實施方案中,疾病組織是細胞的集合(例如血液中的循環癌細胞)。在一些實施方案中,疾病組織是淋巴細胞的集合。在一些實施方案中,疾病組織是白細胞的集合。在一些實施方案中,疾病組織是上皮細胞的集合。在一些實施方案中,疾病組織是結締組織。在一些實施方案中,疾病組織是生殖細胞和/或多能細胞的集合。在一些實施方案中,疾病組織是胚細胞的集合。
合適的疾病組織樣品包括但不限於腫瘤組織、與腫瘤相鄰的正常組織、腫瘤遠端的正常組織、或外周血淋巴細胞。在一些實施方案中,疾病組織樣品是腫瘤組織。在一些實施方案中,疾病組織樣品是含有癌細胞的活檢,諸如癌細胞(例如胰腺癌細胞)的細針抽吸或腹腔鏡檢查獲得的癌細胞(例如胰腺癌細胞)。在一些實施方案中,將活檢的細胞離心成團粒,固定,並且在石蠟中包埋,之後分析。在一些實施方案中,在分析前快速冷凍活檢的細胞。
在一些實施方案中,疾病組織樣品包含循環轉移癌細胞。在一些實施方案中,通過自血液分選循環腫瘤細胞(ctc)獲得疾病組織樣品。在另一個實施方案中,ctc已經自原發性腫瘤脫離並在體液中循環。在又一個實施方案中,ctc已經自原發性腫瘤脫離並在血流中循環。在另一個實施方案中,ctc是轉移的指示。在一些實施方案中,ctc是胰腺癌細胞。在一些實施方案中,ctc是結腸直腸癌細胞。在一些實施方案中,ctc是非小細胞肺癌細胞。
可以基於個體中的疾病組織中的基因組序列鑑定變異。例如,可以自個體的疾病組織獲得基因組dna並進行測序分析。然後,將如此獲得的序列與自參照樣品獲得的序列比較。在一些實施方案中,對疾病樣品進行全基因組測序。在一些實施方案中,將疾病樣品進行全外顯子組測序,即僅對基因組序列中的外顯子測序。在一些實施方案中,在與參照樣品比較前,對基因組序列「富集」特定序列。例如,可以設計特異性探針以在進行測序分析前富集某些期望的序列(例如疾病特異性序列)。全基因組測序、全外顯子組測序和靶向測序的方法是本領域中已知的,並且報告於例如bentley,d.r.etal.,accuratewholehumangenomesequencingusingreversibleterminatorchemistry,nature,2008,v.456,53-59;choi,m.etal.,geneticdiagnosisbywholeexomecaptureandmassivelyparalleldnasequencing,proceedingsofthenationalacademyofsciences,2009,ν.106(45),19096-19101;及ng,s.b.etal.,targetedcaptureandmassivelyparallelsequencingof12humanexomes,nature,2009,v.461,272-276,在此通過提及收錄它們。
在一些實施方案中,基於個體中疾病組織中的轉錄物組序列鑑定變異。例如,可以自個體中的疾病組織獲得全部或部分轉錄物組序列(例如通過諸如rna-seq的方法)並進行測序分析。然後,將如此獲得的序列與自參照樣品獲得的序列比較。在一些實施方案中,將疾病樣品進行全轉錄物組rna-seq測序。在一些實施方案中,在與參照樣品比較前,對轉錄物組序列「富集」特定序列。例如,可以設計特異性探針以在進行測序分析前富集某些期望的序列(例如疾病特異性序列)。全轉錄物組測序和靶向測序的方法是本領域中已知的,並且報告於例如tang,f.etal.,mrna-seqwhole-transcriptomeanalysisofasinglecell,naturemethods,2009,v.6,377-382;ozsolak,f.,rnasequencing:advances,challengesandopportunities,naturereviews,2011,v.12,87-98;german,m.aetal.,globalidentificationofmicrorna-targetrnapairsbyparallelanalysisofrnaends,naturebiotechnology,2008,v.26,941-946;及wang,z.etal.,rna-seq:arevolutionarytoolfortranscriptomics,naturereviews,2009,v.10,p.57-63。在一些實施方案中,轉錄物組測序技術包括但不限於rna聚(a)文庫、微陣列分析、平行測序、大規模平行測序、pcr和rna-seq。rna-seq是一種用於對部分或基本上整個轉錄物組測序的高通量技術。簡言之,用與一個或兩個末端附著的銜接頭將轉錄物組序列的分離的群體轉化成cdna片段的文庫。在擴增或不擴增的情況中,然後分析每種cdna分子以獲得序列信息的短區段,通常為30-400個鹼基對。然後,將序列信息的這些片段與參照基因組、參照轉錄物比對或者從頭裝配以揭示轉錄物的結構(即轉錄邊界)和/或表達水平。
一旦獲得,可以將疾病組織中的序列與參照樣品中的相應序列比較。可以在核酸水平進行序列比較,其通過將疾病組織中的核酸序列與參照樣品中的相應序列比對進行。然後,鑑定導致編碼胺基酸的一種或多種變化的序列變異。或者,可以在胺基酸水平進行序列比較,也就是說,在實施比較前首先在計算機上將核酸序列轉化成胺基酸序列。
在一些實施方案中,可以通過本領域中已知的技術,諸如手動比對、fast-a11(fasta)和基本局部比對搜索工具(blast)完成來自疾病組織的序列與參照的序列的比較。通過blast完成的序列比較需要疾病序列的輸入和參照序列的輸入。blast通過首先鑑定兩種序列之間的短序列匹配(稱為接種的過程)將疾病序列與參照資料庫比較。一旦找到序列匹配,則使用評分矩陣實施序列比對的擴展。
在一些實施方案中,參照樣品是匹配的無疾病的組織樣品。如本文中使用的,「匹配的」無疾病的組織樣品是選自與疾病組織相同或相似組織類型的組織樣品。在一些實施方案中,匹配的無疾病的組織和疾病組織可以源自同一個體。在一些實施方案中,本文中描述的參照樣品是來自同一個體的無疾病的樣品。在一些實施方案中,參照樣品是來自不同個體(例如沒有疾病的個體)的無疾病的樣品。在一些實施方案中,參照樣品是自不同個體的群體獲得的。在一些實施方案中,參照樣品是與生物體相關的已知基因的資料庫。在一些實施方案中,參照樣品可以是與生物體相關的已知基因和來自匹配的無疾病的組織樣品的基因組信息的組合。在一些實施方案中,變體編碼序列可以編碼或包含胺基酸序列中的點突變。在一些實施方案中,變體編碼序列可以編碼或包含胺基酸刪除或插入。
在一些實施方案中,首先基於基因組序列鑑定變體編碼序列的組。然後,進一步過濾此初始組,以基於轉錄物組測序資料庫中變體編碼序列的存在獲得較窄的表達變體編碼序列組(並且如此視為「表達的」)。在一些實施方案中,通過過濾通過轉錄物組測序資料庫將變體編碼序列的組減少至少約10、20、30、40、50或更多倍。
在一些實施方案中,變體編碼序列是源自導致蛋白質中的不同胺基酸的非同義突變(例如點突變)的序列。在一些實施方案中,變體編碼序列是源自連讀突變的序列,在所述連讀突變中修飾或刪除終止密碼子,導致在c端具有新的腫瘤特異性序列的較長蛋白質的翻譯。在一些實施方案中,變體編碼序列是源自剪接位點突變的序列,所述剪接位點突變導致在成熟mrna中內含子的納入,並且如此導致獨特的腫瘤特異性蛋白序列。在一些實施方案中,變體編碼序列是源自染色體重排的序列,所述染色體重排產生在2種蛋白質的接合處具有腫瘤特異性序列的嵌合蛋白(即基因融合)。在一些實施方案中,變體編碼序列是源自導致具有新腫瘤特異性蛋白質序列的新可讀框的移碼突變或刪除的序列。在一些實施方案中,變體編碼序列是源自超過一種突變的序列。在一些實施方案中,變體編碼序列是源自超過一種突變機制的序列。
獲得表位變體編碼序列
過濾本文中在一些實施方案中描述的變體編碼序列以獲得編碼預測結合mhc分子的肽的變體編碼序列(「表位變體編碼序列」)的較小組。在一些實施方案中,通過過濾通過mhc結合預測過程將所述組的變體編碼序列減少至少約10、20、30、40、50、60、80、100、150、200、250、300或更多倍。
可以通過預測算法(諸如netmhc)評估由變體編碼序列編碼的肽結合mhc(諸如mhci)的能力。簡言之,netmhc是一種使用來自免疫表位資料庫和分析資源(iedb)的親和力數據和來自syfpeithi的洗脫數據兩者對定量肽數據訓練的算法。可以對長度為8和14個之間的胺基酸的肽進行mhci結合的預測。netmhc使用對來自55種mhc等位基因(43種人和12種非人)的9聚體胺基酸序列訓練的預測器。為了允許預測較短的輸入序列,netmhc實際上會擴展8聚體胺基酸序列。對於長於9聚體的輸入序列,netmhc會產生輸入序列內含有的所有可能的9聚體胺基酸序列。netmhc然後使用訓練的人工神經網絡和位置特定評分矩陣來預測mhc結合。
選擇免疫原性變體編碼序列
本文中在一些實施方案中提供的方法還包括選擇免疫原性變體編碼序列,其包括預測包含由變體編碼序列編碼的變體胺基酸的肽的免疫原性。可以例如通過考慮肽和相應的肽前體的一種或多種參數預測肽為免疫原性的可能性的方法(諸如在電腦程式中)實施免疫原性的預測。這些參數包括但不限於i)肽對mhci分子的結合親和力;ii)含有肽的肽前體的蛋白質水平;iii)編碼肽前體的轉錄物的表達水平;iv)通過免疫蛋白酶體對肽前體的加工效率;v)編碼肽前體的轉錄物的表達時機;vi)肽對tcr分子的結合親和力;vii)變體胺基酸在肽內的位置;xiii)在與mhci分子結合時肽的溶劑暴露;ix)在與mhci分子結合時變體胺基酸的溶劑暴露;和x)肽中芳香族殘基的含量;和xi)肽前體的性質。在一些實施方案中,免疫原性基於本文中描述的參數的至少2、3、4、5、6、7、8、9或10項。
在一些實施方案中,使用肽對mhc分子的結合親和力預測免疫原性。肽對mhc分子的結合親和力可以預測pmhc的穩定性,其繼而可以允許pmhc的延長呈現,如此增加細胞表面暴露以與免疫細胞潛在相互作用。可以使用本領域中已知的技術預測結合親和力,諸如rankpep、mhcbench、nhlapred、svmhc、netmhcpan和popi,其基於諸如人工神經網絡、平均相對結合矩陣、定量矩陣和穩定化矩陣法的方法。在一些實施方案中,肽對mhc的結合親和力基於位於已知錨定位置中的特定胺基酸殘基(牽涉mhc結合的胺基酸)的存在。在一些實施方案中,對肽中的每個殘基評估其對結合的貢獻。在一些實施方案中,用已知結合mhc的肽訓練分析系統。在一些實施方案中,計算肽-mhc分子的結合能。在一些實施方案中,使用結合閾值評估肽結合mhc的預測親和力,例如ic50值<500nm。
在一些實施方案中,使用疾病組織中肽前體的表達水平預測免疫原性。在一些實施方案中,以生物化學法(諸如western印跡和elisa)測量蛋白質水平。在一些實施方案中,可以通過已知的定量質譜術技術測量蛋白質水平。如lagruta等人證明的,疾病組織中肽前體的高表達水平可以與預測的免疫原性關聯。如描述的,補料入表位加工途徑中的較大量的肽前體的利用度與增加的表位呈遞和免疫原性應答正相關(lagruta,n.l.etal.,avirus-specificcd8+tcellimmunodominancehierarchydeterminedbyantigendoseandprecursorfrequencies,proceedingsofthenationalacademyofsciences,2006,v.103,994-999,在此通過提及將其收錄)。
在一些實施方案中,可以使用編碼疾病組織中的肽前體的轉錄物的表達水平預測免疫原性。在一些實施方案中,通過rt-pcr測量rna表達水平。在一些實施方案中,通過測序分析測量rna表達水平。如上文討論,增加肽前體對表位加工途徑的利用度與源自所述肽前體的所述表位相關的免疫原性應答正相關。此外,已經觀察到mrna水平和蛋白質豐度之間的正關聯(ghaemmaghami,s.etal.,globalanalysisofproteinexpressioninyeast,nature,2003,v.425,737-741,在此通過提及將其收錄)。因此,可以使用編碼疾病組織中的肽前體的轉錄物的表達水平預測免疫原性。
在一些實施方案中,使用通過免疫蛋白酶體對肽前體的加工效率預測免疫原性。如本文中使用的,肽前體的「加工效率」是指表達、翻譯、轉錄、消化、轉運來源胺基酸序列(即較大的肽或蛋白質)以及在結合mhci分子前的任何進一步加工的效率。「免疫蛋白酶體」是蛋白酶的集合,其將肽和/或蛋白質前體酶促消化成小的胺基酸序列,用於表位形成的最終目的。例如,如由chen等人證明的,免疫蛋白酶體產生表位前體的能力與免疫原性直接相關(chen,w.etal.,immunoproteasomesshapeimmunodominancehierarchiesofantiviralcd8+tcellrepertoireandpresentationofviralantigens,thejournalofexperimentalmedicine,2001,v.193,1319-1326,在此通過提及將其收錄)。可以使用牽涉表位加工的步驟的知識預測所得表位的免疫原性。特別地,關於免疫蛋白酶體的研究提示它有效生成mhc表位,並且對免疫蛋白酶體機制的了解會有助於預測免疫原性肽。
在一些實施方案中,可以使用肽前體的表達時機預測免疫原性。在疾病進展中較早期表達的蛋白質更可能呈現為mhc表位(moutaftsi,m.etal.,aconsensusepitopepredictionapproachidentifiesthebreadthofmurinetcd8+-cellresponsestovaccinavirus,naturebiotechnology,2006,v.24,817-819,在此通過提及將其收錄)。在一些實施方案中,可以使用疾病組織的比較分析測定基因產物的時間表達模式。在一些實施方案中,時間表達模式的外推可以允許鑑定與其它鑑定的表達基因產物相比在早期時間點以更大的豐度呈現的表達基因產物。
在一些實施方案中,可以使用肽表位與t細胞受體(tcr)的結合親和力預測免疫原性。預測肽表位與tcr的結合親和力的方法是本領域中已知的,並且報告於例如tung,c.-w.etal.,popisk:t-cellreactivitypredictionusingsupportvectormachinesandstringkernels,bmcbioinformatics,2011,v.12,446,在此通過提及將其收錄。
在一些實施方案中,使用變體胺基酸在肽中的位置預測免疫原性。肽表位在兩個獨特的錨定位置處結合mhci分子。錨定位置之間的跨度以約6-7個胺基酸分開,如通過表位肽序列測量的,不包括佔據錨定位置的胺基酸。已經報告了,兩個mhci錨定位置間的胺基酸跨度(即4-6位的胺基酸)中的突變更可能與免疫原性應答正相關(calis,j.j.a.etal.,propertiesofmhcclassipresentedpeptidesthatenhanceimmunogenicity,ploscomputationalbiology,2013,v.9,1-13,在此通過提及將其收錄)。通過開始對於末端胺基酸的序列位置計數1確定胺基酸的序列位置。
在一些實施方案中,在mhc呈遞表位上呈遞的肽的結構特徵可以預測免疫原性。可以通過計算機3維分析和/或蛋白質停靠程序進行mhc結合的肽的結構評估。預測pmhc分子的結構的方法是本領域中已知的,並且報告於例如在marti-renom,m.a.etal.,comparativeproteinstructuremodelingofgenesandgenomes,annualreviewofbiophysicsandbiomolecularstructure,2000,v.29,291-325,chivian,d.etal.,homologymodelingusingparametricalignmentensemblegenerationwithconsensusandenergy-basedmodelselection,nucleicacidsresearch,2006,v.34,el12,andmcrobb,f.m.etal.,homologymodelinganddocketingevaluationofaminergicgprotein-coupledreceptors,journalofchemicalinformationandmodeling,2010,v.50,626-637,在此通過提及將其收錄。當與mhc分子結合時預測的表位結構(諸如自rosetta算法獲得)的使用可用於評估當表位與mhc分子結合時所述表位的胺基酸殘基的溶劑暴露程度。隨後,可以將此信息與肽的免疫原性關聯。例如,如park等人描述,突變體肽(其中與野生型序列相比,變體胺基酸殘基展現額外的溶劑暴露)與增加的免疫原性正相關(park,m.-s.etal.,accuratestructurepredictionofpeptide-mhccomplexesforidentifyinghighlyimmunogenicantigens,molecularimmunology,2013,v.56,81-90,在此通過提及將其收錄。)在一些實施方案中,使用在mhc複合物上呈遞時整個肽的溶劑暴露預測免疫原性。在一些實施方案中,使用肽上的變體胺基酸的溶劑暴露預測免疫原性。
在一些實施方案中,可以使用肽中的大的和/或芳香族的殘基的表位含量預測免疫原性。calis等人觀察到表位胺基酸序列內的大的和/或芳香族的胺基酸殘基的存在與免疫原性之間的聯繫。具體地,報告了苯丙氨酸和異亮氨酸含量與表位免疫原性正相關。如上文討論,可以使用變體胺基酸的位置和結構評估兩者預測表位免疫原性。除了此討論之外,假設可以預測表位4-6位內的大的和/或芳香族的殘基具有較大程度的溶劑暴露。
在一些實施方案中,可以使用肽前體的性質預測變體編碼胺基酸序列的免疫原性。例如,當疾病組織是腫瘤時,已知與癌症相關的肽前體序列在預測免疫原性時可以是有用的。然而,來自不與癌症直接相關的蛋白質的肽前體序列(例如當突變時)在本發明的方法內也是有用的。
在一些實施方案中,可以使用本文中描述的至少兩種(諸如3、4、5、6、7、8、9或10中的至少任一)參數預測肽的免疫原性。在一些實施方案中,可以使用第一預測性評估選擇一組變體編碼胺基酸序列,其隨後通過第二預測性評估加工,導致表位免疫原性的累積預測。作為本公開內容的一部分意圖可以使用多輪評估預測表位免疫原性。或者,平行評估多項參數,並且可以獲得基於各種參數的評估的綜合得分。例如,可以為每項參數計算得分,並且可以為每項參數分配百分比權重。然後,可以基於評估的每項參數的得分和百分比權重計算綜合範圍。也可以使用與平行參數評估偶聯的序貫評估的組合。
對於變體編碼序列中的給定變異,可以產生各種長度的多個重疊推定突變體肽。在一個實施方案中,可以基於免疫原性對這些多個重疊推定突變體肽排序,其可以涵蓋如本文中描述的一種或多種分析。此外,可以通過本領域中公知的任一種或多種手段實現推定的突變體肽的排序,所述手段可以包括在免疫原性測定中或者根據進行排序過程的那些的偏愛而認為是分開的分析。這些手段的一些非限制性例子包括前體蛋白的豐度、加工的蛋白質組內的肽的豐度,包括此加工的效率,和肽-mhc複合物內肽的豐度。潛在排序分析的其它例子包括但不限於肽的結合親和力、肽-mhc複合物的穩定性、和肽與自身肽的相似性或差異。或者,可以基於與測量普通技術人員公知的或本文中描述的這些或其它特徵的質譜術方法產生的數據的關聯對肽排序。一些代表性特徵包括增加免疫原性的大的或芳香族的胺基酸的存在或缺乏和在肽內找到這些胺基酸的特定位置,對於在肽的中間位置中找到的那些胺基酸給予免疫原性影響偏愛,例如肽4到6(見例如calisetal.plos,9(10):el003266(2013))。
在一些實施方案中,免疫原性的預測還包括hla(人白細胞抗原)分型分析。由於mhc的多基因性(polygeny),每個人將在他或她的細胞上表達至少三種不同的抗原呈遞mhci類分子和三種(或有時四種)mhcii類分子。事實上,由於mhc的極端多態性和mhc基因產物的共顯性表達,在大多數人的細胞上表達的不同mhc分子的數目是較大的。一些人mhci類和ii類基因有超過200種等位基因,每種等位基因在群體中以相對高的頻率存在。因此,僅有較小的下述機率,即在個體的兩條同源染色體上相應的mhc位點會具有相同的等位基因;大多數個體會在mhc基因座處是雜合的。在單個染色體上找到的mhc等位基因的特定組合稱為mhc單倍型。mhc等位基因的表達是共顯性的,在細胞中表達一種基因座處的兩種等位基因的蛋白質產物,並且兩種基因產物都能夠將抗原呈遞給t細胞。如此,每種基因座上的廣泛多態性具有將個體中表達的不同mhc分子的數目倍增,由此增加已經經由多基因性可得的多樣性的潛力(關於一般概述,見例如janeway’simmunobiology,murphy,kenneth編,garlandscience,newyork,ny(2011))。可以使用現有技術中已知的幾種方法中的任一種,諸如基於dna的組織相容性測定法完成hla分型。本領域中的方法的具體例子牽涉進一步分析的聚合酶鏈式反應(pcr)產物,諸如pcr-rflp(限制性片段長度多態性)、pcr-sso(序列特異性寡核苷酸)、pcr-ssp(序列特異性引物)、和pcr-sbt(基於序列的分型)技術。如此,測定牽涉感興趣的肽呈遞的特定基因多態性類型可以提供關於突變體肽的免疫原性的進一步信息。
獲得與mhc分子結合的肽
本文中在一些實施方案中提供的方法包括自個體的疾病組織獲得與mhc分子結合的肽。在一些實施方案中,通過免疫親和技術分離mhc結合的肽。在一些實施方案中,通過親和層析分離mhc結合的肽。在一些實施方案中,通過免疫親和層析分離mhc結合的肽。在一些實施方案中,通過免疫沉澱技術分離mhc結合的肽。
在一些實施方案中,使用抗mhc抗體捕捉mhc/肽分子。在一些實施方案中,可以使用任選具有不同親和力和/或結合特徵的多種抗mhc抗體捕捉mhc/肽複合物。合適的抗體包括但不限於對hlai類特異性的單克隆抗體w6/32,和對hla-a2特異性的單克隆抗體bb7.2。
在一些實施方案中,可以首先分離mhc/肽複合物,隨後將mhc結合的肽與mhc分子分開。在一些實施方案中,通過酸洗脫將mhc結合的肽與mhc分子分開。在一些實施方案中,可以對完整的全細胞,任選地在存在裂解的細胞和/或細胞殘留物的情況中實施酸介導的與mhc分子分開mhc結合的肽。在一些實施方案中,可以在將pmhc暴露於具有酸性ph的緩衝液後與mhc分子分開mhc結合的肽。在一些實施方案中,可以通過溫和酸洗脫(mae)將mhc結合的肽與mhc分子分開。在一些實施方案中,可以通過胞外表面的溫和酸洗脫(mae)將mhc結合的肽與mhc分子分開。在一些實施方案中,可以通過pmhc分子的變性將mhc結合的肽與mch分子分開。
在一些實施方案中,可以在基於質譜術的測序前進一步加工mhc結合的肽。在一些實施方案中,可以在基於質譜術的測序前將mhc結合的肽濃縮。在一些實施方案中,可以在基於質譜術的測序前純化mhc結合的肽。在一些實施方案中,可以在基於質譜術的測序前將mhc結合的肽分級。在一些實施方案中,可以在基於質譜術的測序前將mhc結合的肽富集。在一些實施方案中,可以在進行基於質譜術的測序前將mhc結合的肽進一步酶促消化。在一些實施方案中,可以在基於質譜術的測序前更換可以含有mhc結合的肽的緩衝液。在一些實施方案中,可以在基於質譜術的測序前標記mhc結合的肽。在一些實施方案中,可以在基於質譜術的測序前共價標記mhc結合的肽。在一些實施方案中,可以在基於質譜術的測序前酶促標記mhc結合的肽。在一些實施方案中,可以在基於質譜術的測序前化學標記mhc結合的肽。在一些實施方案中,可以標記mhc結合的肽以允許在基於質譜術的測序期間增強離子化。在一些實施方案中,可以標記mhc結合的肽以允許在基於質譜術的測序期間進行定量。在一些實施方案中,分離的mhc結合的肽可以源自多種來源和/或富集方法,並且任選地可以在基於質譜術的測序前共同合併。
基於質譜術的肽測序
對在本文中描述的方法中與mhc分子結合的肽進行質譜測序。如本文中使用的,「基於質譜術的測序」是指通過使用質譜術鑑定肽和/或蛋白質的胺基酸序列的技術。質譜儀是能夠測量個別的離子化分子的質荷(m/z)比的儀器,使研究人員能夠鑑定未知化合物,量化已知化合物,並且闡明分子的結構和化學性質。可以使用本文中提供的方法獲得與mhci分子結合的肽表位的序列信息。在一些實施方案中,可以測定肽表位的整個序列。在一些實施方案中,可以測定肽表位的部分序列。在一些實施方案中,對肽進行串聯質譜術,諸如串聯層析質譜術(例如lc-ms或lc-ms-ms)。
在一些實施方案中,通過將樣品分離並且加載入儀器上開始質譜術分析。在一些實施方案中,可以在質譜術分析前層析加工mhc結合的肽。在一些實施方案中,層析法是液相層析。在一些實施方案中,層析是反相層析。在一些實施方案中,可以將mhc結合的肽層析分開,並且同時濃縮,之後導入質譜儀中。在一些實施方案中,層析分開可以是在線的,其中自層析源洗脫的肽直接進入質譜儀中。在一些實施方案中,層析分開可以是離線的。在一些實施方案中,可以使用離線層析分開分級分離mhc結合的肽。離線層析分開通常牽涉質譜術樣品的分開和/或分級,其中在樣品離開層析系統時,不將所得的分開和/或分級的樣品立即導入質譜儀中。
在一些實施方案中,可以使用已知的質譜術離子化技術(諸如基質輔助雷射解吸/離子化、電噴霧離子化和/或納米電噴霧離子化、大氣壓化學離子化)對mhc結合的肽測序。在一些實施方案中,mhc結合的肽可以在質譜儀外部、內部和/或在它們進入質譜儀時離子化。在一些實施方案中,可以在質譜儀中分析mhc結合的肽的正離子。隨後,經由暴露於磁場,離子依照其質荷比分開。在一些實施方案中,使用扇形儀器,並且離子依照在它通過儀器的電磁場時離子軌跡的偏轉幅度量化,所述電磁場與離子質荷比正相關。在其它實施方案中,當離子通過四極體時,或者基於它們在三維或線性離子阱或orbitrap中的運動,或在傅立葉變換離子回旋加速器共振質譜儀的磁場中,測量離子質荷比。儀器記錄每個離子的相對豐度,其用於測定初始樣品的化學、分子和/或同位素組成。在一些實施方案中,使用飛行時間儀器,並且利用電場加速離子通過相同的電勢,並且測量每個離子到達檢測器花費的時間。此方法取決於均勻的每個離子的電荷,使得每個離子的動能會是相同的。在此情況中影響速度的唯一變量是質量,較輕的離子以較大的速度行進並且因此較快到達檢測器。以質譜或直方圖、強度對質荷比呈現所得的數據,峰表示離子化化合物或片段。
可以通過串聯質譜術獲得質譜數據。在一些實施方案中,用於獲得關於mhc結合的肽的肽測序的信息的質譜術獲得技術可以是數據依賴性的。在一些實施方案中,用於獲得關於mhc結合的肽的肽測序的信息的質譜術獲得技術可以是數據非依賴性的。在一些實施方案中,用於獲得關於mhc結合的肽的肽測序的信息的質譜術獲得技術可以基於測量的精確質量質譜術。在一些實施方案中,用於獲得關於mhc結合的肽的肽測序的信息的質譜術獲得技術可以是肽質量指紋法。可以通過肽質量指紋法獲得本發明中有用的質譜數據。肽質量指紋法牽涉將來自通過蛋白水解消化產生的肽混合物的譜的觀察質量輸入資料庫中,並且將觀察到的質量與計算機上的源自已知蛋白質的消化的預測片段質量關聯。與樣品質量對應的已知質量提供了已知蛋白質存在於測試樣品中的證據。
在一些實施方案中,串聯質譜術包括使肽離子與氣體碰撞並且片段化(例如由於由碰撞賦予的振動能量)的過程。片段化過程產生在沿著蛋白質的各個位點處的肽鍵處斷裂的斷裂產物。觀察到的片段質量可以與許多給定肽序列之一的預測質量資料庫匹配,並且可以預測蛋白質的存在。在一些實施方案中,質譜術採集技術可以利用片段化技術(諸如碰撞誘導的解離、脈衝q解離、高能碰撞解離、電子轉移解離和電子轉移解離、紅外多光子解離)。
在一些實施方案中,可以使用從質譜儀獲得的數據鑑定肽序列。在一些實施方案中,可以使用搜索算法(諸如sequest和mascot)將肽序列分配給獲得的質譜。在一些實施方案中,分配的肽序列可以具有小於約5%的錯誤發現率。在一些實施方案中,分配的肽序列可以具有小於約1%的錯誤發現率。在一些實施方案中,分配的肽序列可以具有小於約0.5%的錯誤發現率。在一些實施例中,可以通過搜索算法使用資料庫進行獲得譜的肽序列分配。在一些實施方案中,通過搜索算法使用以進行獲得譜的肽序列分配的資料庫可以是生物體的已知序列的資料庫。在一些實施方案中,通過搜索算法使用以進行獲得譜的肽序列分配的資料庫可以是生物體的已知蛋白質的資料庫。在一些實施方案中,通過搜索算法使用以進行獲得譜的肽序列分配的資料庫可以是生物體的已知基因組序列的資料庫。在一些實施方案中,通過搜索算法使用以進行獲得譜的肽序列分配的資料庫可以包括自疾病組織獲得的序列信息。在一些實施方案中,通過搜索算法使用以進行獲得譜的肽序列分配的資料庫可以包括自無疾病的組織獲得的序列信息。
在一些實施方案中,可以手動驗證序列分配譜以通過算法確認正確的片段離子分配。在一些實施方案中,可以使用合成肽標準品確認算法分配的序列。在一些實施方案中,可以將自mhc結合的肽產生的譜與自肽標準品產生的譜比較。例如,比較可以牽涉將片段離子的模式,和任選地片段豐度或強度(基於自疾病組織來源獲得的譜的m/z值)與參照匹配。在一些實施方案中,手動驗證可以確認完整肽序列的序列分配。在一些實施方案中,手動驗證可以確認肽序列的部分片段的序列分配。
質譜術與基因組數據的關聯
本文中在一些實施方案中提供的方法包括將mhc結合的肽的質譜術衍生的序列信息與一組變體編碼序列關聯,以鑑定疾病特異性免疫原性突變體肽。例如,可以使用mhc結合的肽的質譜術序列進一步選擇預測的疾病特異性免疫原性突變體肽的群體。在一些實施方案中,基於質譜術的表位鑑定可以補充基於基因組的免疫原性表位鑑定和/或預測。在一些實施方案中,基於質譜術的表位鑑定可以確認基於基因組的免疫原性表位鑑定和/或預測。
可以將自質譜術分析獲得的數據與基於疾病組織的基因組和/或轉錄物組序列分析的免疫原性肽預測關聯。通常,將自基於質譜術的測序鑑定的胺基酸序列與預測的免疫原性肽的胺基酸序列比較,以找到包含部分序列比對的區域。在一些實施方案中,經由質譜術鑑定的肽會是與預測的免疫原性肽的序列的精確序列匹配。在一些實施方案中,胺基酸序列的長度可以在經由質譜術鑑定的肽和預測的免疫原性肽的長度之間變化。例如,與預測的免疫原性肽相比,經由質譜術鑑定的肽可以含有對肽的c和/或n端修改的別的胺基酸。或者,與預測的免疫原性肽相比,包含變體胺基酸的經由質譜術鑑定的肽可以在c和/或n端具有更少的胺基酸。在這些例示性實施方案中,變體胺基酸和變體胺基酸周圍的序列在經由質譜術鑑定的肽和預測為免疫原性的肽兩者中必須是相同的。在一些實施方案中,自將基於質譜術的序列與免疫原性肽預測關聯獲得的結果將預測的免疫原性序列與經由基於質譜術的測序確認由mhc分子物理呈現的序列匹配。
在一些實施方案中,可以通過肽長度進一步過濾獲得的質譜術序列鑑定。例如,在一些實施方案中,可以進一步過濾通過質譜術鑑定的mhc結合的肽的群體以僅包括長度為8或9個胺基酸的那些鑑定的肽序列。
免疫原性突變體肽的功能性驗證
可以通過功能性研究進一步驗證通過本文中描述的方法鑑定的疾病特異性免疫原性突變體肽。例如,可以基於激活靶向免疫應答(例如由細胞毒性t細胞介導)的能力合成和測試肽。在一些實施方案中,化學合成肽。在一些實施方案中,通過重組方法合成肽。在一些實施方案中,如下合成肽,即首先表達肽前體分子,然後加工所述肽前體分子(例如通過免疫蛋白酶體)以生成感興趣的肽。可以在進行功能性分析前將合成的肽進行進一步純化。
在一些實施方案中,在體外使用預測的疾病特異性免疫原性合成肽來測試細胞毒性t細胞應答。在一些實施方案中,在體內使用預測的疾病特異性免疫原性合成肽來測試細胞毒性t細胞應答。
在一些實施方案中,可以通過小鼠的免疫測試疾病特異性肽的免疫原性。在一些實施方案中,可以通過測量cd8t細胞應答在免疫後測試疾病特異性肽的免疫原性。在一些實施方案中,可以使用mhci/肽特異性的dextramer測量cd8t細胞應答。在一些實施方案中,可以通過分析腫瘤浸潤細胞(til)測試疾病特異性肽的免疫原性。
在一些實施方案中,可以測量特異性表位和/或細胞表面蛋白的存在。在一些實施方案中,可以測量源自疫苗接種的表位的存在。在一些實施方案中,可以測量幹擾素γ(ifn-γ)。在一些實施方案中,可以測量程序性細胞死亡1(pd-1)。在一些實施方案中,可以測量t細胞免疫球蛋白粘蛋白-3(tim-3)。在一些實施方案中,可以測量表達特異性蛋白質和/或表位的細胞毒性t細胞。在一些實施方案中,可以測量展現特異性表位的細胞毒性t細胞。
在一些實施方案中,可以如下測試疾病特異性肽的免疫原性,即首先在樹突細胞中表達肽,然後測試呈遞的抗原被t細胞識別的能力。在一些實施方案中,自患者獲得樹突細胞,其中在所述患者中鑑定疾病特異性肽。在一些實施方案中,可以如下測試疾病特異性肽的免疫原性,即首先在b淋巴細胞中表達肽,然後測試呈遞的抗原被t細胞識別的能力。在一些實施方案中,自患者獲得b淋巴細胞,其中在所述患者中鑑定疾病特異性肽。參見例如美國專利號8,349,558。
免疫原性肽的組成
本公開內容提供了鑑定疾病特異性免疫原性肽的方法。可以基於激活靶向免疫應答(諸如由細胞毒性t細胞介導的)的能力鑑定免疫原性肽。在一些實施方案中,可以使用所鑑定的疾病特異性免疫原性肽的胺基酸序列產生藥學上可接受的組合物。在一些實施方案中,組合物可以包含合成的疾病特異性免疫原性肽。在一些實施方案中,組合物可以包含合成的疾病特異性免疫原性突變體肽。在一些實施方案中,組合物可以包含兩種或更多種疾病特異性免疫原性肽。在一些實施方案中,組合物可以包含兩種或更多種疾病特異性免疫原性突變體肽。在一些實施方案中,兩種或更多種疾病特異性免疫原性肽可以激活對兩個或更多個獨特表位的細胞毒性t細胞應答。
在一些實施方案中,組合物可以包含疾病特異性免疫原性肽的前體(諸如蛋白質、肽、dna和rna)。在一些實施方案中,疾病特異性免疫原性肽的前體可以產生鑑定的疾病特異性免疫原性肽或針對鑑定的疾病特異性免疫原性肽產生疾病特異性免疫原性肽的前體。在一些實施方案中,疾病特異性免疫原性肽的前體可以是前藥。
在一些實施方案中,包含疾病特異性免疫原性肽的組合物可以是藥學可接受的。在一些實施方案中,包含疾病特異性免疫原性肽的組合物可以進一步包含佐劑。例如,可以利用突變肽作為疫苗(參見sahinetal.,int.j.cancer,78:387-9(1998);stumioloetal.,naturebiotechnol,17:555-61(1999);rammenseeetal.,immunolrev188:164-76(2002);及hannanietal.cancerj17:351-358(2011))。此外,依照特定患者的個人需要,疫苗可以含有個體化成分。在一些實施方案中,疫苗可能對特定患者中預測的免疫原性肽是特異性的。在一些實施方案中,疫苗會含有超過一種免疫原性肽或肽前體。在一些實施方案中,疫苗中使用的肽的長度可以在長度上變化。在一些實施方案中,肽的長度是約7至50個胺基酸(諸如約8、9、10、11、12、13、14、15、17、20、22、25、30、35、40、45或50個胺基酸中的任一項)。在一些實施方案中,肽的長度是約8至12個胺基酸。在一些實施方案中,肽的長度是約8至10個胺基酸。肽可以以其分離的形式利用,或者備選可以將肽添加至mhc分離的肽的末端以生成可以證明更具免疫原性的「長肽」(參見例如castleetal.,cancerres72:1081-1091(2012))。在一些實施方案中,肽也可以是加標籤的,或者是融合蛋白,或者是雜合分子。在一些實施方案中,肽是藥學可接受鹽的形式。
在一些實施方案中,疫苗是核酸疫苗。在一些實施方案中,核酸編碼免疫原性肽或肽前體。在一些實施方案中,核酸疫苗包含編碼免疫原性肽或肽前體的序列側翼的序列。在一些實施方案中,核酸疫苗包含超過一種免疫原性表位。在一些實施方案中,核酸疫苗是基於dna的疫苗。在一些實施方案中,核酸疫苗是基於rna的疫苗。在一些實施方案中,基於rna的疫苗包含mrna。在一些實施方案中,基於rna的疫苗包含裸mrna。在一些實施方案中,基於rna的疫苗包含經修飾的mrna(例如,使用魚精蛋白提供保護而免於降解的mrna、含有經修飾的5』cap結構的mrna、或含有經修飾的核苷酸的mrna)。在一些實施方案中,基於rna的疫苗包含單鏈mrna。
多核苷酸可以是基本上純的,或包含在合適的載體或投遞系統中。合適的載體和投遞系統包括病毒,諸如基於腺病毒、痘苗病毒、逆轉錄病毒、皰疹病毒、腺伴隨病毒或含有超過一種病毒的元件的雜合物。非病毒投遞系統包括陽離子脂質和陽離子聚合物(例如陽離子脂質體)。在一些實施方案中,可以使用物理投遞,諸如用「基因槍」。
在一些實施方案中,可以使用本文中描述的肽生成突變體肽特異性治療劑,諸如抗體治療劑。例如,可以使用突變體肽製備和/或鑑定特異性識別突變體肽的抗體。可以使用這些抗體作為治療劑。已經使用合成短肽生成蛋白質反應性抗體。用合成肽免疫的優點是可以使用無限量的純穩定抗原。此方法牽涉合成短肽序列,將它們與大載體分子偶聯,並且用肽-載體分子免疫選擇的動物。抗體的性質取決於一級序列信息。通常可以通過仔細選擇序列和偶聯方法產生對期望肽的良好響應。大多數肽可以引發良好的響應。抗肽抗體的優點是可以在測定突變體肽的胺基酸序列後立即製備它們,並且可以特異性靶向蛋白質的特定區域以進行抗體生成。由於已經對突變體肽篩選高免疫原性,存在有較高的下述機率,即所得的抗體會識別腫瘤環境中的天然蛋白質。如在疫苗情況中一樣,肽的長度是考慮的另一項重要的因素。大致上,10-15個殘基的肽對於抗肽抗體生產是最佳的;肽越長越好,因為可能的表位的數目隨肽長度而增加。然而,長肽增加了合成、純化和與載體蛋白偶聯的困難。抗體的質量依賴於肽的質量。肽產物中含有的副產物可導致低質量的抗體。
肽-載體蛋白偶聯是牽涉高滴度抗體生產的另一項因素。大多數偶聯方法依賴於胺基酸中的反應性官能團,諸如-nh2、-cooh、-sh和酚-oh。定點偶聯是選擇的方法。可以與通過本發明的方法鑑定的肽一起利用在抗肽抗體生成中使用的任何合適的方法。兩種此類已知的方法是多重抗原性肽系統(map)和脂質核心肽(lcp法)。map的優點是綴合方法不是必需的。不將載體蛋白或連接鍵引入免疫的宿主中。一項缺點是肽的純度更難以控制。另外,map可以繞過一些宿主中的免疫應答系統。已知lcp方法提供比其它抗肽疫苗系統更高的滴度,如此可以是有利的。
本文還提供了包含本文中公開的疾病特異性免疫原性突變體肽的分離的mhc/肽複合物。例如,可以使用此類mhc/肽複合物鑑定抗體、可溶性tcr、或tcr類似物。這些抗體的一種類型已經稱作tcr模擬物,因為它們是在特定hla環境的背景中結合來自腫瘤關聯抗原的肽的抗體。已經顯示了此類型的抗體介導在其表面上表達複合物的細胞的裂解,以及保護小鼠免於表達複合物的植入的癌細胞系(參見例如wittmanetal.,j.ofimmunol.177:4187-4195(2006))。tcr模擬物作為iggmab的一項優點是可以實施親和力成熟,並且經由目前的fc域將分子與免疫效應器功能偶聯。也可以使用這些抗體將治療性分子靶向腫瘤,諸如毒素、細胞因子或藥物產品。已經使用肽,諸如使用基於非雜交瘤的抗體生成或有結合能力的抗體片段,諸如噬菌體上的抗肽fab分子的生成使用本發明的方法選擇的那些肽開發出其它類型的分子。還可以將這些片段與用於腫瘤投遞的其它治療性分子綴合,諸如抗肽mhcfab-免疫毒素綴合物、抗肽mhcfab-細胞因子綴合物和抗肽mhcfab-藥物綴合物。
包括免疫原性疫苗的治療方法
本公開內容提供了包含免疫原性疫苗的治療方法。在一些實施方案中,提供了治療疾病(諸如癌症)的方法,其可以包括對個體施用有效量的包含免疫原性肽的組合物。在一些實施方案中,提供了治療疾病(諸如癌症)的方法,其可以包括對個體施用有效量的包含免疫原性肽的前體的組合物。在一些實施方案中,免疫原性疫苗可以包含藥學可接受的疾病特異性免疫原性肽。在一些實施方案中,免疫原性疫苗可以包含疾病特異性免疫原性肽的藥學可接受的前體(諸如蛋白質、肽、dna和rna)。在一些實施方案中,提供了治療疾病(諸如癌症)的方法,其可以包括對個體施用有效量的特異性識別疾病特異性免疫原性突變體肽的抗體。在一些實施方案中,提供了治療疾病(諸如癌症)的方法,其可以包括對個體施用有效量的特異性識別疾病特異性免疫原性突變體肽的可溶性tcr或tcr類似物。
在一些實施方案中,癌症是下列任一種:癌瘤、淋巴瘤、母細胞瘤(blastema)、肉瘤、白血病、鱗狀細胞癌、肺癌(包括小細胞肺癌、非小細胞肺癌、肺腺癌和鱗狀肺癌)、腹膜癌、肝細胞癌、胃癌或胃癌(包括胃腸癌)、胰腺癌、成膠質細胞瘤、宮頸癌、卵巢癌、肝癌、膀胱癌、肝瘤、乳腺癌、結腸癌、黑素瘤、子宮內膜或子宮癌、唾液腺癌、腎癌或腎癌、肝癌、前列腺癌、外陰癌、甲狀腺癌、肝的癌、頭和頸癌、結腸直腸癌、直腸癌、軟組織肉瘤、卡波西(kaposi)氏肉瘤、b細胞淋巴瘤(包括低級/濾泡性非何杰金淋巴瘤(nhl)、小淋巴細胞性(sl)nhl、中級/濾泡性nhl、中等級瀰漫性nhl、高級成免疫細胞性nhl、高級成淋巴細胞性nhl、高級小非切割細胞nhl、大體積疾病nhl、套細胞淋巴瘤、aids相關淋巴瘤、和沃爾登斯特倫(waldenstrom)巨球蛋白血症)、慢性淋巴細胞性白血病(cll)、急性成淋巴細胞性白血病(all)、骨髓瘤,多毛細胞白血病、慢性成髓細胞白血病和移植後淋巴增殖性病症(ptld)以及與斑痣性錯構瘤病相關的異常血管增生、水腫(諸如與腦腫瘤相關)和麥格氏(meigs)症候群
本文中描述的方法在個性化醫學背景下是特別有用的,其中使用通過本文中描述的任一種方法獲得的疾病特異性免疫原性突變體肽開發用於同一個體的治療劑(諸如疫苗或治療性抗體)。因此,例如,在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括:a)鑑定個體中的疾病特異性免疫原性突變體肽;並且b)合成肽或肽前體;並且c)對個體施用肽。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括:1)鑑定個體中的疾病特異性免疫原性突變體肽;b)生成特異性識別突變體肽的抗體;並且c)對個體施用肽。在一些實施方案中,鑑定步驟將序列特異性變體鑑定方法與免疫原性預測方法組合。在一些實施方案中,鑑定步驟將序列特異性變體鑑定方法與質譜術組合。可以使用本文中描述的鑑定疾病特異性免疫原性突變體肽的任何方法進行本文中描述的治療方法。在一些實施方案中,方法還包括自個體獲得疾病組織的樣品。
可以使用本文中提供的方法治療已經診斷具有或懷疑具有癌症的個體(例如人)。在一些實施方案中,個體可以是人。在一些實施方案中,個體可以是至少約35、40、45、50、55、60、65、70、75、80或85歲齡的至少約任一項。在一些實施方案中,個體可以是男性。在一些實施例中,個體可以是女性。在一些實施例中,個體可以已經拒絕手術。在一些實施方案中,個體可以是醫學上不能手術的。在一些實施方案中,個體可以處於ta、tis、t1、t2、t3a、t3b或t4的臨床階段。在一些實施方案中,癌症可以是復發性的。在一些實施方案中,個體可以是展現出與癌症相關的一種或多種症狀的人。在一些實施方案中,個體可以在遺傳上或在其它方面有形成癌症的素因(例如具有風險因素)。
可以在佐劑背景中實施本文中提供的方法。在一些實施方案中,在新輔助背景中實施方法,即可以在初步/確定性療法前實施方法。在一些實施方案中,使用方法治療先前已經治療的個體。可以使用本文中提供的任何治療方法治療先前尚未治療的個體。在一些實施方案中,使用該方法作為一線療法。在一些實施方案中,使用該方法作為二線療法。
在一些實施方案中,提供了降低個體中預先存在的癌症腫瘤轉移(諸如肺轉移或轉移至淋巴結)的發生或負擔的方法,其包括對個體施用有效量的包含免疫原性疫苗的組合物。
在一些實施方案中,提供了延長個體中的癌症疾病進展前時間的方法,其包括對個體施用有效量的包含免疫原性疫苗的組合物。
在一些實施方案中,提供了延長具有癌症的個體的存活的方法,其包括對個體施用有效量的包含免疫原性疫苗的組合物。
在一些實施方案中,在包含免疫原性疫苗的組合物外,可以施用至少一種或多種化學治療劑。在一些實施方案中,一種或多種化學治療劑可以(但不一定)屬於不同類別的化學治療劑。
在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括施用:a)免疫原性疫苗,和b)免疫調節劑。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括施用:a)免疫原性疫苗,和b)檢查點蛋白的拮抗劑。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括施用:a)免疫原性疫苗,和b)程序性細胞死亡1(pd-1)的拮抗劑,諸如抗pd-1。在一些實施方案中,提供了治療個體中的疾病(諸如癌症)的方法,其包括施用:a)免疫原性疫苗,和b)程序性死亡配體1(pd-l1)的拮抗劑,諸如抗pd-l1。在一些實施方案中,提供了治療個體中疾病(諸如癌症)的方法,其包括施用:a)免疫原性疫苗,和b)細胞毒性t淋巴細胞相關蛋白4(ctla-4)拮抗劑,諸如抗ctla-4。
實施例1
此實施例演示了用於預測免疫原性肽表位的例示性方法。
對mc-38和tramp-c1小鼠腫瘤細胞系實施全外顯子組測序以鑑定腫瘤特異性點突變。相對於參照小鼠基因組調用編碼變體以分別鑑定mc-38和tramp-c1中的4285和949種非同義變體。隨後,通過rna-seq分析針對基因表達過濾數據,並且揭示了分別在mc-38和tramp-c1中表達1290和67種突變基因。使用netmhc-3.4算法鑑定出mc-38中170種預測的新表位和tramp-c1腫瘤中6種預測的新表位。
接著,使用轉錄物組生成的fasta資料庫的質譜分析揭示了由mc-38細胞系呈現的797種獨特的h-2kb表位和725種獨特的h-2db表位,以及由tramp-c1細胞系呈現的477種獨特的h-2kb表位和332種獨特的h-2kb表位。觀察到自豐富的轉錄物衍生的肽更可能由mc-38(圖2a)和tramp-c1(圖2b)細胞中的mhci呈遞。
分別在mc-38和tramp-c1中的1290和67種胺基酸變化中,通過質譜術僅發現在mhci上呈遞7種(mc-38中的7種和tramp-c1中的0種)(表1)。在mc-38細胞中通過質譜術也檢測到自癌症睪丸自身抗原mage-d1衍生的一種表位。手動驗證這些肽,並且與肽的合成生成型式比較以實現準確性。預測除了一種外的所有新表位結合mhci(ic50<500nm,表1)。野生型(wt)和突變體轉錄物兩者均由腫瘤細胞表達,並且雖然預測大多數相應的wt肽也結合mhci,但是通過質譜術僅檢測到它們中的三種。
雖然對mhci的肽結合親和力和免疫原性之間存在有關聯,但其它因素也有所貢獻。例如,突變胺基酸與tcr的相互作用可能對於將突變的肽識別為「非自身」是必需的。當相應的wt肽也在mhci上呈現時尤其如此。7種新表位中的5種展現出高結合預測評分(根據netmhc3.4,ic50<50nm,表1)。其它新表位展現出較低的結合預測得分,這提示了它們可以是不太有免疫原性的。利用h-2db和h-2kb的發表的晶體結構和基於rosetta的算法對與mhci的複合物中的每種突變體肽建模並且分析每種新表位中的突變體殘基與t細胞受體相互作用的潛力。通常,展示的肽的tcr識別由與肽殘基3到7的相互作用介導。僅在reps1和adpgk肽中具有高結合得分的肽在此範圍內具有突變。結構建模還預測突變的殘基朝向溶劑界面定向,並且如此判斷為具有呈免疫原性的良好潛力(表1和圖3)。另一方面,irgq、aatf、dpagt1新表位中的突變存在於肽的c末端附近,其可能落在tcr結合區外部,並且提示了這些新表位不可能是免疫原性的(表1和圖3)。
接著,通過與佐劑組合用編碼突變表位的長肽免疫野生型c57bl/6小鼠評估突變腫瘤抗原的免疫原性,並且使用mhci/肽特異性dextramer測量cd8t細胞應答。如圖4a中顯示的,與僅佐劑的組相比,6種肽中的3種引發cd8t細胞應答。基於結構和結合親和力預測,預測reps1和adpgk是免疫原性的,並且兩者都引發強的cd8t細胞應答。在預測為非免疫原性的4種肽中,僅dpagt1誘導弱的cd8t細胞應答。
通過分析腫瘤浸潤細胞(til)在腫瘤的背景中確認了這些突變體肽的免疫原性。觀察到對reps1、adpgk和dpagt1特異性的t細胞在腫瘤床中是富集的(圖4b)。雖然存在有異質性,但是adpgk特異性cd8t細胞在三種中是最豐富的,並且這對mc-38腫瘤是特異性的,因為在同基因tramp-c1腫瘤中檢測不到adpgk特異性cd8t細胞。令人感興趣地,通過質譜術鑑定的自單一癌症睪丸自身抗原(mage-d1)衍生的肽顯示較差的免疫原性,並且在腫瘤床中檢測不到對mage-d1特異性的cd8t細胞(數據未顯示)。
通常分析體積til以監測抗腫瘤應答,這可以不提供真正的評估,因為僅一定分數的til是腫瘤特異性的。使用針對三種免疫原性肽的mhci/肽特異性dextramer檢查與體積til相比抗腫瘤til的頻率和表型。腫瘤特異性cd8t細胞浸潤腫瘤的頻率首先增加,並且隨腫瘤進一步增長而下降,這提示了腫瘤生長與腫瘤中腫瘤特異性cd8t細胞的頻率呈反相關(圖4c)。令人感興趣地,大多數(76.9±7.1%)腫瘤特異性cd8til共表達pd-1和tim-3,與體積til相比t細胞耗盡的標誌物(52.6±3.6%)(圖4d)。腫瘤特異性cd8til也表達較高的表面pd-1水平。
為了測定針對新表位誘導的cd8t細胞是否能提供保護性抗腫瘤免疫,用突變的肽疫苗免疫健康的小鼠,隨後用mc-38腫瘤細胞攻擊。與單獨的佐劑相比,腫瘤生長在疫苗組中的大多數動物中受到完全抑制(圖5a)。在此實驗中生長出腫瘤的單一動物實際上不響應疫苗,強烈支持對突變的肽特異性的cd8t細胞應答賦予保護的可能性(圖5a)。
接著,評估新表位特異性cd8t細胞應答以觀察它們是否可以在免疫後在攜帶腫瘤的小鼠中進一步擴增。在單次免疫後,與未免疫的健康動物相比,adpgk反應性cd8t細胞的頻率在攜帶腫瘤的小鼠的脾中顯著增加(圖4b)。也觀察到在腫瘤中的總cd8til中adgpk特異性cd8t細胞的積累的幾乎三倍增加(圖5b)。肽疫苗接種還增加了腫瘤中cd45+細胞和cd8+t細胞的總體浸潤,這導致腫瘤中總活細胞中新表位特異性cd8t細胞的頻率的幾乎20倍增加(圖5c)。
此外,分析了通過疫苗接種誘導的肽特異性細胞的表型。發現tim-3+pd-1+adgpk特異性cd8til的頻率在疫苗接種後降低,並且這些細胞上pd-1和tim-3的表達表達也是降低的(圖5d和圖5e)。這可以是佐劑效應,因為在僅佐劑的組中也看到它。此結果提示了,腫瘤特異性t細胞在疫苗接種後展現出消耗較少表型,並且這得到接種疫苗的腫瘤中較高的ifn-γ表達性cd8和cd4til的百分比進一步確認(圖5f)。
最後,評估這些疫苗誘導的腫瘤特異性cd8t細胞的定性和定量變化是否可以轉化為建立的腫瘤的消退。即使在此較為困難的治療背景中,與未處理的對照或僅佐劑的組相比,接種疫苗的小鼠顯示顯著的對腫瘤生長的抑制(圖5g)。如此,用具有預測的新表位的簡單肽疫苗接種產生了足夠的t細胞免疫以排斥以前建立的腫瘤。
方法
對h-2b-背景的兩種鼠細胞系:tramp-c1(atcc)和mc-38(academischziekenhuisleiden)的h-2kb和h-2db配體組進行mhci肽概況分析。如先前描述的那樣製備自c57bl/6小鼠衍生的細胞。關於製備細胞系的方法的完整描述,參照美國專利申請流水號13/087,948和美國專利申請流水號11/00,474。使用兩種不同的抗體免疫沉澱每份樣品的mhci分子,以分別提取h-2kb特異性和h-2db特異性肽。通過使用180分鐘梯度的反相層析(nanoacquityuplc系統,waters,milford,ma)分離肽。通過配備有電噴霧離子化(esi)源的ltq-orbitrapvelos雜合質譜儀(thermofisherscientific,bremen,germany)中的數據依賴性獲得(dda)分析洗脫的肽。使用下述方法獲得質譜數據,所述方法包括在orbitrap(對於前3為r=30,000,對於前5為r=60,000)中的高質量準確性的全掃描(調查掃描),接著進行對5種最豐富的前體離子(前5)在orbitrap(r=7500)中或者對3種最豐富的前體離子(前3)在ltq中的ms/ms(概況)掃描。對每套樣品進行7份重複試樣注射和分析。
在ltq-orbitrapelite質譜儀(thermofisher,bremen,germany)上分析對應於鑑定突變體mc-38和tramp-c1抗原肽的合成肽,並使用advance源(michrom-bruker,fremont,ca)以1.2kv的噴射電壓離子化。使用由以下組成的方法獲得質譜數據:以60,000m/δm的解析度在m/z400在orbitrap中的一次完全ms掃描(375-1600m/z),接著是在肽片段離子的ltq中的ms/ms(形心)掃描。
使用來自mc-38和tramp-c1癌細胞系的1μg總rna使用truseqrna樣品製備試劑盒(illumina,ca)產生rna-seq文庫。自細胞系純化總rna,並將其片段化成200-300個鹼基對(bp),平均長度為260bp。將rna-seq文庫多路復用(每道兩種),並且按照製造商的推薦(illumina,ca)在hiseq2000上測序。
每份樣品產生大於約5000萬個配對末端(2x100bp)測序讀段。使用sureselecthumanallexome試劑盒(50mb)(agilent,ca)實施外顯子組捕捉。然後,使用hiseq測序試劑盒(200個循環)在hiseq2000(illumina,ca)上對外顯子組捕捉文庫測序。
自mc-38測序9290萬(m)個rna片段,並且自tramp-c1測序65.3m個rna片段。對於外顯子組測序,自每種細胞系測序60m個讀段。使用gsnap(wuandnacu,bioinformatics,2010,v.26,873-881)將讀段定位到小鼠基因組(ncbi37或mm9版本)。僅保留獨特定位的讀取以進一步分析。在mc-38樣品中獨特定位80.6m個rna片段,並且在tramp-c1樣品中定位57.6m個rna片段。獨特定位mc-38中的50.9m個外顯子片段和tramp-c1中的52m個片段。為了獲得小鼠基因模型,使用gmap將refseq小鼠基因定位至mm9基因組,然後使用基因組序列做出基因模型。
使用gatk1調用基於外顯子組-seq的變體。保留具有10%或更大的等位頻率的變體。使用變體效應預測器工具2在對轉錄物的影響方面注釋變體。僅保留可以解讀胺基酸變化的變體。為了獲得具有表達證據的變體,用rna-seq讀取比對對基於外顯子組的變體位置檢查變異的證據。保留了變體,所述變體通過超過2個rna-seq讀段證實並且基於rna-seq以10%或更多的等位頻率表達。
對於每種胺基酸變異,產生變體全蛋白序列以形成一組推定蛋白,以充當用於搜索lc-ms譜的參照資料庫。在缺乏單體型信息的情況中,相同蛋白質中的多種變異會以資料庫中的不同變體蛋白質為特徵。
使用mascot算法版本2.3.02(matrixscience,london,uk)針對多環靶物誘餌資料庫uniprot版本2011_12或轉錄物組生成的fasta資料庫提交串聯質譜結果用於蛋白質資料庫檢索;包括鼠蛋白和常見的實驗室汙染物,諸如胰蛋白酶。在無酶特異性、甲硫氨酸氧化(+15.995da)和20ppm前體離子質量耐受性的情況下搜索數據。
對於在ltq或orbitrap中獲得的ms/ms數據,分別在0.8da或0.05da處規定片段離子質量耐受性。使用線性判別算法(lda)將搜索結果過濾至5%的估計的肽假髮現率(fdr)。為了突變體肽鑑定中較高的置信度,通過肽長度(對於h-2kb數據為8和對於h-2db為9)或者採用規則表達以分離具有以下充分表徵的錨定基序h-2kb:xxxx[fy]xx[milv](seqidno.22)和h-2db:xxxx[n]xxx[mil](seqidno.23)的肽進一步過濾數據。產生合成肽以驗證序列。
為了產生第一模型,基於模型結構中突變體肽和肽之間的序列相似性,自pdb選擇肽-mhc複合物結構。對於每種突變體肽模型,使用以下pdb代碼:reps1、2zol4;adpgk、1hoc5;dpagt1、3p9l6;cpne1、1juf7;irgq、1ffn8;aatf,1bz9。由於缺乏可以作為合理起始模型使用的與10聚體肽的複合物中的發表的h-2kb晶體結構,沒有對med12肽建模。然後,使用coot10將肽修飾為突變體形式。然後,使用rosettaflexpepdock網絡伺服器11優化這些第一模型,並選擇最高評分模型進行展示。
還檢查了每種肽的頂部評分flexpepdock模型,並且發現主鏈定位對於產生的前10種模型是相似的。使用pymol(llc)產生肽-mhc圖像。
給齡期匹配的6-8周齡c57bl/6小鼠(thejacksonlaboratory)腹膜內注射pbs中各自與佐劑(50μg抗cd40ab克隆fjk45加上100mg聚(i:c)(invivogen))組合的50mg長肽。在第0天和第14天以及最後一次注射後一周免疫小鼠,使用血液或脾細胞檢測ag特異性cd8t細胞。為了鑑定肽特異性t細胞,用pe綴合的dextramer(mhci/肽複合物;immudex,denmark)將細胞染色20分鐘,接著用細胞表面標誌物cd3、cd4、cd8和b220(bdbiosciences)染色。肽序列如下
reps1:grvlelfraaqlandvvlqimelcgatr(seqidno.1);
adpgk:gipvhlelasmtnmelmssivhqqvfpt(seqidno.2);
dpagt1:eagqslvisasiivfnllelegdyr(seqidno.3);
aatf:skllsfmapidhttmsddartelfrs(seqidno.4);
irgq:kardetaallnsavlgaaplfvppad(seqidno.5);
cpne1:dftgsngdpsspyslhylsptgvney(seqidno.6);
med12:gpqekqqrvelssisnfqavselltfe(seqidno.7)。
給c57bl/6小鼠在右體側上皮下植入1x105個mc-38腫瘤細胞。分離整個腫瘤,並用膠原酶和dna酶消化以分離til。用dextramer(如上文描述),接著是針對cd45、thy1.2、cd4、cd8(bdbiosciences)、pd-1(ebiosciences)和tim-3(r&dsystems)的抗體染色til。使用活/死染色對活細胞門控。
給所有動物皮下(右後體側)接種漢克氏平衡鹽溶液(hbss)和無酚紅基質膠(bectondickinsonbioscience,sanjose,ca)的懸浮液中1x105個mc-38細胞。對於預防性研究,在腫瘤接種前3周用佐劑(50mg抗cd40加100mg聚(i:c)或佐劑與各50μgreps1、adpgk和dpagt1肽免疫小鼠。在用腫瘤細胞接種前一天,在血液中測量肽特異性cd8t細胞的誘導。對於攜帶腫瘤的小鼠中的疫苗接種,在用1x105個mc-38腫瘤細胞接種後10天(在研究中包括僅在第10天時具有約100-150mm3體積的腫瘤),用佐劑或佐劑與各50μgreps1、adpgk和dpagt1肽注射小鼠。一周兩次收集測量和重量。每天稱重展現出動物的第一次體重的超過15%的重量減輕的動物,並且如果它們減輕其第一次體重的超過20%,那麼實施安樂死。
較頻繁,根據嚴重性直至每天觀察到展現出不利臨床問題的動物,並且並且如果瀕死,那麼實施安樂死。如果腫瘤體積超過3,000mm3,或在3個月後(若未形成腫瘤),那麼對小鼠實施安樂死。貫穿整個研究,一周兩次實施所有小鼠的臨床觀察。
表
表1:在mc-38細胞系中的mhci上呈遞的突變體肽的匯總。
*每種基因的頂部列出的序列是wt序列,並且每種基因的底部列出的序列是突變體序列。
序列表
l·德拉馬爾(delamarre,leila)
p·盧帕杜斯(lupardus,patrick)
i·梅爾曼(mellman,ira)
m·亞達夫(yadev,mahesh)
s·瓊瓊瓦拉(jhunjhunwala,suchit)
j·萊爾(lill,jennie)
免疫原性突變體肽篩選平臺
146392027600
未指派
隨本文
62/048,742
2014-09-10
23
fastseqforwindowsversion4.0
1
28
prt
人工序列
合成構建物
1
glyargvalleugluleupheargalaalaglnleualaasnaspval
151015
valleuglnilemetgluleucysglyalathrarg
2025
2
28
prt
人工序列
合成構建物
2
glyileprovalhisleugluleualasermetthrasnmetgluleu
151015
metserserilevalhisglnglnvalpheprothr
2025
3
25
prt
人工序列
合成構建物
3
glualaglyglnserleuvalileseralaserileilevalpheasn
151015
leuleugluleugluglyasptyrarg
2025
4
26
prt
人工序列
合成構建物
4
serlysleuleuserphemetalaproileasphisthrthrmetser
151015
aspaspalaargthrgluleupheargser
2025
5
26
prt
人工序列
合成構建物
5
lysalaargaspgluthralaalaleuleuasnseralavalleugly
151015
alaalaproleuphevalproproalaasp
2025
6
26
prt
人工序列
合成構建物
6
aspphethrglyserasnglyaspproserserprotyrserleuhis
151015
tyrleuserprothrglyvalasnglutyr
2025
7
27
prt
人工序列
合成構建物
7
glyproglnglulysglnglnargvalgluleuserserileserasn
151015
pheglnalavalsergluleuleuthrpheglu
2025
8
8
prt
人工序列
合成構建物
8
serileilevalpheasnleuval
15
9
8
prt
人工序列
合成構建物
9
serileilevalpheasnleuleu
15
10
9
prt
人工序列
合成構建物
10
alaglnleuproasnaspvalvalleu
15
11
9
prt
人工序列
合成構建物
11
alaglnleualaasnaspvalvalleu
15
12
9
prt
人工序列
合成構建物
12
alasermetthrasnarggluleumet
15
13
9
prt
人工序列
合成構建物
13
alasermetthrasnmetgluleumet
15
14
9
prt
人工序列
合成構建物
14
serserproaspserleuhistyrleu
15
15
9
prt
人工序列
合成構建物
15
serserprotyrserleuhistyrleu
15
16
9
prt
人工序列
合成構建物
16
alaalaleuleuasnseralaglyleu
15
17
9
prt
人工序列
合成構建物
17
alaalaleuleuasnseralavalleu
15
18
9
prt
人工序列
合成構建物
18
metalaproileasphisthralamet
15
19
9
prt
人工序列
合成構建物
19
metalaproileasphisthrthrmet
15
20
10
prt
人工序列
合成構建物
20
aspproserserservalleuphegluasp
1510
21
10
prt
人工序列
合成構建物
21
aspproserserservalleupheglutyr
1510
22
8
prt
人工序列
合成構建物
變體
1,2,3,4,6,7
xaa=任何胺基酸
變體
5
xaa=phe或tyr
變體
8
xaa=met,ile,leu或val
22
xaaxaaxaaxaaxaaxaaxaaxaa
15
23
9
prt
人工序列
合成構建物
變體
1,2,3,4,6,7,8
xaa=asp或gly
變體
5
xaa=asn
變體
9
xaa=met,ile或leu
23
xaaxaaxaaxaaxaaxaaxaaxaaxaa
15
