一種基於新型磁性多孔材料的磷酸肽富集新方法與流程
2023-06-10 05:47:46 3
本發明涉及分析化學領域,具體是一種基於新型磁性多孔材料的磷酸肽富集新方法。
背景技術:
蛋白質磷酸化修飾作為一種重要的蛋白質翻譯後修飾方式,廣泛參與調控細胞內諸多生命活動。雖然磷酸化蛋白質組學已經取得了很大的進展,但由於磷酸肽豐度低、不易離子化且在質譜鑑定中存在大量非特異性肽段的幹擾,使得磷酸肽的直接鑑定存在很多困難。因此,研究快速高效、特異性強的磷酸肽富集分離方法仍然有著十分重要的意義。
目前,應用較為廣泛的磷酸肽富集分離方法主要有金屬氧化物親和色譜法(Metal Oxide Affinity Chromatography,MOAC)和固相金屬離子親和色譜法(Immobilized metal ion affinity chromatography,IMAC)。其中,金屬氧化物親和色譜法中基於TiO2的富集分離方法由於具有較高的特異性和靈敏度而應用最為頻繁。但研究證明TiO2更易分離出單磷酸化肽段,由於TiO2對多磷酸化位點肽段具有較強的吸附性而不易將其洗脫。該方法對於鑑定多磷酸肽仍然存在一定困難。因此,基於IMAC的磷酸肽富集分離策略由於對單位點磷酸化肽段和多位點磷酸化肽段的富集不存在偏性而受到了越來越多的關注。IMAC富集磷酸肽的基本原理是Zr4+,Fe3+,Ti4+等金屬陽離子與適當的配體(如磷酸基團、氨三乙酸、亞氨乙酸)進行螯合形成金屬複合物從而將金屬離子固定在材料表面。在酸性環境下,磷酸肽特有的磷酸基團通過與金屬離子的螯合作用吸附在材料上,從而與樣品中的非磷酸化肽段進行了分離。在鹼性環境下,這種特異性吸附作用被破壞,磷酸肽被洗脫下來進而進行鑑定。然而研究表明,基於傳統IMAC方法富集磷酸肽的特異性不高。一方面,單一金屬離子的應用使材料在富集磷酸肽的同時也吸附了一些非特異性肽段,導致磷酸肽在質譜檢測中信號受到抑制而影響檢測效果;另一方面,用於固載金屬的配體的親疏水性也直接影響磷酸肽的富集效果。
金屬有機骨架(metal-organic frameworks,MOF)材料是一類由金屬離子和有機配位體通過自組裝形成的材料。由於其具有較大的比表面積和孔隙率、結構和功能的可變性,已廣泛應用於氫氣儲存、催化、生物傳感器、氣體分離等領域。
為了使MOFs材料有更廣泛的應用,目前有兩種方法對MOFs材料進行功能基團修飾,即合成前功能化和合成後修飾。合成前功能化策略是指在MOFs材料合成前選擇具有功能基團的配體,合成後的MOFs材料帶有此目標基團,IRMOFs(Isoreticular Metal–Organic Framework)和ZIF(Zeolitic Imidazolate Frameworks)系列材料都是利用該方法合成的。合成後修飾方法是指通過與MOFs材料的固有基團的共價連接或與不飽和金屬離子的配位作用而引入新的功能基團,該方法已被證明是MOFs材料進行合成後修飾和應用的一種高效而實用的方法。
最近,在蛋白質組學領域研究中,MOFs材料已合成並應用於大分子蛋白的篩除、低豐度肽段富集、磷酸肽/糖肽富集等。Gu等人合成了MIL-53,MIL-100,MIL-101用於肽段富集,由於MOFs材料中的孔徑結構,使得在富集肽段的同時,又可以去除分子量較大的蛋白質,實現了蛋白和肽段的分離,然而這幾種MOFs材料需要藉助離心的手段進行分離,使得操作過程不便而且容易引起材料的丟失;Zhao等合成了Fe3O4@PDA@[Cu3(btc)2]用於不同蛋白酶的固定和蛋白質的酶解,然而由於蛋白酶是通過非特異性吸附作用固定在材料上的,導致在蛋白質酶切的過程中酶會隨著溫度等變化而從材料上脫落,這極大限制了該類固定化酶反應器的應用。因此,考慮到蛋白酶固定在MOFs材料上的不同方式以及磁性材料易於操作的優勢,設計和和合成新型的磁性MOFs材料用於蛋白酶的共價固定仍然是十分必要的。
技術實現要素:
本發明的目的在於提供一種基於新型磁性多孔材料的磷酸肽富集新方法,以解決上述背景技術中提出的問題。
為實現上述目的,本發明提供如下技術方案:
一種基於新型磁性多孔材料的磷酸肽富集新方法,包括:
(1)磁性MOFs材料Fe3O4@DOTA-ZIF-90的製備
首先,將DOTA共價連接到經過氨基修飾的磁性納米材料NH2-MNP表面;隨後金屬離子Zn2+通過與DOTA的螯合作用固定在材料表面形成Fe3O4@DOTA-Zn納米顆粒;然後,將所得到的Fe3O4@DOTA-Zn顆粒懸浮於含硝酸鋅和2-咪唑甲醛的DMF溶液中;
(2)磷酸肽富集
採用步驟(1)製備的磁性MOFs材料Fe3O4@DOTA-ZIF-90進行標準磷酸化蛋白和Hela細胞全蛋白提取物複雜樣本中的磷酸肽富集。
作為本發明進一步的方案:步驟(1)的具體操作步驟為:一、將1mLNH2-MNP置於含有10mgDOTA的乙腈溶液中,反應4h,然後用水和乙醇分別洗滌三次;將磁性納米顆粒重懸在含有8mMZn(NO3)2·4H2O的乙醇溶液中,70℃條件下反應6h,得到Fe3O4@DOTA-Zn2+顆粒;將得到的Fe3O4@DOTA-Zn2+顆粒用乙醇和去離子水分別洗滌三次,並在4℃條件下儲存備用;二、將硝酸鋅和2-咪唑甲醛按2:3的摩爾比溶解於DMF溶液,然後從步驟一得到的Fe3O4@DOTA-Zn2+顆粒中取1mL加入到含硝酸鋅和2-咪唑甲醛的DMF溶液中,將混合物溶液在100℃條件下加熱18h,起始外層ZIF-90的生長,得到磁性MOFs材料Fe3O4@DOTA-ZIF-90;三、通過外加磁場對上述磁性MOFs材料Fe3O4@DOTA-ZIF-90進行分離和收集,並分別用DMF和二氯甲烷進行洗滌,最後將所得磁性MOFs材料Fe3O4@DOTA-ZIF-90在80℃烘箱中烘乾備用。
作為本發明再進一步的方案:步驟(2)的具體步驟為:取磁性MOF材料置於1.5mL離心管中,用上樣緩衝液(50%乙腈,1%TFA)清洗三次;向離心管中加入150μL上樣緩衝液重懸磁性MOF材料,加入蛋白酶切產物,室溫渦旋15min;在外加磁場作用下,吸去上清液,用上樣緩衝液和洗滌緩衝液(50%乙腈,0.1%TFA)各漂洗材料三次;用1μL 0.1M氨水洗脫結合在材料上的磷酸肽,重複五次。
作為本發明再進一步的方案:所述NH2-MNP通過熱溶劑法製備。
與現有技術相比,本發明的有益效果是:
該合成的磁性MOF材料具有較大的金屬固載量、穩定的金屬複合物以及良好的親水性;實驗結果表明,合成的不同金屬離子固載的磁性MOF材料在全磷酸肽富集過程中具有更高的選擇性、靈敏度及富集效率;與傳統的TiO2方法相比,由於材料具有良好的磁響應能力使得操作過程更加省時、便捷。
附圖說明
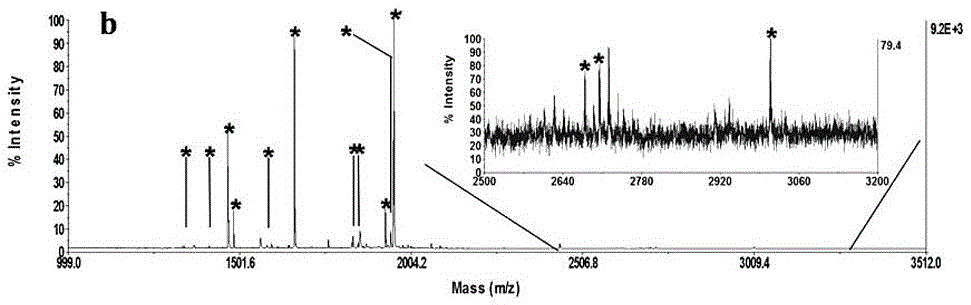
圖1為固載Ti的磁性MOF材料富集磷酸肽後的質譜圖。
圖2為固載Zr的磁性MOF材料富集磷酸肽後的質譜圖。
圖3為固載Fe的磁性MOF材料富集磷酸肽後的質譜圖。
圖4為固載Tb的磁性MOF材料富集磷酸肽後的質譜圖。
圖5為固載Tm的磁性MOF材料富集磷酸肽後的質譜圖。
圖6為固載Ho的磁性MOF材料富集磷酸肽後的質譜圖。
具體實施方式
下面結合具體實施方式對本專利的技術方案作進一步詳細地說明。
請參閱圖1-6,一種基於新型磁性多孔材料的磷酸肽富集新方法,包括:
(1)磁性MOFs材料Fe3O4@DOTA-ZIF-90的製備
磁性MOFs材料的合成方法使用熱溶劑法、合成前功能化法或合成後修飾法。首先,將DOTA共價連接到經過氨基修飾的磁性納米材料NH2-MNP表面;隨後金屬離子Zn2+通過與DOTA的螯合作用固定在材料表面形成Fe3O4@DOTA-Zn納米顆粒;然後,將所得到的Fe3O4@DOTA-Zn顆粒懸浮於含硝酸鋅和2-咪唑甲醛的DMF溶液中,基於DOTA和金屬離子Zn2+的金屬複合物的穩定存在保證了MOFs材料在磁性納米顆粒表面的生長;
具體操作步驟如下:一、將1mLNH2-MNP置於含有10mgDOTA的乙腈溶液中,反應4h,然後用水和乙醇分別洗滌三次;將磁性納米顆粒重懸在含有8mMZn(NO3)2·4H2O的乙醇溶液中,70℃條件下反應6h,得到Fe3O4@DOTA-Zn2+顆粒;將得到的Fe3O4@DOTA-Zn2+顆粒用乙醇和去離子水分別洗滌三次,並在4℃條件下儲存備用;二、將硝酸鋅和2-咪唑甲醛按2:3的摩爾比溶解於DMF溶液,然後從步驟一得到的Fe3O4@DOTA-Zn2+顆粒中取1mL加入到含硝酸鋅和2-咪唑甲醛的DMF溶液中,將混合物溶液在100℃條件下加熱18h,起始外層ZIF-90的生長,得到磁性MOFs材料Fe3O4@DOTA-ZIF-90;三、通過外加磁場對上述磁性MOFs材料Fe3O4@DOTA-ZIF-90進行分離和收集,並分別用DMF和二氯甲烷進行洗滌,最後將所得磁性MOFs材料Fe3O4@DOTA-ZIF-90在80℃烘箱中烘乾備用。
(2)磁性MOFs材料Fe3O4@DOTA-ZIF-90的表徵
使用掃描電鏡(HitachiS-4800)觀察磁性MOFs材料的形貌、粒徑和尺寸;採用能量散射X射線進行元素分析;紅外光譜分析由Nicolet傅立葉變換紅外光譜儀(Nicolet)完成,樣品採用KBr壓片法製備;熱重分析(TGA)由熱重分析儀(SDTQ600)完成,整個實驗操作在氮氣氛圍進行;樣品磁學性能用物理性能測量系統(QuantumDesign)在室溫下測定;X射線衍射分析使用布魯克X射線衍射儀(D8Advance)完成。
(3)標準蛋白酶切產物的製備
將500μg標準磷酸化蛋白α-酪蛋白溶解於100µL的50mM碳酸氫銨溶液,放入沸水中變性10min;按蛋白質:胰蛋白酶=50:1的質量比加入胰蛋白酶,在37℃水浴中孵育16h,收集的酶切肽段分裝後在-20℃條件下保存,備用;將1mg牛血清白蛋白(BSA)溶解於50mM碳酸氫銨溶液,經過DTT還原變性和IAA烷基化處理後,按上述步驟進行酶切,收集的肽段分裝後在-20℃條件下保存,備用。
(4)Hela細胞蛋白酶切產物的製備
將Hela細胞轉移至含有10%胎牛血清的DMEM培養液中,置於培養箱中培養(37℃,5%CO2,飽和溼度);收集培養的Hela細胞置於細胞裂解液中(8M尿素,50mMTris-HCL緩衝液,1%二硫蘇糖醇,1mM氟化鈉,0.2mM釩酸鈉,2mM焦磷酸鈉),冰上裂解30min後,將樣品在4℃以14000g轉速離心10min;收集上清液,在沸水中變性5min;變性後的蛋白樣品的酶切使用FASP(filteraidedsamplepreparation)方法去除尿素,最後用NanoDrop測量收集的肽段濃度。
(5)磷酸肽富集
取磁性MOF材料置於1.5mL離心管中,用上樣緩衝液(50%乙腈,1%TFA)清洗三次;向離心管中加入150μL上樣緩衝液重懸磁性MOF材料,加入蛋白酶切產物,室溫渦旋15min;在外加磁場作用下,吸去上清液,用上樣緩衝液和洗滌緩衝液(50%乙腈,0.1%TFA)各漂洗材料三次;用1μL0.1M氨水洗脫結合在材料上的磷酸肽,重複五次。將洗脫下來的磷酸肽與1μLDHB基質(50%ACN,0.1%H3PO4)混合點於4800MALDI-TOF/TOFMS靶上,自然風乾後進行質譜檢測,或將洗脫下來的磷酸肽經過脫鹽處理後進行液-質聯用分析。
作為優選,所述NH2-MNP通過熱溶劑法製備;
一、磁性MOFs材料Fe3O4@DOTA-ZIF-90的表徵結果:
磁性MOFs材料Fe3O4@DOTA-ZIF-90的粒徑明顯增大,平均直徑約為30um;ZIF-90成功沉積在磁性納米材料中;磁性MOFs材料Fe3O4@DOTA-ZIF-90具有極良好的熱穩定性;磁性MOFs材料Fe3O4@DOTA-ZIF-90可以在外加磁場的作用下實現快速分離;磁性MOFs材料Fe3O4@DOTA-ZIF-90具有較大比表面積。
二、固載不同金屬離子的磁性MOF材料富集磷酸肽效果考察
實驗組處理:首先,1ugα-酪蛋白酶切後肽段與150uL單一過渡金屬離子固載的磁性MOF材料室溫混合15mins,通過外加磁場分離後磁性MOF材料經上樣緩衝液(50%乙腈,1%TFA)、洗滌緩衝液(50%乙腈,0.1%TFA)和去離子水各洗滌三次,最後用0.1M氨水洗脫富集的磷酸肽進行質譜分析。
對照組處理:未經材料富集的α-酪蛋白酶切後肽段直接進行質譜分析。
實驗結果:磷酸化肽段且信號顯著提高,非磷酸化肽段幾乎檢測不到。其中,經Fe3O4@DOTA-ZIF-90-Ti和Fe3O4@DOTA-ZIF-90-Tb富集後可鑑定到15條磷酸化肽段,而基於Zr4+,Fe3+,Tm3+,Ho3+固載的磁性MOF材料可分別鑑定到14,11,11,13條磷酸肽。
實驗結果其結果Fe3O4@DOTA-ZIF-90-Ti和Fe3O4@DOTA-ZIF-90-Tb的富集結果較好,而且經Fe3O4@DOTA-ZIF-90-Ti和Fe3O4@DOTA-ZIF-90-Tb富集後鑑定到的磷酸肽中,多磷酸肽佔46.67%,其比例高於其他金屬離子固載的磁性納MOF材料富集的多磷酸肽比例,說明在磷酸肽富集過程中,不同金屬離子直接影響多磷酸肽的吸附效果。
三、固載不同金屬離子的磁性MOF材料富集磷酸肽的靈敏度考察
實驗處理:降低富集樣品的上樣量,當樣品上樣量為100fmol時,對α-酪蛋白酶切產物進行磷酸肽富集。
實驗結果:經過渡金屬Ti,Zr,Fe固載的磁性MOF材料富集後仍可檢測到5,4,5條磷酸化肽段,而經鑭系金屬離子Tb,Tm,Ho固載的磁性MOF材料富集後可鑑定到3,2,3條磷酸肽。
實驗結果表明:過渡金屬對於磷酸肽富集的靈敏度在整體上優於鑭系金屬對磷酸肽的富集靈敏度。
四、固載不同金屬離子的磁性MOF材料富集磷酸肽的使用重複性考察
實驗處理:將磁性MOF材料用洗脫液進行充分洗滌,所得材料對α-酪蛋白酶切產物進行磷酸肽富集,實驗重複5次。
實驗結果:經過5次富集後,固載過渡金屬Ti,Zr,Fe的磁性MOF材料仍可鑑定到17,15,16條磷酸肽,而固載鑭系金屬Tb,Tm,Ho的磁性MOF材料仍可以檢測到17,16,17條磷酸肽。
實驗結果表明:固載過渡金屬Ti,Zr,Fe,Tb,Tm和Ho的磁性MOF材料對於磷酸肽富集具有良好的使用重複性,也說明鑭系金屬與DOTA之間較強的螯合作用。
五、固載不同金屬離子的磁性MOF材料富集磷酸肽的特異性考察
實驗處理:將α-酪蛋白酶切產物與非磷酸化蛋白牛血清白蛋白酶切產物按1:50比例混合,經過固載不同金屬離子的磁性MOF材料進行磷酸肽富集,然後進行質譜分析。
實驗結果:經過渡金屬Ti,Zr,Fe固載的磁性MOF材料富集後可以分別檢測到14,12,12條信號強度顯著增強的磷酸肽對應的質譜峰,而經鑭系金屬Tb,Tm,Ho固載的磁性MOF材料富集後可以分別檢測到15,12,17條磷酸肽。
實驗結果表明:鑭系金屬固載的磁性MOF材料對磷酸肽的特異性富集效果優於過渡金屬固載的磁性MOF材料對磷酸肽的特異性富集。
六、固載不同金屬離子的磁性MOF材料用於Hela細胞蛋白酶切產物全磷酸肽的富集
實驗處理:首先,將1.0mgHela細胞蛋白提取液進行胰蛋白酶酶切、凍幹後用上樣緩衝液(50%乙腈,1%TFA)進行重溶;然後,重溶的酶切樣品經Fe3O4@DOTA-ZIF-90-Ti和Fe3O4@DOTA-ZIF-90-Tb兩種材料進行全磷酸肽富集;最後,將收集的磷酸肽樣品經除鹽處理後進行質譜分析。
實驗結果:一共鑑定到13450條磷酸肽,對應2965個磷酸化蛋白,其中13116條是特異性磷酸肽。磷酸肽富集特異性高達94%,說明發展的新方法克服了IMAC材料富集磷酸肽過程中非特異性肽段吸附較多的缺點,在富集特異性方面有了顯著提升;在所有富集的磷酸肽中,48.16%是單磷酸肽,35.97%是具有兩個磷酸化位點的肽段,11.36%是具有三個磷酸化位點的肽段,4.5%是是具有四個磷酸化位點的肽段。多磷酸肽在鑑定到的特異性肽段中的比例超過了50%,該方法的多磷酸肽富集效果明顯優於DHB/TiO2法。
該合成的磁性MOF材料具有較大的金屬固載量、穩定的金屬複合物以及良好的親水性;實驗結果表明,合成的不同金屬離子固載的磁性MOF材料在全磷酸肽富集過程中具有更高的選擇性、靈敏度及富集效率;與傳統的TiO2方法相比,由於材料具有良好的磁響應能力使得操作過程更加省時、便捷。
上面對本專利的較佳實施方式作了詳細說明,但是本專利並不限於上述實施方式,在本領域的普通技術人員所具備的知識範圍內,還可以在不脫離本專利宗旨的前提下做出各種變化。
