一種用於免疫層析試紙條的包被液及其製備方法與流程
2023-12-09 09:55:41
本發明屬於醫學檢驗領域,具體地,涉及一種免疫層析試紙條的包被緩衝液及其製備方法。
背景技術:
在製備免疫層析試紙條的過程中,包被緩衝液用於包被抗體包被在硝酸纖維素膜上,能有效保護抗體的效價和減少抗體的非特異結合,提高免疫層析試紙條的穩定性和解析度。目前,在免疫層析試紙條的製備上,都是採用傳統的包被緩衝液將抗體包被在硝酸纖維素膜上,烘乾後再用封閉液對包被膜進行封閉。傳統的包被緩衝液的配方為:1%BSA,餘量為0.025M、pH=7.4的PBS。使用傳統的包被緩衝液存在以下缺陷:(1)抗體包被於硝酸纖維素膜後,需再配製封閉液對其進行封閉,操作步驟繁瑣,增加成本,延長生產時間。(2)抗體一經包被固化後,抗體效價降低,反應螢光信號大幅下降,從而使整個試劑的檢測靈敏度和精密度降低,有效期縮短。
技術實現要素:
為了克服現有技術的不足,本發明的第一個目的在於提供一種用於免疫層析試紙條的包被液;本發明所添加的BSA含量較傳統配方含量高,對硝酸纖維素膜起到一定程度的封閉作用;添加較高含量的蔗糖和一定量的海藻糖能夠保護抗體;有利於提高試劑測試的靈敏度和延長試劑有效期。
本發明的第二個目的是為了提供一種上述用於免疫層析試紙條的包被液的製備方法。
實現本發明的目的可以通過採取如下技術方案達到:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
優選地,所述緩衝液為Tris-HCl緩衝液或者磷酸鹽緩衝液。
優選地,所述緩衝液的濃度為10mM-50mM。
優選地,所述緩衝液的pH值為7.0–7.4。
優選地,所述的包被液包括如下按重量分數計的各組分:
所述磷酸鹽緩衝液的濃度為10mM-50mM,pH為7.0-7.4。
優選地,所述的包被液包括如下按重量分數計的各組分:
所述磷酸鹽緩衝液的濃度為30mM,pH為7.2。
優選地,所述的包被液包括如下按重量分數計的各組分:
所述磷酸鹽緩衝液的濃度為30mM,pH為7.4。
本發明還提供一種用於免疫層析試紙條的包被液的製備方法,包括如下步驟:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.0-7.4;
3)採用濾膜過濾除菌獲得包被液。
優選地,步驟3)所述濾膜的過濾孔徑為0.22~0.25μm。
優選地,步驟2)所述的pH為7.2;步驟3)所述的濾膜的孔徑為0.22μm。
相比現有技術,本發明的有益效果在於:
1、本發明的包被緩衝液配方中,BSA含量較傳統配方含量高,對硝酸纖維素膜起到一定程度的封閉作用,節省了包被膜再封閉的步驟,可顯著降低抗體與樣品發生非特異反應,從而有利於提高測試的精密度和靈敏度。
2、本發明的包被緩衝液加入了較高含量的蔗糖和一定量的海藻糖,能進一步提高抗體耐熱能力,有保護包被抗體效價的作用,可顯著降低抗體包被後,效價和反應螢光信號大幅下降的問題,從而有利於提高試劑測試的靈敏度和延長試劑有效期。
附圖說明
圖1為用實施例1包被液製備的CRP定量檢測免疫層析試紙條的檢測結果。
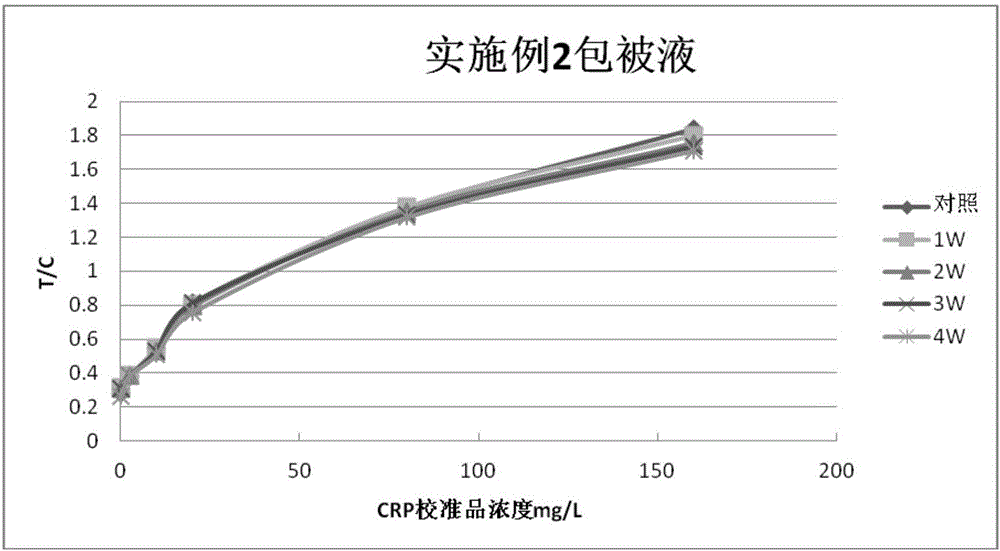
圖2為用實施例2包被液製備的CRP定量檢測免疫層析試紙條的檢測結果。
圖3為用實施例3包被液製備的CRP定量檢測免疫層析試紙條的檢測結果。
圖4為用傳統技術的包被液製備的CRP定量檢測免疫層析試紙條的檢測結果。
具體實施方式
下面,結合附圖以及具體實施方式,對本發明做進一步描述:
實施例1:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為緩衝液為磷酸鹽緩衝液,濃度為10mM,pH為7.0。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.0;
3)採用孔徑為0.22μm孔徑的濾膜過濾除菌獲得包被液。
實施例2:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為緩衝液為Tris-HCl緩衝液,濃度為50mM,pH為7.2。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.2;
3)採用孔徑為0.22μm孔徑的濾膜過濾除菌獲得包被液。
實施例3:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為磷酸鹽緩衝液,所述磷酸鹽緩衝液的濃度為30mM,pH為7.2。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.2;
3)採用孔徑為0.23μm孔徑的濾膜過濾除菌獲得包被液。
實施例4:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為緩衝液為磷酸鹽緩衝液,濃度為20mM,pH為7.2。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.2;
3)採用孔徑為0.22μm孔徑的濾膜過濾除菌獲得包被液。
實施例5:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為緩衝液為磷酸鹽緩衝液,濃度為20mM,pH為7.4。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.4;
3)採用孔徑為0.25μm孔徑的濾膜過濾除菌獲得包被液。
實施例6:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為緩衝液為Tris-HCl緩衝液,濃度為50mM,pH為7.4。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.4;
3)採用孔徑為0.22μm孔徑的濾膜過濾除菌獲得包被液。
實施例7:
一種用於免疫層析試紙條的包被液,包括如下按重量分數計的各組分:
所述緩衝液為緩衝液為磷酸鹽緩衝液,濃度為30mM,pH為7.4。
所述的包被液由以下方法製備而成:
1)用純水配置緩衝液作為基礎液;
2)稱取配方量的BSA、海藻糖、蔗糖、NaN3,溶於配方量的基礎液中,混勻,調節pH至7.4;
3)採用孔徑為0.25μm孔徑的濾膜過濾除菌獲得包被液。
對比例1
1%BSA,餘量為0.025M、pH=7.4的磷酸鹽緩衝液。製得傳統技術的包被液。
本對比例所述的包被液由一下方法製得:
1)用純水配置磷酸鹽緩衝液作為基礎液;
2)稱取配方量的BSA溶於配方量的基礎液中,混勻,調節pH至7.4;
3)採用孔徑為0.22μm孔徑的濾膜過濾除菌獲得包被液。
驗證實施例
以CRP定量檢測免疫層析試紙條為例來說明本發明的包被液與傳統技術的包被液靈敏度、精密度和穩定性對比。所述CRP定量檢測免疫層析試紙條包括底襯及設在所述底襯上的包被膜,所述包被膜的兩端分別搭接有樣品墊和吸水紙,所述樣品墊上噴有螢光膠乳標記CRP單克隆抗體和兔IgG抗體,包被膜上設置有包被線區,所述包被線區包括從靠近所述樣品墊端至靠近所述吸水紙端依次平行設置的包被羊抗兔IgG抗體的質控線、包被能與待檢抗原CRP特異性結合的另一株CRP單克隆抗體的檢測線。
CRP定量檢測免疫層析試紙條的製備方法如下,包括以下步驟:
(1)、螢光膠乳的共價活化
超聲波處理膠乳微球體30秒後,調節膠乳微球體濃度為1.0×1012/ml,15000xg離心20分鐘,離心後收集沉澱物用蒸餾水或者100mMpH6.0磷酸鹽溶液溶解,並超聲波200W處理30秒;先加入30μl的100mg/mlEDC,震蕩混勻,再加入30μl的20mg/mlSμlfo-NHS,震蕩混勻;室溫孵育30分鐘後15000xg、離心20分鐘,沉澱用100mM、pH6.0的檸檬酸緩衝液溶解,放置在2~8℃條件下備用;
(2)、螢光膠乳微粒標記蛋白的製備
將活化後的螢光膠乳超聲波200W處理30秒後,按照50μg標記抗體/100μl螢光膠乳的比例加入兔IgG抗體、CRP單克隆抗體,混勻後室溫攪拌反應2小時,離心洗滌3次,每次15000xg、離心20分鐘,沉澱用PBS-TBN溶解並超聲波100W處理30秒,用PBS-TBN恢復離心前體積,4℃保存,備用;
(3)、製備樣品墊
用標記稀釋液稀釋標記有CRP單克隆抗體的螢光膠乳標記有兔IgG抗體的螢光膠乳,將這兩種標記抗體的膠乳混合,噴於樣品墊上。螢光膠乳標記的CRP單克隆抗體的濃度為0.5mg/ml,按20%的稀釋比,8μl/cm的用量噴在樣品墊上;螢光膠乳標記的兔IgG抗體的濃度為0.5mg/ml,按2%的稀釋比,8μl/cm的用量噴在樣品墊上。
(4)、硝酸纖維素膜上質控線和檢測線的製備
用包被緩衝液稀釋(實施例1、實施例2、實施例3和傳統技術的包被液)羊抗兔IgG抗體以及能與待檢抗原特異結合的另一位點的單克隆抗體,並將稀釋後的兩種抗體分別依次平行地劃線於硝酸纖維素膜上,所述質控線靠近樣品墊一端。質控線包被的羊抗兔IgG抗體的濃度為1mg/ml,用量為20μl/27-35cm,CRP檢測線包被的CRP單克隆抗體的濃度為1mg/ml,用量為20μl/27-35cm。質控線、CRP檢測線相互間隔4mm。將包被好的硝酸纖維素膜置於溼度<30%的50℃的烘箱,乾燥72h後,於2℃~30℃密封乾燥平衡7天以上封袋備用。
(5)、製備試紙條
在底襯上搭接粘貼包被膜,在包被膜靠近標記線的一端搭接粘貼樣品墊,在包被膜另一端搭接粘貼吸水紙,得到試紙板,按照要求切割成適當寬度的試紙條。
在本驗證例中,試紙條的結構及其它參數都是相同的,不同之處僅在於:抗體包被在試紙條上(即質控線和檢測線製備)所使用的包被緩衝液不相同。
在相同的加樣量下,考察實施例3包被液與傳統技術的包被液對免疫層析試紙的靈敏度、精確度的影響。試驗結果如下所示。
1.1靈敏度(最低檢測限)
以5%人血清白蛋白為空白樣本,用實施例3包被液製備的試紙條與用傳統包被液製備的試紙條進行測定,重複20次,結果為:
實施例3包被液製備的試紙條計算結果均值為0.02,標準差SD為0.036,用稀釋後濃度分別為0.10mg/L、0.25mg/L和0.5mg/LCRP標準品溶液測定,測定結果分別為0.098mg/L、0.253mg/L、0.498mg/L,因此實施例3包被液製備的試紙條檢測CRP靈敏度為0.10mg/L;
傳統包被液製備的試紙條計算結果均值為0.08,標準差SD為0.046,
用稀釋後濃度分別為0.10mg/L、0.25mg/L和0.5mg/L CRP標準品溶液測定,測定結果分別為0.2mg/L、0.246mg/L、0.501mg/L,因此傳統包被液製備的試紙條檢測CRP靈敏度為0.25mg/L。
2.2精密度
隨機抽取用實施例3包被液製備的試紙條10份,分別對濃度為10.0mg/L的CRP校準品進行測定,測定結果平均值為10.11,標準差SD為0.7258,變異係數為1.0%;
隨機抽取用傳統包被液製備的試紙條10份,分別對濃度為10.0mg/L的CRP校準品進行測定,測定結果平均值為10.24,標準差SD為0.9258,變異係數為3.5%;
從上述實驗結果可看出,用實施例3包被液製備的試紙條比用傳統包被液的製備的試紙條靈敏度、精密度都要高。
用CRP定量檢測免疫層析試紙條來比較本發明包被液製備的試紙條與傳統包被液製備的試紙條的有效期。
將組裝好的試紙條,按以下設計進行加速破壞試驗:
(1)對照:室溫保存。
(2)破壞組:50℃破壞(保存)1周(W);50℃破壞2周(W);50℃破壞3周(W);50℃破壞周(W)。
對照與破壞組平行測定各濃度水平在各破壞條件下靈敏度、線性水平、線性範圍的一致性,觀察各條件下反應曲線的重合度。
CRP定量檢測免疫層析試紙條的試驗結果如圖1-4所示。
從圖1-3可以看出,採用實施例1-3包被液製備的試紙條,對照組和破壞組都有比較好的曲線重合度,其中以實施例3的最優,實施例1和實施例2次之,從圖4可以看出,傳統的包被液製備的試紙在破壞1W後,其T/C值已經下降的很快,不能與對照線重合,因此,本發明的包被液與傳統包被液相比,具有更好的熱破壞穩定性。
綜上所述,本發明的包被稀釋液與傳統稀釋液相比,操作簡便、成本低、靈敏度高、精密度好,且熱穩定性高,使試劑具有更長的保質期。
對於本領域的技術人員來說,可根據以上描述的技術方案以及構思,做出其它各種相應的改變以及變形,而所有的這些改變以及變形都應該屬於本發明權利要求的保護範圍之內。
