重組羥腈裂解酶及其用於製備光學純手性氰醇的應用的製作方法
2023-05-23 04:11:56 1
本發明屬於生物工程
技術領域:
,具體涉及一種羥腈裂解酶及其基因、含有該基因的重組表達載體和重組表達轉化體,該重組羥腈裂解酶的製備,以及該重組羥腈裂解酶作為催化劑在催化芳香醛不對稱羥氰化以製備光學純手性α-氰醇中的應用。
背景技術:
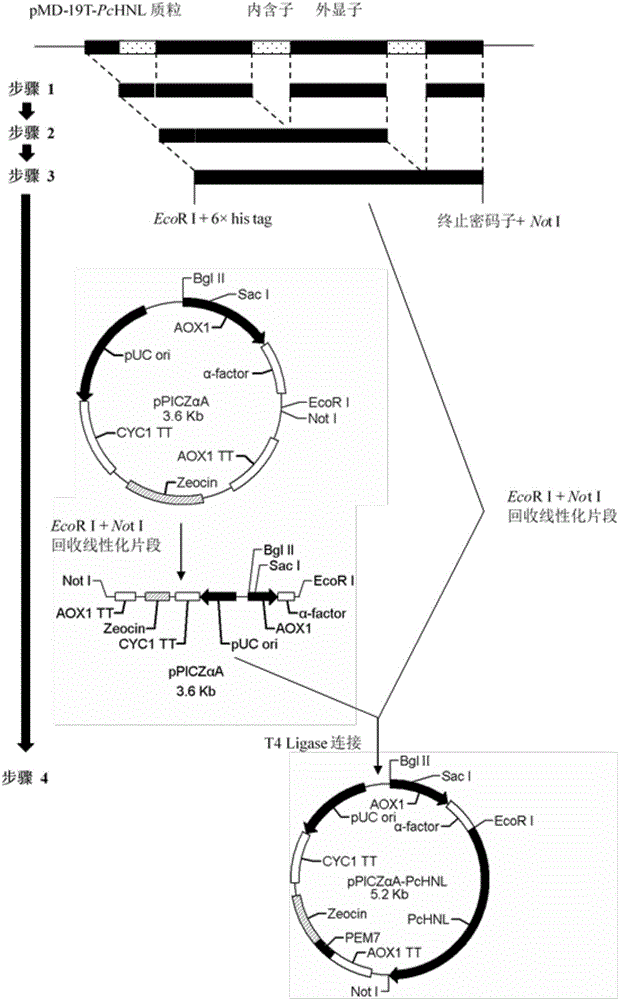
:光學純α-氰醇的α-碳是一個手性碳原子,連接一個羥基和一個腈基,這些基團可以在保持手性的情況下轉化成其他各種基團,再加上氰醇分子中其他官能基團參與的轉化,可以生成多種手性化合物分子,其中許多化合物都具有生物活性。因此,光學純的α-氰醇在藥物和精細化學品的不對稱合成中佔有重要地位。目前,光學純α-氰醇的立體選擇性製備已成為有機合成的重要研究領域。生物催化法是製備光學純氰醇的重要方法,一般使用羥腈裂解酶(Hydroxynitrilelyase,HNL),催化氫氰酸與醛類或酮類化合物的不對稱加成反應,獲得高光學純度的氰醇。目前,羥腈裂解酶的研究歷史已經超過一個世紀,通過羥腈裂解酶催化,合成了許多具有重大經濟價值的手性α-氰醇,不乏工業規模製備的案例。例如:來源於巴西橡膠樹(Heveabrasiliensis)的(S)-羥腈裂解酶(HbHNL)能催化3-苯氧基苯甲醛與氫氰酸不對稱加成製備(S)-3-苯氧基扁桃腈,後者是具有巨大市場前景的擬除蟲菊酯類殺蟲劑化合物的前體,目前其產率高達1000gL-1d-1,產物的ee值高於98.5%(Chim.Oggi.1998,16,15-19)。使用分子改造的苦杏仁(Prunusamygdalus)羥腈裂解酶5號同工酶作為催化劑,催化2-氯苯甲醛的不對稱羥氰化反應合成抗凝血劑氯吡格雷合成前體(R)-2-氯扁桃腈,6h時轉化率達到98%以上,產物的ee值高於98%,反應時空產率達到250gL-1d-1(ChemBioChem.2008,9,58–61)。類似的,使用理性設計改造的苦杏仁(Prunusamygdalus)羥腈裂解酶5號同工酶作為催化劑,催化苯丙醛與氫氰酸進行不對稱加成,合成非巰基血管緊張素轉化酶抑制劑的前體(R)-2-羥基-4-苯基丁腈,反應10h,轉化率高於97%,產物的ee值大於99%(Angew.Chem.Int.Ed.2005,44,4700–4704)。然而,儘管在羥腈裂解酶的研究領域已取得突出成果,並有產業化的實例,該酶催化的反應仍然存在一些共性的問題。由於底物醛的活性較高,容易發生自發的化學羥氰化反應,而自發的化學反應是沒有立體選擇性的;同時產物α-氰醇自身不穩定,在高溫、高pH環境中容易發生自發消旋,因此酶促羥氰化反應通常在低溫(4-10℃)、低pH(100ng/μl)。將80μl畢赤酵母X33的感受態細胞和1μg線性化質粒DNA樣品混勻,轉移至預冷的電轉杯(電極間距0.2cm)中,冰浴5min;然後在2kV、5ms的條件下脈衝電擊一次;之後向電轉杯中迅速加入0.5ml冰上預冷的山梨醇溶液(1M),並將電轉杯中的菌液轉移到裝有0.5mlYPD液體培養基(蛋白腖:20g/L,酵母提取物:10g/L,葡萄糖:20g/L,pH6.0)的1.5mlEppendorf管中,於30℃、200rpm培養2-3h;用移液槍吸取200μl電轉復甦後的菌液,塗布於YPDZ固體培養基平板(瓊脂粉:20g/L,蛋白腖:20g/L,酵母提取物:10g/L,葡萄糖:20g/L,博萊黴素100-2000μg/mL,pH6.0),倒置於30℃培養箱中培養2天左右,至有肉眼可見的轉化子長出,獲得重組畢赤酵母P.pastorisX33/pPICZαA-PcHNL。挑取單個轉化子菌落,抽提基因組,使用AOX通用引物擴增整合至基因組上的目的羥腈裂解酶基因片段,經DNA測序,基因全長1599bp,鹼基序列如序列表中SEDIDNo.2所示。實施例4重組畢赤酵母菌的培養以及重組羥腈裂解酶催化劑的製備將實施例3中的重組畢赤酵母PichiapastorisX33/pPICZαA-PcHNL接種至YPDZ液體培養基(蛋白腖:20g/L,酵母提取物:10g/L,葡萄糖:20g/L,博萊黴素100μg/mL,pH6.0)中,於30℃,250rpm震蕩培養24h,按1%的接種量接種至100ml含有100μg/mL氨苄青黴素的BMGY液體培養基(蛋白腖:20g/L,酵母提取物:10g/L,甘油:10g/L,無胺基酸酵母氮源:13.6g/L,生物素:0.4mg/L,終濃度為100mM的磷酸鉀緩衝鹽,pH6.0)中,置於30℃,250rpm搖床中培養,當培養液的光密度OD600達到1.5時,停止培養,靜置2-3h使酵母細胞沉降,小心傾倒出BMGY培養基上清,然後將收集的菌體用100ml的BMMY培養基(甲醇10ml/L,蛋白腖:20g/L,酵母提取物10g/L,生物素0.4mg/L,無胺基酸酵母氮源13.6g/L,終濃度為100mM的磷酸鉀緩衝鹽,pH6.0)重新懸浮,置於30℃,250rpm搖床中繼續培養,每24h添加2ml的純甲醇進行誘導,持續培養、誘導96h,培養過程中定期吸取培養液,離心後取上清,進行羥腈腈裂解活力測定,監控重組羥腈裂解酶的表達。培養結束後,將培養液於4℃、8000×g離心後去除菌體,上清以0.22μm孔徑的微濾膜微濾,於4℃以截留分子量為30KDa的超濾膜超濾濃縮,並用檸檬酸鈉緩衝液(20mM,pH5.5)反覆洗滌,最終濃縮至重組羥腈腈裂解的濃度大約為100U/ml。對濃縮的酶液冷凍乾燥後製得含有重組羥腈裂解酶的凍幹粗酶粉,比活力為12U/mg。實施例5氫氰酸-甲基叔丁基醚溶液的製備稱取9.8gNaCN,加入250ml的圓底燒瓶中,冰浴冷卻,加入20ml蒸餾水與25ml甲基叔丁基醚,翻口塞密封后於冰浴上磁力攪拌15min,然後在攪拌條件下以注射器緩慢滴加25ml濃度為4M的硫酸溶液,滴加結束後繼續攪拌4min,以分液漏鬥快速分液,分離有機相,剩餘的水相中加入25ml甲基叔丁基醚再萃取一次,合併有機相置於氮氣保護的棕色瓶內,加入10ml檸檬酸-檸檬酸鈉緩衝液(100mM,pH5.0)作為穩定劑,保存於-80℃備用。實施例6重組羥腈裂解酶液催化4-甲硫基苯甲醛不對稱羥氰化反應取2.5ml實施例4製備的濃縮後的羥腈裂解酶液,加入2.5ml如實施例5製備的氫氰酸-甲基叔丁基醚溶液,加入終濃度200mM的4-甲硫基苯甲醛,於15℃,磁力攪拌反應,間歇取樣50μl,以1ml乙酸乙酯萃取,通過液相色譜分析測定反應轉化率和α-氰醇的ee值,反應24h,轉化率97%,產物ee值高於99%。液相色譜分析,使用的色譜柱為OD-H柱(250mm×4.6mm,5μm,大賽璐公司,日本),流動相為正己烷/異丙醇,流動相比例為正己烷/異丙醇:85/15,檢測柱溫25℃,流動相流速0.7ml/min,檢測波長為254nm。其中α-氰醇的ee值測定需要預先對α-氰醇進行乙醯化處理,乙醯化反應的條件為:乙酸乙酯的萃取樣品加入80μl乙酸酐,40μl吡啶,1mg對二甲氨基吡啶,室溫攪拌反應2h,反應產物以1ml飽和硫酸銅水溶液洗滌至水相不變色,1ml水洗兩次,1ml飽和食鹽水洗滌一次,加入無水硫酸鈉乾燥,蒸發去除溶劑,以300μl異丙醇復溶後進行液相色譜分析。實施例7重組羥腈裂解酶催化4-甲硫基苯甲醛不對稱羥氰化反應條件考察按表4條件配置反應體系,稱取5-125mg如實施例4獲得的重組羥腈裂解酶凍幹粗酶粉,溶解於2.37ml檸檬酸-檸檬酸鈉緩衝液(100mM,pH4-6)中,加入2.5ml如實施例5製備的氫氰酸-甲基叔丁基醚溶液,加入終濃度100-500mM的4-甲硫基苯甲醛,於4-25℃,磁力攪拌反應,間歇取樣,薄層層析檢測反應轉化率。當反應轉化率停止增長時,反應液用2倍反應體積乙酸乙酯萃取,共萃取3次,合併有機相,用飽和FeCl3洗滌至水相溶液不變色,再分別以等體積水,飽和食鹽水洗滌一次,加入無水硫酸鈉乾燥,真空減壓蒸發除去溶劑,200-300目矽膠填裝層析柱,快速柱層析分離獲得目標產物。柱層析條件為石油醚/乙酸乙酯:15/1分離出未轉化的4-甲硫基苯甲醛,石油醚/乙酸乙酯:4/1分離得(R)-4-甲硫基扁桃腈。反應轉化率和α-氰醇的ee值通過液相色譜分析測定,使用的色譜柱為OD-H柱(250mm×4.6mm,5μm,大賽璐公司,日本),流動相為正己烷/異丙醇,流動相比例為正己烷/異丙醇:85/15,檢測柱溫25℃,流動相流速0.7ml/min,檢測波長為254nm。其中α-氰醇的ee值測定需要預先對α-氰醇進行乙醯化處理,乙醯化反應的條件為:1mmol氰醇溶解於2ml二氯甲烷,加入400μl乙酸酐,200μl吡啶,5mg對二甲氨基吡啶,室溫攪拌反應2h,反應產物以2倍體積飽和硫酸銅水溶液洗滌至水相不變色,等體積水洗兩次,飽和食鹽水洗滌一次,加入無水硫酸鈉乾燥,真空減壓蒸發去除溶劑,取少量以異丙醇復溶後進行液相色譜分析,分析結果見表4。表4.不同條件重組羥腈裂解酶催化4-甲硫基苯甲醛不對稱羥氰化反應結果實施例8-23重組羥腈裂解酶催化潛手性芳香醛的不對稱羥氰化反應稱取50mg如實施例4獲得的重組羥腈裂解酶凍幹粗酶粉,溶解於2.5ml檸檬酸-檸檬酸鈉緩衝液(100mM,pH5.0)中,加入2.5ml如實施例5製備的氫氰酸-甲基叔丁基醚溶液,分別加入終濃度400mM的前手性芳香醛(實施例8-23),於25℃,磁力攪拌反應,間歇取樣TLC檢測反應轉化率。當反應轉化率停止增長時,反應液用2倍體積乙酸乙酯萃取,共萃取3次,合併有機相,用飽和FeCl3洗滌至水相溶液不變色,再分別以等體積水和飽和食鹽水洗滌一次,加入無水硫酸鈉乾燥,真空減壓蒸發除去溶劑,200-300目矽膠填裝層析柱,快速柱層析分離,使用的流動相為石油醚/乙酸乙酯,首先分離除去未反應醛,隨後適當調整流動相比例,洗脫獲得目標產物。柱層析的流動相比例列於表5中。反應轉化率和α-氰醇的ee值通過液相色譜分析測定,使用的色譜柱為OD-H柱(250mm×4.6mm,5μm,大賽璐公司,日本),流動相為正己烷/異丙醇,流動相比例列於表5中。檢測柱溫25℃,流動相流速0.7ml/min,檢測波長為254nm。其中實施例9-12、14-16、19-20的反應產物進行乙醯化處理後進行ee值分析。乙醯化反應的條件為:1mmol氰醇溶解於2ml二氯甲烷,加入400μl乙酸酐,200μl吡啶,5mg對二甲氨基吡啶,室溫攪拌反應2h,反應產物以2倍體積飽和硫酸銅水溶液洗滌至水相不變色,等體積水洗兩次,飽和食鹽水洗滌一次,加入無水硫酸鈉乾燥,真空減壓蒸發去除溶劑,取少量以異丙醇復溶後進行液相色譜分析,分析結果見表6。表5液相色譜分析以及產品柱層析分離的流動相比例表6.重組巴達木羥腈裂解酶催化潛手性芳香醛不對稱羥氰化反應上述的對實施例的描述是為便於該
技術領域:
的普通技術人員能理解和使用發明。熟悉本領域技術的人員顯然可以容易地對這些實施例做出各種修改,並把在此說明的一般原理應用到其他實施例中而不必經過創造性的勞動。因此,本發明不限於上述實施例,本領域技術人員根據本發明的揭示,不脫離本發明範疇所做出的改進和修改都應該在本發明的保護範圍之內。華東理工大學重組羥腈裂解酶及其用於製備光學純手性氰醇的應用2PatentInversion3.512058DNAPrunuscommunis1cttgccaatacttctgctcatggtaaatttccatcttcagtattcatttaacaaaaaagt60gtagatttataattaagaaaactgaaacaagtagtgcaagaaacaagctaatttagatgc120atgttgaaaaaaatctttcatctcttcacatatattttgcagattttagctacttgaagt180ttgtgtacaacgccactgatacaagcttggaaggatcatatgactacattgtaatcggtg240gaggaacatcagggtgtccattggcagcaactttatcagaaaaatacaaggtgcttcttc300tagaaagaggcactattgctacagaatacccgaacacgttgactgcagatgggtttgcat360ataatctgcagcaacaagatgatggaaagacgccagttgaaaggttcgtgtccgaagatg420gcattgataatgtgcgagccaggatcctcggtggcacgaccataatcaatgcaggcgtct480acgccagagctaacatttcattctatagtcaaacaggaattgaatgggacctggatttgg540tcaataagacatatgagtgggttgaagacgccattgtggtcaagccaaataatcaatctt600ggcaatctgttataggagagggattcttggaggcgggtattcttccagacaatggattta660gtttggatcacgaagcaggaactagactcaccggctcaacttttgacaataatggaacgc720gacatgcggctgatgaactgcttaataaaggagaccctaataacttgctagttgcagttc780aggcctcagtagagaagatcctcttctcttccaatacatcaagtatgttgcatcagtgat840atttaatggtagctcctagtttgtcatgctgcactcgaaaattattattttatcatttta900aaatactaacagaatagtgtgaagtctcatatttcccttccatatttcccaaatttccat960aaacaaaacttcccaattctccttcgtttagtttgacaataattataagctattctctaa1020tgcagatttgtcagctattggagtcatatatacggattctgatggaaactctcatcaggc1080atttgtacgcggtaacggagaagttattgttagtgcagggacaatcggaacgcctcagct1140tctactacttagtggcgttggaccagagtcttacctatcttctctcaacatcacagttgt1200tcagccgaatccttatgttgggcagtttgtgtatgacaatccttgtaatttcattaatat1260tttgcccccaaatccaattgaagcctctgttgtaactgttttaggcattagaagtgatta1320ttatcaagtttctctgtcaagcttgccattttccactccaccctttagtctttttcctac1380aacatcttaccccctcccaaattcgacttttgctcatattgttagccaagttccaggacc1440attgtctcatggttctgtcacgctaaattcatcctctgacgtgagaatcgctccaaatat1500taaattcaattactattcaaattccacagaccttgctaattgtgttagcggcatgaagaa1560gcttggtgacttattaaggacaaaggcattagaaccatataaagctcgagatgtgctggg1620aattgacggtttcaattatttgggagtacctttgccagagaaccaaacagatgatgcatc1680cttcgagacattttgtctagataatgtagcttcatactggcattaccacggtggaagcct1740tgttgggaaagtgcttgatgatagtttccgtgttatggggatcaaagcattacgcgttgt1800tgatgcctccactttcccttacgaaccaaacagccatcctcagggcttctatctgatgtt1860aggaaggtatgtgatgcacacttccaaccactagagattctcaatattttgttgttgttg1920taatgaactctgtgccgcattgctcttttttattaatccttaaaattttgtgttttgcgc1980aggtatgtgggccttcaaatcctgcaagaaaggtcaatccggttggaggctattcataat2040attcaagagtccatgtga20582532DNAPrunuscommunis2LeuAlaAsnThrSerAlaHisAspPheSerTyrLeuLysPheVal51015TyrAsnAlaThrAspThrSerLeuGluGlySerTyrAspTyrIle202530ValIleGlyGlyGlyThrSerGlyCysProLeuAlaAlaThrLeu354045SerGluLysTyrLysValLeuLeuLeuGluArgGlyThrIleAla505560ThrGluTyrProAsnThrLeuThrAlaAspGlyPheAlaTyrAsn657075LeuGlnGlnGlnAspAspGlyLysThrProValGluArgPheVal808590SerGluAspGlyIleAspAsnValArgAlaArgIleLeuGlyGly95100105ThrThrIleIleAsnAlaGlyValTyrAlaArgAlaAsnIleSer110115120PheTyrSerGlnThrGlyIleGluTrpAspLeuAspLeuValAsn125130135LysThrTyrGluTrpValGluAspAlaIleValValLysProAsn140145150AsnGlnSerTrpGlnSerValIleGlyGluGlyPheLeuGluAla155160165GlyIleLeuProAspAsnGlyPheSerLeuAspHisGluAlaGly170175180ThrArgLeuThrGlySerThrPheAspAsnAsnGlyThrArgHis185190195AlaAlaAspGluLeuLeuAsnLysGlyAspProAsnAsnLeuLeu200205210ValAlaValGlnAlaSerValGluLysIleLeuPheSerSerAsn215220225ThrSerAsnLeuSerAlaIleGlyValIleTyrThrAspSerAsp230235240GlyAsnSerHisGlnAlaPheValArgGlyAsnGlyGluValIle245250255ValSerAlaGlyThrIleGlyThrProGlnLeuLeuLeuLeuSer260265270GlyValGlyProGluSerTyrLeuSerSerLeuAsnIleThrVal275280285ValGlnProAsnProTyrValGlyGlnPheValTyrAspAsnPro290295300ArgAsnPheIleAsnIleLeuProProAsnProIleGluAlaSer305310315ValValThrValLeuGlyIleArgSerAspTyrTyrGlnValSer320325330LeuSerSerLeuProPheSerThrProProPheSerLeuPhePro335340345ThrThrSerTyrProLeuProAsnSerThrPheAlaHisIleVal350355360SerGlnValProGlyProLeuSerHisGlySerValThrLeuAsn365370375SerSerSerAspValArgIleAlaProAsnIleLysPheAsnTyr380385390TyrSerAsnSerThrAspLeuAlaAsnCysValSerGlyMETLys395400405LysLeuGlyAspLeuLeuArgThrLysAlaLeuGluProTyrLys410415420AlaArgAspValLeuGlyIleAspGlyPheAsnTyrLeuGlyVal425430435ProLeuProGluAsnGlnThrAspAspAlaSerPheGluThrPhe440445450CysLeuAspAsnValAlaSerTyrTrpHisTyrHisGlyGlySer455460465LeuValGlyLysValLeuAspAspSerPheArgValMETGlyIle470475480LysAlaLeuArgValValAspAlaSerThrPheProTyrGluPro485490495AsnSerHisProGlnGlyPheTyrLeuMETLeuGlyArgTyrVal500505510GlyLeuGlnIleLeuGlnGluArgSerIleArgLeuGluAlaIle515520525HisAsnIleGlnGluSerMET530當前第1頁1 2 3 
