一種低氧響應脂質體藥物載體及其製備方法與應用與流程
2023-05-15 03:25:03 2
本發明涉及藥劑學領域,具體涉及一種具有低氧響應效應的脂質體藥物載體,以及該藥物載體的製備方法及應用。
背景技術:
腫瘤治療中小分子化療藥物沒有組織選擇性,難以在腫瘤病灶部位達到高的藥物濃度,大劑量使用下治療效果差,毒副作用強。將小分子化療藥物裝載到納米藥物載體如脂質體中能夠顯著降低毒副作用,但是傳統的脂質體藥物載體並不能顯著的提高抗癌藥的治療效果,所以,使用新穎的控釋材料改進脂質體藥物載體使其能夠在腫瘤部位特異性釋放藥物,提高療效,是目前迫切需要研究的內容。
低氧是實體瘤微環境的基本特徵之一,正常組織的氧濃度一般在30mm Hg左右,而腫瘤組織的氧濃度較低,有的甚至接近於0。低氧是很多腫瘤治療失敗的主要原因,但是低氧同樣提供了一種治療途徑,因此,設計製備具有根據腫瘤低氧特徵而改變自身理化性裝的納米藥物載體用於低氧實體瘤的治療,將有利於提高腫瘤的治療效果。
在低氧控釋方面,通過文獻調研發現芳香硝基類化合物及其衍生物因其低氧響應性而常被用於腫瘤低氧的檢測,例如,CN201610026007中利用疏水的2-硝基咪唑在低氧環境下在細胞內會轉變成水溶性的2-氨基咪唑。因此,可以利用這一特性來設計納米藥物載體時引入芳香硝基類基團,基團在低氧腫瘤細胞內發生反應,導致納米藥物載體自身的穩定性降低,從而釋放出裝載的抗癌藥物,顯著提高腫瘤部位的藥物濃度,從而提高藥物的利用度。此外,現階段低氧響應藥物載體主要局限於硝基芳烴功能化的聚合物形成的載體,未見有低氧響應脂質體藥物載體的報導。
技術實現要素:
發明目的:本發明所要解決的技術問題是針對現有技術的不足,提供一種低氧響應脂質體藥物載體。
本發明還要解決的技術問題是提供該低氧響應脂質體藥物載體的製備方法及應用。
為了解決上述技術問題,本發明公開一種低氧響應脂質體藥物載體,該脂質體包括磷脂、膽固醇和低氧響應分子,所述膽固醇與磷脂的質量比為1:10-1:2,低氧響應分子與磷脂的質量比為1:10-1:4。
其中,所述磷脂為二棕櫚醯磷脂醯膽鹼(DPPC)、二肉豆蔻醯磷脂醯膽鹼(DMPC)和甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)的混合物,其中二棕櫚醯磷脂醯膽鹼(DPPC)佔磷脂總質量的80-95%,二肉豆蔻醯磷脂醯膽鹼(DMPC)佔磷脂總質量的2-10%,甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)佔磷脂總質量的3-10%;所述膽固醇為高純膽固醇(HP-CHOL);所述低氧響應分子為疏水性芳香硝基化合物衍生物(HR);所述的低氧響應分子位於所述磷脂的雙分子層之間。
其中,所述疏水性芳香硝基化合物衍生物(HR)具有的結構通式為下述兩種通式之一:
通式(1)通式(2)
其中n為8-20之間的任意自然數,基團R為H或者Ar-NO2,Ar為咪唑環、2-甲基咪唑、苯環以及含有1-2個硝基苯環中的一種或多種。
所述疏水性芳香硝基化合物衍生物(HR)具有如下結構式之一:
其中,所述脂質體藥物載體的水化粒徑為50~500納米。
一種低氧響應脂質體藥物載體的製備方法,將配方量的磷脂、膽固醇和低氧響應分子溶於有機溶劑中,真空旋蒸成膜,水化後即得到空載脂質體。
其中,所述的有機溶劑為分析純甲醇和氯仿按體積比1:3-1:5的混合物。
該低氧響應脂質體藥物載體在負載抗腫瘤藥物中的應用。
其中,所述抗腫瘤藥物為親水性抗腫瘤藥物和/或疏水性抗腫瘤藥物,其中,所述的親水性抗腫瘤藥物包括但不僅限於鹽酸阿黴素、鹽酸伊立替康和順鉑中的任意一種或幾種的混合物;所述的疏水性抗腫瘤藥物包括但不僅限於阿黴素、多西他賽、紫杉醇和喜樹鹼中的任意一種或幾種的混合物。
其中,所述抗腫瘤藥物的負載量為1~25wt%。
該載藥脂質體負載抗腫瘤藥物的製備方法為:
(1)若所述抗腫瘤藥物為疏水性抗腫瘤藥物,則:
將配方量的磷脂、膽固醇和低氧響應分子和抗腫瘤藥物溶於有機溶劑中,室溫下真空旋蒸成膜,pH 7.4的磷酸緩衝液水化後即得到載藥脂質體;
(2)若所述抗腫瘤藥物為親水性藥物,則:
採用pH梯度法載藥,則將配方量的磷脂、膽固醇和低氧響應分子溶於有機溶劑中,真空旋蒸成膜後用100~300mM檸檬酸或醋酸鈣水溶液水化,用pH 7.4的磷酸緩衝液透析除去脂質體外的檸檬酸或醋酸鈣,加入抗腫瘤藥物,30~70℃攪拌10~60分鐘即得到載藥脂質體;或者,在水化時按比例加入抗腫瘤藥物,水化後用pH 7.4的磷酸緩衝液透析即得到載藥脂質體;
採用上述兩種方法之一處理之後,未包封的游離藥物可以通過G-50葡聚糖凝膠柱分離除去。
其中,抗腫瘤藥物添加質量與磷脂、膽固醇和低氧響應分子的三者總質量之比為1/3-1/10。
該低氧響應脂質體藥物載體在製備治療抗腫瘤或者其他低氧相關的疾病藥物中的應用。
有益效果:
1、本發明的脂質體的磷脂組成為相變溫度較高的DPPC和DMPC,在人體的生理溫度下呈膠晶態,不會發生藥物非特異性釋放或洩漏,極大地降低對人體正常組織和器官的毒副作用,因此本發明的脂質體可以負載各種小分子抗腫瘤藥物,親水性藥物(鹽酸阿黴素、鹽酸伊立替康、順鉑等)位於脂質體內部核心,疏水性藥物(阿黴素、紫杉醇、喜樹鹼等)位於磷脂雙分子層之間,可同時共載任意一種或幾種,對弱鹼性或弱酸性藥物可以採用pH梯度法載藥達到高的包封率。
2、本發明的脂質體在保持傳統脂質體藥物載體的穩定性的前提下,在雙分子層之間加入疏水性的芳香硝基類化合物作為低氧響應分子,在低氧的腫瘤細胞內,低氧響應分子的硝基被還原為氨基,由疏水性變為親水性,使脂質體的結構不再穩定,釋放藥物,達到在低氧腫瘤部位特異性釋放藥物的目的,顯著提高腫瘤部位的藥物濃度,提高抗腫瘤效果。
3、本發明的脂質體含有PEG化磷脂可以避免被內皮網狀系統捕獲,有效延長脂質體的血液循環時間,使脂質體藥物有充足的時間通過EPR效應在腫瘤部位滯留富集;膽固醇能夠收緊磷脂雙分子膜,使脂質體更加穩定。
4、本發明的脂質體製備方法簡單,易於放大生產,可以採用pH梯度法裝載弱酸性或弱鹼性藥物,在較高的載藥率(20%)時依然保持高的包封率(大於90%);對於脂溶性藥物,可以在旋蒸成膜時直接加入藥物;水化後使用G-50葡聚糖凝膠柱分離載藥脂質體和游離藥物,既可得到載藥低氧響應脂質體。
附圖說明
下面結合附圖和具體實施方式對本發明做更進一步的具體說明,本發明的上述和/或其他方面的優點將會變得更加清楚。
圖1為實施例1製備的低氧響應分子的核磁共振氫譜圖(1H NMR);
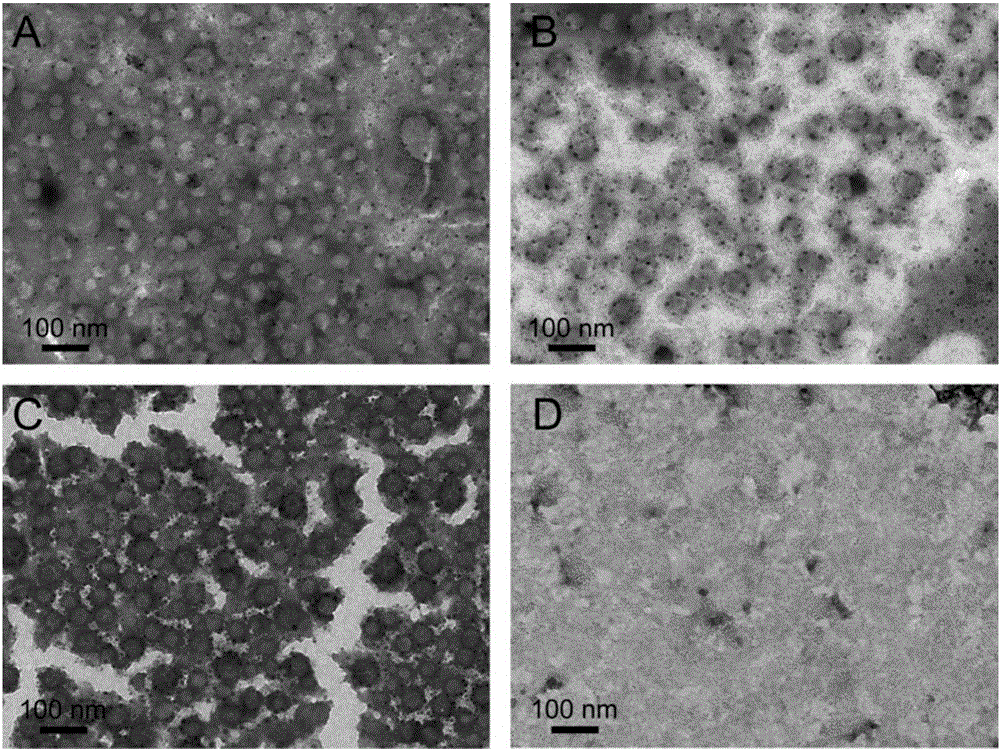
圖2為實施例2-1製備的具有低氧響應脂質體(HR-LPs)和傳統脂質體(LPs)的低氧處理前後的透射電鏡圖(TEM);
圖3為實施例2-1製備的具有低氧響應效應的脂質體藥物載體的體外低氧響應性-紫外吸收特徵峰的變化;
圖4為實施例4-1製備的具有低氧響應效應的阿黴素脂質體藥物載體(DOX-HR-LPs)和傳統阿黴素脂質體(DOX-LPs)在低氧和常氧條件下的阿黴素釋放曲線;
圖5為實施例4-1製備的具有低氧響應效應的阿黴素脂質體藥物載體(DOX-HR-LPs)和傳統阿黴素脂質體(DOX-LPs)在低氧和常氧條件下的細胞內阿黴素的釋放行為觀察結果;
圖6為實施例4-1製備的具有低氧響應效應的阿黴素脂質體藥物載體、傳統阿黴素脂質體、及阿黴素以及對照組(PBS給藥組)在小鼠實體瘤模型上的治療效果圖;
圖7為本發明製備的低氧響應脂質體藥物載體的結構示意圖。其中,圖中的磷脂代表二棕櫚醯磷脂醯膽鹼和二肉豆蔻醯磷脂醯膽鹼,聚乙二醇磷脂代表甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺。
具體實施方式
以下結合實施例,對本發明所述的一種具有低氧響應效應的脂質體藥物載體、製備方法及其應用做進一步說明。
實施例1
本實施所選用的低氧響應分子為2-硝基咪唑衍生物,其製備方法如下:
取2-硝基咪唑60mg和1,12-二溴十二烷70mg加入5mL二甲基甲醯胺(DMF)中溶解充分,再加入K2CO380mg,50℃攪拌反應24h;向反應溶液中加入5mL去離子水,再加入5mL乙酸乙酯萃取,重複萃取3次,合併萃取溶液,再向萃取液中加入2mL去離子水震蕩後靜置分層,除去下層水溶液,重複3次後真空旋蒸除去乙酸乙酯,得到2-硝基咪唑衍生物,即線形低氧響應分子HR(hypoxia responsive elements),其核磁共振氫譜圖(1H NMR)如圖1所示。
實施例2-1
具有低氧響應效應的脂質體藥物載體的製備:
將二棕櫚醯磷脂醯膽鹼(DPPC)、高純膽固醇(HP-CHOL)、二肉豆蔻醯磷脂醯膽鹼(DMPC)、甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:20:3:3:16的質量比(總20mg)溶於甲醇和氯仿混合溶液中(體積比1:4),減壓旋蒸成膜,用10mL去離子水50℃超聲水化,得到空白低氧響應脂質體HR-LPs;對照空白組脂質體LPs的製備方法同HR-LPs,脂質體組分中DPPC、HP-CHOL、DMPC、DSPE-MPEG2K同樣按質量比70:20:3:3(總20mg),不添加低氧響應分子,減壓旋蒸成膜,10mL去離子水50℃超聲水化,得到空白脂質體LPs。
實施例2-2
具有低氧響應效應的脂質體藥物載體的製備:
將二棕櫚醯磷脂醯膽鹼(DPPC)、高純膽固醇(HP-CHOL)、二肉豆蔻醯磷脂醯膽鹼(DMPC)、甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:18:3:3:12的質量比(總20mg)溶於甲醇和氯仿混合溶液中(體積比1:3),其餘步驟同實施例2-1,製備空白低氧響應脂質體HR-LPs。
實施例2-3
具有低氧響應效應的脂質體藥物載體的製備:
將二棕櫚醯磷脂醯膽鹼(DPPC)、高純膽固醇(HP-CHOL)、二肉豆蔻醯磷脂醯膽鹼(DMPC)、甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:8:3:3:18的質量比(總20mg)溶於甲醇和氯仿混合溶液中(體積比1:3),其餘步驟同實施例2-1,製備空白低氧響應脂質體HR-LPs。
實施例2-4
具有低氧響應效應的脂質體藥物載體的製備:
將二棕櫚醯磷脂醯膽鹼(DPPC)、高純膽固醇(HP-CHOL)、二肉豆蔻醯磷脂醯膽鹼(DMPC)、甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:38:3:3:8的質量比(總20mg)溶於甲醇和氯仿混合溶液中(體積比1:5),其餘步驟同實施例2-1,製備空白低氧響應脂質體HR-LPs。
實施例2-5
具有低氧響應效應的脂質體藥物載體的製備:
將二棕櫚醯磷脂醯膽鹼(DPPC)、高純膽固醇(HP-CHOL)、二肉豆蔻醯磷脂醯膽鹼(DMPC)、甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:20:2:4:16的質量比(總20mg)溶於甲醇和氯仿混合溶液中(體積比1:4),其餘步驟同實施例2-1,製備空白低氧響應脂質體HR-LPs。
實施例2-6
具有低氧響應效應的脂質體藥物載體的製備:
將二棕櫚醯磷脂醯膽鹼(DPPC)、高純膽固醇(HP-CHOL)、二肉豆蔻醯磷脂醯膽鹼(DMPC)、甲氧基-聚乙二醇-二硬脂醯基磷脂醯乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按62:21:7:7:15的質量比(總20mg)溶於甲醇和氯仿混合溶液中(體積比1:4),其餘步驟同實施例2-1,製備空白低氧響應脂質體HR-LPs。
實施例3
具有低氧響應效應的脂質體藥物載體(HR-LPs)的低氧響應性考察:
將實施例2-1製備的HR-LPs和LPs在37℃水浴處理3h,低氧組加入肝微粒體和還原性輔酶Ⅱ(NADPH)分別作為除氧劑和還原劑,常氧組只加入NADPH。圖2為具有低氧響應效應的脂質體藥物載體(HR-LPs)及對照組傳統的脂質體藥物載體(LPs)低氧處理前後的透射電鏡(TEM)圖,結果顯示,實施例2-1製備的HR-LPs(圖2C)和LPs(圖2A)呈球形,顆粒粒徑為50納米左右,粒徑分布均勻,多分散性好。低氧處理後,LPs的形態無明顯變化(圖2B),HR-LPs的球形結構已經被完全破壞(圖2D)。
HR-LPs低氧還原之後在325nm處硝基咪唑的紫外特徵吸收峰消失,在290nm處出現新的氨基咪唑特徵峰(圖3A),而LPs低氧還原之後紫外特徵吸收峰沒有發生明顯變化(圖3B),結果顯示HR-LPs有的低氧響應性,而LPs無低氧響應性。
實施例4-1
本實施例所使用的脂質體藥物載體裝載了抗癌藥物阿黴素,採用pH梯度載藥法,其製備方法為:實施例2-1製備的空白脂質體LPs和HR-LPs採用250mM檸檬酸水溶液水化,用pH 7.4的磷酸緩衝液透析除去脂質體外的檸檬酸或醋酸鈣,之後用磷酸氫二鈉調節脂質體溶液的pH為7左右,按照藥脂質量比1:4加入阿黴素,50℃避光攪拌1h後,得到裝載阿黴素的脂質體DOX-LPs和低氧響應脂質體DOX-HR-LPs,4℃保存待用。離心取上清,HPLC測得DOX-LPs和DOX-HR-LPs包封率為96.8±0.29和93.4±1.30(%)。
實施例4-2
本實施例所使用的脂質體藥物載體裝載了抗癌藥物多西他賽,採用pH梯度載藥法,其製備方法為:實施例2-1製備的空白脂質體LPs和HR-LPs採用100mM檸檬酸水溶液水化,按照藥脂質量比1:3加入阿黴素,30℃避光攪拌10min,其餘步驟同實施例4-1得到得到裝載多西他賽的載藥脂質體。
實施例4-3
本實施例所使用的脂質體藥物載體裝載了抗癌藥物紫杉醇,採用pH梯度載藥法,其製備方法為:實施例2-1製備的空白脂質體LPs和HR-LPs採用300mM檸檬酸水溶液水化,按照藥脂質量比1:10加入阿黴素,70℃避光攪拌30min,其餘步驟同實施例4-1得到得到裝載紫杉醇的載藥脂質體。
實施例4-4
本實施例所使用的脂質體藥物載體裝載了抗癌藥物鹽酸阿黴素,將配方量的磷脂、膽固醇和低氧響應分子和抗腫瘤藥物溶於有機溶劑中,室溫下真空旋蒸30分鐘成膜,pH 7.4的磷酸緩衝液水化後即得到裝載鹽酸阿黴素的載藥脂質體。
實施例5
DOX-LPs和DOX-HR-LPs分別在常氧和低氧條件下的體外釋放曲線測定:
將實施例4-1製備的DOX-LPs和DOX-HR-LPs用PBS稀釋後密封在石英比色皿中,37℃進行阿黴素的體外釋放實驗,其中低氧組加入大鼠肝微粒體(100μg/ml)和NADPH(100μM),常氧組只加NADPH。比色皿中阿黴素的濃度用螢光分光光度法測定。結果如圖4所示,DOX-HR-LPs在低氧條件下37℃,pH 7.4左右12h釋放了60%左右的阿黴素,而常氧常氧條件下只有30%左右的阿黴素釋放,DOX-LPs在常氧和低氧條件下的釋放量均很少,不足30%。說明DOX-HR-LPs在低氧條件下可以加速藥物的釋放,傳統阿黴素脂質體DOX-LPs在低氧和常氧條件下均難以釋放藥物。
實施例6
DOX-HR-LPs在低氧和常氧細胞內的藥物釋放行為觀察,通過觀察DOX的細胞內螢光強度來判斷DOX的細胞內釋放速度。
鼠源前列腺癌細胞(RM-1)購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所。具體實驗過程如下:將RM-1細胞以合適密度接種於玻璃底細胞培養皿中,生長24h貼壁,用含有實施例4-1製備的DOX-HR-LPs(DOX 10μg/ml)的培養液處理細胞2h後吸去含藥培養液,PBS洗三遍後加培養液,在細胞表面加蓋玻片形成低氧環境,3h後在萊卡SP8雷射共聚焦顯微鏡下觀察細胞內的DOX螢光強度。結果如圖5所示,選取通過蓋玻片中心的區域,拼圖觀察(圖5A)和局部觀察(圖5C),以及專業圖像分析軟體Image-Pro Plus對螢光強度的分析(圖5B),從蓋玻片外到中心,細胞內的阿黴素螢光強度在逐漸增強,說明從蓋玻片外到中心,隨著氧濃度的降低,DOX-HR-LPs在細胞內釋放DOX的速度逐漸提高。在低氧嚴重的中心部位,細胞內的螢光強度最大,釋放的速度最快。
實施例7
DOX-HR-LPs和DOX-LPs以及DOX在C57BL/6實體瘤模型小鼠上的治療效果結果。
具體實施過程如下:在皮下注射接種RM-1細胞後,待腫瘤體積生長至大約50mm3,將實體瘤模型小鼠隨機分為四組(n=6),分別尾靜脈注射PBS、DOX、以及實施例4-1製備的DOX-LPs和DOX-HR-LPs(DOX劑量5mg/kg),第一次給藥記為第0天,第5天第二次給藥,每3天測量腫瘤體積、小鼠體重至第18天。
結果如圖6所示,圖6A為4個處理組小鼠的體重變化情況,PBS組小鼠的體重一直升高,是由於腫瘤的飛速生長,DOX組在給藥期間體重明顯下降,是由於DOX嚴重的系統毒性導致的,相對於其他三組,DOX-HR-LPs組的體重最穩定,說明DOX-HR-LPs低的毒副作用。圖6B為四個處理組小鼠的生存曲線,PBS、DOX、DOX-LPs以及DOX-HR-LPs的評價生存時間分別為16天、20天、25天和34天,DOX-HR-LPs可以顯著延長小鼠的生存時間,說明治療效果最好,DOX-LPs對治療效果的提升有限,主要作用在於降低毒副作用。
本發明提供了一種低氧響應脂質體藥物載體的思路及方法,具體實現該技術方案的方法和途徑很多,以上所述僅是本發明的優選實施方式,應當指出,對於本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,還可以做出若干改進和潤飾,這些改進和潤飾也應視為本發明的保護範圍。本實施例中未明確的各組成部分均可用現有技術加以實現。
