一種螢光納米探針及其製備方法和其在生物傳感中的應用與流程
2023-05-20 02:14:21 2
本發明屬於分析化學領域,具體涉及一種基於二維鑭金屬有機骨架的螢光納米探針及其製備方法和其在生物傳感中的應用。
背景技術:
二維納米材料因其特異的大比表面積已受到科研領域的熱切關注。在生物傳感領域,已被廣泛應用到生物分子的檢測,尤其是核酸分子的檢測。其中,應用最多的二維納米材料為石墨烯及其衍生物氧化石墨烯(Graphene Oxide, GO)。GO繼承了石墨烯優良的光學性質,不但具有較好的親水性,而且具有大的共軛結構,可通過螢光能量共振轉移和非福射偶極-偶極相互作用,有效猝滅螢光物質(染料分子、量子點和上轉換納米材料等)發出的螢光。因此,納米級的GO作為螢光猝滅元件,可實現對DNA等生物分子的靈敏檢測。
近年來,新型的二維納米材料(如MoS2、WS2和MnO2等),成功實現了對生物分子(如DNA等)的靈敏檢測。例如,文獻報導的MoS2二維納米材料(Changfeng Zhu,J. Am. Chem. Soc. 2013, 135, 5998−6001),可吸附螢光標記的單鏈DNA,並使其螢光信號猝滅,當加入與該單鏈DNA完全匹配的目標DNA後,兩者通過鹼基配對原則進行雜交,形成結構穩定的雙螺旋DNA結構,並從二維納米材料脫離,體系的螢光信號恢復。根據體系螢光強度的變化,可實現對目標DNA的定量檢測。而上述二維納米材料在應用於細胞內或體內分析時,會遇到難以代謝的問題,進而產生一定的毒性,對細胞或組織造成損傷。
納米級金屬有機骨架(Metal-Organic Frameworks,MOFs)作為一種新型的傳感材料,己成為材料化學研究的熱點之一。螢光MOFs材料不僅具有優秀的氣體儲存、選擇和分析能力,而且也可用來檢測陰陽離子、溶劑分子和生物分子等一系列的客體分子。此外,相比於其他納米材料(如GO、MoS2、WS2和MnO2等),納米級MOFs在細胞內或體內完成生物傳感之後,更容易被緩慢水解、代謝,產生較低的生物毒性。因此,MOFs在生物分子傳感領域具有一定潛力。
技術實現要素:
針對上述問題,本發明提供了一種基於二維鑭金屬有機骨架(MOF-La)的螢光納米探針,該螢光探針毒性較低,適用於檢測細胞內部腺苷分子。
本發明另一目的是提供一種基於二維鑭金屬有機骨架(MOF-La)的螢光納米探針的製備方法。該方法採用2,2′-硫代二乙酸和鑭離子製得MOF-La晶體後,通過剝離步驟得到MOF-La的螢光納米探針。
一種基於二維鑭金屬有機骨架(MOF-La)的螢光納米探針的製備方法,包括如下步驟:
(1)在含有OH-的鹼性溶液中,加入2,2′-硫代二乙酸或2,2′-硫代二乙酸鹽,然後加入La3+鑭離子無機鹽,溶解後於120~180℃反應10~30h,反應後,降溫至室溫即得到MOF-La晶體;
(2)將步驟(1)得到的MOF-La晶體加入到有機溶劑中,超聲處理25~35min,離心得到初步被剝離的MOF-La;
(3)將初步被剝離的MOF-La分散於正丁基鋰的有機溶液中,在惰性氣體保護下,於20~30℃反應15~25h,即得到二維MOF-La納米材料。
(4)將二維MOF-La納米材料分散於無機緩衝溶液或者有機緩衝溶液中,加入螢光標記的核苷酸鏈,室溫下反應後離心得到基於二維鑭金屬有機骨架的螢光納米探針。
上述方法,步驟(1)中所述的鹼性溶液,為氫氧化鈉水溶液或氫氧化鉀水溶液。
上述方法,步驟(1)中所述的鹼性溶液,其中OH-的濃度為70mM~120mM;優選濃度為90~110mM。
上述方法,步驟(1)中所述的鑭離子無機鹽,為La(NO3)3或La2(SO4)3。
上述方法,步驟(1)中所述的鑭離子無機鹽,其濃度為15mM~35mM;優選的濃度為20~30mM。
上述方法,步驟(1)中所述的2,2′-硫代二乙酸或2,2′-硫代二乙酸鹽,濃度為30mM~60mM; 優選的濃度為50~55mM。
上述方法,步驟(2)中所述的有機溶劑,為乙醇或正己烷。
上述方法,步驟(3)中所述的正丁基鋰的有機溶液,為正丁基鋰的己烷溶液或正丁基鋰的環己烷溶液。
上述方法,步驟(3)中所述的惰性氣體,為氮氣、氬氣或氦氣。
上述方法,步驟(4)中所述的緩衝溶液,為PBS緩衝溶液或三羥甲基氨基甲烷-鹽酸(Tris-HCl)緩衝液。
上述方法,步驟(4)中所述的緩衝溶液,其PH為6.0~9.0;優選的pH為7.4。
上述方法,步驟(4)中所述的螢光標記的核苷酸鏈,為羅丹明標記的腺苷適體或螢光素標記的腺苷適體或二者的混合。
一種由上述方法製備的基於二維鑭金屬有機骨架的螢光納米探針,其特徵在於,該探針為片狀,厚度為10nm以下,優選的厚度為2~6nm。
本發明還提供了由上述方法製備的螢光納米探針在生物傳感中的應用。
所述的應用包括細胞內或體外的螢光檢測。
本發明提出的二維MOF-La探針對目標分子(腺苷)的識別是通過吸附在其表面的核酸適體對腺苷的選擇性響應。當沒有腺苷時,吸附有羅丹明標記的腺苷適體(TAMRA-P)和螢光素標記的腺苷適體(FAM-P)的二維MOF-La主要發出綠色螢光;當處在含腺苷的環境中時,TAMRA螢光強度恢復而FAM被進一步猝滅,是該螢光探針主要發出紅色螢光。該探針可通過TAMRA和FAM兩種螢光分子的螢光強度變化,檢測體外或細胞內的腺苷。
本發明的有益效果在於:
(1)本發明所述的二維MOF-La探針製備方法簡單,不需要嚴格的合成條件,且細胞毒性低。
(2)本發明所述的二維MOF-La探針可通過顏色的變化檢測目標分子,避免了假陽性結果,定性定量更為準確。
(3)本發明所述的二維MOF-La探針對目標分子有良好的選擇性,細胞中存在的其他生物分子對其螢光信號無明顯影響。
附圖說明:
圖1為MOF-La晶體圖。
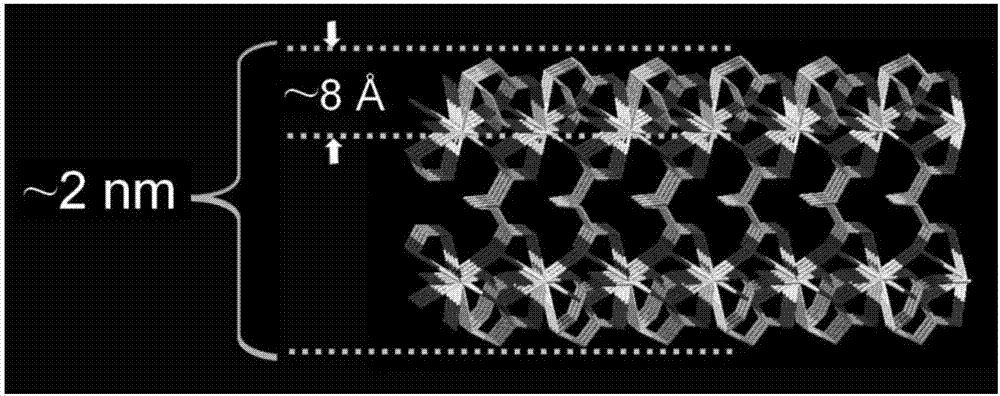
圖2為單層MOF-La結構圖
圖3為剝離後的二維MOF-La的透射電鏡圖。
圖4為剝離後的二維MOF-La的原子力顯微鏡圖。
圖5為二維MOF-La螢光探針對腺苷的選擇性。其中,FI為螢光強度,淺色柱狀圖為FAM螢光強度,深色柱狀圖為TAMRA螢光強度。
圖6為FAM-P+MOF-La探針對核苷響應螢光光譜圖。
圖7為TAMRA-P+MOF-La探針對核苷響應螢光光譜圖。
圖8為螢光探針檢測MCF-7細胞中腺苷的雷射共聚焦顯微成像灰度圖。標尺為30 µm。
具體實施方式
下面結合實施例對本發明的技術方案做進一步的說明,但不應理解為對本發明的限制:
實施例1:
一:MOF-La晶體的製備
(1) 在15 mL NaOH溶液(100 mM)中,加入120 mg (0.8 mmol)2,2′-硫代二乙酸,超聲溶解。然後加入173 mg(0.4 mmol)La(NO3)3·6H2O,震蕩使其溶解。將所得溶液轉移至反應釜的聚四氟乙烯內膽中,封裝反應釜,放入烘箱中,以150℃加熱,反應15 h。反應後,反應釜降溫至室溫即得到MOF-La晶體,其形貌如圖1所示。結構如圖2所示。
(2)取上述反應得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用細胞粉碎儀超聲30 min,在8000 rpm 下離心,得到初步被剝離的MOF-La。然後將該MOF-La分散於10 mL正丁基鋰的己烷溶液(0.16 M)中,通氮氣保護,在25℃條件下,攪拌反應20 h,即得到被剝離的二維MOF-La,其形貌如圖3。從原子力顯微鏡圖(圖4)可以看出,大部分二維MOF-La厚度在2-6 nm 之間。
二:探針對腺苷的螢光響應
① 向10 mL含有FAM-P(20 nM)的磷酸緩衝液(PBS,0.01 M,pH 7.4)中加入2 mg二維MOF-La,振蕩反應5 min,然後分別加入30 nM的單磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、三磷酸尿苷(UTP)、三磷酸鳥苷 (GTP)、三磷酸胞苷(CTP)、穀胱甘肽(GSH)、人血清白蛋白(HSA)、抗壞血酸(Vc)和組胺(histamine),觀察螢光強度的變化。圖5為二維MOF-La螢光探針對腺苷的選擇性。圖6為FAM-P+MOF-La探針加入核苷後的螢光光譜圖。
②向10 mL含有TAMRA-P(15 nM)的磷酸緩衝液(PBS,0.01 M,pH 7.4)中加入2 mg二維MOF-La,振蕩反應5 min,然後分別加入25 nM的AMP、ADP、ATP、UTP、GTP、CTP、GSH、HSA、Vc和histamine,觀察螢光強度的變化,如圖5。圖7為TAMRA-P+MOF-La探針加入核苷後的螢光光譜圖。
三:核酸適體修飾二維MOF-La
將0.2 mg二維MOF-La分散於1 mL PBS(0.01 M,pH 7.4)中,依次加入2 µL FAM-P(25 µM)和2 µL TAMRA-P(25 µM),室溫下攪拌反應2 h,然後在14000 rpm下離心,得到核酸適體修飾的二維MOF-La(Dye-P+MOF-La),將其分散於2 mL PBS(0.01 M,pH 7.4)中,備用。
四:利用Dye-P+MOF-La對細胞內腺苷進行螢光檢測
以人乳腺癌細胞MCF-7細胞為基本模型,將MCF-7細胞在培養皿中培養24 h。然後將50 μL Dye-P+MOF-La探針加入到培養皿中,溫育1到6 h,利用雷射共聚焦螢光顯微鏡進行觀察。圖6分別是Dye-P+MOF-La探針與MCF-7細胞溫育1、2、4、6 h後的螢光成像圖。從圖6中可以看出,隨著溫育時間的增加FAM的螢光強度減弱,而TAMRA的螢光強度增強。
實施例2:
(1) 在15 mL KOH溶液(70 mM)中,加入77 mg (0.45 mmol)2,2′-硫代二乙酸鈉,溶解後加入130 mg(0.225mmol)La2(SO4)3溶解。之後於120℃加熱,反應10 h。反應後降溫至室溫即得到MOF-La晶體。
(2)取上述反應得到的MOF-La (5 mg) 加入到2 mL正己烷中,利用細胞粉碎儀超聲35 min後離心,得到初步被剝離的MOF-La。
(3)將初步被剝離的MOF-La分散於10 mL正丁基鋰的環己烷溶液(0.16 M)中,通氦氣保護,在30℃條件下,攪拌反應25 h,即得到被剝離的二維MOF-La。
(4)將0.2 mg二維MOF-La分散於1 mL PBS(0.01 M,pH 8.0)中,加入2 µL FAM-P(25 µM)室溫下攪拌反應,然後在14000 rpm下離心,得到核酸適體修飾的二維MOF-La。
實施例3:
(1) 在15 mL KOH溶液(90 mM)中,加入154 mg (0.9 mmol)2,2′-硫代二乙酸鈉,溶解後加入227 mg(0.525mmol)La(NO3)3·6H2O溶解。之後於180℃加熱,反應30 h。反應後降溫至室溫即得到MOF-La晶體。
(2)取上述反應得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用細胞粉碎儀超聲25 min後離心,得到初步被剝離的MOF-La。
(3)將初步被剝離的MOF-La分散於10 mL正丁基鋰的環己烷溶液(0.16 M)中,通氬氣保護,在20℃條件下,攪拌反應15 h,即得到被剝離的二維MOF-La。
(4)將0.2 mg二維MOF-La分散於1 mL Tris-HCl緩衝液(0.01 M,pH 6.0)中,加入2 µL TAMRA-P(25 µM)室溫下攪拌反應,然後在14000 rpm下離心,得到核酸適體修飾的二維MOF-La。
實施例4:
(1) 在15 mL NaOH溶液(120 mM)中,加入113 mg (0.75 mmol)2,2′-硫代二乙酸,溶解後加入195 mg(0.45 mmol)La(NO3)3·6H2O溶解。之後於180℃加熱,反應20 h。反應後降溫至室溫即得到MOF-La晶體。
(2)取上述反應得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用細胞粉碎儀超聲30 min後離心,得到初步被剝離的MOF-La。
(3)將初步被剝離的MOF-La分散於10 mL正丁基鋰的己烷溶液(0.16 M)中,通氬氣保護,在20℃條件下,攪拌反應15 h,即得到被剝離的二維MOF-La。
(4)將0.2 mg二維MOF-La分散於1 mL Tris-HCl緩衝液(0.01 M,pH 9.0)中,加入2 µL TAMRA-P(25 µM)室溫下攪拌反應,然後在14000 rpm下離心,得到核酸適體修飾的二維MOF-La。
實施例5:
(1) 在15 mL NaOH溶液(110 mM)中,加入124 mg (0.83 mmol)2,2′-硫代二乙酸,溶解後加入130 mg(0.3 mmol)La(NO3)3·6H2O溶解。之後於150℃加熱,反應15 h。反應後降溫至室溫即得到MOF-La晶體。
(2)取上述反應得到的MOF-La (5 mg) 加入到2 mL乙醇中,利用細胞粉碎儀超聲30 min後離心,得到初步被剝離的MOF-La。
(3)將初步被剝離的MOF-La分散於10 mL正丁基鋰的己烷溶液(0.16 M)中,通氦氣保護,在25℃條件下,攪拌反應20 h,即得到被剝離的二維MOF-La。
(4)將0.2 mg二維MOF-La分散於1 mL Tris-HCl緩衝液(0.01 M,pH 7.4)中,依次加入2 µL FAM-P(25 µM)和2 µL TAMRA-P(25 µM),室溫下攪拌反應,然後在14000 rpm下離心,得到核酸適體修飾的二維MOF-La。
