一種玻璃海鞘多肽的應用的製作方法
2023-05-07 01:13:51 1
本發明屬於生化與生物醫藥領域,具體的說是一種玻璃海鞘多肽的應用。
背景技術:
惡性腫瘤是人類健康的第一殺手,其發病率和致死率均居各中疾病之首。抗癌藥物的研究和開發已成為本世紀新藥研究的重大課題。從海洋中分離純化抗腫瘤活性物質已經成為抗癌藥物研究的熱點之一。我們在篩選抗腫瘤藥物過程中發現從玻璃海鞘中分離純化的一種多肽(PI5931)具有很強的抑制腫瘤細胞生長的作用,對發展成為新的抗癌藥物具有很大潛力。
海鞘(Ascidian)屬於脊索動物門(Chordates),尾索動物亞門(Urochordata),海鞘綱(Ascidiacea),全世界大約有1600種。從中發現了許多具有新的結構和生物學功能的環肽、線性肽及desipeptides。Didemnins(膜海鞘素)最早是從加勒比海鞘中分離的,是desipeptides的家族,具有抗腫瘤,抗病毒和免疫抑制作用,其中Didemnins B是抗腫瘤活性最強的環肽(體外對L1210的IC50為2.5ng/ml),也是第一種進入臨床試驗的海洋天然產物。由兩種海鞘Didemnum cuculiferum和Polysyncranton lithostrotum中發現的一種13個胺基酸的環肽可顯著抑制微管聚合,並能延長小鼠p388淋巴細胞白血病的生存期;但由玻璃海鞘(Ciona intestinalis)中分離出抗腫瘤蛋白一直未見報導。
玻璃海鞘屬於內性目、玻璃海鞘科,為我國北方海水養殖產業的主要生物汙染物,國內有關玻璃海鞘的研究僅僅局限於胚胎發育,生理生化,脂肪酸提取上。董平原等從玻璃海鞘中分離得到了一種具有抗新生血管生成活性和抗腫瘤作用的玻璃海鞘多肽BLF-2,對斑馬魚胚胎血管生成具有顯著的抑制活性,對人臍靜脈內皮細胞的遷移和管腔形成具有顯著的抑制作用。
由玻璃海鞘中提取分離出抗腫瘤多肽一直未見報導,本發明採用多種分離純化手段從玻璃海鞘中分離得到一種新的具有抗腫瘤作用的多肽PI10,實驗證實,該多肽在體外具有誘導人肝癌細胞株BEL-7402凋亡的活性,並對多種腫瘤細胞均具有良好的細胞毒活性。與現有的化療藥物相比,抗腫瘤多肽類藥物具有毒副作用小、不易產生耐藥性等優點,有望成為新型的抗腫瘤藥物。
技術實現要素:
本發明目的在於提供一種玻璃海鞘多肽的應用。
為實現上述目的本發明採用的技術方案為:
玻璃海鞘多肽的應用:玻璃海鞘多肽在製備抗腫瘤藥物中的應用。
所述玻璃海鞘多肽在製備抗人肺癌細胞、人宮頸癌上皮細胞、人肝癌細胞、人結腸癌細胞、人乳腺癌細胞和人神經膠質瘤細胞藥物中的應用。
所述玻璃海鞘多肽按如下方法製備
1)將新鮮的海鞘通過有機溶劑以4-20℃進行沉澱提取1-3次,沉澱物通過濾膜進行超濾截留大於5KDa物質,待用;
2)將上述截留大於5KDa物質,以0.05-0.5M的NaCl緩衝液作為洗脫液進行DEAE陰離子交換柱層析,收集0.15M NaCl緩衝液洗脫組分,待用;
3)將上述收集的洗脫組分經Superdex75分子篩凝膠層析,用超純水做洗脫液,流速為0.8-1.2ml/min,收集洗脫組分,待用;
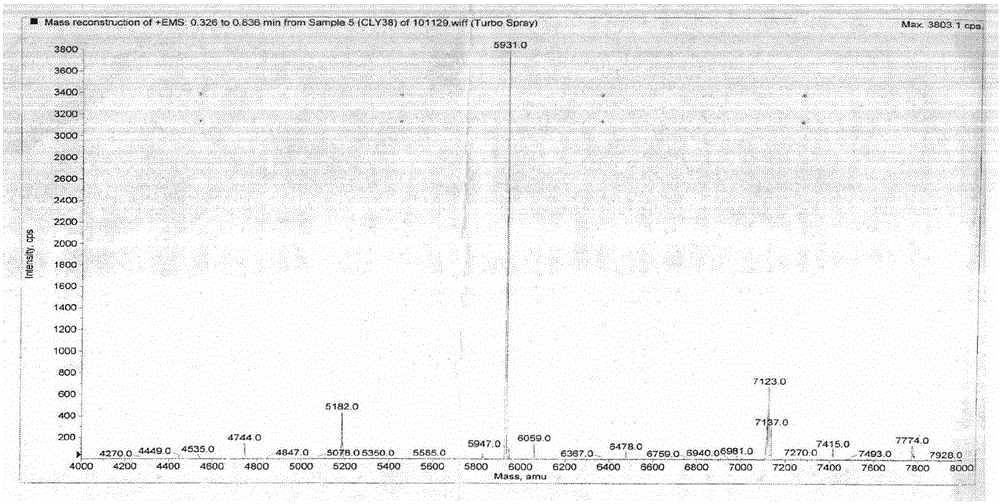
4)將上述洗脫組分經HPLC C-18反相柱分離純化,洗脫液為A液和B液,進行梯度洗脫,起始洗脫液中A液佔總洗脫液體積的90%,B液佔總洗脫液體積的10%,B液每分鐘1%的速率上升,流速為0.5-0.8ml/min,當B液佔總洗脫液體積的28.4%時出現活性組分,即得到N-末端序列為YQPDKFMLRGELRNN,分子量為5931Da的單一組分玻璃海鞘多肽;其中A液為A液總體積0.1%的TFA和A液總體積99.9%的超純水,B液為B液總體積0.1%的TFA和B液總體積99.9%的乙腈。
所述步驟1)通過有機溶劑沉澱時採用體積百分含量為10%-90%的丙酮水溶液,並且每次沉澱時間為12小時。
所述步驟1)通過有機溶劑沉澱時採用體積百分含量為60%-80%的丙酮水溶液。
本發明所具有的優點:
1.本發明中涉及的多肽是一種海洋來源的物質,由於海洋生態環境的特殊性,使得海洋生物具有某些陸上生物所沒有的活性物質,這些活性物質往往具有結構新穎、高活性、耐藥性低等特點,可以為新藥研究和開發提供模式結構和醫藥前體。
2.該多肽在提取過程中經過了70℃高溫加熱,加熱後仍保持活性不變說明該多肽具有熱穩定性,將來製成藥後能延長藥品的貨架壽命。
3.本發明將玻璃海鞘多肽經MTT測定、掃描電鏡觀察、細胞核染色觀察、線粒體膜電位變化等體內外方法證明了該多肽對多種腫瘤細胞具有顯著的抗腫瘤作用,可引起腫瘤細胞凋亡,其誘導機理系通過細胞凋亡途徑,說明了此玻璃海鞘多肽在預防和治療腫瘤方面的作用和新途徑。具體地說,就是通過體外實驗闡明了玻璃海鞘多肽誘導細胞凋亡的途徑,確定此多肽在惡性腫瘤的預防和治療方面的用途。
附圖說明
圖1為本發明實施例提取的多肽PI5931用ABI公司的Q Trap離子噴霧質譜儀(Applied Biosystems,Foster City,CA,USA)以增強的方式測定其分子量。質譜儀配以TurbolonSpray source並以陽離子模式操作
圖2為本發明實施例提取的多肽PI5931的Tricine-SDS-Page電泳分析圖。
圖3為本發明實施例提取的多肽PI5931處理BEL-7402癌細胞,掃描電鏡下正常細胞與細胞凋亡形態變化。(其中圖3A為正常細胞,圖3B為處理12小時後細胞)
圖4為抗腫瘤多肽PI5931處理BEL-7402癌細胞,DAPI染色,觀察凋亡小體的出現。(其中1.正常細胞2.PI5931處理12小時3、PI5931處理18小時,4.PI5931處理24小時(可清晰看見凋亡小體))
圖5為抗腫瘤多肽PI5931處理BEL-7402癌細胞,AO/EB染色觀察凋亡細胞細胞核顏色變化圖。
具體實施方式
實施例1
玻璃海鞘多肽的製備方法:
1)丙酮沉澱製備粗提物:取新鮮海鞘洗淨、粉碎、分散勻漿機勻漿,在70℃下加熱30min,而後以10000rpm,離心20min,得上清,上清液中加入清液體積三倍的體積百分含量為70%的丙酮,在4℃靜置過夜;靜置過夜後以1000rpm離心20min,取沉澱。沉澱重新溶解後通過5KDa的濾膜進行超濾截留,保留大於5KDa的部分,待用。
2)DEAE SepharoseTMFast Flow陰離子交換柱層析:
首先,將粗提物裝入分子截留量為3.5kD的透析袋,採用純水進行初步透析,而後將其對起始緩衝溶液充分透析;將透析好的樣品取出,10000rpm離心去除不溶物,準備上柱;起始緩衝溶液為0.02M Tris-Cl,pH8.0。
其次,取適量的DEAE SepharoseTMFast Flow填料(GE公司生產),加入超純水中,用玻璃棒輕微攪拌均勻後,玻璃棒引流,裝入16×26規格的層析柱,用起始緩衝溶液平衡3-4個柱體積,基線穩定後方可使用。
再次,將樣品上柱後,用起始緩衝溶液衝洗,待不掛柱蛋白完全穿透後,開始洗脫,洗脫液為Tris-Cl、NaCl溶液,即在起始緩衝液的基礎上,分別配製0.05M、0.1M、0.15M、0.2M、0.3M和0.5MNaCl溶液,而後進行分步洗脫,流速為5ml/分鐘,整個層析過程採用280nm檢測蛋白質洗脫峰。
最後,將由六個不同濃度濃度NaCl洗脫所得到的組分用純水充分透析後凍幹,用純水溶解;每個組分質量濃度為200ug/ml,MTT試驗檢測各組份活性,0.15M NaCl洗脫組分為活性組分,將活性組份置於-20℃保存,待用。
3)superdex 75分子篩凝膠層析:
首先,取適量的superdex 75分子篩凝膠填料(GE公司生產),清水浸泡24小時,用玻璃棒輕微攪拌均勻後,玻璃棒引流,裝入1.6×80cm規格的層析柱,用純水平衡3-4個柱體積,基線穩定後方可使用。
其次,將上述0.15M NaCl洗脫組分上柱,用清水以1ml/min的速度衝洗層析柱,整個層析過程採用280nm檢測蛋白質洗脫峰,共得四個洗脫峰,每個洗脫峰為一個組分,將各個組分冷凍乾燥,採用BCA法測定蛋白濃度後,MTT試驗檢測各組份活性,第四個洗脫組分為活性組分,即截取1小時40分鐘至1小時55分鐘的洗脫液。將活性組份置於-20℃保存。
4)將上述洗脫組分經HPLC C-18反相柱(4.6×250mm規格的層析柱)分離純化,洗脫液為A液和B液,進行梯度洗脫,起始洗脫液中A液佔總洗脫液體積的90%,B液佔總洗脫液體積的10%,B液每分鐘1%的速率上升,流速為0.5ml/min,當B液佔總洗脫液體積的28.4%時出現活性組分,經質譜鑑定即得到N-末端序列為YQPDKFMLRGELRNN,分子量為5931Da的單一組分玻璃海鞘多肽(參見圖1);活性組分由等電聚焦電泳測定等電點為PI=7.25。其中A液為A液總體積0.1%的TFA和A液總體積99.9%的超純水,B液為B液總體積0.1%的TFA和B液總體積99.9%的乙腈。
5)海鞘多肽的Tricine-SDS-Page電泳分析鑑定:配置4%的濃縮膠和16.5%的分離膠。取過C-18反相柱組分點樣,用低分子量蛋白Marker為對照,進行Tricine-SDS-Page蛋白電泳,濃縮膠採用50V電壓,分離膠採用60V電壓進行電泳,電泳後用考馬斯亮藍染色液進行染色,在樣品泳道能夠發現6KD左右大小的一條亮帶,說明該多肽的分子量在6KD左右(參見圖2)。
實施例2:抗瘤譜的測定
細胞:人宮頸癌上皮細胞(Hela)、人肝癌細胞(BEL-7402)、人結腸癌細胞(HCT-116)、人乳腺癌細胞(MCF-7)、人肺癌細胞(A549)、人神經膠質瘤細胞(U8T)。以上細胞均為中科院海洋所海洋藥物實驗室提供。
藥品及試劑:玻璃海鞘多肽:中科院海洋所海洋藥物實驗室提供;5-氟脲嘧啶(5-FU)江蘇南通精華製藥有限公司產品,批號為100402;MTT(SIGMA,USA);DMSO(SIGMA,USA);胰蛋白酶(SIGMA,USA);RPMI1640(GIBCO,Invitragen Co.,USA);DMEM(GIBCO,Invitragen Co.,USA);優級胎牛血清(GIBCO,Invitragen Co.,USA);特級胎牛血清Fetal BovineSerum(Hyclone)。
儀器:超低溫冰箱(Nature,USA),細胞培養箱(SANYO,Japan),倒置顯微鏡(NIKON,Japan),酶標儀(Bio-Tek Instruments,Inooski,VT,USA),PH計(Thermo orion,USA),超淨工作檯(FLC-哈爾濱東聯儀器廠)。
而後通過MTT法進行檢測抗腫瘤效果,取各種人的腫瘤細胞株按照常規方法培養傳代,收集對數生長期細胞,調節細胞懸液濃度5×104個/ml左右。將細胞懸液加入96孔培養板中,每個孔加入180μl。置於37℃恆溫培養箱中培養24h後,實驗組加入各濃度上述實施例所得多肽提取物20μl/孔,並以5-FU作為陽性對照組,每組各設4個平行孔,並分別設清水對照以調零。在培養箱37℃,培養48h後,用移液槍將96孔板中液體洗淨後每孔加入MTT(1mg/ml)30μl,置CO2培養箱37℃培養4h,棄去上清,每孔加入DMSO 150μl,置搖床搖勻30min,用酶標儀在492nm下檢測,利用SPSS統計軟體,計算細胞死亡率,求取IC5(參見表1)0。
實驗結果表明,經SPSS軟體統計,玻璃海鞘多肽對用於試驗的6種腫瘤細胞,均有不同程度的抑制作用,並且呈一定的劑量依賴關係,不同濃度的玻璃海鞘多肽對各種腫瘤細胞的抑制率、IC50值詳見表1。
表1不同濃度的玻璃海鞘多肽對5種腫瘤細胞的抑制率
實驗結果顯示,活性組分在50ug/ml濃度時能夠強烈抑制人肝癌細胞(BEL-7402)、人宮頸癌上皮細胞(Hela)、人結腸癌細胞(HCT-116)、人乳腺癌細胞(MCF-7)、人神經膠質瘤細胞(U8T)、人肺癌細胞(A549)生長,抑制率達到50%-75%,說明本發明實施例所得物質能夠抑制癌細胞的增值。
實施例3:掃描電鏡觀察凋亡現象
用六孔板做細胞爬片→37℃培養24小時→加入上述實施例製備所得終濃度100ug/ml的玻璃海鞘蛋白提取物→37℃培養20小時→PBS衝洗→2.5%戊二醛固定→30%、50%、70%、80%、90%、100%乙醇梯度脫水→掃描電子顯微鏡下觀察。
掃描電鏡觀察凋亡細胞的外部形態:掃描電鏡下觀察BEL-7402處理細胞,與正常細胞相比,經過上述實施例製備所得海鞘多肽處理細胞表面微絨毛減少或者消失,細胞變圓皺縮,細胞表面出現蜂窩狀空洞,少數細胞能發現凋亡小體存在(參見圖3)。
實施例4:細胞核染色觀察
1)DAP I染色,觀察凋亡小體的出現,DAPI染色:用六孔板做細胞爬片→37℃培養24小時→加入上述實施例製備所得終濃度100ug/ml的玻璃海鞘蛋白提取物→37℃培養20小時→PBS衝洗→多聚甲醛固定→PBS衝洗→Triton-100破膜→PBS衝洗→DAPI染色20min→螢光顯微鏡下觀察。
經DAPI染色後,在螢光顯微鏡下觀察發現正常細胞細胞核內染色質均勻,經過上述實施例製備所得海鞘多肽處理細胞核內染色質發生固縮,可見細胞核分成大小不同的圓形,是凋亡小體的典型形狀(參見圖4)。
2)AO/EB染色觀察凋亡細胞細胞核顏色變化:用六孔板做細胞爬片→37℃培養24小時→加入上述實施例製備所得終濃度100ug/ml的玻璃海鞘蛋白提取物→37℃培養20小時→PBS衝洗→多聚甲醛固定→PBS衝洗→Triton-100破膜→PBS衝洗→AO/EB混合液染色→螢光顯微鏡下觀察。
經AO/EB染色後,在螢光顯微鏡下觀察發現正常細胞發出綠色螢光,經過上述實施例製備所得海鞘多肽處理細胞發出橙紅色螢光。正常細胞細胞核內染色質均勻,藥物處理細胞核內染色質發生固縮,可見細胞核分成大小不同的圓形,是凋亡小體的典型形狀(參見圖5)。
實施例5
線粒體膜電位檢測(JC-1):
A細胞培養瓶細胞傳代37℃培養24小時
B加入上述實施例製備所得終濃度50ug/ml的玻璃海鞘蛋白提取物,37℃培養20小時
C收集細胞,取10-60萬細胞重懸於0.5ml細胞培養液中
D加入JC-1染色工作液,混勻,37℃培養20分鐘。
E 600g離心4分鐘,棄上清
F用JC-1染色緩衝液洗滌2次
G再用JC-1染色緩衝液重懸後,用螢光分光光度計檢測(激發波長490nm)。
經玻璃海鞘多肽處理過的細胞在螢光分光光度計激發波長為490nm時,在530nm處出現強烈激發光,在590nm處激發光很弱或者沒有。而正常細胞相比在激發波長為490nm時,在530nm出現的激發光弱於590nm出現的激發光。由此可見玻璃海鞘多肽處理過的細胞,線粒體膜電位明顯下降,說明玻璃海鞘誘導腫瘤細胞凋亡走的是線粒體途徑。
