一種可注射型自癒合止血材料及其製備方法和應用與流程
2023-04-25 13:27:56 2
本發明屬於生物醫用材料技術領域,涉及一種止血材料及其製備方法,具體而言,本發明涉及一種可直接施用於外科手術(含微創手術)以及外傷等原因造成的人及其它哺乳動物的組織器官創面,用於止血、封閉傷口、減少組織滲出、促進組織修復以及保護創面組織等目的的明膠基止血粉劑和止血凝膠材料的製備方法。
背景技術:
外科手術過程中需要對不同原因造成的傷口進行止血和封閉,因此止血材料是非常重要的一類生物醫用材料,具有重要的研發和應用意義。目前臨床常用的止血材料從作用機制上可分為三類:第一類止血材料是通過材料的物理或化學作用使傷口部位加速凝血(如止血紗布、高分子多糖類、無機類沸石等);第二類是直接或間接提供外來的凝血成分、利用激發自身凝血機制加速實現凝血(如纖維蛋白類止血材料、含有凝血酶和凝血因子類止血材料);第三類是利用材料對組織很強的粘著力直接封閉創面,從而實現止血(如α氰基丙烯酸酯類材料)。然而不同類型的止血材料都存在諸多瓶頸。
對於利用止血機制來實現血凝的之血製品而言,其缺點是它們僅對流速較小的出血有效,因此使用時必須配合止血鉗夾,這就使得上述止血材料在使用時常常需要外科醫生提前預測出血量或者反覆多次使用止血鉗。另外,載有凝血酶類凝血劑的止血製品在使用過程中,凝血酶類蛋白分子易外溢到正常血管中,因此存在誘發正常血流發生凝血產生血栓的風險,因此不依賴機體凝血機制並能迅速封閉創面的止血製品在外科手術中更受青睞。
而通過物理作用實現止血的止血製品,如止血紗布、海綿等,在止血過程需要通過對出血創面進行物理壓迫,同時材料通過吸收血液中的水,促使凝血,止血速度慢,效果較差。並且,這類材料僅對流速較小的出血有效,因此使用時必須配合止血鉗夾,這就使得上述止血材料在使用時常常需要外科醫生提前預測出血量或者反覆多次使用止血鉗。同時,傳統止血材料(如棉紗、繃帶)對於不規則形狀、深、窄、動脈破裂等現場常見創傷的止血效果很不理想。另外,還存在其他的缺點:1)影響術後縫合,增加新的創面出血;2)不能自然降解,在體內形成殘留;3)止血過程需要長時間的外力按壓實現物理止血,對於脆弱的神經或腦組織不適用。另一類無機物止血材料,包括沸石、高嶺土等,這類材料利用了天然矽鋁酸鹽材料多孔結構、高比表面積等特性,通過吸收血液中的水分,濃縮創面局部的凝血成分,從而實現快速止血。而人工製備的介孔矽材料同樣具有多孔結構、高比表面積等特性,而且相比天然矽鋁酸鹽材料具有成分、粒徑、孔徑可控等優勢,同樣可實現有效止血。然而,這類材料對於血流大的出血無能為力,對於大面積創面效果也有限;並且這類材料雖然介局部組織反應是良性的,但是進入脈管和組織器官的介孔矽顆粒會引起嚴重的全身毒性。因此,開發針對現場和院前急救用的,快速、安全、有效的新型止血材料成為醫學和生物材料科學領域中的重要課題。
可注射的凝膠類止血製品因其臨床易操作性、適於微創手術近年來漸漸進入臨床止血應用。目前國內臨床上使用的止血凝膠類產品主要依靠進口,其中美國強生公司的佔據了主要的市場份額。該材料由明膠組成,水溶後快速形成泡沫狀凝膠物,產品具有很好的可注射性。但在止血過程中存在諸多問題。首先,凝膠力學強度差,流變儀測得彈性模量2倍溶液體積的極性有機溶劑,生成明膠微凝膠顆粒分散液,加入交聯劑交聯反應1~12h,離心、清洗得到明膠微凝膠顆粒;
其中,所述明膠微凝膠顆粒的zeta電勢為-30~+30mv,所述明膠微凝膠顆粒的直徑為20nm~2μm;
(2)將步驟(1)製備得到的表面zeta電勢>+10mv的明膠微凝膠顆粒,分散在ph9的鹼性水溶液中,得分散有帶正電荷的明膠微凝膠顆粒的分散液,再與帶負電荷的高分子顆粒分散液按照顆粒數比1:10~10:1共混,或者與等電點<6的帶負電荷的親水性高分子水溶液按照明膠微凝膠顆粒與親水性高分子的質量比1:10~10:1共混,用ph調節劑調ph至7.0,冷凍乾燥,得明膠微凝膠顆粒凍乾粉末i;
(3)將步驟(1)製備得到的表面zeta電勢<-10mv的明膠微凝膠顆粒,分散在ph9的鹼性水溶液中,得明膠微凝膠顆粒的分散液,再與帶正電荷的高分子顆粒分散液按照顆粒數比1:10~10:1混合,或者與等電點>8的帶正電荷的親水性高分子水溶液按照明膠微凝膠顆粒與親水性高分子的質量比1:10~10:1共混,用ph調節劑調ph至7.0,冷凍乾燥,得明膠微凝膠顆粒凍乾粉末ii;
(4)將步驟(1)製備得到的表面zeta電勢為-10~+10mv的明膠微凝膠顆粒分散在中性水溶液中,再與另一種表面zeta電勢在-10~+10mv的高分子顆粒分散液按照顆粒數比1:10~10:1共混,或者與等電點6~8的親水性高分子水溶液按照明膠微凝膠顆粒與親水性高分子的質量比1:10~10:1共混,冷凍乾燥,得明膠微凝膠顆粒凍乾粉末ⅲ;
(5)將明膠微凝膠顆粒凍乾粉末i、明膠微凝膠顆粒凍乾粉末ii或明膠微凝膠顆粒凍乾粉末ⅲ分別與水性溶液共混,得可注射型自癒合止血材料;
其中,所述的帶正電荷的高分子顆粒的表面電荷為+5~+60mv,帶負電荷的高分子顆粒的表面電荷為-5~-60mv,所述高分子顆粒的直徑為100nm~20μm,在步驟(5)中得到的可注射型自癒合止血材料中膠體顆粒佔總體積的百分比為50vol%~150vol%;在步驟(3)、(4)和(5)中所述的親水性高分子的分子量為1k~500kda。
本發明上述可注射型自癒合止血材料的製備方法中,將步驟(1)製備得到的明膠微凝膠顆粒,冷凍乾燥得到的明膠微凝膠顆粒凍乾粉末與水性溶液共混,也可以得到本發明所述的可注射型自癒合止血材料,但其性能差於本發明中其他方法製備得到的可注射型自癒合膠體凝膠。
本發明上述可注射型自癒合止血材料的製備方法中,在步驟(1)中,根據調整明膠水溶液的濃度、極性有機溶劑的加入量、交聯反應時間等,可以製備得到帶有不同zeta電勢和直徑大小的明膠微凝膠顆粒。本發明上述技術方案中,明膠水溶液濃度優選為1~10w/v%,更優選為2.5~5w/v%;極性有機溶劑的加入量優選為明膠水溶液的>2倍,更優選為3~6倍,明膠微凝膠顆粒直徑優選為20nm~5μm,更優選為100nm~2000nm。
本發明上述可注射型自癒合止血材料的製備方法中,步驟(2)、(3)和(4)中,明膠微凝膠顆粒的分散液和各有機高分子顆粒分散液中的顆粒數的比例影響所製備膠體凝膠的彈性模量和自修復效率,本發明中兩種分散液中顆粒數的比例優選為1:10~10:1,更優選為1:5~5:1,共混的兩種顆粒直徑比為1:5~5:1時,可得到具有更高彈性模量和自修復效率的可注射型自癒合止血材料,若直徑的差異過大,則所得到的膠體凝膠彈性模量下降,自修復效率降低。
在本發明的上述技術方案中,將製備得到的明膠微凝膠顆粒凍乾粉末i、明膠微凝膠顆粒凍乾粉末ii或明膠微凝膠顆粒凍乾粉末ⅲ直接作為止血材料來應用,也可以與適量水性溶液共混,製備得到膠體凝膠狀的可注射型自癒合止血材料,其彈性模量為1pa~100kpa,優選20kpa~100kpa。
進一步地,在上述技術方案中,所述的帶正電荷的高分子顆粒分散液以殼聚糖、a型明膠、聚丙烯醯胺、聚(n-異丙基丙烯醯胺)、聚乙烯亞胺中的一種或幾種作為原料製備得到,所述的帶負電荷的高分子顆粒分散液以透明質酸、海藻酸、a型明膠、b型明膠或聚丙烯酸中的一種或幾種作為原料製備得到,所述的表面zeta電勢在-10~+10mv的高分子顆粒分散液以膠原蛋白、白蛋白、明膠中的一種或幾種作為原料製備得到。所述帶正電荷的高分子顆粒分散液或帶負電荷的高分子顆粒分散液或表面zeta電勢在-10~+10mv的高分子顆粒分散液,本領域技術人員可以根據高分子顆粒的常規製備技術來製備得到,在本申請中不再詳細陳述。
所述的等電點>8的帶正電荷的親水性高分子為殼聚糖、a型明膠、聚丙烯醯胺、聚(n-異丙基丙烯醯胺)、聚乙烯亞胺中的一種或幾種,所述等電點<6的帶負電荷的親水性高分子為透明質酸、海藻酸、a型明膠、b型明膠或聚丙烯酸中的一種或幾種,所述的等電點6~8的高分子為膠原蛋白、白蛋白、明膠、聚乙烯醇、聚乙二醇中的一種或幾種。
進一步地,在上述技術方案中,在步驟(1)中所述的極性有機溶劑為甲醇、乙醇、異丙醇、丁醇、丙酮、乙腈、四氫呋喃中的一種或幾種的組合;所述的交聯劑為戊二醛、甘油醛、甲醛、碳二亞胺、二滷代烷、異氰酸酯、二異氰酸酯、穀氨醯胺轉胺酶、京尼平中的一種或幾種。
進一步地,在上述技術方案中,在步驟(1)中所述的交聯反應的反應體系中交聯劑與明膠中氨基基團的摩爾比為0.1~10。交聯劑與明膠中氨基基團的摩爾比影響所形成的明膠微凝膠顆粒的交聯度,交聯度過高明膠微流強度更高、表面電荷更傾向於帶負電,交聯度過低明膠微球強度低、表面電荷取決於明膠原料的等電點,本發明優選的技術方案中交聯度較低時較為好,優選的,本發明中所述交聯劑與明膠中氨基基團的摩爾比要控制在0.5~5。
進一步地,在上述技術方案中,在步驟(2)和步驟(3)中所述的酸性水溶液和鹼性水溶液中所含有的離子濃度均小於200mm。所述的酸性水溶液和鹼性水溶液中所含有的離子的種類不特別限定,可以採用本領域常規的用於調節酸性或鹼性的試劑,如鹽酸、硫酸、醋酸、氫氧化鈣、氫氧化鉀、氨水、碳酸鈉等。
進一步地,在上述技術方案中,在步驟(2)和步驟(3)中所述的ph調節劑包括酸性物質和鹼性物質,所述酸性物質為葡萄糖酸內酯、hcl、hno3、h2so4中的一種或幾種,所述鹼性物質為尿素和脲酶的組合、或者氫氧化鈉、氫氧化鈣、氫氧化鉀、氨水中的一種或幾種。
進一步地,在上述技術方案中,在步驟(5)中所述的水性溶液是離子濃度120~200mm、ph值為6~8的任意水溶液、親水性高分子的水溶液、不水溶的納米顆粒分散液中的一種或幾種的組合。
進一步地,在上述技術方案中,所述水性溶液中含有生物活性物質和/或賦形劑。其中所述賦形劑為溶劑、分散介質、包被劑、表面活性劑、抗氧化劑、防腐劑、等滲劑、粘合劑、潤滑劑、顏料,以及它們的組合或類似物;所述生物活性物質為凝血劑、抗感染藥物、消炎藥、生物活性蛋白藥物中的至少一種。所述凝血劑選自膠原蛋白、明膠、氧化纖維素、羧甲基纖維素、殼聚糖、透明質酸、海藻酸鈉、高嶺土、凝血酶、纖維蛋白、鈣劑、魚精蛋白、多肽、縮氨酸、胺基酸中的一種或其組合;所述抗感染藥物選自抗生素、抗菌製劑、抗病毒製劑、抗真菌藥物、抗潰瘍藥物、中藥製劑的一種或其組合;所述消炎藥物選自非類固醇類、固醇類消炎藥、抗潰瘍藥物、中藥製劑的一種或其組合。
本發明還提供上述所述的可注射型自癒合止血材料在製備用於體表組織、體腔內組織器官的有血創面的止血、防黏連、防感染、促進組織癒合和/或封閉傷口的止血製品中的應用。其中所述的止血製品可採用止血粉劑、止血顆粒、止血球、止血氣霧劑、止血海綿、止血凝膠、止血膜、止血栓或止血貼等方式。
本發明的有益效果:
1.和傳統止血材料的區別和優勢;
外科手術過程中需要對不同原因造成的傷口進行止血和封閉,因此止血材料是非常重要的一類生物醫用材料,具有重要的研發和應用意義。目前臨床常用的止血材料從作用機制上可分為三類:第一類止血材料是通過材料的物理或化學作用使傷口部位加速凝血(如止血紗布、高分子多糖類、無機類沸石等);第二類是直接或間接提供外來的凝血成分、利用激發自身凝血機制加速實現凝血(如纖維蛋白類止血材料、含有凝血酶和凝血因子類止血材料);第三類是利用材料對組織很強的粘著力直接封閉創面,從而實現止血(如α氰基丙烯酸酯類材料)。然而不同類型的止血材料都存在諸多瓶頸。
對於利用止血機制來實現血凝的止血製品而言,其缺點是它們僅對流速較小的出血有效,因此使用時必須配合止血鉗夾,這就使得上述止血材料在使用時常常需要外科醫生提前預測出血量或者反覆多次使用止血鉗。另外,載有凝血酶類凝血劑的止血製品在使用過程中,凝血酶類蛋白分子易外溢到正常血管中,因此存在誘發正常血流發生凝血產生血栓的風險,因此不依賴機體凝血機制並能迅速封閉創面的止血製品在外科手術中更受青睞。
而通過物理作用實現止血的止血製品,如止血紗布、海綿等,在止血過程需要通過對出血創面進行物理壓迫,同時材料通過吸收血液中的水,促使凝血,止血速度慢,效果較差。並且,這類材料僅對流速較小的出血有效,因此使用時必須配合止血鉗夾,這就使得上述止血材料在使用時常常需要外科醫生提前預測出血量或者反覆多次使用止血鉗。同時,傳統止血材料(如棉紗、繃帶)對於不規則形狀、深、窄、動脈破裂等現場常見創傷的止血效果很不理想。另外,還存在其他的缺點:1)影響術後縫合,增加新的創面出血;2)不能自然降解,在體內形成殘留;3)止血過程需要長時間的外力按壓實現物理止血,對於脆弱的神經或腦組織不適用。另一類無機物止血材料,包括沸石、高嶺土等,這類材料利用了天然矽鋁酸鹽材料多孔結構、高比表面積等特性,通過吸收血液中的水分,濃縮創面局部的凝血成分,從而實現快速止血。而人工製備的介孔矽材料同樣具有多孔結構、高比表面積等特性,而且相比天然矽鋁酸鹽材料具有成分、粒徑、孔徑可控等優勢,同樣可實現有效止血。然而,這類材料對於血流大的出血無能為力,對於大面積創面效果也有限;並且這類材料雖然介局部組織反應是良性的,但是進入脈管和組織器官的介孔矽顆粒會引起嚴重的全身毒性。
而本發明提供的可注射型自癒合止血材料為使用帶表面電荷的高分子微凝膠顆粒,通過顆粒間的靜電相互作用自組裝得到的膠體凝膠材料。由於微凝膠之間的靜電作用是物理交聯且具有可逆性,因此當這種膠體凝膠受到破壞性的剪切力破壞時,微凝膠顆粒間的靜電相互作用被外力破壞,膠體凝膠從具有剛性的固體材料向具有流動性的流體材料轉變,這一過程被稱為剪切變稀行為。當外力取消時,膠體間的相互作用快速恢復,膠體顆粒通過重新形成物理交聯組裝成膠體凝膠。因此本發明所述的止血材料具有可注射性和自癒合性能,自癒合性能測試顯示,剪切破壞後的自修復率超過85%以上。更重要的是,本發明的止血材料在注射和固化過程無需引入化學交聯反應,不同於化學高分子,也沒有引入小分子交聯劑,生物相容性好,可降解吸收,無毒副作用,安全性好,使其在生物醫學領域的廣泛應用成為可能。
另外,本發明提供的止血材料有較好的力學強度,凝膠狀止血材料的彈性模量大於10kpa,對於出血量大、血管壓力高的出血組織也可以實現快速止血。還有本發明止血材料的膠體顆粒的高比表面積、膠體凝膠的穩定強度有利於創口的封閉。
2.在藥物緩釋方面的優勢
止血製品是外科手術中必不可少的生物醫用材料之一,為促進止血、控制手術創面感染等風險、加速催化創口癒合,將止血材料與功能性藥物聯合使用是提高臨床止血、促進創面癒合的有效手段之一。這些凝血藥物、抗菌消炎藥物、或促進組織修復再生的生物活性藥物包括小分子藥物和蛋白類大分子藥物,這些藥物在與止血製品複合使用的過程中都存在藥物釋放不可控,分子類藥物易失活的問題。因此,開發可加載藥物並可控釋放藥物的止血材料具有重要的醫學應用價值。傳統的止血材料通常利用預加工好的止血製品(如止血膜、止血粉、止血海綿等),將材料直接混入藥物溶液,通過藥物在支架的表面物理吸附實現藥物的加載。這種方式通常導致止血材料在使用時,所載藥物的暴釋,對於促進創傷修復的蛋白類藥物不能實現長期持續的釋放。
本發明的止血材料對比與傳統載體材料具有更多優勢。1)具有微納米尺寸的微凝膠顆粒為基本單元,相比傳統多孔支架材料具有更高比表面積,因此可表面吸附的蛋白量更高;2)生長因子的加載是將微凝膠顆粒的凍乾粉直接與生長因子水溶液共混,在顆粒溶脹過程中蛋白分子在滲透壓作用下進入微凝膠顆粒網絡內部,因此蛋白的釋放主要是由微凝膠的降解速率控制的;3)生長因子的釋放速率主要由明膠微凝膠的降解速率調控,因此通過控制微凝膠的交聯度可以實現對加載的生長因子的釋放速率進行調控,進一步將不同的生長因子加載入不同交聯度的膠體顆粒,可以實現多種生長因子的有序可控釋放。
附圖說明
圖1為實施例1方法製備的a型明膠微凝膠顆粒的掃描電鏡照片。
圖2為實施例1方法製備的由帶相反電荷的a型和b型明膠膠體顆粒組成的複合膠體凝膠的自修復行為的流變學測試結果。
圖3為實施例2所述的方法製備的帶相反電荷的海藻酸鈣和a型明膠膠體顆粒組成的複合膠體凝膠的自修復行為的流變學測試結果。
圖4表示實施例6中所述方法製備的止血材料實現生物活性蛋白藥物的有序釋放。
圖5表示實施例7所述的通過動物實驗證實本發明止血材料的止血功效。
具體實施方式
下述非限制性實施例可以使本領域的普通技術人員更全面地理解本發明,但不以任何方式限制本發明。下述實施例中,如無特殊說明,所使用的實驗方法均為常規方法,所用材料、試劑等均可從生物或化學公司購買。
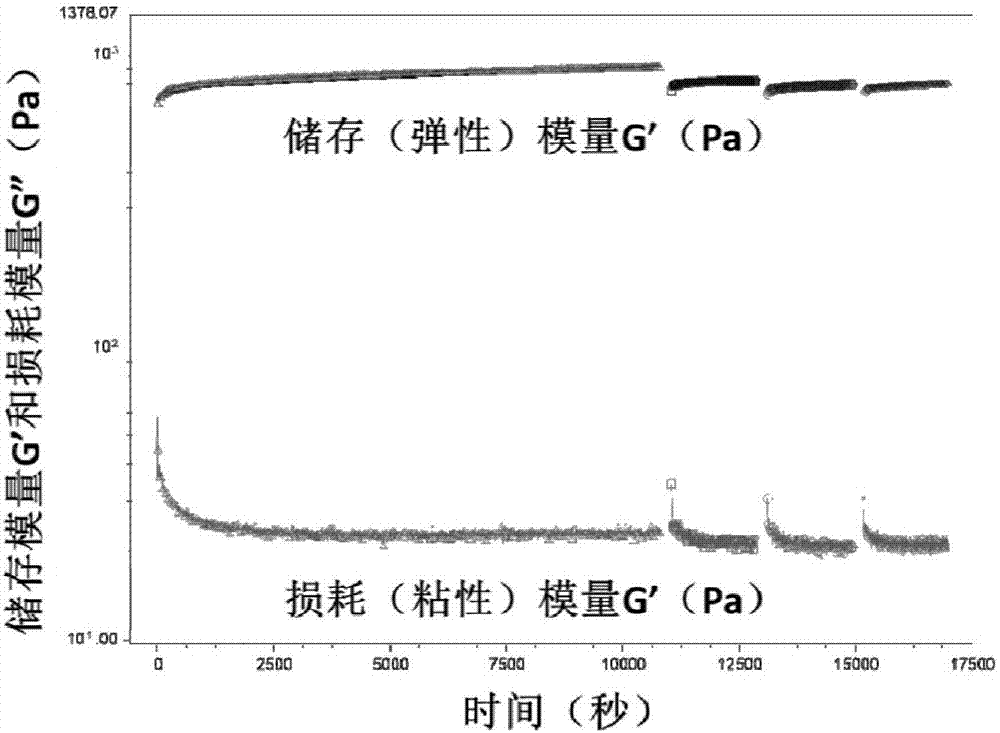
下面實施例中將膠體顆粒冷凍乾燥後得各膠體顆粒的凍乾粉末,其中所述冷凍乾燥條件為:將膠體顆粒在-60℃、5000rpm),即得到海藻酸鈣微凝膠顆粒,顆粒尺寸和表面zeta點位參數如表4所示。將a型明膠和海藻酸鈣微凝膠顆粒分別分散在10mm的醋酸酸性水溶液中,分別得到帶正電荷的a型明膠微凝膠顆粒的分散液ⅰ、帶負電荷的海藻酸微凝膠顆粒的分散液ⅱ,將分散液ⅰ和分散液ⅱ充分混合、攪拌,得分散液iii,其中a型明膠和海藻酸鈣微凝膠顆粒混合的顆粒數量比為2:1;向分散液iii中加入100mm的氫氧化鈉調節ph值至7.0,攪拌混合,冷凍乾燥,得到混有兩相不同膠體顆粒的凍乾粉末。將上述微凝膠顆粒凍乾粉末與一定體積的1mm的nacl鹽溶液共混,並快速攪拌混合均勻得到可注射型自癒合膠體凝膠,即本發明所述的止血材料,其中微凝膠膠體顆粒體積分數佔膠體凝膠體積的50vol%或100vol%。使用流變儀對膠體凝膠的力學參數進行評價,結果如圖3和表5所示,帶相反電荷的海藻酸鈣和a型明膠膠體顆粒共混得到的膠體凝膠的彈性模量隨著膠體顆粒體積分數的增加而增加,體積分數100vol%時,儲存(彈性)模量g』超過12kpa。剪切破壞後5分鐘內自癒合效率同樣隨著膠體顆粒體積分數的增加而增加,體積分數100vol%時,彈性模量g』自癒合效率超過80%。
表4.實施例2中製備的a型明膠和海藻酸微凝膠的性能參數
表5.實施例2中製備的自癒合膠體凝膠在不同膠體體積分數情況下的力學強度(流變測試彈性模量g')和自癒合效率。
*註:自修復效率是採用1000%的應變持續你剪切凝膠材料60s後,檢測應力釋放後5min內的彈性模量恢復的百分比(%)。
實施例3
以b型明膠為原料,在加熱40℃下溶解,配置得到濃度為5w/v%的b型明膠水溶液,調節ph值為3,隨後向溶液中加入3倍體積的乙醇,生成b型明膠微凝膠顆粒懸浮液;向懸浮液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛80μl,交聯反應時間12hr,反覆離心並在去離子水中重懸,得到b型明膠微凝膠顆粒,顆粒尺寸和表面zeta點位參數如表6所示。
將殼聚糖季銨鹽溶於去離子水配置濃度為2.5w/v%殼聚糖季銨鹽水溶液。將明膠b微凝膠顆粒分散在20mm的醋酸酸性水溶液中,進一步將殼聚糖季銨鹽水溶液與明膠b微凝膠顆粒分散液充分共混,攪拌,得分散液iii,其中b型明膠微凝膠顆粒與高分子殼聚糖季銨鹽的質量比為10:1,向分散液iii中加入100mm的氫氧化鈉調節ph值至7.0,然後冷凍乾燥,得到b型明膠膠體顆粒和殼聚糖季銨鹽的複合凍乾粉末。將上述凍乾粉末與一定體積的10mm的nacl鹽溶液共混,並快速攪拌混合均勻得到可注射型自癒合膠體凝膠,即本發明所述的止血材料,其中明膠微凝膠顆粒體積分數佔自癒合凝膠體積分數為100vol%。使用流變儀對膠體凝膠的力學參數進行評價,結果如表7所示,帶相反電荷的b型明膠顆粒和殼聚糖季銨鹽共混得到的膠體凝膠在膠體顆粒體積分數為100vol%時,儲存(彈性)模量g』約48kpa。剪切破壞後5分鐘內自癒合效率在膠體顆粒體積分數為100vol%時,彈性模量g』自癒合效率超過89%。
表6.實施例3中製備的b型明膠微凝膠顆粒的性能參數
表7.實施例3中製備的b型明膠微凝膠顆粒和殼聚糖季銨鹽共混製備的自癒合凝膠的力學強度(流變測試彈性模量g')和自癒合效率。
*註:自修復效率是採用1000%的應變持續你剪切凝膠材料60s後,檢測應力釋放後5min內的彈性模量恢復的百分比(%)。
實施例4
以a型明膠為原料,在加熱40℃下溶解,配置得到濃度為10w/v%的a型明膠水溶液,調節ph值為11,隨後向溶液中各加入2倍體積的乙醇,生成a型明膠微凝膠顆粒懸浮液;向懸浮液中加入25wt%戊二醛水溶液,使明膠微凝膠顆粒交聯,加入戊二醛的量為每g明膠對應25wt%戊二醛264μl,交聯反應時間12hr,反覆離心並在去離子水中重懸,得到a型明膠微凝膠顆粒,顆粒尺寸和表面zeta點位參數如表8所示。
將聚乙二醇(peg,分子量2kda)溶於去離子水配置濃度為5w/v%peg水溶液。將上述方法製備的a型明膠微凝膠顆粒分散得到的peg水溶液中,進一步將peg水溶液與a型明膠微凝膠分散液充分共混,攪拌,得分散液iii,其中a型明膠微凝膠顆粒與peg的質量比為1:2。隨後將分散液iii的ph值調節至7.0,然後冷凍乾燥,得到a型明膠膠體顆粒和peg的複合凍乾粉末。將上述凍乾粉末與一定體積的10mm的nacl鹽溶液共混,並快速攪拌混合均勻得到自癒合膠體凝膠,即本發明所述的止血材料,其中明膠微凝膠顆粒體積分數佔自癒合凝膠體積分數為100vol%。使用流變儀對膠體凝膠的力學參數進行評價,結果如表9所示,當膠體凝膠中a型明膠膠體顆粒體積分數為100vol%時,儲存(彈性)模量g』約19kpa。剪切破壞後5分鐘內自癒合效率在膠體顆粒體積分數為100vol%時,彈性模量g』自癒合效率約為83%。
表8.實施例5中製備的a型明膠微凝膠顆粒的性能參數
表9.實施例4中製備的a型明膠微凝膠顆粒和peg共混製備的自癒合凝膠的力學強度(流變測試彈性模量g')和自癒合效率。
*註:自修復效率是採用1000%的應變持續你剪切凝膠材料60s後,檢測應力釋放後5min內的彈性模量恢復的百分比(%)。
實施例5
以a型明膠為原料,在加熱40℃下溶解,配置得到濃度為5w/v%的a型明膠水溶液,調節ph值為11,隨後向溶液中各加入3.5倍體積的乙醇,生成a型明膠微凝膠顆粒懸浮液;隨後加入25wt%戊二醛水溶液交聯明膠微凝膠顆粒,加入戊二醛的量為每g明膠對應25wt%戊二醛66μl,交聯反應時間12hr,離心清洗得到a型明膠微凝膠顆粒,顆粒尺寸和表面zeta點位參數如表10所示。
通過乳液法製備海藻酸微凝膠顆粒,具體製備方法如下:將1wt%的海藻酸鈉的水溶液加入氯化鈣水溶液中並持續高速攪拌(攪拌速度>5000rpm),即得到海藻酸鈣顆粒,顆粒尺寸和表面zeta點位參數如表10所示。
將a型明膠和海藻酸鈣微凝膠顆粒分別分散在10mm的醋酸酸性水溶液中,分別得到帶正電荷的a型明膠微凝膠顆粒的分散液ⅰ、帶負電荷的海藻酸微凝膠顆粒的分散液ⅱ,將分散液ⅰ和分散液ⅱ充分混合、攪拌,得分散液iii,其中a型明膠和海藻酸微凝膠顆粒混合的顆粒數量比為2:1;向分散液iii中加入100mm的氫氧化鈉調節ph值至7.0,攪拌混合,冷凍乾燥,得到混有兩相不同膠體顆粒的複合凍乾粉末。將聚乙二醇(peg,分子量2kda)溶於去離子水配置濃度為5w/v%peg水溶液,與上述複合凍乾粉末共混,並快速攪拌得到自癒合凝膠,即本發明所述的止血材料,其中兩種膠體顆粒體積分數佔膠體凝膠體積的100vol%。使用流變儀考察膠體凝膠的力學參數,結果如表11所示,當膠體顆粒體積分數100vol%時,儲存(彈性)模量g』超過87kpa。剪切破壞後5分鐘內自癒合效率同樣隨著膠體顆粒體積分數的增加而增加,體積分數100vol%時,彈性模量g』自癒合效率超過91%。
表10.實施例5中製備的a型明膠和海藻酸鈣微凝膠的性能參數
表11.實施例5中製備的自癒合膠體凝膠在不同膠體體積分數情況下的力學強度(流變測試彈性模量g')和自癒合效率。
*註:自修復效率是採用1000%的應變持續你剪切凝膠材料60s後,檢測應力釋放後5min內的彈性模量恢復的百分比(%)。
實施例6
以a型明膠為原料,通過實施例1所述反溶劑法製備a型明膠微凝膠顆粒,戊二醛交聯濃度為每g明膠使用25wt%戊二醛的量為66μl,製備得到帶正電荷的a型明膠微凝膠顆粒;以b型明膠為原料,通過實施例1所述的反溶劑法製備b型明膠微凝膠顆粒,其中戊二醛交聯濃度為每g明膠使用25wt%戊二醛的量為264μl,製備得到帶負電荷的b型明膠微凝膠顆粒,製備參數和所得微凝膠顆粒尺寸和zeta點位數據如表12。
表12.實施例6中製備的不同類型明膠微凝膠顆粒的性能參數
將a型明膠顆粒分散在含100ng/ml濃度的鹼性成纖維生長因子(bfgf)的水溶液中,將b型明膠顆粒分散在含100ng/ml濃度的骨形態發生蛋白-2(bmp-2)的水溶液中,分別得到載有bfgf的a型明膠顆粒和載有bmp-2的b型明膠微凝膠顆粒的分散液。將上述兩種明膠顆粒分散液按照顆粒數比1:1充分混合,並冷凍乾燥,得到載有不同生長因子的兩種明膠顆粒凍乾粉末。將上述微凝膠顆粒凍乾粉末與一定體積的1mm的nacl鹽溶液共混,並快速攪拌混合均勻,得到載有不同生長因子的、可注射型自癒合膠體凝膠,其中微凝膠膠體顆粒體積分數佔膠體凝膠體積的100vol%。兩種不同的生長因子從膠體凝膠載體材料中體外釋放動力學的釋放曲線如圖4所示,載有bfgf的a型明膠由於交聯度低降解速率較快,因此bfgf釋放速率較快,載有bmp-2的b型明膠由於交聯度高降解速率慢,因此bmp-2釋放速率較為緩慢;結果表明本發明所述的膠體凝膠可實現不同生長因子藥物的有序釋放。
實施例7
通過實施1中的製備方法得到a型明膠和b型明膠微凝膠顆粒分散液,將兩種明膠顆粒分別分散在20mm的鹽酸水溶液中,分別得到分散有帶正電荷的a型明膠微凝膠顆粒和帶負電荷的b型明膠微凝膠顆粒的分散液,將兩者充分混合、攪拌,得分散有兩種不同微凝膠顆粒的分散液,其中a型明膠和b型明膠混合的顆粒數量比為1:1;向分散液中加入100mm的氫氧化鈉調節ph值至7.0,攪拌混合,冷凍乾燥,得到含有兩種不同明膠膠體顆粒的凍乾粉末。將上述混合物凍乾粉末與磷酸緩衝溶液pbs共混,並快速攪拌混合均勻得到可注射型自癒合膠體凝膠,即本發明所述的止血材料,其中兩種膠體顆粒體積分數佔膠體凝膠體積的100vol%。以紐西蘭兔背部脊柱骨缺損出血創面為動物實驗模型,製造2.5-4mm的出血創口,將明膠基止血凝膠通過普通醫用注射器直接注射在出血創面,輕輕壓迫1min後出血點被封閉,止血時間為1min。動物實驗的過程如圖5所示。
