一種代代花萼多酚及製備方法與在製備抗炎藥物中的應用與流程
2023-07-19 09:58:56 3
本發明屬於中藥領域,具體涉及一種代代花萼多酚及製備方法與在製備抗炎藥物中的應用。
背景技術:
茶多酚又叫茶單寧,茶鞣質,是茶葉中酚類及其衍生物的總稱,約佔茶葉乾物質總質量的25%,主要是兒茶素類、黃酮類、花青素和酚酸四類物質,其中兒茶素類的含量佔80%左右。兒茶素中的主要成分有四種:表兒茶素(EC)、表沒食子兒茶素(EGC)、表兒茶素沒食子酸酯(ECG)、表沒食子兒茶素沒食子酸酯(EGCG)。現代科學研究表明,茶葉中的生理活性物質主要為茶多酚,它具有優異的抗氧化性能和顯著的清除自由基能力。
目前最有前途的替代經典抗生素治療的抗炎方法之一是使用能增強宿主防禦反應的免疫調節劑。現已知的多種免疫調節劑,包括哺乳動物蛋白,如:γ-幹擾素、粒細胞集落刺激因子和粒細胞-巨噬細胞集落刺激因子及從微生物分離純化的物質。對於免疫細菌多糖和人工合成的化合物來說,其不良反應和副作用已引起人們廣泛注意。大多數植物多酚均為無不良反應的物質,不會對機體產生較大的副作用。隨著人們對這一特性研究的不斷深入,茶多酚在醫療保健、食品、化工、油脂等行業具有廣泛的發展空間,尤其是在日本,美國。雖然我國茶葉資源豐富,但對於茶葉中茶多酚的提取技術及茶多酚在醫藥中的應用還處於研究開發階段。
代代(Citrus aurantium L.var.amara Engl)是芸香科柑橘屬植物酸橙的一個變種,代代花是其花蕾的幹品,具有良好的藥理作用,常用於治療氣鬱不舒、脘腹脹痛、積食不化、噁心嘔吐等。目前國內外對代代花的研究主要以其揮髮油類化合物為主,而對代代花多酚抗炎的研究報導幾乎沒有。代代花作為藥食兩用價值的天然保健品,其多酚的提取純化和藥理活性等方面的研究還有待進一步深入探討,全面加強代代花的生物利用,對於開發新藥、指導臨床用藥具有重要的意義。
技術實現要素:
為了克服現有技術的不足和缺點,本發明的首要目的在於提供一種代代花萼多酚的製備方法。
本發明的另一目的在於提供上述製備方法製備得到的代代花萼多酚。
本發明的再一目的在於提供上述代代花萼多酚在製備抗炎藥物中的應用。
本發明的目的通過下述方案實現:
一種代代花萼多酚的製備方法,包含如下步驟:
將代代花萼粗粉加入溶劑中,加熱提取,離心,取上清液,去除溶劑,得到代代花萼多酚;所述溶劑為水、乙醇水溶液或甲醇水溶液。
以蒸餾水做為溶劑提取到的代代花萼多酚記為CAVP-W,以乙醇做為溶劑提取到的代代花萼多酚記為CAVP-E,以甲醇做為溶劑提取到的代代花萼多酚記為CAVP-M。
所述乙醇水溶液的體積分數為40~60%;優選為50%。
所述甲醇水溶液的體積分數為40~60%;優選為50%。
所述溶劑與代代花萼粗粉的體積質量比為(10~30)mL:1g;
所述溶劑與代代花萼粗粉的體積質量比優選為20:1;
所述加熱提取的溫度為80~100℃;優選為90℃;所述加熱提取的時間為1~3h;優選為1h。
所述離心的轉速為3000~5000r/min;優選為4000r/min。
所述離心的時間為8~12min;優選為10min。
所述去除溶劑的方式優選為減壓濃縮和乾燥;所述減壓濃縮的溫度為40~60℃,乾燥的溫度為40~60℃,乾燥的時間為18~24h。
所述代代花萼粗粉是將代代花萼(Citrus aurantium L.var.amara Engl)乾燥,粉碎,過篩,得到。
所述乾燥溫度為40~60℃;所述乾燥時間為18~24h;所述粉碎過篩為50~60目篩。
一種代代花萼多酚(代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)),通過上述製備方法製備得到。
所述代代花萼多酚(代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M))在製備抗炎藥物中的應用;
所述的代代花萼多酚可作為新型的抗炎藥物,應用於炎症的治療。
一種抗炎藥物,含有上述代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)中的至少一種。
本發明的原理:植物來源的多酚能通過調節巨噬細胞的免疫功能體現出各種有益的藥理作用。本發明發現和確證植物多酚具有顯著的抗炎活性,且植物多酚的使用劑量低,在同樣劑量下的毒副作用也較低。
本發明相對於現有技術具有如下的優點及效果:
(1)本發明首次發現代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)在體外能顯著抑制LPS誘導的RAW264.7巨噬細胞NO的釋放。
(2)本發明首次發現代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)在體外能顯著抑制LPS誘導的RAW264.7巨噬細胞iNOS、IL-6、TNF-α、IL-1β、和COX-2mRNA的表達。
(3)本發明首次發現代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)在體外能顯著抑制LPS誘導的RAW264.7巨噬細胞p-ERK、p-JNK、p-p38、p-p65和COX-2蛋白的表達。
(4)代代花萼多酚(CAVP-W),代代花萼多酚(CAVP-E)或代代花萼多酚(CAVP-M)的用藥劑量比較低,而且在有效用藥劑量範圍內毒性較低。
附圖說明
圖1是實施例1製備得到的代代花萼多酚(CAVP-W)、實施例4製備的代代花萼多酚(CAVP-E)和實施例7製備的代代花萼多酚(CAVP-M)對RAW264.7巨噬細胞的毒性作用圖;
圖2是實施例1製備得到的代代花萼多酚(CAVP-W)、實施例4製備的代代花萼多酚(CAVP-E)和實施例7製備的代代花萼多酚(CAVP-M)對LPS誘導的RAW264.7巨噬細胞釋放NO的影響圖;
圖3是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞形態的影響圖;
圖4是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞iNOS mRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01;
圖5是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞IL-6mRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01。
圖6是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞TNF-αmRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01;
圖7是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞IL-1βmRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01;
圖8是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞COX-2mRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01;
圖9是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化ERK(p-ERK)蛋白水平影響的結果分析圖,其中圖A為p-ERK蛋白表達曝光圖,圖B為p-ERK蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01;
圖10是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化JNK(p-JNK)蛋白水平影響的結果分析圖,其中圖A為p-JNK蛋白表達曝光圖,圖B為p-JNK蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01;
圖11是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化P38(p-P38)蛋白水平影響的結果分析圖,其中圖A為p-P38蛋白表達曝光圖,圖B為p-P38蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01;
圖12是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化P65(p-P65)蛋白水平影響的結果分析圖,其中圖A為p-P65蛋白表達曝光圖,圖B為p-P65蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01;
圖13是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞COX-2蛋白水平影響的結果分析圖,其中圖A為COX-2蛋白表達曝光圖,圖B為COX-2蛋白相對表達量。其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01。
具體實施方式
下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限於此。
實施例中,小鼠巨噬細胞RAW 264.7購自中科院上海生命科學研究院細胞資源中心;代代花萼購自廣州清平藥材市場。
實施例1從代代花萼中製備得到代代花萼多酚(CAVP-W)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中50℃乾燥24h,用粉碎機粉碎後,過60目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入100mL蒸餾水,充分震蕩搖勻,水浴鍋90℃加熱1h;加熱結束後,離心機4000r/min下離心10min,取上層澄清液,將上清液用旋轉蒸發儀在50℃下減壓濃縮,50℃真空乾燥至恆重即得代代花萼粗多酚(CAVP-W)。
實施例2從代代花萼中製備得到代代花萼多酚(CAVP-W)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中40℃乾燥20h,用粉碎機粉碎後,過50目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入50mL蒸餾水,充分震蕩搖勻,水浴鍋80℃加熱2h;加熱結束後,離心機3000r/min下離心8min,取上層澄清液,將上清液用旋轉蒸發儀在55℃下減壓濃縮,40℃真空乾燥至恆重即得代代花萼粗多酚(CAVP-W)。
實施例3從代代花萼中製備得到代代花萼多酚(CAVP-W)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中60℃乾燥18h,用粉碎機粉碎後,過40目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入150mL蒸餾水,充分震蕩搖勻,水浴鍋100℃加熱3h;加熱結束後,離心機5000r/min下離心12min,取上層澄清液,將上清液用旋轉蒸發儀在60℃下減壓濃縮,60℃真空乾燥至恆重即得代代花萼粗多酚(CAVP-W)。
實施例4從代代花萼中製備得到代代花萼多酚(CAVP-E)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中50℃乾燥24h,用粉碎機粉碎後,過60目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入100mL的50%乙醇溶液,充分震蕩搖勻,水浴鍋90℃加熱1h;加熱結束後,離心機4000r/min下離心10min,取上層澄清液,將上清液用旋轉蒸發儀在50℃下減壓濃縮,45℃真空乾燥至恆重,即得代代花萼粗多酚(CAVP-E)。
實施例5從代代花萼中製備得到代代花萼多酚(CAVP-E)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中40℃乾燥20h,用粉碎機粉碎後,過50目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入50mL的40%乙醇溶液,充分震蕩搖勻,水浴鍋80℃加熱2h;加熱結束後,離心機3000r/min下離心8min,取上層澄清液,將上清液用旋轉蒸發儀在55℃下減壓濃縮,50℃真空乾燥至恆重即得代代花萼粗多酚(CAVP-E)。
實施例6從代代花萼中製備得到代代花萼多酚(CAVP-E)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中60℃乾燥18h,用粉碎機粉碎後,過40目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入150mL的60%乙醇溶液,充分震蕩搖勻,水浴鍋100℃加熱3h;加熱結束後,離心機5000r/min下離心12min,取上層澄清液,將上清液用旋轉蒸發儀在60℃下減壓濃縮,60℃真空乾燥至恆重即得代代花萼粗多酚(CAVP-E)。
實施例7從代代花萼中製備得到代代花萼多酚(CAVP-M)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中50℃乾燥24h,用粉碎機粉碎後,過60目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入100mL的50%甲醇溶液,充分震蕩搖勻,水浴鍋90℃加熱1h;加熱結束後,離心機4000r/min下離心10min,取上層澄清液,將上清液用旋轉蒸發儀在50℃下減壓濃縮,45℃真空乾燥至恆重即得代代花萼粗多酚(CAVP-M)。
實施例8從代代花萼中製備得到代代花萼多酚(CAVP-M)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中40℃乾燥20h,用粉碎機粉碎後,過50目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入50mL的40%甲醇溶液,充分震蕩搖勻,水浴鍋80℃加熱2h。加熱結束後,離心機3000r/min下離心8min,取上層澄清液,將上清液用旋轉蒸發儀在55℃下減壓濃縮,50℃真空乾燥至恆重,即得代代花萼粗多酚(CAVP-M)。
實施例9從代代花萼中製備得到代代花萼多酚(CAVP-M)
(1)將代代花萼(Citrus aurantium L.var.amara Engl)置於電熱鼓風乾燥箱中60℃乾燥18h,用粉碎機粉碎後,過40目篩,得代代花萼粗粉備用;
(2)稱量代代花萼粗粉5.0g於錐形瓶中,加入150mL的60%甲醇溶液,充分震蕩搖勻,水浴鍋100℃加熱3h;加熱結束後,離心機5000r/min下離心12min,取上層澄清液,將上清液用旋轉蒸發儀在60℃下減壓濃縮,55℃真空乾燥至恆重,即得代代花萼粗多酚(CAVP-M)。
實施例10 MTT法檢測代代花萼多酚(CAVP-W)、代代花萼多酚(CAVP-E)和代代花萼多酚(CAVP-M)對RAW264.7細胞毒性的影響
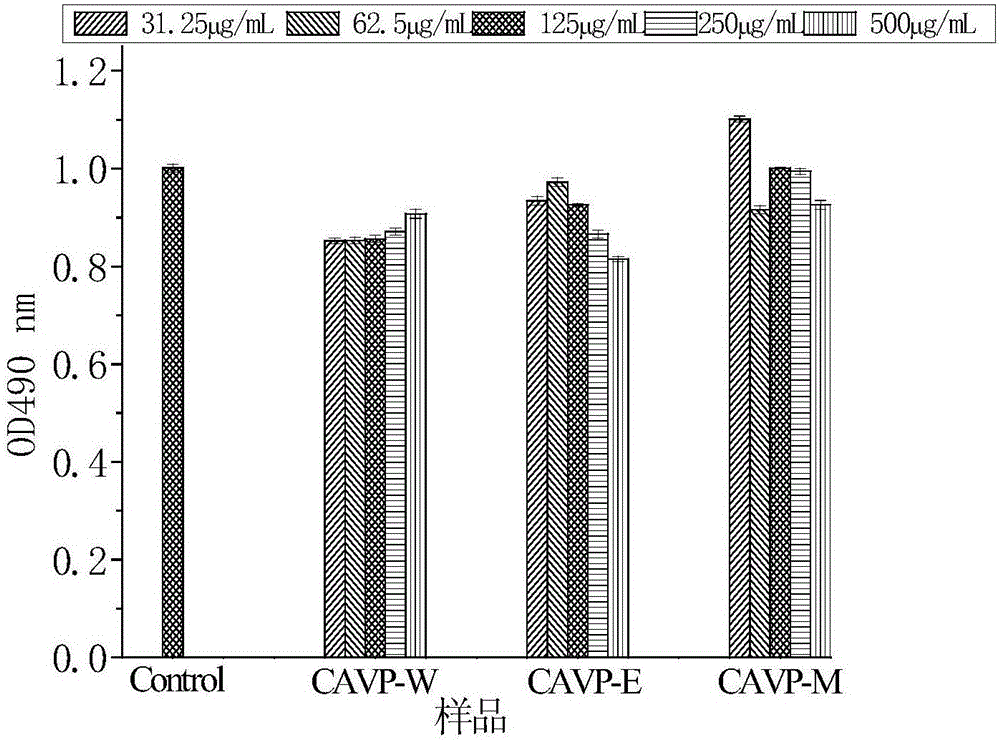
分別取生長對數期的小鼠巨噬細胞RAW264.7,1000rpm離心5min,棄去上清液,用含質量分數為10%胎牛血清的DMEM培養基調整細胞數為3×105/mL,100μL接種於96孔培養板中,置於5%CO2培養箱中,37℃培養24h後,棄去上清液,各組分別加入含有CAVP-W(實施例1製得)、CAVP-E(實施例4製得)、CAVO-M(實施例7製得)的DMEM培養基(CAVO-W、CAVO-E和CAVO-M的終濃度分別為31.25μg/mL、62.5μg/mL、125μg/mL、250和500μg/mL)。在37℃、5%CO2培養箱中培養24h,棄去上清液,PBS清洗兩次,每孔加入200μL不含血清的DMEM基礎培養基和20μL噻唑藍(MTT),放入培養箱中繼續孵育4h,棄上清液,每孔加入150μL二甲基亞碸(DMSO),避光放置於微量振蕩器均勻震蕩10min,用酶標儀測量在490nm波長下的OD值,計算細胞增殖抑制率。圖1是實施例1製備得到的代代花萼多酚(CAVP-W)、實施例4製備的代代花萼多酚(CAVP-E)和實施例7製備的代代花萼多酚(CAVP-M)對RAW264.7巨噬細胞的毒性作用圖。
在CAVO-W、CAVO-E和CAVO-M濃度為31.25~500μg/mL範圍內,三種代代花萼多酚作用於RAW264.7細胞24h,對RAW264.7細胞的生長均沒有毒性作用(圖1)。因此後續的實驗中,CAVO-W、CAVO-E和CAVO-M的濃度設定為500、250、125、62.5、31.25和16.13μg/mL。
實施例11 Griess法檢測CAVO-W、CAVO-E和CAVO-M對RAW264.7細胞釋放NO的影響
常規培養細胞,取對數生長期的RAW264.7細胞,吹打細胞成單細胞懸液,顯微鏡下用血細胞計數板計數後,1000rpm,離心5min去上清,培養基重懸並調整細胞濃度,按20萬個/孔的細胞密度接種於24孔培養板,置於37℃,5%CO2培養箱培養,貼壁24h,吸棄上清,按如下分組要求給藥,每組設3個復孔:Control組,脂多糖(LPS,終濃度為1μg/mL)組,LPS(終濃度為1μg/mL)+地塞米松(DXM,終濃度為50μg/mL)組,LPS(終濃度為1μg/mL)+CAVP-W(實施例1製備得到的代代花萼多酚,終濃度為16.13、31.25、62.5、125、250和500μg/mL)組,LPS(終濃度為1μg/mL)+CAVO-E(實施例4製備得到的代代花萼多酚,終濃度為16.13、31.25、62.5、125、250和500μg/mL)組,LPS(終濃度為1μg/mL)+CAVO-M(實施例7製備得到的代代花萼多酚,終濃度為16.13、31.25、62.5、125、250和500μg/mL)組,對照組添加同體積的培養基。給藥後,置於37℃,5%CO2培養箱,繼續培養24h。分別取各孔細胞上清100μL,相應加入另一新的96孔板中。每孔加50μL Griess試劑A,置於37℃培養箱中反應10min,每孔再加50μL Griess試劑B,置於37℃培養箱中反應10min,立即置板於多標記微孔板檢測儀上,在550nm波長下檢測各孔吸光度值。圖2是實施例1製備得到的代代花萼多酚(CAVP-W)、實施例4製備的代代花萼多酚(CAVP-E)和實施例7製備的代代花萼多酚(CAVP-M)對LPS誘導的RAW264.7巨噬細胞釋放NO的影響圖。
CAVO-W、CAVO-E和CAVO-M能夠抑制LPS誘導的RAW264.7巨噬細胞NO的釋放(圖2)。當濃度為500μg/mL時,CAVO-W對LPS誘導的RAW264.7巨噬細胞NO的抑制率顯著高於CAVO-E和CAVO-M(P<0.01),因此在後續的實驗中選擇CAVO-W進行深入研究。
實施例12代代花萼多酚CAVO-W對LPS誘導的RAW264.7細胞影響的電子顯微鏡觀察
常規培養細胞,取對數生長期的RAW264.7細胞,吹打細胞成單細胞懸液,顯微鏡下用血細胞計數板計數後,1000rpm,離心5min去上清,培養基重懸並調整細胞濃度,按20萬個/孔的細胞密度接種於24孔培養板,置於37℃,5%CO2培養箱培養,貼壁24h,吸棄上清,按如下分組要求給藥,每組設3個復孔:Control組,脂多糖(LPS,終濃度為1μg/mL)組,LPS(終濃度為1μg/mL)+地塞米松(DXM,終濃度為50μg/mL)組,LPS(終濃度為1μg/mL)+CAVP-W(實施例1製備得到的CAVP-W,終濃度為62.5、125、250和500μg/mL)組,對照組添加同體積的DMEM基礎培養基。給藥後,置於37℃,5%CO2培養箱,繼續培養24h。然後取出細胞在電子顯微鏡下拍照。圖3是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞形態的影響圖。
RAW264.7細胞經LPS誘導後,隨著作用時間的改變,細胞形態發生改變,control組細胞呈圓形,邊界清晰,貼壁良好,給予LPS誘導後,隨著時間的延長,RAW264.7細胞形態學的改變逐漸明顯,出現體積變大,呈不規則圓形、橢圓形、伸出偽足,邊界不規則,部分細胞內呈明顯泡沫化(圖3)。經不同濃度的代代花萼多酚CAVP-W治療後,細胞形態改變緩慢,趨於正常(圖3)。
實施例13代代花萼多酚CAVO-W對LPS誘導的RAW264.7細胞iNOS、IL-6、TNF-α、IL-1β和COX-2mRNA表達的影響
常規培養細胞,取對生長數期的RAW264.7細胞,按100萬/孔細胞數接種於6孔板,孵育24h後,吸棄上清,按如下分組要求給藥,每組設3個復孔。Control組,脂多糖(LPS,終濃度為1μg/mL)組,LPS(終濃度為1μg/mL)+地塞米松(DXM,終濃度為50μg/mL)組,LPS(終濃度為1μg/mL)+CAVP-W(實施例1製備得到的代代花萼多酚CAVP-W,終濃度為62.5、125、250和500μg/mL)組,對照組添加同體積的培養基。給藥後,置於37℃,5%CO2培養箱,繼續培養12h。作用12h後,吸棄細胞上清,PBS洗2次。每孔加入Trizol 1mL,靜置5min,吸管吹打至液體無粘稠物,吸取細胞裂解液轉入EP管,每管加入0.2mL氯仿,蓋上EP管蓋,手持用力上下震蕩10s,室溫靜置5min,4℃以12,000rpm離心15min,離心後轉移上層水相至另一EP管中,加入0.5mL異丙醇,室溫靜置10min,4℃離心機以12,000rpm離心10min,小心吸棄去上清,用冷體積分數75%的乙醇1mL清洗2次,分別4℃條件下以7,500rpm離心5min,小心吸棄上清,空氣吹乾,約15min,加入0~50μL RNase-free純水,60℃加熱10min溶解沉澱。測定mRNA的純度和濃度。並用RevertAid First Strand cnthesis Kit(Thermo公司)反轉錄試劑盒,20μL反應體系,對RNA進行逆轉錄。採用DyNAmo Flash SYRB Green qPCR Kit(Thermo公司)試劑盒,ABI實時螢光定量PCR儀(Rrism 7500,Applied Biosystems,Foster City,CA,USA)對mRNA進行擴增,擴增後用ABI PRISM7500SDS軟體中Relative Quantification(ddCt)Study法進行自動分析以獲得目的基因的相對表達量。相關基因mRNA引物序列為iNOS(forward,5′-CGG CAA ACA TGA CTT CAG GC-3′,reverse,5′-GCA CAT CAA AGC GGC CAT AG-3′),IL-6(forward,5′-GTA CTC CAG AAG ACC AGA GG-3′,reverse,5′-TGC TGG TGA CAA CCA CGG CC-3′),TNF-α(forward,5′-GGG GAT TAT GGC TCA GGG TC-3′,reverse,5′-CGA GGC TCC AGT GAA TTC GG-3′),IL-1β(forward,5′-CCA TGG AAT CCG TGT CTT CCT-3′,reverse,5′-GTC TTG GCC GAG GAC TAA GG-3′),COX-2(forward,5′-CAG CAA ATC CTT GCT GTT CC-3′,reverse,5′-TGG GCA AAG AAT GCA AAC ATC-3′)和GAPDH(forward,5′-CAC TCA CGG CAA ATT CAA CGG CAC-3′,reverse,5′-GAC TCC ACG ACA TAC TCA GCA-3′)。
圖4是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞iNOS mRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01。圖5是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞IL-6mRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01。圖6是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞TNF-αmRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01。圖7是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞IL-1βmRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01。圖8是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞COX-2mRNA表達的影響圖;其中,##:與control組比較,P<0.01;**:與LPS組比較,P<0.01。
與control組相比,LPS組分泌的iNOS、IL-6、IL-1β和COX-2顯著增加(P<0.01),表明LPS誘導RAW264.7巨噬細胞釋放NO的炎症模型成立。代代花萼多酚CAVP-W可以抑制iNOS mRNA(圖4)、IL-6mRNA(圖5)、TNF-αmRNA(圖6)、IL-1βmRNA(圖7)和COX-2mRNA(圖8)的分泌(P<0.05)。
實施例14代代花萼多酚CAVO-W對LPS誘導的RAW264.7細胞相關蛋白水平的影響
常規培養細胞,取對生長數期的RAW264.7細胞,按100萬/孔細胞數接種於6孔板,孵育24h後,吸棄上清,按如下分組要求給藥,每組設3個復孔。Control組,脂多糖(LPS,終濃度為1μg/mL)組,LPS(終濃度為1μg/mL)+地塞米松(DXM,終濃度為50μg/mL)組,LPS(終濃度為1μg/mL)+CAVP-W(實施例1製備得到的代代花萼多酚CAVP-W,終濃度為125、250和500μg/mL)組,對照組添加同體積的培養基。其中,LPS+CAVP-W組採用CAVO-II預先刺激2h後,再加脂多糖(LPS+地塞米松組同樣處理),置於37℃,5%CO2培養箱,繼續培養12h。作用2h後,吸棄細胞上清,並且用預冷的PBS清洗兩次,收集細胞至1.5mL離心管中,加入60μL的PIPA裂解液(含磷酸酶抑制劑(PhosSTOP,Roche)和蛋白酶抑制劑(cOmplete ULTRA Tablets,Mini,EDTA-free,EASYpack,Roche)),用1mL的注射器吸取裂解液反覆吹打細胞至充分混勻,於冰上放置30min,每隔10min於渦旋振蕩器上振蕩30s。以12000rpm離心15min,將上清轉移至新的1.5mLEP管,置於冰上待測定蛋白濃度。採用BCA法檢測蛋白濃度(按照BCA Protein Assay Kit說明書進行):先將濃度為2mg/mL的BSA溶液予超純去離子水稀釋為系列質量濃度(0μg/mL、25μg/mL、125μg/mL、250μg/mL、500μg/mL、1000μg/mL)的標準品溶液,再根據需要配置一定量的工作液(BCA Solution:4%(體積分數)Cupric Sulfate=200:4)。取一塊無底物的96孔板,每孔分別加入已稀釋好的系列標準品溶液25μL,以及需要檢測的蛋白溶液25μL(已稀釋5倍),每組均設置復孔。同時加入200μL/孔工作液,輕輕震蕩混勻,置於37℃孵育30min後,取出,於多標記微孔板檢測儀570nm處檢測OD值。根據標準品蛋白溶液所測OD值繪製標準曲線,計算出待測蛋白溶液濃度。根據BCA法測得的蛋白濃度,計算出40μg總蛋白所需蛋白體積,同時加5μL 5×SDS-PAGE上樣緩衝液,再補充相應體積的超純去離子水至總體積為25μL,混勻,充分離心,使液體聚集在底部,100℃加熱變性10min,離心,置於冰上備用。選擇10%(體積分數)分離膠和5%(體積分數)濃縮膠,將已變性好的蛋白樣品依次加入各泳道,樣品兩側的泳道分別加入5μL Marker。電泳槽中加入足夠量的TGS緩衝液,電泳條件為:100V,約150min,直至溴酚藍指示劑跑至距膠下緣約0.5cm時,停止電泳。然後在冰浴中以100V的電壓轉膜100min。用含5%(質量分數)脫脂奶粉的TBST封閉,緩慢搖蕩1h。一抗抗體分別為:GAPDH(14c10)Rabbit mAb、p-ERK、p-JNK、p-P38、p-P65和COX-2(均購自CST公司),二抗抗體為山羊抗兔(HRP標記),購自聚研生物科技有限公司。按照說明書推薦的稀釋比例(1:1000),配製一抗,室溫下輕搖孵育4h或4℃靜置過夜。一抗孵育結束後,更換二抗,HRP標記的二抗按相應比例稀釋(1:2000),室溫輕搖1h。二抗結束後,加入發光液(購自BioFuture公司)並利用凝膠成像儀蛋白條帶顯影。
圖9是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化ERK(p-ERK)蛋白水平影響的結果分析圖,其中圖A為p-ERK蛋白表達曝光圖,圖B為p-ERK蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01。圖10是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化JNK(p-JNK)蛋白水平影響的結果分析圖,其中圖A為p-JNK蛋白表達曝光圖,圖B為p-JNK蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01。圖11是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化P38(p-P38)蛋白水平影響的結果分析圖,其中圖A為p-P38蛋白表達曝光圖,圖B為p-P38蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01。圖12是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞磷酸化P65(p-P65)蛋白水平影響的結果分析圖,其中圖A為p-P65蛋白表達曝光圖,圖B為p-P65蛋白相對表達量;其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01。圖13是實施例1製備得到的代代花萼多酚(CAVP-W)對LPS誘導的RAW264.7巨噬細胞COX-2蛋白水平影響的結果分析圖,其中圖A為COX-2蛋白表達曝光圖,圖B為COX-2蛋白相對表達量。其中,##:與control組比較,P<0.01,**:與LPS組比較,P<0.01。
正常組RAW264.7巨噬細胞內磷酸化的ERK、JNK、P38、P65和COX-2蛋白表達較低,當1μg/mL的LPS作用細胞12h,細胞內磷酸化的ERK、JNK、P38、P65和COX-2蛋白表達顯著上調(P<0.01),從而激活MAPK和NF-κB信號通路(圖9~12)。代代花萼多酚(CAVP-W)可以顯著下調p-ERK(圖9)p-JNK(圖10)、p-P38(圖11)、p-P65(圖12)和COX-2(圖13)蛋白表達。
上述實施例為本發明較佳的實施方式,但本發明的實施方式並不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護範圍之內。
SEQUENCE LISTING
華南理工大學
一種代代花萼多酚及製備方法與在製備抗炎藥物中的應用
1
12
PatentIn version 3.5
1
20
DNA
Artificial Sequence
iNOS的forward
1
cggcaaacat gacttcaggc 20
2
20
DNA
Artificial Sequence
iNOS的reverse
2
gcacatcaaa gcggccatag 20
3
20
DNA
Artificial Sequence
IL-6的forward
3
gtactccaga agaccagagg 20
4
20
DNA
Artificial Sequence
IL-6的reverse
4
tgctggtgac aaccacggcc 20
5
20
DNA
Artificial Sequence
TNF-α的forward
5
ggggattatg gctcagggtc 20
6
20
DNA
Artificial Sequence
TNF-α的 reverse
6
cgaggctcca gtgaattcgg 20
7
21
DNA
Artificial Sequence
IL-1β的forward
7
ccatggaatc cgtgtcttcc t 21
8
20
DNA
Artificial Sequence
IL-1β的reverse
8
gtcttggccg aggactaagg 20
9
20
DNA
Artificial Sequence
COX-2的forward
9
cagcaaatcc ttgctgttcc 20
10
21
DNA
Artificial Sequence
COX-2的reverse
10
tgggcaaaga atgcaaacat c 21
11
24
DNA
Artificial Sequence
GAPDH的forward
11
cactcacggc aaattcaacg gcac 24
12
21
DNA
Artificial Sequence
GAPDH的reverse
12
gactccacga catactcagc a 21
