一種用大蒜花序軸進行脫毒快繁的方法及應用與流程
2023-07-27 16:30:56 3
技術領域
本發明屬於農業生物工程技術領域,涉及大蒜組織培養與快繁的方法,更具體的說是構建一種用大蒜花序軸進行脫毒快繁的新方法。
背景技術:
大蒜(Allium sativum L.)是百合科蔥屬一年生植物,大蒜栽培品種多不能形成種子,通常採用無性繁殖。這就使大蒜的生物多樣性和遺傳特性受到限制,造成嚴重的種性退化,嚴重影響大蒜的產量和品質。長期無性繁殖還導致大蒜病毒的不斷積累,嚴重影響大蒜植株的生長及鱗莖的商品價值。當前,植物組織培養、人工誘變、基因工程以及大蒜多倍體育種等技術的應用,很大程度上提升了大蒜優良品種的選育工作。其中植物組織培養技術作為一種有效的脫毒快繁技術,已成大蒜育種研究熱點。
在大蒜的植物組織培養研究中,大蒜的不同外植體如,莖尖、根尖、幼嫩的葉子、貯藏葉、葉原基 、未成熟的花序軸、鱗莖以及氣生鱗莖等都已被應用於組織培養中用於誘導與再生。不定芽增殖途徑是直接誘導外植體內潛伏的不定芽萌發,具有遺傳性狀穩定,突變率低,再生時間較短等優勢。目前,大蒜不定芽增殖方式多選用莖尖和莖盤(等為外植體,其繁殖係數平均在3到7 之間。花序軸是大蒜的生殖器官,處在生長頂端,病毒含量較低,其自然脫毒效果可以達到77.6%;花苞基部花盤有很高的誘導不定芽的潛力,王秀芝等以大蒜花序軸為外植體,誘導不定芽,每個花序軸不定芽總數可以達到19.2個。可見大蒜花序軸可以作為大蒜脫毒快繁的重要外植體。
然而,許多研究者雖然獲得了較多的不定芽,但脫毒種蒜高效培養成功的相關報導較為少見。因為高頻率試管苗的誘導僅僅是脫毒種蒜生產的限速條件之一,如何保證這些試管苗生根、移栽成活進而獲得脫毒種蒜是另一個重要條件。許多研究者採用離體培養技術從愈傷組織中獲得了大量再生植株,但在誘導生根和移栽環節上損失大量植株,降低了繁殖效率,並且耗時耗力,在應用方面受到限制。有研究者通過優化大蒜再生植株的移植條件,提高其存活率,但植株馴化困難,效果不甚理想。熊正琴等將試管苗誘導形成試管鱗莖,其移栽成活率能明顯提高。此外,試管鱗莖便於儲存、方便運輸、具有更強抗逆性以及無需馴化的優點,誘導成試管鱗莖的方式更加適用於大蒜組織培養。而且有研究表明,試管鱗莖與普通大蒜蒜瓣種植相似,經過其休眠期,便可以直接種植並正常生長。
本發明以寶坻大蒜「六瓣紅」的花序軸作為外植體,通過優化激素種類及濃度配比,獲得高效誘導不定芽培養基,結合誘導試管鱗莖、改進栽培途徑,構建了從外植體到脫毒種蒜生產的完整方法,該體系為大蒜脫毒、快繁、保持優良遺傳穩定性、提高鱗莖產量及品質等提供了重要的技術依據。
技術實現要素:
本發明的目的在於公開了一種用大蒜花序軸進行脫毒快繁的方法,它是按如下的步驟進行:
(1)花序軸誘導不定芽:選擇寶坻大蒜「六瓣紅」,大蒜進入生殖生長期時,其花莖:假莖=1-1.2時,採摘大蒜的花序軸並於4℃中保存兩周。將經低溫儲存兩周後的花序軸置於自來水下衝洗30 min,0.1% HgCl2 消毒20 min,蒸餾水衝洗3-4次,再用75%的酒精消毒10 min,蒸餾水衝洗3-4次。剝下外層苞葉及表面退化的花原基殘留物和膜質苞片,並去除花莖部分,將花序軸接入不定芽誘導培養基中,每瓶接入2個花序軸。誘導不定芽的培養基為: MS+2.0 mg L-1 KT+0.1 mg L-1 NAA+ 30.0 g· L-1 蔗糖+7.5 g ·L-1 瓊脂,pH=6.2。每個花序軸誘導的不定芽數可以達到11個;不定芽誘導試管鱗莖的誘導率均在90%以上,最高可達到98.78%,而每個花序軸誘導的試管鱗莖數最高可達到10.64個,其繁殖係數相對於鱗莖直接種植高了2倍多;
(2)不定芽誘導試管鱗莖:花序軸生長六周後,形成的不定芽高度達到3-5cm時,將其接入誘導培養基中誘導試管鱗莖,所述的誘導培養基指的是試管鱗莖誘導培養基:MS+120 g· L-1綿白糖+6.8 g· L-1瓊脂,pH=7.5,其詳細的方法是:當花序軸誘導的不定芽生長六周後,形成的不定芽高度達到3-5cm時,將其接入另試管鱗莖誘導培養基中誘導試管鱗莖;
(3)試管鱗莖的收穫與儲藏:不定芽在誘導試管鱗莖的培養基中誘導六周後,試管鱗莖成熟,將其取出並洗去培養基,在避光處晾乾,晾乾後,在4℃下保存3周後種植。
(4)再生植株和再生鱗莖的獲得:試管鱗莖度過休眠期後,於10月底種植,覆膜。第二年5月份,揭開薄膜,並進行除草,澆水以及鬆土工作。在6月下旬,組培大蒜成熟並收穫;
(5)組培大蒜病毒檢測和染色體檢測: 利用酶聯免疫技術和根尖細胞染色體製片技術分別檢測組培大蒜脫毒效果和染色體變異情況,組培大蒜達到部分脫毒效果,未觀察到染色體異常現象。
本發明所述的NAA是 a-萘乙酸(1-naphthlcetic acid),簡稱NAA ; KT是激動素(Kinetin),簡稱KT;所述的MS基本培養基配方:
每1L基本培養基中含有:KNO3 1900mg,NH4NO3 1650mg, MgSO4∙7H2O 370 mg, KH2PO4 170 mg, CaCl2∙2H2O 440 mg, MnSO4∙4H2O 22.3 mg, ZnSO4∙7H2O 8.6 mg, H3BO3 6.2 mg, KI 0.83 mg, Na2MO3∙2H2O 0.25 mg, CuSO4∙5H2O 0.025 mg, CoCl2∙6H2O 0.025 mg, Na2-EDTA 37.7 mg, FeSO4∙7H2O 27.8 mg, 甘氨酸2.0 mg, 鹽酸硫胺素0.4 mg, 鹽酸吡哆素0.5 mg, 煙酸0.5 mg, 肌醇100 mg。
本發明進一步公開了用大蒜花序軸進行脫毒快繁方法在提高大蒜脫毒快繁效率方面的應用,實驗結果顯示:本發明的方法是有效的,能夠縮短大蒜制種時間,增大繁殖係數,由於不經過脫分化和再分化過程,可以最大限度保證了優良大蒜品種的遺傳穩定性。
本發明以大蒜花序軸為外植體,構建了從外植體選擇、花序軸不定芽誘導、不定芽誘導試管鱗莖、試管鱗莖打破休眠、大田栽培種植、脫毒效果檢測、遺傳穩定性檢測、直到脫毒種蒜獲得的完整的方法。
下面本發明以典型的天津市寶坻大蒜快繁為代表,更加具體的說明實施方案:
1、花序軸誘導不定芽最佳培養基篩選:本發明所用的大蒜為寶坻大蒜「六瓣紅」,材料來自於天津師範大學生物科技園中。選擇於第一年10月底種植的寶坻大蒜「六瓣紅」,大蒜進入生殖生長期時,其花莖:假莖=1-1.2時,採摘大蒜的花序軸並於4℃中保存兩周。將經低溫儲存兩周後的花序軸置於自來水下衝洗30 min,0.1% HgCl2 消毒20 min,蒸餾水衝洗3-4次,再用75%的酒精消毒10 min,蒸餾水衝洗3-4次。剝下外層苞葉及表面退化的花原基殘留物和膜質苞片,並去除花莖部分,將花序軸接入篩選培養基中,每瓶接入2個花序軸。篩選培養基以MS為基本培養基,添加不同種類(KT,6-BA以及NAA)及濃度的激素,附加蔗糖30g·L-1,瓊脂7.5g·L-1,pH=6.2,121 ℃ (1.03×105 Pa)滅菌20 min後使用。以下為花序軸誘導不定芽的篩選培養基:
表1 培養基激素配比
2、不定芽誘導試管鱗莖:花序軸生長六周後,形成的不定芽高度達到3-5cm時,將其接入另一種固體培養基中(MS+120 g· L-1綿白糖+6.8 g· L-1瓊脂,pH=7.5)誘導試管鱗莖,觀察並記錄試管鱗莖生長狀況。
3、試管鱗莖的收穫與儲藏:不定芽在誘導試管鱗莖的培養基中誘導六周後,試管鱗莖成熟,將其取出並洗去培養基,在避光處晾乾,晾乾後,在4℃下保存3周後種植。
4、再生植株和鱗莖的形態學觀察:試管鱗莖度過休眠期後,於10月底種植,並覆膜。第二年5月份,揭開薄膜,並進行除草,澆水以及鬆土工作。在6月下旬,大蒜成熟並收穫。測量鱗莖直徑,將大蒜鱗莖按照大中小的標準分為三組,每一組測量十個數據,將得到的三十個數據進行平均,得到試管鱗莖的平均直徑大小。
5、病毒檢測:酶聯免疫試劑OYDV、LYSV和GMV的DAS-ELISA檢測試劑盒購自美國Agdia公司。所用檢測抗體、酶標抗體、對硝基苯磷酸二鈉(PNP)底物、陽性對照、GEB樣品提取緩衝液、聚乙烯微孔板均購自Agdia公司,酶結合物為鹼性磷酸酶(AP)標記的OYDV、LYSV、GMV3種病毒抗體,陰性對照為GEB提取緩衝液,具體檢測方法參照Agdia公司說明書。用雙抗體夾心酶聯免疫吸附法檢測大蒜的脫毒效果,方法參照試劑盒說明書,每個樣品重複三次。
6、再生植株染色體檢測:選取大蒜花序軸試管鱗莖再生植株根尖,用固定液固定24h後,用蒸餾水衝洗3-4次,放入70%的乙醇中進行保存。選取保存的根尖,用蒸餾水衝洗3-5次,加入1M HCl在60℃水浴中水解8 min,蒸餾水衝洗3-5次,將根尖分生組織區置於載玻片中央,滴加2-3滴卡寶品紅溶液,染色8min,用濾紙吸去多餘染液,在顯微鏡下觀察根尖分生組織區染色體形態。
本發明公開的用大蒜花序軸進行脫毒快繁的方法與現有技術相比所具有的積極效果在於:
(1)該方法的核心是通過高頻誘導試管鱗莖、試管鱗莖低溫春化、設施栽培進而在實現脫毒種蒜生產。傳統利用莖尖脫毒快繁,需要經過脫分化、再分化、誘導試管苗、試管苗生根、煉苗移栽等繁瑣過程,歷時兩年才能獲得脫毒種蒜。本實驗室構建的方法,大大提高了大蒜脫毒快繁效率,節省培育時間,降低生產成本。
(2)大蒜花序軸處於大蒜植株生長頂端,其本身帶毒量少,且通過花序軸直接誘導不定芽,沒有經過脫分化和再分化過程,植株遺傳穩定性得到保障。
(3)4℃下處理兩周,打破花序軸休眠期,更加有利於不定芽誘導。
(4)本發明優化了各個環節,構建了從外植體到脫毒種蒜以及組培蒜脫毒效果和遺傳穩定性檢測的完整的方法,該方法在國內外尚未見相關報導。
附圖說明
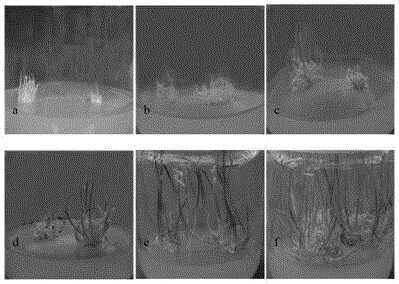
圖1為大蒜花序軸不定芽誘導,其中a.花序軸剛接入培養基,b-f.花序軸生長約1周、2周、3周、4周和6周時的生長狀況;
圖2為大蒜花絮軸不定芽誘導試管鱗莖,其中a.不定芽接入誘導試管鱗莖培養基中,b-f. 不定芽誘導試管鱗莖1周、2周、3周、4周和6周的生長狀況;
圖3為形成的不定芽總數與形成的試管鱗莖數總數相關性分析;
圖4為試管鱗莖的外觀、大小與解剖圖,其中a-b.從培養瓶中收穫的成簇的試管鱗莖 c.收穫的所有試管鱗莖,d.比較寶坻蒜瓣與試管鱗莖大小 e-f. 在解剖鏡下觀察試管鱗莖的生長點(箭頭所指)(圖中比例尺為1.9cm);
圖5為大蒜試管鱗莖所得再生植株與鱗莖的形態,其中a.再生植株在地裡的生長情況,b.收穫鱗莖時再生植株的形態,c.獨頭鱗莖 d.分瓣鱗莖e.二次生長鱗莖(圖中比例尺為1.9cm);
圖6為大蒜花絮軸試管鱗莖再生植株根尖分生組織區的染色體檢測。
具體實施方式
下面結合實施例說明本發明,這裡所述實施例的方案,不限制本發明,本領域的專業人員按照本發明的精神可以對其進行改進和變化,所述的這些改進和變化都應視為在本發明的範圍內,本發明的範圍和實質由權利要求來限定。其中本發明所用到的NAA,KT, 蔗糖,10%安替福民、瓊脂均有市售。
實施例1
(1)花序軸誘導不定芽:選擇寶坻大蒜「六瓣紅」,大蒜進入生殖生長期時,其花莖:假莖=1-1.2時,採摘大蒜的花序軸並於4℃中保存兩周。將經低溫儲存兩周後的花序軸置於自來水下衝洗30 min,0.1% HgCl2 消毒20 min,蒸餾水衝洗3次,再用75%的酒精消毒10 min,蒸餾水衝洗3次。剝下外層苞葉及表面退化的花原基殘留物和膜質苞片,並去除花莖部分,將花序軸接入不定芽誘導培養基中,每瓶接入2個花序軸。誘導不定芽的培養基為: MS+2.0 mg L-1 KT+0.1 mg L-1 NAA+ 30.0 g· L-1 蔗糖+7.5 g ·L-1 瓊脂,pH=6.2。每個花序軸誘導的不定芽數可以達到11個;不定芽誘導試管鱗莖的誘導率均在90%以上,最高可達到98.78%,而每個花序軸誘導的試管鱗莖數最高可達到10.64個,其繁殖係數相對於鱗莖直接種植高了2倍多;
(2)不定芽誘導試管鱗莖:花序軸生長六周後,形成的不定芽高度達到3-5cm時,將其接入誘導培養基中誘導試管鱗莖,所述的誘導培養基指的是試管鱗莖誘導培養基:MS+120 g· L-1綿白糖+6.8 g· L-1瓊脂,pH=7.5,其詳細的方法是:當花序軸誘導的不定芽生長六周後,形成的不定芽高度達到3-5cm時,將其接入另試管鱗莖誘導培養基中誘導試管鱗莖。
(3)試管鱗莖的收穫與儲藏:不定芽在誘導試管鱗莖的培養基中誘導六周後,試管鱗莖成熟,將其取出並洗去培養基,在避光處晾乾,晾乾後,在4℃下保存3周後種植。
(4)再生植株和再生鱗莖的獲得:試管鱗莖度過休眠期後,於10月底種植,覆膜。第二年5月份,揭開薄膜,並進行除草,澆水以及鬆土工作。在6月下旬,組培大蒜成熟並收穫;
(5)組培大蒜病毒檢測和染色體檢測: 利用酶聯免疫技術和根尖細胞染色體製片技術分別檢測組培大蒜脫毒效果和染色體變異情況,組培大蒜達到部分脫毒效果,未觀察到染色體異常現象。
本發明所述的NAA是 a-萘乙酸(1-naphthlcetic acid),簡稱NAA ; KT是激動素(Kinetin),簡稱KT;所述的MS基本培養基配方:
每1L基本培養基中含有:KNO3 1900mg,NH4NO3 1650mg, MgSO4∙7H2O 370 mg, KH2PO4 170 mg, CaCl2∙2H2O 440 mg, MnSO4∙4H2O 22.3 mg, ZnSO4∙7H2O 8.6 mg, H3BO3 6.2 mg, KI 0.83 mg, Na2MO3∙2H2O 0.25 mg, CuSO4∙5H2O 0.025 mg, CoCl2∙6H2O 0.025 mg, Na2-EDTA 37.7 mg, FeSO4∙7H2O 27.8 mg, 甘氨酸2.0 mg, 鹽酸硫胺素0.4 mg, 鹽酸吡哆素0.5 mg, 煙酸0.5 mg, 肌醇100 mg。
實施例2
1、大蒜花序軸誘導不定芽誘導
由於不同激素種類(KT、6-BA及NAA)及濃度對不定芽再生效率有一定的影響,我們設計了12種篩選培養基,將低溫保存兩周後的大蒜花絮軸接入上述篩選培養基中,統計不定芽誘導率,確定最佳誘導培養條件,其結果如下表所示:
表2 不同激素配比對寶坻大蒜花序軸不定芽增殖的影響
從表2中可以看出,在培養基1到6中,培養基2的誘導率較高,每個花序軸誘導的不定芽數達到6.12個。在6- BA濃度相同時,不添加NAA的培養基誘導率較高,說明誘導不定芽時6-BA比NAA的影響大。培養基7到12中,11的誘導率較高,每個花序軸誘導的不定芽數達到11.00個,在KT濃度相同時,添加NAA的培養基誘導率較高,表明KT與NAA共同作用花序軸不定芽的誘導。而從表中結果發現,培養基7到12均比培養基1到6的誘導率高,說明KT比6-BA更適合大蒜花絮軸不定芽的誘導,因此,大蒜花絮軸誘導不定芽的最優培養基為:培養基11,即MS+2.0 mg L-1 KT+0.1 mg L-1 NAA+ 30.0 g· L-1 蔗糖+7.5 g ·L-1 瓊脂,pH=6.2,其誘導率達到11個。
圖1是在最佳誘導培養基上誘導不定芽各環節:剛接入培養基時未見明顯膨大(圖1-a)。經過一個星期左右,其表面出現凸起,花序軸明顯膨大,切塊表面增厚,形成半透明的叢生芽,大多數生長於中部和下部,並且密集生長(圖1-b)。不定芽持續生長,大約兩周後,半透明的不定芽變成嫩綠色,達到2釐米的長度(圖1-c)。4周後,形成密集的不定芽叢(圖1-e)。大約6周後,不定芽可以移植到誘導試管鱗莖培養基中(圖1-f)。
2、大蒜花序軸不定芽誘導試管鱗莖
由於眾多的不定芽叢生於同一個花絮軸基部,難以保證每一顆苗能夠誘導出實生根進行移栽,本研究通過誘導試管鱗莖途徑以提高繁殖效率。誘導試管鱗莖的培養基為:MS+ 120.0 g· L-1 綿白糖+6.8 g ·L-1 瓊脂,pH=7.5 。從圖2中可以看到,誘導大約1周後,不定芽根部開始膨大(圖2-b);2周後,試管苗出現枯萎(圖2-c);3周時,鱗莖外表皮逐漸變為紫色(圖2-d);4周時,誘導形成的試管鱗莖大部分外表皮變為紫色,試管苗枯萎現象嚴重(圖2-e);6周後,試管苗枯萎,試管鱗莖基本成熟(圖2-f)。此時,將試管鱗莖從培養瓶中取出,洗去表面培養基,於陰涼處晾乾。
從表3中可以看到,不定芽誘導試管鱗莖的誘導率均在90%以上,最高可達到98.78%,而每個花序軸誘導的試管鱗莖數最高可達到10.64個,其繁殖係數相對於鱗莖直接種植(繁殖係數為5)高了2倍多。從圖3中可以看出,大蒜花序軸形成的不定芽總數與形成試管鱗莖總數呈顯著正相關(p<0.05)。因此,在需要獲得高誘導率的試管鱗莖時,誘導不定芽則需要在誘導率較高的培養基上生長。
表3大蒜花絮軸不定芽誘導試管鱗莖
註:小寫字母在0.05水平上差異顯著,大寫字母在0.01水平上差異顯著。
3 試管鱗莖的收穫與貯藏
大蒜花序軸誘導形成試管鱗莖總計1260個。較大的試管鱗莖的直徑為6.65mm,中等大小的直徑為4.23mm,而相對較小的直徑為1.68mm。從培養瓶中收穫的試管鱗莖成簇狀排列,每簇最多可達到25個(見圖4-a-b)。晾乾後的試管鱗莖外表皮呈紫色(見圖4-c),與寶坻大蒜鱗莖外表皮一致。在解剖鏡下觀察,試管鱗莖都具有生長點(見圖4-e-f),因此,在渡過休眠期後,移栽至地裡,試管鱗莖均可以正常生長。
4 大蒜試管鱗莖所得再生植株與鱗莖的形態學統計分析
大蒜試管鱗莖的再生植株數量為539株,收穫的鱗莖中,獨頭蒜有530株,分成兩瓣的有8株,四瓣的1株。鱗莖的最大直徑為22.14mm,最小直徑為3.16mm,二次生長的1株。
5病毒檢測
對通過試管鱗莖種植大田所得再生植株葉片分別用OYDV、LYSV和GMV試劑盒進行DAS-ELISA檢測,用酶標儀讀取405nm吸光度值,並與陰性對照、陽性對照吸光度值進行比較。結果表明,未脫毒寶坻大蒜病毒感染比較嚴重,且為複合型感染(見表4)。
從表4中可以看出,在未脫毒寶坻大蒜中均檢測出感染上述三種病毒,但病毒對植株侵染程度不同,這是一種複合侵染的方式。未脫毒大蒜樣品OYDV、LYSV和GMV檢測結果分別為陰性對照的3.10、6.11和3.11倍,感染情況相當嚴重。這種可能是導致大蒜品質下降,繁殖係數降低的原因之一。經過花序軸脫毒快繁途徑後再生植株樣品OYDV、LYSV和GMV檢測結果分別為陰性對照的2.9、4.3和1.2倍,達到一定脫毒效果。
表4再生植株葉片ELISA病毒檢測結果
6細胞學觀察
大蒜是真核細胞生物,染色體的正常形態和結構保證了基因遺傳的穩定性,觀察大蒜花序軸試管鱗莖再生植株根尖分生組織區的染色體形態和結構,細胞中有16條染色體,並且形態正常,未發現染色體異常現象,因此保證了大蒜種質的遺傳穩定性。
本發明構建的大蒜脫毒快繁方法與常規方法的對比試驗結果如下:
對比試驗:
結論:與常規方法相比,本發明以大蒜花序軸為外植體,構建了從外植體選擇、花序軸不定芽誘導、不定芽誘導試管鱗莖、試管鱗莖打破休眠、大田栽培種植、脫毒效果檢測、遺傳穩定性檢測、直到脫毒種蒜獲得的完整的方法,省去試管苗生根和移栽,解決了試管苗成活率低的問題。該體系為大蒜脫毒、快繁、保持優良遺傳穩定性、提高鱗莖產量及品質等提供了重要的技術依據。
