一株高木糖耐性肺炎克雷伯氏菌株及其構建方法與流程
2023-08-01 01:19:31 4
【技術領域】
本發明屬於生物工程技術領域,涉及工業微生物的育種,尤其是一種高木糖耐性肺炎克雷伯氏菌株及其構建方法。
背景技術:
木糖,是植物細胞壁(木質纖維素)水解產物中除葡萄糖外含量最高的糖類物質。伴隨著人類對能源和化工產品需求量的巨大增長和全球變暖、海平面升高、海水酸化等環境問題的日益嚴重,追求綠色化工和尋找可再生新能源的呼聲日益高漲,而木質纖維素作為目前已知的含量最豐富,成本最低的生物質材料,對其進行有效利用進行生物質乙醇以及其他大宗化學品的生物方法生產是解決上述矛盾和問題的可行方案之一。因此,找到一種可行的方法對木糖加以利用,能夠有效提高木質纖維素的利用率,提高生產效率,降低成本。
作為一種重要的化工原料和液體燃料,2,3-丁二醇廣泛應用於化工、醫藥、食品和航空航天等領域。而目前生產2,3-丁二醇的主要方法是化學法,化學法主要是以石油裂解時產生的四碳類碳氫化合物在高溫高壓下水解得到,成本高、過程煩瑣、不易操作,所以一直很難實現大規模的工業化生產。相比於化學合成法,生物法生產2,3-丁二醇不僅解決了原料來源問題,而且無毒、汙染小,符合人們對環境友好的要求,是未來最具競爭力的2,3-丁二醇生產方法。
肺炎克雷伯氏菌是目前已知存在的天然2,3-丁二醇產量最高的菌株之一,前人對該菌株生產2,3-丁二醇的研究大都集中在不同底物和條件下表型優異菌株的篩選和發酵條件的優化和少數基因的轉錄和表達上,對該菌株木糖耐受性的研究一直沒有突破,直至gtme的出現為底物耐受性的研究打開了一扇新的大門。提高肺炎克雷伯氏菌株在高濃度木糖環境下高效轉化2,3-丁二醇的能力,能夠為利用生物方法工業化生產2,3-丁二醇和木質纖維素合理利用打下堅實的基礎。
技術實現要素:
本發明的目的是選育高木糖耐性的肺炎克雷伯氏菌株。
所述的基因rpod核苷酸序列如表中seqno:1所示
所述出發酵母菌株為肺炎克雷伯氏菌(klebsiellapneumoniaecicc10781),購自中國工業微生物菌種保藏中心),公眾可購買獲得。
大腸桿菌(escherichiia.colidh5α),本實驗室保藏。
實驗使用的質粒pdk7,本實驗室保藏。
本發明的技術方案:高木糖耐性肺炎克雷伯氏菌株的構建方法,通過易錯pcr的方法將目的基因rpod擴增出來,連接到pdk7質粒上,根據不同體系依次命名易錯pcr突變質粒文庫。將質粒文庫中的各個質粒分別電擊轉化kpg電轉感受態,將驗證成功的菌株分別按照對應質粒順序命名,純化保藏好得到rpod突變菌株文庫。將突變株經高木糖壓力篩選,獲得高木糖耐受表型。分別將對照菌k.pneumoniae及高木糖耐性表型菌株進行發酵,以細胞生長速度和2,3丁二醇產量為指標,篩選獲得高木糖耐性和高產2,3-丁二醇的突變株kpc。該構建方法的具體操作過程如下:
(1)全局轉錄因子σ編碼基因rpod突變質粒文庫的構建
依照表1易錯pcr反應體系中mn2+與mg2+的不同,分別設定a、b、c三個和1-7七種共計3×7=21個體系(表2),根據genbank公布的k.pneumoniaeσ因子基因(rpod)序列設計引物,以k.pneumoniae基因組為模板,進行pcr反應,擴增目的基因rpod。
表1易錯pcr反應體系
*121個體系分別對應唯一一種mn2+和mg2+濃度組合,單位mm
表2個易錯pcr體系
表3pcr反應條件
得到各易錯pcr體系產物後,經純化回收,與pdk7質粒一同經saci、xbai雙酶切後連接,轉化e.colidh5α感受態後,於cm抗性平板上塗布培養,挑取轉化子經驗證後,試劑盒提取、純化質粒,根據不同體系依次命名構建易錯pcr突變質粒文庫。
(2)rpod突變菌株文庫的構建
將質粒文庫中的各個質粒分別電擊轉化kpg電轉感受態,通過cm抗性平板篩選獲得的轉化子利用菌落pcr技術擴增cm抗性基因cat片段後進行質粒精提驗證,將驗證成功的菌株分別按照對應質粒順序命名,純化保藏好得到rpod突變菌株文庫。
(3)突變株的篩選與高耐性和高產2,3丁二醇表型的獲得
將突變株經高木糖壓力篩選,可獲得高木糖耐受表型,分別將對照菌k.pneumoniae及高木糖耐性表型菌株進行發酵,利用bioscreen全自動生長曲線分析儀測定生長曲線,以細胞生長速度和2,3-丁二醇產量為指標,篩選獲得高木糖耐性和高產2,3-丁二醇的突變株,總體技術路線見圖1所示。
本發明的優點和積極效果:
本發明將提高肺炎克雷伯氏菌木糖發酵生產2,3-丁二醇效率,解決木糖利用難題,與原始菌株比較木糖消耗量提高了169%,2,3-丁二醇產量提高了216%,具有重要的經濟、社會和環境效益。同時也將擴展了定向進化技術在生物技術領域的應用,使工業微生物菌種改造從經典的物理或化學隨機突變向對特定啟動子的定向進化和細胞整體代謝網絡的操縱轉變,快速高效地提高菌種的耐受性和生產性能。
【附圖說明】
圖1.高耐性菌株篩選技術路線
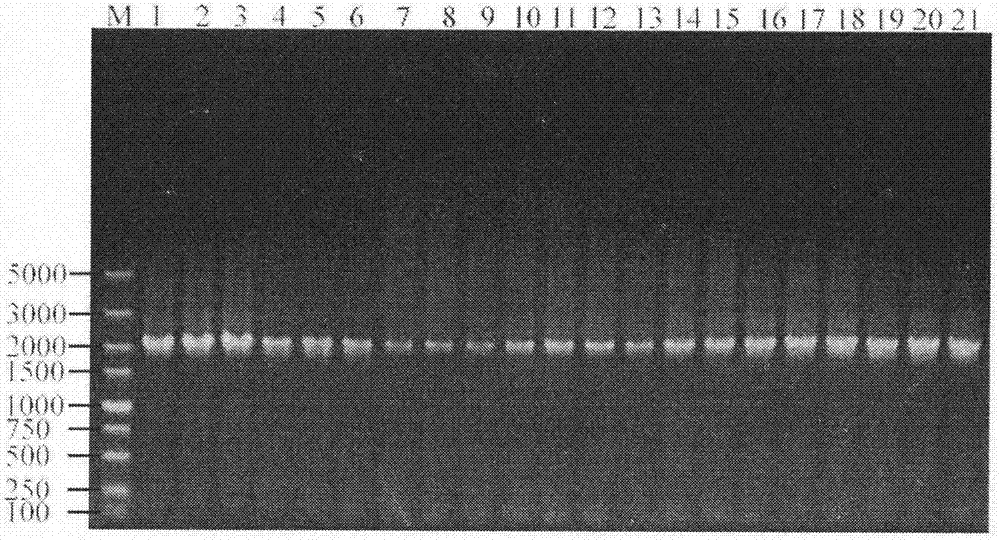
圖2.21個易錯體系擴增產物(m:dl5000marker;1-21:分別對應a1至c7共21個體系擴增產物)
圖3.a1片段(2088bp)、pdk7質粒(4800bp)酶切(m:dl5000marker;1:pdk7質粒saci、xbai雙酶切;2:a1體系rpod片段saci、xbai雙酶切)
圖4.pdk7-rpod質粒的構建過程與圖譜
圖5.(a)a1-1質粒精提驗證(m:dl5000marker;1:pdk7質粒;2:a1-1質粒);(b)質粒pcr驗證(m:dl5000marker;1:pdk7質粒pcr;2:a1-1質粒pcr);(c)a1-1質粒酶切驗證(m:dl5000marker;1:pdk7質粒對照;2:a1-1質粒雙酶切(saci、xbai)
圖6.cat基因菌落pcr(m:dl5000marker;1-20:分別為抗性平板上挑取所得轉化子菌落對應菌落pcr產物)
圖7.(a)不同菌株菌體乾重增長曲線;(b)不同菌株木糖發酵消耗曲線;(c)2,3-丁二醇的生成曲線;(d)乙偶姻生成曲線
【具體實施方式】
本發明所使用的肺炎克雷伯氏菌體是可以採用任何來源的肺炎克雷伯氏菌株。
下述實施例中的方法,如無特別說明,均為常規方法。
實施例1:全局轉錄因子σ編碼基因rpod基因突變文庫的建立
(1)rpod突變質粒文庫的構建
多數情況下,研究者使用pcr的方法擴增dna時要求擴增過程儘可能減少鹼基錯配或鹼基置換的出現,以提高變異菌株篩選或菌種鑑定是的準確性和可靠性。而具有熱穩定性的dna聚合酶憑藉其固有的3』→5』的核酸外切酶活性確保了擴增過程中的高保真度,此外,通過控制pcr反應條件能夠進一步降低擴增過程中鹼基錯誤的引入。
易錯pcr正是基於以上條件的反向利用,通過使用保真度較低的聚合酶,調整pcr反應體系和反應條件,以一定概率向dna擴增過程中引入隨機突變,以建立某個基因的突變文庫,用以篩選表型出現變化的菌株和個體。本實驗利用易錯pcr方法擴增k.pneumoniae菌株的rpod基因,依照表1易錯pcr反應體系中mn2+與mg2+的不同,分別設定a、b、c三個和1-7七種共計3×7=21個體系(表2),用引物rpod-sense-saci(pdk7)和rpod-anti-xbai(pdk7)見表4按照表3方法對每個體系進行溫度梯度pcr,確定個體系pcr退火溫度(表5)。
表4本實例中所用到的引物
表5易錯pcr各體系退火溫度(單位:℃)
易錯pcr各體系條件確立後,按照上述方法和條件,以rpod-sense-saci(pdk7)和rpod-anti-xbai(pdk7)為引物,以kpg基因組為模板進行易錯pcr,獲得21體系擴增產物2088bp,電泳驗證圖如圖2所示。得到各易錯pcr體系產物後,經試劑盒純化回收,與pdk7質粒一同經saci、xbai雙酶切電泳圖見圖3所示,酶切後用solutioni連接(連接體系見表6)構建質粒,將構建好的質粒轉化e.colidh5α感受態後,於cm抗性平板上塗布,過夜培養,挑取轉化子利用試劑盒精提質粒,然後進行以rpod-sense-saci和rpod-anti-xbai為引物,精提的質粒為模版進行pcr驗證,反應條件:95℃5min;94℃45s,55℃1min,72℃130s,28個循環;72℃10min。用saci和xbai進行雙酶切進行驗證,經驗證後,將驗證正確的質粒進行純化,並根據不同體系依次命名構建易錯pcr突變質粒文庫,質粒的構建圖譜見圖4(以a1-1質粒為例)。突變質粒文庫構建過程凝膠電泳驗證見圖5(以a1-1質粒為例),本實例中所用的pcr擴增體系見表7,質粒文庫所含有各體系質粒(共計91個質粒)見表8。
表6solutioni連接酶連接方法
註:反應條件為16℃水浴,過夜連接
表7本實施例中所用的pcr擴增體系
表8質粒文庫
實施例2:σ因子全局轉錄調控獲得高耐性和高產2,3-丁二醇表型及發酵實驗
(1)重組突變質粒電轉化及突變菌株文庫的構建:
將表8質粒文庫中的各個質粒分別電擊轉化kpg感受態,通過cm抗性平板篩選獲得的轉化子,利用菌落pcr技術擴增cm抗性基因cat片段(940bp,圖6)所用引物見表9,然後精提質進行pcr驗證和酶切驗證,將驗證成功的菌株分別按照對應質粒順序命名,純化保藏好得到rpod突變菌株文庫(共計523株菌株)。
表9本實例中所用到的引物
(2)菌株復篩與高耐性和高產2,3丁二醇表型的獲得:
將篩選得到的突變菌株文庫中的突變株,經過120g/l高木糖壓力篩選,可獲得高木糖耐受表型,然後分別將對照菌k.pneumoniae及高木糖耐性表型菌株進行發酵,利用bioscreen全自動生長曲線分析儀測定生長曲線,分別以細胞生長速度和2,3丁二醇產量為指標,最後篩選獲得一株具有高木糖耐性和高產2,3-丁二醇表型的突變株kpc。
(3)高木糖耐性並高產2,3-丁二醇突變菌株的發酵驗證實驗
將所得突變菌株和對照菌株分別接種到裝有120g/l液體木糖培養基的1l發酵罐中,發酵條件為250rpm、35℃、通氣為0.4l/min,進行發酵培養60h,通過取樣分析,測定od600,由od600可以計算出菌體乾重,結果如圖7(a)可知突變菌株菌體乾重的增長速率和總量都明顯高於對照菌株,說明突變菌株kpc的生長速度比對照菌株快。利用hplc測定發酵液中木糖及各產物濃度,高效液相色譜條件為:色譜柱為bio-radhpx-87h,300×7.8mm;檢測器為示差折光檢測器(rid);流動相為5mmol/l硫酸,流速為0.6ml/min;檢測器溫度為45℃,柱溫為65℃。將樣品稀釋到合適的濃度並經0.22μm的濾膜過濾,進樣量為20μl。將所得的結果繪製成折線圖:由圖7(b)可知,初始木糖濃度為120g/l時,kpg和kpc兩株菌62h木糖消耗量分別為37.65g/l和110.5g/l,消耗速率分別為0.61g/l/h和1.78g/l/h;相對出發菌株,kpc菌株木糖消耗量提高了193.5%。改造菌株木糖消耗總量和消耗速率有大幅度提高。
由圖7(c)和圖7(d)可以看到,隨著木糖消耗的增加,乙偶姻和2,3-丁二醇的產量都有不同程度的提高,發酵62h菌株kpc中,乙偶姻和2,3-丁二醇產量分別達到4.76g/l和38.6g/l,相對kpg分別提高了361.3%和228.5%。
