鋰電池的製作方法
2023-05-27 17:07:07 3
技術領域
實施例涉及一種鋰電池。
背景技術:
鋰電池可用作用於諸如攝影機、行動電話和膝上型電腦等的可攜式電子裝置的電源。可再充電的鋰二次電池可具有比一般的鉛蓄電池、鎳鎘電池、氫鎳電池和鎳鋅電池等的每單位重量的能量密度大三倍或更多倍的每單位重量的能量密度,並可迅速地被充電。
技術實現要素:
實施例針對一種鋰電池。
可通過提供鋰電池來實現實施例,所述鋰電池包括:正電極,所述正電極包括包含大約50mol%至大約100mol%的鎳的鋰鎳基複合化合物;負電極;以及電解質,其中,電解質包括鋰鹽和由下面的式1表示的化合物:
其中,在式1中,R1、R2、R3和R4均獨立地為氫、未取代的C1-C10烷基、取代有一個或更多個滷素原子的C1-C10烷基、未取代的C6-C20芳基、取代有一個或更多個滷素原子的C6-C20芳基、未取代的C3-C20雜芳基或取代有一個或更多個滷素原子的C3-C20雜芳基。
在式1中,R1至R4可均獨立地為氫、甲基或三氟甲基。
由式1表示的化合物可以是下面的化合物2至化合物6中的一種:
鋰鎳基複合化合物可由下面的式7表示:
LixNiyM1-yO2
其中,在式7中,x可以是0.9至1.2,y可以是0.5至1.0,M可以是鈷(Co)、錳(Mn)、鋁(Al)或它們的組合。
由式7表示的化合物可以是由下面的式8和式9中的一個表示的化合物:
LixNiyCozMn1-y-zO2
其中,在式8中,1≤x≤1.2,0.5≤y<1,0≤z≤0.5,1-y-z可以是0至0.5,
LixNiyCozAl1-y-zO2
其中,在式9中,y可以是0.5至1.0,z可以是0至0.5。
由式7表示的化合物可以是LiNi0.6Co0.2Mn0.2O2或LiNi0.88Co0.1Al0.02O2。
基於電解質的總重量,可以以大約0.1wt%至大約10wt%的量包括由式1表示的化合物。
電解質可包括有機溶劑,所述有機溶劑包括碳酸二烷基酯、環狀碳酸酯、鏈狀酯或環狀酯、鏈狀醯胺或環狀醯胺、脂肪腈、鏈狀醚或環狀醚或者它們的衍生物。
電解質可包括有機溶劑,所述有機溶劑包括碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)、碳酸甲丙酯、碳酸乙丙酯、碳酸二乙酯(DEC)、碳酸二丙酯、碳酸亞丙酯(PC)、碳酸亞乙酯(EC)、碳酸亞丁酯、丙酸乙酯、丁酸乙酯、乙腈、丁二腈(SN)、二甲基亞碸、二甲基甲醯胺、二甲基乙醯胺、γ-戊內酯、γ-丁內酯或四氫呋喃。
鋰鹽可包括LiPF6、LiBF4、LiSbF6、LiAsF6、LiClO4、LiCF3SO3、Li(CF3SO2)2N、LiC4F9SO3、LiAlO2、LiCl、LiI、LiAlCl4、LiN(CxF2x+1SO2)(CyF2y+1SO2)或它們的混合物,其中,x和y均獨立地為1至20。
電解質中鋰鹽的濃度可以為大約0.01M至大約2.0M。
附圖說明
通過參照附圖詳細地描述示例性實施例,特徵對於本領域技術人員來講將是明顯的,在附圖中:
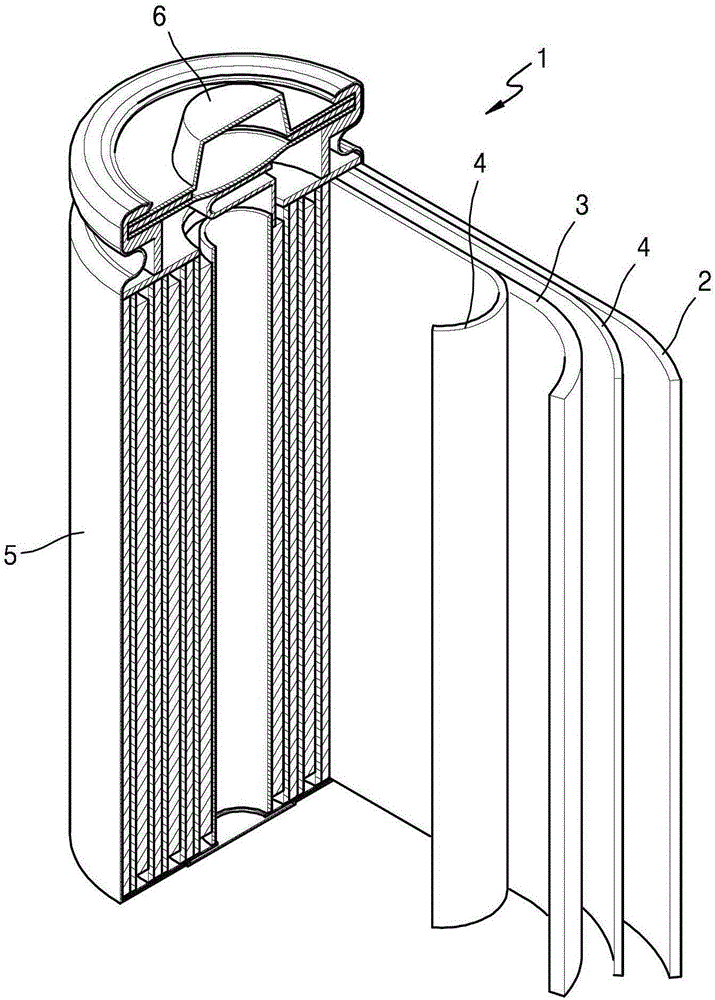
圖1示出根據示例性實施例的鋰電池的視圖;
圖2示出根據示例1和對比示例1製造的鋰電池的微分容量曲線圖;
圖3示出展示示例1和對比示例1的鋰電池的阻抗特性的曲線圖;
圖4示出展示根據示例2和對比示例4製造的鋰電池的阻抗特性的曲線圖;
圖5示出展示根據對比示例2和對比示例5製造的鋰電池的阻抗特性的曲線圖;
圖6示出展示根據對比示例3和對比示例6製造的鋰電池的阻抗特性的曲線圖;
圖7示出展示示例1和對比示例1的鋰電池在高溫(45℃)下的充電和放電特性的曲線圖;
圖8示出展示示例2和對比示例4的鋰電池在高溫(45℃)下的充電和放電特性的曲線圖;
圖9示出展示對比示例2和對比示例5的鋰電池在高溫(45℃)下的充電和放電特性的曲線圖;
圖10示出展示對比示例3和對比示例6的鋰電池在高溫(45℃)下的充電和放電特性的曲線圖;
圖11示出展示示例1和對比示例1的鋰電池在高溫(60℃)下儲存之後的阻抗特性的曲線圖;
圖12示出展示示例2和對比示例4的鋰電池在高溫(60℃)下儲存之後的阻抗特性的曲線圖;
圖13示出展示對比示例2和對比示例5的鋰電池在高溫(60℃)下儲存之後的阻抗特性的曲線圖;以及
圖14示出展示對比示例3和對比示例6的鋰電池在高溫(60℃)下儲存之後的阻抗特性的曲線圖。
具體實施方式
現在將參照附圖在下文中更充分地描述示例實施例;然而,示例實施例可以以不同的形式實施,且不應當被解釋為局限於在此闡述的實施例。相反,提供這些實施例使得本公開將是徹底的且完整的,並將向本領域技術人員充分地傳達示例性實施方式。
在附圖中,為了圖示的清楚,會誇大層和區域的尺寸。還將理解的是,當層或元件被稱為「在」另一層或元件「上」時,所述層或元件可直接在所述另一層或元件上,或者也可存在中間元件。另外,還將理解的是,當元件被稱為「在」兩個元件「之間」時,所述元件可以是這兩個元件之間的唯一元件,或者也可存在一個或更多個中間元件。同樣的附圖標記始終指示同樣的元件。
諸如「……中的至少一個(種)」的表述在一列元件(要素)之後時,修飾整列的元件(要素),而不是修飾該列中的個別元件(要素)。
在下文中,將更詳細地描述根據示例性實施例的鋰電池。
根據實施例的鋰電池可包括例如正電極、負電極和電解質。正電極可包括例如包括50mol%或更多的鎳的鋰鎳基複合化合物。「包括50mol%或更多的鎳的鋰鎳基複合化合物」指在鋰鎳基複合化合物中鎳的量相對於過渡金屬的總量在大約50mol%或更大的範圍內的鋰鎳基複合化合物。例如,在LixNiyM1-yO2中,過渡金屬的總量表示Ni和M的總量。
在另一實施例中,「包括50mol%或更多的鎳的鋰鎳基複合化合物」指鎳的摩爾量是鋰的摩爾量的50%至100%的鋰鎳基複合化合物。電解質可包括例如鋰鹽和由以下的式1表示的化合物。
在式1中,R1、R2、R3和R4可均獨立地為例如氫、未取代的C1-C10烷基、取代有一個或更多個滷素原子(例如,1至5個滷素原子,代表性地,1至3個滷素原子)的C1-C10烷基、未取代的C6-C20芳基、取代有一個或更多個滷素原子(例如,1至5個滷素原子,代表性地,1至3個滷素原子)的C6-C20芳基、未取代的C3-C20雜芳基或取代有一個或更多個滷素原子(例如,1至5個滷素原子,代表性地,1至3個滷素原子)的C3-C20雜芳基。
由式1表示並包括在電解質中的化合物可具有包含兩個磺醯基的環狀結構。當向電解質添加這樣的化合物時,電解質可由於磺醯基而具有高溫穩定性。由式1表示的化合物可由於環狀結構而在電解質之前減少或分解,從而形成磺酸(-SO3-)類聚合物膜。這樣的聚合物膜可覆蓋電極的較大區域,此外,這樣的磺酸(-SO3-)類聚合物膜可具有優異的高溫穩定性。因此,可獲得在高溫下抑制電阻增大的強效果。
如上所述,當向電解質添加由式1表示的化合物時,可在負電極處更容易地形成穩定SEI層,因此鋰電池可具有增強的壽命,例如,高溫壽命。當在高溫下儲存鋰電池時,可抑制副反應,因此可抑制例如內電阻的增大的電壓降,由此增強高溫儲存特性。在實施方式中,在以上的式1中,R1至R4中的每個可獨立地為例如氫、甲基或三氟甲基。
在實施方式中,由式1表示的化合物可以是下面的化合物2至化合物6中的一種。
在實施方式中,基於電解質的總重量,可以以大約0.1wt%至大約10wt%(例如,大約0.1wt%至大約7wt%)的量包括由式1表示的化合物。當電解質中的由式1表示的化合物的量在上述範圍內時,可獲得具有增強的壽命特性的電池。
在鋰電池中,正電極可包括富鎳的鋰鎳基複合氧化物。富鎳的鋰鎳基複合氧化物可包括例如大約50mol%至大約100mol%的量的鎳。當鎳的含量在上述範圍內時,可製造高輸出和高容量的鋰電池。然而,當鎳的含量與上述範圍一樣高時,會嚴重地發生富鎳的鋰鎳基複合氧化物的過渡金屬的沉積並會使高溫特性劣化。
當電解質包括由例如根據實施例的式1表示的化合物時,可增強負電極的保護作用,因此可產生較少量的副產物,其可幫助減少正電極的過渡金屬的洗脫。此外,由式1表示的化合物可在正電極處具有聚合物膜效應,因此可減少由於副產物造成的對正電極的損害。這樣,通過在電解質中包括由式1表示的化合物,可減少和/或防止例如高溫特性劣化的上述問題。因此,可製造在高溫下具有長壽命且抑制電阻增大的強效果的高輸出和高容量鋰電池。如果使用包含少於50mol%的鎳的鋰鎳基複合氧化物,與使用包含大約50mol%至大約100mol%的鎳的鋰鎳基複合氧化物的情況相比,前者則會發生較少的電池劣化。因此,如果向電解質添加由式1表示的化合物,且使用包括包含少於50mol%的鎳的鋰鎳基複合氧化物的電極,則在高溫下長壽命和抑制電阻增大的強效果會不明顯。
當使用包括富鎳的鋰鎳基複合氧化物的電極和包括由式1表示的化合物的電解質兩者時,鋰電池可在高溫下具有改善的壽命和抑制電阻增大的好效果。在實施方式中,富鎳的鋰鎳基複合氧化物可以是由下面的式7表示的化合物。
[式7]
LixNiyM1-yO2
在式7中,x可以是0.9至1.2,y可以是0.5至1.0,M可以是鈷(Co)、錳(Mn)和/或鋁(Al)。
由式7表示的化合物可以是例如由以下的式8表示的化合物或由以下的式9表示的化合物。
[式8]
LixNiyCozMn1-y-zO2
在式8中,1≤x≤1.2,0.5≤y<1,0≤z≤0.5,1-y-z可以是0至0.5,
[式9]
LixNiyCozAl1-y-zO2
在式9中,y可以是0.5至1.0,z可以是0至0.5。
在實施方式中,由式7表示的化合物可以是例如LiNi0.6Co0.2Mn0.2O2或LiNi0.88Co0.1Al0.02O2。
電解質的有機溶劑可包括低沸點溶劑。如在此使用的術語「低沸點溶劑」可指在25℃(環境溫度)和1atm下具有200℃或更低的沸點的溶劑。
例如,有機溶劑可包括碳酸二烷基酯、環狀碳酸酯、鏈狀酯或環狀酯、鏈狀醯胺或環狀醯胺、脂肪腈、鏈狀醚或環狀醚或者它們的衍生物。
在實施方式中,有機溶劑可包括例如碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)、碳酸甲丙酯、碳酸乙丙酯、碳酸二乙酯(DEC)、碳酸二丙酯、碳酸亞丙酯(PC)、碳酸亞乙酯(EC)、碳酸亞丁酯、丙酸乙酯、丁酸乙酯、乙腈、丁二腈(SN)、二甲基亞碸、二甲基甲醯胺、二甲基乙醯胺、γ-戊內酯、γ-丁內酯或四氫呋喃。在實施方式中,可使用合適的低沸點溶劑。
在實施方式中,電解質中的鋰鹽的濃度可以是例如大約0.01M至大約2.0M。在實施方式中,可使用合適的鋰鹽的濃度。在上述濃度範圍內,可實現增強的電池特性。
在電解質中使用的鋰鹽可包括合適的鋰鹽。在實施方式中,鋰鹽可包括例如LiPF6、LiBF4、LiSbF6、LiAsF6、LiClO4、LiCF3SO3、Li(CF3SO2)2N、LiC4F9SO3、LiAlO2、LiAlCl4、LiN(CxF2x+1SO2)(CyF2y+1SO2)(其中,x和y均獨立地為1至20)、LiCl、LiI或它們的混合物等。在實施方式中,電解質的鋰鹽可以是例如LiPF6。
電解質可處於液體或凝膠狀態。
鋰電池的類型可包括諸如鋰離子電池、鋰離子聚合物電池和鋰硫電池等的鋰二次電池以及鋰一次電池。
在鋰電池中,石墨可用作負極活性物質。鋰電池可具有4.5V或更大的高電壓,例如,4.8V或更大。
可使用下面的方法製造根據實施例的鋰電池。
首先,可製備正電極。
例如,可製備在其中混合有正極活性物質、導電物質、粘合劑和溶劑的正極活性物質組合物。可將正極活性物質組合物直接塗覆在金屬集流體上以製造正電極板。在另一實施例中,可將正極活性物質組合物澆鑄在單獨的支撐件上,然後可將與支撐件分離的膜層壓在金屬集流體上,從而完成正電極的製造。在實施方式中,可使用其它方法來製造正電極。
作為正極活性物質,例如,可結合一般的含鋰金屬氧化物來使用上述富鎳的鋰鎳基複合氧化物。含鋰金屬氧化物可包括鋰以及從鈷、錳、鎳和它們的組合中選擇的金屬的複合氧化物。含鋰金屬氧化物可以是由下面的式中的任意一個表示的化合物:LiaA1-bB』bD2,其中,0.90≤a≤1.8,0≤b≤0.5;LiaE1-bB』bO2-cDc,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05;LiE2-bB』bO4-cDc,其中,0≤b≤0.5,0≤c≤0.05;LiaNi1-b-cCobB』cDα,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α≤2;LiaNi1-b-cCobB』cO2-αF』α,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNi1-b-cCobB』cO2-αF』2,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNi1-b-cMnbB』cDα,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α≤2;LiaNi1-b-cMnbB』cO2-αF』α,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNi1-b-cMnbB』cO2-αF』2,其中,0.90≤a≤1.8,0≤b≤0.5,0≤c≤0.05,0<α<2;LiaNibEcGdO2,其中,0.90≤a≤1.8,0≤b≤0.9,0≤c≤0.5,0.001≤d≤0.1;LiaNibCocMndGeO2,其中,0.90≤a≤1.8,0≤b≤0.9,0≤c≤0.5,0≤d≤0.5,0.001≤e≤0.1;LiaNiGbO2,其中,0.90≤a≤1.8,0.001≤b≤0.1;LiaCoGbO2,其中,0.90≤a≤1.8,0.001≤b≤0.1;LiaMnGbO2,其中,0.90≤a≤1.8,0.001≤b≤0.1;LiaMn2GbO4,其中,0.90≤a≤1.8,0.001≤b≤0.1;QO2;QS2;LiQS2;V2O5;LiV2O5;LiI』O2;LiNiVO4;Li(3-f)J2(PO4)3,其中,0≤f≤2;Li(3-f)Fe2(PO4)3,其中,0≤f≤2;以及LiFePO4。
在以上的式中,A可以是Ni、Co、Mn或它們的組合,B』可以是A1、Ni、Co、Mn、Cr、Fe、Mg、Sr、V、稀土元素或它們的組合,D可以是O、F、S、P或它們的組合,E可以是Co、Mn或它們的組合,F』可以是F、S、P或它們的組合,G可以是A1、Cr、Mn、Fe、Mg、La、Ce、Sr、V或它們的組合,Q可以是Ti、Mo、Mn或它們的組合,I』可以是Cr、V、Fe、Sc、Y或它們的組合,J可以是V、Cr、Mn、Co、Ni、Cu或它們的組合。
例如,正極活性物質可以是LiCoO2、LiMnxO2x(其中,x=1或2)、LiNi1-xMnxO2x(其中,0<x0.5)或LiFePO4等。
在實施方式中,上述化合物可在它們的表面處具有塗覆層。在實施方式中,可結合具有塗覆層的化合物來使用所述化合物。塗覆層可包括諸如塗覆元素的氧化物、塗覆元素的氫氧化物,塗覆元素的羥基氧化物,塗覆元素的碳酸氧鹽(oxycarbonate)或塗覆元素的羥基碳酸鹽(hydroxycarbonate)的塗覆元素化合物。塗覆元素化合物可以是非晶的或結晶的。包括在塗覆層中的塗覆元素可包括例如Mg、Al、Co、K、Na、Ca、Si、Ti、V、Sn、Ge、Ga、B、As、Zr或它們的混合物。可通過使用對正極活性物質的物理性質沒有不利影響的各種方法(例如,噴塗或浸漬等)中的任意一種通過在上述化合物中使用塗覆元素來形成塗覆層。
導電物質可包括例如炭黑或石墨微粒等。在實施方式中,導電物質可以是合適的導電物質。
粘合劑的示例可包括偏二氟乙烯/六氟丙烯共聚物、聚偏二氟乙烯(PVDF)、聚丙烯腈、聚甲基丙烯酸甲酯、聚四氟乙烯、上述聚合物的混合物以及丁苯橡膠類聚合物。在實施方式中,粘合劑可包括合適的粘合劑。
溶劑可包括例如N-甲基吡咯烷酮、丙酮或水等。在實施方式中,溶劑可包括合適的溶劑。
正極活性物質、導電物質、粘合劑和溶劑的量可與在合適的鋰電池中使用的正極活性物質、導電物質、粘合劑和溶劑的量處於同一水平。在實施方式中,可根據期望的鋰電池的用途和構成而省略導電物質、粘合劑和溶劑中的至少一種。
接下來,製備負電極。
例如,可通過混合負極活性物質、導電物質、粘合劑和溶劑來製備負極活性物質組合物。可將負極活性物質組合物直接塗覆在金屬集流體上並將其乾燥以獲得負電極板。在實施方式中,可將負極活性物質組合物澆鑄在單獨的支撐件上,並且可將從支撐件分離的膜層壓在金屬集流體上以完成負電極板的製造。
作為負極活性物質,可使用鋰電池的合適的負極活性物質。例如,負極活性物質可包括鋰金屬、可與鋰合金化的金屬、過渡金屬氧化物、非過渡金屬氧化物和/或碳質物質。
例如,可與鋰合金化的金屬可包括矽(Si)、錫(Sn)、鋁(Al)、鍺(Ge)、鉛(Pb)、鉍(Bi)、銻(Sb)、Si-Y合金(Y是除了Si之外的鹼金屬、鹼土金屬、13族至16族元素、過渡金屬、稀土元素或它們的組合)或Sn-Y合金(Y是除了Sn之外的鹼金屬、鹼土金屬、13族至16族元素、過渡金屬、稀土元素或它們的組合)等。Y的示例可包括鎂(Mg)、鈣(Ca)、鍶(Sr)、鋇(Ba)、鐳(Ra)、鈧(Sc)、釔(Y)、鈦(Ti)、鋯(Zr)、鉿(Hf)、(Rf)、釩(V)、鈮(Nb)、鉭(Ta)、(Db)、鉻(Cr)、鉬(Mo)、鎢(W)、(Sg)、鎝(Tc)、錸(Re)、(Bh)、鐵(Fe)、鉛(Pb)、釕(Ru)、鋨(Os)、(Hs)、銠(Rh)、銥(Ir)、鈀(Pd)、鉑(Pt)、銅(Cu)、銀(Ag)、金(Au)、鋅(Zn)、鎘(Cd)、硼(B)、鋁(Al)、鎵(Ga)、錫(Sn)、銦(In)、鍺(Ge)、磷(P)、砷(As)、銻(Sb)、鉍(Bi)、硫(S)、硒(Se)、碲(Te)、釙(Po)或它們的組合。
例如,過渡金屬氧化物可包括鈦酸鋰氧化物、氧化釩或氧化鋰釩等。
例如,非過渡金屬氧化物可包括SnO2或SiOx等,其中0<x<2。
碳質物質可包括例如結晶碳、非晶碳或它們的混合物。結晶碳的示例可包括天然石墨和人造石墨,它們中的每個具有不規則的形狀或者是板、薄片、球體或纖維狀的形狀。非晶碳的示例可包括軟碳(低溫煅燒碳)、硬碳、中間相瀝青碳化產物和煅燒焦。
在負極活性物質組合物中,可使用與在正極活性物質組合物中使用的導電物質和粘合劑相同的導電物質和粘合劑。
負極活性物質、導電物質、粘合劑和溶劑的量可與在合適的鋰電池中使用的負極活性物質、導電物質、粘合劑和溶劑的量處於同一水平。可根據期望的鋰電池的用途和構成而省略導電物質、粘合劑和溶劑中的至少一種。
接下來,製備將置於正電極與負電極之間的隔板。
可使用合適的隔板。關於隔板,可使用對於電解質中的離子遷移具有低阻力並具有高的電解質保持能力的隔板。隔板的示例可包括玻璃纖維、聚酯、特氟龍(Teflon)、聚乙烯、聚丙烯、聚四氟乙烯(PTFE)或它們的組合,它們中的每個可以是無紡織物或紡織物。例如,可在鋰離子電池中使用由聚乙烯或聚丙烯等形成的可卷繞的隔板,可在鋰離子聚合物電池中使用具有高的電解質保持能力的隔板。例如,可根據下面的方法來製造隔板。
可通過混合聚合物樹脂、填料和溶劑來製備隔板組合物。可在電極的上部上直接塗覆隔板組合物並將其乾燥,從而完成隔板的製造。在實施方式中,可在支撐件上澆鑄隔板組合物並將其乾燥,並且可在電極的上部上層壓從支撐件分離的隔板的膜,從而完成隔板的製造。
在隔板的製造中使用的聚合物樹脂可包括在電極板的粘合劑中使用的合適的物質。例如,聚合物樹脂可包括偏二氟乙烯/六氟丙烯共聚物、PVDF、聚丙烯腈、聚甲基丙烯酸甲酯或它們的混合物等。
接下來,製備上述電解質。
如圖1所示,鋰電池1可包括正電極3、負電極2和隔板4。可卷繞、堆疊或摺疊正電極3、負電極2和隔板4,其後,將它們容納在電池殼體5中。隨後,可向電池殼體5中注入電解質,並用蓋組件6來密封電池殼體5,從而完成鋰電池1的製造。電池殼體5可具有圓柱形形狀、矩形形狀、袋形狀或薄膜形狀。例如,鋰電池可以是大尺寸的薄膜型電池。例如,鋰電池可以是鋰離子電池。
隔板可設置在正電極與負電極之間以形成電池組件。可以以雙電池單元結構堆疊多個電池組件並將其浸漬到電解質中,將所得物放進袋中並氣密地密封,從而完成鋰離子聚合物電池的製造。
在實施方式中,可堆疊電池組件以形成電池組,可在需要高容量和高功率輸出的任何裝置中使用這樣的電池組。例如,可在筆記本電腦、智慧型手機和電動車輛等中使用電池組。
此外,鋰電池可具有優異的壽命特性和高倍率特性,因此可用在電動車輛(EV)中。例如,鋰電池可用在諸如插電式混合動力電動車輛(PHEV)等的混合動力車輛中。鋰電池還可用在需要儲存大量電力的領域中。例如,鋰電池可用在電動自行車和電機驅動工具等中。
在此使用的術語「烷基」指完全飽和的支鏈或非支鏈(直鏈或鏈狀)烴。
「烷基」的非限制性示例包括甲基、乙基、正丙基、異丙基、正丁基、異丁基、仲丁基、正戊基、異戊基、新戊基、異戊基、正己基、3-甲基己基、2,2-二甲基戊基、2,3-二甲基戊基和正庚基。
「烷基」的至少一個氫原子可被滷素原子、取代有滷素原子的C1-C20烷基(例如,CCF3、CHCF2、CH2F或CCl3等)、C1-C20烷氧基、C1-C20烷氧基烷基、羥基、硝基、氰基、氨基、脒基、肼基、腙基、羧基或其鹽、磺醯基、氨磺醯基、磺酸基或其鹽、磷酸基或其鹽、C1-C20烷基、C2-C20烯基、C2-C20炔基、C1-C20雜烷基、C6-C20芳基、C6-C20芳烷基、C6-C20雜芳基、C7-C20雜芳烷基、C6-C20雜芳氧基、C6-C20雜芳氧烷基或C6-C20雜芳烷基取代。
術語「滷素」指氟、溴、氯和碘等。
在此使用的術語「芳基」也指芳環稠合到至少一個碳環的基團。「芳基」的非限制性示例包括苯基、萘基和四氫萘基。
此外,芳基的至少一個氫原子可被與上述烷基中的取代基相同的取代基取代。
術語「雜芳基」指包含從N、O、P和S中選擇的至少一種雜原子並具有碳原子作為剩餘成環原子的單環或二環有機化合物。雜芳基可包含例如1至5個雜原子和5至10環成員。S族或N族可通過氧化具有各種氧化態。
雜芳基的示例包括噻吩基、呋喃基、吡咯基、咪唑基、吡唑基、噻唑基、異噻唑基、1,2,3-噁二唑基、1,2,4-噁二唑基、1,2,5-噁二唑基、1,3,4-噁二唑基、1,2,3-噻二唑基、1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、異噻唑-3-基、異噻唑-4-基、異噻唑-5-基、噁唑-2-基、噁唑-4-基、噁唑-5-基、異噁唑-3-基、異噁唑-4-基、異噁唑-5-基、1,2,4-三唑-3-基、1,2,4-三唑-5-基、1,2,3-三唑-4-基、1,2,3-三唑-5-基、四唑基、吡啶-2-基、吡啶-3-基、2-吡嗪-2-基、吡嗪-5-基、2-嘧啶-2-基、4-嘧啶-2-基和5-嘧啶-2-基。
術語「雜芳基」包括雜芳環稠合到芳基、環脂族和雜環基中的至少一者的情形。
現在將參照下面的示例和對比示例更詳細地描述電解質和鋰電池。這些示例僅為了舉例說明的目的而不旨在限制示例的範圍。
為了強調一個或更多個實施例的特性,提供下面的示例和對比示例,但將理解的是,示例和對比示例將不被理解為限制實施例的範圍,對比示例也不將理解為在實施例的範圍之外。此外,將理解的是實施例不局限於在示例和對比示例中描述的具體細節。
示例1:鋰電池的製造
首先,通過在EC和DMC的混合溶劑(體積比為3:7)中混合1wt%(相對於電解質的總重量)的由以下的式2表示的化合物(例如,化合物2)和LiPF6(以形成最終1.15M的LiPF6溶液)來製備電解質。
使用下面的工藝來製造負電極。
將作為導電物質的97wt%的石墨顆粒(由三菱化工製造的MC20)和1.5wt%的BM408(由Daicel製造)以及作為粘合劑的1.5wt%的BM400-B(由Zeon製造)混合,將此混合物添加到蒸餾水,使用機械攪拌器攪拌得到的溶液60分鐘以製備負極活性物質漿料。使用刮片(doctor blade)將負極活性物質漿料塗覆在具有10μm的厚度至大約60μm的厚度的銅(Cu)集流體上,將塗覆的集流體在熱氣式乾燥器中在100℃下乾燥0.5小時,隨後在真空120℃的條件下進一步乾燥4小時並輥壓,從而完成負電極的製造。負電極具有1.55g/cc的混合密度和14.36mg/cm2的負載水平(L/L)。
根據下面的工藝單獨地製造正電極。
將94wt%的LiNi0.6Co0.2Mn0.2O2(由Samsung SDI製造的NCM 622)、作為導電物質的3.0wt%的乙炔黑(Denka black)以及作為粘合劑的3.0wt%的PVDF(由Solvay製造的Solef6020)混合。將此混合物添加到作為溶劑的N-甲基-2-吡咯烷酮,使用機械攪拌器攪拌得到的混合物30分鐘以製備正極活性物質漿料。使用刮片將正極活性物質漿料塗覆在具有20μm的厚度至大約60μm的厚度的鋁(Al)集流體上。將塗覆的集流體在熱氣式乾燥器中在100℃下乾燥0.5小時,隨後在真空120℃的條件下進一步乾燥4小時並輥壓,從而完成正電極的製造。正電極具有3.15g/cc的混合密度和27.05mg/cm2的負載水平(L/L)。
使用具有16μm的厚度的聚乙烯隔板(由SK Innovation製造)和根據上述工藝製備的電解質來製造鋰電池(大約40mAh袋型電池單元)。
示例2:鋰電池的製造
除了在製造正電極中使用LiNi0.88Co0.1Al0.02O2代替LiNi0.6Co0.2Mn0.2O2之外,以與示例1的方式相同的方式製造鋰電池。
示例3和示例4:鋰電池的製造
除了在電解質的製備中式2的化合物的量分別為0.1wt%和10wt%之外,以與示例1的方式相同的方式製造鋰電池。
對比示例1:鋰電池的製造
除了在電解質的製備中不添加式2的化合物之外,以與示例1的方式相同的方式製造鋰電池。
對比示例2:鋰電池的製造
除了在製造正電極中用LiCoO2代替LiNi0.6Co0.2Mn0.2O2之外,以與對比示例1的方式相同的方式製造鋰電池。
對比示例3:鋰電池的製造
除了在製造正電極中用LiNi0.33Co0.33Mn0.33O2代替LiNi0.6Co0.2Mn0.2O2之外,以與對比示例1的方式相同的方式製造鋰電池。
對比示例4:鋰電池的製造
除了在電解質的製備中不添加式2的化合物之外,以與示例2的方式相同的方式製造鋰電池。
對比示例5:鋰電池的製造
除了在製造正電極中使用LiCoO2代替LiNi0.6Co0.2Mn0.2O2之外,以與示例1的方式相同的方式製造鋰電池。
對比示例6:鋰電池的製造
除了在製造正電極中使用LiNi0.33Co0.33Mn0.33O2代替LiNi0.6Co0.2Mn0.2O2之外,以與示例1的方式相同的方式製造鋰電池。
評價示例1:微分容量曲線(dQ/dV)
示例1和對比示例1的鋰電池各自在環境溫度(25℃)下使用0.5C倍率的恆流充電直到電壓達到4.20V(相對於Li),然後在保持4.20V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用0.5C倍率的恆流使各個鋰電池放電直到電壓達到2.80V(相對於Li)(化成操作,第一循環)。
已經歷化成操作的各個鋰電池在25℃下使用0.5C倍率的恆流充電直到電壓達到4.20V(相對於Li),然後在保持4.20V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用1.5C倍率的恆流使各個鋰電池放電直到電壓達到2.80V(相對於Li),重複此充電和放電循環300次。
評價所得鋰電池的微分容量特性並在圖2中示出評價結果。
參照圖2,可以看出,示例1的鋰電池在對比示例1的鋰電池之前在大約2V下經歷分解反應。從結果可看出當向電解質添加式1的化合物時,式1的化合物在電解質的其它組分之前分解,從而在負電極的表面處形成作為保護膜的SEI膜。
評價示例2:阻抗特性
1)示例1和對比示例1
示例1和對比示例1的鋰電池各自在環境溫度(25℃)下使用0.5C倍率的恆流充電直到電壓達到4.20V(相對於Li),然後在保持4.20V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用0.5C倍率的恆流使各個鋰電池放電直到電壓達到2.80V(相對於Li)(化成操作,第一循環)。
根據2-探針方法在25℃下使用1260A阻抗/增益相位分析儀(Solartron)測量經歷化成操作的鋰電池的電阻。就這點而言,幅度為±10mV,頻率範圍是0.1Hz至1MHz。
在製造示例1和對比示例1的鋰電池之後的24小時後測量其阻抗,在圖3中示出針對阻抗測量結果的奈奎斯特曲線。在圖3中,由半圓的位置和尺寸確定電極界面電阻。就這一點而言,半圓左側和右側上的x軸上的截距之間的差表示電極界面電阻。
2)示例2和對比示例4
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量示例2和對比示例4的鋰電池的電阻,在圖4中示出測量結果。
3)對比示例2和對比示例5
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量對比示例2和對比示例5的鋰電池的電阻,在圖5中示出測量結果。
4)對比示例3和對比示例6
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量對比示例3和對比示例6的鋰電池的電阻,在圖6中示出測量結果。
參照圖3至圖6,可看出與對比示例1至對比示例6的鋰電池相比,示例1和示例2的鋰電池展現出減小的界面電阻。對比示例3和對比示例6的鋰電池使用具有少的鎳含量的鋰鎳基複合氧化物,因此,與示例1的鋰電池相比,前者展現出增加的界面電阻。從結果可看出,包含50mol%或更多的鎳的富鎳的正極活性物質具有顯著的電阻減小效果。這些結果歸因於:當包括式1的化合物的電解質與包括富鎳的正極活性物質的正電極一起使用時,式1的化合物在Li負電極處比在正電極處形成更多的SEI層,SEI層用作有效的保護膜,抑制電解質的有機溶劑的還原分解。
評價示例3:高溫(45℃)充電和放電特性
1)示例1和對比示例1
示例1和對比示例1的鋰電池各自在25℃下使用0.1C倍率的恆流充電直到電壓達到4.30V(相對於Li),然後在保持4.30V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用0.1C倍率的恆流使各個鋰電池放電直到電壓達到2.8V(相對於Li)(化成操作,第一循環)。
已經歷化成操作(第一循環)的各個鋰電池在25℃下以1.0C倍率的恆流充電直到電壓達到4.20V(相對於Li),然後在保持4.20V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用0.2C倍率的恆流使各個鋰電池放電直到電壓達到3.0V(相對於Li)(化成操作,第二循環)。每個所得鋰電池在45℃下使用1.0C倍率的恆流充電直到電壓達到4.20V(相對於Li),然後在保持4.20V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用1.0C倍率的恆流使各個鋰電池放電直到電壓達到3.0V(相對於Li),重複此充電和放電循環200次。
在所有的充電和放電循環中,在每個循環結束時存在20分鐘的休息期。
在圖7中示出充電和放電實驗結果的一部分。
2)示例2和對比示例4
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量示例2和對比示例4的鋰電池的電阻,在圖8中示出測量結果。
3)對比示例2和對比示例5
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量對比示例2和對比示例5的鋰電池的電阻,在圖9中示出測量結果。
4)對比示例3和對比示例6
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量對比示例3和對比示例6的鋰電池的電阻,在圖10中示出測量結果。
參照圖6至圖10,可看出與對比示例1至對比示例6的鋰電池相比,示例1和示例2的鋰電池展現出顯著的增強的放電容量和壽命特性。
此外,使用與用於示例1和示例2的鋰電池的方法相同的方法來評價示例3和示例4的鋰電池的充電和放電實驗結果。
作為評價的結果,示例3和示例4的鋰電池展現出與示例1的鋰電池的放電容量和壽命特性幾乎相似的放電容量和壽命特性。
評價示例4:在高溫(60℃)儲存之後的阻抗特性
1)示例1和對比示例2
示例1和對比示例2的鋰電池各自在25℃下使用0.1C倍率的恆流充電直到電壓達到4.30V(相對於Li),然後在保持4.30V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用0.1C倍率的恆流使各個鋰電池放電直到電壓達到2.8V(相對於Li)(化成操作,第一循環)
已經歷化成操作(第一循環)的各個鋰電池在25℃下使用1.0C倍率的恆流充電直到電壓達到4.20V(相對於Li),然後在保持4.20V的恆壓的情況下,以0.05C倍率的電流截止充電過程。隨後,使用0.2C倍率的恆流使各個鋰電池放電直到電壓達到3.0V(相對於Li)(化成操作,第二循環)。
各個鋰電池在25℃下使用1.0C倍率的恆流充電直到電壓達到4.30V(相對於Li),然後在保持4.30V的恆壓的情況下,以0.05C倍率的電流截止充電過程以形成4.3V的完全充電狀態(SOC=100%)
在烘箱中在60℃的高溫下儲存各個所得的鋰電池20天,根據2-探針方法在25℃下使用1260A阻抗/增益相位分析儀(Solartron)測量其電阻。就這點而言,幅度為±10mV,頻率範圍是0.1Hz至1MHz。
在製造示例1和對比示例2的鋰電池之後的24小時後測量其阻抗,在圖11中示出針對阻抗測量結果的奈奎斯特曲線。
2)示例2和對比示例4
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量示例2和對比示例4的鋰電池的電阻,在圖12中示出測量結果。
3)對比示例2和對比示例5
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量對比示例2和對比示例5的鋰電池的電阻,在圖13中示出測量結果。
4)對比示例3和對比示例6
使用與在示例1和對比示例1的鋰電池的電阻測量中使用的評價方法相同的評價方法來測量對比示例3和對比示例6的鋰電池的電阻,在圖14中示出測量結果。
參照圖11至圖14,可看出在高溫(60℃)儲存之後,示例1和示例2的鋰電池展現出比對比示例2和對比示例3的鋰電池的電阻增大更小的電阻增大。
通過總結和回顧,可在高的操作電壓下操作鋰電池,因此,可不使用與鋰高度反應的水性電解液。例如,可在鋰電池中使用有機電解質。可通過在有機溶劑中溶解鋰鹽來製備有機電解質。例如,有機溶劑可以是在高電壓下穩定並可具有高離子傳導率、高介電常數和低粘度的有機溶劑。
LiPF6可用作鋰鹽。然而,LiPF6可與電解質的有機溶劑反應,並因此可使有機溶劑的消耗和大量氣體的產生加快。此外,當碳酸酯類極性非水溶劑被用作有機溶劑時,會進行在初始充電期間負電極/正電極與電解質之間的副反應使用過量電荷的不可逆反應。由於不可逆反應,可在負電極的表面上形成諸如固體電解質界面(SEI)層的鈍化層。SEI層可防止在充電和放電期間的電解質的分解,並用作離子隧道。由於SEI層具有更高的穩定性和更低的電阻,因此鋰電池可具有更長的壽命。
為了穩定SEI層,可使用各種添加劑。使用一些添加劑形成的一些SEI層在高溫下會容易劣化。例如,SEI層會在高溫下具有降低的穩定性。實施例可提供這樣的電解質,其幫助抑制LiPF6的副反應並幫助形成具有增強的高溫穩定性的SEI層。
從以上描述明顯的是,根據實施例的鋰電池展現增強的高溫壽命特性並抑制電阻的增大。
實施例可提供具有增強的電池單元性能的鋰電池。
已經在這裡公開了示例實施例,儘管採用了具體術語,但僅以一般的和描述性的含義來使用和解釋這些術語,而不是出於限制的目的。在一些情況下,如對截止到本申請提交時的本領域普通技術人員而言明顯的是,除非另有明確說明,否則結合具體實施例描述的特徵、特性和/或元件可單獨使用,或者可與結合其它實施例描述的特徵、特性和/或元件組合地使用。因此,本領域技術人員將理解的是,在不脫離如權利要求書中闡述的本發明的精神和範圍的情況下,可以進行形式上和細節上的各種變化。
