一種EZH2蛋白的表位肽及其應用的製作方法
2023-06-09 19:35:27
本發明涉及一種肽,尤其涉及一種EZH2-CTL表位肽及其應用。
背景技術:
多發性骨髓瘤是造血系統來源於B細胞的惡性腫瘤,在美國多發性骨髓瘤是排在非霍奇金淋巴瘤之後發病率第二的血液系統惡性腫瘤,它佔所有腫瘤的1%及血液系統惡性腫瘤的13%。多發性骨髓瘤是由漿細胞在骨髓內的惡性克隆性增殖並侵潤引起,最終導致高丙種球蛋白血症、免疫機能下降及各靶器官損害。對於大多數患者而言這種疾病是無法治癒的。接受常規化療患者的中位生存在3-4年,而在接受自體外周血造血幹細胞移植後,有50%的患者可以達到完全緩解,這些患者的中位生存可以延長到5-7年。但是,絕大部分患者最終會復發。
目前認為這些患者復發的根源是因為體內存在微小殘留病灶,因此,需要一種有效的方法,能使接受化療或自體造血幹細胞移植之後患者體內的微小殘留病灶被有效清除。
免疫治療就是一種非常合適的選擇。骨髓瘤細胞分泌的獨特型抗原是一種腫瘤特異性抗原。有學者用這種獨特型抗原給多發性骨髓瘤患者接種以進行免疫治療,但是這種治療療效讓人失望,一部分原因被歸咎於這種獨特型抗原的免疫原性不夠強。因此,我們迫切的需要發現一種大部分患者共有的新型的腫瘤抗原來改善免疫治療對多發性骨髓瘤的療效。理想的腫瘤抗原應該在不同起源的腫瘤細胞表明表達,在正常組織中低表達或者不表達,而且在腫瘤細胞的生長及生存中不可或缺,這樣腫瘤細胞才不可能通過不表達或者下調表達該抗原以逃避免疫攻擊。
免疫治療一直是醫學領域研究的熱點,眾多研究者尋找到許多多發性骨髓瘤的靶點,比如熱休克蛋白(HSP)、未摺疊蛋白(XBP1)及CD138+等,但這些靶點都有各自的局限性,比如CD138+理論上表達於所有骨髓瘤細胞表面,但是近期的一些研究卻認為,骨髓瘤幹細胞可能存在於一群CD138-的細胞中,而XBP1及Hsp在患者中的表達率也無法達到100%。這就需要我們不斷尋找新的骨髓瘤治療靶點,以最終達到個體化治療的目的,即:對於每位患者檢測其體內各種腫瘤抗原的表達情況,根據其強弱選擇合適的靶點,以達到最佳的治療效果,這種個體化的有差異的治療也許是今後腫瘤免疫治療的發展方向。
技術實現要素:
本發明提供了一種EZH2表位肽,以及所述表位肽的應用。
本發明第一個方面是提供一種EZH2表位肽,所述表位肽含有、並優選組成為如下序列:
1)YMCSFLFNL(SEQ ID No.1);或者
2)序列1)經過取代、缺失、或添加一個或多個胺基酸、且具有EZH2抗原表位肽功能的胺基酸序列。
本發明第二個方面是提供所述EZH2表位肽的應用,所說應用包括製備藥物、疫苗中的應用。
其中,所述藥物或疫苗以所述EZH2表位肽為作用靶點。
其中,所述藥物或疫苗為治療/預防腫瘤的藥物。
所述腫瘤優選為至少包括前列腺癌、乳腺癌、膀胱癌、胃癌及血液腫瘤(如淋巴瘤和骨髓瘤等)。
更優選地,所述藥物為治療骨髓瘤和/或血液腫瘤的藥物。
其中,所述疫苗為預防骨髓瘤和/或血液腫瘤的疫苗。
其中,所述藥物和/或疫苗還可以包括佐劑、輔料。
在本發明一種優選實施例中,所述EZH2表位肽誘導的CTL細胞作為藥物的全部或部分活性成分。
本發明還提供一種所述EZH2表位肽誘導的CTL細胞(EZH2-CTLs)。
本發明提供了一種EZH2表位肽,該EZH2表位肽能夠誘導出EZH2-CTLs,在體外試驗中有明確殺傷HLA-A0201+骨髓瘤細胞作用,並且對正常造血細胞沒有殺傷。
附圖說明
圖1 EZH2肽段與T2細胞結合力預實驗結果,A為EZH2肽段與其他肽對T2細胞結合力對比預實驗結果,B為EZH2肽段與其他肽對T2細胞結合穩定性預實驗結果;
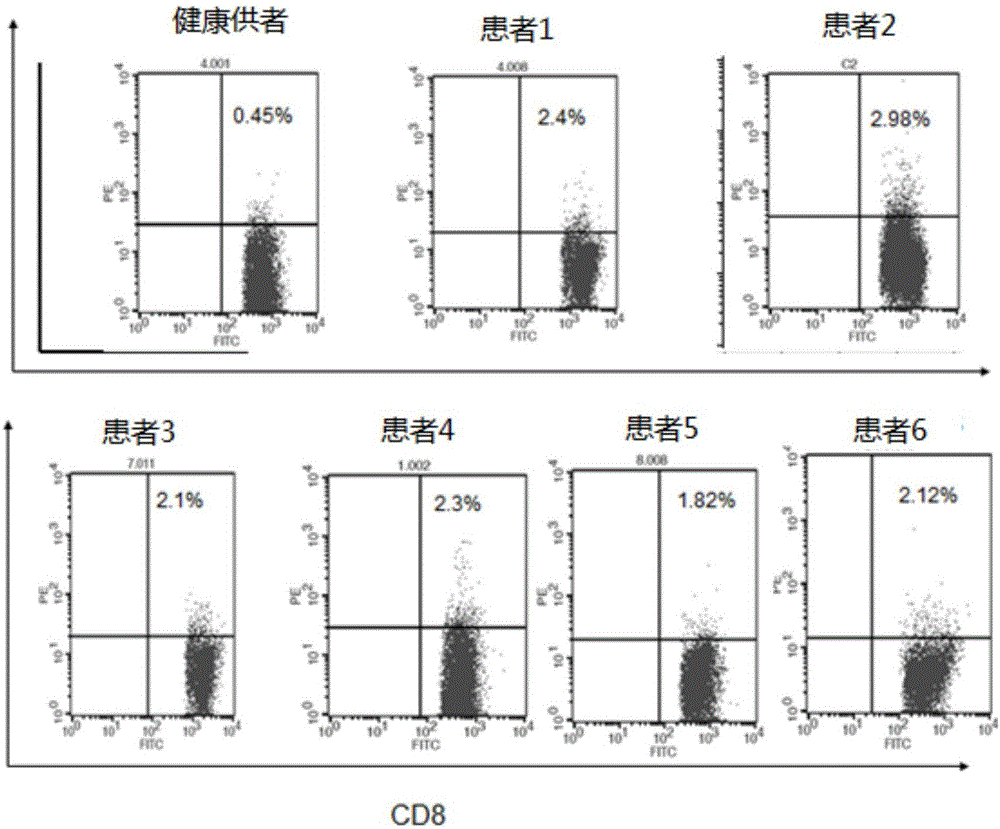
圖2為健康供者及患者外周血中EZH2-CTLs水平測定;
圖3為T細胞增殖實驗;
圖4為乳酸脫氫酶釋放試驗檢測EZH2-CTL對靶細胞殺傷作用;
圖5為EZH2-CTLs細胞殺傷骨髓瘤細胞時的脫顆粒作用。
具體實施方式
EZH2蛋白胺基酸序列(SEQ ID No.3),Genbank登錄號為:AAC51520.1,如下所述:
mgqtgkksek gpvcwrkrvk seymrlrqlk rfrradevks mfssnrqkil erteilnqew kqrriqpvhiltsvsslrgt recsvtsdld fptqviplkt lnavasvpim yswsplqqnf mvedetvlhn ipymgdevldqdgtfieeli knydgkvhgd recgfindei fvelvnalgq yndddddddg ddpeereekq kdledhrddkesrpprkfps dkifeaissm fpdkgtaeel kekykelteq qlpgalppec tpnidgpnak svqreqslhsfhtlfcrrcf kydcflhpfh atpntykrkn tetaldnkpc gpqcyqhleg akefaaalta eriktppkrpggrrrgrlpn nssrpstpti nvleskdtds dreagtetgg enndkeeeek kdetssssea nsrcqtpikmkpnieppenv ewsgaeasmf rvligtyydn fcaiarligt ktcrqvyefr vkessiiapa paedvdtpprkkkrkhrlwa ahcrkiqlkk dgssnhvyny qpcdhprqpc dsscpcviaq nfcekfcqcs secqnrfpgcrckaqcntkq cpcylavrec dpdlcltcga adhwdsknvs ckncsiqrgs kkhlllapsd vagwgifikdpvqknefise ycgeiisqde adrrgkvydk ymcsflfnln ndfvvdatrk gnkirfanhs vnpncyakvmmvngdhrigi fakraiqtge elffdyrysq adalkyvgie remeip
本發明提供了兩種EZH2表位肽:YMCSFLFNL(SEQ ID No.1)、SQADALKYV(SEQ ID No.2)。
表1,EZH2表位肽及其與人HLA-A0201親和力預測積分
表1中:a:NIH BIMAS http://www-bimas.cit.nih.gov/molbio/hla_bind
b:SYFPEITHI http://www.syfpeithi.de/
本發明選取合成了兩條HLA A0201陽性肽HIV-1pol肽段(序列:ILKEPVHGV)、流感病毒基質蛋白肽段(序列:GILGFVFTL)作為本實驗的陽性對照。
T2細胞表位肽結合親和及穩定性實驗
1)T2細胞親和實驗
收集T2細胞,用4℃的無菌PBS離心洗滌三次,加入無血清1640培養基,2×105/孔細胞接種於24孔細胞培養板中,設立實驗組及對照組,每組重複三個副孔,將未加肽刺激的T2細胞作為空白對照,每孔加入相應的候選肽段及對照肽段(終濃度50uM),同時加入β2微球蛋白(終濃度2.5ug/ml),將細胞置於37℃,5%CO2培養箱中孵育18h,再次收集細胞,4℃、PBS洗滌三次,加入FITC標記的HLA-A0201單克隆抗體BB7.2(2ul/孔),4℃避光孵育15分鐘,4℃、PBS洗滌3次,流式細胞儀檢測平均螢光強度。
用螢光指數(FI,螢光係數)作為衡量親和力指標,螢光係數>1的表位肽被認為與HLA-A0201分子具有高親和力,螢光係數由以下公式計算得到:
用螢光指數(FI)=(樣本平均螢光強度-空白對照平均螢光強度)/空白對照平均螢光強度
參照圖1A,YMCSFLFNL序列(aa661)螢光係數大於1,達到1.4左右,說明該表位肽與HLA-A0201親和力高。
2)T2細胞表位肽結合穩定性實驗
收集T2細胞,1×105/孔接種於96孔細胞培養板中,加入無血清1640培養基、β2微球蛋白、以及相應的候選肽段及對照肽段,將細胞置於培養箱中孵育18h,再次收集細胞,洗滌後加入無血清1640培養基、胞外布雷菲德菌素共同孵育1h,收集細胞,洗滌後再次加入含有胞外布雷菲德菌素(0.5ug/ml)的無血清1640培養基,放入培養箱中孵育,於不同的時間點(0,2,4,8,12,24h)收集細胞。每一個實驗組設置三個副孔,加入FITC標記的HLA-A0201單克隆抗體BB7.2,流式細胞儀檢測平均螢光強度,計算出每點的FI,用此衡量表位肽誘導的HLA-A0201的表達情況。
參照圖1B,各個時間點上,YMCSFLFNL序列(aa661)螢光係數均明顯高於aa729序列,因此與HLA-A0201結合穩定。
在健康供者及患者體內檢測所篩選肽段相應五聚體陽性細胞毒性T細胞(CTLS)
收集健康供者及兩名多發性骨髓瘤確診未緩解患者外周血5ml,用淋巴細胞分離液分離方法提取外周血單個核細胞,將細胞計數後取1×106個細胞,溶於100ulPBS中,加入2ul所篩選表位肽對應的PE標記的五聚體及同型對照,常溫避光孵育40分鐘,後冰面放置1分鐘,加入FITC標記的CD8+單克隆抗體,4℃避光15分鐘,取出後以4℃PBS洗3次,用500ulPBS重懸後用流式細胞儀進行檢測。
參照圖2,健康供者體內EZH2-CTLS水平明顯低於骨髓瘤患者,說明,本發明表位肽是生理狀態下產生的表位肽片段。
體外驗證EZH2蛋白特異性細胞毒性T細胞對骨髓瘤細胞細胞溶解作用
1)誘導生成細胞毒性T細胞:包括HLA-A0201+健康供者外周血單個核細胞分離、DC細胞誘導培養、細胞毒性T細胞誘導培養。
1.1)獲取HLA-A0201+健康供者外周血單個核細胞
1.2)誘導生成DC細胞
(1).將提取的單個核細胞按照每孔1×106個加入24孔板中靜置2h,使單核細胞貼壁。
(2).吸盡24孔板中的細胞懸液,並用含有10%FBS的1640培養基0.5ml輕輕衝刷每孔。
(3).每孔加入含有GM-CSF及IL-4 10的培養基。
(4).每3日半量換液一次,加入GM-CSF及IL-4,第5日半量換液,加入GM-CSF 10、IL-4 10及TNF-α10,48h後DC細胞成熟。
(5).加入EZH2肽段靜置2-4h。
(6).30Gy伽馬射線照射成熟的DC細胞。
(7).吸除所有上清,加入淋巴細胞或者誘導的CTL細胞。
1.3).PBMC來源CTLs的產生
(1).淋巴細胞與DC細胞共培養時,加入有IL-2 50IU/ml、IL-7 2.5ng/ml及IL-15 5ng/ml的10%FBS的1640培養基,將淋巴細胞計數後與成熟DC細胞按照10:1比例混合。
(2).每2-3日半量換液一次,同時加入IL-2、IL-7及IL-15。
(3).第7日將淋巴細胞移入新生成DC孔中並與之共培養。
(4).每次與新的DC細胞共培養前,需取樣檢測特異性。
1.4)CTL細胞CD8及五聚體雙陽性率的檢測
(1).取5×105個培養的CTL細胞離心後以100ul無菌PBS重懸。
(2).用帶有螢光標記的MHC/肽多聚體(Epimer)標記細胞後加入抗-CD8-FITC。
(3).PBS洗滌液洗細胞後重懸於適量PBS洗滌液中。
(4).細胞流式儀分析。
2)CTL細胞表型測定:
(1).取3×106個培養的CTL細胞,同時取未經過與DC共培養的外周血PBMC作為對照組。
(2).用帶有螢光標記的MHC/肽多聚體(Epimer)標記後加入抗-CD8-FITC及抗-CD45RA-APC或抗CD45RO-APC。
(3).PBS洗滌液洗細胞後重懸於適量PBS洗滌液中。
(4).細胞流式儀分析。
3)CTL細胞增殖實驗:取經過與DC細胞共培養四周的CTLs細胞進行實驗:
a、取10×106個培養的CTL細胞,加入無菌PBS5ml,以1000轉10分鐘離心,棄上清,以10ml無菌PBS重懸,使其達到每1ml有1×106個細胞。
b、加入CFSE使其終濃度為3μM,放入37℃二氧化碳培養箱孵育15分鐘,每5分鐘搖勻細胞。
c、取出細胞後加入等量胎牛血清放入4℃冰箱終止10分鐘。
d、用PBS洗滌三次,每次為1000轉10分鐘。
e、用含有10%FBS的1640重懸,使細胞濃度達到1×106/ml。
f、將細胞分組移入24孔培養板中,每孔CTL細胞為1×106個。A組為空白CTL細胞,B組為CTL細胞按10:1比例加入(HLA-A0201+骨髓瘤細胞株),C組為CTL細胞按10:1比例加入(HLA-A0201-骨髓瘤細胞株),每組設3個復孔。
g、96小時後收集三組細胞即9孔,用PBS洗滌兩次,每次為1000轉10分鐘,後進行流式細胞檢測。
4)CTL細胞因子分泌測定:
a、取經過與DC細胞共培養四周的EZH2-CTLs 1×106個細胞進行實驗,每組設3個副孔;
b、將培養基(包含細胞)移入10ml無菌離心管中,以1000轉10分鐘離心;
c、將上清培養基吸出,與捕獲微球共孵育,加入包被了抗體的微球混合物孵育2h,以PBS洗滌;
d、加入標記生物素螢光探測試(PE標記)劑孵育1h,以PBS洗滌;
流式細胞儀上機檢測;
e、用FlowCytomix Pro軟體計算被測樣本中相應細胞因子的濃度。
5)CTL細胞殺傷實驗:取經過與DC細胞共培養四周的CTLs細胞進行實驗:
a、取10×106個培養的CTL細胞,調整濃度至1×106個細胞/ml。
b、加入CFSE使其終濃度為3μM,放入37℃二氧化碳培養箱孵育15分鐘。
c、取出細胞後加入等量胎牛血清放入4℃冰箱終止10分鐘。
d、用無菌PBS洗滌三次。
e、用含有10%FBS的1640重懸,使細胞濃度達到1×106/ml。
f、將細胞分組移入24孔培養板中,每孔CTL細胞為1×106個。設置空白CTL細胞組,ARH-77(HLA-A0201+骨髓瘤細胞株)組,及LP1(HLA-A0201-骨髓瘤細胞株)組。
g、效靶細胞混合培養4小時後混合離心;
h、重懸後避光加入PI,4℃避光15分鐘後上流式細胞儀進行檢測。
6)EZH2-CTLs細胞功能測定:
6.1.CTLs與HLA-A0201+靶細胞混合實驗測定CD107a表達情況(該實驗重複三次):
a、取1×106個培養的CTLs細胞;
b、取2×106個培養的(HLA-A0201+)多發性骨髓瘤細胞;
c、將CTL細胞與靶細胞混合。
d、將效靶細胞混合液放入V型底96孔培養板中。
e、將放有細胞的96孔板放入37℃5%二氧化碳培養箱中,培養4小時。
f、培養4h後取出培養板,吹勻並吸出每孔細胞懸液,將10孔細胞混合。
g、以100ul無菌PBS重懸效靶細胞混合液,加入2ul抗-CD8-FITC及10ul抗-CD107a-PC5。
h、用無菌PBS洗滌液洗細胞後重懸。
i、用流式細胞儀進行檢測。
6.2.CTLs與HLA-A0201-靶細胞混合實驗測定CTLs細胞CD107a表達情況(該實驗重複三次):
a、取1×106個培養的CTLs細胞,以1000轉10分鐘離心,棄上清,用含有10%FBS的1640重懸,使體積為333ul。
b、取2×106個培養的(HLA-A0201-)多發性骨髓瘤細胞,以1000轉10分鐘離心,棄上清,用含有10%FBS的1640重懸,使體積為667ul。
c、將CTLs細胞333ul與靶細胞667ul混合,共1ml。
d、將效靶細胞混合液放入V型底96孔培養板中,每孔100ul,共10孔。
e、將放有細胞的96孔板放入37℃5%二氧化碳培養箱中,培養4小時(對96孔板進行離心1000轉5分鐘)。
f、培養4h後取出培養板,吹勻並吸出每孔細胞懸液,將10孔細胞混合。
g、向效靶細胞混合液中加入5ml無菌PBS,混勻後以1000轉10分鐘離心,棄上清。以100ul無菌PBS重懸效靶細胞混合液,加入2ul抗-CD8-FITC及10ul抗-CD107a-PC5在冰上避光反應20分鐘。
h、用無菌PBS洗滌液洗細胞3次,400xg 5分鐘,細胞沉澱重懸於500ulPBS中。
i、用流式細胞儀進行檢測。
參照圖3,經過本發明肽刺激的DC細胞(pulsedDC)具有誘導相應EZH2-CTLS細胞增殖的能力,OD值明顯高於未經本發明肽刺激的DC細胞(unpulsedDC)。
抗原特異性CTLS細胞表達CO45RO和CD45RA情況如下:
CD8+CD45RA-細胞佔所有CTLS細胞88%。
CD8+CD45RO+細胞佔所有CTLS細胞90%。
細胞因子測定結果如表2所示。
表2,細胞因子測定結果
EZH2-CTLs對骨髓瘤殺傷作用
參照圖4,細胞毒性分析表明,CTLS可特異性殺傷HLA-A0201陽性骨髓瘤細胞株及原代細胞,而對HLA-A0201陰性骨髓瘤細胞株無殺傷作用
為了衡量EZH2-CTLs細胞殺傷骨髓瘤細胞株的效能,藉助測量CD107a在EZH2-CTLs細胞表面的表達,評估其細胞殺傷骨髓瘤細胞時的脫顆粒作用,如圖5所示,CD107a在EZH2-CTLs細胞釋放細胞毒顆粒時會短暫的在CTLs細胞膜表面表達。
上述實驗證明,本發明提供了一種新型的腫瘤特異性抗原的CTL表位肽,其能夠誘導出EZH2-CTLs,證實其在體外試驗中有明確殺傷HLA-A0201+骨髓瘤細胞作用,並且對正常造血細胞沒有殺傷,可以作為靶點達到體內/體外殺傷骨髓瘤細胞的目的。
同樣的,由於EZH2在其他眾多腫瘤(如前列腺癌、乳腺癌、膀胱癌、胃癌、血液腫瘤、淋巴瘤等)中都有高表達,與腫瘤的惡性進程、侵襲性、轉移能力關係密切,因此該EZH2表位肽也可以作為靶點治療/預防前列腺癌、乳腺癌、膀胱癌、胃癌及其他血液腫瘤如淋巴瘤等多種腫瘤。
以上對本發明的具體實施例進行了詳細描述,但其只是作為範例,本發明並不限制於以上描述的具體實施例。對於本領域技術人員而言,任何對本發明進行的等同修改和替代也都在本發明的範疇之中。因此,在不脫離本發明的精神和範圍下所作的均等變換和修改,都應涵蓋在本發明的範圍內。
